一种联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的引物和探针、试剂盒及应用的制作方法
本发明属于生物检测
技术领域:
,具体涉及一种联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的引物和探针、试剂盒及应用。
背景技术:
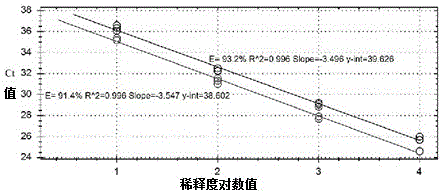
:非洲猪瘟(africanswinefever,asf)是由非洲猪瘟病毒(africanswinefevervirus,asfv)引起的一种急性、高度接触性传染病。asf临床症状表现为发热、呼吸困难、皮肤发绀和淋巴结、肾、胃肠黏膜明显出血,死亡率高达100%。由于该病对养猪业危害巨大,且病原学和流行病学较为复杂,尚无有效疫苗用于临床,故世界动物卫生组织(oie)将非洲猪瘟列为法定报告动物疫病,我国将其列为一类动物疫病。尤其是自2018年9月我国发生首例非洲猪瘟疫情以来,给我国生猪养殖造成非常严重的损失,甚至严重影响百姓的“菜篮子”,给我国经济和民生保障带来巨大影响。因此,相关部门相继出台相应的非洲猪瘟防控措施,尤其是种猪要严格规范种猪引种和调运,对跨省调运种猪必须严格开展asfv检测。伪狂犬病(pr)是由伪狂犬病病毒(prv)引起的一种家畜和多种野生动物共患的高度接触性传染病,能够造成发热、奇痒、繁殖障碍、脑脊髓炎等症状。prv能感染反刍动物、啮齿动物、食肉动物等,但猪是prv唯一的传播和贮存宿主,可以隐性感染,长期带毒。prv可感染各个阶段的猪,且临床症状因日龄而不同。尤其是prv感染可造成种猪带毒并垂直传播,因此种猪一旦带毒便可终身带毒、排毒,污染环境,引起仔猪的感染和发病。同时,由于prv容易发生缺失/插入变异,使得现有疫苗无法对猪群产生有效保护,加上目前生猪养殖过程中prv疫苗仍以活疫苗为主,存在毒力返强风险,所以prv在我国猪群长期广泛流行难以控制,给我国养猪业造成巨大损失。因此《国家中长期动物疫病防治规划(2012-2020)》将pr列为净化种畜禽重点疫病。为实现种猪场asf和pr的大规模筛查和监测,急需一种快速有效的asfv和prv检测方法。常规的分子诊断包括普通pcr,荧光定量pcr、基因芯片及恒温扩增检测技术等,普通pcr、基因芯片及恒温扩增检测技术等方法存在灵敏度低、成本高,开发技术难度大、易造成气溶胶污染等缺点,而荧光定量pcr比其他常规分子诊断技术具有灵敏性高、特异性好、通量高、污染低等优势。其中,实时taqman荧光定量pcr技术在动物疫病诊断、基因定性和定量检测等方面得到广泛应用,并且已经成为当前病毒核酸快速检测的主要方法。目前,针对asfv或prv的实时荧光定量pcr检测试剂盒类型比较单一,单纯检测asfv和prv野毒或疫苗毒,无法实现asfv和prv的双重检测,这些试剂盒费时费力且成本相对较高,难以应对当前猪场病毒混合感染的现状。因此,研发一种联合检测非洲猪瘟病毒和猪伪狂犬病病毒的双重实时荧光定量pcr试剂盒,有助于提高种猪场asf和pr监测和诊断效率,确保种猪场生物安全。技术实现要素:本本发明解决的技术问题是提供一种联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的引物和探针、试剂盒及应用,同时检测非洲猪瘟病毒、猪伪狂犬病病毒野毒株的单一或混合感染,提高种猪场asf和pr监测和诊断效率。为了解决上述问题,本发明的一个方面提供一种联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的引物和探针,包括:检测非洲猪瘟病毒的正向引物,其序列如seqidno:1所示;检测非洲猪瘟病毒的反向引物,其序列如seqidno:2所示;检测非洲猪瘟病毒的taqman探针,其序列如seqidno:3所示;检测猪伪狂犬病病毒野毒株的正向引物,其序列如seqidno:4所示,检测猪伪狂犬病病毒野毒株的反向引物,其序列如seqidno:5所示,检测检测猪伪狂犬病病毒野毒株的taqman探针,其序列如seqidno:6所示。所述seqidno:1的序列为:5’-gtctggaagagctgtatc-3’。所述seqidno:2的序列为:5’-ggaacatctccgatcaaa-3’。所述seqidno:3的序列为:5’-cctcatcaacaccgagattggcaca-3’。所述seqidno:4的序列为:5’-gtacgtgctcgtgatgac-3’。所述seqidno:5的序列为:5’-cgtcagctccttgatgac-3’。所述seqidno:6的序列为:5’-cctgggactacacgctcgtc-3’。本发明根据asfv的b646l基因、prv的ge基因的保守序列设计了特异性引物及taqman探针,并对不同引物探针组合进行筛选,优化引物、taqman探针,获得了上述的对asfv、prv检测特异性高、敏感性强的引物、探针。优选地,所述的用于检测非洲猪瘟病毒的taqman探针,其5’端标记的荧光报告基团为fam,3’端标记的荧光淬灭基团为bhq1;所述的用于检测猪伪狂犬病病毒野毒株的taqman探针,其5’端标记的荧光报告基团为vic,3’端标记的荧光淬灭基团为bhq1。本发明的另一个方面提供一种联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的双重实时荧光定量pcr检测试剂盒,包括引物、探针混合液,所述引物、探针混合液包含上述的联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的引物和探针。优选地,还包含qpcr预混液、阳性对照品、阴性对照品。优选地,所述阳性对照品为非洲猪瘟病毒b646l基因质粒标准物质与猪伪狂犬病病毒标准毒株的混合液,所述阴性对照品为无核酸酶水。优选地,所述qpcr预混液为premixextaqprobeqpcr2x。优选地,所述引物、探针混合液中用于检测非洲猪瘟病毒的正向引物、反向引物、taqman探针的浓度均为0.1μmol/l;所述引物、探针混合液中用于检测猪伪狂犬病病毒野毒株的的正向引物、反向引物、taqman探针的浓度均为0.4μmol/l。本发明的再一方面提供如上述的联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的引物和探针在制备联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的试剂盒中的应用。本发明与现有技术相比,具有以下有益效果:1.本发明的联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的引物和探针、试剂盒,可通过一个pcr反应同时检测asfv、prv单一或混合感染,减少多次加样造成的环境污染;2.本发明的联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的引物和探针、试剂盒对同一份样品可通过一次荧光定量pcr试验实现对asfv、prv的检测,检测过程只需要1h,相较于单重荧光定量pcr试验中一份需要进行两次检测,极大程度上减少了工作量、提高了检测效率,节约了成本,有助于实验室大规模检测;3.本发明的联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的引物和探针,为分别针对asfv、prv的保守序列设计筛选获得最优的引物、taqman探针,可使本检测试剂盒及方法能特异、准确、灵敏地检测asfv、prv;4.本发明的联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的试剂盒中所用的阳性对照品为经数字pcr定值后的非洲猪瘟病毒b646l基因质粒标准物质与猪伪狂犬病病毒(prv)标准毒株的混合液,既可实现对核酸提取过程的监控,又能评判检测的有效性和准确性。附图说明图1为实施例1中最适引物探针组合检测非洲猪瘟病毒b646l基因质粒标准物质的扩增曲线图2为实施例1中最适引物探针组合检测猪伪狂犬病病毒(prv)标准毒株的扩增曲线图3为实施例1中asfv退火温度优化的扩增曲线图4为实施例1中prv退火温度优化的扩增曲线图5为实施例3中asfv/prv野毒双重实时荧光定量pcr方法特异性验证图6为实施例4中asfv/prv野毒双重实时荧光定量pcr方法标准曲线。具体实施方式下面将结合本发明的实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1asfv/prv野毒双重实时荧光定量pcr方法的建立1.引物和taqman探针设计使用megalign软件分别对genbank公布的不同asfv的b646l基因序列(登录号:mk128995.1、mk333181.1、mn172368.1、mk333180.1、mk645909.1)和不同prv的ge基因序列(登录号:mn240564.1、mh507059.1、mk622288.1、ku962922.1、kf017615.1)进行序列比对,进一步确定各自基因的保守片段,并针对该保守片段,利用oligo7软件设计引物和探针各3组。asfv、prv探针的5′端分别标记fam、vic荧光发射基团,3′端均标记bhq1荧光淬灭基团,asfv、prv的引物和探针序列如表1。表1asfv、prv引物和探针的序列引物/探针(5’-3’)序列asfv-f1ggagatgttccaggtaggasfv-r1gtccataaaacgcaggtgasfv-p1cacaccaacaataaccaccacgatgasfv-f2ctgcataatggcgttaacasfv-r2gctgatacgtgtccataaasfv-p2ccacaccaacaataaccaccacgasfv-f3gtctggaagagctgtatcasfv-r3ggaacatctccgatcaaaasfv-p3cctcatcaacaccgagattggcacaprv-f1gtacgtgctcgtgatgacprv-r1cgtcagctccttgatgacprv-p1cctgggactacacgctcgtcprv-f2catgctctctccggtgtacprv-r2gctgctgaactcgtcctcprv-p2actactacgacggcgacgacgaprv-f3tctggtgaacgtgtccgaprv-r3ctcgaagcacaccgtggtcprv-p3tggccgggatctggacgttcct2.阳性对照品的制备阳性对照品选用非洲猪瘟病毒b646l基因质粒标准物质、猪伪狂犬病毒(prv)标准毒株,并采用数字pcr方法对其进行准确定值。通过数字pcr对猪伪狂犬病病毒(prv)标准毒株进行定值,定值结果为7.6×104copies/μl。将非洲猪瘟病毒b646l基因质粒标准物质(5.8×104copies/μl)与定值为7.6×104copies/μl的猪伪狂犬病病毒(prv)标准毒株等体积混合,即为阳性对照品。asfv、prv核酸数字pcr定值:ddpcr反应体系包括2×ddpcrsupermix10μl,dna模板2μl,正向引物(10pmol/μl)1.8μl,反向引物(10pmol/μl)1.8μl,探针(10pmol/μl)0.5μl,dnase-freewater3.9μl,总体积为20μl。其中,asfv和prv正向引物、反向引物及探针如表2所示。表2asfv和prv正向引物、反向引物及探针序列将配置的ddpcr反应液转入微滴生成卡中,利用微滴生成仪生成微滴;将微滴转入pcr板中,置于pcr仪中按如下反应程序进行扩增:95℃预变性10min;94℃变性30s,52℃退火30s(注:asfv退火温度为52℃,prv退火温度为60℃),40个循环;98℃10min;4℃1h,升降温速率2℃/s。扩增完成后将pcr板置于微滴分析仪中进行荧光读取,计算目的核酸片段含量。3.核酸提取使用tguides32磁珠法病毒dna/rna提取试剂盒(购自天根生化科技(北京)有限公司,货号dp604),根据产品使用说明书进行病毒dna/rna提取,提取后的核酸置于-80℃冰箱保存备用。4.引物、taqman探针筛选采用设计合成的引物和taqman探针建立单重荧光定量pcr方法,将上述非洲猪瘟病毒b646l基因质粒标准物质(5.8×104copies/μl)、定值为7.6×104copies/μl的猪伪狂犬病病毒(prv)标准毒株分别进行10倍系列稀释,选择5.8×102copies/μl的非洲猪瘟病毒b646l基因质粒标准物质、7.6×102copies/μl的猪伪狂犬病病毒(prv)标准毒株分别作为模板,采用takarapremixextaqtm(probeqpcr)试剂及推荐的反应体系、反应条件,扩增结果如图1、2所示,以最低ct值和最高荧光强度增加值(△rn)的引物及探针组合为最佳,筛选得到最优引物组合。筛选得到的最优引物组合如表3所示。表3最优引物、taqman探针组合5.asfv/prv野毒双重实时荧光定量pcr方法优化(1)引物探针浓度的优化对步骤4确定的最优引物探针组合分别稀释到不同工作浓度,以步骤2确定的阳性对照品为模板,对各病毒引物探针终浓度进行优化选择,引物终浓度范围区间为0.1~1μm,以0.1μm为梯度递增,探针终浓度范围区间为0.1~0.5μm,以0.1μm为梯度递增进行正交试验。采用takarapremixextaqtm(probeqpcr)试剂及推荐的反应体系、反应条件,以最低ct值、较高荧光强度增加值(△rn)、扩增效率、重复性和平台期等因素作为综合判定依据,确定最佳引物终浓度为:asfv-f(0.1μmol/l)、asfv-r(0.1μmol/l)、asfv-p(0.1μmol/l);prv-f(0.4μmol/l)、prv-r(0.4μmol/l)、prv-p(0.4μmol/l)。(2)退火温度的优化将上述步骤2确定的阳性对照品为模板,对退火温度进行优化,将其设置在54℃~62℃范围内,采用takarapremixextaqtm(probeqpcr)试剂及推荐的反应体系、反应条件。扩增结果如图3、图4所示,以最低ct值、较高荧光强度增加值(△rn)、扩增效率、平台期等因素作为综合判定依据,确定最佳退火温度为54℃。6.asfv/prv野毒双重实时荧光定量pcr方法的建立在上述引物和taqman探针的引导下建立asfv/prv野毒双重实时荧光定量pcr方法,检测体系如表4所示。表4检测体系试剂体积终浓度premixextaqprobeqpcr2x12.5μl1xasfvforwardprimer(10μmol/l)0.25μl0.1μmol/lasfvreverseprimer(10μmol/l)0.25μl0.1μmol/lasfvprobe(10μmol/l)0.25μl0.1μmol/lprvforwardprimer(10μmol/l)1μl0.4μmol/lprvreverseprimer(10μmol/l)1μl0.4μmol/lprvprobe(10μmol/l)1μl0.4μmol/l模板2μlh2o6.75μltotal25μl扩增条件为:95℃30s;95℃5s,54℃30s,共40个循环。检测结果判定方法:1):在fam、vic通道,阳性对照品ct值<32且呈现“s”型扩增曲线,阴性对照品无ct值且无扩增曲线,当满足以上要求时实验成立。2):在fam通道中,样品ct值≤40,且出现“s”型扩增曲线,则认为asfv阳性;3):在vic通道中,样品ct值≤40,且出现“s”型扩增曲线,则认为prv阳性;4):fam和vic通道中,无“s”型扩增曲线或ct值即为阴性。实施例2asfv/prv野毒双重实时荧光定量pcr试剂盒试剂盒包括实施例1中所述的引物探/针混合液、qpcr预混液、阳性对照品、阴性对照品。试剂盒在使用25μl实时荧光定量pcr检测体系时,所述引物和taqman探针的用量优选为:3.75μl。所述的qpcr预混液为takarapremixextaqtm(probeqpcr)。所述的阳性对照品为非洲猪瘟病毒b646l基因质粒标准物质(5.8×104copies/μl)与定值为7.6×104copies/μl的猪伪狂犬病病毒(prv)标准毒株的等体积混合液,所述的阴性对照品无核酸酶水。上述试剂盒对asfv、prv检测的应用也属于本发明的内容。上述试剂盒的应用包括以下步骤:(1)多重荧光定量pcr体系的配制:根据待检测样本总数以及阳性对照、阴性对照个数,按照表5配制反应体系。表5检测体系试剂(2)加样:按照核酸提取试剂盒说明书提取的样品的核酸、阴性对照品、阳性对照品,各取2μl,分别加入相应的反应管中,盖好管盖,混匀,瞬时离心,应避免气泡。(3)pcr扩增:将步骤(2)中的反应管置于荧光定量pcr仪中进行扩增,设置检测通道,样品信息,反应体系,扩增条件。(4)结果分析:根据上述实施例1中的判定方法对结果进行分析判定。实施例3特异性检测以本实验室保存的猪瘟病毒、猪繁殖与呼吸综合征病毒、口蹄疫病毒、猪细小病毒、猪伪狂犬病病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒的阳性核酸各一份为特异性样品,以实施例1中所述的b646l基因质粒标准物质(5.8×104copies/μl)与定值为7.6×104copies/μl的猪伪狂犬病病毒(prv)标准毒株混合液为阳性对照品,无核酸酶水为阴性对照品,核酸提取、检测体系及检测条件如上述实施例1中所述。检测结果如图5所示,根据结果可见,阳性对照品满足试验成立条件,ct值<32且呈现特定的“s”型扩增曲线,阴性对照品无ct值且无扩增曲线。结果表明,本发明方法与其他病毒无交叉反应,可特异性地检测asfv和prv。实施例4灵敏度检测及标准曲线的建立将实施例1中的阳性对照品进行10倍系列稀释,混合液中非洲猪瘟病毒b646l基因质粒标准物质的浓度为5.8×104copies/μl-5.8×100copies/μl、猪伪狂犬病病毒(prv)标准毒株的浓度为7.6×104copies/μl-7.6×100copies/μl,每个梯度做3个重复,在实施例1中的所述的引物和taqman探针的引导下进行多重荧光定量pcr检测,检测体系及检测条件如实施例1中所述。检测结果显示,多重荧光定量pcr方法对asfv的最低检测限为58copies/μl、对prv的最低检测限为7.6copies/μl,结果表明,本发明建立的多重荧光定量pcr方法具有较高的灵敏度。以起始模板浓度的对数为横坐标,ct值为纵坐标绘制标准曲线,如图6所示,标准曲线的相关系数(r2)均在0.99以上,扩增效率e均在90%~110%,表明该方法具有良好的线性关系。实施例5重复性检测以不同梯度稀释的阳性对照品为模板,在实施例1中所述引物和taqman探针的组合下进行多重荧光定量pcr检测,重复检测3次,检测体系及检测条件如实施例1中所述。同时分不同时间段检测3次,分别计算ct值的变异系数,对多重荧光定量pcr方法的组内和组间重复性进行评估。结果如表6所示,变异系数均小于2%,表明本发明建立的asfv/prv野毒双重实时荧光定量pcr方法的重复性良好。表6组内和组间重复性分析实施例6临床应用检测(1)样品:从北京地区猪场采集的180份临床样品,包括全血样品100份、组织病料样品40份,环境样品20份,饲料样品20份;非洲猪瘟阳性核酸20份。其中非洲猪瘟阳性核酸为北京市动物疫病预防控制中心实验室保存。(2)临床样品核酸的提取:按照实施例1中的所述的病毒核酸提取方法,提取临床样本的核酸,作为多重荧光定量pcr检测的模板。(3)用实施例2中所述的试剂盒进行多重荧光定量pcr检测。同时使用青岛立见非洲猪瘟病毒荧光pcr检测试剂盒、北京世纪元亨猪伪狂犬病毒(ge基因)荧光pcr检测试剂盒分别对asfv、prv进行比对检测。(4)结果如下表7所示,双重实时荧光定量pcr检测的结果与单重实时荧光定量pcr检测结果符合率为100%,表明本发明所述的asfv/prv野毒双重实时荧光定量pcr试剂盒可用于快速诊断和流行病学调查。表7临床样品检测结果显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。序列表<110>北京市动物疾病预防控制中心<120>一种联合检测非洲猪瘟病毒和猪伪狂犬病病毒野毒株的引物和探针、试剂盒及应用<160>6<170>siposequencelisting1.0<210>1<211>18<212>dna<213>人工序列(artificialsequence)<400>1gtctggaagagctgtatc18<210>2<211>18<212>dna<213>人工序列(artificialsequence)<400>2ggaacatctccgatcaaa18<210>3<211>25<212>dna<213>人工序列(artificialsequence)<400>3cctcatcaacaccgagattggcaca25<210>4<211>18<212>dna<213>人工序列(artificialsequence)<400>4gtacgtgctcgtgatgac18<210>5<211>18<212>dna<213>人工序列(artificialsequence)<400>5cgtcagctccttgatgac18<210>6<211>20<212>dna<213>人工序列(artificialsequence)<400>6cctgggactacacgctcgtc20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1