一种猪流感病毒的检测引物及其试剂盒的制作方法
1.本发明涉及基因检测技术领域,尤其是涉及数字pcr检测猪流感病毒的引物及其试剂盒。
背景技术:
2.猪流感(swine influenza,si)是由猪流感病毒(swine influenza virus,siv)引起的猪急性呼吸道传染病,不仅给养猪业带来了极大的危害,还严重危害人类健康,因此引起全球公共卫生的关注。猪流感病毒(siv)感染可引起以呼吸道疾病为特征的呼吸道疾病如咳嗽,打喷嚏,流鼻涕,直肠温度升高,昏昏欲睡,呼吸困难和食欲降低。该病毒对热、消毒剂敏感,而对干燥和低温的抵抗力强大。猪流感病毒能够在多种动物的细胞上增殖,但病毒分离和疫苗生产时,经常采用鸡胚接种。病毒具有血凝活性,但不同毒株的抗原性无明显的区分。由于病毒受到抗体的压力很大,因此病毒的变异频繁,其机理涉及分子水平的抗原漂移和抗原转变。
3.猪流感病毒属于正黏病毒科甲型流感病毒属,病毒粒子多形态。基因组包含八个分节段的负链rna,至少编码12~13种蛋白。根据病毒表面糖蛋白的不同,甲型流感病毒可以分为 16种ha亚型(h1~h16)以及9种na亚型(n1~n9)。甲型流感病毒可感染多种宿主,包括禽、猪、以及人等。由于猪的呼吸道上皮细胞中同时具有与禽流感病毒和人流感病毒结合的受体,因此人流感病毒和禽流感病毒均可感染猪。同样,越来越多的报道表明,siv也可以反传给禽和人。自1974年起,全球常有siv感染人的报道,并导致部分病例死亡。更为重要的是1957 年、1968年以及2009年的流感大流行毒株均推测与猪流感病毒有关。2011年8月起,倍受全球关注的猪流感三源重配h3n2/h1n2亚型变异株在美国13个地区造成318人感染,其中1 人死亡,16人住院治疗。
4.近些年,荧光定量pcr(real time polymerase chain reaction,qpcr)是检测定量猪流感病毒常使用的技术手段,该技术通过在pcr反应体系中加入荧光标记的探针(如taqman),利用实时积累的荧光信号监测整个扩增过程,最后通过标准曲线对未知模板进行定量分析,以此来评估pcr的扩增效果。荧光定量pcr主要依赖于校准物制备的标准曲线,进而确定未知样品的浓度,因此是一种相对定量的方法。该技术存在众多不足:1.校准品和样品间背景的差异易影响pcr的效率和测量响应;2.低拷贝数的目标核酸分子不能通过扩增检测到;3.样品的pcr扩增效率可能与校准物的扩增效率不同;4.rna提取时引入rna溶液的杂质或者 rna降解影响了pcr动态扩增过程。因此,荧光定量pcr很难达到对低拷贝值猪流感病毒的检测与绝对定量。
5.数字pcr(digital polymerase chain reaction,dpcr)是一项针对单分子靶标核酸绝对定量的新技术。该技术是将含有dna模板的pcr溶液稀释后分布到大量的独立反应室(如芯片),液体分子遵从泊松分布,单分子间通过稀释分离,并且独自进行pcr扩增,这种样品的分配可以极大降低本底信号的影响,提高低丰度靶标的扩增灵敏度,最后分析每个扩增产物,通过泊松概率分布公式计算出dna模板的原始拷贝数而不需要采用参考标准物或
者外标。极大提高了检出率,假阴性检出水平(单dna模板出现在反应室而未被检出)非常低。其具有操作方便、检测通量高、特异性强、灵敏度高、定量准确等优点。
6.数字pcr作为核酸定量的新技术,克服了实时荧光定量pcr的一系列缺点,实现了单个核酸分子的绝对定量。避免了荧光定量pcr使用标准曲线对测量结果产生影响等问题。此技术可代替荧光定量pcr应用于猪流感病毒的定量检测。
技术实现要素:
7.基于上述技术问题,本发明提供了一组特异性强,扩增效率高的pcr引物及探针,再结合高灵敏度的数字pcr技术,以达到检测和绝对定量低拷贝值猪流感病毒的目的。
8.即本发明提供了一种猪流感病毒的检测引物,所述检测引物包括猪流感病毒的正向引物、反向引物以及扩增探针引物,所述正向引物及反向引物位于猪流感病毒基因34-54和115-135碱基,其序列如seq id no:001和seq id no:002所示。
9.所述扩增探针引物位于猪流感病毒基因66-84碱基,其序列如seq id no:003所示。所述引物扩增基因序列位于新冠病毒基因34-135碱基,扩增片段大小为102个碱基,如seq id no: 004所示。
10.在上述的猪流感病毒检测引物中,所述猪流感病毒引物序列选自pubmed数据库中猪流感病毒基因34-54和115-135碱基,其序列如seq id no:001和seq id no:002所示。其引物3’端不存在自身互补重叠序列,可避免发夹结构和引物二聚体的产生。
11.在上述的猪流感病毒检测引物中,所述正向引物和反向引物分别如seq id no.001和seqid no.002所示。
12.siv-正向:ctttctatcatcccgtcaggc(seq id no.001)
13.siv-反向:ccattccatgagagcctcaag(seq id no.002)
14.所述扩增探针引物序列如seq id no.003所示。
15.siv-探针:cgagatcgcgcagagactg(seq id no.003)
16.所述扩增区域序列如seq id no.004所示。
17.引物扩增序列:
18.ctttctatcatcccgtcaggccccctcaaagccgagatcgcgcagagactggaaa gtgtctttgcaggaaagaacacagatcttgaggctctcatggaatgg(seq id no.004)
19.在上述的猪流感病毒检测引物中,所述检测引物的使用方法:
20.1)提取样品rna;
21.2)rna反转录为cdna;
22.3)利用seq id no:001-003所示的正、反向扩增引物及扩增探针引物,对步骤2)所述cdna样品利用芯片pcr扩增仪进行扩增,获得新冠病毒的扩增产物;
23.4)利用生物芯片阅读仪对步骤3)所述扩增产物进行扫描和分析,获得所述扩增产物的拷贝值。
24.本发明还提供了一种检测猪流感病毒的试剂盒,所述试剂盒包括上述的检测引物。
25.进一步地,所述检测试剂盒包括样品rna抽提试剂、rna反转录试剂、无水乙醇、检测体系pcr反应液、阳性对照品、阴性对照品;
26.其中检测体系pcr反应液包括:1对扩增引物和1条探针引物,序列如seq id no:001-003 所示。
27.优选地,所述检测体系pcr反应液还包括:2x multiplex pcr plus buffer;dntp mix; hotstar taq plus dna polymerase。
28.本发明设计了检测猪流感病毒的正、反向引物及探针引物,可同时用于荧光定量pcr及数字pcr扩增反应。通过荧光定量pcr扩增对比发现其扩增效率优于其它引物。对质粒标准品及送检样本进行数字pcr检测,均可以精确地检测猪流感病毒的绝对拷贝值。通过调整正反向引物及探针的浓度、退火温度等反应条件,可使扩增效率达到最佳。
29.本发明取得的有益效果:设计的猪流感病毒正反向扩增引物,可以高效的扩增出目的基因,具有很高的特异性及精确性,其扩增效率优于其它扩增引物;采用数字pcr方法扩增目的基因,具有灵敏度高,能够绝对定量等优点。将极大地提高猪流感病毒的检出效率,为临床检测猪流感病毒提供一种可靠方法。
附图说明:
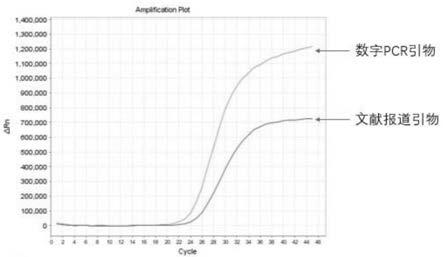
30.图1为本发明实施例与文献报道引物的扩增对比;
具体实施方式
31.以下优选实施例仅用以说明本发明的技术方案而非限制,尽管通过下述优选实施例已对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
32.下文中将结合附图对本发明的实施例进行详细说明。需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互任意组合。
33.实施例1
34.检测猪流感病毒扩增的引物序列
35.包括seq id no:001-003所示的序列,为扩增猪流感病毒的正、反向引物及探针引物。
36.本发明设计的正、反向引物碱基分布随机,引物3’端无连续的3个或以上gc碱基聚集, 3’端不存在自身互补重叠序列,可避免发夹结构和引物二聚体的产生。相关文献 (pmc7119756)报道引物如seq id no:005-007所示,其正反向引物gc含量过高,易产生引物二聚体,不利于荧光定量pcr扩增。
37.文献报道正向引物:tcaggccccctcaaagccga(seq id no.005)
38.文献报道反向引物:gggcacggtgagcgtgaaca(seq id no.006)
39.文献报道探针:cgcgcagagactggaaagtgtc(seq id no.007)
40.在检测中,利用上述权利要求书中所述的正、反向引物及探针引物与相关文献的引物探针进行对比,以人工合成猪流感病毒基因(上海生物工程股份有限公司)作为模板,同时进行荧光定量pcr扩增,获得扩增曲线图(图1),上述权利要求书中所述引物的扩增效率明显优于文献报道引物。
41.实施例2
42.测试基于数字pcr技术的猪流感病毒检测试剂盒
43.包括:样品rna抽提试剂盒(凯捷公司的rna提取试剂盒,货号52904);无水乙醇; rna反转录试剂盒(凯捷公司的反转录试剂盒,货号205411);数字pcr微滴式芯片试剂盒(杭州领航基因公司提供的芯片试剂盒,货号d1);检测体系pcr反应液、阳性对照品、阴性对照品。其中检测体系pcr反应液包括:2x multiplex pcr plus buffer;dntp mix; hotstar taq plus dna polymerase;seq id no:001-003所示的扩增猪流感病毒的正、反向引物及探针引物。
44.实施例3
45.基于微滴数字pcr技术检测猪流感病毒的方法
46.(1)抽提咽拭子标准品中的基因组rna
47.1)吸取560μl提前加有carrier rna的buffer avl置于1.5ml离心管中。
48.2)加入140μl咽拭子标准品,涡流混合15s。
49.3)室温孵育10min。
50.4)简短离心使离心管内管壁粘附液滴集中至管底。
51.5)加入560μl无水乙醇,混匀漩涡15s。
52.6)吸取630μl步骤5中液体加入到2ml收集管中的过滤柱中,盖上盖子,6000xg(8000 转/分钟)离心1分钟。
53.7)重复步骤6。
54.8)加入500μl buffer aw1,6000xg(8000转/分钟)离心1分钟。
55.9)加入500μl buffer aw2,20000xg(14000转/分钟)离心3分钟。
56.10)将过滤柱放置于新的1.5ml无菌离心管中,加入60μl buffer ave室温孵育1min。
57.11)6000xg(8000转/分钟)离心1分钟收集样品溶解液。
58.(2)rna反转录
59.1)将rna样品、reverse transcription mix以及rnase-free water于室温下解冻,将gdnaremoval mix和reverse transcription enzyme提前置于冰上。
60.2)按如下表格配制去基因组dna反应液体系
[0061][0062][0063]
3)45℃孵育2min后立即放于冰上待用。
[0064]
4)按如下表格配制反转录反应液体系
[0065]
试剂名称用量reverse transcription enzyme1μlreverse transcription mix4μltemplate rna(step 3)15μl
总计20μl
[0066]
5)混匀后按如下程序进行反应
[0067]
steptimetemperatureannealing step3min25℃reverse-transcription step10min45℃inactivation of reaction5min85℃
[0068]
(3)试剂配制:
[0069]
检测体系pcr反应液配制如下:
[0070]
试剂名称用量2x multiplex pcr master mix12.5μl正向引物(6μm)2.5μl反向引物(6μm)2.5μl探针引物(3μm)2.5μl样品cdna模板5.0μl总计25.0μl
[0071]
其中,正反向扩增引物及探针引物碱基序列如seq id no:001-003所示。
[0072]
按检测样本份数总共配制pcr反应液xμl,每份20μl分装:
[0073]
x=20μl反应液x(n份标本+1份阳性对照+1份阴性对照)
[0074]
n为检测标本数。
[0075]
(4)加样:将5μl步骤(2)中获得的cdna样品加入到检测体系pcr反应液中;对阳性对照实验而言,直接加5μl阳性对照品;对阴性对照实验而言,直接加5μl ddh2o。
[0076]
(5)芯片上样:用移液枪吸取14μl步骤(4)中配置好的pcr反应液上样到芯片中,加入 16μl甘油密封芯片,再放置于液滴生成仪上进行液滴生成。
[0077]
(6)数字pcr扩增:扩增在液滴芯片专用pcr仪上进行,使用仪器为tc1.0 pcr仪(杭州领航基因科技有限公司)。反应条件如下:95℃预变性5分钟30秒;95℃30秒,55℃90 秒,72℃30秒,共45个循环;4℃保存。
[0078]
(7)荧光扫描及图像分析:
[0079]
将步骤(6)中扩增完成的芯片放置于生物芯片阅读仪中进行荧光扫描拍照并进行数据分析,分析完成后即可计算出样本中猪流感病毒分子的绝对拷贝数值。
[0080]
实施例4
[0081]
采用本发明中基于数字pcr技术的猪流感病毒检测试剂盒检测临床标本。
[0082]
取送检咽拭子标本12例,其中临床确诊阳性7例,阴性5例。该12例样本按实施例3所述方法提取样本rna反转录,配制试剂并检测。每份标本加入检测体系pcr反应液中5μl,同时做阳性,阴性对照。每个样本重复2次。数字pcr引物检测结果显示7例阳性,5例阴性,且与确诊结果一致,准确率为100%。文献报道引物检测结果显示阳性4例,阴性8例,准确率为75.0%。数字pcr引物检测结果显著高于文献报道引物。
[0083]
检测结果如下表1:
[0084][0085][0086]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1