一株可缓解ETEC致腹泻的植物乳杆菌及其应用的制作方法
一株可缓解etec致腹泻的植物乳杆菌及其应用
技术领域
[0001]
本发明涉及一株可缓解etec致腹泻的植物乳杆菌及其应用,属于微生物技术领域。
背景技术:
[0002]
etec,肠毒性大肠埃希杆菌,定居于小肠表面,不损坏也不侵入肠黏膜上皮细胞,通过产生肠毒素引起分泌性腹泻,是人类霍乱样病人大便中新发现的一组致腹泻性大肠埃希杆菌,是发达国家“旅游者腹泻”的主要病原之一,是“成人霍乱综合征”的常见原因,也是小儿腹泻的重要病原,其发病率仅次于轮状病毒。
[0003]
同时,etec也是引起家畜特别是幼畜(初生仔猪、犊牛等)腹泻的重要病原菌。初生仔猪感染etec后,常因剧烈水样腹泻和迅速脱水而死亡,发病率和死亡率均很高,给养猪业带来巨大负担。
[0004]
etec会产生热不稳定毒素lt和热稳定性毒素st,继而改变紧密连接的完整性,引发炎症、肠道功能异常,以及破坏离子、溶质和水的胞旁通道,最终导致腹泻。传统的氟喹诺酮类、利福昔明等抗生素对etec引起腹泻的预防是有效的,但通常只用于高危人群,如免疫功能严重抑制的患者。同时,这些传统药物也会产生很大的副作用,例如,常常会引发肠胃不适、中枢系统出现异常反应,以及头痛、头晕等症状。而且,长期服用这些传统药物会对肝造成损害。另外,长期服用这些传统药物还存在成本高、etec出现抗菌素耐药性等问题。上述缺陷均使得这些传统药物的使用受到限制,而替代方法的有效性还在研究中。
[0005]
益生菌是通过定殖在人体内,改变宿主肠道菌群组成,进而代谢产生如短链脂肪酸等有益代谢物,以对宿主产生有益影响的一类菌。与普通的药物相比,益生菌具有安全性高、无副作用、不会出现耐药性和成本低等优势。并且,研究表明,少数益生菌确实可对一些特殊的疾病起到预防和/或治疗作用,例如,公开号为cn108220206a的专利申请文本中,长双歧杆菌ys108r就可很好的预防和/或治疗结肠炎。虽然已有文献报道植物乳杆菌缓解etec致腹泻的作用,但效果的优良性还不确定。
[0006]
因此,发现一株可缓解etec致腹泻的益生菌或者优于已有报道的同种菌对预防和/或治疗腹泻这一疾病十分关键。
技术实现要素:
[0007]
[技术问题]
[0008]
本发明要解决的技术问题是提供一株可缓解腹泻的植物乳杆菌(lactobacillus plantarum)。
[0009]
[技术方案]
[0010]
为解决本发明的技术问题,本发明提供了一株植物乳杆菌(lactobacillus plantarum)ccfm1143,所述植物乳杆菌(lactobacillus plantarum)ccfm1143已于2020年08月19日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:61149,保藏地址为广
州市先烈中路100号大院59号楼5楼。
[0011]
所述植物乳杆菌(lactobacillus plantarum)ccfm1143是从来源于黑龙江肇东地区的桦甸泡菜样本中分离得到的,该菌株经测序分析,其16s rdna序列如seq id no.1所示,将测序得到的序列在ncbi中进行核酸序列比对,结果显示菌株为植物乳杆菌,命名为植物乳杆菌(lactobacillus plantarum)ccfm1143。
[0012]
所述植物乳杆菌(lactobacillus plantarum)ccfm1143在mrs培养基上的菌落呈现乳白色、表面光滑、圆形凸起。
[0013]
本发明还提供了一种制备预防和/或治疗腹泻的产品的方法,所述方法为使用上述植物乳杆菌(lactobacillus plantarum)ccfm1143。
[0014]
在本发明的一种实施方式中,所述产品中,上述植物乳杆菌(lactobacillus plantarum)ccfm1143的活菌数为不低于1
×
10
10
cfu/ml或1
×
10
10
cfu/g。
[0015]
在本发明的一种实施方式中,所述产品包括功能性食品或药品。
[0016]
在本发明的一种实施方式中,所述药品含有上述植物乳杆菌(lactobacillus plantarum)ccfm1143、药物载体和/或药用辅料。
[0017]
本发明的一种实施方式中,所述食品包含含有上述植物乳杆菌(lactobacillus plantarum)ccfm1143的保健食品;或所述食品包含使用含有上述植物乳杆菌(lactobacillus plantarum)ccfm1143的发酵剂生产得到的乳制品、豆制品、肉制品或果蔬制品。
[0018]
在本发明的一种实施方式中,所述发酵剂的制备方法为将上述植物乳杆菌(lactobacillus plantarum)ccfm1143接种到培养基中,于37℃下培养18h,得到培养液;将培养液离心,得到菌体;将菌体用生理盐水重悬,得到发酵剂。
[0019]
在本发明的一种实施方式中,所述培养基为mrs培养基。
[0020]
本发明还提供了一种用于预防和/或治疗腹泻的产品,所述产品含有上述植物乳杆菌(lactobacillus plantarum)ccfm1143。
[0021]
在本发明的一种实施方式中,所述产品中,上述植物乳杆菌(lactobacillus plantarum)ccfm1143的活菌数不低于1
×
10
10
cfu/ml或1
×
10
10
cfu/g。
[0022]
在本发明的一种实施方式中,所述产品包括功能性食品、保健食品或药品。
[0023]
在本发明的一种实施方式中,所述药品含有上述植物乳杆菌(lactobacillus plantarum)ccfm1143、药物载体和/或药用辅料。
[0024]
在本发明的一种实施方式中,所述食品包括含有所述植物乳杆菌(lactobacillus plantarum)ccfm1143的乳制品、豆制品、肉制品或果蔬制品;或使用所述植物乳杆菌(lactobacillus plantarum)ccfm1143生产得到的乳制品、豆制品、肉制品或果蔬制品。
[0025]
在本发明的一种实施方式中,所述发酵剂的制备方法为将上述植物乳杆菌(lactobacillus plantarum)ccfm1143接种到培养基中,于37℃下培养18h,得到培养液;将培养液离心,得到菌体;将菌体用生理盐水重悬,得到发酵剂。
[0026]
在本发明的一种实施方式中,所述培养基为mrs培养基。
[0027]
[有益效果]
[0028]
本发明筛选出了一株植物乳杆菌(lactobacillus plantarum)ccfm1143,此植物乳杆菌(lactobacillus plantarum)ccfm1143具有缓解腹泻的作用,具体体现在:
[0029]
(1)显著提高腹泻小鼠的体重;
[0030]
(2)显著降低腹泻小鼠的粪便含水量;
[0031]
(3)显著缓解腹泻小鼠空肠的病理损伤;
[0032]
(4)显著降低腹泻小鼠血清中的炎症因子水平;
[0033]
(5)显著降低腹泻小鼠血清中肠毒素st的含量;
[0034]
(6)显著提高腹泻小鼠血清中水通道蛋白aqp3的含量;
[0035]
(7)显著提高腹泻小鼠肠道菌群丰度;
[0036]
(8)显著提高腹泻小鼠粪便中短链脂肪酸的含量;
[0037]
(9)显著抑制etec的毒力基因esta、estb、elt表达。
[0038]
因此,植物乳杆菌(lactobacillus plantarum)ccfm1143在制备预防和/或治疗腹泻的产品(如功能性食品或药品等)中,具有巨大的应用前景。
[0039]
生物材料保藏
[0040]
一株植物乳杆菌(lactobacillus plantarum)ccfm1143,分类学命名为lactobacillus plantarum,已于2020年08月19日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:61149,保藏地址为广州市先烈中路100号大院59号楼5楼。
附图说明
[0041]
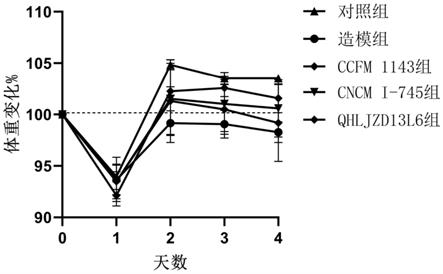
图1:不同组小鼠的体重变化情况。
[0042]
图2:不同组小鼠粪便含水量的变化情况。
[0043]
图3:不同组小鼠空肠的病理损伤情况。
[0044]
图4:不同组小鼠空肠绒毛的高度。
[0045]
图5:不同组小鼠空肠隐窝的深度。
[0046]
图6:不同组小鼠空肠的绒毛/隐窝值。
[0047]
图7:不同组小鼠血清中ifn-γ的含量。
[0048]
图8:不同组小鼠血清中tnf-α的含量。
[0049]
图9:不同组小鼠血清中il-6的含量。
[0050]
图10:不同组小鼠血清中il-10的含量。
[0051]
图11:不同组小鼠血清中肠毒素st的含量。
[0052]
图12:不同组小鼠血清中水通道蛋白aqp3的含量。
[0053]
图13:不同组小鼠粪便中allobaculum的水平。
[0054]
图14:不同组小鼠粪便中bifidobacterium的水平。
[0055]
图15:不同组小鼠粪便中odoribacter的水平。
[0056]
图16:不同组小鼠粪便中proteus的水平。
[0057]
图17:不同组小鼠粪便中pseudomonas的水平。
[0058]
图18:不同组小鼠粪便中丙酸的含量。
[0059]
图19:不同组小鼠粪便中丁酸的含量。
[0060]
图20:不同组小鼠粪便中乙酸的含量。
[0061]
图21:不同组小鼠粪便中异丁酸的含量。
[0062]
图22:不同组处理后etec的肠毒素基因esta表达。
plantarum)qhljzd13l6。
[0079]
表1 ccfm1143的生理生化特性
[0080]
过氧化氢酶-棉籽糖+核糖-海藻糖-纤维二糖-低聚果糖-盐藻糖-阿拉伯糖-甘露糖-低聚木糖-木糖+山梨糖+
[0081]
实施例2~7中,植物乳杆菌(lactobacillus plantarum)菌液和布拉迪酵母菌液的制备方法如下:
[0082]
挑取实施例1获得的植物乳杆菌的单菌落接入mrs液体培养基中,于37℃厌氧培养24h,得到活化液;将活化液按照1%(v/v)的接种量接入mrs液体培养基中,于37℃厌氧培养24h,得到一级种子液;将一级种子液按照1%(v/v)的接种量接入mrs液体培养基中,于37℃厌氧培养24h,得到二级种子液;将二级种子液按照1%(v/v)的接种量接入mrs液体培养基中,于37℃厌氧培养24h,得到菌液;将菌液6000g离心15min,收集沉淀;将沉淀用ph为7.4的pbs缓冲液洗涤两次后,6000g再次离心10min,得到菌体;用含有130g/l脱脂乳、20g/l海藻糖和20g/l蔗糖的保护剂溶液将植物乳杆菌菌体重悬至细胞浓度为5
×
10
9
cfu/ml,得到植物乳杆菌菌液。
[0083]
布拉迪酵母菌液的制备方法如下:
[0084]
取一勺布拉迪酵母菌粉接入ypd液体培养基中,于28℃培养24h,得到活化液;将活化液按照1%(v/v)的接种量接入ypd液体培养基中,于28℃培养24h,得到一级种子液;将一级种子液按照1%(v/v)的接种量接入ypd液体培养基中,于28℃培养24h,得到二级种子液;将二级种子液按照1%(v/v)的接种量接入ypd液体培养基中,于28℃培养24h,得到菌液;将菌液6000g离心15min,收集沉淀;将沉淀用ph为7.4的pbs缓冲液洗涤两次后,6000g再次离心10min,得到菌体;用含有130g/l脱脂乳、20g/l海藻糖和20g/l蔗糖的保护剂溶液将布拉迪酵母菌体重悬至细胞浓度为5
×
10
9
cfu/ml,得到布拉迪酵母菌菌液。
[0085]
研究证明布拉迪酵母菌株没有病源性和扩散性(限定在消化道中,而不会向身体的任何其他位置扩散),通常生长良好,且具有独特生物活性,适合作为人和动物的益生菌使用。自分离出布拉迪酵母菌株以来,已进行了广泛的研究,共发表400多篇相关研究报告。1962年该菌株开始应用于治疗人类腹泻(作为处方药使用),1993开始用于改善单胃动物营养和健康的饲料添加剂,适用于母猪,仔猪,肉鸡,蛋鸡,犊牛,特种皮毛动物、水产动物等。布拉迪酵母已成为商业化菌株并且已有文献报道布拉迪酵母在缓解etec引起的腹泻的有益作用,因此,下述实施例中以布拉迪酵母作为阳性对照。
[0086]
实施例2:植物乳杆菌ccfm1143对腹泻小鼠体重和粪便含水量的影响
[0087]
具体步骤如下:
[0088]
取balb/c小鼠40只,于饲养室温为22~24℃,湿度为40~60%,12h/12h昼夜交替,自由进食及饮水的条件下饲养1周后,随机分为5组,每组8只,5组分别为:对照组、造模组、灌胃布拉迪酵母菌液的布拉迪酵母组(cncmi-745组)、灌胃植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液的qhljzd13l6组、灌胃植物乳杆菌(lactobacillus plantarum)ccfm1143菌液的ccfm1143组。
[0089]
实验共3周:动物适应性饲养1周后开始实验。从造模前7天开始,一直持续到实验结束(不包括抗生素处理的那3天),对照组和造模组小鼠每只每天灌胃0.2ml含有130g/l脱
脂乳、20g/l海藻糖和20g/l蔗糖的保护剂溶液,布拉迪酵母组每只每天灌胃0.2ml布拉迪酵母菌液,qhljzd13l6组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液,ccfm1143组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)ccfm1143菌液;适应后的第2周为造模期,造模第1~3天,在小鼠饮用水中加入5g/l的链霉素,以消除balb/c小鼠肠道正常菌群,造模第4~7天,用不含抗生素的无菌水代替含有链霉素的水作为小鼠饮用水,并且,对小鼠禁食18h,18h后,给每组小鼠每只灌胃0.2ml浓度为1.2
×
10
11
cfu/ml的etec o78:k80悬液(通过将etec o78:k80菌体溶于浓度为8.5g/l的生理盐水而得),连续灌胃4天,1天2次,每次间隔2h。
[0090]
造模期间以及造模结束后,通过体重计测定每组小鼠体重;实验结束后,收集小鼠粪便,通过lyobeta 5ps冻干机(西班牙泰事达公司)测定小鼠粪便的含水量,测定结果分别见图1~2。
[0091]
由图1可知,在整个实验期间,造模组小鼠的体重下降了1.72%;对照组小鼠的体重增加了3.53%,与造模组相比,有显著差异(p<0.01);ccfm1143组小鼠的体重增加了1.57%;qhljzd13l6小鼠的体重下降了0.83%;布拉迪酵母组小鼠的体重增加了0.60%,与造模组组相比,无统计学意义(p>0.05)。
[0092]
由图2可知,造模组小鼠粪便中的含水量是对照组小鼠的1.1倍(p<0.01);ccfm1143组小鼠粪便中的含水量为60.81%,与造模组小鼠相比,存在显著差异(p<0.01);在布拉迪酵母组也发现了与ccfm1143组相似的结果;而qhljzd13l6组小鼠粪便中的含水量为64.02%,与造模组小鼠相比,没有明显差异。
[0093]
可见,植物乳杆菌ccfm1143可有效缓解腹泻小鼠体重降低、粪便含水量升高的症状,且效果优于布拉迪酵母;而植物乳杆菌qhljzd13l6则无此作用。
[0094]
实施例3:植物乳杆菌ccfm1143对腹泻小鼠空肠病理损伤情况的影响
[0095]
具体步骤如下:
[0096]
取balb/c小鼠40只,于饲养室温为22~24℃,湿度为40~60%,12h/12h昼夜交替,自由进食及饮水的条件下饲养1周后,随机分为5组,每组8只,5组分别为:对照组、造模组、灌胃布拉迪酵母菌液的布拉迪酵母组(cncmi-745组)、灌胃植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液的qhljzd13l6组、灌胃植物乳杆菌(lactobacillus plantarum)ccfm1143菌液的ccfm1143组。
[0097]
实验共3周:动物适应性饲养1周后开始实验。从造模前7天开始,一直持续到实验结束(不包括抗生素处理的那3天),对照组和造模组小鼠每只每天灌胃0.2ml含有130g/l脱脂乳、20g/l海藻糖和20g/l蔗糖的保护剂溶液,布拉迪酵母组每只每天灌胃0.2ml布拉迪酵母菌液,qhljzd13l6组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液,ccfm1143组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)ccfm1143菌液;适应后的第2周-为造模期,造模第1~3天,在小鼠饮用水中加入5g/l的链霉素,以消除balb/c小鼠肠道正常菌群,造模第4~7天,用不含抗生素的无菌水代替含有链霉素的水作为小鼠饮用水,并且,对小鼠禁食18h,18h后,给每组小鼠每只灌胃0.2ml浓度为1.2
×
10
11
cfu/ml的etec o78:k80悬液(通过将etec o78:k80菌体溶于浓度为8.5g/l的生理盐水而得),连续灌胃4天,1天2次,每次间隔2h。
[0098]
实验结束后,处死小鼠,取小鼠空肠,于4%(v/v)多聚甲醛中浸泡24h,得到固定好
的空肠组织;将固定好的空肠组织依次进行脱水、透明、浸蜡后,用莱卡石蜡包埋机将组织包埋于蜡块中,得到包埋好空肠组织的蜡块;其中,脱水、透明、浸蜡的具体步骤如下:(1)脱水:将固定好的组织先依次经70%、80%和90%(v/v)梯度乙醇溶液进行脱水,每个梯度各30min,然后放入95%和100%(v/v)酒精溶液各2次,每次20min;(2)透明:将组织先放入酒精和二甲苯等体积比混合液中15min,然后放入二甲苯i和二甲苯ii各15min;(3)浸蜡:将组织样放入62℃的石蜡i和石蜡ii液体中各30min。
[0099]
将包埋好空肠组织的蜡块用莱卡手动轮转切片机进行切片,切片厚度为5μm,得到空肠组织切片;将空肠组织切片经展片和捞片、烤片、苏木精染色、分化、漂洗、伊红复染、脱水、透明、封片,得到h&e空肠切片;其中,展片和捞片、烤片、苏木精染色、分化、漂洗、伊红复染、脱水、透明、封片的具体操作如下:(1)展片和捞片:将切片放于42℃恒温水浴中进行展片后用载玻片小心地捞出;(2)烤片:将切片放于60℃烘箱中过夜烤片;(3)苏木精染色:将切片先进行水化(即先将切片置于二甲苯i和二甲苯ii各5min,然后依次放入100%、95%、90%、80%和70%(v/v)梯度酒精溶液中各5min,最后放入蒸馏水中3min),然后进行染色(即将切片放入苏木精染色液中约20s),最后进行水洗(即将切片用自来水冲洗约30min);(4)分化:将切片放入1%(v/v)盐酸乙醇溶液中7s,进行褪色;(5)漂洗:用自来水冲洗切片约20min;(6)复染:将切片浸入伊红染色液,立即取出;(7)脱水:将切片先依次放入95%(v/v)乙醇溶液i、95%(v/v)乙醇溶液ii、70%(v/v)乙醇溶液,放入后立即取出,然后浸入80%(v/v)乙醇溶液50s,最后浸入100%(v/v)乙醇2min;(8)透明:将切片先浸入乙醇和二甲苯等体积比混合液1min,然后浸入二甲苯i和二甲苯ii各2min;(9)封片:将切片用中性树胶封片。
[0100]
用pannoramic midi数字切片扫描仪扫描制作好的h&e空肠切片,并且,拍照观察小鼠空肠的绒毛长度和隐窝深度,观察结果见图3~6。
[0101]
由图3~6可知,与对照组小鼠相比,造模组小鼠空肠的绒毛长度明显缩短了22.78%,隐窝深度明显增加了70.40%;与造模组小鼠相比,ccfm1143组小鼠空肠的绒毛长度增加了17.56%,隐窝深度降低了33.72%;qhljzd13l6组小鼠空肠的绒毛长度增加了24.37%,隐窝深度降低了25.20%;布拉迪酵母组小鼠空肠的绒毛长度增加了20.72%,隐窝深度降低了20.58%。
[0102]
可见,植物乳杆菌ccfm1143可有效缓解腹泻小鼠空肠的病理损伤情况,且在隐窝深度降低方面的效果优于布拉迪酵母;而植物乳杆菌qhljzd13l6的缓解效果要差一些。
[0103]
实施例4:植物乳杆菌ccfm1143对腹泻小鼠血清中炎症因子水平的影响
[0104]
具体步骤如下:
[0105]
取balb/c小鼠40只,于饲养室温为22~24℃,湿度为40~60%,12h/12h昼夜交替,自由进食及饮水的条件下饲养1周后,随机分为5组,每组8只,5组分别为:对照组、造模组、灌胃布拉迪酵母菌液的布拉迪酵母组(cncmi-745组)、灌胃植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液的qhljzd13l6组、灌胃植物乳杆菌(lactobacillus plantarum)ccfm1143菌液的ccfm1143组。
[0106]
实验共3周:动物适应性饲养1周后开始实验。从造模前7天开始,一直持续到实验结束(不包括抗生素处理的那3天),对照组和造模组小鼠每只每天灌胃0.2ml含有130g/l脱脂乳、20g/l海藻糖和20g/l蔗糖的保护剂溶液,布拉迪酵母组每只每天灌胃0.2ml布拉迪酵
母菌液,qhljzd13l6组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液,ccfm1143组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)ccfm1143菌液;适应后的第2周为造模期,造模第1~3天,在小鼠饮用水中加入5g/l的链霉素,以消除balb/c小鼠肠道正常菌群,造模第4~7天,用不含抗生素的无菌水代替含有链霉素的水作为小鼠饮用水,并且,对小鼠禁食18h,18h后,给每组小鼠每只灌胃0.2ml浓度为1.2
×
10
11
cfu/ml的etec o78:k80悬液(通过将etec o78:k80菌体溶于浓度为8.5g/l的生理盐水而得),连续灌胃4天,1天2次,每次间隔2h。
[0107]
实验结束后,取血并处死小鼠,取小鼠血清,通过elisa试剂盒测定每组小鼠血清中ifn-γ、tnf-α、il-6和il-10的含量,检测结果见图7~10。
[0108]
如图7所示,造模组小鼠血清中ifn-γ的含量为251.11pg/ml,比对照组(174.46pg/ml)显著升高;相比于造模组小鼠,ccfm1143组小鼠血清中ifn-γ的含量显著降低,为造模组的67.26%;qhljzd13l6组小鼠为造模组的73.12%;布拉迪酵母组小鼠为造模组的70.75%。
[0109]
如图8所示,造模组小鼠血清中tnf-α的含量为316.84pg/ml,比对照组(186.35pg/ml)显著升高;相比于造模组小鼠,ccfm1143组小鼠血清中tnf-α的含量显著降低,为造模组的66.43%;qhljzd13l6组小鼠为造模组的69.90%;布拉迪酵母组小鼠为造模组的95.57%。
[0110]
如图9所示,造模组小鼠血清中il-6的含量为49.40pg/ml,比对照组(25.23pg/ml)显著升高;相比于造模组小鼠,ccfm1143组小鼠血清中il-6的含量显著降低,为造模组的54.15%;qhljzd13l6组小鼠为造模组52.02%;布拉迪酵母组小鼠为造模组的81.67%。
[0111]
如图10所示,造模组小鼠血清中il-10的含量为18.57pg/mg,比对照组(25.92pg/mg)显著降低;相比于造模组小鼠,ccfm1143组小鼠血清中il-10的含量显著升高,增加了55.64%;qhljzd13l6组小鼠增加了4.13%;布拉迪酵母组小鼠增加了33.24%。
[0112]
可见,植物乳杆菌ccfm1143可显著降低腹泻小鼠血清中的抑炎因子水平以及显著增加腹泻小鼠血清中的抗炎因子水平,且效果优于布拉迪酵母;而植物乳杆菌qhljzd13l6并无抗炎作用。
[0113]
实施例5:植物乳杆菌ccfm1143对腹泻小鼠血清中肠毒素st和水通道蛋白aqp3含量的影响
[0114]
具体步骤如下:
[0115]
取balb/c小鼠40只,于饲养室温为22~24℃,湿度为40~60%,12h/12h昼夜交替,自由进食及饮水的条件下饲养1周后,随机分为5组,每组8只,5组分别为:对照组、造模组、灌胃布拉迪酵母菌液的布拉迪酵母组(cncmi-745组)、灌胃植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液的qhljzd13l6组、灌胃植物乳杆菌(lactobacillus plantarum)ccfm1143菌液的ccfm1143组。
[0116]
实验共3周:动物适应性饲养1周后开始实验。从造模前7天开始,一直持续到实验结束(不包括抗生素处理的那3天),对照组和造模组小鼠每只每天灌胃0.2ml含有130g/l脱脂乳、20g/l海藻糖和20g/l蔗糖的保护剂溶液,布拉迪酵母组每只每天灌胃0.2ml布拉迪酵母菌液,qhljzd13l6组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液,ccfm1143组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)
ccfm1143菌液;适应后的第2周为造模期,造模第1~3天,在小鼠饮用水中加入5g/l的链霉素,以消除balb/c小鼠肠道正常菌群,造模第4~7天,用不含抗生素的无菌水代替含有链霉素的水作为小鼠饮用水,并且,对小鼠禁食18h,18h后,给每组小鼠每只灌胃0.2ml浓度为1.2
×
10
11
cfu/ml的etec o78:k80悬液(通过将etec o78:k80菌体溶于浓度为8.5g/l的生理盐水而得),连续灌胃4天,1天2次,每次间隔2h。
[0117]
实验结束后,取血并处死小鼠,取小鼠血清,通过elisa试剂盒测定每组小鼠血清中肠毒素st和水通道蛋白aqp3的含量,检测结果见图11~12。
[0118]
如图11所示,造模组小鼠血清中肠毒素st的含量为1168.14pg/ml,比对照组(976.00pg/ml)显著升高;相比于造模组小鼠,ccfm1143组小鼠血清中肠毒素st的含量显著降低,降低了13.02%;qhljzd13l6组小鼠血清中肠毒素st的含量降低了5.54%;布拉迪酵母组小鼠血清中肠毒素st的含量降低了16.15%。
[0119]
如图12所示,造模组小鼠血清中水通道蛋白aqp3的含量为141.37pg/ml,比对照组(193.23pg/ml)显著降低;相比于造模组小鼠,ccfm1143组小鼠血清中aqp3的含量显著升高,升高了22.27%;qhljzd13l6组小鼠血清中aqp3的含量升高了12.83%;布拉迪酵母组小鼠血清中aqp3的含量降低了0.53%。
[0120]
可见,植物乳杆菌ccfm1143可显著降低腹泻小鼠血清中肠毒素st的含量,并且,显著提高腹泻小鼠血清中水通道蛋白aqp3的含量,且效果优于布拉迪酵母;而植物乳杆菌qhljzd13l6并不明显。
[0121]
实施例6:植物乳杆菌ccfm1143对腹泻小鼠肠道菌群丰度的影响
[0122]
具体步骤如下:
[0123]
取balb/c小鼠40只,于饲养室温为22~24℃,湿度为40~60%,12h/12h昼夜交替,自由进食及饮水的条件下饲养1周后,随机分为5组,每组8只,5组分别为:对照组、造模组、灌胃布拉迪酵母菌液的布拉迪酵母组(cncmi-745组)、灌胃植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液的qhljzd13l6组、灌胃植物乳杆菌(lactobacillus plantarum)ccfm1143菌液的ccfm1143组。
[0124]
实验共3周:动物适应性饲养1周后开始实验。从造模前7天开始,一直持续到实验结束(不包括抗生素处理的那3天),对照组和造模组小鼠每只每天灌胃0.2ml含有130g/l脱脂乳、20g/l海藻糖和20g/l蔗糖的保护剂溶液,布拉迪酵母组每只每天灌胃0.2ml布拉迪酵母菌液,qhljzd13l6组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液,ccfm1143组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)ccfm1143菌液;适应后的第2周为造模期,造模第1~3天,在小鼠饮用水中加入5g/l的链霉素,以消除balb/c小鼠肠道正常菌群,造模第4~7天,用不含抗生素的无菌水代替含有链霉素的水作为小鼠饮用水,并且,对小鼠禁食18h,18h后,给每组小鼠每只灌胃0.2ml浓度为1.2
×
10
11
cfu/ml的etec o78:k80悬液(通过将etec o78:k80菌体溶于浓度为8.5g/l的生理盐水而得),连续灌胃4天,1天2次,每次间隔2h。
[0125]
实验结束后,收集小鼠粪便,通过fastdna spin kit(美国mp生物医药公司)提取粪便中的基因组dna,对提取得到的基因组dna的v3-v4区进行特异性pcr扩增,16s rdna测序,分析粪便菌群变化,分析结果见图13~17。
[0126]
由图13~17可知,与对照组小鼠相比,造模组小鼠肠道的变形杆菌和假单胞菌水
平升高(分别升高了177.46%和881.56%),odoribacter、bifidobacterium和allobaculum水平降低(分别降低了94.97%、95.89%和98.20%);与造模组小鼠相比,ccfm1143组小鼠肠道的变形杆菌和假单胞菌水平分别降低了2.20%和96.38%,odoribacter、bifidobacterium和allobaculum分别增加了14.24倍,28.70倍,70.40倍;qhljzd13l6组小鼠肠道的变形杆菌增加了1.92%和假单胞菌水平降低了93.47%,odoribacter、bifidobacterium和allobaculum分别增加了9.76倍,23.62倍和65.10倍;布拉迪酵母组小鼠肠道的变形杆菌增加了16.00%和假单胞菌水平下降了28.01%,odoribacter、bifidobacterium和allobaculum分别增加了0.63倍,0.11倍和6.67倍。
[0127]
可见,植物乳杆菌ccfm1143可有效提高腹泻小鼠肠道菌群丰度,且效果优于布拉迪酵母;而植物乳杆菌qhljzd13l6作用差一些。
[0128]
实施例7:植物乳杆菌ccfm1143对腹泻小鼠粪便中短链脂肪酸含量的影响
[0129]
具体步骤如下:
[0130]
取balb/c小鼠40只,于饲养室温为22~24℃,湿度为40~60%,12h/12h昼夜交替,自由进食及饮水的条件下饲养1周后,随机分为5组,每组8只,5组分别为:对照组、造模组、灌胃布拉迪酵母菌液的布拉迪酵母组(cncmi-745组)、灌胃植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液的qhljzd13l6组、灌胃植物乳杆菌(lactobacillus plantarum)ccfm1143菌液的ccfm1143组。
[0131]
实验共3周:动物适应性饲养1周后开始实验。从造模前7天开始,一直持续到实验结束(不包括抗生素处理的那3天),对照组和造模组小鼠每只每天灌胃0.2ml含有130g/l脱脂乳、20g/l海藻糖和20g/l蔗糖的保护剂溶液,布拉迪酵母组每只每天灌胃0.2ml布拉迪酵母菌液,qhljzd13l6组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)qhljzd13l6菌液,ccfm1143组每只每天灌胃0.2ml植物乳杆菌(lactobacillus plantarum)ccfm1143菌液;适应后的第2周为造模期,造模第1~3天,在小鼠饮用水中加入5g/l的链霉素,以消除balb/c小鼠肠道正常菌群,造模第4~7天,用不含抗生素的无菌水代替含有链霉素的水作为小鼠饮用水,并且,对小鼠禁食18h,18h后,给每组小鼠每只灌胃0.2ml浓度为1.2
×
10
11
cfu/ml的etec o78:k80悬液(通过将etec o78:k80菌体溶于浓度为8.5g/l的生理盐水而得),连续灌胃4天,1天2次,每次间隔2h。
[0132]
实验结束后,收集小鼠粪便置于液氮中,后转移至-80℃冰箱,在进行短链脂肪酸含量的检测前取出,进行真空冷冻干燥,准确称取0.05g冻干后的粪便样品溶解于0.5ml饱和氯化钠溶液中,浸泡30min,组织匀浆机匀浆,加入0.02ml浓度为10%的硫酸,震荡30s,在通风橱内向粪便溶液中准确加入1ml乙醚溶液,震荡30s后离心15min(8000g、4℃),移取上清液至含有0.25g无水硫酸钠的离心管中,震荡均匀,离心15min(8000g、4℃),取上清至气质容量瓶中,通过gcms检测短链脂肪酸含量,检测结果见图18~21。
[0133]
如图18~21所示,造模组小鼠粪便中丁酸、乙酸的含量分别下降到对照组小鼠的94.92%和70.29%,丙酸、异丁酸的含量分别升高到对照组小鼠的1.25倍和1.03倍,其中,乙酸含量的下降最为显著;ccfm1143组小鼠粪便中丙酸、丁酸、乙酸、异丁酸的含量与造模组相比显著上调,分别是造模组的1.82倍、1.78倍、1.45倍和1.82倍;qhljzd13l6组小鼠粪便中丙酸、丁酸、乙酸、异丁酸的含量分别是造模组的0.74倍,1.37倍,0.82倍,0.96倍;布拉迪酵母组小鼠粪便中丙酸、丁酸、乙酸、异丁酸的含量分别是造模组的1.02倍,1.22倍,2.68
倍,1.21倍。
[0134]
可见,植物乳杆菌ccfm1143可显著提高腹泻小鼠粪便中短链脂肪酸的含量,且效果优于布拉迪酵母和植物乳杆菌qhljzd13l6。
[0135]
实施例8:植物乳杆菌ccfm1143对etec o78:k80的肠毒素基因表达的影响
[0136]
将培养16h的etec o78:k80和培养18h的植物乳杆菌ccfm1143共培养4h后,15000
×
g10min收集菌体,用bead-beater(powerlzyer
tm
24,mo bio laboratories,inc.,carlsbad,ca)破壁,3000rpm(1.5min)两次,2500rpm(1.5min)两次,每两次之间间隔,在冰上孵育2min,并按照ribopure
tm
rna purification kit,bacteria(ambion,tx)试剂盒的步骤提取总rna。提取的总rna用superscript first-strand synthesis system(invitrogen,carlsbad,ca)试剂盒进行反转录。大肠杆菌etec中的gapa基因被作为管家基因计算毒素基因esta、estb、elt的表达。实时荧光定量pcr用applied biosystems 7500real-time pcr system stratagene,每次退火后读取荧光信号。基因esta、estb、elt的表达见图22~24。
[0137]
qpcr引物信息如下:
[0138]
表2 qpcr引物信息
[0139][0140][0141]
qpcr反应体系:12.5μl master mix sybr green荧光染料;3.75μl 150nm上游引物;3.75μl 150nm下游引物;1μl cdna;4μl双蒸水补。
[0142]
肠毒素基因qpcr反应程序:95℃ 10min;95℃ 30s,56℃ 1min,72℃ 1min(40个循环)。
[0143]
如图22~24所示,造模组小鼠的肠毒素基因esta、estb、elt的相对含量分别为对照组的5.33倍、3.27倍、13.72倍。与造模组相比,布拉迪酵母组的肠毒素基因esta、estb、elt的相对含量显著下降,分别下降了28.08%,30.48%、10.94%,具有显著性差异(p<0.05)。而植物乳杆菌ccfm1143的肠毒素基因esta、estb、elt的相对含量显著下降了83.83%、72.31%、77.1%(p<0.001)。植物乳杆菌qhljzd13l6对于肠毒素基因esta、estb、elt的变化并不显著。
[0144]
可见,植物乳杆菌ccfm1143的可显著降低肠毒素基因esta、estb、elt的相对含量,且效果优于布拉迪酵母,植物乳杆菌qhljzd13l6则无此作用。
[0145]
实施例9:植物乳杆菌ccfm1143的应用
[0146]
植物乳杆菌ccfm1143可用于制备片剂,片剂的具体制备过程如下:
[0147]
挑取实施例1获得的植物乳杆菌(lactobacillus plantarum)ccfm1143的单菌落接入mrs液体培养基中,于37℃培养16h,得到菌浓数量级达1
×
10
7
cfu/ml的活化液;将活化液按照1%(v/v)的接种量接入mrs液体培养基中,于37℃培养16h,得到一级种子液;将一级种子液按照1%(v/v)的接种量接入mrs液体培养基中,于37℃培养16h,得到二级种子液;将二级种子液按照1%(v/v)的接种量接入mrs液体培养基中,于37℃培养16h,得到菌液;将菌液6000g离心15min,收集沉淀;将沉淀用ph为7.4的pbs缓冲液洗涤两次后,6000g再次离心10min,得到菌体;用含有130g/l脱脂乳、20g/l海藻糖和20g/l蔗糖的保护剂溶液将植物乳杆菌菌体重悬至细胞浓度为1
×
10
10
cfu/ml,得到植物乳杆菌菌液;将植物乳杆菌菌液冷冻干燥,得到植物乳杆菌菌粉;在植物乳杆菌菌粉中加入占植物乳杆菌菌菌粉总重计2%的硬脂酸作润滑剂、3%的cmc-na作粘合剂后进行压片,得到片剂。
[0148]
取上述方法制备的片剂以1g/只的剂量每天灌胃etec致腹泻小鼠,连续两周,可有效缓解小鼠腹泻的症状,在预防和/或治疗腹泻上有极好的效果。
[0149]
实施例10:植物乳杆菌ccfm1143的应用
[0150]
植物乳杆菌ccfm1143可用于制备菌粉,菌粉的具体制备过程如下:
[0151]
挑取实施例1获得的植物乳杆菌(lactobacillus plantarum)ccfm1143的单菌落接入mrs液体培养基中,于37℃培养16h,得到菌浓数量级达1
×
10
7
cfu/ml的活化液;将活化液按照1%(v/v)的接种量接入mrs液体培养基中,于37℃培养16h,得到一级种子液;将一级种子液按照1%(v/v)的接种量接入mrs液体培养基中,于37℃培养16h,得到二级种子液;将二级种子液按照1%(v/v)的接种量接入mrs液体培养基中,于37℃培养16h,得到菌液;将菌液6000g离心15min,收集沉淀;将沉淀用ph为7.4的pbs缓冲液洗涤两次后,6000g再次离心10min,得到菌体;用含有130g/l脱脂乳、20g/l海藻糖和20g/l蔗糖的保护剂溶液将植物乳杆菌菌体重悬至细胞浓度为1
×
10
10
cfu/ml,得到植物乳杆菌菌液;将植物乳杆菌菌液冷冻干燥,得到菌粉。
[0152]
取上述方法制备菌粉以1g/只的剂量每天灌胃etec致腹泻小鼠,连续两周,可有效缓解小鼠腹泻的症状,在预防和/或治疗腹泻上有极好的效果。
[0153]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1