一种三组分制备α,α-双取代异色满衍生物的方法与流程
一种三组分制备
α
,
α-双取代异色满衍生物的方法
技术领域
[0001]
本发明涉及一种异色满衍生物的制备方法,具体涉及一种三组分制备α,α-双取代异色满衍生物的方法。
背景技术:
[0002]
异色满骨架存在于许多天然产物和合成药物中,具有广泛的生物活性,特别是在α位有两个取代基的结构单元已经证明具有抗氧化,抗癌,抗菌,抗真菌,抗病毒和抗抑郁活性。硝基是活性的天然产物和药物的重要合成子,在异色满α位引入硝基并将其转化氨基的化合物,具有抗炎、镇痛、降血压和抗肿瘤药性的作用。
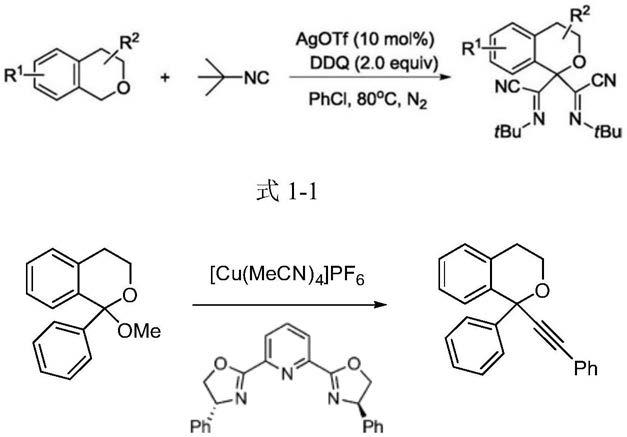
[0003]
目前,在异色满骨架的α位引入两个取代基的方法非常有限,常用的途径有两种:一种是α-单取代异色满在强氧化剂ddq作用下与亲核性基团反应制得双α-氰基亚胺取代异色满类化合物(cn 107082771 a;chinese chemical letters 2019,30:1241
–
1243),如式1-1;另一种是异色满α位内酯化合物在强碱性的金属有机试剂烷基锂亲核作用下与炔化合物的反应转化,(angew.chem.int.ed.2015,54:14154
–
14158),如式1-2所示。然而,现有的方法所用原料合成步骤长,同时需要使用强氧化剂和对水敏感的金属有机试剂,操作复杂,原子经济性差。
[0004][0005]
技术实现要素:
[0006]
为克服现有技术中的问题,本发明的目的在于提供一种三组分制备α,α-双取代异色满衍生物的方法。
[0007]
为实现上述目的,本发明所采用的技术方案是:
[0008]
一种三组分制备α,α-双取代异色满衍生物的方法,将β-苯乙醇类化合物、醛、硝基烷烃混合均匀,然后加入酸催化剂,加热下反应,得到α,α-双取代异色满衍生物;
该取代异色满衍生物的结构式如下:
[0009][0010]
其中,a代表h、c1~c6的烷基、苯基、萘基、对甲苯基、邻甲苯基、间甲苯基、对叔丁基苯基、对氯苯基、对溴苯基、对氟苯基、对硝基苯基、对甲氧基苯基、对三氟甲基苯基、间氯苯基、间硝基苯基、苯乙烯基、对甲苯乙烯基、对氯苯乙烯基与对硝基苯乙烯基中的任意一种;b、c代表h与och3中的任意一种;r代表h与c1~c6的烷基中的任意一种。
[0011]
本发明进一步的改进在于,β-苯乙醇类化合物结构式如下:
[0012][0013]
其中,b、c代表h与och3中的任意一种。
[0014]
本发明进一步的改进在于,醛结构式如下:a-cho,其中,a代表h、c1~c6的烷基、苯基、萘基、对甲苯基、邻甲苯基、间甲苯基、对叔丁基苯基、对氯苯基、对溴苯基、对氟苯基、对硝基苯基、对甲氧基苯基、对三氟甲基苯基、间氯苯基、间硝基苯基、苯乙烯基、对甲苯乙烯基、对氯苯乙烯基、对硝基苯乙烯基中的任意一种。
[0015]
本发明进一步的改进在于,硝基烷烃结构式如下:rch2no2;其中,r代表h与c1~c6的烷基中的任意一种。
[0016]
本发明进一步的改进在于,酸催化剂为c1~c8烷基磺酸、全氟代烷基磺酸、芳基磺酸、樟脑磺酸、方酸和高氯酸中的任意一种。
[0017]
本发明进一步的改进在于,β-苯乙醇类化合物、醛与硝基烷烃的摩尔比为1:(1~2):(1~ 10)。
[0018]
本发明进一步的改进在于,β-苯乙醇类化合物、醛与硝基烷烃的摩尔比为摩尔比为1:2:10。
[0019]
本发明进一步的改进在于,酸催化剂的加入量是β-苯乙醇类化合物的摩尔量的 0.5~2.0倍。
[0020]
本发明进一步的改进在于,反应的温度为40℃~120℃,时间为2~48h。
[0021]
与现有技术相比,本发明具有的有益效果:本发明在无溶剂条件下将β-苯乙醇类化合物、醛与硝基烷烃直接混合,得到高产率的α,α-双取代异色满衍生物。反应的过程中β-苯乙醇类化合物、醛在酸催化下生成了中间体α-单取代异色满衍生物,该中间体在酸作用下脱氢生成异色满碳鎓离子化合物,进一步与亲核性的硝基化合物作用生成产物。本发明所用的方法与专利cn201910780001.5相比,无需分离中间体,三组分一锅煮反应,步骤短,操作简单。本发明制备得到的α,α-双取代异色满衍生物可作为药物、活性的天然产物、有机合成的重要结构单元,在药物、活性的天然产物的制备中具有很大的应用潜力。
具体实施方式
[0022]
下面结合实施例对本发明进一步详细说明,但本发明所要保护的范围不限于这些
实施例。
[0023]
本发明的一种三组分制备α,α-双取代异色满衍生物的方法的反应式如下所示:
[0024][0025]
a代表h、c1~c6的烷基、苯基、萘基、对甲苯基、邻甲苯基、间甲苯基、对叔丁基苯基、对氯苯基、对溴苯基、对氟苯基、对硝基苯基、对甲氧基苯基、对三氟甲基苯基、间氯苯基、间硝基苯基、苯乙烯基、对甲苯乙烯基、对氯苯乙烯基、对硝基苯乙烯基中的任意一种;b、c代表h、och3中的任意一种;r代表h、c1~c6的烷基中的任意一种。
[0026]
将β-苯乙醇类化合物、醛、硝基烷烃混合均匀,然后加入酸催化剂,在40℃~ 120℃下反应2~48h,得到取代异色满衍生物;
[0027]
其中,所述的酸催化剂为c1~c8烷基磺酸、全氟代烷基磺酸、芳基磺酸、樟脑磺酸、方酸和高氯酸中的任意一种;
[0028]
所述的β-苯乙醇类化合物、醛与硝基烷烃摩尔比为1:(1~2):(1~10),优选的摩尔比是1:2:10;
[0029]
所述的酸催化剂用量为β-苯乙醇类化合物的摩尔量的0.5~2.0倍。
[0030]
下面为具体实施例。
[0031]
实施例1
[0032]
以制备下式化合物1-硝基甲基-6,7-二甲氧基-1-苯基异苯并二氢吡喃为例,所用原料及其制备方法如下:
[0033][0034]
将109mg(0.6mmol)2-(3,4-二甲氧基苯基)乙醇、122ul(1.2mmol)苯甲醛和321ul (6mmol)硝基甲烷置于反应瓶中,搅拌均匀,加入甲烷磺酸58mg(0.6mmol),在120℃反应2小时,待反应结束,冷却至室温,加入2ml饱和碳酸氢钠水溶液,用10ml二氯甲烷萃取三次,合并有机相,用无水硫酸钠干燥,抽滤,浓缩,粗产物进行柱层析分离(乙酸乙酯和正己烷),得到白色固体产物,其产率为81%。所得产物用bruker avance型超导傅立叶数字化核磁共振谱仪进行表征,表征数据如下:1h nmr(600mhz,cdcl3)δ7.40
–
7.39(m, 2h),7.36
–
7.32(m,3h),6.64(s,1h),6.58(s,1h),5.06(d,j=12.1hz,1h),4.89(d,j=12.1hz, 1h),3.88(ddd,j=11.6,6.1,2.0hz,1h),3.81(s,3h),3.79(s,3h),3.52(td,j=11.4,3.7hz,1h), 3.05
–
2.89(m,1h),2.52
–
2.33(m,1h);
13
c nmr(151mhz,cdcl3)δ147.77,145.93,140.08, 127.64,127.56,126.86,126.54,123.46,110.88,109.78,81.96,78.86,59.48,55.30,54.80,26.96. hrms(esi)m/z:c
18
h
19
nnao5[m+na]
+
理论值352.1161,实测值352.1156.
[0035]
实施例2
[0036]
以制备下式化合物1-硝基甲基-6,7-二甲氧基-1-苯基异苯并二氢吡喃为例,所用
原料及其制备方法如下:
[0037][0038]
在实施例2中,将实施例1中所用的甲烷磺酸用高氯酸替换,高氯酸用量为2-(3,4
-ꢀ
二甲氧基苯基)乙醇摩尔量的0.5倍,反应温度替换40℃,反应时间替换12小时,其它步骤与实施例1相同,制备成白色固体产物,其产率为52%,所得产物用bruker avance型超导傅立叶数字化核磁共振谱仪进行表征,表征数据为:1h nmr(600mhz,cdcl3)δ7.40
–
7.39(m, 2h),7.36
–
7.32(m,3h),6.64(s,1h),6.58(s,1h),5.06(d,j=12.1hz,1h),4.89(d,j=12.1hz, 1h),3.88(ddd,j=11.6,6.1,2.0hz,1h),3.81(s,3h),3.79(s,3h),3.52(td,j=11.4,3.7hz,1h), 3.05
–
2.89(m,1h),2.52
–
2.33(m,1h);
13
c nmr(151mhz,cdcl3)δ147.77,145.93,140.08, 127.64,127.56,126.86,126.54,123.46,110.88,109.78,81.96,78.86,59.48,55.30,54.80,26.96. hrms(esi)m/z:c
18
h
19
nnao5[m+na]
+
理论值352.1161,实测值352.1156.
[0039]
实施例3
[0040]
以制备下式化合物1-硝基甲基-6,7-二甲氧基-1-苯基异苯并二氢吡喃为例,所用原料及其制备方法如下:
[0041][0042]
在实施例3中,将实施例1中所用的甲烷磺酸用方酸替换,方酸用量为2-(3,4-二甲氧基苯基)乙醇摩尔量的2倍,反应温度替换100℃,反应时间替换48小时,其它步骤与实施例1相同,制备成白色固体产物,其产率为79%,所得产物用bruker avance型超导傅立叶数字化核磁共振谱仪进行表征,表征数据为:1h nmr(600mhz,cdcl3)δ7.40
–
7.39(m,2h), 7.36
–
7.32(m,3h),6.64(s,1h),6.58(s,1h),5.06(d,j=12.1hz,1h),4.89(d,j=12.1hz,1h), 3.88(ddd,j=11.6,6.1,2.0hz,1h),3.81(s,3h),3.79(s,3h),3.52(td,j=11.4,3.7hz,1h),3.05
ꢀ–
2.89(m,1h),2.52
–
2.33(m,1h);
13
c nmr(151mhz,cdcl3)δ147.77,145.93,140.08,127.64, 127.56,126.86,126.54,123.46,110.88,109.78,81.96,78.86,59.48,55.30,54.80,26.96.hrms (esi)m/z:c
18
h
19
nnao5[m+na]
+
理论值352.1161,实测值352.1156.
[0043]
实施例4
[0044]
以制备下式化合物1-硝基甲基-6,7-二甲氧基-1-苯基异苯并二氢吡喃为例,所用原料及其制备方法如下:
[0045][0046]
在实施例4中,将实施例1中所用的甲烷磺酸用等摩尔的三氟甲烷磺酸替换,其它步骤与实施例1相同,制备成白色固体产物,其产率为68%,所得产物用bruker avance型超导傅立叶数字化核磁共振谱仪进行表征,表征数据为:1h nmr(600mhz,cdcl3)δ7.40
–
7.39(m, 2h),7.36
–
7.32(m,3h),6.64(s,1h),6.58(s,1h),5.06(d,j=12.1hz,1h),4.89(d,j=12.1hz, 1h),3.88(ddd,j=11.6,6.1,2.0hz,1h),3.81(s,3h),3.79(s,3h),3.52(td,j=11.4,3.7hz,1h), 3.05
–
2.89(m,1h),2.52
–
2.33(m,1h);
13
c nmr(151mhz,cdcl3)δ147.77,145.93,140.08, 127.64,127.56,126.86,126.54,123.46,110.88,109.78,81.96,78.86,59.48,55.30,54.80,26.96. hrms(esi)m/z:c
18
h
19
nnao5[m+na]
+
理论值352.1161,实测值352.1156.
[0047]
实施例5
[0048]
以制备下式化合物1-硝基甲基-6,7-二甲氧基-1-对氯苯基异苯并二氢吡喃为例,所用原料及其制备方法如下:
[0049][0050]
在实施例5中,将实施例1中所用的苯甲醛用等摩尔的对氯苯甲醛替换,其它步骤与实施例1相同,制备成淡黄色固体,其产率为80%,表征数据为:1h nmr(600mhz,cdcl3)δ 7.30
–
7.24(m,4h),6.59(s,2h),5.02(d,j=12.0hz,1h),4.88(d,j=12.0hz,1h),3.96
–
3.86 (m,1h),3.83(s,3h),3.80(s,3h),3.52(d,j=3.6hz,1h),3.01
–
2.93(m,1h),2.49
–
2.38(m, 1h);
13
c nmr(151mhz,cdcl3)δ147.96,146.11,138.65,133.77,127.99,127.74,126.80, 123.10,110.98,109.49,81.69,78.39,59.57,55.34,54.83,26.90.hrms(esi)m/z: c
18
h
18
clnnao5[m+na]
+
理论值386.0771,实测值386.0776.
[0051]
实施例6
[0052]
以制备下式化合物1-硝基甲基-6,7-二甲氧基-1-对甲苯基异苯并二氢吡喃为例,所用原料及其制备方法如下:
[0053]
nmr(151mhz,cdcl3) δ149.11,147.27,145.21,127.99,127.98,127.79,125.60,125.62,123.90,112.08,110.44,82.47, 79.45,60.86,56.38,55.88,27.91.hrms(esi)m/z:c
19
h
18
f3nnao5[m+na]
+
理论值420.1035,实测值420.1031.
[0063]
实施例9
[0064]
以制备下式化合物1-硝基甲基-6,7-二甲氧基-1-异丁基异苯并二氢吡喃为例,所用原料及其制备方法如下:
[0065][0066]
在实施例9中,所用的苯甲醛用等摩尔的异戊醛替换,其它步骤与实施例1相同,制备成白色固体,其产率为70%,表征数据为:1h nmr(600mhz,cdcl3)δ6.65(s,1h),6.58(s,1h), 4.92(d,j=12.1hz,1h),4.68(d,j=12.1hz,1h),3.85-3.88(m,1h),3.79(s,3h),3.76(s,3h), 3.48-3.55(m,1h),2.92-3.05(m,1h),2.42-2.35(m,1h),1.62-1.65(m,1h),1.78-1.85(m,2h), 0.90-0.93(m,6h);
13
c nmr(151mhz,cdcl3)δ146.11,145.90,127.99,127.51,111.48,108.41, 80.37,76.92,60.05,56.21,55.80,47.20,29.2,23.91,22.60.hrms(esi)m/z:c
16
h
23
nnao
5 [m+na]
+
理论值332.1474,实测值332.1466.
[0067]
实施例10
[0068]
以制备下式化合物1-硝基甲基-6,7-二甲氧基-1-异戊基异苯并二氢吡喃为例,所用原料及其制备方法如下:
[0069][0070]
在实施例10中,将实施例1中所用的苯甲醛用等摩尔的环己基甲醛替换,其它步骤与实施例1相同,制备成白色固体,其产率为72%,表征数据为:1h nmr(600mhz,cdcl3)δ6.66 (s,1h),6.59(s,1h),4.93(d,j=12.1hz,1h),4.69(d,j=12.1hz,1h),3.85-3.88(m,1h),3.79(s, 3h),3.76(s,3h),3.48-3.55(m,1h),2.92-3.05(m,1h),2.42-2.35(m,1h),1.99(m,1h),1.83(d,j =11.9hz,4h),1.72(d,j=12.4hz,1h),1.50
–
1.22(m,5h);
13
c nmr(151mhz,cdcl3)δ 146.11,145.90,127.99,127.52,111.48,108.41,81.41,77.93,60.08,56.21,55.80,40.8,29.2,28.7, 25.9,25.8.hrms(esi)m/z:c
18
h
25
nnao5[m+na]
+
理论值358.1630,实测值358.1625.
[0071]
实施例11
[0072]
以制备下式化合物1-硝基甲基-1-苯基异苯并二氢吡喃为例,所用原料及其制备方法如下:
[0073][0074]
在实施例11中,将实施例1中所用的2-(3,4-二甲氧基苯基)乙醇用等摩尔的β-苯乙醇替换,其它步骤与实施例1相同,制备成黄色固体,其产率为78%,表征数据为:1h nmr (600mhz,cdcl3)δ7.40
–
7.39(m,2h),7.36
–
7.26(m,7h),5.06(d,j=12.1hz,1h),4.88(d,j =12.1hz,1h),4.05(ddd,j=11.6,6.0,1.8hz,1h),3.69(td,j=11.4,3.7hz,1h),3.10
–
3.04 (m,1h),2.69
–
2.56(m,1h);
13
c nmr(151mhz,cdcl3)δ140.1,139.8,132.4,128.4,127.6, 127.5,126.9,126.5,125.7,122.8,81.9,78.9,60.8,28.7.hrms(esi)m/z:c
16
h
15
nnao3[m+na]
+
理论值292.0950,实测值292.0939.
[0075]
实施例12
[0076]
以制备下式化合物1-硝基甲基-6,7-二甲氧基-1-对三氟甲基苯基异苯并二氢吡喃为例,所用原料及其制备方法如下:
[0077][0078]
在实施例12中,将实施例1中所用的2-(3,4-二甲氧基苯基)乙醇用等摩尔的β-苯乙醇替换,将苯甲醛用等摩尔的对三氟甲基苯甲醛替换,其它步骤与实施例1相同,制备成黄色固体,其产率为76%,表征数据为:1h nmr(600mhz,cdcl3)δ7.63(d,j=8.4hz,2h),7.58 (d,j=8.4hz,2h),7.36
–
7.26(m,4h),5.13(d,j=12.1hz,1h),4.98(d,j=12.1hz,1h),4.00 (ddd,j=11.4,5.8,2.6hz,1h),3.61(td,j=11.1,3.8hz,1h),3.07.011.3(m,1h),2.58
–
2.54(m, 1h);
13
c nmr(151mhz,cdcl3)δ145.1,139.8,138.4,132.4,128.4,128.0,126.9,125.7,125.6, 125.6,122.8,82.5,79.5,60.8,29.7,27.9.hrms(esi)m/z:c
17
h
14 f3nnao3[m+na]
+
理论值360.0823,实测值360.0811。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1