Seroin蛋白的截短体及其应用的制作方法
seroin蛋白的截短体及其应用
技术领域
[0001]
本发明涉及生物技术领域,具体涉及seroin蛋白的截短体,还涉及该蛋白截短体的应用。
背景技术:
[0002]
家蚕(bombyx mori)是鳞翅目昆虫的典型代表,起源于中国,由原始的野桑蚕(bombyx mandarina)经人为驯化而来,具有重要的农业和经济意义(sutherland et al.,2010)。作为一种完全变态昆虫,家蚕在变态成蛹的过程中不进食也不运动,仅以茧包裹自身来抵御外界危害。构成蚕茧的蚕丝是一种外部纺成的纤维蛋白分泌物。蚕丝主要由丝素蛋白(fibroin)和丝胶蛋白(sericin)构成(向仲怀,2005)。通过质谱等分子生物学研究技术对蚕丝的组分进行研究分析,发现蚕丝中除丝素和丝胶外,还有许多低分子量蛋白质,主要包括各种蛋白酶抑制剂和seroin蛋白(zhang et al.,2015,dong et al.,2013)。seroin蛋白是鳞翅目泌丝昆虫所特有的一类蛋白,1998年,zurovec等人在大蜡螟(galleria mellorella)的丝中发现一种由中部丝腺和后部丝腺共同分泌合成的小分子丝蛋白seroin(zurovec et al.,2013)。2001年在家蚕中也鉴定到了两种seroin蛋白,同样由中部丝腺和后部丝腺共同分泌,并将其命名为seroin1和seroin2,并通过后续研究发现,家蚕的seorin蛋白在细菌诱导后的蚕体中上调表达,进一步研究发现seroin蛋白对细菌具有较强的抑制活性,其中seroin1对革兰氏阳性细菌藤黄微球菌的抑制活性较强,而seroin2对革兰氏阴性细菌大肠杆菌和革兰氏阳性细菌藤黄微球菌的抑制活性都很强(nirmala et al.,2001,singh et al.,2014)。近年来,通过搜索ncbi蛋白质序列库,表达序列标签(est)库和转录组数据库,研究人员在分属于13个鳞翅目家族的32个物种中,共鉴定到了64个seroin蛋白。其中,在家蚕中鉴定到了除seroin1和seroin2外的另一个seroin蛋白,将其命名为seroin3,三个seroin蛋白的分子量都在10kda左右。通过比较不同seroin的序列,发现seroin蛋白的c端序列较为保守,而n端序列富含脯氨酸(dong et al.,2016)。
[0003]
seroin蛋白具有的抗菌活性使其能够作为一种天然防腐剂、抗菌剂,在农业、食品、医药、美容化妆品等多个领域都具有潜在的应用价值。解决大量合成制备seroin蛋白的方法是实现seroin蛋白应用的首要前提。目前人工制备蛋白质主要有两种方法:基因工程合成法和化学合成法。此前对于seroin蛋白主要通过原核表达的方式,即基因工程合成法,获得重组蛋白(singh et al.,2014)。原核表达需要使用大肠杆菌(escherichia coli)等细菌作为表达菌株,而seroin作为一类抑菌活性较强的蛋白,通过原核表达的方式来获得其重组蛋白存在一个无法避免的问题:seroin蛋白对宿主具有毒性或生长抑制性。这一问题可能导致菌株生长缓慢甚至无法表达,或仅能表达折叠不完全、功能受限的重组蛋白。因此,通过原核表达来获得seroin蛋白的方式具有很大的不确定性,无法保证生产效率、产物的产量和产物的活性。化学合成法目前主要用于合成小于10kda的小分子蛋白,但是对于10kda以上的蛋白,合成成本高,且合成难度大,因此研究具有生物学活性的seroin截短片段对开发seroin抗菌产品具有重要意义。
技术实现要素:
[0004]
有鉴于此,本发明的目的之一在于提供一种seroin蛋白的截短体;本发明的目的之二在于提供所述seroin蛋白的截短体在制备抗菌剂中的应用。
[0005]
为达到上述目的,本发明提供如下技术方案:
[0006]
1、seroin蛋白的截短体,所述seroin蛋白的截短体为seroin1、seroin2或seroin3的n端或c端片段;
[0007]
seroin1的n端氨基酸序列如seq id no.7所示,seroin1的c端氨基酸序列seq id no.8所示;
[0008]
seroin2的n端氨基酸序列如seq id no.9所示,seroin1的c端氨基酸序列seq id no.10所示;
[0009]
seroin3的n端氨基酸序列如seq id no.11所示,seroin1的c端氨基酸序列seq id no.12所示。
[0010]
优选的,所述seroin蛋白的截短体为seroin2的n端或c端片段,seroin2的n端氨基酸序列如seq id no.9所示,seroin2的c端氨基酸序列seq id no.10所示。
[0011]
2、所述seroin蛋白的截短体在制备抗菌剂中的应用。
[0012]
优选的,所述抗菌剂为抗革兰氏阴性菌或/和抗革兰氏阳性菌。
[0013]
优选的,所述革兰氏阴性菌为大肠杆菌;所述抗革兰氏阳性菌为金黄色葡萄球菌。
[0014]
本发明的有益效果在于:本发明公开了seroin蛋白的截短体,seroin蛋白截短体来源于三种seroin蛋白的分子量为3.7kda—4.8kda的n端多肽和分子量为5.5kda—6.2kda的c端多肽,研究发现截短后的多肽具有抗菌活性,特别是三种seroin蛋白截短后3.7kda—4.8kda的n端多肽具有与其全长蛋白序列几乎一样高的抗菌活性,由于截短片段大大缩短了蛋白质的分子量,从而降低了通过化学法合成多肽的成本与难度。与此前完整蛋白的生产技术,本发明具有生产成本低、活性高、稳定性强、简便快捷等明显优点。
附图说明
[0015]
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
[0016]
图1为家蚕seroin蛋白的序列比对;
[0017]
图2为大肠杆菌与seroin1全长及截短肽段孵育后的相对增长率;
[0018]
图3为金黄色葡萄球菌与seroin1全长及截短肽段孵育后的相对增长率;
[0019]
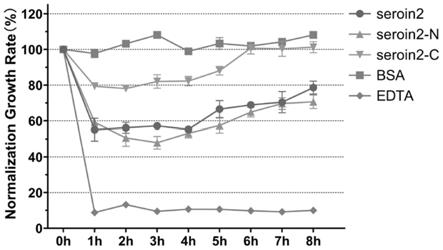
图4为大肠杆菌与seroin2全长及截短肽段孵育后的相对增长率;
[0020]
图5为金黄色葡萄球菌与seroin2全长及截短肽段孵育后的相对增长率;
[0021]
图6为大肠杆菌与seroin3全长及截短肽段孵育后的相对增长率;
[0022]
图7为金黄色葡萄球菌与seroin2全长及截短肽段孵育后的相对增长率。
具体实施方式
[0023]
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
[0024]
实施例1、seroin蛋白生物信息学分析
[0025]
基于ncbi数据库(https://www.ncbi.nlm.nih.gov/)下载的seroin1(基因编号gi|19070653)、seroin2(基因编号gi|19070655)和seroin3(基因编号gi|512931752)的核苷酸和氨基酸序列,seroin1、seroin2和seroin3的氨基酸分别如seq id no.1、seq id no.2和seq id no.3所示;seroin1、seroin2和seroin3的核苷酸序列如seq id no.4、seq id no.5和seq id no.6所示。然后利用以下在线软件及生物学软件进行序列的分析:
[0026]
蛋白质的信号肽预测:signalp(http://www.cbs.dtu.dk/services/signalp/);
[0027]
蛋白质的分子量和等电点预测:expasy(http://www.expasy.org/tools/);
[0028]
同源比对软件:clustal x和genedoc;
[0029]
氨基酸序列长度、信号肽、分子量和等电点的分析结果如表1所示。
[0030]
表1、家蚕seroin蛋白的序列特征分析
[0031][0032][0033]
序列比对信息如图1所示。
[0034]
实施例2、seroin蛋白截短合成
[0035]
基于此前研究结果,将3种家蚕seroin蛋白去除信号肽序列后划分为n端与c端两部分,所得序列如表2所示(dong et al.,2016)。利用化学合成方式获得seroin蛋白全长与截短肽段,并分别命名为seroin1-n、seroin1-c、seroin2-n、seroin2-c、seroin3-n和seroin3-c,相关信息已在表1中说明。
[0036]
表2、家蚕seroin蛋白的截短体氨基酸序列
[0037][0038]
实施例3、seroin蛋白截短肽段的抑菌活性验证
[0039]
为评价不同seroin蛋白肽段的抑菌活性,本实验选取两种细菌:大肠杆菌(革兰氏阴性菌,g-)和金黄色葡萄球菌(staphylococcus aureus,革兰氏阳性菌,g+)分别与各seroin蛋白肽段进行孵育,用分光光度法检测细菌的生长曲线,并计算其相对于对照组的细菌增长率。具体方法如下:
[0040]
1)使用无菌磷酸缓冲液(pbs),溶解足量的seroin蛋白肽段至蛋白浓度为1mg/ml;
[0041]
2)使用lb液体培养基,将细菌培养至od
600
=0.2-0.3;
[0042]
3)取50μl蛋白溶液和150μl菌液,分别加入至96孔板每孔中,充分混匀,并以未添加蛋白的无菌pbs溶液组作为空白对照、以添加蛋白等量牛血清蛋白(bsa)溶液组作为阴性对照、以添加蛋白等量乙二胺四乙酸(edta)溶液组作为阳性对照;
[0043]
4)将96孔板置于37℃,60rpm环境下孵育8小时,并利用紫外分光光度计,每隔1小时测量一次每孔od
600
的吸光度并记录;
[0044]
5)将记录所得数据根据公式计算其基于空白对照组的相对增长率,公式如下:
[0045][0046]
6)根据处理后的数据绘制各组相对增长率曲线,结果如图2-7所示。
[0047]
实验结果表明,seroin蛋白的全长及截短肽段对大肠杆菌和金黄色葡萄球菌两种细菌均具有一定的抑制性,尤其是金黄色葡萄球菌(g+),且全长的抑制效果最好,n端的截短肽段具有与全长相似的抑制效果,而c端的截短肽段的抑菌效果较差。具体结果为,seroin1蛋白的全长及截短肽段对大肠杆菌(g-),具有约15%的抑制活性;对于金黄色葡萄球菌(g+),seroin1蛋白的全长及截短肽段具有约35%的抑制活性,seroin1全长及截短肽段的抑菌效果可持续约1小时,如图2-3。seroin2蛋白的全长及seroin2-n对大肠杆菌(g-),具有约40-45%的抑制活性,而seroin2-c仅具有20%的抑制性;对于金黄色葡萄球菌(g+),seroin2蛋白的全长及seroin-n段具有约60%的抑制活性,而seroin2-c的抑制性仅有25%,seroin2的全长及截短肽段的抑菌效果可持续约3小时,如图4-5。seroin3蛋白的全长及seroin3-n和seroin3-c对大肠杆菌(g-),分别具有25%、20%和15%的抑制活性;对于金黄色葡萄球菌(g+),seroin3蛋白的全长及seroin3-n和seroin3-c对具有约40%、30%和20%的抑制活性;seroin3全长及截短肽段的抑菌效果可持续约4小时,如图6-7。
[0048]
综合来说,本发明通过多肽合成的方式,获得了3种seroin蛋白的全长及n端和c端的截短肽段,并在体外验证了肽段的抑菌活性。抑菌实验的结果表明,seroin蛋白对革兰氏阳性菌具有更好的抑制活性,并且n端的截短肽段能在体外达到与全长相似的抑制效果,而相对保守c端的抑制活性较差。3种seroin蛋白的全长及截短肽段的抑菌活性比较表明,seroin2具有最好的抑菌效果,seroin3次之,seroin1的抑菌效果最差。且在全长及截短肽段的抑菌效果持续性上,seroin2和seroin3同样比seroin1要好。相比于此前报道的通过原核表达技术获取seroin蛋白的方式,本发明完善了其稳定性差、效率低下、实验周期长等缺陷。并在不影响抑菌效果的前提下,通过对seroin蛋白进行截短,进一步降低了实验成本、提高了实验的成功率。
[0049]
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1