一种高产大麻萜酚的酿酒酵母菌株及其构建方法和应用与流程
[0001]
本发明涉及合成生物学技术领域,通过基因工程改造,获得一株高产大麻萜酚酸的重组酿酒酵母菌株,特别是涉及一种高产大麻萜酚的酿酒酵母菌株及其构建方法和应用。
背景技术:
[0002]
无致幻副作用的大麻萜酚(cannabigerol,cbg)在医药、食品、保健和化妆品等领域有重要的应用价值。cbg与人体cb1和cb2受体结合后行使诸如抗肿瘤、抗炎症、抗氧化、保护神经、免疫调节及治疗癌症等功效。同时,cbg还对甲氧西林耐药性的金黄色葡萄菌有杀菌效果。在大麻植物腺毛的基盘细胞中,液泡中聚酮化合物途径利用脂肪酸合成二羟基戊苯酸(olivetolic acid,ola),质体中的甲羟戊酸途径利用乙酰基辅酶a合成牻牛儿焦磷酸(geranyl pyrophosphate,gpp)。进一步,香叶基转移酶将gpp和ola缩合形成大麻萜酚酸(cannabigerolic acid,cbga)。大麻萜酚酸经过脱羧处理后获得大麻萜酚产物。2006年,taura等从c.sativa中鉴定了植物来源的二羟基戊苯合酶(olivetol synthase,ols),其在ola合成途径中被命名为tks。gagne等鉴定出了ola环化酶(ola cyclase,oac)(gagne et al.,2012)。在酿酒酵母中以己酰辅酶a为前体,tks(taura等鉴定的ols酶)和oac酶可合成了0.5mg/l ola。2016年,kathleen等从大麻植物cannabis sativa l.的腺毛cdna中扩增到具有gpp:oa异戊烯转移酶功能的蛋白pt3。利用酿酒酵母底盘细胞合成gpp的特点,可在酿酒酵母体内表达异戊烯转移酶和ola合成途径获得大麻萜酚酸产物。
[0003]
但是,现在现有技术中存在以下几个问题:第一,在酿酒酵母中不能协调大麻萜酚酸合成途中的代谢前体gpp和ola的合成量,最终导致大麻萜酚酸产量低的问题;第二,不能在酿酒酵母中大量积累ola代谢产物用于合成大麻萜酚酸。
[0004]
因此,市面上亟需一种能够解决上述一个或者多个问题的一种高产大麻萜酚的酿酒酵母菌株及其构建方法和应用。
技术实现要素:
[0005]
为解决现有技术中存在的一个或者多个问题,本发明提供了一种高产大麻萜酚的酿酒酵母菌株及其构建方法和应用。
[0006]
本发明为达到上述目的所采用的技术方案是:一种高产大麻萜酚的酿酒酵母菌株的构建方法,所述方法包括:
[0007]
步骤01、构建一株产大麻萜酚的酿酒酵母菌株a;
[0008]
步骤02、通过基因编辑技术在产大麻萜酚的酿酒酵母菌株a中插入tks酶和oac酶,获得高产大麻萜酚的酿酒酵母菌株b。
[0009]
在一些实施例中,所述方法还包括:
[0010]
步骤03、在高产大麻萜酚的酿酒酵母菌株b中筛选oac酶的表达启动子获得最佳表达启动子,并利用最佳表达启动子插入2个拷贝数的oac基因,获得高产大麻萜酚的酿酒酵
母菌株c。
[0011]
在一些实施例中,所述步骤02包括:
[0012]
步骤21、以产大麻萜酚的酿酒酵母菌株a为基础,通过引物f1/r1进行pcr扩增得到1622位点上游1000bp同源臂片段1622b-up,引物f2/r2进行扩增获得融合的tks-oac片段,引物f3/r3进行扩增获得1622b位点下游1000bp同源臂片段1622b-down;
[0013]
步骤22、通过醋酸锂/peg3350化学转化方法,将上述3个片段转化产大麻萜酚的酿酒酵母菌株a;
[0014]
步骤23、利用crispr-cas9基因编辑工具,在特定grna(taaagccaccacatcgcaaa)的引导下对1622b位点进行双链断裂切割dna;
[0015]
步骤24、产大麻萜酚的酿酒酵母菌株a内的同源重组酶将1622b-up、tks-oac和1622b-dp三个片段连接成一个片段,最后通过位于tks-oac两端的1622b-up和1622b-dp同源臂,在1622b位点整合tks-oac表达框;
[0016]
步骤25、通过营养缺陷性的组成培养基筛选转化阳性克隆获得高产大麻萜酚的酿酒酵母菌株b。
[0017]
在一些实施例中,每个pcr扩增的片段之间包含50bp的同源臂序列。
[0018]
在一些实施例中,所述步骤03包括:
[0019]
步骤31、以高产大麻萜酚的酿酒酵母菌株b为基础,通过引物f5/r5进行pcr扩增得到yprcd15c位点上游1000bp同源臂片段yprcd15c-up,引物f6/r6进行扩增获得表达启动子ptdh3,引物f7/r7进行扩增获得oac-eno1t编码序列,引物f8/r8进行扩增获得yprcd15c位点下游1000bp同源臂片段yprcd15c-down;
[0020]
步骤32、通过醋酸锂/peg3350化学转化方法,将上述4个片段转化为高产大麻萜酚的酿酒酵母菌株b;
[0021]
步骤33、利用crispr-cas9基因编辑工具,在特定grna(aatccgaacaacagagcata)的引导下对yprcd15c位点进行双链断裂切割dna;
[0022]
步骤34、高产大麻萜酚的酿酒酵母菌株b内的同源重组酶将上述4个片段连接成1个片段,最后通过位于oac表达框上下游的yprcd15c-up和yprcd15c-dp同源臂,在yprcd15c位点整合tks-oac表达框;
[0023]
步骤35、通过营养缺陷性的组成培养基筛选转化阳性克隆获得高产大麻萜酚的酿酒酵母菌株c。
[0024]
在一些实施例中,每个pcr扩增的片段之间包含50bp的同源臂序列。
[0025]
本发明还公开了一种高产大麻萜酚的酿酒酵母菌株,所述高产大麻萜酚的酿酒酵母菌株通过上述的构建方法构建而成。
[0026]
本发明公开了一种高产大麻萜酚的酿酒酵母菌株在产大麻萜酚酸中的应用。
[0027]
本发明的有益效果是:本发明通过基因编辑技术调控2,4-二羟基戊苯合成酶tks和2,4-二羟基戊苯酸合成酶oac的基因拷贝数,增加ola的积累量。最终,平衡大麻萜酚酸合成前体gpp和ola的代谢流量,达到高产大麻萜酚酸的目的。
附图说明
[0028]
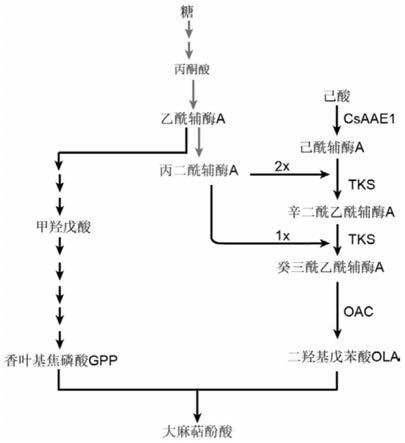
图1为大麻萜酚酸在酿酒酵母中的合成途径;
[0029]
图2为产物2,4-二羟基戊苯酸和大麻萜酚酸的标准曲线;
[0030]
图3为yg001和yg002在相同条件下产出2,4-二羟基戊苯酸产量多少的对比图;
[0031]
图4为yg001菌株、yg002菌株、yg003菌株、yg004菌株和yg005菌株在相同条件下产大麻萜酚酸产量多少的对比图。
具体实施方式
[0032]
为使本发明的上述目的、特征和优点能够更加浅显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
[0033]
本发明公开了一种高产大麻萜酚的酿酒酵母菌株,通过基因编辑技术在产大麻萜酚的酿酒酵母菌株a中插入tks和oac酶,得到高产大麻萜酚的酿酒酵母菌株b(yg002菌株)。
[0034]
在一些实施例中,在高产大麻萜酚的酿酒酵母菌株b(yg002菌株)中通过筛选oac酶的表达启动子获得最佳表达启动子,并利用最佳表达启动子插入2个拷贝数的oac酶基因,获得高产大麻萜酚的酿酒酵母菌株c。
[0035]
如图1所示,图1为大麻萜酚酸在酿酒酵母中的合成途径。
[0036]
上述实施例通过基因编辑技术调控2,4-二羟基戊苯合成酶tks和2,4-二羟基戊苯酸合成酶oac的基因拷贝数,增加ola的积累量。最终,平衡大麻萜酚酸合成前体gpp和ola的代谢流量,达到高产大麻萜酚酸的目的。
[0037]
本发明还提出了一种高产大麻萜酚的酿酒酵母菌株的构建方法,所述方法包括:
[0038]
步骤01、构建一株产大麻萜酚的酿酒酵母菌株a;
[0039]
步骤02、通过基因编辑技术在产大麻萜酚的酿酒酵母菌株a中插入tks酶和oac酶,获得高产大麻萜酚的酿酒酵母菌株b(yg002菌株)。
[0040]
具体过程如下:
[0041]
在产大麻萜酚的酿酒酵母菌株a(产cbga基础菌株yg001)中,利用cripsr-cas9技术,在1622b位点插入融合的tks-oac基因序列(seq1)。首先以产大麻萜酚的酿酒酵母菌株a(产cbga基础菌株yg001)为模板,通过引物f1/r1进行pcr扩增得到1622位点上游1000bp同源臂片段1622b-up,引物f2/r2进行扩增获得融合的tks-oac片段,引物f3/r3进行扩增获得1622b位点下游1000bp同源臂片段1622b-down。每个pcr扩增的片段之间包含50bp的同源臂序列。通过醋酸锂/peg3350化学转化方法,将上述3个片段转化yg001菌株。利用crispr-cas9基因编辑工具,在特定grna的引导下对1622b位点进行双链断裂切割dna。酿酒酵母体内的同源重组酶将1622b-up、tks-oac和1622b-dp三个片段连接成一个片段,最后通过位于tks-oac两端的1622b-up和1622b-dp同源臂,在1622b位点整合tks-oac表达框。通过营养缺陷性的组成培养基筛选转化阳性克隆获得高产大麻萜酚的酿酒酵母菌株b(yg002菌株),测序验证后进行培养分析。
[0042]
如图2和图3所示,将yg001菌株和yg002菌株在2ml ypd培养基中培养16h,起始0.2od/ml转接至ypg培养基中培养84h,添加1mm己酸底物合成cbga的底物。培养72h后分析代谢产物和菌株生物量。代谢产物采用高效液相层析仪器和对应的色谱柱分析,分析产物2,4-二羟基戊苯酸的标曲如图2a所示。yg001与yg002生物量分别为13.1od和15.2od。yg002
菌株的ola含量较出发菌株yg001提高了3.2倍。
[0043]
表1引物序列
[0044]
引物名称序列f-1aacatttaagtcacaaggaggaatatcagttr-1aagagaaggtttttttaggctaagataataactacttttcttaaactgtcaacagccaf-2gctgttgacagtttaagaaaagtagttattatcttagcctaaaaaaaccttctctttggar-2aatttcgtaagacgagtatctacatacatgggtgaccaaaagagcgf-3cgcccgctcttttggtcacccatgtatgtagatactcgtcttacgaaattggatatagttr-4actttggaaaagaaggtacggactact
[0045]
构建高产大麻萜酚的酿酒酵母菌株b(yg002菌株)的单菌落,在2ml ypd(葡萄糖2%w/v,酵母提取物1%w/v,蛋白胨2%w/v)24孔板中,在30度550rpm摇床中过夜培养,然后起始od=0.2转接至3ml ypg(葡萄糖2%w/v,酵母提取物1%w/v,蛋白胨2%w/v)培养液进行培养,添加1mm己酸产大麻萜酚酸。间隔24h补加2%w/v半乳糖,培养84h收集200ul样品进行产物分析。样品收集后,加入0.2ml体积0.5mm玻璃珠和2倍体积的乙酸乙酯进行提取。在高速组织研磨仪中处理180s,间隔30s,重复三次,瞬时离心后,取上层有机层至1.5ml离心管中,加入乙酸乙酯重复震荡萃取两次,收集的上层有机相。在旋转蒸发仪上挥干至无溶剂残留,用80%乙腈/h2o溶剂(含0.05%甲酸)重悬,0.22um pvdf滤膜过滤至液相检测瓶内插管中,作为检测样品。样品中的代谢产物通过agilent1260高效液相分析代谢产物含量,色谱柱型号为poroshell 120ec-c18柱,3.0x100mm,2.7um,分析柱稳维持恒定40摄氏度,流动相条件如表3。
[0046]
表3高效液相分析流动相条件
[0047][0048]
[0049]
[0050][0051]
在一些实施例中,所述方法还包括:
[0052]
步骤03、在高产大麻萜酚的酿酒酵母菌株b(yg002菌株)中,利用cripsr-cas9技术,在yprcd15c位点插入oac基因表达框序列(seq2)。首先以产大麻萜酚的酿酒酵母菌株a(yg001菌株)为模板,通过引物f5/r5进行pcr扩增得到yprcd15c位点上游1000bp同源臂片段yprcd15c-up,引物f6/r6进行扩增获得表达启动子ptdh3,引物f7/r7进行扩增获得oac-eno1t编码序列,引物f8/r8进行扩增获得yprcd15c位点下游1000bp同源臂片段yprcd15c-down。每个pcr扩增的片段之间包含50bp的同源臂序列。通过醋酸锂/peg3350化学转化方法,将上述4个片段转化高产大麻萜酚的酿酒酵母菌株b(yg002菌株)。利用crispr-cas9基因编辑工具,在特定grna的引导下对yprcd15c位点进行双链断裂切割dna。酿酒酵母体内的同源重组酶将上述4个片段连接成1个片段,最后通过位于oac表达框上下游的yprcd15c-up和yprcd15c-dp同源臂,在yprcd15c位点整合tks-oac表达框。通过营养缺陷性的组成培养
基筛选转化阳性克隆获得高产大麻萜酚的酿酒酵母菌株bc(yg003菌株),测序验证后进行培养分析。
[0053]
具体地,还可以在高产大麻萜酚的酿酒酵母菌株b(yg002菌株)中敲入不同的启动子表达的oac表框,分别获得yg004(pgal1-oac表达框seq.3)、yg005(phsp26
--
oac表达框seq.4)。
[0054]
表2构建引物2
[0055]
引物名称序列f5ataacaccatatatggcagtacatcagr5aggctaattttttgactaatgaaattttaaaactacattaatgtgttagtttttctttctf6acacattaatgtagttttaaaatttcattagtcaaaaaattagccttttaattctgctgtr6aaaacgatcaagtgcttgacggccattttgtttgtttatgtgtgtttattcgaaactaagf7aaacacacataaacaaacaaaatggccgtcaagcacttgatcr7gatagttaatttttattctagcatatatttaagttatacatgggtgaccaaaagagcgf8cgctcttttggtcacccatgtataacttaaatatatgctagaataaaaattaactatcr8atgttatatctcaatatctcaatatattttgg
[0056]
参照图4所示,图4为yg001菌株、yg002菌株、yg003菌株、yg004菌株和yg005菌株产大麻萜酚酸的柱状对比图;从上图可以看出,yg003菌株产大麻萜酚酸量最多,yg001菌株产量最少。
[0057]
本发明还提出了一种高产大麻萜酚的酿酒酵母菌株在产大麻萜酚算中的应用。
[0058]
综上所述,本发明通过基因编辑技术调控2,4-二羟基戊苯合成酶tks和2,4-二羟基戊苯酸合成酶oac的基因拷贝数,增加ola的积累量。最终,平衡大麻萜酚酸合成前体gpp和ola的代谢流量,达到高产大麻萜酚酸的目的。
[0059]
以上所述实施例仅表达了本发明的两种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1