一种分离的增殖态小胶质细胞及其制备方法以及在小胶质细胞替换中的应用与流程
1.本发明属于生物药物领域,具体涉及一种分离的相对内源小胶质细胞具备竞争优势的小胶质细胞及其制备方法。
背景技术:
2.小胶质细胞是中枢神经系统(cns)内重要的免疫细胞,携带有基因突变的小胶质细胞参与了多种神经退行性病变的发生和发展。例如,目前已知的老年痴呆症基因组风险位点,》50%都表达于小胶质细胞内。因此,替换病变小胶质细胞,或增强小胶质细胞功能,具有巨大的临床应用前景。常规的基因治疗思路无法用于小胶质细胞,主要原因是由于:1.常用的非整合类病毒载体(如aav)无法感染小胶质细胞;2.整合类的病毒载体(如lentivirus)即使能够感染小胶质细胞,但只能影响注射位点局部的细胞,无法在全脑层面上对小胶质细胞进行操控。因此,如何在全脑范围内操控小胶质细胞成为其基因治疗的瓶颈。
3.目前小胶质细胞移植有两种方案:1在巨噬细胞集落因子1受体(csf1r)敲除的幼年小鼠脑内进行鼠源小胶质细胞移植(bennett,f.c.,et al.,a combination of ontogeny and cns environment establishes microglial identity.neuron,2018.98(6):p.1170-1183.e8.);2在表达人源csf1的免疫缺陷幼年小鼠脑内进行人源小胶质细胞移植(hasselmann,j.,et al.,development of a chimeric model to study and manipulate human microglia in vivo.neuron,2019.103(6):p.1016-1033.e10.)。两种方案中,宿主必须为特定的转基因动物,且必须在发育早期完成替换,无法运用于医疗实践。
4.实验表明(bruttger,j.,et al.,genetic cell ablation reveals clusters of local self-renewing microglia in the mammalian central nervous system.immunity,2015.43(1):p.92-106.;lund,h.,et al.,competitive repopulation of an empty microglial niche yields functionally distinct subsets of microglia-like cells.nature communications,2018.9(1):p.4845.),小胶质细胞彼此间存在竞争,因此各自占据了cns内均匀分布的生态龛位(niche),互不重叠;而一旦小胶质细胞个体试图侵入临近niche,结果往往会以失败告终,这也是直接移植小胶质细胞失败的重要原因(图1a)。不仅如此,如果血液内髓系细胞进入脑内,小胶质细胞也会和这些血液来源的髓系细胞进行竞争,抢夺cns内有限的niche。因此,如何人为清空这些niche,是小胶质细胞移植成功的关键。利用csf1r受体抑制剂(如plx5622,plx3397,blz945等),可以选择性清除cns内的小胶质细胞,以及其他依赖csf1r存活的髓系细胞,空出cns内小胶质细胞的生态龛位;然而一旦停止药物处理,小胶质细胞会在7天内急剧增殖,并恢复正常数量;维持药物给予又会阻止外源小胶质细胞存活;因此单纯给予宿主csf1r受体抑制剂进行移植的方案不可实现(图1b)。对宿主进行致死辐照等强力清髓性处理,结合csf1r受体抑制剂,可以
抑制宿主cns内小胶质细胞和髓系细胞增殖;然而,强力清髓性处理后必须给宿主进行造血干细胞移植,否则宿主无法存活,在此条件下,新移植的造血干细胞又会产生新的髓系细胞进入cns,重新占据cns内小胶质细胞生态龛位(图1c)。为此,需要在对宿主进行csf1r受体抑制剂和强剂量清髓性处理后,将基因工程改造过的造血干细胞植入宿主体内;这些基因改造过的造血干细胞产生的髓系细胞,可被特定药物(非csf1r受体抑制剂)清除,从而空出cns内小胶质细胞niche,为外源小胶质细胞的移植创造条件(图1d)。以此为基础,已开发出成年野生型小鼠脑内小胶质细胞移植方案(xu,z.,et al.,efficient strategies for microglia replacement in the central nervous system.cell rep,2020.32(6):p.108041.)。上述方案,是通过清空宿主小鼠cns内小胶质细胞生态龛位,以实现在成年野生型小鼠中枢神经系统进行小胶质细胞移植;上述方案依赖于致死辐照等强力清髓性处理,该处理方法的剂量存在较大风险,因此需要降低剂量,或者采用其他更温和的清髓性处理技术(例如白消安等清髓性药物),然而如果采用更温和清髓性处理技术,又可能无法显著削弱宿主cns内小胶质细胞和髓系细胞的增殖能力,使之在同外源小胶质细胞竞争生态龛位过程中仍然更具优势(因为外源小胶质细胞在急性分离后处于损伤状态)。
技术实现要素:
5.如前所述,目前三种小胶质细胞移植方案中,有两种宿主必须为特定的转基因动物,且必须在发育早期完成替换,无法运用于医疗实践。采用致死剂量辐照等强力清髓性处理,该处理方法的剂量存在较大风险,而不采用致死剂量辐照等强力清髓性处理无法使外源小胶质细胞占据优势。
6.本发明一个方面提供了一种分离的增殖态小胶质细胞的制备方法,所述的增殖态小胶质细胞制备方法为给予除宿主外其他的供体以巨噬细胞集落因子1受体抑制剂,并在停止给予巨噬细胞集落因子1受体抑制剂3天以后从供体中获得增殖态小胶质细胞;
7.或在给予除宿主外其他的供体以巨噬细胞集落因子1受体抑制剂的同时,在所述供体小胶质细胞内过表达巨噬细胞集落因子1受体,并在停止给予巨噬细胞集落因子1受体抑制剂3天以后从供体中获得增殖态小胶质细胞;
8.或者在除宿主外其他的供体的小胶质细胞内过表达巨噬细胞集落因子1受体,然后从供体中获得增殖态小胶质细胞。
9.在本发明的技术方案中,给予除宿主外的其他供体以巨噬细胞集落因子1受体抑制剂的时间为供体内小胶质细胞已被消除95%以上时,停止给予巨噬细胞集落因子1受体抑制剂。
10.在本发明的技术方案中,所述巨噬细胞集落因子1受体抑制剂选自可透血脑屏障药物的巨噬细胞集落因子1受体抑制剂,优选为plx5622,plx3397,blz-945。本发明另一个方面提供了本发明上述方法制备得到的分离的增殖态小胶质细胞。
11.本发明另一个方面提供了一种制剂,所述制剂中包含本发明上述方法制备得到的分离的增殖态小胶质细胞。
12.本发明再一个方面提供了本发明所述的分离的增殖态小胶质细胞在制备用于异源性小胶质细胞替换的试剂中用途。
13.本发明再一个方面提供了本发明所述的分离的增殖态小胶质细胞在制备用于治
疗病变小胶质细胞相关疾病的制剂中的用途。
14.在本发明的技术方案中,所述的病变小胶质细胞相关疾病选自病变小胶质细胞引发的神经退行性疾病、胶质细胞瘤。
15.本发明再一个方面提供了本发明所述的分离的增殖态小胶质细胞在提高小胶质细胞进入生物龛位竞争优势中的用途。
16.本发明再一个方面提供另一种小胶质细胞的替换方法,所述替换方法包括以下步骤:
17.1)采用辐照和或消髓药物抑制宿主中枢神经系统中髓系细胞增殖,同时采用巨噬细胞集落因子1受体抑制剂清除宿主中枢神经系统中内源小胶质细胞;
18.2)在宿主中枢神经系统中植入强势竞争生物龛位的外源小胶质细胞;
19.3)给予宿主以骨髓细胞或造血干细胞。
20.在本发明的技术方案中,所述的替换方法为非诊断和治疗目的的。
21.在本发明的技术方案中,所述替换方法的步骤1)中采用的辐照方法为非致死剂量的辐照。
22.在本发明的技术方案中,所述替换方法的步骤1)中采用的消髓药物选自白消安、hepsulfam,pl109,dexamfetaminesulfaat,pl102,treosulfan,melphalan。
23.在本发明的技术方案中,所述替换方法的步骤1)中巨噬细胞集落因子1受体抑制剂选自plx5622,plx3397,blz-945可透血脑屏障药物。
24.在本发明的技术方案中,所述替换方法的步骤2)中,所述强势竞争生物龛位的外源小胶质细胞在步骤1)处理的宿主的中枢神经系统中髓系细胞和小胶质细胞被抑制,在用药物消除95%以上宿主小胶质细胞,且撤药后24到48小时内进行替换。
25.在本发明的技术方案中,所述替换方法的步骤2)中,所述强势竞争生物龛位的外源小胶质细胞选自分离的增殖态小胶质细胞、过表达csf1r的小胶质细胞,或小胶质细胞前体细胞。
26.在本发明的技术方案中,所述的增殖态小胶质细胞制备方法为给予除宿主外的其他供体以巨噬细胞集落因子1受体抑制剂的,并在停止给予巨噬细胞集落因子1受体抑制剂3天后,优选为停止给予巨噬细胞集落因子1受体抑制剂后第3-5天从供体中获得增殖态小胶质细胞。
27.在本发明的技术方案中,所述步骤3)中给予的骨髓细胞或造血干细胞,且所述骨髓细胞或造血干细胞产生的髓系细胞能够被他莫昔芬消除。
28.在本发明的技术方案中,所述步骤3)中还包括持续给予他莫昔芬的步骤。
29.在本发明的技术方案中,所述步骤3)中给予的骨髓细胞或造血干细胞通过以下方法获得,通过分离来自特定品系小鼠的骨髓细胞或造血干细胞,所述特定品系小鼠,指其产生的髓系细胞可被他莫昔芬消除,例如cx3cr1-creer:rosa-dta小鼠。
30.在本发明的技术方案中,所述的宿主与供体为人或其他哺乳动物,例如小鼠。所述的宿主与供体为野生型。
31.本发明在现有技术的基础上,通过温和清髓性技术降低宿主来源小胶质细胞和髓系细胞的竞争力,并药物或者基因工程手段,强化外源小胶质细胞的竞争优势(例如使其进入快速增殖态,或者直接植入小胶质细胞前体细胞),促进外源小胶质细胞获得生态龛位;
同时制造适合外源小胶质细胞存活的cns内环境,促进外源小胶质细胞增殖。
32.有益效果
33.本发明提供一种具有生态龛位竞争优势的外源小胶质细胞及其制备方法。由于本发明提供的外源小胶质细胞能够提高进入生态龛位的竞争优势,因此可以极大程度地降低清髓性处理强度,进而降低了风险,提高了安全性。
34.现有的小胶质细胞移植方案中,宿主必须为特定的转基因动物,且必须在发育早期完成替换,无法运用于医疗实践。在先的方案,虽然可在成年野生型动物实现小胶质细胞移植,但依赖于致死辐照等强力清髓性处理。而本方案则在先前基础上,降低清髓性处理强度,或省略清髓性处理,提高了安全性,理论上可推广到其他物种,甚至人类,可应用于涉及小胶质细胞的多种神经退行性疾病治疗,以及胶质细胞瘤等神经系统癌症的治疗。
附图说明
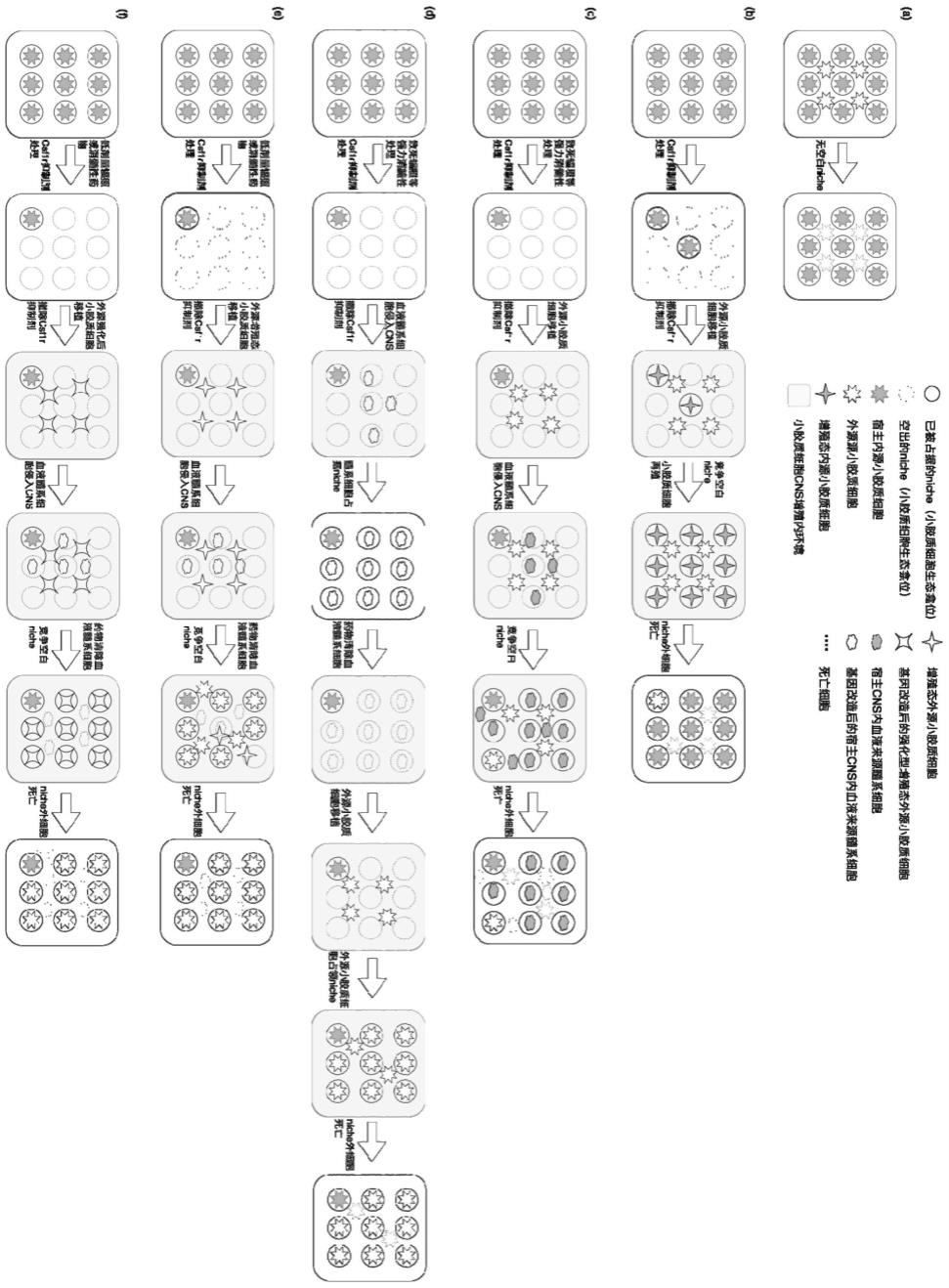
35.图1为小胶质细胞原理示意图。其中(a)-(d)为现有技术中的方案,(e)-(f)为本发明的方案。
36.其中图1(a)表示小胶质细胞彼此间存在竞争,因此各自占据了cns内均匀分布的生态龛位(niche),互不重叠;niche一旦被占领,又很难被niche外的细胞侵占,这也是直接移植小胶质细胞失败的重要原因。
37.图1(b)表示利用csf1r受体抑制剂(如plx5622,plx3397,blz945等),可以选择性清除cns内的小胶质细胞,以及其他依赖csf1r存活的髓系细胞,空出cns内小胶质细胞的niche;然而一旦停止药物处理,小胶质细胞会在7天内急剧增殖,并恢复正常数量;维持药物给予又会阻止外源小胶质细胞存活;因此单纯给予宿主csf1r受体抑制剂进行移植的方案不可实现。
38.图1(c)表示如果血液内髓系细胞进入脑内,小胶质细胞也会和这些血液来源的髓系细胞进行竞争,抢夺cns内有限的niche。因此,如何人为清空这些niche,是小胶质细胞移植成功的关键。对宿主进行致死辐照等强力清髓性处理,结合csf1r受体抑制剂,可以抑制宿主cns内小胶质细胞和髓系细胞增殖;然而,强力清髓性处理后必须给宿主进行造血干细胞移植,否则宿主无法存活,在此条件下,新移植的造血干细胞又会产生新的髓系细胞进入cns,重新占据cns内小胶质细胞niche。
39.图1(d)表示为此,在对宿主进行csf1r受体抑制剂和强剂量清髓性处理后,将基因工程改造过的造血干细胞植入宿主体内;这些基因改造过的造血干细胞产生的髓系细胞,可被特定药物(非csf1r受体抑制剂)清除,从而空出cns内小胶质细胞niche,为外源小胶质细胞的移植创造条件。
40.图1(e)表示宿主接受csf1r受体抑制剂处理并撤药后,小胶质细胞会进入快速增殖状态;基于该现象,预先用csf1r受体抑制剂同步处理供体小鼠和受体小鼠并撤药,使供体来源的外源小胶质细胞预先进入增殖状态,并使受体小鼠cns内环境匹配外源小胶质细胞增殖态;这一步骤可增加植入后外源小胶质细胞的存活率。
41.图1(f)表示移植具备强增殖分化能力的小胶质细胞前体细胞,也能达到类似效果。进一步地,还可以对外源小胶质细胞进行基因工程改造,使之在同宿主脑内髓系细胞的竞争中占据优势地位(例如过表达csf1r或者对csf1r进行突变,提高其对csf1r或il34的亲
和性,增强其存活和增殖能力)。
42.图2为小胶质细胞移植方案示意图。
43.图3采用现有技术中方案与采用本发明方案结果对比。其中图3a为正常小鼠、辐射致死小鼠以及本发明方案采用白消安处理的小鼠的照片。从照片可以看出致死辐照会使小鼠进入衰老状态(毛色变白),而白消安处理后小鼠状态正常。图3b左图显示文献(xu,z.,et al.,efficient strategies for microglia replacement in the central nervous system.cell rep,2020.32(6):p.108041.)中的移植效果,右图显示采用本发明中方案的移植效果。二者无显著差异。
具体实施方式
44.为了使本发明的上述目的、特征和优点能够更加明显易懂,下面对本发明的具体实施方式做详细的说明,但不能理解为对本发明的可实施范围的限定。
45.本发明一个方面提供了一种分离的增殖态小胶质细胞的制备方法,所述的增殖态小胶质细胞制备方法为给予除宿主外其他的供体以巨噬细胞集落因子1受体抑制剂,并在停止给予巨噬细胞集落因子1受体抑制剂3天以后从供体中获得增殖态小胶质细胞;
46.或在给予除宿主外其他的供体以巨噬细胞集落因子1受体抑制剂的同时,在所述供体小胶质细胞内过表达巨噬细胞集落因子1受体,并在停止给予巨噬细胞集落因子1受体抑制剂3天以后从供体中获得增殖态小胶质细胞;
47.或在除宿主外其他的供体的小胶质细胞内过表达巨噬细胞集落因子1受体,然后从供体中获得增殖态小胶质细胞。
48.在本发明一些技术的实施例中,给予除宿主外的其他供体以巨噬细胞集落因子1受体抑制剂的时间为供体内小胶质细胞已被消除95%以上时,停止给予巨噬细胞集落因子1受体抑制剂。
49.在本发明一些技术的实施例中,所述巨噬细胞集落因子1受体抑制剂选自可透血脑屏障药物的巨噬细胞集落因子1受体抑制剂,优选为plx5622,plx3397,blz-945。
50.本发明另一个方面提供了本发明上述方法制备得到的分离的增殖态小胶质细胞。
51.本发明另一个方面提供了一种制剂,所述制剂中包含本发明上述方法制备得到的分离的增殖态小胶质细胞。
52.本发明再一个方面提供了本发明所述的分离的增殖态小胶质细胞在制备用于异源性小胶质细胞替换的试剂中用途。
53.本发明再一个方面提供了本发明所述的分离的增殖态小胶质细胞在制备用于治疗病变小胶质细胞相关疾病的制剂中的用途。
54.在本发明一些技术的实施例中,所述的病变小胶质细胞相关疾病选自病变小胶质细胞引发的神经退行性疾病、胶质细胞瘤。
55.本发明再一个方面提供了本发明所述的分离的增殖态小胶质细胞在提高小胶质细胞进入生物龛位竞争优势中的用途。
56.本发明再一个方面提供另一种小胶质细胞的替换方法,所述替换方法包括以下步骤:
57.1)采用辐照和或消髓药物抑制宿主中枢神经系统中髓系细胞增殖,同时采用巨噬
细胞集落因子1受体抑制剂清除宿主中枢神经系统中内源小胶质细胞;
58.2)在宿主中枢神经系统中植入强势竞争生物龛位的外源小胶质细胞;
59.3)给予宿主以骨髓细胞或造血干细胞。
60.在本发明一些技术的实施例中,所述的替换方法为非诊断和治疗目的的。
61.在本发明一些技术的实施例中,所述替换方法的步骤1)中采用的辐照方法为非致死剂量的辐照。
62.在本发明一些技术的实施例中,所述替换方法的步骤1)中采用的消髓药物选自白消安、hepsulfam,pl109,dexamfetaminesulfaat,pl102,treosulfan,melphalan。
63.在本发明的技术方案中,所述替换方法的步骤1)中巨噬细胞集落因子1受体抑制剂选自
…
plx5622,plx3397,blz-945可透血脑屏障药物。
64.在在本发明一些技术的实施例中,所述替换方法的步骤2)中,所述强势竞争生物龛位的外源小胶质细胞在步骤1)处理的宿主的中枢神经系统中髓系细胞和小胶质细胞被抑制,在用药物消除95%以上宿主小胶质细胞,且撤药后24到48小时内进行。
65.在本发明一些技术的实施例中,所述替换方法的步骤2)中,所述强势竞争生物龛位的外源小胶质细胞选自分离的增殖态小胶质细胞、过表达csf1r的小胶质细胞,或小胶质细胞前体细胞。
66.在本发明一些技术的实施例中,所述的增殖态小胶质细胞制备方法为给予除宿主外的其他供体以巨噬细胞集落因子1受体抑制剂的,并在停止给予巨噬细胞集落因子1受体抑制剂3天后,优选为停止给予巨噬细胞集落因子1受体抑制剂后第3-5天从供体中获得增殖态小胶质细胞。
67.在本发明一些技术的实施例中,所述步骤3)中给予的骨髓细胞或造血干细胞,且所述骨髓细胞或造血干细胞产生的髓系细胞能够被他莫昔芬消除。
68.在本发明一些技术的实施例中,所述步骤3)中还包括持续给予他莫昔芬的步骤。
69.在本发明一些技术的实施例中,所述步骤3)中给予的骨髓细胞或造血干细胞通过以下方法获得,通过分离来自特定品系小鼠的骨髓细胞或造血干细胞,所述特定品系小鼠,指其产生的髓系细胞可被他莫昔芬消除,例如cx3cr1-creer:rosa-dta小鼠。
70.在本发明一些技术的实施例中,所述的宿主与供体为人或其他哺乳动物,例如小鼠。所述的宿主与供体为野生型。
71.实施例1
72.1)采用非致死剂量的辐照和或消髓药物白消安抑制野生型小鼠中枢神经系统中髓系细胞增殖,同时采用巨噬细胞集落因子1受体抑制剂清除宿主中枢神经系统中内源小胶质细胞;
73.2)给予除野生型小鼠宿主外的其他野生型小鼠供体以巨噬细胞集落因子1受体抑制剂的,并在停止给予巨噬细胞集落因子1受体抑制剂后第3-5天从供体中获得增殖态小胶质细胞;并在步骤1)处理的宿主的中枢神经系统中髓系细胞和小胶质细胞被抑制,在用药物消除95%以上宿主小胶质细胞,且撤药后24到48小时内,植入增殖态小胶质细胞;
74.3)给予宿主以骨髓细胞或造血干细胞;所述骨髓细胞或造血干细胞产生的髓系细胞能够被他莫昔芬消除;并持续性给予他莫昔芬。
75.持续观察小鼠状态以及移植效果,实验结果见图3,对比现有技术的采用致死辐射
剂量的方案,本发明的方法小鼠状态和正常小鼠状态类似,明显好于现有技术方案中的小鼠。移植效果也与现有技术相当。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1