一种响应面法优化鹿血酶解肽工艺的方法及其应用与流程
本发明属于动物药提取技术领域,尤其涉及一种响应面法优化鹿血酶解肽工艺的方法及其对lps诱导的h9c2大鼠心肌细胞心力衰竭模型的保护作用研究。
背景技术:
鹿血中的有机物占16%—17%,其中主要为血红蛋白,血红蛋白由血红素和珠蛋白组成,珠蛋白分子量较大,直接食用不易被人体消化吸收(靳艳.鹿血活性肽在制备降血压药物及保健品中的应用[a].中国畜牧业协会.第八届(2017)中国鹿业发展大会论文集[c].中国畜牧业协会:2017:3)。另外,用新鲜鹿血调配的产品极大的影响了人们的感官状态,而多肽和蛋白质的基本组成单元都是氨基酸,从氨基酸营养的角度来分析,两者没有区别。但是多肽的相对分子质量比蛋白质小很多,并具有一些蛋白质所没有的生理调节功能。生物活性肽能够以完整的形式被机体吸收,在微量或低浓度的情况下即可发挥生物调节作用。因此利用降解技术将蛋白质中的肽释放出来,可提高蛋白利用率,使人体能快速补充营养,补充能量,快速合成人体千万种蛋白质,发挥多种生理活性作用。(elstvler,jensadler-nissen.enzymichydrolysisoffoodproteins.appliedsciencepublishers[j],1984)
鹿血是梅花鹿(cervusnipporttemminck)或马鹿(cervuselaphuslinnaeus)的膛血或茸血,系传统的名贵中药。近年来,鹿血产品的研发受到广泛关注,目前鹿血产品主要形式为鹿血酒、鹿血口服液、鹿血口嚼片、鹿血滋补胶囊,作为特色药食同源食品,市面上也出现了鹿血蛋羹、鹿血豆腐、鹿血粥等产品。现代临床研究表明,鹿血肽在抗氧化、提高免疫力、抗衰老、抗肿瘤等方面有显著疗效。
心力衰竭是临床常见病、多发病,是多种心脏疾病的最终结局,根据全球各地的流行病学调查显示,在总人口数中,平均每100个人,就会有3~5个人有某种程度的心力衰竭。因此对它的发病机理和预防治疗的研究也成为医学研究的热点。目前,鹿血酶解肽对lps诱导的h9c2大鼠心肌细胞心力衰竭模型的保护作用研究尚未开展。
技术实现要素:
本发明目的在于提供一种响应面法优化鹿血酶解肽工艺的方法及其应用,以解决鹿血酶解肽工艺有待进一步优化,且目前鹿血酶解肽对lps诱导的h9c2大鼠心肌细胞心力衰竭模型的保护作用研究尚未开展的技术问题。
为实现上述目的,本发明的一种响应面法优化鹿血酶解肽工艺的方法及其应用的具体技术方案如下:
一种响应面法优化鹿血酶解肽工艺的方法,包括如下步骤,且以下步骤顺次进行:
(1)取一定量用纱布过滤好的新鲜鹿血,按底物浓度5%加入一定量的蒸馏水,再加入一定量的酶(1000~5000u/g),在适宜的温度(40~60℃)下水解,反应过程中不断加入1mol/lnaoh或hcl维持ph恒定在所需值(9~11),水解(4~6h)反应结束后沸水浴灭酶30min,迅速冷却,水解液3800r/min离心30min,收集上清液冷冻干燥备用。
(2)选择ph值、酶解时间、酶解温度、酶量四个因素对步骤(1)进行单因素实验,确定ph值、酶解时间、酶解温度、酶量的最优水平,以单因素实验最优点为中心,围绕最优点上下各取1个水平值作为响应面的水平,分别编码-1、0、1,根据bx-benhnken设计原则进行四因素响应面实验。
tnf-α、il-6、il-1β是促炎症因子,它们可以被脂多糖(lipopolysaccharides,lps)诱导,引起心肌细胞凋亡。用lps诱导h9c2大鼠心肌细胞建立心力衰竭模型,应用elisa试剂盒检测培养上清液tnf-α、il-6、il-1β含量水平,以不同质量浓度的鹿血酶解寡肽(dbp-5)抑制tnf-α、il-6、il-1β释放的能力作为筛选指标,评价鹿血酶解肽对lps诱导的h9c2大鼠心肌细胞心力衰竭模型的保护作用。
利用1μg/mllps诱导h9c2大鼠心肌细胞建立心力衰竭模型,噻唑蓝(methylthiazolyltetrazolium,mtt)实验测定不同分子量的鹿血酶解肽对h9c2大鼠心肌细胞增殖抑制活性的影响;应用elisa试剂盒检测培养上清液tnf-α、il-6、il-1β水平,以不同质量浓度的鹿血酶解寡肽(dbp-5)抑制tnf-α、il-6、il-1β释放的能力作为筛选指标,评价鹿血酶解肽对lps诱导的h9c2大鼠心肌细胞心力衰竭模型的保护作用。
采用designexpert10.0对响应面试验结果进行分析。细胞炎症因子测定实验采用spss17.0软件进行数据的显著性分析,计量数据以
采用氨基酸分析仪得出鹿血酶解肽中赖氨酸含量最高,为17.81%,鹿血酶解肽中人体必需氨基酸含量较大为52.78%。
本发明的一种响应面法优化鹿血酶解肽工艺的方法及其应用具有以下优点:本发明通过响应面优化试验,分别对提取ph值、提取时间、提取温度、提取酶量进行优化,确定了鹿血酶解肽的最佳工艺条件,使鹿血酶解时水解度可达到28.98%,为鹿血的进一步开发应用提供了研究基础。
为验证鹿血酶解肽对lps诱导的h9c2大鼠心肌细胞心力衰竭模型的保护作用,本实验研究了不同分子量的鹿血酶解肽对h9c2大鼠心肌细胞的增殖抑制的影响及鹿血寡肽(dbp-5)对h9c2大鼠心肌细胞释放tnf-α、il-6、il-1β水平的影响。结果表明,不同分子量的鹿血酶解肽对h9c2大鼠心肌细胞增殖有抑制作用,且分子量<1的鹿血酶解寡肽(dbp-5)增殖抑制率最大。鹿血酶解寡肽质量浓度为200μg/ml时,对大鼠心肌细胞h9c2的抑制作用最强。给药后h9c2大鼠心肌细胞上清液中tnf-α、il-6、il-1β含量均有不同程度的降低,在质量浓度达到200μg/ml时,上述3种细胞炎症因子释放量达到最低,进一步验证了鹿血酶解肽对lps诱导的h9c2大鼠心肌细胞心力衰竭模型具有保护作用。
附图说明
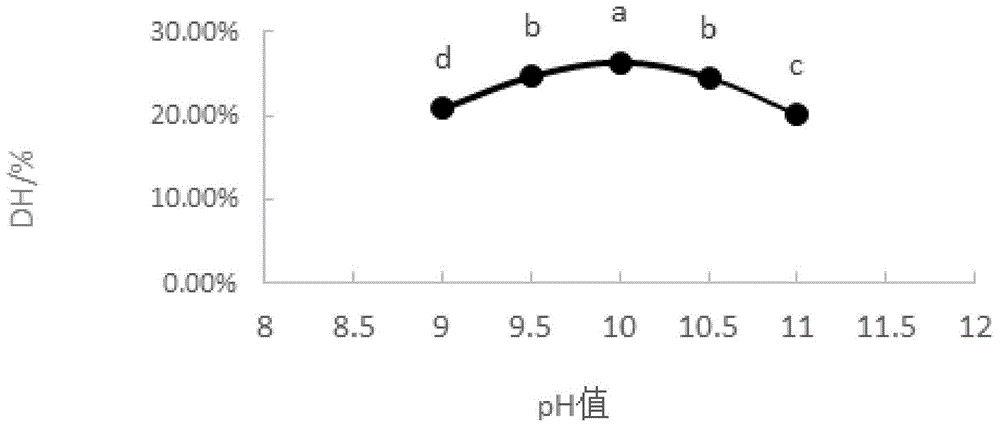
图1为不同ph值对水解度的影响。
图2为不同酶解时间对水解度的影响。
图3为不同酶解温度对水解度的影响。
图4为不同酶量对水解度的影响。
图5a为ph与时间交互作用的响应面图。
图5b为ph与时间交互作用的等高线图。
图6a为ph与温度交互作用的响应面图。
图6b为ph与温度交互作用的等高线图。
图7a为ph与酶量交互作用的响应面图。
图7b为ph与酶量交互作用的等高线图。
图8a为时间与温度交互作用的响应面图。
图8b为时间与温度交互作用的等高线图。
图9a为时间与酶量交互作用的响应面图。
图9b为时间与酶量交互作用的等高线图。
图10a为温度与酶量交互作用的响应面图。
图10b为温度与酶量交互作用的等高线图。
图11为bfp-5对h9c2大鼠心肌细胞tnf-α分泌量的影响。
图12为bfp-5对h9c2大鼠心肌细胞il-6分泌量的影响。
图13为bfp-5对h9c2大鼠心肌细胞il-1β分泌量的影响。
具体实施方式
为了更好地了解本发明的目的、结构及功能,下面结合附图,对本发明一种响应面法优化鹿血酶解肽工艺的方法及其应用做进一步详细的描述。
实施例1:
取一定量用纱布过滤好的新鲜鹿血,加入一定量的蒸馏水,配成底物浓度为5%的溶液。将配置好的溶液置于温度为52℃的恒温水与锅内,用1mol/lnaoh或hcl维持ph恒定在10.4后加入4400u/g的碱性蛋白酶,反应过程中用1mol/lnaoh或hcl使ph值始终维持在10.4,酶解5h。酶解结束后,将酶解液调至ph值为中性,置于沸水浴中30min,将酶灭活。得到的酶解液迅速冷却,3800r/min条件下离心30min,弃掉沉淀,保留上清液。将上述上清液用滤膜过滤,将滤液冻干,即得鹿血酶解肽冻干粉。
响应面法优化鹿血酶解肽工艺的方法
(1)采用茚三酮比色法测定水解度;
(2)实验设计和统计分析:
a、单因素试验;
以水解度为指标,考察ph值9~11、时间为4~6h、温度为40~60℃、酶量为1000u/g~5000u/g四个因素对鹿血酶解肽水解度的影响,结果如图1~图4所示:
由图1可知,在ph9~10范围内随着ph值逐渐升高,水解度也逐渐升高,当ph达到10时,鹿血酶解肽水解度达到最高值为26.40%。在ph10~11.0范围内,水解度逐渐下降。这是由于酶作为蛋白质的一种,其酶促反应速率和ph值关系密切,当ph达到某一最适范围时,酶活性达到最高,酶促反应速率最大,当ph偏离最适值时,酶的天然构象和酶与底物的解离状态会受到影响,进而影响酶的稳定性、抑制酶的活性甚至失活,故确定酶解最适ph为10。
由图2可知,在酶解时间4~5h范围内,鹿血酶解肽水解度随时间延长而升高,5h后水解度开始下降,这是由于随着反应的进行,酶的活性部位与底物结合达到饱和时,反应趋向于平衡时,反应时间持续增加会使酶解产物浓度增加,从而竞争性抑制作用变强,而新生成的小分子肽、氨基酸等产物容易发生副反应,故酶促反应开始下降,因此选择最适时间为5h。
由图3可知,在温度40~55℃范围内随着温度逐渐升高,水解度也逐渐升高,55℃时达到最高26.57%。55℃后鹿血酶解肽水解度升高速率减慢,这是由于在一定温度范围内,随温度的升高,酶的活性增强,酶促反应加快,酶解温度达到一定程度时,温度再升高会导致蛋白质变性,以及引起蛋白质的聚集和沉淀作用,使其溶解度下降,从而使酶解速率降低,因此确定酶解温度55℃为宜。
由图4可知,随着酶量的增加,鹿血酶解肽水解度也逐渐增加,当酶量达到4000u/g时,水解度增加速率变小,甚至有下降的趋势。这是由于底物达到饱和,体系流动性会变差反应速率反而会呈现下降趋势,综合考虑酶用量应为4000u/g。
b、响应面优化试验方法
依据单因素试验结果,选取ph(a)、时间(b)、温度(c)、酶量(d)四个因素为优化对象,进行四因素三水平的响应面试验设计。利用实验设计软件进行非线性回归的二次多项式模型拟合,预测的模型如下
y=31.50+1.28a+0.67b-1.86c+1.58d+0.56ab-2.32ac+0.24ad+2.34bc-2.76bd-2.31cd-5.80a2-5.26b2-4.29c2-4.01d2。
具体的试验方案如表1所示;试验结果如表2所示。
表1响应面的因素与水平
表2响应面优化试验设计及结果
由表3可以看出,模型极显著(p<0.001),失拟项不显著(p>0.05),表明方程无失拟性因素存在,回归模型与实际值能较好地拟合。由f检验可以得到4个因素对鹿血酶解肽效果的影响顺序依次为:ph(a)>酶量(b)>温度(c)>时间(d)。ac、bc、cd的p值<0.05,说明ph值和温度、酶量和温度、酶量和时间之间的交互作用对水解度的影响达到显著水平,bd、a2、b2、c2、d2的p值<0.01,达到极显著水平。模型的决定系数r2=0.9329,表明由响应面试验设计所获得的回归方程与实际情况拟合较好;变异系数(cv)为0.7851%,表明实验操作准确且可靠性较高。
表3回归模型的方差分析与显著性检验
根据回归方程分析结果做出响应曲面图和等高线图,进一步直观地确认酶解ph、时间、温度、酶量四因素交互用对鹿血肽酶解效果的影响,结果见图5~图10。
等高线的形状为椭圆形表示因素的交互作用显著,圆形则表示交互作用不显著,由图5a和图5b可知,随着ph增加及酶解时间延长,水解度先升高后降低,说明在此范围内鹿血酶解肽水解度存在极大点,但因素ab之间没有存在明显的交互作用。如图6a和图6b可知,温度一定,随着ph的升高,鹿血酶解肽水解度呈现逐渐升高后趋于平缓且略有降低,说明在此范围内鹿血酶解肽水解度存在最大值,且等高线呈椭圆形,表明因素ac之间交互作用显著;如图7a和图7b可知,ph增加及酶量增大,水解度先升高后降低,说明在此范围内鹿血酶解肽水解度存在最大值,因素ad之间交互作用不明显;如图8a和图8b可知,温度一定,随着时间的延长,鹿血酶解肽水解度缓慢升高后开始降低,说明在此范围内鹿血酶解肽水解度存在最大值,且等高线呈椭圆形,表明因素bc之间交互作用显著;如图9a和图9b可知,时间一定,随着酶量的增加,鹿血酶解肽水解度呈现升高后趋于逐渐降低的趋势,说明在此范围内鹿血酶解肽水解度存在极值,且等高线呈椭圆形,曲面走势最为陡峭,表明因素bd之间的交互作用极为显著;如图10a和图10b可知,酶量一定,随着温度的升高,鹿血酶解肽水解度逐渐升高后降低,说明在此范围内鹿血酶解肽水解度存在极大点;且等高线呈椭圆形,表明因素cd之间交互作用显著。
采用designexpert10软件进行分析,得到的最优酶解条件为:ph10.43、酶解时间4.93h、酶解温度51.94℃、酶量4449.60u/g。水解度预测值为29.75%。考虑到实际操作的可能性,将试验条件修正为:ph10.4、酶解时间5h、酶解温度52℃,酶量4400u/g。在该修正条件下进行3次平行试验,平均值为28.98%,接近理论值,表明该数学模型可用于优化鹿血肽酶解过程。
实施例3:以lps诱导建立h9c2大鼠心肌细胞心力衰竭模型,研究鹿血酶解肽对其的保护作用。包括以下步骤:
(1)取一定量用纱布过滤好的新鲜鹿血,加入一定量的蒸馏水,配成底物浓度为5%的溶液。将配置好的溶液置于温度为52℃的恒温水浴锅内,用1mol/lnaoh或hcl维持ph恒定在10.4后加入4400u/g的碱性蛋白酶,反应过程中用1mol/lnaoh或hcl使ph值始终维持在10.4,酶解5h。酶解结束后,将酶解液调至ph值为中性,置于沸水浴中30min,将酶灭活。得到的酶解液迅速冷却,3800r/min条件下离心30min,弃掉沉淀,保留上清液。
(2)将所述步骤(1)中获得的上清液经过0.45μm滤膜微滤、1kda、3kda、10kda超滤膜超滤,采用超滤分离纯化方法得到分子总提液(dbp-1)、质量大于10kda的鹿血蛋白(dbp-2)、分子质量3kda~10kda鹿血多肽(dbp-3)、分子质量1kda~3kda鹿胎多肽(dbp-4)、分子质量小于1kda鹿血寡肽(dbp-5),冻干备用。
(3)取对数生长期的细胞,进行铺板实验。弃去培养液,用3mlpbs洗涤细胞2~3次,弃去pbs,加入适量的细胞消化液,待细胞消化完全,调密度为105/ml,每空100μl的混悬细胞液接种至96孔培养板上,放入37℃5%co2培养箱中培养24h,待生长至单层融合状态时分组实验。每组加入1μg/ml的脂多糖(lipopolysaccharides,lps)100μl造模,空白对照组除外,空白对照组加入100μl的dmem(改良型)10%胎牛血清;培养24h后,样品组加入100μl配好的25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml的样品溶液,阳性对照组为100μl的10μg/ml卡托普利,每组5个复孔。在37℃、5%co2条件下培养24h,弃去上清液,每孔加入5mg/ml的mtt10μl,4h后加入dmso100μl,振荡5min,于490nm波长处测其od值。计算细胞增殖抑制指数。细胞增殖抑制率(%)=[(a空白对照组﹣a给药组平均)/a给药组平均]×100%;表4为鹿血酶解肽对h9c2大鼠心肌细胞增殖抑制的影响;
表4各组细胞增殖抑制率测定结果(
注:#表示模型和空白组相比,*表示给药组和模型组相比*表示p<0.05;**表示p<0.01;***表示p<0.001
与空白组相比,lps模型组细胞显著增殖(p<0.001),证明lps模型造模成功;与lps模型组相比,各给药组均不同程度地降低h9c2大鼠心肌细胞的增殖,其中dbp-5组分活性最强。在25~200μg/ml质量浓度范围内,细胞增殖抑制指数随着样品浓度的增高而增高,呈现浓度依赖性,当浓度达到400μg/ml时,细胞增殖抑制指数开始下降,各样品组与模型组相比有显著性差异(p<0.001)。在200μg/ml质量浓度下,鹿血酶解肽抑制作用最为显著。综上所述鹿血酶解肽对h9c2大鼠心肌细胞增值抑制活性结果为:组分dbp-5、200μg/ml质量浓度下活性最强。
(4)将对数生长期细胞接种于96孔培养板,每孔体积200μl,密度为105个/孔,于37℃、5%co2培养箱中培养24h,待细胞贴壁后,弃去上清液,分别加入25、50、100、200、400μg/ml的dbp-5样品溶液150μl,设定空白组、模型组、阳性对照组,每组5个复孔。于37℃、5%co2条件下培养24h后,取上清液150μl,按tnf-α、il-6、il-1β试剂盒说明书测定tnf-α、il-6、il-1β的分泌量。图11、12、13为鹿血酶解肽对大鼠心肌细胞释放tnf-α、il-6、il-1β水平的影响;
由图11-图13可知鹿血酶解寡肽质量浓度为200μg/ml时,对大鼠心肌细胞的抑制作用最强。给药后大鼠心肌细胞上清液中tnf-α、il-6、il-1β含量均有不同程度的降低,在质量浓度达到200μg/ml时,上述3种细胞炎症因子释放量达到最低,证明鹿血酶解肽对心力衰竭模型的保护作用与其抑制炎症因子的释放密切相关,进一步验证鹿血酶解肽对lps诱导的h9c2大鼠心肌细胞心力衰竭模型具有保护作用。
实施例4:对鹿血酶解寡肽进行氨基酸分析
取酶解后的鹿血寡肽(dbp-5)冻干粉10mg,加入10ml6mol/l的盐酸,配成浓度为1mg/ml的溶液,110℃水解24h,氨基酸自动检测仪测定氨基酸组成,结果见表5。
表5鹿血酶解寡肽氨基酸组成及含量
由表5可知,鹿血酶解肽中含有17种氨基酸,其中lys含量在鹿血酶解肽氨基酸总含量中占比最高,占17.81%;其次是phe和ala、gly,分别占14.97%和10.32%、8.68%。人体必需氨基酸(lys、phe、val、leu、thr、ile、met)含量较高,占氨基酸总含量的52.78%。thr、ile、met低于人体必需氨基酸模式,其它几种必需氨基酸均高于或与人体模式相近。这表明鹿血具有较高的营养价值以及保健功能。
可以理解,本发明是通过一些实施例进行描述的,本领域技术人员知悉的,在不脱离本发明的精神和范围的情况下,可以对这些特征和实施例进行各种改变或等效替换。另外,在本发明的教导下,可以对这些特征和实施例进行修改以适应具体的情况及材料而不会脱离本发明的精神和范围。因此,本发明不受此处所公开的具体实施例的限制,所有落入本申请的权利要求范围内的实施例都属于本发明所保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!