一种适用于同时检测十一种病原菌的试剂盒及其检测方法与流程
1.本发明属于生物技术领域,具体涉及一种适用于同时检测十一种病原菌的试剂盒及其检测方法。
背景技术:
2.据世界卫生组织(world health organization,who)统计数据,全球因感染性疾病死亡的患者占因疾病死亡的患者的比例已经达到45%。在发展中国家,感染性疾病导致发病率和死亡率不断上升。由于国际贸易往来增加以及经济全球化态势,各种耐药的病原菌在全世界范围内广泛传播。我国人口众多,社区感染和医院感染发病率均居高不下,因感染造成的死亡率也较高。不同地区医院感染所致直接经济损失有较大差异,下呼吸道感染所致直接经济损失较大。感染为患者带来巨大的生理和心理双重痛苦,也给社会造成巨大的经济损失。根据中国细菌耐药监测网监测数据,2019年我国27个省市自治区36家三甲医院(30所综合性医院和6所儿童专科医院)临床分离获得249758株细菌,细菌性感染情况不容乐观。因此,对细菌性感染疾病的及时诊断是其疾病监控和有效治疗的关键。
3.目前常用的病原菌检测方法主要包括以下:培养法、血清学检测、分子生物学检测方法等。培养法目前仍然是细菌等病原体诊断的金标准。然而该方法存在以下缺点:(1)操作复杂繁琐:工作量巨大,消耗大量人工操作;(2)周期长:一般都需要3-7天或者更长时间;(3)灵敏度低:检测阳性率低且对样本的要求比较高;(4)检测效率低:仅能单个病原体培养,检测通量低。血清学检测是利用抗原与抗体的特异性反应原理进行检测,该方法是灵敏性低,仅反映人体免疫反应情况,而不能反映患者真实感染情况,仅可以用于回顾性调查,但对早期诊断意义不大。分子生物学方法主要是通过pcr的方法检测病原体特异性靶基因鉴定病原菌。常用的检测方法包括实时荧光定量pcr、rt-pcr等。尽管荧光pcr方法具有高特异性、敏感性和时效性,但也存在如下缺点:(1)通量低:受限于荧光通道,单次仅能检测几种病原体;(2)成本高:多种病原体同时检测,成本较高。
4.因此,亟需开发操作简单、准确度高、通量高、检测成本低,且可以针对同一份标本检测多种病原菌的检测技术,实现快速准确检测病原菌,可以大大提高检测效率、缩短检测周期、降低检测成本,具有显著的经济与社会效益,适用于临床检测、卫生防疫及流行病学调查等。
技术实现要素:
5.针对现有技术中所存在的问题,本发明的目的在于提供一种特异性强、灵敏度高、通量高、操作简单、检测成本低的检测多种病原菌的试剂盒及其检测方法。
6.为了实现上述目的,本发明采用如下技术方案:
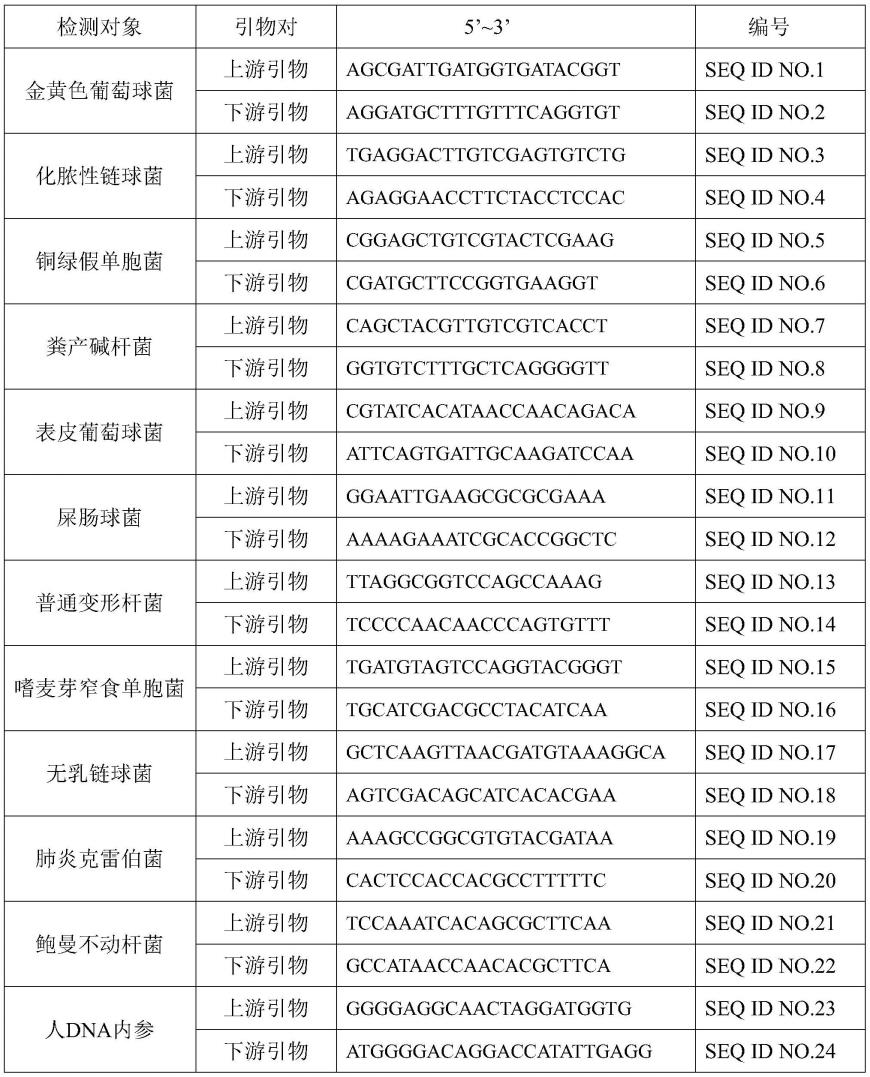
7.本发明的第一方面,提供一种适用于同时检测十一种病原菌的检测试剂,所述试剂包括金黄色葡萄球菌检测引物对、化脓性链球菌检测引物对、铜绿假单胞菌检测引物对、粪产碱杆菌检测引物对、表皮葡萄球菌检测引物对、屎肠球菌检测引物对、普通变形杆菌检
测引物对、嗜麦芽窄食单胞菌检测引物对、无乳链球菌检测引物对、肺炎克雷伯菌检测引物对、鲍曼不动杆菌检测引物对。
8.一种实施方式中,所述金黄色葡萄球菌检测引物对包括核苷酸序列如seq id no.1所示的上游引物和核苷酸序列如seq id no.2所示的下游引物。
9.一种实施方式中,所述化脓性链球菌检测引物对包括核苷酸序列如seq id no.3所示的上游引物和核苷酸序列如seq id no.4所示的下游引物。
10.一种实施方式中,所述铜绿假单胞菌检测引物对包括核苷酸序列如seq id no.5所示的上游引物和核苷酸序列如seq id no.6所示的下游引物。
11.一种实施方式中,所述粪产碱杆菌检测引物对包括核苷酸序列如seq id no.7所示的上游引物和核苷酸序列如seq id no.8所示的下游引物。
12.一种实施方式中,所述表皮葡萄球菌检测引物对包括核苷酸序列如seq id no.9所示的上游引物和核苷酸序列如seq id no.10所示的下游引物。
13.一种实施方式中,所述屎肠球菌检测引物对包括核苷酸序列如seq id no.11所示的上游引物和核苷酸序列如seq id no.12所示的下游引物。
14.一种实施方式中,所述普通变形杆菌检测引物对包括核苷酸序列如seq id no.13所示的上游引物和核苷酸序列如seq id no.14所示的下游引物。
15.一种实施方式中,所述嗜麦芽窄食单胞菌检测引物对包括核苷酸序列如seq id no.15所示的上游引物和核苷酸序列如seq id no.16所示的下游引物。
16.一种实施方式中,所述无乳链球菌检测引物对包括核苷酸序列如seq id no.17所示的上游引物和核苷酸序列如seq id no.18所示的下游引物。
17.一种实施方式中,所述肺炎克雷伯菌检测引物对包括核苷酸序列如seq id no.19所示的上游引物和核苷酸序列如seq id no.20所示的下游引物。
18.一种实施方式中,所述鲍曼不动杆菌检测引物对包括核苷酸序列如seq id no.21所示的上游引物和核苷酸序列如seq id no.22所示的下游引物。
19.本发明的第二方面,提供一种上述检测试剂用于制备同时检测十一种病原菌的检测试剂盒中的用途。
20.本发明的第三方面,提供一种同时检测十一种病原菌的检测试剂盒,所述试剂盒中包括上述检测试剂。
21.本发明的试剂盒采用多重pcr技术在单管中同时进行十一种病原菌的检测,根据扩增及检测情况可分析判断金黄色葡萄球菌、化脓性链球菌、铜绿假单胞菌、粪产碱杆菌、表皮葡萄球菌、屎肠球菌、普通变形杆菌、嗜麦芽窄食单胞菌、无乳链球菌、肺炎克雷伯菌、鲍曼不动杆菌感染情况。因此,引物的设计是本发明试剂盒的关键。
22.基于本发明所述试剂盒是采用多重pcr技术来进行检测的,所以试剂盒中还可以包括其他一些pcr所需要的常规试剂,如:master mix、样品基因组提取试剂中的一种或多种。由于此类pcr常用试剂均可经市场途径单独购得或者自行配置,因此具体需要将哪些试剂装配入试剂盒,可以根据客户实际需要配置,为方便起见,也可全部装配入试剂盒。
23.检测时的pcr反应体系中,引物、master mix均为常见组分,其含量亦为常规。
24.所述pcr反应体系可自行配置,也可直接以市售的不含引物的通用pcr反应液加入引物获得。例如,所述试剂盒中还可以在master mix中,加入本发明的引物、待检样本即可
获得pcr反应体系。
25.进一步地,所述试剂盒还包括人dna内参扩增引物对。所述人dna内参扩增引物对包括核苷酸序列如seq id no.23所示的上游引物和核苷酸序列如seq id no.24所示的下游引物。
26.进一步地,所述试剂盒还可以含有阳性质控品。所述阳性质控品为含目标病原体特异核酸片段和人内参特异核酸片段的puc57质粒dna。可单独市购或根据现有技术自行构建。
27.进一步地,所述试剂盒还可以含有阴性质控品。所述阴性质控品为te缓冲液。可单独市购或根据现有技术自行配置。
28.本发明的第四方面,提供了前述检测试剂盒的使用方法,包括如下步骤:
29.(1)提取样品基因组dna;
30.(2)加样:将样品基因组dna、阳性质控品或阴性质控品分别加入装有pcr反应体系的pcr管中,获得对应的样品反应管、阳性反应管或阴性反应管,所述pcr反应体系中含有前述检测引物对;
31.(3)pcr反应:反应管置于pcr仪上,设置循环参数,进行pcr反应;
32.(4)pcr反应结束后,分析结果。
33.步骤(1)中,提取样品基因组dna为现有技术。
34.优选地,步骤(3)中,pcr反应的条件设置为:98℃10min循环1次;98℃10sec、60℃10sec、72℃30sec、循环35次;72℃5min循环1次;4℃∞循环1次。
35.本发明的第三方面,提供了前述试剂盒在制备病原菌检测产品中的用途。
36.与现有技术相比,本发明具有如下有益效果:
37.采用本发明的技术方案,可以检测并鉴定十一种病原菌,该方法操作简单、检测准确、灵敏高,特异性高,显著缩短检测时间,可以实现2-3小时内可出检测结果。人dna内参可以确保在检测过程中对核酸质量进行质控,避免因核酸样本不合格导致假阴性的问题。多重pcr和片段分析法相结合,保证检测的通量且成本较低,适合疾控中心、医院及其它医疗机构使用。
附图说明
38.图1为本发明具体实施方式中的粪产碱杆菌的毛细电泳分离结果图。
39.图2为本发明具体实施方式中的普通变形杆菌的毛细电泳分离结果图。
40.图3为本发明具体实施方式中的阳性质控品的毛细电泳分离结果图。
41.图4为本发明实施例3特异性分析结果。
42.图5为本发明对比例2中引物对1的扩增效果。
43.图6为本发明对比例2中引物对2的扩增效果。
44.图7为本发明对比例2中引物对3的扩增效果。
具体实施方式
45.在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体
实施方案,而不是为了限制本发明的保护范围。
46.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
47.实施例1试剂盒的制备及使用方法
48.分别合成金黄色葡萄球菌检测引物对、化脓性链球菌检测引物对、铜绿假单胞菌检测引物对、粪产碱杆菌检测引物对、表皮葡萄球菌检测引物对、屎肠球菌检测引物对、普通变形杆菌检测引物对、嗜麦芽窄食单胞菌检测引物对、无乳链球菌检测引物对、肺炎克雷伯菌检测引物对、鲍曼不动杆菌检测引物对,其核苷酸序列如下表1所示。各检测引物物对可单独包装,也可以组合配成多重pcr检测混合液。所述多重pcr检测混合液中,上述各引物对的量采用本领域技术人员所知悉的常规用量即可。
49.也就是说,本发明的试剂盒,可以是含有独立包装的各组引物对,也可以是含有配置好的含有各组引物对的多重pcr检测混合液。
50.进一步地,所述试剂盒还可以含有人dna内参扩增引物对,其核苷酸序列如下表1所示。
51.进一步地,所述试剂盒还可以含有阳性质控品。所述阳性质控品为含目标病原体特异核酸片段和人内参特异核酸片段的puc57质粒dna。
52.进一步地,所述试剂盒还可以含有阴性质控品。所述阴性质控品为te缓冲液。
53.进一步地,所述试剂盒还可以含有master mix、样品基因组提取试剂等。所述master mix可购于invitrogen公司。
54.表1
[0055][0056]
实施例2试剂盒的检测效果评价
[0057]
本发明实施例中提供一种本试剂盒的具体使用方式,将表1中序列所示的各检测引物对、人dna内参扩增引物对、与购于invitrogen公司的master mix,混合均匀,获得pcr反应液。
[0058]
1、采集患者样品(痰液、尿液、脑脊液、胸水、腹水、穿刺液等样本),提取样本中病原菌dna,获得待测dna样本。
[0059]
2、pcr反应体系配制与检测
[0060]
(1)根据检测需求设置排版方式,根据排版将pcr反应液加入8联管或96孔板中,每孔加17.5μl,并往反应孔中分别依次加入2.5μl的阴性质控品(te缓冲液)、待测dna样本和阳性质控品(含目标病原体特异核酸片段和人内参特异核酸片段的puc57质粒dna),盖好盖
子。
[0061]
(2)充分混匀并离心。
[0062]
(3)上述配制好的试剂进行反应。
[0063]
3、设置pcr程序
[0064]
(1)按照pcr仪操作说明书设置pcr程序,pcr反应扩增条件见下表2。
[0065]
表2
[0066][0067]
(2)pcr扩增结束后,将pcr扩增板/管进行短暂离心,然后小心打开管盖,加矿物油密封,使用核酸片段分析仪进行检测。
[0068]
4、结果分析
[0069]
通过检测反应产物片段大小判断样本检测结果。阴性对照管中应无反应产物片段。否则,此次实验结果无效,重新检测。阳性质控品检测反应体系中,在75-80bp和下表所示范围内各有一反应产物片段,否则此次实验结果无效,重新检测。对于样本检测反应体系,在75-80bp范围内应有内参反应产物片段,否则,此次实验结果无效,重新检测。若样本检测结果为阳性,根据反应产物信号强度和对应片段大小,判断出所感染的病原体类型。整个检测流程约为2-3小时。
[0070]
参见图1至图3所示的实验检测数据,各病原体对应的片段大小值见下表3。
[0071]
表3
[0072]
病原体种类片段大小金黄色葡萄球菌92-97bp化脓性链球菌128-134bp铜绿假单胞菌140-146bp粪产碱杆菌160-165bp表皮葡萄球菌182-190bp屎肠球菌241-249bp普通变形杆菌272-279bp嗜麦芽窄食单胞菌291-300bp无乳链球菌322-330bp肺炎克雷伯菌350-361bp鲍曼不动杆菌380-393bp人dna内参75-80bp
[0073]
实施例3试剂盒的灵敏度和特异性分析
[0074]
灵敏度分析:
[0075]
分别对金黄色葡萄球菌、化脓性链球菌、铜绿假单胞菌、粪产碱杆菌、表皮葡萄球菌、屎肠球菌、普通变形杆菌、嗜麦芽窄食单胞菌、无乳链球菌、肺炎克雷伯菌、鲍曼不动杆菌的核酸进行梯度稀释,浓度分别为1
×
106copies/ml、1
×
105copies/ml、1
×
104copies/ml、1
×
103copies/ml、1
×
102copies/ml和10copies/ml,每个梯度稀释液重复3-5份样本,利用与实施例2中相同的,确定的十一种病原菌多重pcr检测体系,进行多重pcr扩增和片段分析检测,直至检测不到信号,每份进行20次的重复检测,以90-95%的阳性检出率水平作为最低检测下限(lod),即为灵敏度。
[0076]
相关病原菌株如下:
[0077]
表4
[0078][0079][0080]
本发明试剂盒的检测灵敏度,如下表所示:
[0081]
表5
[0082]
检测指标lod(copies/ml)金黄色葡萄球菌1000化脓性链球菌1000铜绿假单胞菌100粪产碱杆菌1000表皮葡萄球菌100屎肠球菌100普通变形杆菌100嗜麦芽窄食单胞菌100
无乳链球菌1000肺炎克雷伯菌100鲍曼不动杆菌100
[0083]
特异性分析:
[0084]
本发明建立的检测方法的特异性主要表现特异性引物的特异性。设计的引物都经过blast比对分析,具有高度保守性和特异性,能特异性区分种属相近的细菌。为了确定检测方法的特异性,选择以下十种无关病原菌株作为模拟干扰样本,所有病原菌株购于广东省微生物菌种保藏中心和中国医学菌种保藏中心,将不同的病原菌株提取核酸后检测,浓度为10ng/μl,将以上得到的每种样本的总核酸与等量的人内参对照质粒(puc57)混合,作为模板进行多重pcr扩增和片段分析,验证本发明试剂盒引物设计的特异性。
[0085]
相关病原菌株如下:
[0086]
表6
[0087]
病原菌株来源肺炎链球菌atcc49619粪肠球菌atcc29212奇异变形杆菌cmcc49005粘质沙雷氏菌atcc 8100大肠埃希菌atcc25922阴沟肠杆菌atcc13047产气肠杆菌atcc13048流感嗜血杆菌atcc49766脆弱类杆菌atcc25285产酸克雷伯菌atcc49131
[0088]
结果如图4显示,十种无关病原体的总核酸与等量的人内参对照质粒(puc57)为模板进行的多重pcr和片段分析,仅能扩增出75bp的人内参条带,无其他扩增条带。从以上数据可以看出,本发明试剂盒对这些微生物的检测结果都为阴性,证明本发明试剂盒与其他微生物之间没有交叉反应,体现试剂盒检测病原体的特异性强。
[0089]
实施例4试剂盒应用于临床样本检验
[0090]
1、检测方法
[0091]
应用本发明实施例2中相同试剂检测“金标准”细菌培养方法测定的样本100例,包含金黄色葡萄球菌阳性样本10例,化脓性链球菌阳性样本8例,铜绿假单胞菌阳性样本5例,粪产碱杆菌阳性样本1例,表皮葡萄球菌阳性样本5例,屎肠球菌阳性样本5例,普通变形杆菌阳性样本4例,嗜麦芽窄食单胞菌阳性样本5例,无乳链球菌阳性样本6例,肺炎克雷伯菌阳性样本5例和鲍曼不动杆菌阳性样本12例。
[0092]
2、检测结果
[0093]
与细菌培养方法对比,本发明试剂盒阳性检出率为100%,一致性高,未出现漏检情况,结果具有统计学意义。本发明专利试剂盒检测临床样本与金标准细菌培养方法比较,无明显差异,但是在多重检测、操作时间短、操作简单等方面具有明显的优势。
[0094]
对比例1
[0095]
按照实施例1的方法制备对比引物组1-12,见下表7。
[0096][0097]
区别仅在于,将实施例1的引物组中seq id no.1-2所示的引物替换为seq id no.25-26所示的引物获得对比引物组1。将实施例1的引物组中seq id no.3-4所示的引物替换为seq id no.27-28所示的引物获得对比引物组2。将实施例1的引物组中seq id no.5-6所示的引物替换为seq id no.29-30所示的引物获得对比引物组3。将实施例1的引物组中seq id no.7-8所示的引物替换为seq id no.31-32所示的引物获得对比引物组4。将实施例1的引物组中seq id no.9-10所示的引物替换为seq id n.33-34所示的引物获得对比引物组5。将实施例1的引物组中seq id no.11-12所示的引物替换为seq id no.35-36所示的引物获得对比引物组6。将实施例1的引物组中seq id no.13-14所示的引物替换为seq id no.37-38所示的引物获得对比引物组7。将实施例1的引物组中seq id no.15-16所
示的引物替换为seq id no.39-40所示的引物获得对比引物组8。将实施例1的引物组中seq id no.17-18所示的引物替换为seq id no.41-42所示的引物获得对比引物组9。将实施例1的引物组中seq id no.19-20所示的引物替换为seq id no.43-44所示的引物获得对比引物组10。将实施例1的引物组中seq id no.21-22所示的引物替换为seq id no.45-46所示的引物获得对比引物组11。将实施例1的引物组中seq id no.23-24所示的引物替换为seq id no.47-48所示的引物获得对比引物组12。将实施例1的引物组中seq id no.1-24所示的引物替换为seq id no.25-48所示的引物获得对比引物组13。
[0098]
最低检出限验证按照实施例3的方法进行最低检出限验证。实施例3与对比例的最低检出限对比如下表8。
[0099]
检测指标实施例3,lod(copies/ml)对比例,lod(copies/ml)金黄色葡萄球菌10005000化脓性链球菌10001000铜绿假单胞菌1001000粪产碱杆菌10001000表皮葡萄球菌1001000屎肠球菌100100普通变形杆菌1001000嗜麦芽窄食单胞菌1001000无乳链球菌10001000肺炎克雷伯菌1001000鲍曼不动杆菌100100
[0100]
由表8可知,对于样本中痕量的金黄色葡萄球菌、铜绿假单胞菌、表皮葡萄球菌、普通变形杆菌、嗜麦芽窄食单胞菌、肺炎克雷伯菌的核酸,本公开试剂盒比对比例有更强的检测能力。
[0101]
特异性验证按照实施例3的方法进行特异性验证。结果显示,对比例的引物对的反应结果均为阴性。
[0102]
由实施例3和对比例的对比可以看出,本公开可以一次性检测出金黄色葡萄球菌、化脓性链球菌、铜绿假单胞菌、粪产碱杆菌、表皮葡萄球菌、屎肠球菌、普通变形杆菌、嗜麦芽窄食单胞菌、无乳链球菌、肺炎克雷伯菌、鲍曼不动杆菌的十一种病原菌,敏感性高,特异性高,最低检出限更低,覆盖度更广。
[0103]
对比例2
[0104]
本对比例以金黄色葡萄球菌为例,展示了在研发过程中发现的部分效果不理想的引物。金黄色葡萄球菌引物序列及筛选:对3组引物组合,先用单重pcr扩增筛选引物扩增效果,单重检测结果发现引物对3扩增效率较低,引物对1和2可以基本满足后续实验需要(如图5-图7所示),需要加入多重pcr法中做进一步验证。将引物对1和2分别加入多重pcr体系中进行扩增,检测结果如下:
[0105]
引物对1
[0106]
f-1:agcgattgatggtgatacggt(seq id no.49)
[0107]
r-1:tttaggatgctttgtttcaggtg(seq id no.50)
[0108]
引物对2
[0109]
f-2:agcgattgatggtgatacggt(seq id no.51)
[0110]
r-2:aggatgctttgtttcaggtgt(seq id no.52)
[0111]
引物对3
[0112]
f-3:agcgattgatggtgatactgt(seq id no.53)
[0113]
r-3:tttaggatgtttcgtttcaggcg(seq id no.54)
[0114]
引物对1加入多重pcr体系检测结果:引物对金黄色葡萄球菌扩增效率变低,可能和其他引物对之间有竞争抑制或者有引物二聚体导致该引物对扩增效率降低,从而影响后续检测的需求。引物对2加入多重pcr体系检测结果:各病原菌引物对扩增效率基本无改变。从多方面综合考虑,选择引物对2为金黄色葡萄球菌在多重pcr检测体系中的引物对,该体系经过反复验证,满足检测要求。
[0115]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1