一种遗传毒性物质的高通量筛查方法
1.本发明涉及遗传毒性高通量筛查的技术领域,特别涉及一种遗传毒性物质的高通量筛查方法。
背景技术:
2.近年来发现,在药物,农药和染料的生产过程中,一定量具有遗传毒性的化合物如硝基多环芳烃(npah)、含硝基农药、酚类等不受控制地排入空气,土壤和水体中,对生态环境和人体健康构成潜在风险。部分含硝基化合物会在人体中经历多种酶系统的代谢,以激活其生物活性,并对人体细胞造成不可逆转的遗传损害。因此,对这类胁迫因子的检测也越来越有必要。
3.目前,可用于筛查含硝基化合物遗传毒性的主要方法包括鼠伤寒沙门氏菌回复突变试验(reverse mutation test of salmonella typhi munine,又称ames试验)和sos/umu试验。然而,鼠伤寒沙门氏菌是一种危害较大的人畜共患病病原菌,会引起急性肠胃炎、小肠结肠炎、伤寒、副伤寒、败血症等病症,导致实验安全性较差。上述检测方法通常具有操作繁杂、检测时间长、无法实现高通量、需要严格的无菌操作等不利于推广的因素。并且由于专利保护等原因,个别检测方法并不利于国内推广,限制了其广泛使用。
技术实现要素:
4.为了克服现有技术的缺点与不足,本发明的目的在于提供一种遗传毒性物质的高通量筛查方法。该筛查方法操作便利、耗时短、无需额外添加化学试剂、不受色素干扰,易于实现高通量样品检测。
5.本发明的目的通过下述技术方案实现:
6.本发明所提供一种遗传毒性物质的高通量筛查方法,包括以下步骤:
7.步骤一:将编码硝基还原酶基因、编码o
‑
乙酰转移酶基因、dna损伤检测响应元件和噬菌体裂解基因插入到大肠杆菌表达载体,得到重组载体;并将该重组载体转入到大肠杆菌,得到重组大肠杆菌;
8.步骤二:利用上述重组大肠杆菌制备大肠杆菌检测液,将大肠杆菌检测液与待测样品在微孔板中孵育,大肠杆菌细胞裂解;同时添加同体积纯溶剂的大肠杆菌检测液作对照;通过吸光度计算菌体存活率,实现高通量检测;
9.或者,
10.步骤三:通过大肠杆菌存活率、重组大肠杆菌存活率,计算相对存活率,实现高通量检测;
11.相对存活率(%)=b/a*100%;其中,a
‑
大肠杆菌存活率,b
‑
重组大肠杆菌存活率。
12.所述的重组载体,构造元件如图1。
13.所述重组载体中,自5
′
至3
′
端依次为编码硝基还原酶基因、编码o
‑
乙酰转移酶基因、dna损伤检测响应元件和噬菌体裂解基因。
14.所述编码硝基还原酶基因,可为任意一种编码硝基还原酶基因,优选为sgsc1412鼠伤寒沙门氏菌的编码硝基还原酶基因nfsb,其基因序列为seq id no.1;硝基还原酶的氨基酸序列为seq id no.5。
15.所述编码o
‑
乙酰转移酶基因,可为任意一种编码o
‑
乙酰转移酶基因,优选为sgsc1412鼠伤寒沙门氏菌的编码o
‑
乙酰转移酶基因nhoa,其基因序列为seq id no.2;o
‑
乙酰转移酶的氨基酸序列为seq id no.6。
16.优选的,所述dna损伤检测响应元件的核苷酸序列为seq id no.3。
17.所述的噬菌体裂解基因,可为任意一种噬菌体裂解基因,优选为lambda噬菌体的裂解基因srrz,其基因序列为seq id no.4。
18.步骤二中,所述的微孔板可选自96孔板、48孔板、24孔板等。
19.步骤二中,所述的孵育的时间优选为15~60min;进一步为20min。
20.步骤二中,所述的吸光度是在600nm处的光吸收值,可记为od
600
。
21.步骤二中,具体包括如下步骤:
22.(1)利用所述的重组大肠杆菌制备大肠杆菌检测液;
23.(2)将待测样品与大肠杆菌检测液在微孔板中混合,同时添加同体积纯溶剂的大肠杆菌检测液作对照;两组样品均继续培养15~60min;
24.(3)将与待测样品混合的大肠杆菌检测液与对照组的大肠杆菌检测液分别测得od
600
;
25.(4)计算存活率,根据存活率标准曲线计算待测样品的遗传毒性程度。
26.所述大肠杆菌检测液的制备步骤如下:
27.1)将重组大肠杆菌储藏物用lb固体培养基进行培养,使其复苏活化;
28.2)将得到的活化大肠杆菌单菌落接入到lb液体培养基中进行震荡培养至对数生长期后期,得到饱和菌液;
29.3)将得到的饱和菌液以1∶100体积比接种到新鲜的lb液体培养基中,培养至菌液od
600
为0.1~0.4,加入iptg至终浓度为0.01~0.2mm,诱导培养,得到大肠杆菌检测液。
30.步骤3)中,所述的诱导培养的时间优选为1~1.5h。
31.所述大肠杆菌表达载体可为任意一种大肠杆菌载体,如pbluescript,puc18,puc19,pet系列载体(如pet30a(+))等。以puc18为出发载体,构建的大肠杆菌裂解载体为pustba。
32.所述的大肠杆菌,为e.coli bl21(de3),e.coli dh5a,e.coli xl1
‑
blue或e.coli hb101。
33.所述的遗传毒性物质可为含硝基化合物,具体为1
‑
硝基萘(1
‑
nn)、2
‑
硝基芴(2
‑
nf)和5
‑
硝基苊(5
‑
na)等中的至少一种;
34.所述菌体存活率的标准曲线如下:
[0035]1‑
nn,y=54.37+(97.81
‑
54.37)/{1+10
(17.74
‑
log x)
×
(
‑
0.1095)
},r2=0.99(2≤x≤170);
[0036]2‑
nf,y=66.13+(100.2
‑
66.13)/{1+10
(1.117
‑
log x)
×
(
‑
3.676)
},r2=0.99(0.5≤x≤2.5);
[0037]5‑
na,y=65.39+(100.8
‑
65.39)/{1+10
(2.586
‑
log x)
×
(
‑
0.5784)
},r2=0.99(0.125≤x≤
15)。
[0038]
其中,x表示遗传毒性物质的浓度(μmol/l),y表示菌体存活率(%),r2表示曲线拟合相关系数。
[0039]
所述的遗传毒性物质还可为常用农药,为有机磷酸酯类、苯胺类(异菌脲除外)、酰胺类、甲酸盐类、叔丁硫基类、酚类、微生物类的农药等中的至少一种;具体为:敌百虫、敌敌畏
‑
氯氰菊酯、草铵膦、吡虫啉、灭蝇胺、二甲戊灵、联苯
‑
噻虫嗪、腐霉
‑
福美双、唑醚
‑
代森锌、多菌灵、甲氨基阿维菌素苯甲酸盐、哒螨灵、阿维
‑
丁醚脲、复硝酚钠和阿维菌素中的至少一种。
[0040]
含有所述重组载体的重组大肠杆菌也属于本发明的保护范围。
[0041]
本发明相对于现有技术具有如下的优点及效果:
[0042]
(1)操作对象为大肠杆菌,无致病风险,操作简便易行。
[0043]
(2)测试周期短,2h内可检测完成。
[0044]
(3)检测过程无需添加额外试剂(如酶底物等),成本低廉。
[0045]
(4)检测灵敏度高,对1
‑
nn、2
‑
nf、5
‑
na敏感浓度范围分别为在2~170、0.5~2.5、0.125~15μmol/l条件下敏感。
[0046]
(5)可实现高通量筛查,检测效率高,省时省力。
附图说明
[0047]
图1是实施例1中遗传毒性检测载体构建示意图。
[0048]
图2是实施例2中重组大肠杆菌(e.coli bl21(de3)/pustba)对1
‑
nn、2
‑
nf、5
‑
na不同具有遗传毒性的含硝基化合物的裂解响应图。
[0049]
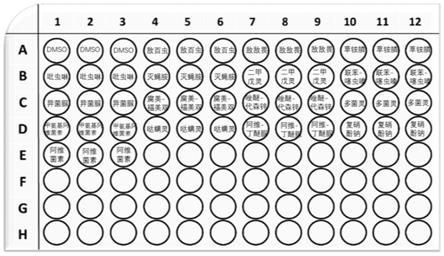
图3是实施例3中常用农药在96孔板中的实验方案示意图。
具体实施方式
[0050]
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
[0051]
下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。所使用的材料、试剂等,如无特殊说明,为从商业途径得到的试剂和材料。
[0052]
实施例1遗传毒性检测载体构建
[0053]
以puc18为出发载体,构建遗传毒性检测载体pust。具体构建方法如下:
[0054]
1.合成dna损伤检测响应元件p
umu
(seq id no.3)和t7终止子序列,在p
umu
上游添加xbai位点,下游添加spei酶切位点;在t7终止子上游添加ecori位点,下游添加smai酶切位点,记为t7t。
[0055]
2.以lambda噬菌体基因组dna为模板,扩增srrz基因(seq id no.4)。在srrz基因的上下游分别添加spei、ecori酶切位点。
[0056]
3.采用生物积木(biobricks)方法,采用酶切、连接方法将各元件按照启动子p
umu
‑
裂解基因srrz
‑
t7终止子顺序连接,插入到puc18载体中,得到遗传毒性响应载体pust。
[0057]
4.合成t7启动子和t7终止子序列,在t7启动子上游添加kpni酶切位点,下游添加
bamhi酶切位点,记为t7
‑
1;在另一个t7启动子上游添加smai酶切位点,下游添加psti酶切位点,记为t7
‑
2;在t7终止子上游添加xhoi酶切位点,在下游添加ndei酶切位点,记为t7t
‑
1。
[0058]
5.以sgsc1412鼠伤寒沙门氏菌基因组dna为模板,分别扩增nfsb基因(seq id no.1)和nhoa基因(seq id no.2)。在nfsb基因的上游添加bamhi酶切位点,下游添加smai酶切位点,在nhoa基因的上游添加psti酶切位点,在下游添加xhoi酶切位点。
[0059]
6.采用生物积木(biobricks)方法,采用酶切、连接方法将各元件按照启动子
‑
nfsb
‑
启动子
‑
nhoa
‑
终止子顺序连接,插入到pust载体中,得到遗传毒性检测载体pustba。载体构建示意图如图1所示。
[0060]
7.将载体pustba或pust转入到e.coli bl21(de3)感受态细胞,获得遗传毒性物质检测用的重组大肠杆菌e.coli bl21(de3)/pustba或e.coli bl21(de3)/pust。
[0061]
实施例2硝基化合物遗传毒性测试
[0062]
存活率的计算
[0063]
大肠杆菌检测液接触待测样品后20min,分别测定各测试菌液在600nm处的光吸收值(od
600
)。
[0064]
存活率(%)=b/a*100%
[0065]
其中,a
‑
添加二甲基亚砜的菌液od
600
[0066]
b一添加待测样品的菌液od
600
。
[0067]
1.重组大肠杆菌的复苏活化
[0068]
将重组大肠杆菌e.coli bl21(de3)/pustba从
‑
80℃冰箱中取出,并划线于lb平板培养基中,在37℃条件下恢复培养14h。挑取单菌落,接种至lb培养液中,在37℃、250rpm条件下培养12~16h,得到饱和菌液。
[0069]
2.大肠杆菌检测液制备
[0070]
将复苏活化的饱和菌液以1∶100体积比例接种至新鲜lb培养基,以190μl体积量加入到96孔培养板中,在35~38℃,600~1000rpm条件下培养至od
600
到0.1~0.4,加入iptg至终浓度为0.01~0.2mm,诱导培养用时约1~1.5h,得到大肠杆菌检测液。
[0071]
3.与待测样品接触
[0072]
配制一定浓度梯度含有硝基化合物(1
‑
nn、2
‑
nf或5
‑
na)的溶液作为待测样品;其中,含1
‑
nn的溶液中1
‑
nn的浓度梯度为2、6、20、58、170μmol/l;含2
‑
nf的溶液中2
‑
nf的浓度梯度为0.5、0.75、1、1.5、2、2.5μmol/l;含5
‑
na的溶液中5
‑
na的浓度梯度为0.125、0.63、1.25、3.5、15μmol/l。
[0073]
将待测样品10μl加入到上述96孔板内,在35~38℃,800rpm条件下继续培养20分钟,设置3个平行组。同时设置添加相同体积的纯溶剂(二甲基亚砜),和相同体积、相同浓度的样品至重组型e.coli bl21(de3)/pust菌株和野生型e.coli bl21(de3)菌株作为阴性对照。
[0074]
4.实验结果表明,在该饱和浓度(170μmol/l 1
‑
nn、2.5μmol/l 2
‑
nf、15μmol/l 5
‑
na)条件下,遗传毒性响应载体pust中缺乏编码硝基还原酶基因(nfsb)和o
‑
乙酰转移酶基因(nhoa)的重组型e.coli bl21(de3)/pust菌株以及不含遗传毒性响应载体的野生型e.coli bl21(de3)菌株生长正常,未发生菌体裂解。然而,e.coli bl21(de3)/pustba菌株
呈现不同程度的裂解。本实施例中检测结果如图2所示,各硝基化合物检测的标准曲线对应为:
[0075]1‑
nn,y=54.37+(97.81
‑
54.37)/{1+10
(17.74
‑
log x)
×
(
‑
0.1095)
},r2=0.99(2≤x≤170);
[0076]2‑
nf,y=66.13+(100.2
‑
66.13)/{1+10
(1.117
‑
log x)
×
(
‑
3.676)
},r2=0.99(0.5≤x≤2.5);
[0077]5‑
na,y=65.39+(100.8
‑
65.39)/{1+10
(2.586
‑
log x)
×
(
‑
0.5784)
},r2=0.99(0.125≤x≤15)。
[0078]
其中,x表示遗传毒性物质的浓度(μmol/l),y表示菌体存活率(%),r2表示曲线拟合相关系数。
[0079]
该结果表明,在检测浓度范围内,样品浓度与菌体存活率成剂量相关性。因此,可以用该菌株e.coli bl21(de3)/pustba对含硝基化合物样品是否具有遗传毒性进行检测。
[0080]
实施例3常用农药遗传毒性高通量筛查
[0081]
本实施例拟常用农药进行遗传毒性筛查,以菌体存活率为标准指标。对应的检测农药的遗传毒性程度,可反映为相对存活率大小。
[0082]
相对存活率(%)=b/a*100%
[0083]
其中,a
‑
野生型e.coli bl21(de3)菌株存活率
[0084]
b
‑‑
e.coli bl21(de3)/pustba存活率
[0085]
1.按照实施例2步骤1
‑
2制备e.coli bl21(de3)/pustba检测菌液、e.coli bl21(de3)/pust检测菌液、及野生型e.coli bl21(de3)检测菌液。
[0086]
2.取待测农药按一定比例分别溶于二甲基亚砜,稀释比例见表1。参照实施例2,在96孔板中,将待测农药与大肠杆菌检测液混合,同时添加同体积纯溶剂(二甲基亚砜)的大肠杆菌检测液做对照;两组样品均继续培养20min。所述农药均采购自东莞某农药店。
[0087]
3.实验方案如图3所示。
[0088]
4.将与待测农药混合的大肠杆菌检测液与对照组的大肠杆菌检测液分别测得od
600
。
[0089]
5.计算相对存活率,所得结果如表1所示。
[0090]
表1常用农药的相对存活率
[0091][0092]
表1结果表明,所筛查的含硝基化合物农药均具有一定的遗传毒性,蚍虫啉、二甲戊灵、联苯
‑
噻虫嗪和复硝酚钠诱导的e.coli bl21(de3)/pustba相对存活率为53%~89%,均低于缺乏编码硝基还原酶(nfsb)和o
‑
乙酰转移酶(nhoa)的e.coli bl21(de3)/pust相对存活率。有机磷酸酯类、苯胺类、酰胺类(异菌脲除外)、甲酸盐类、叔丁硫基类、酚类和微生物类的农药中,均含有一定的遗传毒性,其中敌百虫、草铵膦、腐霉
‑
福美双、哒螨灵、阿维菌素诱导的e.coli bl21(de3)/pustba相对存活率仅有70%以下,而e.coli bl21(de3)/pust相对存活率均在90%以上。
[0093]
上述检测结果表明,包含有本发明所述含硝基化合物的遗传毒性筛查方法,在响应浓度范围内对待测物进行检测,最终以相对细胞存活率表示待测样品的遗传毒性含量,并在96孔板中可实现高通量筛查。该方法无致病风险,操作简单、检测灵敏度高、省时省力、易于推广。
[0094]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1