MAdCAM靶向的免疫耐受的制作方法
madcam靶向的免疫耐受
1.相关申请的交叉引用
2.本技术要求于2019年5月20日提交的美国临时申请号62/850,172的优先权,其通过援引以整体并入本文。
3.本技术还涉及于2018年8月23日提交的美国临时申请号62/721,644、于2018年5月24日提交的美国临时申请号62/675,972、于2017年12月6日提交的美国临时申请号62/595,357、于2017年12月6日提交的美国临时申请号62/595,348、于2018年8月23日提交的美国非临时申请号16/109,875、于2018年8月23日提交的美国非临时申请号16/109,897、于2018年5月24日提交的美国非临时申请号15/988,311、于2018年5月24日提交的pct申请号pct/us2018/034334以及于2018年11月28日提交的pct/us2018/062780,其各自通过援引以整体并入本文。
技术领域
4.本文提供的实施方式涉及例如用于局部或靶向免疫赦免的方法和组合物。
背景技术:
5.有害的免疫应答的实例(例如在移植组织的排斥中或在自身免疫性疾患中)构成了全世界数百万人的主要健康问题。器官移植的长期结果通常以慢性排斥和移植器官的最终衰竭为特征。已知超过20种自身免疫性疾患,基本上影响身体的每个器官,并且仅在北美就影响超过5000万人。在这两种情况下用于对抗致病性免疫应答的广泛活性免疫抑制药物都有严重的副作用。
技术实现要素:
6.本文公开了提供位点特异性免疫赦免的方法和治疗化合物。本文公开的实施方式通过援引并入本部分。
7.在一些实施方式中,治疗化合物包括工程化的多特异性化合物,例如工程化的双特异性分子,例如工程化的双特异性抗体分子,包括:
8.1)选自以下的特异性靶向部分:
9.a)供体特异性靶向部分,其例如优先结合供体靶标(同与接受者抗原的结合相比优先),并且可用于为来自供体的移植组织(例如器官)提供位点特异性免疫赦免;或
10.b)组织特异性靶向部分,其例如优先地结合受试者靶组织(与受试者非靶组织相比优先),并且可用于为遭受不必要的免疫攻击的受试者组织(例如,在自身免疫性疾患中)提供位点特异性免疫赦免;和
11.2)选自以下的效应物结合/调节部分:
12.(a)免疫细胞抑制性分子结合/调节部分(在本文中称为icim结合/调节部分);
13.(b)免疫抑制性免疫细胞结合/调节部分(在本文中称为iic结合/调节部分);
14.(c)作为治疗化合物的一部分促进免疫抑制性局部微环境的效应物结合/调节部
分,例如通过在靶标附近提供抑制或最小化免疫系统对靶标的攻击的物质(在本文中称为sm结合/调节部分);或
15.(d)免疫细胞刺激分子结合/调节部分(在本文中称为icsm结合/调节部分),其中icsm通过例如阻断共刺激分子与其反结构之间的相互作用来抑制免疫激活。
16.效应物结合/调节部分可以属于类别a、b和c中的多于一类。例如,如下所示的,ctla4结合分子属于类别a和b两者。
17.在一些实施方式中,治疗化合物包括icim结合/调节部分。在一些实施方式中,icim结合/调节分子结合并激动抑制性分子,例如抑制性免疫检查点分子,或以其他方式抑制或降低免疫细胞(例如细胞毒性t细胞、b细胞、nk细胞或骨髓细胞例如中性粒细胞或巨噬细胞)的活性。
18.在一些实施方式中,治疗化合物包括工程化的多特异性化合物,例如工程化的双特异性分子,例如工程化的双特异性抗体分子,包括:
19.1)特异性靶向部分,例如供体特异性靶向部分(其结合供体靶标并且可用于为来自供体的移植组织例如器官提供位点特异性免疫赦免)或组织特异性靶向部分(其结合受试者组织靶标并且可用于为遭受有害的免疫攻击(例如在自身免疫性疾患中)的受试者组织提供位点特异性免疫赦免);和
20.2)效应物结合/调节部分,包括icim结合/调节部分,其与免疫细胞上的效应物分子,例如抑制性受体,例如pd-1结合,其中,在特异性靶向部分与其靶标结合并且icim结合/调节部分与免疫细胞上的效应物分子的结合后,免疫细胞活性(例如免疫细胞发动免疫攻击的能力)下调,例如,通过依赖于免疫细胞上效应物分子聚集的抑制性信号。在一些实施方式中,工程化的多特异性化合物包括额外的结合部分使得其结合超过两种特异性分子,诸如但不限于3种或4种。
21.在一些实施方式中,治疗化合物包括icim结合/调节部分并具有以下特性中的一种或两种:(a)当治疗化合物与其靶标结合时免疫细胞的下调水平大于当治疗化合物未与其靶标结合时;以及(b)当与免疫细胞上的细胞表面抑制性受体例如pd-1接合时,治疗化合物不抑制或基本上不抑制细胞表面抑制性受体结合内源性配体的能力。
22.在一些实施方式中,当治疗化合物与其靶标结合时免疫细胞的下调水平大于治疗化合物未与其靶标结合时。在实施方式中,靶标结合的治疗化合物的下调水平等于或大于未与其靶标结合时所见的水平的1.5倍、2倍、4倍、8倍或10倍。在实施方式中,当治疗化合物未与靶结合时,它不或不显著下调免疫细胞。因此,抑制性受体例如pd-1的无差别或有害的激动被最小化或消除。例如,当治疗化合物与免疫细胞结合但未与靶向部分结合时,治疗化合物与抑制性免疫检查点分子的接合不会导致下调或不会导致显著下调,例如,治疗化合物结合的免疫细胞上的抑制性受体未聚集或未充分聚集以产生足以下调或显著抑制免疫细胞的抑制性信号。
23.在实施方式中,当与免疫细胞上的细胞表面抑制性受体例如pd-1接合时,治疗化合物不抑制或基本上不抑制细胞表面抑制性受体结合内源性配体的能力。在一些实施方式中,治疗化合物可以结合pd-1上的pd-l1/2结合位点。因此,抑制性受体例如pd-1的无差别或有害的拮抗被最小化或消除。在实施方式中,治疗化合物与免疫细胞上的抑制性受体例如pd-1的结合不妨碍或基本上不妨碍抑制性受体结合天然配体例如pd-l1的能力。在实施
方式中,治疗化合物与免疫细胞上的免疫抑制性受体例如pd-1的结合比在没有治疗化合物的情况下所见的天然配体例如pd-l1的结合减少小于50、40、30、20、10或5%。
24.在一些实施方式中,治疗化合物包括icim结合/调节部分,并且当以治疗有效剂量向受试者给药时,不会导致不可接受的全身免疫抑制水平,如果在一种类型的所有免疫细胞(例如所有t细胞)中抑制性受体的无差别激动发生,或全身免疫激活达到不可接受的水平,则这是可能的,如果治疗化合物拮抗抑制性受体与其天然配体的相互作用,则这也是可能的。
25.虽然不希望受理论束缚,但是据信,在向受试者给药后,包括icim结合/调节部分的治疗化合物可以以四种状态中的任一种存在:i)未结合和以游离溶液;ii)通过icim结合/调节部分仅与免疫细胞(例如t细胞)表面表达的抑制性受体结合;iii)通过靶向部分仅与靶移植物的表面或受试者组织结合;以及iv)通过靶向部分与靶移植物的表面或受试者组织两者结合,并通过icim结合/调节部分与免疫细胞(例如t细胞)表达的抑制性受体结合。当治疗化合物通过靶向部分仅与靶移植物或受试者组织结合(iii)时,其对靶移植物或组织没有或基本上没有影响。当治疗化合物通过靶向部分与靶移植物或组织结合并通过icim结合/调节部分与免疫细胞(例如t细胞)表达的抑制性受体结合(iv)时,其在靶器官或组织处产生免疫赦免。虽然不希望受理论束缚,但是据信这是通过靶移植物或供体组织在其表面多聚化治疗化合物分子来实现的,例如通过以高密度和化合价固定多个治疗化合物分子来实现。治疗化合物分子的多聚化允许治疗化合物的icim结合/调节部分促进免疫细胞(例如,致病性t细胞)表面表达的抑制性受体的聚集,以及抑制信号的传递,以起沉默或下调免疫细胞的作用。例如,在t细胞的情况下,可以使用包括icim结合/调节部分的治疗化合物,所述icim结合/调节部分包括pd-l1分子或抗pd-1ab。多个治疗化合物分子与靶标的结合导致治疗化合物分子的多聚化,这反过来借助pd-l1分子或功能性抗pd-1抗体分子导致t细胞上pd-1的聚集。如果在靶mhc将抗原呈递到t细胞上的t细胞受体的情况下发生这种聚集,则会产生负信号并且t细胞将被灭活。在实施方式中,icim结合/调节部分(例如功能性抗体分子)结合效应物分子但不抑制或不显著抑制效应物分子与其一种或多种天然配体的相互作用。
26.在一些实施方式中,治疗化合物包括iic结合/调节部分,其结合和募集免疫抑制性免疫细胞(例如treg,例如foxp3+cd25+treg)至靶组织附近。
27.在一些实施方式中,治疗化合物包括sm结合/调节部分,其调节例如结合和抑制、隔离、降解或以其他方式中和调节免疫应答的物质,例如可溶性分子,例如atp或amp。
28.在一些实施方式中,治疗化合物包括对免疫细胞上的靶标具有特异性的靶向部分。在一些实施方式中,靶标如本文所述。在一些实施方式中,靶标是madcam。在一些实施方式中,靶向部分是与madcam结合的抗体。
29.在一些实施方式中,治疗化合物包括结合刺激分子(例如共刺激分子)的icsm结合/调节部分。在一些实施方式中,icsm通过以下抑制共刺激分子反结构。结合/调节共刺激分子或共刺激分子反结构可以用于下调免疫细胞开展免疫应答的能力。在一些实施方式中,icsm结合/调节部分可以结合免疫细胞上的刺激性分子,例如共刺激性分子,例如t细胞上的ox40,或另一细胞(诸如但不限于,免疫细胞诸如nk细胞、肥大细胞、树突细胞,或例如非免疫细胞诸如内皮细胞或平滑肌细胞)上的刺激性分子例如ox40l的反成员。
30.在一些实施方式中,治疗化合物包括供体特异性靶向部分并为植入受试者体内的供体移植组织提供位点特异性免疫赦免。在一些实施方式中,治疗化合物包括组织特异性靶向部分并为受试者的组织(例如受自身免疫性疾患中有害的免疫应答影响的组织)提供位点特异性免疫赦免。
31.靶向部分对待被保护以免受免疫系统影响的供体移植物或受试者组织具有特异性。在一些实施方式中,效应物分子结合部分包括从头产生的结合结构域,例如功能性抗体分子。在一些实施方式中,效应物结合/调节部分包括源自识别在免疫细胞(例如t细胞)表面上表达的抑制性受体的天然配体的氨基酸序列。
32.在一些实施方式中,治疗化合物沉默待保护的移植物或供体组织附近的免疫细胞,例如t细胞,但不沉默不接近靶标的免疫细胞,例如t细胞,因为治疗化合物需要靶移植物或供体组织的存在以起作用。这与当治疗化合物仅结合免疫细胞(例如t细胞)表达的抑制性受体时形成对比,在这种情况下没有功能性后果。
33.本文所述的方法和治疗化合物至少部分基于提供位点特异性免疫赦免。本文所述的治疗化合物和使用它们的方法允许最小化(例如减少或消除)临床环境中免疫抑制治疗剂的非位点特异性全身给药,例如,在需要逆转和抑制免疫应答的情况下,诸如在自身免疫性疾病或组织(例如器官)移植物中。虽然当由异常免疫系统驱动的潜在病理生理学受到影响时能够产生具有临床意义的应答,但广泛作用的免疫抑制剂具有降低患者全身免疫系统功能的不良作用。由于正常运作的免疫系统的作用是对抗存在于周围环境中的病原体和机会性生物体的持续攻击,并不断清除健康个体的癌细胞,因此进行慢性免疫抑制的患者发生感染和癌症的风险增加。本文所述的方法和治疗化合物提供了仅选择性靶向和减弱、减少或消除病理部位的病原性免疫应答同时对其他地方的正常全身免疫系统功能具有最小抑制的疗法。
34.在一些实施方式中,提供了如本文所提供的治疗化合物。在一些实施方式中,化合物包括:i)特异性靶向部分,其选自:a)供体特异性靶向部分,其例如优先结合供体靶标;或b)组织特异性靶向部分,其例如优先地结合受试者的靶组织;以及ii)效应物结合/调节部分,其选自:(a)免疫细胞抑制性分子结合/调节部分(icim结合/调节部分);(b)免疫抑制性免疫细胞结合/调节部分(iic结合/调节部分);或(c)作为治疗化合物的一部分促进免疫抑制性局部微环境的效应物结合/调节部分,例如通过在靶标附近提供抑制或最小化免疫系统对靶标的攻击的物质(sm结合/调节部分)。
35.在一些实施方式中,效应物结合/调节部分包括icim结合/调节部分。在一些实施方式中,效应物结合/调节部分包括icim结合/调节部分,其包括抑制性免疫检查点分子配体分子。在一些实施方式中,抑制性免疫分子反配体分子包括pd-l1分子。在一些实施方式中,icim是其中抑制性免疫分子反配体分子与选自pd-1、kir2dl4、lilrb1、lilrb或ctla-4的同源抑制性免疫检查点分子接合。在一些实施方式中,icim是抗体。在一些实施方式中,icim包括与pd-1、kir2dl4、lilrb1、lilrb或ctla-4结合的抗体。在一些实施方式中,icim结合/调节部分包括针对细胞表面抑制性分子的功能性抗体分子。
36.在一些实施方式中,细胞表面抑制性分子是抑制性免疫检查点分子。在一些实施方式中,抑制性免疫检查点分子选自pd-1、kir2dl4、lilrb1、lilrb2、ctla-4,或选自表1。
37.在一些实施方式中,效应物结合/调节部分包括iic结合/调节部分。
38.在一些实施方式中,化合物从n末端到c末端具有下式:r1
‑‑‑
接头区a—r2或r3—接头区b—r4,其中,r1、r2、r3和r4各自独立地包括效应物结合/调节部分,例如icim结合/调节部分、iic结合/调节部分、icsm结合/调节部分或sm结合/调节部分;特异性靶向部分;或不存在;前提是存在效应物结合/调节部分和特异性靶向部分。
39.在一些实施方式中,提供了包括与靶细胞结合的靶向部分和效应物结合/调节部分的多肽,其中效应物结合/调节部分是il-2突变蛋白多肽(il-2突变蛋白),其是突变的il-2蛋白质。在一些实施方式中,靶向部分包括与靶细胞表面上的靶蛋白结合的抗体。在一些实施方式中,多肽包括如本文所提供的两条多肽链。在一些实施方式中,第一链包括vh结构域并且第二链包括与靶细胞或靶细胞上表达的蛋白质(例如但不限于madcam)结合的抗体的vl结构域。在一些实施方式中,靶向部分是与madcam结合的抗体。在一些实施方式中,靶向部分与oat1(slc22a6)和oct2(slc22a2)结合。在一些实施方式中,靶向部分是与oat1(slc22a6)和oct2(slc22a2)结合的抗体。在一些实施方式中,靶向部分不与oat1(slc22a6)和oct2(slc22a2)结合。为避免疑问,本文提及的oct2不是转录因子,而是肾组织中表达的表面蛋白。在一些实施方式中,靶向部分是与胰腺中发现的蛋白质特异性结合的部分。在一些实施方式中,靶向部分与fxyd2、tspan7、dpp6、hepacam2、tmem27或gpr119结合。在一些实施方式中,靶向部分不与fxyd2、tspan7、dpp6、hepacam2、tmem27或gpr119结合。在一些实施方式中,靶向部分是与fxyd2、tspan7、dpp6、hepacam2、tmem27或gpr119结合的抗体。
40.在一些实施方式中,多肽包括形成多肽或治疗化合物的第一链和第二链,其中
41.所述第一链包括:
[0042]vh-h
c-接头-c1,其中vh是可变重结构域,其通过第二链的v
l
结构域与靶细胞结合;hc是包括ch1-ch2-ch3结构域的抗体的重链,接头是如本文提供的甘氨酸/丝氨酸氨基酸序列或不存在,并且c1是il-2突变蛋白,其可以如本文所提供的在n末端或c末端方向与fc蛋白融合,其中可以存在将il-2突变蛋白与fc蛋白连接的甘氨酸/丝氨酸接头;并且
[0043]
所述第二链包括:
[0044]vl-lc,其中v
l
是可变轻链结构域,其通过第一链的vh结构域与靶细胞结合,并且lc结构域是轻链ck结构域。在一些实施方式中,第一链包括c
1-接头-v
h-h,其中变量如上定义。
[0045]
在一些实施方式中,多肽包括式c
1-接头-ch2-ch3-接头-scfv,其中c1和接头如上文和本文所定义,ch2和ch3是重链结构域并且scfv是用作靶向部分以结合本文提供的组织靶标的单链抗体样片段。在一些实施方式中,突变蛋白与本文提供的fc区融合并且一个或多个接头不存在。在一些实施方式中,接头是本文提供的甘氨酸/丝氨酸接头。在一些实施方式中,接头是肽序列。
[0046]
在一些实施方式中,本文提供了治疗自身免疫性疾病或病症的方法,所述方法包括给药一种或多种本文提供的治疗化合物或多肽。
[0047]
在一些实施方式中,本文提供了治疗本文所述的疾病或病症的方法,所述方法包括给药一种或多种本文提供的治疗化合物或多肽。
[0048]
在一些实施方式中,提供了治疗患有炎性肠病的受试者的方法,所述方法包括向受试者给药本文提供的治疗化合物或多肽以治疗炎性肠病。在一些实施方式中,受试者患有克罗恩病和/或溃疡性结肠炎。
[0049]
在一些实施方式中,提供了治疗患有自身免疫性肝炎的受试者的方法,所述方法
包括向受试者给药如本文提供的治疗化合物或多肽以治疗自身免疫性肝炎。
[0050]
在一些实施方式中,提供了治疗原发性硬化性胆管炎的方法,所述方法包括向受试者给药如本文提供的治疗化合物或多肽以治疗原发性硬化性胆管炎。
[0051]
在一些实施方式中,提供了治疗(例如,减轻)肠道中的炎症的方法,所述方法包括向受试者给药如本文提供的治疗化合物或多肽以治疗肠道中的炎症。在一些实施方式中,炎症在小肠中。在一些实施方式中,炎症在大肠中。在一些实施方式中,炎症在肠道或结肠中。
[0052]
在一些实施方式中,提供了治疗(例如,减轻)胰腺中的炎症的方法,所述方法包括向受试者给药如本文提供的治疗化合物或多肽以治疗胰腺中的炎症。在一些实施方式中,所述方法治疗胰腺炎。
[0053]
在一些实施方式中,提供了治疗1型糖尿病的方法,所述方法包括向受试者给药本文提供的治疗化合物或多肽以治疗1型糖尿病。
[0054]
在一些实施方式中,提供了治疗移植受试者的方法,所述方法包括向受试者给药治疗有效量的本文提供的治疗化合物或多肽,从而治疗移植(接受者)受试者。
[0055]
在一些实施方式中,提供了在具有移植的供体组织的受试者中治疗gvhd的方法,所述方法包括向受试者给药治疗有效量的本文提供的治疗化合物或多肽。
[0056]
在一些实施方式中,提供了治疗患有自身免疫性疾患或处于患自身免疫性疾患的风险或升高的风险中的受试者的方法,所述方法包括给药治疗有效量的本文提供的治疗化合物或多肽,从而治疗受试者。
[0057]
在一些实施方式中,化合物从n末端到c末端具有下式:
[0058]
a1
‑‑‑
接头a
‑‑‑
a2
‑‑‑
接头b
‑‑‑
a3或a3
‑‑‑
接头a
‑‑‑
a2
‑‑‑
接头b
‑‑‑
a1,
[0059]
其中,a1和a3各自独立地是效应物结合/调节部分,例如icim结合/调节部分、iic结合/调节部分、icsm结合/调节部分或sm结合/调节部分;或特异性靶向部分,其中a2包括fc区或不存在;并且接头a和接头b是接头,但不必相同。
附图说明
[0060]
图1描绘了本文提供的治疗化合物的非限制性实施方式。
[0061]
图2描绘了本文提供的治疗化合物可以如何起作用的非限制性图示。
[0062]
图3描绘了本文提供的治疗化合物的非限制性图示。
[0063]
图3a描绘了本文提供的治疗化合物的非限制性图示。
[0064]
图4描绘了本文提供的治疗化合物的非限制性图示。
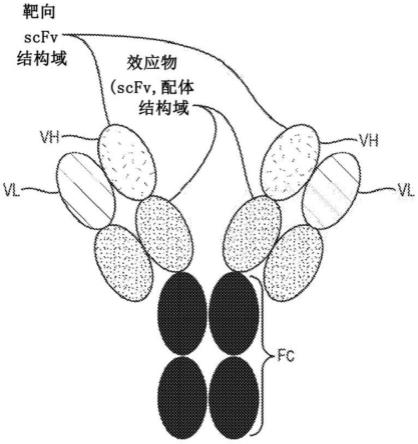
[0065]
图5描绘了本文提供的治疗化合物的非限制性图示。
[0066]
图6描绘了本文提供的治疗化合物的非限制性图示。
[0067]
图7描绘了本文提供的治疗化合物的非限制性图示。
[0068]
图8描绘了本文提供的治疗化合物的非限制性图示。
[0069]
图9描绘了本文提供的治疗化合物的非限制性图示。
[0070]
图10描绘了本文提供的治疗化合物的非限制性图示。
[0071]
图11描绘了本文提供的治疗化合物的非限制性图示。
[0072]
图12描绘了本文提供的治疗化合物的非限制性图示。
[0073]
图13描绘了本文提供的治疗化合物的非限制性图示。
[0074]
图14描绘了本文提供的治疗化合物的非限制性图示。
[0075]
图15描绘了本文提供的治疗化合物的非限制性图示。
[0076]
图16描绘了本文提供的治疗化合物的非限制性图示。
[0077]
图17描绘了本文提供的治疗化合物的非限制性图示。
[0078]
图18描绘了本文提供的治疗化合物的非限制性图示。
[0079]
图19描绘了本文提供的治疗化合物的非限制性图示。
具体实施方式
[0080]
本技术通过援引以整体并入以下的每一项:于2018年3月15日提交的美国申请号15/922,592和于2018年3月15日提交的pct申请号pct/us2018/022675。本技术还通过援引以整体并入以下中的每一项:于2018年8月23日提交的美国临时申请号62/721,644、于2018年5月24日提交的美国临时申请号62/675,972、于2017年12月6日提交的美国临时申请号62/595,357、于2017年12月6日提交的美国临时申请号62/595,348、于2018年8月23日提交的美国非临时申请号16/109,875、于2018年8月23日提交的美国非临时申请号16/109,897、于2018年5月24日提交的美国非临时申请号15/988,311、于2018年5月24日提交的pct申请号pct/us2018/034334以及于2018年11月28日提交的pct/us2018/062780。
[0081]
如本文所用且除非另有说明,否则术语“约”旨在意指其修饰的值的
±
5%。因此,约100意指95至105。
[0082]
如本文和所附权利要求中使用的,除上下文另外明确规定,否则单数形式“一个/种(a)”、“一个/种(an)”和“所述(the)”包括复数指示物。
[0083]
如本文所用,术语“约”意指数值是近似值并且小的变化不会显著影响所公开的实施方式的实践。在使用数值限制的情况下,除非上下文另有说明,否则“约”意指数值可以变化
±
10%并且保持在所公开的实施方式的范围内。
[0084]
如本文所用,术语“动物”包括但不限于人和非人脊椎动物,例如野生动物、家畜和农场动物。
[0085]
如本文所用,术语“接触”意指将体外系统或体内系统中的两种元素放在一起。例如,治疗化合物与个体或患者或细胞“接触”包括将化合物给药于个体或患者,诸如人,以及例如将化合物引入到含有靶标的含细胞或纯化制剂的样品中。
[0086]
如本文所用,术语“包括(comprising)”(以及包括的任何形式,例如“comprise”、“comprises”和“comprised”)、“具有(having)”(以及具有的任何形式,例如“have”和“has”)、“包括(including)”(以及包括的任何形式,例如“includes”和“include”),或“包含(containing)”(以及包含的任何形式,例如“contains”和“contain”)都是包容性的或开放式的,并且不排除额外的、未列举的要素或方法步骤。引用术语“包括”的任何组合物或方法也应理解为也描述了诸如由或基本上由所引用的组分或元素组成的组合物。
[0087]
如本文所用,当用于指具有不同结构域或异源序列的蛋白质时术语“融合”或“连接”意指蛋白质结构域是通过肽键或其他共价键相互连接的同一肽链的一部分。结构域或区段可以彼此直接连接或融合,或者另一个结构域或肽序列可以在两个结构域或序列之间,并且这样的序列仍将被认为是彼此融合或连接的。在一些实施方式中,本文提供的各种
结构域或蛋白质彼此直接连接或融合,或者接头序列(诸如本文所述的甘氨酸/丝氨酸序列)将两个结构域连接在一起。如果两个肽序列彼此直接相连,则它们是直接连接的,或者如果存在连接两个区的接头或其他结构,则是间接连接的。接头可以直接连接到两个不同的肽序列或结构域。
[0088]
如本文所用,可互换使用的术语“个体”、“受试者”或“患者”意指任何动物,包括哺乳动物,诸如小鼠、大鼠、其他啮齿动物、兔、狗、猫、猪、牛、绵羊、马或灵长类动物,诸如人。
[0089]
如本文所用,术语“抑制”是指与不存在抑制结果、症状或活性的化合物时的活性或结果相比结果、症状或活性降低。在一些实施方式中,结果、症状或活性被抑制约或至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或99%。如果结果、症状或活性完全消除或消失,则其也可以是被抑制的。
[0090]
如本文所用,短语“有此需要”意指受试者已被鉴定为需要特定方法或治疗。在一些实施方式中,可以通过任何诊断手段进行鉴定。在本文所述的任何方法和治疗中,受试者可能是有此需要的。在一些实施方式中,受试者处于或将前往特定疾病、疾患或病症普遍存在的环境中。
[0091]
如本文所用,短语“从x到y的整数”意指包括端点在内的任何整数。例如,短语“从x到y的整数”意指1、2、3、4或5。
[0092]
如本文所用,术语“哺乳动物”意指啮齿动物(即,小鼠、大鼠或豚鼠)、猴、猫、狗、牛、马、猪或人。在一些实施方式中,哺乳动物是人。
[0093]
在一些实施方式中,本文提供了治疗化合物。在一些实施方式中,治疗化合物是蛋白质或多肽,其具有彼此相互作用的多条链。多肽可以通过非共价相互作用或共价相互作用(例如通过二硫键或其他共价键)彼此相互作用。因此,如果实施方式涉及治疗化合物,则也可以说它涉及本文提供的蛋白质或多肽,以及反之亦然,如上下文所指示的。
[0094]
如本文所用,短语“眼科可接受的”意指对被治疗的眼睛或其功能或对被治疗的受试者的总体健康没有持续的有害作用。然而,应认识到,短暂作用诸如轻微刺激或“刺痛”感是区域性(topical)眼科给药时常见的,并且这种短暂作用的存在与所讨论的组合物、制剂或成分(例如赋形剂)是如本文定义的“眼科可接受的”并不矛盾。在一些实施方式中,药物组合物可以是眼科可接受的或适用于眼科给药。
[0095]“特异性结合”特定抗原、靶标或表位,或与其“特异性结合”,或对其具有“特异性”,意指结合与非特异性相互作用相比,可测量地不同。例如,可以通过确定与对照分子的结合相比的分子的结合来测量特异性结合,对照分子通常是不具有结合活性的类似结构的分子。例如,特异性结合可以通过与与靶标相似的对照分子的竞争来确定。
[0096]
对特定抗原、靶标或表位的特异性结合可以例如通过抗体具有的对抗原或表位的kd为以下来表现:至少约10-4m
、至少约10-5m
、至少约10-6m
、至少约10-7m
、至少约10-8m
、至少约10-9m
,替代地至少约10-10m
、至少约10-11m
、至少约10-12m
或更大,其中kd是指特定抗体-靶标相互作用的解离速率。通常,特异性结合抗原或靶标的抗体具有的相对于抗原或靶标的kd是或至少是对照分子的2、4、5、10、20、50、100、500、1000、5,000、10,000或更多倍。
[0097]
在一些实施方式中,对特定抗原、靶标或表位的特异性结合可以例如通过抗体具有的对抗原、靶标或表位的ka或ka是相对于对照对抗原、靶标或表位的至少2、4、5、20、50、100、500、1000、5,000、10,000或更多倍来表现,其中ka或ka是指特定抗体-抗原相互作用的
缔合速率。
[0098]
如本文所提供的,治疗化合物和组合物可用于本文所提供的治疗方法中。如本文所用,术语“治疗(“treat”、“treated”或“treating”)”意指治疗性治疗和预防性治疗二者,其中目的是减缓(减轻)不期望的生理状况、疾患或疾病,或获得有益的或期望的临床结果。出于这些实施方式的目的,有益的或期望的临床结果包括但不限于症状的缓解;病症、疾患或疾病的程度减轻;病症、疾患或疾病的状态稳定(没有恶化);病症、疾患或疾病进展的延迟或减缓;病症、疾患或疾病状态的改善或缓解(无论是部分还是全部),无论是可检测的还是不可检测的;至少一个可测量的物理参数的改善,患者不一定可辨别;或者病症、疾患或疾病的改进或改善。治疗包括在没有过多水平的副作用的情况下引起临床上显著的反应。治疗还包括与未接受治疗的预期存活期相比延长存活期。
[0099]
本文提供了治疗化合物,例如治疗性蛋白质分子,例如融合蛋白,其包括通常作为单独的结构域的靶向部分和效应物结合/调节部分。还提供了使用和制备治疗化合物的方法。靶向部分用于将治疗化合物和因此效应物结合/调节部分定位到需要免疫赦免的位点。效应物结合/调节部分包括以下中的一种或多种:(a)免疫细胞抑制性分子结合/调节部分(icim结合/调节部分);(b)免疫抑制性免疫细胞结合/调节部分(iic结合/调节部分);(c)可溶性分子结合/调节部分(sm结合/调节部分)或(d)阻断或抑制免疫细胞刺激性分子结合/调节部分(本文称为icsm结合/调节部分)的分子。在一些实施方式中,icsm通过例如阻断共刺激分子与其反结构之间的相互作用来抑制免疫激活。在一些实施方式中,治疗化合物包括:(a)和(b);(a)和(c);(a)和(d);(b)和(c);(b)和(d);(c)和(d);或(a)、(b)、(c)和(d)。
[0100]
本公开提供了例如可以充当pd-1激动剂的分子。不受任何特定理论的束缚,pd-1的激动作用抑制t细胞活化/信号传导,并且可以通过不同的机制实现。例如,交联可以导致激动,珠粒结合的功能性pd-1激动剂已在(akkaya.ph.d.thesis:modulation of the pd-1pathway by inhibitory antibody superagonists.christ church college,oxford,uk,2012)中描述,其通过援引并入本文。pd-1与结合非重叠表位的两种mab的交联诱导pd-1信号传导(davis,us 2011/0171220),其通过援引并入本文。另一实例是通过使用山羊抗pd-1抗血清来说明的(例如af1086,r&d systems),其通过援引并入本文,其在可溶时充当激动剂(said et al.,2010,nat med),其通过援引并入本文。可用于本实施方式的pd-1激动剂的非限制性实例包括但不限于ucb克隆19或克隆10、pd1ab-1、pd1ab-2、pd1ab-3、pd1ab-4以及pd1ab-5、pd1ab-6(anaptys/celgene)、pd1-17、pd1-28、pd1-33以及pd1-35(collins et al,us 2008/0311117 a1 antibodies against pd-1 and uses therefor,其通过援引并入),或可以是双特异性、单价抗pd-1/抗cd3(ono)等。在一些实施方式中,pd-1激动剂抗体可以是阻断pd-l1与pd-1结合的抗体。在一些实施方式中,pd-1激动剂抗体可以是不阻断pd-l1与pd-1结合的抗体。
[0101]
pd-1激动可以通过任何方法(例如实施例中描述的方法)测量。例如,可以构建表达(包括稳定表达)构建体的细胞,所述构建体包括与b-半乳糖苷酶“酶供体”融合的人pd-1多肽和2)与b-半乳糖苷酶“酶受体”融合的shp-2多肽”。不受任何理论的束缚,当pd-1接合时,shp-2被募集到pd-1。酶受体和酶供体形成可以被测定的完全活性的b-半乳糖苷酶。然而,该测定不直接显示pd-1激动,而是显示pd-1信号传导的激活。pd-1激动也可以通过测量
t细胞活化的抑制来测量,因为不受任何理论的束缚,pd-1激动抑制抗cd3诱导的t细胞活化。例如,pd-1激动可以通过用pha(用于人t细胞)或cona(用于小鼠t细胞)预活化t细胞以使得它们表达pd-1来测量。然后可以在存在抗pd-1(或pd-l1)的情况下用抗cd3重新激活细胞,用于pd-1激动测定。相对于单独的抗cd3刺激,在存在抗cd3的情况下接收pd-1激动剂信号传导的t细胞将显示出降低的激活。活化可以通过增殖或细胞因子产生(il-2、ifng、il-17)或其他标志物(诸如cd69活化标志物)读取出。因此,pd-1激动可以通过细胞因子产生或细胞增殖来测量。其他方法也可用于测量pd-1激动。
[0102]
pd-1是在活化的t细胞和其他免疫细胞上表达的ig超家族成员。pd-1的天然配体似乎是pd-l1和pd-l2。不受任何特定理论的束缚,当pd-l1或pd-l2与活化的t细胞上的pd-1结合时,引发抑制性信号传导级联,导致活化的t效应细胞功能减弱。因此,用pd-1拮抗剂阻断t细胞上的pd-1与另一细胞(例如,肿瘤细胞)上的pd-l1/2之间的相互作用被称为检查点抑制,并将t细胞从抑制中释放出来。相比之下,pd-1激动剂抗体可以与pd-1结合并发出抑制性信号并减弱t细胞的功能。因此,pd-1激动剂抗体可以作为效应物分子结合/调节部分并入本文所述的各种实施方式中,当与靶向部分配对时,其可以实现局部组织特异性免疫调节。
[0103]
效应物分子结合/调节部分可以以多种方式提供免疫抑制信号传导或环境。在一些实施方式中,效应物结合/调节部分包括icim结合/调节部分,其直接结合并且(在如本文所述的适当条件下)激活由负责驱动疾病病理学的免疫细胞表达的抑制性受体。在另一种实施方式中,效应物结合/调节部分包括以及iic结合/调节部分并且结合并积累免疫抑制性免疫细胞。在一些实施方式中,积累的免疫抑制性细胞促进免疫赦免。在另一种实施方式中,效应物结合/调节部分包括sm结合/调节部分,其操纵周围的微环境以使其更不允许免疫细胞(例如,驱动疾病病理学的免疫细胞)的功能。在一些实施方式中,sm结合/调节部分消耗促进免疫攻击或激活的实体。在一些实施方式中,效应物结合/调节部分包括icsm结合/调节部分,其结合一对刺激分子(例如共刺激分子)的成员,并抑制共刺激分子与共刺激分子反结构(诸如但不限于ox40或cd30或cd40与ox40l或cd30l或cd40l)之间的相互作用,并抑制包括该对的成员的细胞(诸如但不限于t细胞、b细胞、nk细胞或其他免疫细胞)的免疫刺激。
[0104]
靶向部分和效应物结合/调节部分以共价或非共价方式、直接或通过接头实体彼此物理栓系,例如作为治疗蛋白质分子中同一蛋白质分子的成员。在一些实施方式中,靶向和效应物部分通常作为分开的结构域在治疗蛋白质分子例如融合蛋白中提供。在一些实施方式中,靶向部分、效应物结合/调节部分或两者各自包括单域抗体分子,例如骆驼科抗体vhh分子或人可溶性vh结构域。它还可以包含单链可变片段(scfv)或fab结构域。在一些实施方式中,可以向受试者给药治疗蛋白质分子或编码治疗蛋白质分子的核酸,例如mrna或dna。在一些实施方式中,靶向和效应物分子结合/调节部分连接至第三实体,例如载体,例如聚合物载体、树枝状聚合物或颗粒,例如纳米颗粒。治疗化合物可用于下调选定靶标或位点的组织处或组织中的免疫应答,同时不具有或基本上没有全身免疫抑制功能。靶标或位点可以包括供体组织或自体组织。
[0105]
本文提供了用本文公开的治疗化合物为移植的供体组织提供位点特异性免疫赦免的方法,所述移植的供体组织为例如同种异体移植组织,例如本文所述的组织,例如同种
异体移植肝、同种异体移植肾、同种异体移植心脏、同种异体移植胰腺、同种异体胸腺或胸腺组织、同种异体移植皮肤或同种异体移植肺。在实施方式中,治疗最小化对供体移植组织的排斥、最小化免疫效应细胞介导的对供体移植组织的损伤、延长对供体移植组织的认可或延长供体移植组织功能寿命。
[0106]
本文还提供了通过利用本文公开的治疗化合物最小化供体免疫细胞(例如供体t细胞)介导对接受者组织的免疫攻击的能力来抑制移植物抗宿主病(gvhd)的方法。
[0107]
本文还提供了通过给药本文公开的治疗化合物例如以提供对免疫系统的位点或组织特异性调节来治疗(例如治疗性治疗或预防性治疗(或预防))受试者中自身免疫性疾患或反应的方法。在一些实施方式中,该方法提供针对受试者组织的耐受性、排斥的最小化、免疫效应细胞介导的损伤的最小化或延长其功能。在一些实施方式中,治疗化合物包括靶向(例如,特异性靶向)处于自身免疫攻击中或处于自身免疫攻击风险中的组织的靶向部分。非限制性的示例性组织包括但不限于胰腺、髓鞘、唾液腺、滑膜细胞和肌细胞。
[0108]
如本文所用,术语“治疗(“treat”、“treated”或“treating”)”是关于治疗性治疗,其中目的是减缓(减轻)不期望的生理状况、疾患或疾病,或获得有益的或期望的临床结果。例如,有益的或期望的临床结果包括但不限于症状的缓解;病症、疾患或疾病的程度减轻;病症、疾患或疾病的状态稳定(没有恶化);病症、疾患或疾病进展的延迟或减缓;病症、疾患或疾病状态的改善或缓解(无论是部分还是全部),无论是可检测的还是不可检测的;至少一个可测量的物理参数的改善,患者不一定可辨别;或者病症、疾患或疾病的改进或改善。治疗包括在没有过多水平的副作用的情况下引起临床上显著的反应。治疗还包括与未接受治疗的预期存活期相比延长存活期。因此,“治疗自身免疫性疾病/病症”意指减轻或改善与本文所述的自身免疫性疾病/疾患或其他病症相关的任何主要现象或次要症状的活动。本文提供了多种疾病或病症。治疗性治疗也可以预防性地给药以在发作前预防或减轻疾病或病症。
[0109]
在一些实施方式中,治疗化合物的给药在疾患明显之后开始。在一些实施方式中,治疗化合物的给药在疾患发作或完全发作之前开始。在一些实施方式中,治疗化合物的给药在疾患发作或完全发作之前开始,例如在患有疾患的受试者中,高风险受试者中,具有疾患的风险或存在的生物标志物的受试者中,具有疾患的家族史或疾患的风险的其他指标或无症状存在的受试者中。例如,在一些实施方式中,治疗患有胰岛细胞损伤但尚未患有糖尿病的受试者。
[0110]
虽然不希望受理论束缚,但据信靶向部分的功能是结合治疗剂并将其积累到需要免疫赦免的解剖部位处的选择性表达的靶标。在一些实施方式中,例如,在供体组织移植的情况下,靶标部分与存在于供体组织中但不存在于接受者中的靶标(例如等位基因产物)结合。对于自身免疫性疾患的治疗,靶向部分结合优先在需要免疫赦免的解剖部位(例如,在胰腺中)表达的靶标。对于gvhd的治疗,靶向部分靶向宿主组织,并保护宿主免受来自移植组织的移植免疫效应细胞的攻击。
[0111]
同样,虽然不希望受理论束缚,但据信效应物结合/调节部分用于递送免疫抑制信号传导或以其他方式产生免疫赦免环境。
[0112]
除非另有定义,否则本文使用的所有技术和科学术语具有与实施方式所属的领域中普通技术人员所通常理解相同的含义。尽管在实施或测试本实施方式中可使用与本文所
述的那些方法和材料类似或等效的方法和材料,但是下面描述合适的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考文献均通过援引以其整体并入。此外,材料、方法和实例仅是说明性的而不是限制性的。标题、副标题或编号或字母元素例如(a)、(b)、(i)等仅是为了便于阅读。本文档中标题或编号或字母元素的使用不需要按字母顺序进行步骤或元素,或者步骤或元素不需要必须彼此分离。根据描述和附图以及根据权利要求,实施方式的其他特征、目的和优点将显而易见。
[0113]
附加定义
[0114]
除非另有定义,否则本文使用的所有技术和科学术语具有与实施方式所属的领域中普通技术人员所通常理解相同的含义。在描述和要求保护本实施方式时,在提供定义的情况下,将根据其如何定义的使用以下术语和在整个本技术中以其他方式引用的术语。
[0115]
还应当理解,本文所用术语的目的仅是描述特定实施方式,而不旨在限制。
[0116]
如本文所用的术语抗体分子是指包括至少一个功能性免疫球蛋白可变结构域序列的多肽,例如免疫球蛋白链或其片段。抗体分子包括抗体(例如全长抗体)和抗体片段。在一些实施方式中,抗体分子包括全长抗体或全长免疫球蛋白链的抗原结合或功能片段。例如,全长抗体是天然存在的或通过正常免疫球蛋白基因片段重组过程)形成的免疫球蛋白(ig)分子(例如,igg抗体)。在实施方式中,抗体分子是指免疫球蛋白分子的具有免疫学活性的抗原结合部分,例如抗体片段。抗体片段(例如,功能片段)包括抗体的一部分,例如fab、fab
′
、f(ab
′
)2、f(ab)2、可变片段(fv)、域抗体(dab)或单链可变片段(scfv)。功能性抗体片段与同完整(例如全长)抗体识别的抗原相同的抗原结合。术语“抗体片段”或“功能片段”还包括由可变区组成的分离片段,诸如由重链和轻链的可变区组成的“fv”片段,或其中轻链和重链可变区通过肽接头连接的重组单链多肽分子(“scfv蛋白”)。在一些实施方式中,抗体片段不包括没有抗原结合活性的抗体部分,例如fc片段或单个氨基酸残基。示例性抗体分子包括全长抗体和抗体片段,例如,dab(域抗体)、单链、fab、fab’和f(ab’)2片段,以及单链可变片段(scfv)。
[0117]
术语“抗体分子”还包括域或单域抗体(其也可称为“sdab”或“vhh”)的完整或抗原结合片段。域抗体包括可以作为独立的抗体片段的vh或v
l
。此外,域抗体包括仅重链抗体(hcab)。域抗体还包括作为cdr环移植到其中的基础骨架的igg的ch2结构域。它也可以一般定义为包括氨基酸序列的多肽或蛋白质,所述氨基酸序列由被三个互补决定区中断的四个框架区构成。这表示为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。sdab可以在骆驼科动物诸如美洲驼中产生,但也可以使用本领域众所周知的技术合成产生。sdab或多肽的氨基酸残基的编号是根据kabat et al给出的vh结构域的一般编号("sequence of proteins of immunological interest,"us public health services,nih bethesda,md,publication no.91,其通过援引并入本文)。根据这个编号,sdab的fr1包括位置1-30处的氨基酸残基,sdab的cdr1包括位置31-36处的氨基酸残基,sdab的fr2包括位置36-49处的氨基酸,sdab的cdr2包括位置50-65处的氨基酸残基,sdab的fr3包括位置66-94处的氨基酸残基,sdab的cdr3包括位置95-102处的氨基酸残基,并且sdab的fr4包括位置103-113处的氨基酸残基。域抗体也在wo2004041862和wo2016065323中进行了描述,其各自通过援引并入此。域抗体可以是如本文所述的靶向部分。
[0118]
抗体分子可以是单特异性(例如,单价或二价)、双特异性(例如,二价、三价、四价、
五价或六价)、三特异性(例如,三价、四价、五价、六价)或具有更高阶的特异性(例如,四特异性)和/或超过六价的更高价。抗体分子可以包括轻链可变区的功能片段和重链可变区的功能片段,或者重链和轻链可以融合在一起形成单个多肽。
[0119]
多特异性治疗化合物(例如双特异性抗体分子)的形式的实例示出在以下非限制性实例中。尽管用抗体分子进行了说明,但它们可以用作包括其他非抗体部分作为特异性结合或效应物部分的治疗分子的平台。在一些实施方式中,这些非限制性实例基于对称或不对称fc形式。
[0120]
例如,附图说明了非限制性和变化的对称同二聚体方法。在一些实施方式中,二聚化界面以人igg1ch2-ch3结构域为中心,其通过跨越ch2/ch2和ch3/ch3二者的接触界面二聚化。所示的所得双特异性抗体具有由四个结合单元构成的总价,其中在二聚体的每一侧的n末端处具有两个相同的结合单元并且在二聚体的每一侧的c末端处具有两个相同的单元。在每种情况下,同二聚体n末端处的结合单元与同二聚体c末端处的结合单元不同。在分子两末端对于对于两抑制性t细胞受体使用这种类型的二价,可以在分子的两端实现对组织栓系抗原(tissue tethering antigen)的二价。
[0121]
例如,在图3中,图示了非限制性实施方式。同二聚体的n末端包含两个相同的fab结构域,其由作为独立的多肽的两条相同的轻链构成,通过vh/vl相互作用以及cκ或cλ与ch1相互作用与每条重链的n末端vh-ch1结构域交界。cκ或cλ与ch1之间存在天然二硫键,在轻链和重链之间提供共价锚。在此设计的c末端处是两个相同的scfv单元,其中(在该实例中)fc的ch3结构域的c末端后接柔性的亲水接头,该接头通常由(但不限于)丝氨酸、甘氨酸、丙氨酸和/或苏氨酸残基构成,其后是每个scfv单元的vh结构域,其后是富含甘氨酸/丝氨酸的接头,其后是vl结构域。这些级联的vh和vl结构域缔合以形成附加在fc的c末端的单链可变片段(scfv)。由于以fc为中心的同二聚体性质,在该分子的c末端存在两个这样的单元。scfv的结构域顺序可以被配置为从n到c末端vh-接头-vl或vl-接头-vh。
[0122]
在不同端上具有不同结合区的分子的非限制性实例是其中一端是pd-1激动剂,并且提供靶标特异性的抗体是抗madcam-1抗体。这可以如例如图3a所示来说明,其图示了不同方向的分子。
[0123]
在一些实施方式中,madcam抗体是本文别处所述的阻断或非阻断抗体。不受任何理论的束缚,已显示madcam通过其两个ig超家族i-set结构域内的多个残基与淋巴细胞上表达的整合素α4β7的头部相互作用,并且已经描述了该相互作用的原子水平结构基础(viney jl et al.(1996).j immunol.157,2488-2497;yu y et al(2013).j biol chem.288,6284-6294;yu y et al(2012).j cell biol.196,131-146,其各自通过援引以其整体并入)。在人(chen j et al(2003).nat struct biol.10,995-1001;de chateau m et al(2001).biochemistry.40,13972-13979)和小鼠(day es et al(2002).cell commun adhes.9,205-219;hoshino h et al(2011).j histochem cytochem.59,572-583)分子系统二者中,已经在结构、机械和功能方面的大量细节中表明,madcam与α4β7的任何相互作用依赖于整合素β7亚单元i样结构域中存在的三个双阳离子结合位点并且这些金属结合位点可以与ca2+、mn2+和mg2+配位。在具有或不具有mg2+或mn2+的情况下在高水平ca2+的存在下,使用细胞粘附测定、流式细胞术和/或流动室测定,madcam/α4β7相互作用显示出较低的功能亲和力并允许滚动粘附淋巴细胞,而在激活整合素的低ca2+但高mg2+或mn2+中,
madcam/α4β7相互作用具有更高的功能亲和力并介导牢固的淋巴细胞粘附(chen j et al(2003).nat struct biol.10,995-1001)。许多小组已经表明,可以利用各种基于细胞:细胞、细胞:膜prep和/或细胞:蛋白质的粘附/相互作用测定,用facs、基于细胞流动室的计数或基于ihc的读数来监测抗madcam或抗α4β7抗体对madcam与α4β7相互作用的影响,允许鉴定阻断或非阻断抗体(nakache,m et al(1989).nature.337,179-181;streeter,pr et al(1988).nature.331.41-46;yang y et al(1995).scand j immunol.42.235-247;leung e et al(2004).immunol cell biol.82.400-409;pullen n et al(2009).b j pharmacol.157.281-293;soler d et al(2009).j pharmacol exp ther.330.864-875;qi j et al(2012).j biol chem.287.15749-15759)。
[0124]
这在小鼠系统设置中得到了例证,该系统具有抗小鼠madcam抗体,诸如meca-89(非阻断)和meca-367(阻断)的鉴定(nakache,m et al(1989).nature.337,179-181;streeter,pr et al(1988).nature.331.41-46;yang y et al(1995).scand j immunol.42.235-247)。在人系统中,已经鉴定出阻断人madcam与人α4β7的相互作用的抗体,诸如抗人madcam pf-00547659(pullen n et al(2009).b j pharmacol.157.281-293)以及抗人α4β7维多珠单抗(soler d et al(2009).j pharmacol exp ther.330.864-875),以及不阻断相互作用的抗体,诸如抗人madcam克隆17f5(soler d et al(2009).j pharmacol exp ther.330.864-875),和抗人α4β7克隆j19(qi j et al(2012).j biol chem.287.15749-15759)。因此,基于期望的效果,抗体可以是阻断的或非阻断的。在一些实施方式中,抗体是非阻断madcam抗体。在一些实施方式中,抗体是阻断madcam抗体。证明抗体是阻断的还是非阻断的一个非限制性实例可在实施例6中找到,但可以使用任何方法。本文所述述的每个参考文献均通过援引以其整体并入。在一些实施方式中,pd-1激动剂被il-2突变蛋白,诸如但不限于本文所述的那些替代。
[0125]
在另一实例中并且如图4中所描绘的,同二聚体的n末端包含两个相同的fab结构域,其由作为独立的多肽的两条相同的轻链构成,通过vh/vl相互作用以及cκ或cλ与ch1的相互作用与每条重链的n末端vh-ch1结构域交界。cκ或cλ与ch1之间存在天然二硫键,在轻链和重链之间提供共价锚。在此设计的c末端处是两个相同的vh单元(尽管非抗体部分也可以在此处或在四个末端附连/融合点中的任何一个处被替换),其中(在该实例中)fc的ch3结构域的c末端后接柔性的亲水接头,该接头通常由(但不限于)丝氨酸、甘氨酸、丙氨酸和/或苏氨酸残基构成,其后是基于可溶性独立vh3种系家族的vh结构域。由于以fc为中心的同二聚体性质,在该分子的c末端存在两个这样的单元。
[0126]
在另一个非限制性实例中,如图5所示的,同二聚体的n末端包含两个相同的fab结构域,该结构域由两条相同的轻链构成,与图3和图4不同,它们通过cκ或cλ的c末端与vh的n末端之间的接头在n末端处与重链物理相连。接头可以是36-80个氨基酸长度并且由丝氨酸、甘氨酸、丙氨酸和苏氨酸残基构成。物理相连的n末端轻链通过vh/vl相互作用以及cκ或cλ与ch1的相互作用与每条重链的n末端vh-ch1结构域交界。cκ或cλ与ch1之间存在天然二硫键,在轻链和重链之间提供额外稳定性。在此设计的c末端处是两个相同的fab单元,其中(在该实例中)fc的ch3结构域的c末端后接柔性的亲水接头,该接头通常由(但不限于)丝氨酸、甘氨酸、丙氨酸和/或苏氨酸残基构成,其后是ch1结构域,然后是c末端的vh结构域。被设计成与c端ch1/vh结构域配对的轻链表达为单独的多肽,不同于与所述的n末端vh/ch1结
构域相连的n端轻链。c末端轻链在vh/vl和cκ或cλ与ch1之间形成界面。天然二硫键将这条轻链锚定于重链。同样,四个附连/融合点中任一处的任何抗体部分可以被非抗体部分(例如,不包括抗体分子的效应物结合/调节部分)替换。
[0127]
双特异性抗体也可以是不对称的,如以下非限制性实例中所示。非限制性实例也描绘在图示了不对称/异二聚体方法的图6、图7和图8中。同样,在任何这些形式中,四个附连/融合点中任一处的任何抗体部分可以被非抗体部分(例如,不包括抗体分子的效应物结合/调节部分)替换。在一些实施方式中,二聚化界面以人igg1ch2-ch3结构域为中心,其通过跨越ch2/ch2和ch3/ch3二者的接触界面二聚化。然而,为了实现每条重链的异二聚化而不是同二聚化,在每个ch3结构域中引入了突变。异源二聚化突变包括一个ch3结构域中的t366w突变(kabat)和另一个ch3域中的t366s、l368a和y407v(kabat)突变。通过将天然残基突变为半胱氨酸残基,诸如ch3/ch3界面的相对侧的s354和y349,可以使用从头二硫键进一步稳定异源二聚化界面。所示的所得双特异性抗体具有由四个结合单元构成的总价。通过这种方法,整个分子可以被设计为仅在一个末端具有双特异性,以及在另一末端具有单特异性(整体三特异性)或在任一末端具有双特异性,整体分子特异性为2或4。在下面的示例性实例中,c末端包括两个相同的结合结构域,其可以例如为组织栓系靶标提供二价单特异性。在所有三个示例性实例的n末端,两个结合结构域都包括不同的识别元件/互补位,并且其可以实现对相同效应物部分靶标上的两个不同表位的识别,或者可以识别例如t细胞抑制性受体和cd3。在一些实施方式中,n末端结合部分可以与例如其他单一多肽形式诸如scfv、单链fab、级联scfv、vh或vhh域抗体构型互换。也可以使用其他类型的识别元件,诸如线性或环状肽。
[0128]
不对称分子的实例描绘在图6中。参考图6,分子的n末端由以下构成:通过vh/vl和cκ或cλ/ch1相互作用以及由天然重/轻链二硫键构成的共价栓系与第一重链配对的第一轻链。在该异二聚体分子的另一侧,在n末端是通过cκ或cλ的c末端与vh的n末端之间的接头物理相连的第二轻链和第二重链。接头可以是36-80个氨基酸长度并且由丝氨酸、甘氨酸、丙氨酸和苏氨酸残基构成。物理相连的n末端轻链通过vh/vl相互作用以及cκ或cλ与ch1的相互作用与每条重链的n末端vh-ch1结构域交界。cκ或cλ与ch1之间存在天然二硫键,在轻链和重链之间提供额外稳定性。在分子的c末端是两个相同的可溶性vh3种系家族vh结构域,它们通过基于n末端甘氨酸/丝氨酸/丙氨酸/苏氨酸的接头连接到重链1和重链2二者的ch3结构域的c末端。
[0129]
在一些实施方式中,不对称分子可以如图7所示的说明。例如,分子的n末端由两个不同的基于vh3种系的可溶性vh结构域构成,它们通过基于甘氨酸/丝氨酸/丙氨酸/苏氨酸的接头连接到人igg1铰链区。连接到第一重链的vh结构域不同于连接到第二重链的vh结构域。在每条重链的c末端是额外的基于vh3的可溶性vh结构域,其在两条重链中的每一条上都是相同的。重链通过fc模块的ch3界面上存在的先前描述的杵-臼(knobs into holes)突变异二聚化。
[0130]
在一些实施方式中,不对称分子可以如图8所说明。该实例类似于图7中所示的分子,不同之处在于两个n末端fab单元以以下方式配置:轻链1和轻链2通过cκ或cλ的c末端和每个相应vh的n末端之间的接头与重链1和重链2物理相连。在每种情况下,接头可以是36-80个氨基酸长度并且由丝氨酸、甘氨酸、丙氨酸和苏氨酸残基构成。物理相连的n末端轻链
通过vh/vl相互作用以及cκ或cλ与ch1的相互作用与每条重链的n末端vh-ch1结构域交界。cκ或cλ与ch1之间存在天然二硫键,在轻链和重链之间提供额外稳定性。
[0131]
双特异性分子也可以具有混合形式。这在例如,图9、图10和图11中说明。
[0132]
例如,如图9所图示的,说明了与图7的部分形式选择组合的基于同二聚体fc的方法(参见图3、4和5),其中总分子价为四,但特异性限于双特异性。n末端由两个相同的基于vh3种系的可溶性vh结构域构成,并且c末端由两个相同的基于vh3种系的可溶性vh结构域组成,它们对n末端结构域具有不同的特异性。因此,每个特异性具有二价。同样,在这种形式中,四个附连/融合点中任一处的任何抗体部分可以被非抗体部分(例如,不包括抗体分子的效应物结合/调节部分)替换。
[0133]
图10图示了另一实例。在该实例中,分子由四个基于vh3种系的可溶性vh结构域构成。前两个结构域具有相同的特异性(例如抑制性受体),从n末端开始的第3个结构域可以对组织抗原具有特异性,以及从n末端开始的第四个结构域可以对人血清白蛋白(hsa)具有特异性,从而使分子在缺乏ig fc结构域的情况下延长半衰期。结构域1和2、结构域2和3以及结构域3和4之间存在三个富含甘氨酸、丝氨酸、丙氨酸和/或苏氨酸的接头。这种形式可以被配置为最高达四特异性,但在每种情况下都是单价的,或者具有双特异性并且在每种情况下都是二价的。结构域的顺序可以改变。同样,在这种形式中,任何抗体部分都可以被非抗体部分(例如,不包括抗体分子的效应物结合/调节部分)替换。
[0134]
图11图示了又另一种方法。该实例类似于图3和4,因为它基于fc同二聚体,在分子的n末端具有两个相同的fab单元(二价单特异性)。该实例的不同之处在于每条重链的c末端附加有级联scfv。因此,在每种情况下,fc的ch3结构域的c末端通过基于甘氨酸/丝氨酸/丙氨酸/苏氨酸的接头连接到第一vh结构域的n末端,第一vh结构域在c末端通过12-15个氨基酸的富含甘氨酸/丝氨酸的接头连接到第一vl结构域的n末端,第一vl结构域通过在c末端的25-35个氨基酸的基于甘氨酸/丝氨酸/丙氨酸/苏氨酸的接头连接到第二vh结构域的n末端,第二vh结构域在c末端通过12-15个氨基酸的基于甘氨酸/丝氨酸的接头连接到第2vl结构域的n末端。因此,在这种基于fc同二聚体的分子中,在分子的c末端存在两个相同的级联scfv,例如为单个组织抗原提供四价或为两个不同分子提供二价。这种形式也可以适配有异二聚体fc核心,通过使用如图5、6和7中的单链fab构型,允许在fc的c末端有两个不同的级联scfv,允许c末端的单价四特异性,同时保留n末端的二价单特异性或n末端的单价双特异性。因此,该分子可以被配置为具有2、3、4、5或6特异性。级联scfv单元内scfv的结构域顺序可以被配置为从n到c末端vh-接头-vl或vl-接头-vh。同样,在这种形式中,四个附连/融合点中任一处的任何抗体部分可以被非抗体部分(例如,不包括抗体分子的效应物结合/调节部分)替换。
[0135]
还可以构建具有例如更短的全身pk同时具有增加的组织渗透的双特异性抗体。这些类型的抗体可以基于例如基于人vh3的域抗体形式。这些在例如图12、图13和图14中图示。图12、13和14各自包括基于vh3种系家族的可溶性vh结构域模块。每个结构域为大约12.5kda,允许小的整体mw,其不受任何特定理论的束缚,这应当有利于增强组织渗透。在这些实例中,没有一个vh结构域识别任何半衰期延长靶标,诸如fcrn或hsa。如图12所示的,该分子由两个vh结构域构成,它们通过第一结构域的c末端和第二结构域的n末端之间的柔性亲水性基于甘氨酸/丝氨酸的接头连接。在这个实例中,一个结构域可以识别t细胞共刺激
受体,并且第二个可以识别组织栓系抗原。如图13所图示的,分子由具有基于甘氨酸/丝氨酸的亲水性接头的n-c末端连接的三个vh结构域构成。分子可以被配置为三特异性的但对于每个靶标是单价的。它可以是双特异性的,对于一个靶标为双价并且对于另一个为单价。如图14所图示的,分子由具有四个vh结构域构成,每个结构域之间具有n-c末端的富含甘氨酸/丝氨酸的接头。该分子可以被配置为四特异性的、三特异性的或双特异性的,在每种情况下具有不同抗原价。同样,在这种形式中,任何抗体部分都可以被非抗体部分(例如,不包括抗体分子的效应物结合/调节部分)替换。
[0136]
双特异性抗体的其他实施方式在图15和16中图示。图15和16由人igg ch1/cκ界面的天然异二聚化核心构成,其包括共价锚定相互作用的c末端重/轻二硫键。这种形式不包含fc或任何用于延长半衰期的部分。如图15所图示的,该分子在恒定κ结构域的n末端处附加有scfv片段,所述scfv片段由以下组成:n末端vh结构域在其c末端通过12-15个氨基酸的基于gly/ser的接头连接至vl结构域的n末端,所述vl结构域在其c末端通过天然vl-cκ肘部序列连接到恒定κ结构域的n末端。ch1结构域在n末端附加有scfv片段,所述scfv片段由以下组成:n末端vl结构域在其c末端通过12-15个氨基酸的gly/ser接头连接至vh结构域的n末端,所述vh结构域在其c末端通过天然vh-ch1肘部序列连接到ch1结构域的n末端。如图16所图示的,分子具有与实施例13相同的n末端构型。然而,恒定κ和ch1结构域的c末端附加有scfv模块,其可以是vh-vl或vl-vh构型,并且可以对相同抗原具有特异性或对两种不同抗原具有特异性。vh/vl结构域间接头可以是12-15个氨基酸的长度并且由gly/ser残基组成。scfv结合亚单元可以被交换成可溶性vh结构域或肽识别元件,或者甚至级联scfv元件。这种方法也可以被配置为使用可变λ和/或恒定λ结构域。同样,在这种形式中,附连/融合点中任一处的任何抗体部分可以被非抗体部分(例如,不包括抗体分子的效应物结合/调节部分)替换。
[0137]
图17图示了另一种实施方式。图17表示由以下组成的级联scfv形式:第一n末端vl结构域在其c末端用12-15个氨基酸的富含gly/ser的接头连接至第一vh结构域的n末端,在第一vh c末端通过25-30个氨基酸的基于gly/ser/ala/thr的接头连接至第二vl结构域的n末端。第二vl结构域在c末端通过12-15个氨基酸的gly/ser接头连接至第2vh结构域的n末端。每个scfv识别不同的靶抗原,诸如共刺激t细胞分子和组织栓系靶标。同样,在这种形式中,任何抗体部分都可以被非抗体部分(例如,不包括抗体分子的效应物结合/调节部分)替换。
[0138]
图18图示了另一种实施方式。图18是f(ab’)2 scfv融合物。这由人igg ch1结构域的天然人igg1铰链区c末端中的通过两个二硫键连接的两个相同的fab组分组成。不存在人igg1ch2和ch3结构域。在重链1和2的c末端是两个相同的scfv片段,它们通过富含gly/ser/ala/thr的接头连接至huigg1铰链区的c末端。在所示的构型中,vh在每个scfv单元的n末端,并通过12-15个氨基酸的富含gly/ser的接头连接至vl结构域的n末端。替代地构型是n末端-vl-接头-vh-c末端。在该设计中,构建体是双特异性的,对于每个靶标具有二价。同样,在这种形式中,四个附连/融合点中任一处的任何抗体部分可以被非抗体部分(例如,不包括抗体分子的效应物结合/调节部分)替换。
[0139]
如本文所用的术语,cd39分子是指具有足够的cd39序列的多肽,作为治疗化合物的一部分,它将atp磷酸水解为amp。在一些实施方式中,cd39分子将atp磷酸水解为amp,相
当于或至少为天然存在的cd39(cd39分子来源的cd39)的速率的10%、20%、30%、40%、50%、60%、70%、80%、90%或95%。在一些实施方式中,cd39分子与天然存在的cd39具有至少60、70、80、90、95、99或100%的序列同一性或实质上的序列同一性。
[0140]
可以使用任何功能同工型(具有cd39或本文讨论的其他蛋白质)。示例性cd39序列包括genbank accession#np_001767.3或来自以下序列的成熟形式:
[0141]
medtkesnvktfcsknilailgfssiiaviallavgltqnkalpenvkygivldagsshtslyiykwpaekendtgvvhqveecrvkgpgiskfvqkvneigiyltdcmerareviprsqhqetpvylgatagmrllrmeseeladrvldvverslsnypfdfqgariitgqeegaygwitinyllgkfsqktrwfsivpyetnnqetfgaldlggastqvtfvpqnqtiespdnalqfrlygkdynvythsflcygkdqalwqklakdiqvasneilrdpcfhpgykkvvnvsdlyktpctkrfemtlpfqqfeiqgignyqqchqsilelfntsycpysqcafngiflpplqgdfgafsafyfvmkflnltsekvsqekvtemmkkfcaqpweeiktsyagvkekylseycfsgtyilslllqgyhftadswehihfigkiqgsdagwtlgymlnltnmipaeqplstplshstyvflmvlfslvlftvaiigllifhkpsyfwkdmv(seq id no:1)。
[0142]
在一些实施方式中,cd39分子包括在人或鼠血清中循环中发现的cd39的可溶性催化活性形式,参见例如metabolism of circulating adp in the bloodstream is mediated via integrated actions of soluble adenylate kinase-1 and ntpdase1/cd39 activities,yegutkin et al.faseb j.2012 sep;26(9):3875-83。可溶性重组cd39片段也描述于以下中:inhibition of platelet function by recombinant soluble ecto-adpase/cd39,gayle,et al.,j clin invest.1998 may 1;101(9):1851
–
1859。
[0143]
如本文所用的术语,cd73分子是指具有足够的cd73序列的多肽,作为治疗化合物的一部分,它将细胞外amp去磷酸化为腺苷。在一些实施方式中,cd73分子将细胞外amp去磷酸化为腺苷,相当于或至少为天然存在的cd73(cd73分子来源的cd73)的速率的10%、20%、30%、40%、50%、60%、70%、80%、90%或95%。在一些实施方式中,cd73分子与天然存在的cd73具有至少60、70、80、90、95、99或100%的序列同一性或实质上的序列同一性。示例性cd73序列包括genbank aah65937.1 5'-核苷酸酶,(cd73)[智人]或来自以下序列的成熟形式,mcpraarapatlllalgavlwpaagaweltilhtndvhsrleqtsedsskcvnasrcmggvarlftkvqqirraepnvllldagdqyqgtiwftvykgaevahfmnalrydamalgnhefdngvegliepllkeakfpilsanikakgplasqisglylpykvlpvgdevvgivgytsketpflsnpgtnlvfedeitalqpevdklktlnvnkiialghsgfemdkliaqkvrgvdvvvgghsntflytgnppskevpagkypfivtsddgrkvpvvqayafgkylgylkiefdergnvisshgnpillnssipedpsikadinkwrikldnystqelgktivyldgssqscrfrecnmgnlicdaminnnlrhadetfwnhvsmcilngggirspidernngtitwenlaavlpfggtfdlvqlkgstlkkafehsvhrygqstgeflqvggihvvydlsrkpgdrvvkldvlctkcrvpsydplkmdevykvilpnflanggdgfqmikdellrhdsgdqdinvvstyiskmkviypavegrikfstgshchgsfsliflslwavifvlyq(seq id no:2)。
[0144]
在一些实施方式中,cd73分子包括cd73的可溶性形式,其可以通过蛋白水解切割或剪切应力对gpi锚的水解而从内皮细胞膜脱落,参见例如参考文献:yegutkin g,bodin p,burnstock g.effect of shear stress on the release of soluble ecto-enzymes atpase and 5
’‑
nucleotidase along with endogenous atp from vascular endothelial cells.br j pharmacol 2000;129:921
–
6。对于cd73功能,参见colgan et al.,physiological roles for ecto-5
’‑
nucleotidase(cd73),purinergic signalling,june 2006,2:351。
[0145]
如本文所用的术语,细胞表面分子结合剂是指与细胞(例如免疫抑制性免疫细胞,例如,treg)上的细胞表面分子结合(例如特异性结合)的分子,通常是多肽。在一些实施方式中,细胞表面结合剂具有来自细胞表面分子的天然存在的配体的足够的序列,使得它可以特异性结合细胞表面分子(细胞表面分子配体)。在一些实施方式中,细胞表面结合是结合(例如特异性结合)细胞表面分子的抗体分子。
[0146]
如本文所用的术语,供体特异性靶向部分是指作为治疗化合物的组分,将治疗化合物优先定位于植入的供体组织而不是接受者组织的部分,例如抗体分子。作为治疗化合物的组分,供体特异性靶向部分为来自供体的移植组织(例如器官)提供位点特异性免疫赦免。
[0147]
在一些实施方式中,供体特异性靶向部分,它与基因座处存在的等位基因的产物,例如多肽产物结合,该等位基因不存在于(接受者)受试者的基因座处。在一些实施方式中,供体特异性靶向部分与产物上的表位结合,该表位不存在于(接受者)受试者中。
[0148]
在一些实施方式中,供体特异性靶向部分,作为治疗化合物的组分,优先与供体靶标或抗原结合,例如,对于供体抗原或组织,具有的对供体靶标的结合亲合力比它对受试者抗原或组织的亲合力大,例如是其至少2、4、5、10、50、100、500、1,000、5,000或10,000倍。在一些实施方式中,供体特异性靶向部分对供体组织中存在(但受试者中不存在)基因座的等位基因产物的结合亲合力是它对受试者中存在的基因座的等位基因(该等位基因不存在于供体组织中)的产物的亲和力的至少2、4、5、10、50、100、500、1,000、5,000或10,000倍。可以在细胞悬浮液中测量以供体特异性部分为组分的治疗化合物的亲和力,例如,将对具有等位基因的悬浮细胞的亲和力与它对不具有等位基因的悬浮细胞的亲和力进行比较。在一些实施方式中,对供体等位基因细胞的结合亲和力低于10nm。在一些实施方式中,对供体等位基因细胞的结合亲和力低于100pm、50pm或10pm。
[0149]
在一些实施方式中,对供体等位基因产物的特异性足以使得当供体特异性靶向部分与免疫下调效应物偶联时:i)植入组织的免疫攻击(例如,通过临床环境中的组织学炎症反应、浸润性t效应细胞或器官功能,例如肾脏的肌酐来测量的)大幅下降,例如与在其他方面类似的植入物但缺少与免疫下调效应物偶联的供体特异性靶向部分中看到的相比;和/或ii)在植入组织之外或远离植入组织,接受者中的免疫功能基本得以维持。在一些实施方式中,看到以下一种或多种:在治疗化合物的治疗水平下,外周血淋巴细胞计数基本上不受影响,例如t细胞水平在正常的25%、50%、75%、85%、90%或95%以内,b细胞水平在正常的25%、50%、75%、85%、90%或95%以内,和/或粒细胞(pmn)细胞水平在正常的25%、50%、75%、85%、90%或95%以内,或单核细胞水平在正常的25%、50%、75%、85%、90%或95%以内;在治疗化合物的治疗水平下,pbmc(外周血单核细胞)针对非疾病相关抗原的离体增殖功能基本上正常或在正常的70%、80%或90%以内;在治疗化合物的治疗水平下,与免疫抑制相关的机会性感染和癌症风险的发生率或风险相对于正常未大幅增加;或在治疗化合物的治疗水平下,与免疫抑制相关的机会性感染和癌症的风险的发生率或风险远低于利用标准护理或非靶向免疫抑制所见的。在一些实施方式中,供体特异性靶向部分包括抗体分子、靶特异性结合多肽或靶配体结合分子。
[0150]
如本文所用的术语,效应物是指介导免疫应答的实体,例如细胞或分子,例如可溶性或细胞表面分子。
[0151]
如本文所用,效应物配体结合分子是指具有来自效应物的天然存在的反配体的足够的序列的多肽,它可以以足够的特异性结合效应物,从而它可以充当效应物结合/调节分子。在一些实施方式中,它以天然存在的反配体的至少10%、20%、30%、40%、50%、60%、70%、80%、90%或95%的亲和力结合效应物。在一些实施方式中,它与效应物的天然存在的反配体具有至少60%、70%、80%、90%、95%、99%或100%的序列同一性,或实质上的序列同一性。
[0152]
如本文所用,效应物特异性结合多肽是指能够以足够的特异性结合的多肽,从而它可以充当效应物结合/调节部分。在一些实施方式中,特异性结合多肽包括效应物配体结合分子。
[0153]
如本文所用,升高的风险是指受试者中疾患的风险,其中受试者具有疾患或疾患的症状的病史、与疾患或疾患的症状相关的生物标志物、或疾患或疾患的症状的家族史中的一种或多种。
[0154]
如本文所用术语,针对效应物或抑制性免疫检查点分子的功能性抗体分子是指当作为多聚化治疗化合物的icim结合/调节部分存在时,可以结合并激动效应物或抑制性免疫检查点分子的抗体分子。在一些实施方式中,当作为单体结合(或当治疗化合物未多聚化时结合)效应物或抑制性免疫检查点分子时,抗效应物或抑制性免疫检查点分子抗体分子不拮抗、基本上不拮抗、不阻止或基本上不阻止抑制性免疫检查点分子的内源反配体与抑制性免疫检查点分子的结合。在一些实施方式中,当作为单体结合(或当治疗化合物未多聚化时结合)抑制性免疫检查点分子时,抗效应物或抑制性免疫检查点分子抗体分子不激动或基本上不激动效应物或抑制性分子。
[0155]
如本文所用的术语,icim结合/调节部分是指以下效应物结合/调节部分:作为治疗化合物的一部分,结合并激动细胞表面抑制性分子,例如抑制性免疫检查点分子,例如pd-1,或者结合或调节细胞信号传导,例如结合fcrl,例如fcrl1-6,或者结合并拮抗促进免疫功能的分子。
[0156]
如本文所用的术语,iic结合/调节部分是指作为治疗化合物的一部分,结合免疫抑制性免疫细胞的效应物结合/调节部分。在一些实施方式中,iic结合/调节部分增加结合位点处的免疫抑制性免疫细胞的数量或浓度。
[0157]
如本文所用的术语,icsm结合/调节部分是指拮抗刺激性(例如共刺激性)结合对的免疫刺激作用的效应物结合/调节部分。如本文所用的术语,刺激性或共刺激性结合对包括两个成员:1)免疫细胞表面上的分子;和2)该细胞分子的结合配偶体,其可以是额外的免疫细胞或非免疫细胞。通常,在一个成员与另一个结合后,假设满足其他要求,免疫细胞表面上的成员会刺激免疫细胞,例如共刺激分子,并且免疫应答得到促进。在共刺激分子和共刺激分子反结构两者都在免疫细胞上表达的情况下,可能会发生两种细胞的双向激活。在实施方式中,icsm结合/调节部分结合并拮抗结合对的免疫细胞表达的成员。例如,它结合并拮抗ox40。在另一种实施方式中,icsm结合/调节部分结合并拮抗本身结合免疫细胞表达成员的结合对成员,例如,它结合并拮抗ox40l。在任一情况下,都实现了对免疫细胞的刺激或共刺激的抑制。在实施方式中,icsm结合/调节部分减少结合位点处的免疫刺激性免疫细胞的数量或活性。
[0158]
如本文所用的术语,il-2突变蛋白分子是指以高亲和力结合cd25(il-2rα链)并以
低亲和力结合其他il-2r信号传导组分cd122(il-2rβ)和cd132(il-2rγ)的il2变体。这种il-2突变蛋白分子优先激活treg细胞。在实施方式中,单独地或作为治疗化合物的组分,il-2突变蛋白以细胞毒性或效应t细胞的至少2、5、10或100倍活化treg。示例性的il-2突变蛋白分子描述于wo2010085495、wo2016/164937、us2014/0286898a1、wo2014153111a2、wo2010/085495、细胞毒性wo2016014428a2,wo2016025385a1以及us20060269515中。这些参考文献中公开的包括额外结构域(例如fc结构域,或用于延长半衰期的其他结构域)的突变蛋白可以在没有这样的额外结构域的本文所述的治疗化合物和方法中使用。在另一种实施方式中,iic结合/调节部分包括il-2突变蛋白或其活性片段,其偶联例如融合至另一多肽,例如延长体内半衰期的多肽,例如免疫球蛋白恒定区,或其多聚体或二聚体,例如amg 592。在实施方式中,治疗化合物包括amg 592的il-2部分。在实施方式中,治疗化合物包括il-2部分但不包括amg 592的免疫球蛋白部分。在一些实施方式中,突变蛋白不包括fc区中。对于一些il-2突变蛋白,突变蛋白被工程化为包含fc区,因为这样的区域已被证明增加突变蛋白的半衰期。在一些实施方式中,延长的半衰期对于本文描述和体现的方法不是必需的。在一些实施方式中,与il-2突变蛋白融合的fc区包括n297突变,诸如但不限于n297a。在一些实施方式中,与il-2突变蛋白融合的fc区不包括n297突变,诸如但不限于n297a。
[0159]
如本文所用的术语,“抑制性免疫检查点分子配体分子”是指具有足够的抑制性免疫检查点分子配体序列的多肽,例如,在pd-l1分子的情况下,具有足够的pd-l1序列,当作为多聚化治疗化合物的icim结合/调节部分存在时,可以结合并激动其同源抑制性免疫检查点分子,例如,同样在pd-l1分子的情况下,为pd-1。
[0160]
在一些实施方式中,当作为单体结合(或当治疗化合物未多聚化时结合)其同源配体例如pd-1时,抑制性免疫检查点分子配体分子,例如pd-l1分子不拮抗或基本上不拮抗或不阻止或基本上不阻止内源抑制性免疫检查点分子配体与抑制性免疫检查点分子的结合。例如,在pd-l1分子的情况下,pd-l1分子不拮抗内源pd-l1与pd-1的结合。
[0161]
在一些实施方式中,当作为单体结合其同源抑制性免疫检查点分子时,抑制性免疫检查点分子配体不激动或基本上不激动抑制性免疫检查点分子。举例来说,例如,当与pd-1结合时,pd-l1分子不激动或基本上不激动pd-1。
[0162]
在一些实施方式中,抑制性免疫检查点分子配体分子与天然存在的抑制性免疫检查点分子配体具有至少60%、70%、80%、90%、95%、99%或100%的序列同一性,或实质上的序列同一性。
[0163]
示例性抑制性免疫检查点分子配体分子包括:pd-l1分子,其结合抑制性免疫检查点分子pd-1,并且在实施方式中与天然存在的pd-l1(例如包括以下序列的pd-l1分子)具有至少60%、70%、80%、90%、95%、99%或100%的序列同一性,或实质上的序列同一性:
[0164]
mrifavfifmtywhllnaftvtvpkdlyvveygsnmtieckfpvekqldlaalivywemedkniiqfvhgeedlkvqhssyrqrarllkdqlslgnaalqitdvklqdagvyrcmisyggadykritvkvnapynkinqrilvvdpvtseheltcqaegypkaeviwtssdhqvlsgkttttnskreeklfnvtstlrintttneifyctfrrldpeenhtaelvipelplahppnerthlvilgaillclgvaltfifrlrkgrmmdvkkcgiqdtnskkqsdthleet(seq id no:3),或其活性片段;在一些实施方式中,活性片段包括pd-l1序列的残基19至290;hla-g分子,其与抑制性免疫检查点分子kir2dl4、lilrb1和lilrb2中的任一个结合,并且在实施方式中与天然存在的hla-g具有至少60%、70%、80%、90%、95%、99%或100%的序列同一
性,或实质上的序列同一性。示例性的hla-g序列包括,例如,在以下序列中发现的成熟形式:genbank p17693.1 recname:full=hla i类组织相容性抗原,α链g;altname:full=hla g抗原;altname:full=mhc i类抗原g;flags:前体,或在以下序列中mvvmaprtlflllsgaltltetwagshsmryfsaavsrpgrgeprfiamgyvddtqfvrfdsdsacprmeprapwveqegpeyweeetrntkahaqtdrmnlqtlrgyynqseasshtlqwmigcdlgsdgrllrgyeqyaydgkdylalnedlrswtaadtaaqiskrkceaanvaeqrraylegtcvewlhrylengkemlqradppkthvthhpvfdyeatlrcwalgfypaeiiltwqrdgedqtqdvelvetrpagdgtfqkwaavvvpsgeeqrytchvqheglpeplmlrwkqsslptipimgiva(seq id no:4)。
[0165]
如本文所用的术语,抑制性分子反配体分子是指以下多肽:具有足够的抑制性分子反配体序列使得当作为多聚化治疗化合物的icim结合/调节部分存在时,可以结合并激动同源抑制性分子。在一些实施方式中,当作为单体结合(或当治疗化合物未多聚化时结合)抑制性分子时,抑制性分子反配体分子不拮抗、基本上不拮抗、不阻止或基本上不阻止抑制性分子的内源反配体与抑制性分子的结合。在一些实施方式中,当作为单体结合(或当治疗化合物未多聚化时结合)抑制性分子时,抑制性分子反配体分子不激动或基本上不激动抑制性分子。
[0166]
如本文所用的那些术语,序列同一性、百分比同一性和相关术语是指两个序列(例如,两个核酸序列或两个氨基酸或多肽序列)的相关性。在氨基酸序列的情况下,术语“基本上相同”在本文中用于指第一氨基酸包含足够的或最少数目的以下氨基酸残基:所述氨基酸残基与第二氨基酸序列中的比对氨基酸残基i)是相同的或ii)是保守置换,使得第一和第二氨基酸序列可以具有共同的结构域和/或共同的功能活性。例如,包含与参考序列(例如本文提供的序列)具有至少约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的共同结构域的氨基酸序列。
[0167]
在核苷酸序列的情况下,术语“基本上相同”在本文中用于指第一核酸序列包含足够的或最少数目的与第二核酸序列中的比对核苷酸相同的核苷酸,使得第一和第二核苷酸序列编码具有共同功能活性的多肽,或编码共同结构多肽结构域或共同功能多肽活性。例如,与参考序列(例如本文提供的序列)具有至少约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的核苷酸序列。
[0168]
术语“功能变体”是指具有与天然存在的序列基本上相同的氨基酸序列,或由基本上相同的核苷酸序列编码并且能够具有天然存在的序列的一种或多种活性的多肽。
[0169]
序列之间的同源性或序列同一性(术语在本文中可互换使用)的计算如下进行。
[0170]
为了确定两个氨基酸序列或两个核酸序列的百分比同一性,出于最佳比较目的对序列进行比对(例如,可以在第一和第二氨基酸或核酸序列中的一个或两个中引入缺口以用于最佳比对,并且出于比较目的可以忽略非同源序列)。在优选的实施方式中,出于比较目的比对的参考序列的长度为参考序列长度的至少30%,优选至少40%,更优选至少50%、60%,并且甚至更优选至少70%、80%、90%、100%。然后比较相应氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸。当第一序列中的一个位置被与第二序列中相应位置处相同的氨基酸残基或核苷酸占据时,那么分子在该位置是相同的(如本文所用,氨基酸或核酸“同一性”等同于氨基酸或核酸“同源性”)。
[0171]
考虑到为两个序列的最佳比对需要引入的缺口的数目和每个缺口的长度的情况
下,两个序列之间的百分比同一性随着序列共享的相同位置的数目的变化而变化。
[0172]
序列的比较和两个序列之间的百分比同一性的确定可以使用数学算法来完成。在优选的实施方式中,使用以下确定两个氨基酸序列之间的百分比同一性:已并入gcg软件包(可从http://www.gcg.com获得)中的gap程序的needleman and wunsch((1970)j.mol.biol.48:444-453)算法,使用blossum 62矩阵或pam250矩阵以及缺口权重为16、14、12、10、8、6或4和长度权重为1、2、3、4、5或6。在又另一种优选的实施方式中,使用以下确定两个核苷酸序列之间的百分比同一性:gcg软件包(可在http://www.gcg.com获得)中的gap程序,使用nwsgapdna.cmp矩阵以及缺口权重为40、50、60、70或80和长度权重为1、2、3、4、5或6。特别优选的参数组(除非另有说明,否则应该使用的参数)是blossum 62评分矩阵,其中缺口罚分为12,缺口延长罚分为4,并且移码缺口罚分为5。
[0173]
可以使用以下确定两个氨基酸或核苷酸序列之间的百分比同一性:已经并入align程序(2.0版)的e.meyers and w.miller((1989)cabios,4:11-17)的算法,使用pam120权重残基表,缺口长度罚分为12并且缺口罚分4。
[0174]
本文所述的核酸和蛋白质序列可以用作“查询序列”以对公共数据库进行搜索以例如鉴定其他家族成员或相关序列。这样的搜索可以使用altschul,et al.(1990)j.mol.biol.215:403-10的nblast和xblast程序(2.0版)进行。blast核苷酸搜索可以用nblast程序,得分=100,字长=12进行,以获得与例如本文提供的任何核酸序列同源的核苷酸序列。blast蛋白质搜索可以用xblast程序,得分=50,字长=3进行,以获得与本文提供的蛋白质分子同源的氨基酸序列。为了获得用于比较目的的缺口比对,可以如altschul et al.,(1997)nucleic acids res.25:3389-3402中所述使用缺口blast。当使用blast和缺口blast程序时,可以使用各自程序(例如xblast和nblast)的默认参数。参见http://www.ncbi.nlm.nih.gov。
[0175]
如本文所用,术语“在低严格性、中等严格性、高严格性或非常高严格性条件下的杂交”描述了用于杂交和洗涤的条件。用于进行杂交反应的指导可以在current protocols in molecular biology,john wiley&sons,n.y.(1989),6.3.1-6.3.6中找到,其通过援引并入。在该参考文献中描述了水性和非水性方法,并且可以使用其任一种。本文涉及的特定杂交条件如下:1)低严格性杂交条件,在约45℃的6x氯化钠/柠檬酸钠(ssc)中,然后在至少50℃的0.2x ssc、0.1%sds中洗涤两次(对于低严格条件,洗涤温度可以提高至55℃);2)中等严格性杂交条件,在约45℃的6x ssc中,然后在60℃的0.2x ssc、0.1%sds中洗涤一次或多次;3)高严格性杂交条件,在约45℃的6x ssc中,然后在65℃的0.2x ssc、0.1%sds中洗涤一次或多次;以及优选地4)非常高严格性杂交条件是65℃的0.5m磷酸钠、7%sds,然后在65℃的0.2x ssc、1%sds中洗涤一次或多次。除非另有说明,否则非常高严格性条件(4)是优选条件和应当使用的条件。
[0176]
应理解,本实施方式的分子和化合物可以具有对其功能没有实质影响的额外的保守或非必需氨基酸置换。
[0177]
术语“氨基酸”旨在包括以下:包括氨基官能团和酸官能团二者并且能够包括在天然存在的氨基酸的聚合物中的所有分子,无论是天然的还是合成的。示例性氨基酸包括天然存在的氨基酸;其类似物、衍生物和同类物;具有变异侧链的氨基酸类似物;以及上述任何一种的任一的所有立体异构体。如本文所用,术语“氨基酸”包括d-或l-旋光异构体和肽
模拟物。
[0178]“保守氨基酸置换”是其中氨基酸残基被具有相似侧链的氨基酸残基替代的置换。具有相似侧链的氨基酸残基家族已在本领域中定义。这些家族包括具有以下的氨基酸:碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-支链侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。cd39分子、cd73分子、细胞表面分子结合剂、供体特异性靶向部分、效应物配体结合分子、icim结合/调节部分、iic结合/调节部分、抑制性免疫检查点分子配体分子、抑制性分子反配体分子、sm结合/调节部分或icsm结合/调节部分。
[0179]
如本文所用的术语,sm结合/调节部分是指作为治疗化合物的一部分促进免疫抑制性局部微环境的效应物结合/调节部分,例如通过在靶标附近提供抑制或最小化免疫系统对靶标的攻击的物质。在一些实施方式中,sm结合/调节部分包括或结合抑制或最小化免疫系统对靶标的攻击的分子。在一些实施方式中,治疗化合物包括结合并积累具有免疫抑制功能的可溶性物质(例如内源或外源物质)的sm结合/调节部分。在一些实施方式中,治疗化合物包括结合和抑制、隔离、降解或以其他方式中和促进免疫攻击的物质,例如可溶性物质,通常并且内源性可溶性物质的sm结合/调节部分。在一些实施方式中,治疗化合物包括以下sm结合/调节部分,其包括免疫抑制物质,例如已知具有免疫抑制性的蛋白质片段。举例来说,效应物分子结合部分结合或包括消耗促进免疫效应细胞功能的组分例如atp或amp的物质,例如cd39分子或cd73分子。
[0180]
如本文所用的术语,特异性靶向部分是指供体特异性靶向部分或组织特异性靶向部分。
[0181]
如本文所用的术语,受试者是指哺乳动物受试者,例如人受试者。在一些实施方式中,受试者是非人哺乳动物,例如马、狗、猫、牛、山羊或猪。
[0182]
如本文所用,靶配体结合分子是指具有来自靶配体的天然存在的反配体的足够的序列的多肽,它可以以足够的特异性与靶组织(例如供体组织或受试者靶组织)上的靶配体结合,从而它可以充当特异性靶向部分。在一些实施方式中,它以天然存在的反配体的至少10%、20%、30%、40%、50%、60%、70%、80%、90%或95%的亲和力结合靶组织或细胞。在一些实施方式中,它与靶配体的天然存在的反配体具有至少60%、70%、80%、90%、95%、99%或100%的序列同一性,或实质上的序列同一性。
[0183]
如本文所用的术语,靶位点是指包含由靶向部分结合的实体(例如表位)的位点。在一些实施方式中,靶位点是建立免疫赦免的位点。
[0184]
如本文所用的术语,组织特异性靶向部分是指作为治疗分子的组分,将治疗分子优先定位于靶组织而不是受试者的其他组织的部分,例如抗体分子。作为治疗化合物的组分,组织特异性靶向部分为靶组织(例如经历自身免疫攻击或处于自身免疫攻击风险中的器官或组织)提供位点特异性免疫赦免。在一些实施方式中,组织特异性靶向部分与不存在于靶组织外部,或以足够低的水平存在的产物(例如多肽产物)结合,在治疗分子的治疗浓度下,不存在或基本上不存在不可接受的免疫抑制水平。在一些实施方式中,组织特异性靶向部分与表位结合,该表位不存在于靶位点外部或基本上不存在于靶位点外部。
[0185]
在一些实施方式中,组织特异性靶向部分,作为治疗化合物的组分,优先结合靶组织或靶组织抗原,例如,对于靶抗原或组织,具有的对靶组织或抗原的结合亲合力比它对存在于靶组织外部的非靶组织或抗原的亲合力大,例如是其至少2、4、5、10、50、100、500、1,000、5,000或10,000倍。可以在细胞悬浮液中测量以组织特异性部分为组分的治疗化合物的亲和力,例如,将对具有靶抗原的悬浮细胞的亲和力与它对不具有靶抗原的悬浮细胞的亲和力进行比较。在一些实施方式中,对带有靶抗原的细胞的结合亲和力低于10nm。
[0186]
在一些实施方式中,对带有靶抗原的细胞的结合亲和力低于100pm、50pm或10pm。在一些实施方式中,对靶抗原的特异性足以使得当组织特异性靶向部分与免疫下调效应物偶联时:i)靶组织的免疫攻击(例如,通过临床环境中的组织学炎症反应、浸润性t效应细胞或器官功能,例如肾脏的肌酐来测量的)大幅下降,例如与在其他方面类似的植入物但缺少与免疫下调效应物偶联的组织特异性靶向部分中看到的相比;和/或ii)在植入组织之外或远离靶组织,接受者中的免疫功能基本得以维持。
[0187]
在一些实施方式中,看到以下一种或多种:在治疗化合物的治疗水平下,外周血淋巴细胞计数基本上不受影响,例如t细胞水平在正常的25%、50%、75%、85%、90%或95%以内,b细胞水平在正常的25%、50%、75%、85%、90%或95%以内,和/或粒细胞(pmn)细胞水平在正常的25%、50%、75%、85%、90%或95%以内,或单核细胞水平在正常的25%、50%、75%、85%、90%或95%以内;在治疗化合物的治疗水平下,pbmc(外周血单核细胞)针对非疾病相关抗原的离体增殖功能基本上正常或在正常的70%、80%或90%以内;在治疗化合物的治疗水平下,与免疫抑制相关的机会性感染和癌症风险的发生率或风险相对于正常未大幅增加;或在治疗化合物的治疗水平下,与免疫抑制相关的机会性感染和癌症的风险的发生率或风险远低于利用标准护理或非靶向免疫抑制所见的。在一些实施方式中,组织特异性靶向部分包括抗体分子。在一些实施方式中,供体特异性靶向部分包括抗体分子、靶特异性结合多肽或靶配体结合分子。在一些实施方式中,组织特异性靶向部分结合仅在或基本上仅在靶组织上存在或表达的产物或产物上的位点。
[0188]
icim结合/调节部分:结合抑制性受体的效应物结合/调节部分
[0189]
本文所述的方法和化合物提供了具有效应物结合/调节部分的治疗化合物,所述效应物结合/调节部分包括icim结合/调节部分,其直接结合并激活免疫细胞表面上的抑制性受体,例如以减少或消除或基本上消除免疫细胞介导免疫攻击的能力。icim结合/调节部分与靶向实体的偶联促进了免疫细胞反应的位点特异性或局部下调,例如,基本上限于具有靶向部分的结合位点的位置。因此,基本上保留了正常的全身免疫功能。在一些实施方式中,icim结合/调节部分包括抑制性免疫检查点分子反配体分子,例如抑制性免疫检查点分子的天然配体或天然配体的片段(例如,pd-l1或hla-g)。在一些实施方式中,icim结合/调节部分包括与抑制性免疫检查点分子接合的功能性抗体分子,例如包括scfv结合结构域的功能性抗体分子。
[0190]
在一些实施方式中,包括例如功能性抗体分子或抑制性免疫检查点分子配体分子的icim结合/调节部分结合抑制性受体但不阻止抑制性受体的天然配体与抑制性受体的结合。在实施方式中,使用以下形式:其中靶向部分与包括例如scfv结构域的icim结合/调节部分偶联(例如融合),并且被配置为使得当在溶液(例如,在血液或淋巴液)(并且可能是单体形式)中结合抑制性受体时,治疗分子:i)不能激动,或不能大幅激动(例如,以完全激动
分子所见的水平的小于30%、20%、15%、10%或5%激动)免疫细胞上的抑制性受体;和/或ii)不能拮抗,或不能大幅拮抗(例如,以完全拮抗分子所见的水平的小于30%、20%、15%、10%或5%拮抗)免疫细胞上的抑制性受体。可以通过候选分子在基于体外细胞的测定(其中未表达靶标,例如,使用基于mlr的测定(混合淋巴细胞反应))中增加或减少免疫应答的能力来评估其激动或不激动的能力。
[0191]
在一些实施方式中,候选icim结合/调节部分可以减少、完全或基本上消除全身免疫抑制和全身免疫激活。在一些实施方式中,当与靶标结合时,治疗化合物的靶向结构域,将用于在需要免疫保护的组织表面上聚集或多聚化该治疗化合物。在一些实施方式中,icim结合/调节部分,例如包括scfv结构域的icim结合/调节部分,需要聚集或多聚体状态以能够向局部免疫细胞递送激动和免疫抑制信号或显著水平的这样的信号。这种类型的治疗可以例如,提供局部免疫抑制,同时使全身免疫系统不受干扰或基本上不受干扰。也就是说,免疫抑制定位于需要抑制的地方而不是全身性的,并且不是定位于特定区域或组织类型。
[0192]
在一些实施方式中,在与靶标例如靶器官、组织或细胞类型结合后,治疗化合物包被靶标,例如靶器官、组织或细胞类型。当循环淋巴细胞试图接合和破坏靶标时,这种治疗将仅在或以更大程度在治疗化合物积累的部位处提供“关闭”信号。
[0193]
可以评估候选治疗化合物结合(例如特异性结合)其靶标的能力,例如通过elisa、基于细胞的测定或表面等离激元共振。这种特性通常应该最大化,因为它介导了免疫赦免的位点特异性和局部性质。可以评估候选治疗化合物在与靶标结合时下调免疫细胞的能力,例如,通过基于细胞的活性测定。这种特性通常应该最大化,因为它介导了免疫赦免的位点特异性和局部性质。可以评估由单体(或非结合)形式的候选治疗化合物实现的下调水平,例如通过基于细胞的活性测定。这种特性通常应该被最小化,因为它可以介导免疫系统的全身性下调。可以评估由单体(或非结合)形式的候选治疗化合物实现的细胞表面抑制性分子(例如抑制性免疫检查点分子)的拮抗水平,例如通过基于细胞的活性测定。这种特性通常应该被最小化,因为它可以介导免疫系统的全身性有害激活。通常,应该选择和平衡特性以产生足够稳健的位点特异性免疫赦免,而没有不可接受水平的抑制性免疫检查点分子的非位点特异性激动或拮抗。
[0194]
示例性抑制性免疫检查点分子
[0195]
示例性抑制性分子(例如抑制性免疫检查点分子)(连同它们的反配体)可以在表1中找到。该表列出了示例性icim结合部分可以结合的分子。
[0196]
[0197][0198]
pd-l1/pd-1途径
[0199]
程序性细胞死亡蛋白1(通常称为pd-1)是一种属于免疫球蛋白超家族的细胞表面受体。pd-1在t细胞和其他细胞类型,包括但不限于b细胞、骨髓细胞、树突状细胞、单核细胞、t调节细胞、ink t细胞上表达。pd-1结合两种配体,pd-l1和pd-l2,并且是一种抑制性免疫检查点分子。在载有抗原的mch与t细胞上的t细胞受体接合的情况下,与同源配体pd-l1或pd-l2的接合最小化或阻止t细胞的活化和功能。pd-1的抑制作用可以包括促进淋巴结中抗原特异性t细胞的凋亡(程序性细胞死亡)和减少调节性t细胞(抑制t细胞)的凋亡两者。
[0200]
在一些实施方式中,治疗化合物包括激动pd-1抑制的icim结合/调节部分。icim结合/调节部分可以包括抑制性分子反配体分子,例如,包括pd-1的配体的片段(例如pd-l1或pd-l2的片段),或包括例如结合pd-1的scfv结构域的另一部分,例如功能性抗体分子。
[0201]
在一些实施方式中,治疗化合物包括优先结合受试者中不存在、以显著较低水平存在的供体抗原(例如来自表2的供体抗原)的靶向部分,并且被定位于受试者的供体移植组织上。在一些实施方式中,它不结合或基本上不结合其他组织。在一些实施方式中,治疗化合物可以包括对hla-a2具有特异性并特异性结合供体同种异体移植组织,但不结合或基本上不结合宿主组织的靶向部分。在一些实施方式中,治疗化合物包括icim结合/调节部分,例如抑制性分子反配体分子,例如包括pd-1的配体的片段(例如pd-l1或pd-l2的片段),或包括例如结合pd-1的scfv结构域的另一部分,例如功能性抗体分子,使得治疗化合物例如当与靶标结合时激活pd-1。治疗化合物靶向同种异体移植物并为同种异体移植物提供局部免疫赦免。
[0202]
在一些实施方式中,治疗化合物包括优先结合表3的抗原的靶向部分,并被定位于受试者(例如患有自身免疫性疾患(例如表3的自身免疫性疾患)的受试者)中的靶标上。在一些实施方式中,它不结合或基本上不结合其他组织。在一些实施方式中,治疗化合物包括icim结合/调节部分,例如抑制性分子反配体分子,例如包括pd-1的配体的片段(例如pd-l1或pd-l2的片段),或包括例如结合pd-1的scfv结构域的另一部分,例如功能性抗体分子,使得治疗化合物例如当与靶标结合时激活pd-1。治疗化合物靶向遭受自身免疫攻击的组织并为该组织提供局部免疫赦免。
[0203]
pd-l1和pdl2或由其衍生的多肽可以提供候选icim结合部分。然而,在单体形式中,例如,当治疗化合物在血液或淋巴液中循环时,该分子可能具有拮抗pd-l1/pd-1途径的不良作用,并且可能仅当在靶标(例如靶器官)表面聚集或多聚化时才激动pd-1途径。在一些实施方式中,治疗化合物包括icim结合/调节部分,该部分包括功能性抗体分子,例如scfv结构域,其对可溶形式的pd-1途径呈惰性或基本上惰性,但当在组织表面多聚化(通过靶向部分)时激动和驱动抑制信号。
[0204]
hla-g:kir2dl4/lilrb1/lilrb2途径
[0205]
kir2dl4、lilrb1和lilrb2是在t细胞、nk细胞和骨髓细胞上发现的抑制性分子。
hla-g是每一种的反配体。
[0206]
kir2dl4也称为cd158d、g9p、kir-103as、kir103、kir103as、kir、kir-2dl4、杀伤细胞免疫球蛋白样受体,以及两个ig结构域和长胞质尾区4。lilrb1也称为lilrb1、cd85j、ilt-2、ilt2、lir-1、lir1、mir-7、mir7、pir-b、pirb、白细胞免疫球蛋白样受体b1。lilrb2也称为cd85d、ilt-4、lir-2、lir2、mir-10、mir10和ilt4。
[0207]
包括hla-g分子的治疗化合物可用于例如利用包括hla-g分子的多聚化治疗化合物分子向包括kir2dl4、lilrb1和lilrb2中任一种的免疫细胞提供抑制信号,并且从而提供位点特异性免疫赦免。
[0208]
包括激动性抗kir2dl4、抗lilrb1或抗lilrb2抗体分子的治疗化合物可用于向包括kir2dl4、lilrb1和lilrb2中任一种的免疫细胞提供抑制信号。
[0209]
hla-g仅在多聚化时,例如在细胞表面表达或在与珠粒表面缀合时递送抑制信号。在实施方式中,提供了包括hla-g分子的治疗化合物,该治疗化合物在溶液中不会多聚化(或不会充分多聚化以导致显著水平的抑制性分子激动)。使用最小化溶液中的多聚化的hla-g分子将最小化免疫细胞的全身激动和有害的免疫抑制。
[0210]
尽管不希望受理论束缚,但据信除非多聚化,否则hla-g在下调中无效,治疗化合物通过靶向部分与靶标的结合使icim结合实体多聚化,并且多聚化的icim结合实体结合抑制性分子并将其聚集在免疫细胞表面,从而介导下调免疫细胞的负信号。因此,试图破坏靶组织的浸润免疫细胞(包括抗原呈递细胞和其他骨髓细胞、nk细胞和t细胞)被下调。
[0211]
虽然hla-g分子在单体形式时最小化拮抗作用是期望的,但lilrb1和lilrb2的冗余将最小化对全身的影响,即使有一些单体拮抗作用。
[0212]
在一些实施方式中,治疗化合物包括icim结合/调节部分,该部分包括hla-g分子,例如无b2m同工型(例如,hla-g5),参见carosella et al.,advances in immunology,2015,127:33。在无b2m形式中,hla-g优先结合lilrb2。
[0213]
用于构建hla-g分子的合适序列包括genbank p17693.1recname:full=hla i类组织相容性抗原,α链g;altname:full=hla g抗原;altname:full=mhc i类抗原g;flags:前体或
[0214]
mvvmaprtlflllsgaltltetwagshsmryfsaavsrpgrgeprfiamgyvddtqfvrfdsdsacprmeprapwveqegpeyweeetrntkahaqtdrmnlqtlrgyynqseasshtlqwmigcdlgsdgrllrgyeqyaydgkdylalnedlrswtaadtaaqiskrkceaanvaeqrraylegtcvewlhrylengkemlqradppkthvthhpvfdyeatlrcwalgfypaeiiltwqrdgedqtqdvelvetrpagdgtfqkwaavvvpsgeeqrytchvqheglpeplmlrwkqsslptipimgivaglvvlaavvtgaavaavlwrkkssd(seq id no:5)。可以测试候选hla-g分子在方法和化合物使用中的适用性,例如,通过类似于“synthetic hla-g proteins for therapeutic use in transplantation,”lemaoult et al.,2013 the faseb journal 27:3643中描述的方法。
[0215]
在一些实施方式中,治疗化合物包括优先结合受试者中不存在、以显著较低水平存在的供体抗原(例如来自表2的供体抗原)的靶向部分,并且被定位于受试者的供体移植组织上。在一些实施方式中,它不结合或基本上不结合其他组织。在一些实施方式中,治疗化合物可以包括对hla-a2具有特异性并特异性结合供体同种异体移植物但不结合宿主组织的靶向部分,并且与包括结合kir2dl4、lilrb1或lilrb2的hla-g分子的icim结合/调节部
分组合,使得例如当与靶标结合时治疗化合物激活kir2dl4、lilrb1或lilrb2。治疗化合物靶向同种异体移植物并为同种异体移植物提供局部免疫赦免。
[0216]
在一些实施方式中,治疗化合物包括优先结合组织特异性抗原,例如来自表3的抗原的靶向部分,并被定位于受试者(例如患有自身免疫性疾患(例如来自表3的自身免疫性疾患)的受试者)中的靶位点上。在一些实施方式中,它不结合或基本上不结合其他组织。在实施方式中,治疗化合物包括icim结合/调节部分,该i部分包括结合kir2dl4、lilrb1或lilrb2的hla-g分子,使得例如当与靶标结合时治疗化合物激活kir2dl4、lilrb1或lilrb2。治疗化合物靶向遭受自身免疫攻击的组织并为该组织提供局部免疫赦免。
[0217]
很可能可以工程化一种还可以结合lilrb1的稳定且可溶的hla-g-b2m融合蛋白。例如,hla-g的晶体结构是使用hla-g/b2m单体确定的(clements et al.2005 pnas 102:3360)。
[0218]
fcrl家族
[0219]
fcrl1-6通常抑制b细胞活化或功能。这些1型跨膜糖蛋白由5种免疫球蛋白样结构域的不同组合构成,其中每种蛋白质由3至9个结构域组成,并且在所有fcrl蛋白中都没有保守的单个结构域类型。一般来说,fcrl的表达仅限于淋巴细胞,主要在b淋巴细胞中表达。通常,fcrl的功能是压制b细胞活化。
[0220]
icim结合/调节部分可以包括激动性抗bcma抗体分子。在一些实施方式中,治疗化合物包括抗fcrl抗体分子和抗b细胞受体(bcr)抗体分子。尽管不希望受理论束缚,但据信包括两种特异性的抗体分子的治疗化合物将使fcrl与bcr紧密接近并抑制bcr信号传导。
[0221]
嗜乳脂蛋白和嗜乳脂蛋白样分子
[0222]
效应物结合/调节部分可以包括嗜乳脂蛋白的激动剂或拮抗剂。在一些实施方式中,效应物结合/调节部分,激动性或功能性btn1a1分子、btn2a2分子、btnl2分子或btnl1分子。
[0223]
如本文所用的术语,功能性btnxi分子(其中xi=1a1、2a2、l2或l1)是指具有足够的btnxi序列的多肽,作为治疗化合物的一部分,它抑制t细胞。在一些实施方式中,btnxi分子与天然存在的嗜乳脂蛋白和嗜乳脂蛋白样分子具有至少60%、70%、80%、90%、95%、99%或100%的序列同一性,或实质上的序列同一性。
[0224]
在一些实施方式中,效应物结合/调节部分,拮抗性btnl8分子。
[0225]
如本文所用的术语,拮抗性btnl8分子是指具有足够的btnl8序列的多肽,作为治疗化合物的一部分,它抑制静息t细胞的活化、增殖或细胞因子分泌。在一些实施方式中,btnl8分子与天然存在的嗜乳脂蛋白具有至少60%、70%、80%、90%、95%、99%或100%的序列同一性,或实质上的序列同一性。
[0226]
iic结合/调节部分:募集免疫抑制性t细胞的效应物结合/调节部分
[0227]
在一些实施方式中,治疗化合物包括效应物结合/调节部分,例如在由提供位点特异性免疫赦免的靶向部分介导的位点上结合、活化或保留免疫抑制性细胞,例如免疫抑制性t细胞的iic结合/调节部分。iic结合/调节部分(例如包括抗体分子,包括例如scfv结合结构域的iic结合/调节部分)结合免疫抑制性细胞类型,例如treg,例如foxp3+cd25+tregs。器官、组织或特定细胞类型耐受性与近端和浸润靶器官的treg的压倒性增加有关;在实施方式中,本文所述的方法和化合物合成地重建和模拟了这种生理状态。积累treg后,
产生免疫抑制性微环境,用于保护感兴趣的器官免受免疫系统的影响。
[0228]
garp结合剂作为treg和tgfb靶向分子
[0229]
garp是活化的treg表面表达的潜在tgf-β的膜蛋白受体(tran et al.2009 pnas 106:13445 and wang et al.2009 pnas 106:13439)。在一些实施方式中,治疗化合物包括结合可溶性garp和表达garp细胞(诸如活化的人treg)中的一个或两个的iic结合实体,以及将治疗化合物靶向感兴趣的靶组织的靶向部分。包括garp-结合剂的iic结合/调节部分包括例如包括抗garp抗体分子(例如抗garp scfv结构域)的iic结合/调节部分。虽然不希望受理论束缚,据信包括garp结合剂的治疗化合物实现了表达garp的treg在由治疗化合物的靶向部分靶向的位点(例如移植物或器官损伤位点)处的积累。同样,虽然不希望受理论束缚,据信包括garp结合剂的治疗化合物实现也可以实现可溶性garp在器官损伤位点处的积累,其将用于以局部方式结合和激活免疫抑制性细胞因子tgfb1(fridrich et al.2016 plos one 11:e0153290;doi:10.1371/journal.pone.0153290以及hahn et al.2013 blood 15:1182)。因此,包括garp结合剂的效应物结合/调节部分可以充当iic结合/调节部分或sm结合/调节部分。
[0230]
ctla4作为treg靶向和t效应细胞沉默分子
[0231]
在一些实施方式中,效应物结合/调节部分,例如包括结合treg表面上表达的ctla4的抗体分子,例如scfv结构域。治疗分子在靶位点处积累或保留ctla4+treg,具有局部免疫抑制结果。
[0232]
尽管在treg上表达更高,但ctla4也在活化的t细胞上表达。包括效应物结合/调节部分(例如抗ctla4抗体或功能性抗ctla4抗体)的治疗化合物可以下调表达ctla4的t细胞。因此,在包括结合ctla4的效应物结合/调节部分的治疗化合物中,效应物部分还可以充当icim结合/调节部分。
[0233]
在一些实施方式中,抗ctla4结合剂在单体形式时既不拮抗也不激动,并且仅在与靶标结合后聚集或多聚化时才激动。
[0234]
虽然不希望受理论束缚,但据信治疗化合物通过靶向部分与靶标的结合实现治疗化合物的多聚化。在记忆和活化t细胞的情况下,ctla4被治疗化合物的效应物结合/调节部分结合,聚集,并且通过记忆和活化t细胞表达的ctla4的接合产生抑制信号
[0235]
在一些实施方式中,抗ctla4结合剂在单体形式时既不拮抗也不激动,并且仅在与靶标结合后聚集或多聚化时才激动。
[0236]
il-2突变蛋白分子:激活tregs的il2受体结合剂
[0237]
优先扩增或刺激treg细胞(相对于细胞毒性t细胞)的il-2突变蛋白分子可以用作iic结合/调节部分。
[0238]
在一些实施方式中,iic结合/调节部分包括il-2突变蛋白分子。如本文所用,术语“il-2突变蛋白分子”或“il-2突变蛋白”是指优先活化treg细胞的il-2变体。在一些实施方式中,单独地或作为治疗化合物的组分,il-2突变蛋白分子以细胞毒性t细胞的至少2、5、10或100倍活化treg。用于评估treg细胞的优先活化的合适测定可以在美国专利号9,580,486中的例如实施例2和3中或wo2016014428中的例如实施例3、4和5中找到,其每一个通过援引整体并入。成熟il-2的序列是
[0239]
aptssstkktqlqlehllldlqmilnginnyknpkltrmltfkfympkkatelkhlqcleeelkplee
vlnlaqsknfhlrprdlisninvivlelkgsettfmceyadetativeflnrwitfcqsiistlt(成熟il-2序列)(seq id no:6)
[0240]
il-2的未成熟序列可以由以下表示:
[0241]
myrmqllscialslalvtnsaptssstkktqlqlehllldlqmilnginnyknpkltrmltfkfympkkatelkhlqcleeelkpleevlnlaqsknfhlrprdlisninvivlelkgsettfmceyadetativeflnrwitfcqsiistlt(seq id no:15)。
[0242]
在一些实施方式中,iic结合/调节部分包括il-2突变蛋白或其活性片段,其偶联例如融合至另一多肽,例如延长体内半衰期的多肽,例如免疫球蛋白恒定区,或其多聚体或二聚体。
[0243]
il-2突变蛋白分子可以通过il-2的一个或多个残基的突变来制备。il-2突变蛋白的非限制性实例可见于wo2016/164937、us9580486、us7105653、us9616105、us9428567、us2017/0051029、us2014/0286898a1、wo2014153111a2、wo2010/085495、wo2016014428a2、wo2016025385a1以及us20060269515,其每个都通过援引整体并入。
[0244]
在一些实施方式中,上述序列的位置1处的丙氨酸缺失。在一些实施方式中,il-2突变蛋白分子包括成熟il-2序列的位置125处的用丝氨酸置换半胱氨酸。us20060269515中描述了作为il-2突变蛋白分子的突变和置换的其他组合,其通过援引整体并入。在一些实施方式中,位置125处的半胱氨酸也被缬氨酸或丙氨酸置换。在一些实施方式中,il-2突变蛋白分子包括v91k置换。在一些实施方式中,il-2突变蛋白分子包括n88d置换。在一些实施方式中,il-2突变蛋白分子包括n88r置换。在一些实施方式中,il-2突变蛋白分子包括h16e、d84k、v91n、n88d、v91k或v91r的置换,其任何组合。在一些实施方式中,这些il-2突变蛋白分子还包括如本文所述的位置125处的置换。在一些实施方式中,il-2突变蛋白分子选自由以下组成的组的一个或多个置换:t3n、t3a、l12g、l12k、l12q、l12s、q13g、e15a、e15g、e15s、h16a、h16d、h16g、h16k、h16m、h16n、h16r、h16s、h16t、h16v、h16y、l19a、l19d、l19e、l19g、l19n、l19r、l19s、l19t、l19v、d20a、d20e、d20h、d20i、d20y、d20f、d20g、d20t、d20w、m23r、r81a、r81g、r81s、r81t、d84a、d84e、d84g、d84i、d84m、d84q、d84r、d84s、d84t、s87r、n88a、n88d、n88e、n88i、n88f、n88g、n88m、n88r、n88s、n88v、n88w、v91d、v91e、v91g、v91s、i92k、i92r、e95g和q126。在一些实施方式中,il-2突变蛋白分子的氨基酸序列与成熟il-2序列中所示的氨基酸序列不同,具有c125a或c125s置换和具有选自以下的一个置换:t3n、t3a、l12g、l12k、l12q、l12s、q13g、e15a、e15g、e15s、h16a、h16d、h16g、h16k、h16m、h16n、h16r、h16s、h16t、h16v、h16y、l19a、l19d、l19e、l19g、l19n、l19r、l19s、l19t、l19v、d20a、d20e、d20f、d20g、d20t、d20w、m23r、r81a、r81g、r81s、r81t、d84a、d84e、d84g、d84i、d84m、d84q、d84r、d84s、d84t、s87r、n88a、n88d、n88e、n88f、n88i、n88g、n88m、n88r、n88s、n88v、n88w、v91d、v91e、v91g、v91s、i92k、i92r、e95g、q126i、q126l和q126f。在一些实施方式中,il-2突变蛋白分子与成熟il-2序列中所示的氨基酸序列不同,具有c125a或c125s置换和选自以下的一个置换:d20h、d20i、d20y、d20e、d20g、d20w、d84a、d84s、h16d、h16g、h16k、h16r、h16t、h16v、i92k、i92r、l12k、l19d、l19n、l19t、n88d、n88r、n88s、v91d、v91g、v91k和v91s。在一些实施方式中,il-2突变蛋白包括n88r和/或d20h突变。
[0245]
在一些实施方式中,il-2突变蛋白分子在多肽序列中在选自由以下组成的组的位置处包括突变:氨基酸30、氨基酸31、氨基酸35、氨基酸69和氨基酸74。在一些实施方式中,
位置30处的突变是n30s。在一些实施方式中,位置31处的突变是y31h。在一些实施方式中,位置35处的突变是k35r。在一些实施方式中,位置69处的突变是v69a。在一些实施方式中,位置74处的突变是q74p。在一些实施方式中,突变蛋白包括v69a突变、q74p突变、n88d或n88r突变,以及l53i、l56i、l80i或l118i突变中的一个或多个。在一些实施方式中,突变蛋白包括v69a突变、q74p突变、n88d或n88r突变,以及选自由以下组成的组的l至i突变:l53i、l56i、l80i、和l118i突变。在一些实施方式中,il-2突变蛋白包括v69a、q74p、n88d或n88r突变以及l53i突变。在一些实施方式中,il-2突变蛋白包括v69a、q74p、n88d或n88r突变以及l56i突变。在一些实施方式中,il-2突变蛋白包括v69a、q74p、n88d或n88r突变以及l80i突变。在一些实施方式中,il-2突变蛋白包括v69a、q74p、n88d或n88r突变以及l118i突变。如本文所提供,突变蛋白还可以包括c125a或c125s突变。
[0246]
在一些实施方式中,突变蛋白包含t3a突变。本文提供的全长il-2突变蛋白可能没有用本文提供的t3a或其他突变来说明,但可以将这样的突变添加到本文提供的突变蛋白中,就像本文说明的任何其他突变的情况一样。因此,在一些实施方式中,突变蛋白包括t3n突变。在一些实施方式中,突变蛋白包含t3a突变。在一些实施方式中,突变蛋白包含l12g突变。在一些实施方式中,突变蛋白包含l12k突变。在一些实施方式中,突变蛋白包含l12q突变。在一些实施方式中,突变蛋白包含l12s突变。在一些实施方式中,突变蛋白包含q13g突变。在一些实施方式中,突变蛋白包含e15a突变。在一些实施方式中,突变蛋白包含e15g突变。在一些实施方式中,突变蛋白包含e15s突变。在一些实施方式中,突变蛋白包含h16a突变。在一些实施方式中,突变蛋白包含h16d突变。在一些实施方式中,突变蛋白包含h16g突变。在一些实施方式中,突变蛋白包含h16k突变。在一些实施方式中,突变蛋白包含h16m突变。在一些实施方式中,突变蛋白包含h16n突变。在一些实施方式中,突变蛋白包含h16r突变。在一些实施方式中,突变蛋白包含h16s突变。在一些实施方式中,突变蛋白包含h16t突变。在一些实施方式中,突变蛋白包含h16v突变。在一些实施方式中,突变蛋白包含h16y突变。在一些实施方式中,突变蛋白包含l19a突变。在一些实施方式中,突变蛋白包含l19d突变。在一些实施方式中,突变蛋白包含l19e突变。在一些实施方式中,突变蛋白包含l19g突变。在一些实施方式中,突变蛋白包含l19n突变。在一些实施方式中,突变蛋白包含l19r突变。在一些实施方式中,突变蛋白包含l19s突变。在一些实施方式中,突变蛋白包含l19t突变。在一些实施方式中,突变蛋白包含l19v突变。在一些实施方式中,突变蛋白包含d20a突变。在一些实施方式中,突变蛋白包含d20e突变。在一些实施方式中,突变蛋白包含d20h突变。在一些实施方式中,突变蛋白包含d20i突变。在一些实施方式中,突变蛋白包含d20y突变。在一些实施方式中,突变蛋白包含d20f突变。在一些实施方式中,突变蛋白包含d20g突变。在一些实施方式中,突变蛋白包含d20t突变。在一些实施方式中,突变蛋白包含d20w突变。在一些实施方式中,突变蛋白包含m23r突变。在一些实施方式中,突变蛋白包含r81a突变。在一些实施方式中,突变蛋白包含r81g突变。在一些实施方式中,突变蛋白包含r81s突变。在一些实施方式中,突变蛋白包含r81t突变。在一些实施方式中,突变蛋白包含d84a突变。在一些实施方式中,突变蛋白包含d84e突变。在一些实施方式中,突变蛋白包含d84g突变。在一些实施方式中,突变蛋白包含d84i突变。在一些实施方式中,突变蛋白包含d84m突变。在一些实施方式中,突变蛋白包含d84q突变。在一些实施方式中,突变蛋白包含d84r突变。在一些实施方式中,突变蛋白包含d84s突变。在一些实施方式中,突变蛋白包含d84t突
变。在一些实施方式中,突变蛋白包含s87r突变。在一些实施方式中,突变蛋白包含n88a突变。在一些实施方式中,突变蛋白包含n88d突变。在一些实施方式中,突变蛋白包含n88e突变。在一些实施方式中,突变蛋白包含n88i突变。在一些实施方式中,突变蛋白包含n88f突变。在一些实施方式中,突变蛋白包含n88g突变。在一些实施方式中,突变蛋白包含n88m突变。在一些实施方式中,突变蛋白包含n88r突变。在一些实施方式中,突变蛋白包含n88s突变。在一些实施方式中,突变蛋白包含n88v突变。在一些实施方式中,突变蛋白包含n88w突变。在一些实施方式中,突变蛋白包含v91d突变。在一些实施方式中,突变蛋白包含v91e突变。在一些实施方式中,突变蛋白包含v91g突变。在一些实施方式中,突变蛋白包含v91s突变。在一些实施方式中,突变蛋白包含i92k突变。在一些实施方式中,突变蛋白包含i92r突变。在一些实施方式中,突变蛋白包含e95g突变。在一些实施方式中,突变蛋白包含q126突变。
[0247]
尽管以列表形式说明了突变,但这只是为了方便起见,并且突变蛋白可以具有本文提供的一个或多个置换。
[0248]
在一些实施方式中,il-2突变蛋白分子包括选自由以下组成的组的置换:相对于上文提供的成熟人il-2序列的n88r、n88i、n88g、d20h、d109c、q126l、q126f、d84g或d84i。在一些实施方式中,il-2突变蛋白分子包括d109c的置换以及n88r置换和c125s置换中的一个或两个。在一些实施方式中,il-2突变蛋白分子中位置109处的半胱氨酸与聚乙二醇部分连接,其中聚乙二醇部分具有的分子量在5kda和40kda之间。
[0249]
一些实施方式中,将本文所述的任何置换与位置125处的置换组合。置换可以是c125s、c125a或c125v置换。
[0250]
除了本文所述的置换或突变之外,在一些实施方式中,il-2突变蛋白在对应于seq id no:15的位置73、76、100或138的一个或多个位置处或对应于seq id no:6的位置53、56、80或118的一个或多个位置处具有置换/突变。在一些实施方式中,il-2突变蛋白在对应于seq id no:15的以下位置处包括突变:73和76;73和100;73和138;76和100;76和138;100和138;73、76和100;73、76和138;73、100和138;76、100和138;或73、76、100和138中的每一个。在一些实施方式中,il-2突变蛋白在对应于seq id no:6的以下位置处包括突变:53和56;53和80;53和118;56和80;56和118;80和118;53、56和80;53、56和118;53、80和118;56、80和118;或53、56、80和118中的每一个。由于il-2可以与其他蛋白质融合或拴系,如本文所用,术语对应于参考seq id no:6或15是指序列将如何利用比对软件的默认设置进行比对,诸如可以与ncbi网站一起使用。在一些实施方式中,突变是亮氨酸到异亮氨酸。因此,il-2突变蛋白可以在对应于seq id no:15的位置73、76、100或138或对应于seq id no:6的位置53、56、80或118的一个或多个位置处包括一个或多个异亮氨酸。在一些实施方式中,突变蛋白包括对应于seq id no:6的l53处的突变。在一些实施方式中,突变蛋白包括对应于seq id no:6的l56处的突变。在一些实施方式中,突变蛋白包括对应于seq id no:6的l80处的突变。在一些实施方式中,突变蛋白包括对应于seq id no:6的l118处的突变。在一些实施方式中,突变是亮氨酸到异亮氨酸。在一些实施方式中,突变蛋白还包括对应于seq id no:6的这些突变蛋白中的位置69、74、88、125处的突变或的其任何组合。在一些实施方式中,突变是v69a突变。在一些实施方式中,突变是q74p突变。在一些实施方式中,突变是n88d或n88r突变。在一些实施方式中,突变是c125a或c125s突变。
[0251]
在一些实施方式中,il-2突变蛋白包括在对应于seq id no:15的位置49、51、55、57、68、89、91、94、108和145中的一个或多个位置处,或对应于seq id no:6的一个或多个位置29、31、35、37、48、69、71、74、88和125处的突变。置换可以单独使用或彼此组合使用。在一些实施方式中,il-2突变蛋白包括在2、3、4、5、6、7、8、9处或在位置49、51、55、57、68、89、91、94、108和145中的每一个处的置换。这样的组合的非限制性实例包括但不限于在以下位置处的突变:49、51、55、57、68、89、91、94、108和145;49、51、55、57、68、89、91、94和108;49、51、55、57、68、89、91和94;49、51、55、57、68、89和91;49、51、55、57、68和89;49、51、55、57和68;49、51、55和57;49、51和55;49和51;51、55、57、68、89、91、94、108和145;51、55、57、68、89、91、94和108;51、55、57、68、89、91和94;51、55、57、68、89和91;51、55、57、68和89;55、57和68;55和57;55、57、68、89、91、94、108和145;55、57、68、89、91、94和108;55、57、68、89、91和94;55、57、68、89、91和94;55、57、68、89和91;55、57、68和89;55、57和68;55和57;57、68、89、91、94、108和145;57、68、89、91、94和108;57、68、89、91和94;57、68、89和91;57、68和89;57和68;68、89、91、94、108和145;68、89、91、94和108;68、89、91和94;68、89和91;68和89;89、91、94、108和145;89、91、94和108;89、91和94;89和91;91、94、108和145;91、94和108;91和94;或94和108。每种突变都可以相互组合。可以在seq id no:6中进行相同的置换,但编号将适当调整,如根据本公开清楚的(seq id no:15中的编号少20对应于seq id no:6中的位置)。
[0252]
在一些实施方式中,il-2突变蛋白在对应于seq id no:15的位置35、36、42、104、115或146中的一个或多个位置或在seq id no:6中的等效位置(例如,位置15、16、22、84、95或126)处包括突变。这些突变可以与本文所述的其他亮氨酸到异亮氨酸突变或在对应于seq id no:15的位置73、76、100或138处或对应于seq id no:6的位置53、56、80或118中的一个或多个位置处的突变组合。在一些实施方式中,突变是e35q、h36n、q42e、d104n、e115q或q146e或其任何组合。在一些实施方式中,这些置换中的一个或多个是野生型。在一些实施方式中,突变蛋白在对应于seq id no:15的位置35、36、42、104、115或146或在seq id no:6的等效位置(例如位置15、16、22、84、95和126)的一个或多个位置处包括野生型残基。
[0253]
这些位置处的突变可以与本文所述的任何其他突变组合,包括但不限于对应于seq id no:15的位置73、76、100或138处或对应于seq id no:6的位置53、56、80或118中的一个或多个位置处的置换。在一些实施方式中,il-2突变蛋白包括对应于seq id no:15的n49s突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:15的y51s或y51h突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:15的k55r突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:15的t57a突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:15的k68e突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:15的v89a突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:15的n91r突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:15的q94p突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:15的n108d或n108r突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:15的c145a或c145s突变。这些置换可以单独使用或相互组合使用。在一些实施方式中,突变蛋白包括这些置换中的每一个。在一些实施方式中,突变蛋白包括这些突变中的1、2、3、4、5、6、7或8个。在一些实施方式中,突变蛋白在对应于seq id no:15的位置35、36、42、104、115或146或在seq id no:6的等效位置(例如位置15、
16、22、84、95和126)的一个或多个位置处包括野生型残基。
[0254]
在一些实施方式中,il-2突变蛋白包括对应于seq id no:6的n29s突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:6的y31s或y31h突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:6的k35r突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:6的t37a突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:6的k48e突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:6的v69a突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:6的n71r突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:6的q74p突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:6的n88d或n88r突变。在一些实施方式中,il-2突变蛋白包括对应于seq id no:6的c125a或c125s突变。这些置换可以单独使用或相互组合使用。在一些实施方式中,突变蛋白包括这些突变中的1、2、3、4、5、6、7或8个。在一些实施方式中,突变蛋白包括这些置换中的每一个。在一些实施方式中,突变蛋白在对应于seq id no:15的位置35、36、42、104、115或146或在seq id no:6的等效位置(例如位置15、16、22、84、95和126)的一个或多个位置处包括野生型残基。
[0255]
对于本文所述的任何il-2突变蛋白,在一些实施方式中,对应于seq id no:15的位置35、36、42、104、115或146或seq id no:6的等效位置(例如位置15、16、22、84、95和126)中的一个或多个位置是野生型(例如,如seq id no:6或15所示的)。在一些实施方式中,对应于seq id no:15的位置35、36、42、104、115或146或seq id no:6的等效位置(例如位置15、16、22、84、95和126)中的2、3、4、5、6个或每一个是野生型。
[0256]
在一些实施方式中,il-2突变蛋白包括以下序列:
[0257]
myrmqllscialslalvtnsaptssstkktqlqlehllldlqmilngisnhknprlarmltfkfympekateikhlqcleeelkpleealrlapsknfhlrprdlisdinvivlelkgsettfmceyadetativeflnrwitfsqsiistlt(seq id no:16)
[0258]
在一些实施方式中,il-2突变蛋白包括以下序列:
[0259]
myrmqllscialslalvtnsaptssstkktqlqlehllldlqmilngisnhknprlarmltfkfympekatelkhiqcleeelkpleealrlapsknfhlrprdlisdinvivlelkgsettfmceyadetativeflnrwitfsqsiistlt(seq id no:17)
[0260]
在一些实施方式中,il-2突变蛋白包括以下序列:
[0261]
myrmqllscialslalvtnsaptssstkktqlqlehllldlqmilngisnhknprlarmltfkfympekatelkhlqcleeelkpleealrlapsknfhirprdlisdinvivlelkgsettfmceyadetativeflnrwitfsqsiistlt(seq id no:18)
[0262]
在一些实施方式中,il-2突变蛋白包括以下序列:
[0263]
myrmqllscialslalvtnsaptssstkktqlqlehllldlqmilngisnhknprlarmltfkfympekatelkhlqcleeelkpleealrlapsknfhlrprdlisdinvivlelkgsettfmceyadetativefinrwitfsqsiistlt(seq id no:19)
[0264]
在一些实施方式中,本文所述的il-2突变蛋白序列不包括il-2前导序列。il-2前导序列可以由序列myrmqllscialslalvtns(seq id no:20)表示。因此,在一些实施方式中,上面所述的序列也可以包括没有前导序列的肽。虽然seq id no:16-20仅示出了在对应于seq id no:15的位置73、76、100或138中的一个位置或对应于seq id no:6的位置53、56、80
或118中的一个或多个位置处的突变,但是肽可以在这些位置处包括一个、两个、三个或4个突变。在一些实施方式中,每个位置处的置换是异亮氨酸或其他类型的保守氨基酸置换。在一些实施方式中,所述位置处的亮氨酸独立地被异亮氨酸、缬氨酸、甲硫氨酸或苯丙氨酸置换。
[0265]
在一些实施方式中,il-2突变蛋白分子与本文所述的fc区或其他接头区融合。这样的融合蛋白的实例可见于us9580486、us7105653、us9616105、us9428567、us2017/0051029、wo2016/164937、us2014/0286898a1、wo2014153111a2、wo2010/085495、wo2016014428a2、wo2016025385a1、us2017/0037102以及us2006/0269515,其每个都通过援引整体并入。
[0266]
在一些实施方式中,fc区包括所谓的lala突变。使用fc区的kabat编号,这将对应于l247a、l248a和g250a。在一些实施方式中,使用fc区的eu编号,fc区包括l234a突变、l235a突变和/或g237a突变。不管使用的编号系统如何,在一些实施方式中,fc部分可以包括对应于这些残基的突变。在一些实施方式中,fc区包括n297g或n297a(kabat编号)突变。kabat编号基于全长序列,但是将用于基于本领域技术人员对fc区使用的传统比对的片段中。
[0267]
在一些实施方式中,fc区包括以下序列:
[0268]
dkthtcppcpapeaagapsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg。(seq id no:21)
[0269]
或者
[0270]
dkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg。(seq id no:28)
[0271]
在一些实施方式中,il-2突变蛋白与fc区连接。接头的非限制性实例是甘氨酸/丝氨酸接头。例如,甘氨酸/丝氨酸接头可以是ggggsggggsggggsggggs(seq id no:22)或ggggsggggsggggs(seq id no:30)的序列。这只是非限制性实例,并且接头可以具有不同数目的ggggs(seq id no:23)或gggga重复(seq id no:29)。在一些实施方式中,接头包括1、2、3、4、5、6、7、8、9或10个ggggs(seq id no:23)或gggga重复(seq id no:29)重复。在一些实施方式中,接头的长度为10个氨基酸。在一些实施方式中,接头的长度为5个氨基酸。在一些实施方式中,接头的长度为15个氨基酸。在一些实施方式中,接头的长度为20个氨基酸。在一些实施方式中,接头的长度为25个氨基酸。在一些实施方式中,接头的长度为30个氨基酸。在一些实施方式中,接头的长度为35个氨基酸。在一些实施方式中,接头的长度为5-50个氨基酸。
[0272]
因此,il-2/fc融合物可以由式z
il-2m-l
gs-z
fc
表示,其中z
il-2m
是如本文所述的il-2突变蛋白,l
gs
是如本文所述的接头序列(例如甘氨酸/丝氨酸接头)并且z
fc
是本文所述的或本领域技术人员已知的fc区。在一些实施方式中,该式可以以相反方向z
fc-l
gs-z
il-2m
。
[0273]
在一些实施方式中,il-2/fc融合物包括以下序列:
[0274]
myrmqllscialslalvtnsaptssstkktqlqlehllldlqmilngisnhknprlarmltfkfympekateikhlqcleeelkpleealrlapsknfhlrprdlisdinvivlelkgsettfmceyadetativeflnrwitfsqsiistltggggsggggsggggsggggsdkthtcppcpapeaagapsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:24)
[0275]
myrmqllscialslalvtnsaptssstkktqlqlehllldlqmilngisnhknprlarmltfkfympekatelkhiqcleeelkpleealrlapsknfhlrprdlisdinvivlelkgsettfmceyadetativeflnrwitfsqsiistltggggsggggsggggsggggsdkthtcppcpapeaagapsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:25)
[0276]
myrmqllscialslalvtnsaptssstkktqlqlehllldlqmilngisnhknprlarmltfkfympekatelkhlqcleeelkpleealrlapsknfhirprdlisdinvivlelkgsettfmceyadetativeflnrwitfsqsiistltggggsggggsggggsggggsdkthtcppcpapeaagapsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:26)
[0277]
myrmqllscialslalvtnsaptssstkktqlqlehllldlqmilngisnhknprlarmltfkfympekatelkhlqcleeelkpleealrlapsknfhlrprdlisdinvivlelkgsettfmceyadetativefinrwitfsqsiistltggggsggggsggggsggggsdkthtcppcpapeaagapsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:27)。
[0278]
在一些实施方式中,il-2/fc融合物包括选自下表表3的序列:
[0279]
表3:il-2/fc融合蛋白氨基酸序列
[0280]
[0281]
[0282][0283]
在一些实施方式中,il-2突变蛋白包括下表中提供的一个或多个序列,在一些实施方式中,其示出了与其他蛋白质或接头融合的il-2突变蛋白。该表还提供了il-2可以与其融合的各种fc结构域或变体的序列:
[0284]
[0285]
[0286]
[0287]
[0288]
[0289]
是l并且x3和x4是i。在一些实施方式中,x1和x3是l并且x2和x4是i。在一些实施方式中,x1和x4是l并且x2和x3是i。在一些实施方式中,x2和x3是l并且x1和x4是i。在一些实施方式中,x2和x4是l并且x1和x3是i。在一些实施方式中,x3和x4是l并且x1和x2是i。在一些实施方式中,x1、x2和x3是l并且x4是i。在一些实施方式中,x2、x3和x4是l并且x1是i。在一些实施方式中,x1、x3和x4是l并且x2是i。在一些实施方式中,x1、x2和x4是l并且x3是i。
[0296]
还可以认为每种蛋白质具有本文提供的c125s和lala和/或g237a突变。如本技术全文所述,c125置换也可以是c125a。
[0297]
在实施方式中,il-2突变蛋白分子包括与天然存在的人il-2分子,例如本文公开的或通过援引并入的那些中天然存在的il-2序列的至少60%、70%、80%、85%、90%、95%或97%的序列同一性或同源性。
[0298]
如本文所述,il-2突变蛋白可以是具有栓系部分的双特异性分子的一部分,诸如将il-2突变蛋白靶向表达madcam的细胞的madcam抗体。如本文所述,双特异性分子可以由两条多肽链产生。在一些实施方式中,可以使用以下:
[0299][0300]
[0301]
这些蛋白质可以在il-2突变蛋白中有或没有c125a或c125s突变的情况下产生。可以包括的il-2突变蛋白的实例在本文中示例说明,诸如但不限于seq id no:59或seq id no:60的序列。
[0302]
在一些实施方式中,轻链中的任一个的恒定κ结构域可以被恒定λ结构域替换。
[0303]
gitr粘合剂
[0304]
gitr(cd357)是存在于treg上的细胞表面标志物。阻断gitr-gitrl相互作用维持treg功能。在一些实施方式中,治疗化合物包括结合表达gitr的treg细胞的iic结合实体以及将治疗化合物靶向感兴趣的靶组织的靶向部分。
[0305]
在一些实施方式中,治疗化合物包括抗gitr抗体分子,例如抑制gitr与gitrl结合的抗gitr抗体分子。
[0306]
在一些实施方式中,治疗化合物包括抗gitr抗体分子、抑制gitr与gitrl结合的抗gitr抗体分子和pd-1激动剂、il-2突变蛋白分子或本文所述的其他效应物。
[0307]
虽然不希望受理论束缚,据信包括gitr结合剂的治疗化合物实现了表达gitr的treg在由治疗化合物的靶向部分靶向的位点(例如移植物或器官损伤位点)处的积累。
[0308]
嗜乳脂蛋白/嗜乳脂蛋白样分子
[0309]
效应物结合/调节部分可以包括激动性btnl2分子。虽然不希望受理论束缚,但是据信激动性btnl2分子诱导treg细胞。
[0310]
如本文所用术语,激动性btnl2分子是指具有足够的btnl2序列的多肽,作为治疗化合物的一部分,它诱导treg细胞。在一些实施方式中,btnl2分子与天然存在的嗜乳脂蛋白具有至少60%、70%、80%、90%、95%、99%或100%的序列同一性,或实质上的序列同一性。
[0311]
在一些实施方式中,效应物结合/调节部分,拮抗性btnl8分子。
[0312]
包括sm结合/调节部分的治疗化合物:局部微环境的操纵
[0313]
治疗化合物可以包括促进免疫抑制性局部微环境的效应物结合/调节部分,例如通过在靶标附近提供抑制或最小化免疫系统对靶标的攻击的物质,其在本文中称为sm结合/调节部分。
[0314]
在一些实施方式,sm结合/调节部分包括抑制或最小化免疫系统对靶标的攻击的分子(在本文中称为sm结合/调节部分)。在一些实施方式中治疗化合物包括结合并积累具有免疫抑制功能的可溶性物质(例如内源或外源物质)的sm结合/调节部分。在一些实施方式中,治疗化合物包括sm结合/调节部分,例如cd39分子或cd73分子或碱性磷酸酶分子,其结合、抑制、隔离、降解或以其他方式中和促进免疫攻击的可溶性物质,通常是内源可溶性物质,例如在cd39分子或碱性磷酸酶分子的情况下的atp,或在cd73分子的情况下的amp。在一些实施方式中,治疗化合物包括sm结合/调节部分,其包括免疫抑制物质,例如免疫抑制性蛋白质片段。
[0315]
包括icsm结合/调节部分的治疗化合物:刺激的抑制,例如免疫细胞的共刺激的抑制
[0316]
治疗化合物可以包括抑制或拮抗刺激性例如共刺激性结合对(例如ox40和ox40l)的icsm结合/调节部分。icsm结合/调节部分可以结合和拮抗该对中的任一成员。
[0317]
在实施方式中,icsm结合/调节部分包括结合并拮抗刺激性例如共刺激性结合对
的任一成员的抗体分子。在实施方式中,icsm结合/调节部分包括结合对成员中的一个的拮抗性类似物。在这样的实施方式中,icsm结合/调节部分可以包括结合另一成员的一个成员的可溶性片段。通常,该类似物与结合该对的靶成员的天然存在的成员将具有至少50%、60%、70%、80%、90%、95%或98%的同源性或序列同一性。在结合存在于免疫细胞表面的成员的icsm结合/调节部分的情况下,icsm结合/调节部分通常结合但不激活,或允许内源反成员结合和激活。
[0318]
因此,在结合对包括例如ox40免疫细胞成员和ox40l反成员的情况下,icsm结合/调节成员可以包括以下任何一种:
[0319]
a)结合ox40免疫细胞成员并拮抗刺激(例如通过阻断内源ox40l反成员的结合)的抗体分子;
[0320]
b)结合ox40l反成员并拮抗刺激(例如通过阻断内源ox40l反成员与ox40免疫细胞成员的有效结合)的抗体分子;
[0321]
c)结合ox40免疫细胞成员并拮抗刺激的ox40l反成员的可溶性片段或类似物;以及
[0322]
c)结合ox40l反成员并拮抗刺激的ox40免疫细胞成员的可溶性片段或类似物。
[0323]
例如,icsm结合/调节部分(例如反成员的抗体分子或拮抗类似物)可以结合cd2、icos、cd40l、cd28、lfa1、slam、tim1、cd30、ox40(cd134)、41bb(cd137)、cd27、hvem、dr3、gitr、baffr、taci、bcma、或cd30、cd40。在另一种实施方式中,icsm结合/调节部分(例如反成员的抗体分子或拮抗类似物)可以结合b7.1、b7.2、icosl(b7-h2、b7rp1)、lfa3、cd48、cd58、icam1、slam、tim4、cd40、cd30l、ox40l(cd252)、41bbl(cd137l)、cd70、light、tl1a、gitrl、baff、april、或cd30、cd40l。
[0324]
在一些实施方式中,icsm结合/调节分子结合并拮抗存在于免疫细胞上的激活或共刺激分子,例如共刺激分子,或结合反成员,阻止反成员激活存在于免疫细胞上的共刺激分子。在一些实施方式中,icsm包括拮抗性抗体分子,例如,结合免疫细胞上的共刺激分子或结合icsm的反成员,阻止反成员激活免疫细胞上的共刺激分子,并且导致抑制共刺激分子活性的抗体分子。在一些实施方式中,icsm包括拮抗性对应物分子,例如结合共刺激分子并导致共刺激分子活性抑制的分子的片段。
[0325]
在一些实施方式中,结合对的一个成员将在免疫细胞(例如t、b或nk细胞或树突状细胞)的表面上,而反成员将在另一免疫细胞或apc,例如树突状细胞或非免疫细胞(诸如平滑细胞或内皮细胞)上。
[0326]
下表提供了共刺激分子和反结构对的非限制性实例
[0327][0328][0329]
供体组织
[0330]
本文所述的治疗化合物和方法可以与供体组织移植到受试者中联合使用,并且可
以最小化对供体移植组织的排斥,最小化免疫效应细胞介导的对供体移植组织的损伤,延长对供体移植组织的认可,或延长供体移植组织的功能寿命。组织可以是异种移植物或同种异体移植物组织。移植的组织可以包括器官的全部或部分,例如肝、肾、心脏、胰腺、胸腺、皮肤或肺。
[0331]
在实施方式中,本文所述的治疗化合物减少或消除了对全身免疫抑制的需要。本文所述的治疗化合物和方法也可用于治疗gvhd。在一些实施方式中,宿主细胞被治疗化合物包被,所述治疗化合物包括作为效应物结合/调节部分的pd-l1分子。
[0332]
表2提供了移植适应症的靶分子。靶分子是靶向部分结合的靶标。如本文别处所讨论的,在一些实施方式中,选择靶向部分,使其结合存在于供体组织上并且不由受试者(接受者)表达或由以不同水平(例如降低或显著降低的)表达的等位基因的产物。
[0333][0334]
自身免疫性疾患
[0335]
本文所述的治疗化合物和方法可用于治疗患有有害的自身免疫应答或具有患有害的自身免疫应答风险的受试者,例如以下中的自身免疫应答:1型糖尿病、多发性硬化症、心肌炎(cardiomyositis)、白癜风、脱发、炎性肠病(ibd,例如克罗恩病或溃疡性结肠炎)、舍格伦综合征、局灶节段性肾小球硬化症(fsgs)、硬皮病/系统性硬化症(ssc)或类风湿性关节炎。在一些实施方式中,对于遭受自身免疫攻击或具有自身免疫攻击风险的受试者组织,治疗使组织排斥最小化,使组织免疫效应细胞介导的损伤最小化,延长组织存活。表3提供了多种自身免疫适应症和器官/细胞类型的靶分子。靶分子是靶向部分结合的靶标。
[0336]
[0337][0338]
[0339]
可以用本文所述的化合物治疗的自身免疫疾患和疾病的其他实例包括但不限于心肌炎、心肌梗死后综合征、心包切开术后综合征、亚急性细菌性心内膜炎、抗肾小球基膜型肾炎、间质性膀胱炎、狼疮肾炎、膜性肾小球肾病、慢性肾病(“ckd”)、自身免疫性肝炎、原发性胆汁性肝硬变、原发性硬化性胆管炎、抗合成酶综合征(antisynthetase syndrome)、斑秃、自身免疫性血管性水肿、自身免疫性孕酮皮炎、自身免疫性荨麻疹、大疱性类天疱疮、瘢痕性类天疱疮、疱疹样皮炎、盘状红斑狼疮、获得性大疱性表皮松解症、结节性红斑、妊娠期类天疱疮、化脓性汗腺炎、扁平苔藓、硬化性苔藓、线状iga病(lad)、硬斑病、寻常型天疱疮、急性苔藓痘疮样糠疹、mucha-habermann病、银屑病、系统性硬皮病、白癜风、艾迪生病、自身免疫性多内分泌综合征(aps)1型、自身免疫性多内分泌腺综合征(aps)2型、自身免疫性多内分泌综合征(aps)3型、身免疫性胰腺炎(aip)、1型糖尿病、自身免疫性甲状腺炎、ord甲状腺炎、格雷夫斯病、自身免疫性卵巢炎、子宫内膜异位症、自身免疫性睾丸炎、舍格伦综合征、自身免疫性肠病、乳糜泻、克罗恩病、显微镜下结肠炎、溃疡性结肠炎、血小板减少、痛性肥胖病(adiposis,dolorosa,)、成人斯蒂尔病(adult-onset still's,disease)、强直性脊柱炎(ankylosing,spondylitis)、crest综合征、药物性狼疮、附着点炎相关关节炎(enthesitis-related arthritis)、嗜酸性筋膜炎、费尔蒂综合征、igg4相关疾病、幼年型关节炎、莱姆病(慢性)、混合性结缔组织病(mctd)、复发性风湿病、帕里-龙贝格综合征、帕尔森-特纳综合征、银屑病关节炎、反应性关节炎、复发性多软骨炎、腹膜后纤维化、风湿热、类风湿性关节炎、结节病、schnitzler综合征、系统性红斑狼疮(sle)、未分化结缔组织病(uctd)、皮肌炎、纤维肌痛、包涵体肌炎、肌炎、重症肌无力、神经性肌强直、副肿瘤性小脑变性、多发性肌炎、急性播散性脑脊髓炎(adem)、急性运动轴突性神经病、抗-n-甲基-d-天冬氨酸(抗-nmda)受体脑炎、巴洛同心圆性硬化、bickerstaff脑炎、慢性炎性脱髓鞘多发性神经病、吉兰-巴雷综合征、桥本脑病、特发性炎性脱髓鞘病、兰伯特-伊顿肌无力综合征、多发性硬化症、oshtoran综合征、链球菌相关的小儿自身免疫性神经精神疾病(pediatric autoimmune neuropsychiatric disorder associated with streptococcus,pandas)、进行性炎症性神经病、不宁腿综合征、僵硬人综合征、小舞蹈症、横贯性脊髓炎、自身免疫性视网膜病、自身免疫性葡萄膜炎、康恩综合征、格雷夫斯眼病、中间葡萄膜炎、木样结膜炎、蚕蚀性角膜溃疡、视神经脊髓炎、斜视性眼阵挛-肌阵挛综合征、视神经炎、巩膜炎、susac综合征、交感性眼炎、托洛萨-亨特综合征、自身免疫性内耳病(aied)、梅尼埃病(m
é
ni
è
re's disease)、目赤如鸠眼、嗜酸性肉芽肿性多血管炎(egpa)、巨细胞动脉炎、肉芽肿性多血管炎(gpa)、iga血管炎(igav)、川崎病、白细胞碎裂性血管炎、狼疮性血管炎、类风湿性血管炎、显微镜下多血管炎(mpa)、结节性多动脉炎(pan)、风湿性多肌痛、血管炎、原发性免疫缺陷等。
[0340]
可以用本文所述的化合物治疗的潜在自身免疫性疾患和疾病以及自身免疫并存症的其他实例包括但不限于慢性疲劳综合征、复杂区域疼痛综合征、嗜酸性食管炎、胃炎(gastirtis)、间质性肺病、poems综合征、雷诺氏现象、原发性免疫缺陷、坏疽性脓皮病,无丙种球蛋白血症、淀粉样变性(anyloidosis)、肌萎缩侧索硬化(anyotrophic lateral sclerosis)、抗肾小管基膜型肾炎、特应性变态反应、特应性皮炎、自身免疫性周围神经病、blau综合征、卡斯尔曼病、美洲锥虫病、慢性阻塞性肺病、慢性复发性多灶性骨髓炎、补体成分2缺乏、接触性皮炎、库欣综合征、皮肤白细胞碎裂性血管炎、dego病、湿疹、嗜酸性胃肠
炎、嗜酸性肺炎、胎儿成红细胞增多症、进行性骨化纤维发育不良、胃肠道类天疱疮、低丙种球蛋白血症、特发性巨细胞心肌炎、特发性肺纤维化、iga肾病、免疫调节性脂蛋白、ipex综合征、ligenous结膜炎、majeed综合、发作性睡病、拉斯马森脑炎、精神分裂症、血清病、脊椎关节病、急性发热性嗜中性皮肤病、大动脉炎等。
[0341]
在一些实施方式中,自身免疫性疾患不包括寻常型天疱疮、天疱疮。在一些实施方式中,自身免疫性疾患不包括落叶型天疱疮。在一些实施方式中,自身免疫性疾患不包括大疱性类天疱疮。在一些实施方式中,自身免疫性疾患不包括古德帕斯丘病(goodpasture’s disease)。在一些实施方式中,自身免疫性疾患不包括银屑病。在一些实施方式中,自身免疫性疾患不包括皮肤病。在一些实施方式中,疾患不包括肿瘤疾患,例如癌症。
[0342]
治疗化合物
[0343]
治疗化合物包括与效应物结合/调节部分功能相关的特异性靶向部分。在一些实施方式中,特异性靶向部分和效应物结合/调节部分通过共价键或非共价键(例如将一个与另一个直接连接的共价键或非共价键)彼此连接。在其他实施方式中,特异性靶向部分和效应物结合/调节部分通过接头部分例如共价或非共价连接。例如,在融合多肽的情况下,包括特异性靶向部分的多肽序列和多肽序列可以彼此直接连接或通过一个或多个接头序列连接。在一些实施方式中,接头部分包括多肽。然而,接头不限于多肽。在一些实施方式中,接头部分包括其他骨架,例如非肽聚合物,例如peg聚合物。在一些实施方式中,接头部分可以包括颗粒,例如纳米颗粒,例如聚合物纳米颗粒。在一些实施方式中,接头部分可以包括支化分子或树枝状聚合物。然而,在其中效应物结合/调节部分包括icim结合/调节部分(其结合效应物如pd-1)的实施方式中,应避免在不存在靶标结合的情况下导致聚集的结构,因为它们可能会在不存在靶标结合的情况下导致聚集。因此,在实施方式中,治疗化合物具有的结构(例如,icim的拷贝)被充分限制,使得在不存在靶标结合的情况下的聚集被最小化或基本上消除,或消除,或充分最小化,使得不会发生实质性的全身免疫抑制。
[0344]
在一些实施方式中,治疗化合物包括多肽,该多肽包括与效应物结合/调节部分共价或非共价缀合的特异性靶向部分。在一些实施方式中,治疗性分子包括融合蛋白,该融合蛋白包括例如直接或通过包括一个或多个氨基酸残基的连接部分与效应物结合/调节部分融合的特异性靶向部分。在一些实施方式中,治疗性分子包括多肽,该多肽包括通过非共价键或共价键(例如除肽键以外的共价键,例如巯基键)与效应物结合/调节部分连接的特异性靶向部分。
[0345]
在一些实施方式中,治疗化合物包括多肽,例如融合多肽,其包括:
[0346]
1.a)包括靶标特异性结合多肽的特异性靶向部分;
[0347]
1.b)包括靶标配体结合分子的特异性靶向部分;
[0348]
1.c)包括抗体分子的特异性靶向部分;
[0349]
1.d)包括单链抗体分子例如scfv结构域的特异性靶向部分;
[0350]
1.e)包括抗体分子的轻链或重链可变区中的第一个的特异性靶向部分,并且其中另一个可变区与第一个共价或非共价缔合;
[0351]
并且
[0352]
2.a)包括效应物特异性结合多肽的效应物结合/调节部分;
[0353]
2.b)包括效应物配体结合分子的效应物结合/调节部分;
[0354]
2.c)包括抗体分子的效应物结合/调节部分;
[0355]
2.d)包括单链抗体分子例如scfv结构域的效应物结合/调节部分;
[0356]
2.e)包括抗体分子的轻链或重链可变区中的第一个的效应物结合/调节部分,并且其中另一个可变区与第一个共价或非共价缔合。
[0357]
在一些实施方式中,治疗化合物包括1.a和2.a。
[0358]
在一些实施方式中,治疗化合物包括1.a和2.b。
[0359]
在一些实施方式中,治疗化合物包括1.a和2.c。
[0360]
在一些实施方式中,治疗化合物包括1.a和2.d。
[0361]
在一些实施方式中,治疗化合物包括1.a和2.e。
[0362]
在一些实施方式中,治疗化合物包括1.b和2.a。
[0363]
在一些实施方式中,治疗化合物包括1.b和2.b。
[0364]
在一些实施方式中,治疗化合物包括1.b和2.c。
[0365]
在一些实施方式中,治疗化合物包括1.b和2.d。
[0366]
在一些实施方式中,治疗化合物包括1.b和2.e。
[0367]
在一些实施方式中,治疗化合物包括1.c和2.a。
[0368]
在一些实施方式中,治疗化合物包括1.c和2.b。
[0369]
在一些实施方式中,治疗化合物包括1.c和2.c。
[0370]
在一些实施方式中,治疗化合物包括1.c和2.d。
[0371]
在一些实施方式中,治疗化合物包括1.c和2.e。
[0372]
在一些实施方式中,治疗化合物包括1.d和2.a。
[0373]
在一些实施方式中,治疗化合物包括1.d和2.b。
[0374]
在一些实施方式中,治疗化合物包括1.d和2.c。
[0375]
在一些实施方式中,治疗化合物包括1.d和2.d。
[0376]
在一些实施方式中,治疗化合物包括1.d和2.e。
[0377]
在一些实施方式中,治疗化合物包括1.e和2.a。
[0378]
在一些实施方式中,治疗化合物包括1.e和2.b。
[0379]
在一些实施方式中,治疗化合物包括1.e和2.c。
[0380]
在一些实施方式中,治疗化合物包括1.e和2.d。
[0381]
在一些实施方式中,治疗化合物包括1.e和2.e。
[0382]
本文公开的治疗化合物可以例如包括多个效应物结合/调节和特异性靶向部分。用任何合适的接头或平台来呈现多个部分。接头通常与一个或多个效应物结合/调节和靶向部分偶联或融合。
[0383]
在一些实施方式中,两个(或更多个)接头共价地或非共价地缔合,例如以形成异或同二聚治疗化合物。例如,接头可以包括fc区和两个彼此缔合的fc区。在包括两个接头区的治疗化合物的一些实施方式中,接头区可以自缔合,例如,作为两个相同的fc区。在包括两个接头区的治疗化合物的一些实施方式中,接头区不能或基本上不能自缔合,例如,两个fc区可以是杵和臼对的成员。
[0384]
治疗化合物的非限制性示例性构型包括以下(例如,以n到c末端顺序):
[0385]
r1
‑‑‑
接头区a—r2
[0386]
r3
‑‑‑
接头区b
‑‑‑
r4,
[0387]
其中,
[0388]
r1、r2、r3和r4各自独立地包括效应物结合/调节部分,例如icim结合/调节部分、iic结合/调节部分、icsm结合/调节部分或sm结合/调节部分;特异性靶向部分;或不存在。
[0389]
接头区a和接头b包括可以彼此缔合的部分,例如,接头a和接头b各自包括fc部分,前提是存在效应物结合/调节部分和特异性靶向部分。
[0390]
在一些实施方式中:
[0391]
r1包括效应物结合/调节部分,例如icim结合/调节部分、iic结合/调节部分、icsm结合/调节部分或sm结合/调节部分,或不存在。
[0392]
r2包括特异性靶向部分,或不存在;
[0393]
r3包括效应物结合/调节部分,例如icim结合/调节部分、iic结合/调节部分、icsm结合/调节部分或sm结合/调节部分,或不存在。
[0394]
r4包括特异性靶向部分,或不存在;
[0395]
接头区a和接头b包括可以彼此缔合的部分,例如,接头a和接头b各自包括fc部分,前提是存在r1或r3中的一个并且存在r2或r4中的一个。
[0396]
在一些实施方式中:
[0397]
r1包括特异性靶向部分,或不存在;
[0398]
r2包括效应物结合/调节部分,例如icim结合/调节部分、iic结合/调节部分、icsm结合/调节部分或sm结合/调节部分,或不存在。
[0399]
r3包括特异性靶向部分,或不存在;
[0400]
r4包括效应物结合/调节部分,例如icim结合/调节部分、iic结合/调节部分、icsm结合/调节部分或sm结合/调节部分,或不存在。
[0401]
接头区a和接头b包括可以彼此缔合的部分,例如,接头a和接头b各自包括fc部分,前提是存在r1或r3中的一个并且存在r2或r4中的一个。
[0402]
非限制性实例包括但不限于:
[0403]
[0404]
[0405][0406]
在一些实施方式中:
[0407]
r1、r2、r3和r4各自独立地包括:激活免疫细胞(例如t细胞或b细胞)上的抑制性受体,例如pd-l1分子或功能性抗pd-1抗体分子(pd-1的激动剂)的效应物结合调节部分;特异性靶向部分;或不存在;
[0408]
前提是存在效应物结合部分和特异性靶向部分。
[0409]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分)。
[0410]
在一些实施方式中:
[0411]
r1和r3独立地包括效应物结合调节部分,其激活免疫细胞(例如t细胞或b细胞)上的抑制性受体,例如pd-l1分子或功能性抗pd-1抗体分子(pd-1的激动剂);并且
[0412]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0413]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分)。
[0414]
在一些实施方式中:
[0415]
r1和r3独立地包括功能性抗pd-1抗体分子(pd-1的激动剂);并且
[0416]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0417]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分)。
[0418]
在一些实施方式中:
[0419]
r1和r3独立地包括特异性靶向部分,例如抗组织抗原抗体;并且
[0420]
r2和r4独立地包括功能性抗pd-1抗体分子(pd-1的激动剂),例如scfv分子。
[0421]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分)。
[0422]
在一些实施方式中:
[0423]
r1和r3独立地包括pd-l1分子(pd-1的激动剂);并且
[0424]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子;并且
[0425]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分)。
[0426]
在一些实施方式中:
[0427]
r1和r3独立地包括特异性靶向部分,例如抗组织抗原抗体;并且
[0428]
r2和r4独立地包括pd-l1分子(pd-1的激动剂)。
[0429]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分)。
[0430]
在一些实施方式中:
[0431]
r1、r2、r3和r4各自独立地包括:sm结合/调节部分,其调节例如结合和抑制、隔离、降解或以其他方式中和调节免疫应答的物质,例如可溶性分子,例如atp或amp,例如cd39分子或cd73分子;特异性靶向部分;或不存在;
[0432]
前提是存在sm结合/调节部分和特异性靶向部分。
[0433]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0434]
在一些实施方式中:
[0435]
r1和r3独立地包括sm结合/调节部分,其调节例如结合和抑制、隔离、降解或以其他方式中和调节免疫应答的物质,例如可溶性分子,例如atp或amp,例如cd39分子或cd73分子;并且
[0436]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0437]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0438]
在一些实施方式中:
[0439]
r1和r3独立地包括cd39分子或cd73分子;并且
[0440]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0441]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0442]
在一些实施方式中:
[0443]
r1和r3各自包括cd39分子;并且
[0444]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子;并且
[0445]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0446]
在一些实施方式中:
[0447]
r1和r3各自包括cd73分子;并且
[0448]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0449]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0450]
在一些实施方式中:
[0451]
r1和r3中的一个包括cd39分子,并且另一个包括cd73分子;并且
[0452]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0453]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0454]
在一些实施方式中:
[0455]
r1、r2、r3和r4各自独立地包括:hla-g分子;特异性靶向部分;或不存在;
[0456]
前提是存在hla-g分子和特异性靶向部分。
[0457]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0458]
在一些实施方式中:
[0459]
r1和r3各自包括hlg-a分子;并且
[0460]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0461]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0462]
在一些实施方式中:
[0463]
r1和r3各自包括激动性抗lilrb1抗体分子;并且
[0464]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0465]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0466]
在一些实施方式中:
[0467]
r1和r3各自包括激动性抗kir2dl4抗体分子;并且
[0468]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0469]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0470]
在一些实施方式中:
[0471]
r1和r3各自包括激动性抗lilrb2抗体分子;并且
[0472]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0473]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0474]
在一些实施方式中:
[0475]
r1和r3各自包括激动性抗nkg2a抗体分子;并且
[0476]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0477]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0478]
在一些实施方式中:
[0479]
r1和r3中的一个包括选自以下的第一部分,而另一个包括选自以下的不同部分:拮抗性抗lilrb1抗体分子、激动性抗kr2dl4抗体分子和激动性抗nkg2a抗体分子;并且
[0480]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0481]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0482]
在一些实施方式中:
[0483]
r1和r3中的一个包括拮抗性抗lilrb1抗体分子,并且另一个包括激动性抗kr2dl4抗体分子;并且
[0484]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0485]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上
不自配对的fc部分)。
[0486]
在一些实施方式中:
[0487]
r1和r3中的一个包括拮抗性抗lilrb1抗体分子,并且另一个包括激动性抗nkg2a抗体分子;并且
[0488]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0489]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0490]
在实施方式中:
[0491]
r1、r2、r3和r4各自独立地包括:il-2突变蛋白分子;特异性靶向部分;或不存在;
[0492]
前提是存il-2突变蛋白分子和特异性靶向部分。
[0493]
在实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0494]
r1、r2、r3和r4中的一个包括il-2突变蛋白分子,一个包括抗gitr抗体分子,例如抑制gitrl与gitr结合的抗gitr抗体分子,并且一个包括特异性靶向部分;
[0495]
在实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0496]
在实施方式中:
[0497]
r1和r3各自包括il-2突变蛋白分子;并且
[0498]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0499]
在实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0500]
在实施方式中:
[0501]
r1和r3中的一个包括garp结合分子,例如抗garp抗体分子或gitr结合分子,例如抗gitr抗体分子,并且另一个包括il-2突变蛋白分子;并且
[0502]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0503]
在实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0504]
在实施方式中:
[0505]
r1和r3中的一个包括garp结合分子,例如抗garp抗体分子,并且另一个包括il-2突变蛋白分子;并且
[0506]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0507]
在实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0508]
在实施方式中:
[0509]
r1和r3中的一个包括gitr结合分子,例如抗gitr抗体分子,以及另一个包括il-2突变蛋白分子;并且
[0510]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0511]
在实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0512]
在一些实施方式中:
[0513]
r1、r2、r3和r4各自独立地包括:激活b细胞上的抑制性受体的效应物结合调节部分,例如抗fcrl抗体分子,例如激动性抗fcrl抗体分子;特异性靶向部分;或不存在;
[0514]
前提是存在效应物结合部分和特异性靶向部分。
[0515]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0516]
在实施方式中,抗fcrl分子包括:抗fcrl抗体分子,例如针对fcrl1、fcrl2、fcrl3、fcrl4、fcrl5或fcrl6的激动性抗fcrl抗体分子。
[0517]
在一些实施方式中:
[0518]
r1和r3各自包括激动性抗fcrl抗体分子;并且
[0519]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0520]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0521]
在实施方式中,抗fcrl分子包括:抗fcrl抗体分子,例如针对fcrl1、fcrl2、fcrl3、fcrl4、fcrl5或fcrl6的激动性抗fcrl抗体分子。
[0522]
在一些实施方式中:
[0523]
r1和r3独立地包括特异性靶向部分,例如针对组织抗原的抗体分子;并且
[0524]
r2和r4各自包括抗fcrl抗体分子,例如激动性抗fcrl抗体分子,例如scfv分子。
[0525]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0526]
在实施方式中,抗fcrl分子包括:抗fcrl抗体分子,例如针对fcrl1、fcrl2、fcrl3、fcrl4、fcrl5或fcrl6的激动性抗fcrl抗体分子。
[0527]
在一些实施方式中:
[0528]
r1、r2、r3和r4中的一个包括抗bcr抗体分子,例如拮抗性抗bcr抗体分子,一个包括抗fcrl抗体分子,并且一个包括特异性靶向部分。
[0529]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0530]
在一些实施方式中,抗fcrl分子包括:抗fcrl抗体分子,例如针对fcrl1、fcrl2、fcrl3、fcrl4、fcrl5或fcrl6的激动性抗fcrl抗体分子。
[0531]
在一些实施方式中:
[0532]
r1、r2、r3和r4中的一个包括包含抗bcr抗体分子例如拮抗性抗bcr抗体分子和抗fcrl抗体分子的双特异性抗体分子,并且一个包括特异性靶向部分;
[0533]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0534]
在实施方式中,抗fcrl分子包括:抗fcrl抗体分子,例如针对fcrl1、fcrl2、fcrl3、fcrl4、fcrl5或fcrl6的激动性抗fcrl抗体分子。
[0535]
在一些实施方式中:
[0536]
r1、r2、r3和r4各自独立地包括:
[0537]
i)最小化或抑制t细胞活性、扩增或功能的效应物结合/调节部分(t细胞效应物结
合/调节部分),例如icim结合/调节部分、iic结合/调节部分、icsm结合/调节部分或sm结合/调节部分;
[0538]
ii)最小化或抑制b细胞活性、扩增或功能的效应物结合/调节部分(b细胞效应物结合/调节部分),例如icim结合/调节部分、iic结合/调节部分、icsm结合/调节部分或sm结合/调节部分;
[0539]
iii)特异性靶向部分;或
[0540]
iv)不存在;
[0541]
前提是存在t细胞效应物结合/调节部分、b细胞效应物结合/调节部分和特异性靶向部分。
[0542]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分)。
[0543]
在一些实施方式中,r1、r2、r3和r4中的一个包括激动性抗pd-1抗体并且一个包括hla-g分子。
[0544]
在一些实施方式中,r1、r2、r3和r4中的一个包括sm结合/调节部分,例如cd39分子或cd73分子。在一些实施方式中,r1、r2、r3和r4中的一个包括结合、激活或维持调节性免疫细胞例如treg细胞或breg细胞的实体,例如il-2突变蛋白分子。
[0545]
在一些实施方式中,r1、r2、r3和r4中的一个包括激动性抗pd-1抗体,或一个包括hla-g分子,并且一个包括il-2突变蛋白分子。在一些实施方式中,pd-1抗体被il-2突变蛋白分子替代。在一些实施方式中,r1、r2、r3和r4中的一个包括激动性抗pd-1抗体,一个包括hla-g分子,并且一个包括cd39分子或cd73分子。在一些实施方式中,pd-1抗体被il-2突变蛋白分子替代。
[0546]
接头区
[0547]
如本文别处所讨论的,特异性靶向部分和效应物结合/调节部分可以通过接头区连接。本文所述的任何接头区都可以用作接头。例如,接头区a和b可以包括fc区。在一些实施方式中,治疗化合物包括可以自缔合的接头区。在一些实施方式中,治疗化合物包括具有使自缔合最小化的部分的接头区,并且通常接头区a和接头区b是异二聚体。接头还包括甘氨酸/丝氨酸接头。在一些实施方式中,接头可以包括ggggs(seq id no:23)的一个或多个重复。在一些实施方式中,接头包括seq id no:23的1、2、3、4或5个重复。在一些实施方式中,接头包括或ggggsggggsggggsggggs(seq id no:22)ggggsggggsggggs(seq id no:30)。这些接头可以用于本文提供的任何治疗化合物或组合物中。
[0548]
接头区可以包括已被修饰(例如突变的)以产生异二聚体的fc区。在一些实施方式中,fc区的ch3结构域可以被突变。这样的fc区的实例可见于例如美国专利号9,574,010中,其通过援引整体并入此。如本文所限定的fc区包括ch3结构域或其片段,并且可以额外包括一个或多个额外恒定区结构域或其片段,包括铰链、ch1或ch2。应当理解,fc氨基酸残基的编号是kabat et al.,1991,nih publication 91-3242,national technical information service,springfield,va.中的eu索引编号。“kaba中所示的eu索引”是指人igg1kabat抗体的eu索引编号。为方便起见,美国专利号9,574,010的表b提供了根据来自人igg1的ch2和ch3结构域的如在kabat中所示的eu索引编号的氨基酸,其通过援引并入此。美国专利号9,574,010的表1.1提供了可以用作接头区的变异fc异二聚体的突变。美国专利号9,574,010的表1.1通过援引并入此。
[0549]
在一些实施方式中,接头区a包括第一ch3结构域多肽,并且接头区b包括第二ch3结构域多肽,与野生型ch3结构域多肽相比,第一和第二ch3结构域多肽独立地包括氨基酸修饰,其中第一ch3结构域多肽在位置t350、l351、f405和y407处包括氨基酸修饰,并且第二ch3结构域多肽在位置t350、t366、k392和t394处包括氨基酸修饰,其中位置t350处的氨基酸修饰是t350v、t3501、t350l或t350m;位置l351处的氨基酸修饰是l351y;位置f405处的氨基酸修饰是f405a、f405v、f405t或f405s;位置y407处的氨基酸修饰是y407v、y407a或y407i;位置t366处的氨基酸修饰是t366l、t366i、t366v或t366m,位置k392处的氨基酸修饰是k392f、k392l或k392m,并且位置t394处的氨基酸修饰是t394w,并且其中氨基酸残基的编号是根据kaba中所示的eu索引。
[0550]
在一些实施方式中,位置k392处的氨基酸修饰是k392m或k392l。在一些实施方式中,位置t350处的氨基酸修饰是t350v。在一些实施方式中,第一ch3结构域多肽进一步包括选自q347r,以及s400r或s400e之一的一个或多个氨基酸修饰。在一些实施方式中,第二ch3结构域多肽进一步包括选自l351y、k360e,以及n390r、n390d或n390e之一的一个或多个氨基酸修饰。在一些实施方式中,第一ch3结构域多肽进一步包括选自q347r,以及s400r或s400e之一的一个或多个氨基酸修饰,并且第二ch3结构域多肽进一步包括选自l351y、k360e,以及n390r、n390d或n390e之一的一个或多个氨基酸修饰。在一些实施方式中,位置t350处的氨基酸修饰是t350v。在一些实施方式中,位置f405处的氨基酸修饰是f405a。在一些实施方式中,位置y407处的氨基酸修饰是y407v。在一些实施方式中,位置t366处的氨基酸修饰是t366l或t366i。在一些实施方式中,位置f405处的氨基酸修饰是f405a,以及位置y407处的氨基酸修饰是y407v,位置t366的氨基酸修饰是t366l或t366i,并且位置k392处的氨基酸修饰是k392m或k392l。在一些实施方式中,第一ch3结构域多肽包括氨基酸修饰t350v、l351y、s400e、f405v和y407v,并且第二ch3结构域多肽包括氨基酸修饰t350v、t366l、n390r、k392m和t394w。在一些实施方式中,第一ch3结构域多肽包括氨基酸修饰t350v、l351y、s400e、f405t和y407v,并且第二ch3结构域多肽包括氨基酸修饰t350v、t366l、n390r、k392m和t394w。在一些实施方式中,第一ch3结构域多肽包括氨基酸修饰t350v、l351y、s400e、f405s和y407v,并且第二ch3结构域多肽包括氨基酸修饰t350v、t366l、n390r、k392m和t394w。在一些实施方式中,第一ch3结构域多肽包括氨基酸修饰t350v、l351y、s400e、f405a和y407v,并且第二ch3结构域多肽包括氨基酸修饰t350v、l351y、t366l、n390r、k392m和t394w。在一些实施方式中,第一ch3结构域多肽包括氨基酸修饰q347r、t350v、l351y、s400e、f405a和y407v,并且第二ch3结构域多肽包括氨基酸修饰t350v、k360e、t366l、n390r、k392m和t394w。在一些实施方式中,第一ch3结构域多肽包括氨基酸修饰t350v、l351y、s400r、f405a和y407v,并且第二ch3结构域多肽包括氨基酸修饰t350v、t366l、n390d、k392m和t394w。在一些实施方式中,第一ch3结构域多肽包括氨基酸修饰t350v、l351y、s400r、f405a和y407v,并且第二ch3结构域多肽包括氨基酸修饰t350v、t366l、n390e、k392m和t394w。在一些实施方式中,第一ch3结构域多肽包括氨基酸修饰t350v、l351y、s400e、f405a和y407v,并且第二ch3结构域多肽包括氨基酸修饰t350v、t366l、n390r、k392l和t394w。在一些实施方式中,第一ch3结构域多肽包括氨基酸修饰t350v、l351y、s400e、f405a和y407v,并且第二ch3结构域多肽包括氨基酸修饰t350v、t366l、n390r、k392f和t394w。
[0551]
在一些实施方式中,包括异二聚体ch3结构域的分离的异二聚体包括第一ch3结构域多肽和第二ch3结构域多肽,第一ch3结构域多肽包括位置f405和y407处氨基酸修饰,并且第二ch3结构域多肽包括位置t366和t394处氨基酸修饰,其中:(i)第一ch3结构域多肽进一步包括位置l351处的氨基酸修饰,并且(ii)第二ch3结构域多肽进一步包括位置k392处的氨基酸修饰,其中位置f405处的氨基酸修饰是f405a、f405t、f405s或f405v;并且位置y407处的氨基酸修饰是y407v、y407a、y407l或y407i;位置t394处的氨基酸修饰是t394w;位置l351处的氨基酸修饰是l351y;位置k392处的氨基酸修饰是k392l、k392m、k392v或k392f,并且位置t366处的氨基酸修饰是t366i、t366l、t366m或t366v,其中异二聚体ch3结构域具有约70℃或更高的的熔融温度(tm)和大于约90%的纯度,并且其中氨基酸残基的编号根据kabat中所示的eu索引。
[0552]
在一些实施方式中,接头区a包括第一ch3结构域多肽并且接头区b包括第二ch3结构域多肽,其中第一ch3结构域多肽包括位置f405和y407处的氨基酸修饰,并且第二ch3结构域多肽包括位置t366和t394处的氨基酸修饰,其中:(i)第一ch3结构域多肽还包含在位置l351处的氨基酸修饰,并且(ii)第二ch3结构域多肽还包含在位置k392处的氨基酸修饰,其中位置f405处的氨基酸修饰是f405a、f405t、f405s或f405v;并且位置y407处的氨基酸修饰是y407v、y407a、y407l或y407i;位置t394处的氨基酸修饰是t394w;位置l351处的氨基酸修饰是l351y;位置k392处的氨基酸修饰是k392l、k392m、k392v或k392f,并且位置t366处的氨基酸修饰是t366i、t366l、t366m或t366v,其中异二聚体ch3结构域具有约70c或更高的的解链温度(tm)和大于约90%的纯度,并且其中氨基酸残基的编号根据kabat中所示的eu索引。在一些实施方式中,位置f405处的氨基酸修饰是f405a。在一些实施方式中,位置t366处的氨基酸修饰是t366i或t366l。在一些实施方式中,位置y407处的氨基酸修饰是y407v。在一些实施方式中,位置f405处的氨基酸修饰是f405a,位置y407处的氨基酸修饰是y407v,位置t366的氨基酸修饰是t366i或t366l,并且位置k392处的氨基酸修饰是k392l或k392m。在一些实施方式中,位置f405处的氨基酸修饰是f405a,位置y407处的氨基酸修饰是y407v,位置t366的氨基酸修饰是t366l,并且位置k392处的氨基酸修饰是k392m。在一些实施方式中,位置f405处的氨基酸修饰是f405a,位置y407处的氨基酸修饰是y407v,位置t366的氨基酸修饰是t366l,并且位置k392处的氨基酸修饰是k392l。在一些实施方式中,位置f405处的氨基酸修饰是f405a,位置y407处的氨基酸修饰是y407v,位置t366的氨基酸修饰是t366i,并且位置k392处的氨基酸修饰是k392m。在一些实施方式中,位置f405处的氨基酸修饰是f405a,位置y407处的氨基酸修饰是y407v,位置t366的氨基酸修饰是t366i,并且位置k392处的氨基酸修饰是k392l。在一些实施方式中,第一ch3结构域多肽还进一步包括在位置s400处的选自s400d和s400e的氨基酸修饰,并且第二ch3结构域多肽还进一步包括氨基酸修饰n390r。在一些实施方式中,位置f405处的氨基酸修饰是f405a,位置y407处的氨基酸修饰是y405v,位置s400处的氨基酸修饰是s400e,位置t366处的氨基酸修饰是t366l,并且位置k392处的氨基酸修饰是k392m。
[0553]
在一些实施方式中,修饰的第一和第二ch3结构域包括在基于g型免疫球蛋白(igg)的fc构建体中。igg可以是igg1、igg2、igg3或igg4。
[0554]
包括变体ch3结构域的其他接头区a和接头区b描述于美国专利号9,499,634和9,562,109中,其每个都通过援引整体并入。
[0555]
接头区a和接头区b可以是蛋白质(例如天然存在的蛋白质,诸如人血清白蛋白)的互补片段。在实施方式中,接头区a和接头区b中的一个包括蛋白质(例如hsa)的第一(例如n末端)片段,并且另一个包括蛋白质(例如has)的第一(例如c末端)片段。在实施方式中,片段包括n末端和c末端片段。在实施方式中,片段包括两个内部片段。通常片段不重叠。在实施方式中,第一和第二片段一起提供原始蛋白质例如hsa的完整序列。第一片段提供用于与其他序列例如r1、r2、r3或r4的序列(如本文限定的)连接,例如融合的n末端和c末端。
[0556]
接头区a和接头区b可以源自白蛋白多肽。在一些实施方式中,白蛋白多肽选自天然人血清白蛋白多肽和人异白蛋白多肽。可以修饰白蛋白多肽,使得接头区a和接头区b彼此相互作用以形成异二聚体。修饰的白蛋白多肽的实例描述于美国专利号9,388,231和9,499,605中,其每个都通过援引整体并入此。
[0557]
因此,本文提供了式r1
‑‑‑
接头区a—r2以及r3
‑‑‑
接头区b
‑‑‑
r4的多功能异多聚体蛋白质,其中接头区a和接头区b形成异多聚体。在一些实施方式中,接头区a包括第一多肽并且接头区b包括第二多肽;其中所述第一和第二多肽中的每一个都包括氨基酸序列,所述氨基酸序列包括选自天然人血清白蛋白多肽和人异白蛋白多肽的白蛋白多肽的片段;其中所述第一和第二多肽通过在分割位点分割所述白蛋白多肽获得,使得分割导致在分割位点处缺失零至3个氨基酸残基;其中所述第一多肽包括选自a194c、l198c、w214c、a217c、l331c和a335c的至少一个突变,并且所述第二多肽包括选自l331c、a335c、v343c、l346c、a350c、v455c和n458c的至少一个突变;并且其中所述第一和第二多肽自组装以形成单体形式的白蛋白多肽的准天然结构。
[0558]
在一些实施方式中,分割位点位于白蛋白多肽的环上,该环具有高溶剂可及表面积(sasa)并且与白蛋白结构的其余部分接触有限,b)分割导致转运蛋白多肽之间的互补界面。这些分割位点描述于例如美国专利号9,388,231中,其通过援引整体并入此。
[0559]
在一些实施方式中,第一多肽包括具有本文所述的一个或多个突变的白蛋白多肽的残基1-337或残基1-293。在一些实施方式中,第二多肽包括具有本文所述的一个或多个突变的白蛋白多肽的残基342-585或304-585。在一些实施方式中,第一多肽包括白蛋白蛋白质的残基1-339、1-300、1-364、1-441、1-83、1-171、1-281、1-293、1-114、1-337或1-336。在一些实施方式中,第二多肽包括白蛋白蛋白质的残基301-585、365-585、442-585、85-585、172-585、282-585或115-585、304-585、340-585或342-585。
[0560]
在一些实施方式中,第一和第二多肽包括如下表所示的白蛋白蛋白质残基。白蛋白蛋白质的序列描述如下。
[0561][0562][0563]
在一些实施方式中,第一和第二多肽包括可以彼此形成共价键诸如二硫键的接头。接头的非限制性实例是肽接头。在一些实施方式中,肽接头包括ggggs(seq id no:23)。接头可以与第一多肽的c末端和第二多肽的n末端融合。接头也可以用于附连本文所述的部分,而不会废除接头形成二硫键的能力。在一些实施方式中,第一和第二多肽不包括可以形成共价键的接头。在一些实施方式中,第一和第二多肽具有以下置换。
[0564]
第一多肽置换第二多肽置换a217cv343cl331ca350ca217cl346cw214cv343ca335cl346cl198cv455ca217ca335ca217cl331cl198cn458ca194cv455c
[0565]
白蛋白多肽的序列可以是如所示的人白蛋白的序列,为去除n末端信号传导残基的后蛋白形式(mkwvtfisllflfssaysrgvfrr)
[0566]
dahksevahrfkdlgeenfkalvliafaqylqqcpfedhvklvnevtefaktcvadesaencdkslhtlfgdklctvatlretygemadccakqepernecflqhkddnpnlprlvrpevdvmctafhdneetflkkylyeiarrhpyfyapellffakrykaafteccqaadkaacllpkldelrdegkassakqrlkcaslqkfgerafkawavarls
qrfpkaefaevsklvtdltkvhtecchgdllecaddradlakyicenqdsissklkeccekpllekshciaevendempadlpslaadfveskdvcknyaeakdvflgmflyeyarrhpdysvvlllrlaktyettlekccaaadphecyakvfdefkplveepqnlikqncelfeqlgeykfqnallvrytkkvpqvstptlvevsrnlgkvgskcckhpeakrmpcaedylsvvlnqlcvlhektpvsdrvtkccteslvnrrpcfsalevdetyvpkefnaetftfhadictlsekerqikkqtalvelvkhkpkatkeqlkavmddfaafvekcckaddketcfaeegkklvaasqaalgl(human albumin,seq id no:42)
[0567]
在一些实施方式中,接头区a和接头区b形成如本文所述的异二聚体。
[0568]
在一些实施方式中,多肽包括在n末端的抗体,该抗体由与igg fc骨架的c末端上的scfv融合的igg1 fc骨架上的f(ab’)2构成。在一些实施方式中,igg fc骨架是igg1fc骨架。在一些实施方式中,igg1骨架被igg4骨架、igg2骨架或其他类似的igg骨架替换。本段中描述的igg骨架可以用于整个本技术,其中fc区被称为治疗化合物的一部分。因此,在一些实施方式中,由igg1 fc骨架上的f(ab’)2构成的抗体可以是igg1fc上的抗madcam抗体或抗pd-1抗体或本文提供的任何其他靶向部分或效应物结合/调节部分。在一些实施方式中,与c末端融合的scfv区段可以是抗pd-1抗体(如果n末端区是抗madcam抗体的话),或抗madcam抗体(如果n末端区是抗pd-1抗体的话)。在这种非限制性实例中,n末端可以是靶向部分,诸如本文提供的那些中的任一个,并且c末端可以是效应物结合/调节部分,诸如本文提供的那些中的任一个。替代地,在一些实施方式中,n末端可以是效应物结合/调节部分,诸如本文提供的那些中的任一个,并且c末端可以是靶向部分,诸如本文提供的那些中的任一个。
[0569]
在一些实施方式中,n末端可以是靶向部分,诸如本文提供的那些中的任一个,并且c末端可以是效应物结合/调节部分,诸如本文提供的那些中的任一个。
[0570]
在一些实施方式中,治疗化合物包括两种均二聚化的多肽。在一些实施方式中,多肽的n末端包括与人igg1 fc结构域(例如ch2和/或ch3结构域)融合的效应物结合/调节部分。在一些实施方式中,fc结构域的c末端是与靶向部分融合的另一个接头。因此,在一些实施方式中,分子可以使用式r1-接头a-fc区-接头b-r2表示,其中r1可以是效应物结合/调节部分,r2是靶向部分,接头a和接头b独立地是本文提供的接头。在一些实施方式中,接头1和接头2不同。
[0571]
在一些实施方式中,分子可以使用式r1-接头a-fc区域-接头b-r2表示,其中r1可以是靶向部分,r2是效应物结合/调节部分,接头a和接头b独立地是本文提供的独立接头。在一些实施方式中,接头a和接头b不同。接头可以选自本文提供的非限制性实例。在一些实施方式中,r1和r2独立地选自f(ab’)2和scfv抗体结构域。在一些实施方式中,r1和r2是不同的抗体结构域。在一些实施方式中,scfv以vl-vh结构域方向。
[0572]
在一些实施方式中,治疗化合物是双特异性抗体。在一些实施方式中,双特异性抗体由包括以下的四个多肽链构成:
[0573]
链1:nt-vh1-ch1-ch2-ch3-接头a-scfv[vl2-接头b-vh2]-ct
[0574]
链2:nt-vh1-ch1-ch2-ch3-接头a-scfv[vl2-接头b-vh2]-ct
[0575]
链3:nt-vl1-cl-ct
[0576]
链4:nt-vl1-cl-ct,
[0577]
其中链1和2彼此相同,并且链3和4彼此相同,
[0578]
其中链1与链2形成同二聚体;并且链3和4与链1和链2缔合。也就是说,当每条轻链
与每条重链缔合时,vl1与vh1缔合并且cl与ch1缔合以形成两个功能性fab单元。不受任何特定理论的束缚,每个scfv单元本质上是功能性的,因为vl2和vh2与本文提供的接头(例如ggggs(seq id no:23)、ggggsggggsggggsggggs(seq id no:22)或ggggsggggsggggs(seq id no:30)共价级联连接。彼此独立的接头a和接头b的序列可以相同或不同,并且或者如本技术通篇所述。因此,在一些实施方式中,接头a包括ggggs(seq id no:23),或其两个重复,或ggggsggggsggggs(seq id no:30)或ggggsggggsggggsggggs(seq id no:22)。在一些实施方式中,接头b包括ggggs(seq id no:23),或其两个重复,或ggggsggggsggggs(seq id no:30)或ggggsggggsggggsggggs(seq id no:22)。scfv可以以nt-vh2-vl2-ct或nt-vl2-vh2-ct方向排列。nt或nt代表蛋白质的n末端,并且ct或ct代表蛋白质的c末端。ch1、ch2和ch3是来自igg fc区的结构域,并且cl代表恒定轻链,其可以是κ或λ家族轻链。其他定义代表它们在本领域中通常使用的方式。
[0579]
在一些实施方式中,vh1和vl1结构域源自效应物分子并且vh2和vl2结构域源自靶向部分。在一些实施方式中,vh1和vl1结构域源自靶向部分并且vh2和vl2结构域源自效应物结合/调节部分。
[0580]
在一些实施方式中,vh1和vl1结构域源自抗pd-1抗体,并且vh2和vl2结构域源自抗madcam抗体。在一些实施方式中,vh1和vl1结构域源自抗madcam抗体并且vh2和vl2结构域源自抗pd-1抗体。
[0581]
在一些实施方式中,接头a包括1、2、3、4或5个ggggs(seq id no:23)重复。在一些实施方式中,接头b包括1、2、3、4或5个ggggs(seq id no:23)重复。为避免疑问,本技术通篇中使用的接头a和接头b的序列彼此独立。因此,在一些实施方式中,接头a和接头b可以相同或不同。在一些实施方式中,接头a包括ggggs(seq id no:23),或其两个重复,或ggggsggggsggggs(seq id no:30)或ggggsggggsggggsggggs(seq id no:22)。在一些实施方式中,接头b包括ggggs(seq id no:23),或其两个重复,或ggggsggggsggggs(seq id no:30)或ggggsggggsggggsggggs(seq id no:22)。
[0582]
在一些实施方式中,治疗化合物包括轻链和重链。在一些实施方式中,轻链和重链在n末端以靶向部分的vh结构域开始,随后是人igg1的ch1结构域,其与人igg1的fc区(例如ch2-ch3)融合。在一些实施方式中,fc区的c末端与本文提供的接头融合,诸如但不限于ggggs(seq id no:23),或其两个或三个重复,或ggggsggggsggggs(seq id no:30)。然后可以将接头与效应物结合/调节部分,诸如本文提供的任何一种效应物部分融合。多肽可以同二聚化,因为通过重链同二聚化,其产生具有两个效应物部分,诸如两个抗pd-1抗体的治疗化合物。在这个方向上,靶向部分是igg形式,存在两个fab臂,每个臂识别靶向部分的结合配偶体,例如,被抗madcam靶向部分结合的madcam。
[0583]
在一些实施方式中,治疗剂或多肽包括下式:
[0584]
具有igg同种型的可变重链和可变轻链的抗体(靶向部分),例如,具有效应物分子,诸如il-2突变蛋白。在一些实施方式中,il-2突变蛋白在可变重链的c末端融合。这可以由式vl和vh-iggconstantdomain-l1-e表示,其中l1是接头,诸如本文提供的甘氨酸/丝氨酸接头,e是效应物分子,诸如il-2突变蛋白,并且vl和vh是可变的轻链和重链。vl结构域可以是κ结构域。在一些实施方式中,igg恒定结构域包括以下序列:
[0585]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssv
vtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaagapsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:44)
[0586]
在一些实施方式中,接头包括ggggs。在一些实施方式中,il-2突变蛋白包括本文提供的il-2突变蛋白,诸如seq id no:31-41之一,其还可以具有附加到il-2突变蛋白的n或c末端的fc分子。fc结构域可以包括seq id no:21或43。在一些实施方式中,il-2突变蛋白包括seq id no:47-60之一的序列。在一些实施方式中,il-2突变蛋白包括seq id no:41或seq id no:56。在一些实施方式中,il-2突变蛋白包括seq id no:40或seq id no:55。
[0587]
在一些实施方式中,靶向部分是madcam抗体。
[0588]
在一些实施方式中,靶向部分是madcam抗体。
[0589]
[0590]
[0591]
[0592]
[0593]
[0594]
[0595]
[0596]
[0597]
[0598]
[0599]
[0600]
[0601]
[0602]
[0603]
[0604]
[0605]
[0606]
[0607]
[0608]
[0609][0610][0611]
在一些实施方式中,抗体包括如表6或表7中所示的cdr组。在一些实施方式中,抗体包括表6的克隆id:6、克隆id:59或克隆id:63的cdr。
[0612]
抗体可以是scfv形式,其也在表6的非限制性实施方式中图示。
[0613]
在一些实施方式中,madcam抗体选自下表,其可以是如表7所示的igg形式。
[0614]
[0615]
[0616]
[0617]
[0618]
[0619]
[0620]
[0621]
[0622]
[0623]
[0624]
[0625]
[0626]
[0627]
[0628]
[0629]
[0630]
[0631]
[0632]
[0633]
[0634]
[0635]
[0636]
[0637][0638]
在一些实施方式中,抗体包括表7的克隆id:6、克隆id:75或克隆id:79的cdr。
[0639]
本文所示的igg和scfv形式只是非限制性实例。本文提供的cdr可以以不同形式放置,包括不同的vh和vl/vk形式,并且仍然能够结合madcam。
[0640]
尽管在本文提供的表格中说明了cdr,但还有其他方式来注释或识别cdr。例如,在一些实施方式中,hcdr2可以在n末端具有额外的氨基酸。例如,对于克隆6的hcdr2,该表指示其具有以下序列:srinsygtsttya(seq id no:91)然而,在一些实施方式中,hcdr2具有vsrinsygtsttya(seq id no:629)的序列,其被示出为在hcdr2的n末端具有额外的残基缬氨酸。在本文提供的表的vh肽中清楚地示出了缬氨酸。因此,在一些实施方式中,hcdr2包括紧邻表中所列hcdr2的n末端的一个附加的氨基酸。残基将是表中同一行提供的vh序列中发现的紧邻hcdr2的n末端的残基。具有该信息的本领域技术人员可以立即设想具有紧邻表中所列hcdr2的n末端的额外氨基酸残基的hcdr2肽序列。这些实施方式被充分描述并且不需要应用来列出这些不同注释中的每一个,并且本领域技术人员根据本文提供的指导和描述可以分别写出它们而无需任何过度实验。
[0641]
类似地,hcdr3可以不包括半胱氨酸残基。表6和表7中提供的每个hcdr3多肽都以半胱氨酸残基开始。在一些实施方式中,hcdr3不包括半胱氨酸。此外,在一些实施方式中,hcdr3不具有本文提供的表6和7中所示的最后一个c末端残基。因此,在一些实施方式中,hcdr3不具有表中所示的半胱氨酸和/或最后一个c末端残基。拥有该信息的本领域技术人
员可以立即设想不具有表中所示的半胱氨酸和/或最后一个c末端残基的hcdr3肽序列。这些实施方式被充分描述并且不需要应用来列出这些不同注释中的每一个,并且本领域技术人员根据本文提供的指导和描述可以分别写出它们而无需任何过度实验。
[0642]
在一些实施方式中,轻链cdr2可以在n末端具有一个或两个额外的氨基酸残基。这些额外的残基将是紧邻存在于本文提供的vl/vk链中的轻链cdr2(lcdr2)的n末端的那些残基,与所示的cdr在同一行。例如,克隆6的lcdr2作为gasslqs(seq id no:87)提供,但在一些实施方式中可以是iygasslqs(seq id no:630)或ygasslqs(seq id no:631)。拥有该信息的本领域技术人员可以立即设想在本文提供的lcdr2序列的n末端具有一或两个额外氨基酸残基的lcdr2肽序列。这些实施方式被充分描述并且不需要应用来列出这些不同注释中的每一个,并且本领域技术人员根据本文提供的指导和描述可以分别写出它们而无需任何过度实验。
[0643]
还有用于注释cdr的替代系统,所有这些系统都可以使用。例如,可以基于kabat系统、imgt系统或chothia来选择cdr。也可以使用其他专有系统,这可能基于预测的蛋白质的3维结构。因此,在一些实施方式中,表7的克隆id:6、克隆id:75或克隆id:79的cdr也可以如表8中所示表征。这些替代的cdr可以代替表7中引用的这些克隆或表6中的等效克隆编号,即克隆6、克隆59和克隆63。
[0644]
[0645]
[0646][0647]
在一些实施方式中,抗体与另一种抗体或治疗剂连接。在一些实施方式中,madcam抗体与本文提供的或通过援引并入的pd-1抗体或il-2突变蛋白连接。
[0648]
在一些实施方式中,madcam抗体包括表6中所示的序列。在一些实施方式中,抗体是表6所示的scfv形式。在一些实施方式中,抗体包括来自表6的克隆1-66中任一个的cdr1、来自克隆1-84中任一个的cdr2以及来自表6的克隆1-66中任一个的cdr3。在一些实施方式中,抗体包括来自表6的克隆1-66中任一个的lcdr1、来自表6的克隆1-66中任一个的lcdr2以及来自表6的克隆1-66中任一个的lcdr3。在一些实施方式中,上文所示的cdr的氨基酸残基包含突变。在一些实施方式中,cdr包含1、2、3、4、5、6、7、8、9或10个置换或突变。在一些实施方式中,置换是保守置换。
[0649]
在一些实施方式中,madcam抗体具有选自表7的克隆1-84中任一个的vh区和选自表7中所示的克隆1-84中任一个的vl区。在一些实施方式中,抗体包括来自表7的克隆1-84中任一个的cdr1、来自克隆1-84中任一个的cdr2以及来自表7的克隆1-84中任一个的cdr3。
在一些实施方式中,抗体包括来自表7的克隆1-84中任一个的lcdr1、来自表7的克隆1-84中任一个的lcdr2以及来自表7的克隆1-84中任一个的lcdr3。在一些实施方式中,上文所示的cdr的氨基酸残基包含突变。在一些实施方式中,cdr包含1、2、3、4、5、6、7、8、9或10个置换或突变。在一些实施方式中,置换是保守置换。
[0650]
在一些实施方式中,分子包括与madcam结合的抗体。在一些实施方式中,抗体包括(i)重链可变区,其包括重链cdrl、cdr2和cdr3序列,其中重链cdr1序列具有表6或表7中所示的任何cdr1序列的氨基酸序列;重链cdr2具有表6或表7中所示的任何cdr2序列的氨基酸序列,并且重链cdr3具有表6或表7中所示的任何cdr3序列的氨基酸序列;或任何前述的变体;以及(ii)轻链可变区,其包括轻链cdr1、cdr2和cdr3序列,其中轻链cdr1序列具有表6或表7中所示的任何lcdr1序列的氨基酸序列;轻链lcdr2具有表6或表7中所示的任何lcdr2序列的氨基酸序列,并且轻链cdr3具有表6或表7中所示的任何lcdr3序列的氨基酸序列,或任何前述的变体。
[0651]
在一些实施方式中,抗体包括重链可变区,其包括重链cdrl、cdr2和cdr3序列,其中重链cdrl、cdr2和cdr3序列具有表6的抗体6或表7的抗体6中所示的氨基酸序列,或任何前述的变体;以及(ii)轻链可变区,其包括轻链cdrl、cdr2和cdr3序列,其中轻链cdrl、cdr2和cdr3序列具有表6的抗体6或表7的抗体6中所示的氨基酸序列,或任何前述的变体。
[0652]
在一些实施方式中,抗体包括重链可变区,其包括重链cdrl、cdr2和cdr3序列,其中重链cdrl、cdr2和cdr3序列具有表6的抗体59或表7的抗体75中所示的氨基酸序列,或任何前述的变体;以及(ii)轻链可变区,其包括轻链cdrl、cdr2和cdr3序列,其中轻链cdrl、cdr2和cdr3序列具有表6的抗体59或表7的抗体75中所示的氨基酸序列,或任何前述的变体。
[0653]
在一些实施方式中,抗体包括重链可变区,其包括重链cdr1、cdr2和cdr3序列,其中重链cdr1、cdr2和cdr3序列具有表6的抗体63或表7的抗体79中所示的氨基酸序列,或任何前述的变体;以及(ii)轻链可变区,其包括轻链cdr1、cdr2和cdr3序列,其中轻链cdr1、cdr2和cdr3序列具有表6的抗体63或表7的抗体79中所示的氨基酸序列,或任何前述的变体。
[0654]
这些是非限制性示例性实例并且抗体可以具有本文提供的表中所示的cdr并且明确引用而不写出每个cdr组的先前段落。
[0655]
在一些实施方式中,madcam抗体包括本文提供的vh和vl(vk)链,诸如表7中所示的那些。在一些实施方式中,vh肽包括seq id no:414、591或599的序列。在一些实施方式中,vk链包括415、592或600的序列。在一些实施方式中,抗体包括seq id no:414的vh和seq id no:415的vk。在一些实施方式中,抗体包括seq id no:591的vh和seq id no:592的vk。在一些实施方式中,抗体包括seq id no:599的vh和seq id no:600的vk。vh和vk也可以是表6所示的scfv形式。
[0656]
在一些实施方式中,提供了包括以下多肽中的一种或多种的治疗剂:
[0657]
[0658][0659]
在一些实施方式中,多肽包含seq id no:620、622或624的一种肽和seq id no:621、623或625的第二肽。在一些实施方式中,提供了一种多肽,该多肽包括seq id no:620的第一肽和包括seq id no:621的序列的第二肽。在一些实施方式中,提供了一种多肽,该多肽包括seq id no:620的第一肽和包括seq id no:623的序列的第二肽。在一些实施方式中,提供了一种多肽,该多肽包括seq id no:620的第一肽和包括seq id no:625的序列的第二肽。在一些实施方式中,提供了一种多肽,该多肽包括seq id no:622的第一肽和包括seq id no:621的序列的第二肽。在一些实施方式中,提供了一种多肽,该多肽包括seq id no:622的第一肽和包括seq id no:623的序列的第二肽。在一些实施方式中,提供了一种多肽,该多肽包括seq id no:622的第一肽和包括seq id no:625的序列的第二肽。在一些实
施方式中,提供了一种多肽,该多肽包括seq id no:624的第一肽和包括seq id no:621的序列的第二肽。在一些实施方式中,提供了一种多肽,该多肽包括seq id no:624的第一肽和包括seq id no:623的序列的第二肽。在一些实施方式中,提供了一种多肽,该多肽包括seq id no:624的第一肽和包括seq id no:625的序列的第二肽。
[0660]
在一些实施方式中,多肽被称为抗体或抗原结合蛋白。
[0661]
在一些实施方式中,如本文所提供的,madcam抗体或其结合片段直接或间接地与pd-1抗体或其结合片段连接。
[0662]
在一些实施方式中,如本文所提供的,madcam抗体或其结合片段直接或间接地与il-2突变蛋白或其结合片段连接。il-2突变蛋白可以是本文提供的任何突变蛋白或本领域技术人员已知的其他il-2突变蛋白。
[0663]
在一些实施方式中,如果治疗化合物包括fc部分,则fc结构域(部分)带有突变以使fc区“无效应物”,即不能结合fcr。使fc区无效应物的突变是已知的。在一些实施方式中,根据已知编号系统的fc区中的突变选自:k322a、l234a、l235a、g237a、l234f、l235e、n297、p331s或其任何组合。在一些实施方式中,fc突变包括l234和/或l235和/或g237处的突变。在一些实施方式中,fc突变包括l234a和/或l235a突变,其可称为lala突变。在一些实施方式中,fc突变包括l234a、l235a和g237a突变。
[0664]
本文公开了接头区多肽、治疗性肽和编码多肽(例如治疗化合物)的核酸、包括核酸序列的载体以及包括核酸或载体的细胞。
[0665]
治疗化合物可以包括多个特异性靶向部分。在一些实施方式中,治疗化合物包括多个一种特异性靶向部分、多个拷贝的供体特异性靶向部分或多个组织特异性靶向部分。在一些实施方式中,治疗化合物包括第一和第二供体特异性靶向部分,例如对第一供体靶标具有特异性的第一供体特异性靶向部分和对第二供体靶标具有特异性的第二供体特异性靶向部分,例如,其中第一和第二靶标被发现在相同的供体组织上。在一些实施方式中,治疗化合物包括例如针对组织特异性靶标的第一特异性靶向部分和针对第二靶标的第二特异性靶向部分,例如,其中第一和第二靶标被发现在相同或不同的靶组织上。
[0666]
在一些实施方式中,治疗化合物包括多个效应物结合/调节部分,每个包括icim结合/调节部分,icim结合/调节部分的数目足够低以使免疫细胞上icim结合/调节部分的配体的聚集(在不存在靶标结合的情况下)最小化,例如,以避免在治疗化合物不与靶标结合的情况下免疫细胞的全身激动。
[0667]
在一些实施方式中,治疗化合物从n末端到c末端具有下式:
[0668]
a1
‑‑‑
接头a
‑‑‑
a2
‑‑‑
接头b
‑‑‑
a3
[0669]
a3
‑‑‑
接头a
‑‑‑
a2
‑‑‑
接头b
‑‑‑
a1,
[0670]
其中,
[0671]
a1和a3各自独立地包括效应物结合/调节部分,例如icim结合/调节部分、iic结合/调节部分、icsm结合/调节部分或sm结合/调节部分;或特异性靶向部分,
[0672]
a2包括fc区或不存在;并且
[0673]
接头a和接头b各自是独立的接头。
[0674]
在一些实施方式中,
[0675]
a1包括il-2突变蛋白分子,
[0676]
a3包括特异性靶向部分,例如抗人madcam ab,例如scfv,
[0677]
a2包括fc区,并且
[0678]
接头a和接头b各自是独立的接头,进一步包括甘氨酸/丝氨酸接头。
[0679]
在一些实施方式中,提供了一种多肽,其中该多肽包括下式的肽
[0680]
ab-constantdomain-接头a-il2mutein-接头b-fcregion,其中ab是与madcam结合的可变重链结构域,constantdomain是ig恒定结构域,诸如igg1、igg2、igg3或igg4,接头a是接头,诸如本文提供的那些,并且il2mutein是il-2突变蛋白,诸如本文提供的那些。在一些实施方式中,可变重链结构域是表7中所示的可变重链结构域。在一些实施方式中,可变重链结构域包括表7的克隆id:6、75或79的可变重链结构域。在一些实施方式中,可变重链结构域包括表7的6、75或79的重结构域的cdr。在一些实施方式中,vh包括seq id no:414、seq id no:591和seq id no:599的序列。
[0681]
在一些实施方式中,constantdomain包括igg1恒定结构域,诸如本文提供的那些。在一些实施方式中,恒定结构域包括突变以使恒定区“无效应物”,即不能结合fcr。使恒定区无效应物的突变是已知的。在一些实施方式中,根据已知编号系统的恒定区中的突变选自:k322a、l234a、l235a、g237a、l234f、l235e、n297、p331s或其任何组合。在一些实施方式中,恒定区突变包括l234和/或l235和/或g237处的突变。在一些实施方式中,恒定区突变包括l234a和/或l235a突变,其可称为lala突变。在一些实施方式中,恒定区突变包括l234a、l235a和g237a突变。在一些实施方式中,constantdomain包括seq id no:44。
[0682]
在一些实施方式中,可变重链结构域包括seq id no:90的第一cdr、seq id no:91的第二cdr以及seq id no:92的第三cdr。在一些实施方式中,可变重链结构域包括seq id no:359的第一cdr、seq id no:170的第二cdr以及seq id no:360的第三cdr。在一些实施方式中,可变重链结构域包括seq id no:135的第一cdr、seq id no:381的第二cdr以及seq id no:382的第三cdr。这些仅是说明性的,并且还提供了本文和表中所示的cdr组。
[0683]
在一些实施方式中,接头a是甘氨酸/丝氨酸接头,其可以是本文提供的任何甘氨酸/丝氨酸接头。在一些实施方式中,接头是ggggsggggsggggsggggs(seq id no:22)或ggggsggggsggggs(seq id no:30)的序列。这只是非限制性实例,并且接头可以具有不同数目的ggggs(seq id no:23)或gggga重复(seq id no:29),或这两个的混合物。在一些实施方式中,接头包括1、2、3、4、5、6、7、8、9或10个ggggs(seq id no:23)和/或gggga重复(seq id no:29)重复。在一些实施方式中,接头的长度为10个氨基酸。在一些实施方式中,接头的长度为5个氨基酸。在一些实施方式中,接头的长度为15个氨基酸。在一些实施方式中,接头的长度为20个氨基酸。在一些实施方式中,接头的长度为25个氨基酸。在一些实施方式中,接头的长度为30个氨基酸。在一些实施方式中,接头的长度为35个氨基酸。在一些实施方式中,接头的长度为5-50个氨基酸。
[0684]
在一些实施方式中,il-2突变蛋白包括seq id no:31的序列。在一些实施方式中,il-2突变蛋白包括seq id no:32的序列。在一些实施方式中,il-2突变蛋白包括seq id no:33的序列。在一些实施方式中,il-2突变蛋白包括seq id no:34的序列。在一些实施方式中,il-2突变蛋白包括seq id no:35的序列。在一些实施方式中,il-2突变蛋白包括seq id no:36的序列。在一些实施方式中,il-2突变蛋白包括seq id no:37的序列。在一些实施方式中,il-2突变蛋白包括seq id no:38的序列。在一些实施方式中,il-2突变蛋白包括
seq id no:39的序列。在一些实施方式中,il-2突变蛋白包括seq id no:40的序列。在一些实施方式中,il-2突变蛋白包括seq id no:41的序列。在一些实施方式中,il-2突变蛋白进一步包括t3a置换(突变)。在一些实施方式中,fc区包括具有seq id no:21的序列的肽。在一些实施方式中,fc区包括具有seq id no:28的序列的肽。在一些实施方式中,fc区的c末端与可变重链的n末端或c末端或il-2突变蛋白连接。在一些实施方式中,将fc区与可变重链或il-2突变蛋白连接的接头是甘氨酸/丝氨酸或甘氨酸/丙氨酸接头。在一些实施方式中,将fc区与可变重链的c或n末端或il-2突变蛋白连接的接头是甘氨酸/丝氨酸接头,其可以是ggggsggggsggggsggggs(seq id no:22)或ggggsggggsggggs(seq id no:30)的序列。这只是非限制性实例,并且接头可以具有不同数目的ggggs(seq id no:23)或gggga重复(seq id no:29),或这两个的混合物。在一些实施方式中,接头包括1、2、3、4、5、6、7、8、9或10个ggggs(seq id no:23)和/或gggga重复(seq id no:29)重复。在一些实施方式中,接头的长度为10个氨基酸。在一些实施方式中,接头的长度为5个氨基酸。在一些实施方式中,接头的长度为15个氨基酸。在一些实施方式中,接头的长度为20个氨基酸。在一些实施方式中,接头的长度为25个氨基酸。在一些实施方式中,接头的长度为30个氨基酸。在一些实施方式中,接头的长度为35个氨基酸。在一些实施方式中,接头的长度为5-50个氨基酸。
[0685]
在一些实施方式中,多肽进一步包括式vl-constantdomainlight的多肽,其中vl是可变轻链并且constantdomainlight是igg轻链恒定结构域,其中多肽可以是具有式ab-constantdomain-接头a-il2mutein-接头b-fcregion的多肽或与其缔合。在一些实施方式中,vl包括seq id no:415、seq id no:592或seq id no:600的序列。这些仅是实例性的,并且vl结构域可以是本文,诸如在表7中提供的vl/vk序列。在一些实施方式中,可变轻链结构域包括seq id no:93的第一cdr、seq id no:87的第二cdr以及seq id no:94的第三cdr。在一些实施方式中,可变轻链结构域包括seq id no:361的第一cdr、seq id no:362的第二cdr以及seq id no:363的第三cdr。在一些实施方式中,可变重链结构域包括seq id no:383的第一cdr、seq id no:384的第二cdr以及seq id no:385的第三cdr。这些仅是说明性的,并且还提供了本文和表中所示的cdr组。
[0686]
在一些实施方式中,恒定结构域还包括突变以抵消效应物功能,诸如本文提供的那些。在一些实施方式中,constantdomainlight包括以下序列:
[0687]
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:45)
[0688]
式il2mutein-接头a-fcregion-接头b-ab和vl-constantdomainlight的不同多肽可以彼此互换。在一些实施方式中,多肽包括可变重链,其包括seq id no:90的第一cdr、seq id no:91的第二cdr以及seq id no:92的第三cdr,以及可变轻链,其包括seq id no:93的第一cdr、seq id no:87的第二cdr和seq id no:94的第三cdr。在一些实施方式中,多肽包括可变重链,其包括seq id no:359的第一cdr、seq id no:170的第二cdr以及seq id no:360的第三cdr,以及可变轻链,其包括seq id no:361的第一cdr、seq id no:362的第二cdr和seq id no:363的第三cdr。在一些实施方式中,多肽包括可变重链,其包括seq id no:135的第一cdr、seq id no:381的第二cdr以及seq id no:382的第三cdr,以及可变轻链,其包括seq id no:383的第一cdr、seq id no:384的第二cdr和seq id no:385的第三cdr。这些是非限制性实例并且如表1和2中madcam抗体所示的cdr组合也可以使用的并在本
文中提供。
[0689]
在一些实施方式中,提供了化合物,其包括从n末端到c末端的下式:
[0690]
il2mutein-接头a-fcregion-接头b-ab,其中il2mutein是可以例如优先激活treg的任何il-2突变蛋白;接头a和接头b各自独立地是本文提供的接头,fc区可以是诸如本文提供的任一种,并且ab是组织靶向部分,诸如本文提供的那些。在一些实施方式中,ab是与madcam或本文提供的另一细胞表面靶标结合的抗体。在一些实施方式中,抗体是scfv形式。在一些实施方式中,scfv形式的抗体是表6中提供的抗体。在一些实施方式中,scfv形式的抗体是包括表6或表7中所示的cdr的抗体。
[0691]
在一些实施方式中,il-2突变蛋白的c末端与fc区的n末端连接。在一些实施方式中,连接是直接的或通过接头,诸如本文所述的那些。在一些实施方式中,接头是甘氨酸/丝氨酸接头。在一些实施方式中,将il-2突变蛋白与fc区连接的接头是甘氨酸/丝氨酸接头,其可以是ggggsggggsggggsggggs(seq id no:22)或ggggsggggsggggs(seq id no:30)的序列。这只是非限制性实例,并且接头可以具有不同数目的ggggs(seq id no:23)或gggga重复(seq id no:29),或这两个的混合物。在一些实施方式中,接头包括1、2、3、4、5、6、7、8、9或10个ggggs(seq id no:23)和/或gggga重复(seq id no:29)重复。在一些实施方式中,接头的长度为10个氨基酸。在一些实施方式中,接头的长度为5个氨基酸。在一些实施方式中,接头的长度为15个氨基酸。在一些实施方式中,接头的长度为20个氨基酸。在一些实施方式中,接头的长度为25个氨基酸。在一些实施方式中,接头的长度为30个氨基酸。在一些实施方式中,接头的长度为35个氨基酸。在一些实施方式中,接头的长度为5-50个氨基酸。
[0692]
在一些实施方式中,il-2突变蛋白包括seq id no:31的序列。在一些实施方式中,il-2突变蛋白包括seq id no:32的序列。在一些实施方式中,il-2突变蛋白包括seq id no:33的序列。在一些实施方式中,il-2突变蛋白包括seq id no:34的序列。在一些实施方式中,il-2突变蛋白包括seq id no:35的序列。在一些实施方式中,il-2突变蛋白包括seq id no:36的序列。在一些实施方式中,il-2突变蛋白包括seq id no:37的序列。在一些实施方式中,il-2突变蛋白包括seq id no:38的序列。在一些实施方式中,il-2突变蛋白包括seq id no:39的序列。在一些实施方式中,il-2突变蛋白包括seq id no:40的序列。在一些实施方式中,il-2突变蛋白包括seq id no:41的序列。在一些实施方式中,il-2突变蛋白进一步包括t3a置换(突变)。在一些实施方式中,fc区包括具有seq id no:21的序列的肽。在一些实施方式中,fc区包括具有seq id no:28的序列的肽。在一些实施方式中,fc区的c末端与可变重链的n末端连接。在一些实施方式中,将fc区与可变重链连接的接头是甘氨酸/丝氨酸或甘氨酸/丙氨酸接头。在一些实施方式中,将fc区与可变重链的n末端连接的接头是甘氨酸/丝氨酸接头,其可以是ggggsggggsggggsggggs(seq id no:22)或ggggsggggsggggs(seq id no:30)的序列。这只是非限制性实例,并且接头可以具有不同数目的ggggs(seq id no:23)或gggga重复(seq id no:29),或这两个的混合物。在一些实施方式中,接头包括1、2、3、4、5、6、7、8、9或10个ggggs(seq id no:23)和/或gggga重复(seq id no:29)重复。在一些实施方式中,接头的长度为10个氨基酸。在一些实施方式中,接头的长度为5个氨基酸。在一些实施方式中,接头的长度为15个氨基酸。在一些实施方式中,接头的长度为20个氨基酸。在一些实施方式中,接头的长度为25个氨基酸。在一些实施方式中,接头的长度为30个氨基酸。在一些实施方式中,接头的长度为35个氨基酸。在一些实施方式
中,接头的长度为5-50个氨基酸。
[0693]
在一些实施方式中,可变重链包括表6或表7中所示的cdr。在一些实施方式中,可变重链包括hcdr1、hcdr2和hcdr3,其中hcdr1、hcdr2和hcdr3如在表6或表7中所示。在一些实施方式中,可变重链具有表6中针对克隆1所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆2所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆3所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆4所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆5所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆6所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆7所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆8所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆9所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆10所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆11所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆12所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆13所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆14所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆15所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆16所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆17所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆1所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆18所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆19所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆20所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆21所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆22所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆23所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆24所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有如表6中针对克隆25所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有如表6中针对克隆26所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆27所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆28所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆29所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆30所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆31所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆32所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆33所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆34所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆35所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆36所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆37所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆38所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆39所示的hcdr1、hcdr2和hcdr3。在
一些实施方式中,可变重链具有表6中针对克隆40所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆41所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆42所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆43所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆44所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆45所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆46所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆47所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆48所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆49所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆50所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆51所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆52所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆53所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆54所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆55所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆56所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆57所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆58所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆59所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆60所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆61所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆62所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆63所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆64所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆65所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表6中针对克隆66所示的hcdr1、hcdr2和hcdr3。
[0694]
在一些实施方式中,可变重链具有表7中针对克隆1所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆2所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆3所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆4所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆5所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆6所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆7所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆8所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆9所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆10所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆11所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆12所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆13所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆14所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆15所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7
中针对克隆16所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆17所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆1所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆18所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆19所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆20所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆21所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆22所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆23所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆24所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有如表7中针对克隆25所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有如表7中针对克隆26所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆27所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆28所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆29所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆30所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆31所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆32所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆33所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆34所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆35所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆36所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆37所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆38所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆39所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆40所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆41所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆42所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆43所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆44所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆45所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆46所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆47所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆48所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆49所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆50所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆51所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆52所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆53所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆54所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆55所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆56所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆57所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆58所示
的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆59所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆60所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆61所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆62所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆63所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆64所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆65所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆66所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆67所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆68所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆69所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆70所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆71所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆72所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆73所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆74所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆75所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆76所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆77所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆78所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆79所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆80所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆81所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆82所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆83所示的hcdr1、hcdr2和hcdr3。在一些实施方式中,可变重链具有表7中针对克隆84所示的hcdr1、hcdr2和hcdr3。
[0695]
在一些实施方式中,可变重链具有表6中针对克隆1所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆2所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆3所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆4所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆5所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆6所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆7所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆8所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆9所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆10所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆11所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆12所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆13所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆14所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆15所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆16所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克
隆17所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆1所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆18所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆19所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆20所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆21所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆22所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆23所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆24所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有如表6中针对克隆25所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有如表6中针对克隆26所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆27所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆28所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆29所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆30所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆31所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆32所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆33所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆34所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆35所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆36所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆37所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆38所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆39所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆40所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆41所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆42所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆43所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆44所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆45所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆46所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆47所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆48所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆49所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆50所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆51所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆52所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆53所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆54所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆55所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆56所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆57所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆58所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆59所示的lcdr1、
lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆60所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆61所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆62所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆63所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆64所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆65所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表6中针对克隆66所示的lcdr1、lcdr2和lcdr3。
[0696]
在一些实施方式中,可变重链具有表7中针对克隆1所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆2所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆3所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆4所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆5所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆6所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆7所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆8所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆9所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆10所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆11所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆12所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆13所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆14所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆15所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆16所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆17所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆1所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆18所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆19所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆20所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆21所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆22所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆23所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆24所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有如表7中针对克隆25所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有如表7中针对克隆26所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆27所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆28所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆29所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆30所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆31所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆32所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆33所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆34所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链
具有表7中针对克隆35所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆36所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆37所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆38所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆39所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆40所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆41所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆42所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆43所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆44所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆45所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆46所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆47所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆48所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆49所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆50所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆51所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆52所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆53所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆54所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆55所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆56所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆57所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆58所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆59所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆60所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆61所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆62所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆63所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆64所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆65所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆66所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆67所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆68所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆69所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆70所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆71所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆72所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆73所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆74所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆75所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆76所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆77所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆78所示
的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆79所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆80所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆81所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆82所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆83所示的lcdr1、lcdr2和lcdr3。在一些实施方式中,可变重链具有表7中针对克隆84所示的lcdr1、lcdr2和lcdr3。
[0697]
在一些实施方式中,cdrs彼此交换。克隆1的hcdr1可以替代克隆10的hcdr1,或反之亦然。可以对本文提供的克隆的任何hcdr(例如,hcdr1替代hcdr1;hcdr2替代hcdr2;或hcdr3替代hcdr3)或lcdr(例如,lcdr1替代lcdr1;lcdr2替代lcdr2;或lcdr3替代lcdr3)进行这种cdr交换。因此,在一些实施方式中,抗体包括如表6的克隆1-66或表7的克隆1-84中的任一个所示的hcdr1,如表6的克隆1-66或表7的克隆1-84中的任一个所示的hcdr2,如表6的克隆1-66或表7的克隆1-84中的任一个所示的hcdr3,如表6的克隆1-66或表7的克隆1-84中的任一个所示的lcdr1,如表6的克隆1-66或表7的克隆1-84中的任一个所示的lcdr2,如表6的克隆1-66或表7的克隆1-84中的任一个所示的lcdr3,或任何前述的变体。
[0698]
在一些实施方式中,madcam抗体是如克隆6、59或63中所示的scfv形式。如那些序列中所示的接头的长度是20个氨基酸残基,但长度也可以是5、10或15个氨基酸残基。在一些实施方式中,连接抗体的vh和vl(或vk)序列的接头是甘氨酸/丝氨酸接头,其可以是以下序列:ggggsggggsggggsggggs(seq id no:22)或ggggsggggsggggs(seq id no:30)。这只是非限制性实例,并且接头可以具有不同数目的ggggs(seq id no:23)或gggga重复(seq id no:29)。在一些实施方式中,接头包括1、2、3、4、5、6、7、8、9或10个ggggs(seq id no:23)或gggga重复(seq id no:29)重复。因此,表6中所示的接头是非限制性实例并且可以用任何其他接头(诸如本文提供的那些)代替。
[0699]
在一些实施方式中,多肽包括下式:
[0700]
aptssstkktqlqlehllldlqmilnginnyknpkltrmltfkfympkkatelkhlqcleeelkpleealnlapsknfhlrprdlisdinvivlelkgsettfmceyadetativefinrwitfsqsiistlt-接头1-dkthtcppcpapeaagapsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg-接头2-ab,
[0701]
其中接头1、接头2和ab如本文所提供。在一些实施方式中,接头1是ggggsggggsggggs(seq id no:30)或ggggsggggsggggsggggs(seq id no:22)。在一些实施方式中,接头2是ggggs(seq id no:23)。在一些实施方式中,接头2是ggggsggggs(seq id no:619)。在一些实施方式中,接头2是ggggsggggsggggs(seq id no:30)。在一些实施方式中,ab是如madcamab表6中所示的scfv。在一些实施方式中,ab包括seq id no:95的序列。在一些实施方式中,ab包括seq id no:364的序列。在一些实施方式中,ab包括seq id no:386的序列。在一些实施方式中,ab包括vh和vk或vl片段。在一些实施方式中,vh包括如表7中所示的序列。在一些实施方式中,vk包括如表7中所示的序列。在一些实施方式中,ab包括如表7中针对克隆所示的vh和vk。在一些实施方式中,vh和vk通过接头连接。在一些实施方式中,vh和vk通过包括ggggsggggsggggsggggs(seq id no:22)的肽的肽接头连接。在一些实施方
式中,vh和vk通过包括ggggs的肽的肽接头连接。在一些实施方式中,vh和vk通过包括ggggsgggg(seq id no:619)的肽的肽接头连接。在一些实施方式中,vh和vk通过包括ggggsggggsggggs(seq id no:30)的肽的肽接头连接。
[0702]
在一些实施方式中,ab包括seq id no:414的vh和seq id no:415的vk。在一些实施方式中,ab包括seq id no:591的vh和seq id no:592的vk。在一些实施方式中,ab包括seq id no:599的vh和seq id no:600的vk。
[0703]
在一些实施方式中,肽包括:
[0704]
aptssstkktqlqlehllldlqmilnginnyknpkltrmltfkfympkkatelkhlqcleeelkpleealnlapsknfhlrprdlisdinvivlelkgsettfmceyadetativefinrwitfsqsiistlt-(ggggsggggsggggs或ggggsggggsggggsggggs)-dkthtcppcpapeaagapsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg-(ggggs或ggggsggggs或ggggsggggsggggs)-ab,
[0705]
其中ab如本文所示。在一些实施方式中,ab包括seq id no:95的序列。在一些实施方式中,ab包括seq id no:364的序列。在一些实施方式中,ab包括seq id no:386的序列。在一些实施方式中,ab包括vh和vk或vl片段。在一些实施方式中,vh包括如表7中所示的序列。在一些实施方式中,vk包括如表7中所示的序列。在一些实施方式中,ab包括如表7中针对克隆所示的vh和vk。在一些实施方式中,vh和vk通过接头连接。在一些实施方式中,vh和vk通过包括ggggsggggsggggsggggs(seq id no:22)的肽的肽接头连接。在一些实施方式中,vh和vk通过包括ggggs(seq id no:23)的肽的肽接头连接。在一些实施方式中,vh和vk通过包括ggggsggggs(seq id no:619)的肽的肽接头连接。
[0706]
在一些实施方式中,ab包括seq id no:414的vh和seq id no:415的vk。在一些实施方式中,ab包括seq id no:591的vh和seq id no:592的vk。在一些实施方式中,ab包括seq id no:599的vh和seq id no:600的vk。这些实例是非限制性的,还提供了表7中所示的vh和vk的组合。
[0707]
在一些实施方式中,治疗化合物或多肽包括抗pd-1重链和轻链的式,其中pd-1重链与madcam抗体(scfv)(诸如本文提供的那些)在pd-1 igg重链的c末端连接。肽可以具有式a1-a2-接头1-a4-接头2-a5和a6,其中a1是pd-1重链,a6是pd-1轻链;a2是igg恒定结构域(例如igg1恒定结构域),接头1如本文提供,诸如但不限于甘氨酸/丝氨酸接头,其可以是ggggsggggsggggsggggs(seq id no:22)或ggggsggggsggggs(seq id no:30)的序列,这只是非限制性实例,并且接头可以具有不同数目的ggggs(seq id no:23)或gggga重复(seq id no:29)以及在一些实施方式中,接头包括1、2、3、4、5、6、7、8、9或10个ggggs(seq id no:23)或gggga重复(seq id no:29)重复;a4是vh结构域,诸如表7中所示的那些;接头2如本文提供,诸如但不限于甘氨酸/丝氨酸接头,其可以是ggggsggggsggggsggggs(seq id no:22)或ggggsggggsggggs(seq id no:30)的序列,这只是非限制性实例,并且接头可以具有不同数目的ggggs(seq id no:23)或gggga重复(seq id no:29)以及在一些实施方式中,接头包括1、2、3、4、5、6、7、8、9或10个ggggs(seq id no:23)或gggga重复(seq id no:29)重复;并且a5是vk/vl结构域,诸如表7中所示的那些;在一些实施方式中,接头2是ggggsggggsggggs
(seq id no:30)。在一些实施方式中,a4-接头2-a5是scfv抗体,诸如表6中所示的那些。表6中所示的接头可以被ggggsggggsggggs(seq id no:30)的接头替换。在一些实施方式中,a4-接头2-a5包括表6或表7中所示的hcdr组(例如,hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3)。为避免疑问,cdr组是指为表中提供的每个不同抗体克隆所示的cdr。在一些实施方式中,a4包括seq id no:414的肽并且a5包括seq id no:415的肽。在一些实施方式中,a4包括seq id no:591的肽并且a5包括seq id no:592的肽。在一些实施方式中,a4包括seq id no:599的肽并且a5包括seq id no:600的肽。这些实例是非限制性的,还提供了表7中所示的vh和vk的组合。
[0708]
在一些实施方式中,a2包括以下序列:
[0709]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaagapsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:44)
[0710]
一旦表达,pd-1抗体的重链和轻链彼此结合以形成包括与抗madcam抗体连接的抗pd-1抗体的化合物。抗madcam抗体可以是与madcam结合的任何抗体,诸如本文提供的那些。
[0711]
源自参考,例如人多肽的多肽
[0712]
在一些实施方式中,治疗分子的组分源自或基于参考分子,例如,在用于人的治疗分子的情况下,源自天然存在的人多肽。例如,在一些实施方式中,cd39分子、cd73分子、细胞表面分子结合剂、供体特异性靶向部分、效应物配体结合分子、icim结合/调节部分、iic结合/调节部分、抑制性免疫检查点分子配体分子、抑制性分子反配体分子、sm结合/调节部分、特异性靶向部分、靶配体结合分子或组织特异性靶向部分的全部或部分可以基于或源自天然存在的人多肽。例如,pd-l1分子可以基于或源自人pd-l1序列。
[0713]
在一些实施方式中,治疗化合物组分,例如pd-l1分子:
[0714]
a)包括天然存在形式的人多肽的全部或一部分,例如活性部分;
[0715]
b)包括具有出现在2017年1月11日的数据库(例如genbank数据库)中的序列的人多肽的全部或一部分(例如活性部分),其为与疾病状态无关的人多肽的天然存在形式;
[0716]
c)包括具有与a)或b)的序列相差不超过1、2、3、4、5、10、20或30个氨基酸残基的序列的人多肽;
[0717]
d)包括具有与a)或b)的序列的氨基酸残基相差不超过1%、2%、3%、4%、5%、10%、20%或30%的序列的人多肽;
[0718]
e)包括具有与a)或b)的序列没有实质性差异的序列的人多肽;或
[0719]
f)包括具有c)、d)或e)的序列的人多肽,其生物活性(例如增强或抑制免疫应答的能力)与具有a)或b)的序列的人多肽没有实质性差异。
[0720]
在一些实施方式中,治疗化合物可以包括多个效应物结合/调节部分。例如,治疗化合物可以包括选自以下的两种或更多种:
[0721]
(a)icim结合/调节部分;(b)iic结合/调节部分;(c)sm结合/调节部分,或(d)icsm结合/调节部分。在一些实施方式,例如,治疗化合物可以包括多个(例如两个)icim结合/调节部分(其中它们相同或不同);举例来说,两个激活或激动pd-1的icim结合/调节部分;多
个(例如两个)iic结合/调节部分(其中它们相同或不同);多个(例如两个)sm结合/调节部分(其中它们相同或不同),或多个(例如两个)icsm结合/调节部分(其中它们相同或不同)。在一些实施方式中,治疗化合物可以包括icim结合/调节部分和iic结合/调节部分;icim结合/调节部分和sm结合/调节部分;iic结合/调节部分和sm结合/调节部分;icim结合/调节部分和icsm结合/调节部分;iic结合/调节部分和icsm结合/调节部分;或icsm结合/调节部分和sm结合/调节部分。在一些实施方式中,治疗化合物包括多个靶向部分。在一些实施方式中,靶向部分可以相同或不同。
[0722]
药物组合物和试剂盒
[0723]
在另一方面,本实施方式提供了组合物,例如药学上可接受的组合物,其包括与药学上可接受的载体一起配制的本文所述的治疗化合物。如本文所用,“药学上可接受的载体”包括生理学相容的任何和所有溶剂、分散介质、等渗剂和吸收延迟剂等。
[0724]
载体可以适用于静脉内、肌内、皮下、肠胃外、直肠、局部、眼科、区域性、脊椎或表皮给药(例如通过注射或输注)。如本文所用,术语“载体”意指与化合物一起给药的稀释剂、佐剂或赋形剂。在一些实施方式中,药物载体也可以是液体,诸如水和油,包括石油、动物、植物或合成来源的油,诸如花生油、大豆油、矿物油、芝麻油等。药物载体还可以是盐水、阿拉伯胶、明胶、淀粉糊、滑石、角蛋白、胶体二氧化硅、脲等。此外,还可使用助剂、稳定剂、增稠剂、润滑剂和着色剂。载体可以用于包括本文提供的治疗化合物的药物组合物。
[0725]
本文提供的实施方式的组合物和化合物可以是多种形式。这些包括,例如,液体、半固体和固体剂型,诸如液体溶液(例如,可注射和可输注溶液)、分散体或混悬剂、脂质体和栓剂。优选的形式取决于预期的给药方式和治疗应用。典型的组合物是可注射或可输注溶液的形式。在一些实施方式中,给药方式是肠胃外(例如,静脉内、皮下、腹腔内、肌内)。在一些实施方式中,治疗分子通过静脉内输注或注射给药。在另一种实施方式中,治疗分子通过肌内或皮下注射给药。在另一种实施方式中,将治疗分子局部给药至靶位点,例如通过注射或区域性给药。
[0726]
如本文所用,短语“肠胃外给药(parenteral administration)”和“胃肠外给药(administered parenterally)”意指肠内和区域性给药以外的给药方式,通常通过注射,并且包括但不限于静脉内、肌内、动脉内、鞘内、囊内、眶内、心内、真皮内、腹腔内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊椎内、硬膜外和胸骨内注射和输注。
[0727]
治疗组合物在制造和储存条件下通常应该是无菌和稳定的。该组合物可以被配制成溶液、微乳液、分散体、脂质体或其他适合高治疗分子浓度的有序结构。无菌可注射溶液可以通过将所需量的活性化合物(即,治疗分子)掺入适当溶剂中,根据需要与上文列举的一种或多种成分组合,然后通过过滤灭菌来制备。通常,分散体是通过将活性化合物掺入包含基础分散介质和来自上面列举的那些所需的其他成分的无菌载剂中来制备的。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,其从其先前无菌过滤的溶液产生活性成分加上任何额外的所需成分的粉末。可以例如,通过使用诸如卵磷脂的包衣,通过在分散情况下维持所需的粒度,以及通过使用表面活性剂来维持溶液的适当的流动性。可注射组合物的延长吸收可以通过在组合物中包括延迟吸收的剂(例如单硬脂酸盐和明胶)来实现。
[0728]
本领域技术人员将理解,给药途径和/或方式将根据所需结果而变化。在某些实施
方式中,活性化合物可以与将保护化合物免于快速释放的载体,诸如控释制剂,包括植入物、透皮贴剂和微囊化递送系统一起制备。可以使用可生物降解的可生物相容性聚合物,例如乙烯-乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。用于制备这样的制剂的许多方法已获得专利或为本领域技术人员公知。参见例如sustained and controlled release drug delivery systems,j.r.robinson,ed.,marcel dekker,inc.,new york,1978。
[0729]
在某些实施方式中,治疗化合物可以例如与惰性稀释剂或可同化的食用载体一起口服给药。化合物(和其他成分,如果需要的话)也可以封装在硬或软明胶胶囊中,压制成片剂,或直接掺入受试者的饮食中。对于口服治疗给药,化合物可以与赋形剂混合并以可摄取片剂、颊含片、锭剂、胶囊剂、酏剂、混悬剂、糖浆剂、威化饼(wafer)等形式使用。为了通过肠胃外给药以外的方式给药化合物,可能需要用防止其失活的材料包被化合物,或将化合物与防止其失活的材料共给药。治疗组合物也可以与本领域已知的医疗装置一起给药。
[0730]
调整剂量方案以提供最佳的所需反应(例如,治疗反应)。例如,可以给药单次推注,可以随着时间给药多个分开的剂量,或者可以根据治疗情况的紧急情况按比例减少或增加剂量。以剂量单位形式配制肠胃外组合物以易于给药和剂量均匀是特别有利的。如本文所用的剂量单位形式是指适合作为待治疗受试者的单位剂量的物理离散单位;每个单位包含经计算产生期望治疗效果的预定量的活性化合物,以及所需的药物载体。剂量单位形式的规格决定于并直接依赖于(a)活性化合物的独特特性和要达到的特定治疗效果,以及(b)混合这样的活性化合物用于治疗个体敏感性的技术中固有的局限性。
[0731]
治疗化合物的治疗或预防有效量的示例性、非限制性范围是0.1-30mg/kg,更优选1-25mg/kg。治疗化合物的剂量和治疗方案可由技术人员确定。在某些实施方式中,治疗化合物通过注射(例如皮下或静脉内)以以下剂量给药:约1至40mg/kg,例如1至30mg/kg,例如约5至25mg/kg、约10至20mg/kg、约1至5mg/kg、1至10mg/kg、5至15mg/kg、10至20mg/kg、15至25mg/kg或约3mg/kg。给药时间表可以从例如每周一次到每2、3或4周一次变化。在一种实施方式中,治疗化合物每隔一周以约10至20mg/kg的剂量给药。治疗化合物可以以大于20mg/min,例如20-40mg/min,并且通常大于或等于40mg/min的速率通过静脉输注给药,以达到约35至440mg/m2,通常约70至310mg/m2,以及更通常约110至130mg/m2的剂量。在实施方式中,约110至130mg/m2的输注速率达到约3mg/kg的水平。在其他实施方式中,治疗化合物可以以小于10mg/min,例如小于或等于5mg/min的速率通过静脉输注给药,以达到约1至100mg/m2,例如约5至50mg/m2、约7至25mg/m2或约10mg/m2的剂量。在一些实施方式中,治疗化合物在约30分钟的时间段内输注。需要注意的是,剂量值可能会随着待缓解的病症的类型和严重程度而变化。应进一步理解,对于任何特定受试者,应根据个体需要以及给药或监督组合物给药的人的专业判断随时间调整特定的剂量方案,并且本文所述的剂量范围仅仅是示例性的,且无意限制要求保护的组合物的范围或实践。
[0732]
药物组合物可以包括“治疗有效量”或“预防有效量”的治疗分子。“治疗有效量”是指在必要的剂量和时间段内实现期望治疗结果的有效量。治疗分子的治疗有效量可以根据诸如个体的疾病状态、年龄、性别和体重,以及治疗化合物在个体中引起期望应答的能力等因素而变化。治疗有效量也是治疗分子t的任何毒性或有害作用被治疗有益作用超过的量。相对于未治疗受试者,“治疗有效剂量”优选抑制可测量的参数(例如免疫攻击)至少约
20%,更优选至少约40%,甚至更优选至少约60%,以及更优选至少约80%。可以在预测移植排斥或自身免疫性疾患中的功效的动物模型系统中评价化合物抑制可测量参数(例如免疫攻击)的能力。替代地,组合物的这种性质可以通过经由熟练从业者已知的测定检测化合物的抑制,这样的体外抑制的能力来估计。
[0733]“预防有效量”是指在必要的剂量和时间段内达到期望预防结果的有效量。一般地,由于在疾病发生之前或早期阶段对受试者使用预防剂量,因此预防有效量将小于治疗有效量。
[0734]
包括本文所述的治疗化合物的试剂盒也在实施方式的范围内。该试剂盒可以包括一种或多种其他元件,包括:使用说明;其他试剂,例如标记、治疗剂或用于将治疗分子螯合或以其他方式偶联至标记或其他治疗剂的试剂,或辐射防护组合物;用于制备用于给药的治疗分子的装置或其他材料;药学上可接受的载体;以及用于向受试者给药的装置或其他材料。
[0735]
在一些实施方式中,本文提供的实施方式还包括但不限于:
[0736]
1.一种治疗化合物,包括:
[0737]
i)选自以下的特异性靶向部分:
[0738]
a)供体特异性靶向部分,其例如优先结合供体靶标;或
[0739]
b)组织特异性靶向部分,其例如优先结合受试者的靶组织;以及
[0740]
ii)选自以下的效应物结合/调节部分:
[0741]
(a)免疫细胞抑制性分子结合/调节部分(icim结合/调节部分);
[0742]
(b)免疫抑制性免疫细胞结合/调节部分(iic结合/调节部分);或
[0743]
(c)作为治疗化合物的一部分促进免疫抑制性局部微环境的效应物结合/调节部分,例如通过在靶标附近提供抑制或最小化免疫系统对靶标的攻击的物质(sm结合/调节部分)。
[0744]
2.根据实施方式1所述的治疗化合物,其中所述效应物结合/调节部分直接结合并激活抑制性受体。
[0745]
3.根据实施方式2所述的治疗化合物,其中所述效应物结合/调节部分是抑制性免疫检查点分子。
[0746]
4.根据实施方式1-3中任一项所述的治疗化合物,其中所述效应物结合/调节部分由免疫细胞表达。
[0747]
5.根据实施方式4所述的治疗化合物,其中所述免疫细胞导致有害的免疫应答。
[0748]
6.根据实施方式4或5所述的治疗化合物,其中所述免疫细胞引起疾病病理学。
[0749]
7.根据实施方式1所述的治疗化合物,其中,当治疗化合物通过靶向部分与靶标结合时,治疗分子激动效应物结合/调节所结合的分子的能力与当治疗化合物未通过靶向部分与靶标结合时相比更大,例如是其2、5、10、100、500或1,000倍。
[0750]
8.根据实施方式1-7所述的治疗化合物,其中,当作为单体结合(或当治疗化合物未多聚化时结合)其同源配体,例如抑制性免疫检查点分子时,不激动或基本上不激动同源配体。
[0751]
9.根据实施方式1-8所述的治疗化合物,其中,在治疗化合物的治疗有效剂量下,存在效应物结合/调节部分所结合的分子的显著的全身激动。
[0752]
10.根据实施方式1-9所述的治疗化合物,其中,在治疗化合物的治疗有效剂量下,效应物结合/调节部分所结合的分子的激动基本上仅在靶向部分结合的靶位点处发生。
[0753]
11.根据实施方式1-9所述的治疗化合物,其中,治疗化合物与其同源配体例如抑制性免疫检查点分子的结合不抑制或基本上不抑制内源反配体与同源配体例如抑制性免疫检查点分子的结合。
[0754]
12.根据实施方式1-11所述的治疗化合物,其中,效应物结合/调节部分与其同源配体的结合抑制内源反配体与效应物结合/调节部分的同源配体的结合小于60%、50%、40%、30%、20%、10或5%。
[0755]
13.根据实施方式1-12所述的治疗化合物,其中,效应物结合/调节部分与其同源配体的结合抑制内源反配体与效应物结合/调节部分的同源配体的结合小于5%。
[0756]
14.根据实施方式1-11所述的治疗化合物,其中,效应物结合/调节部分与同源配体的结合基本上没有导致效应物结合/调节分子的同源配体的拮抗。
[0757]
15.根据实施方式1所述的治疗化合物,其中,效应物结合/调节部分包括icim结合/调节部分。
[0758]
16.根据实施方式15所述的治疗化合物,其中,效应物结合/调节部分包括icim结合/调节部分,所述icim结合/调节部分包括抑制性免疫检查点分子配体分子。
[0759]
17.根据实施方式16所述的治疗化合物,其中,所述抑制性免疫分子反配体分子包括pd-l1分子。
[0760]
18.根据实施方式15所述的治疗化合物,其中,icim是其中抑制性免疫分子反配体分子与选自pd-1、kir2dl4、lilrb1、lilrb或ctla-4的同源抑制性免疫检查点分子接合。
[0761]
19.根据实施方式18所述的治疗化合物,其中,所述icim是抗体。
[0762]
20.根据实施方式18所述的治疗化合物,其中,icim包括与pd-1、kir2dl4、lilrb1、lilrb或ctla-4结合的抗体。
[0763]
21.根据实施方式20所述的治疗化合物,其中,所述抗体是与pd-1结合的抗体。
[0764]
22.根据实施方式20所述的治疗化合物,其中,所述抗体是与pd-1结合的抗体并且是pd-1激动剂。
[0765]
23.根据实施方式20所述的治疗化合物,其中,所述抗体是与pd-1结合的抗体并且当被栓系在靶位点时是pd-1激动剂。
[0766]
24.根据实施方式16所述的治疗化合物,其中,所述抑制性免疫分子反配体分子包括hla-g分子。
[0767]
25.根据实施方式15所述的治疗化合物,其中,icim是其中抑制性免疫分子反配体分子与选自pd-1、kir2dl4、lilrb1、lilrb或ctla-4的同源抑制性免疫检查点分子接合。
[0768]
26.根据实施方式15所述的治疗化合物,其中,所述抑制性免疫分子反配体分子与选自表1的同源抑制性免疫检查点分子接合。
[0769]
27.根据实施方式15所述的治疗化合物,其中,当作为单体结合其同源抑制性免疫检查点分子时,不激动或基本上不激动抑制性免疫检查点分子。
[0770]
28.根据实施方式15所述的治疗化合物,其中,所述抑制性免疫分子反配体与天然存在的抑制性免疫检查点分子配体具有至少60%、70%、80%、90%、95%、99%或100%的同源性。
[0771]
29根据实施方式1所述的治疗化合物,其中,所述效应物结合/调节部分包括icim结合/调节部分,其包括针对细胞表面抑制性分子的功能性抗体分子。
[0772]
30.根据实施方式1所述的治疗化合物,其中,所述细胞表面抑制性分子是抑制性免疫检查点分子。
[0773]
31.根据实施方式30所述的化合物,其中,抑制性免疫检查点分子选自pd-1、kir2dl4、lilrb1、lilrb2、ctla-4,或选自表1。
[0774]
32.根据实施方式1-31中任一项所述的治疗化合物,其中,在治疗化合物的治疗有效剂量下全身性免疫抑制水平小于使用全身性免疫抑制剂(如果相关的话)的护理标准给出的水平,或小于由等摩尔量的游离(不作为治疗化合物的组分)效应物结合/调节分子给出的水平。
[0775]
33.根据实施方式1-32所述的治疗化合物,其中全身免疫激活水平(例如在治疗化合物的治疗有效剂量下)低于由等摩尔量的游离(不作为治疗化合物的组分)效应物结合/调节分子给出的水平。
[0776]
34.根据实施方式1-33中任一项所述的治疗化合物,进一步包括第二效应物结合/调节部分。
[0777]
35.根据实施方式34所述的治疗化合物,其中,第二效应物结合/调节部分与所述效应物结合/调节部分结合不同的靶标。
[0778]
36.根据实施方式34或35所述的治疗化合物,其中,第二效应物结合/调节部分包括iic结合/调节部分。
[0779]
.根据实施方式34或35所述的治疗化合物,其中,第二效应物结合/调节部分包括sm结合/调节部分。
[0780]
37.根据实施方式1所述的治疗化合物,其中,效应物结合/调节部分包括iic结合/调节部分。
[0781]
38.根据实施方式1所述的治疗化合物,其中,效应物结合/调节部分包括iic结合/调节部分,其在靶位点增加、募集或积累免疫抑制性免疫细胞。
[0782]
39.根据实施方式1所述的治疗化合物,其中,效应物结合/调节部分包括结合或特异性结合免疫抑制性免疫细胞上的细胞表面分子的细胞表面分子结合剂。
[0783]
40.根据实施方式1所述的治疗化合物,其中,效应物结合/调节部分包括结合或特异性结合免疫抑制性免疫细胞上的细胞表面分子的细胞表面分子配体分子。
[0784]
41.根据实施方式1所述的治疗化合物,其中,效应物结合/调节部分包括结合免疫抑制性免疫细胞上的细胞表面分子的抗体分子。
[0785]
42.根据实施方式38-41中任一项所述的治疗化合物,其中,免疫抑制性免疫细胞包括t调节细胞,诸如foxp3+cd25+t调节细胞。
[0786]
43.根据实施方式1-42中任一项所述的治疗化合物,其中,效应物结合/调节部分结合garp,并且例如包括结合表达garp的免疫抑制细胞例如treg上的garp的抗体分子。
[0787]
44.根据实施方式1所述的治疗化合物,其中,效应物结合/调节部分包括sm结合/调节部分。
[0788]
45.根据实施方式44所述的治疗化合物,其中,sm结合/调节部分促进免疫抑制性局部微环境。
[0789]
46.根据实施方式44和45中任一项所述的治疗化合物,其中,效应物分子结合部分例如通过以下提高可用性:增加抑制免疫细胞功能的物质例如抑制免疫细胞的激活或激活的免疫细胞的功能的物质的局部浓度或量。
[0790]
47.根据实施方式44-46中任一项所述的治疗化合物,其中,效应物分子结合部分结合并积累具有免疫抑制功能的可溶性物质,例如内源或外源物质。
[0791]
48.根据实施方式44-47中任一项所述的治疗化合物,其中,效应物分子结合部分例如通过以下降低可用性:降低促进免疫细胞功能的物质例如促进免疫细胞的激活或激活的免疫细胞的功能的物质的局部浓度或量,或隔离该物质。
[0792]
49.根据实施方式44-48中任一项所述的治疗化合物,其中,sm结合/调节部分促进免疫抑制性局部微环境,例如通过在靶标附近提供抑制或最小化免疫系统对靶标的攻击的物质。
[0793]
50.根据实施方式44-49中任一项所述的治疗化合物,其中,sm结合/调节部分包括抑制或最小化免疫系统对靶标的攻击的分子。
[0794]
51.根据实施方式44-50中任一项所述的治疗化合物,其中,sm结合/调节部分结合和/或积累具有免疫抑制功能的可溶性物质,例如内源或外源物质。
[0795]
52.根据实施方式44-51中任一项所述的治疗化合物,其中,sm结合/调节部分结合和/或抑制、隔离、降解或以其他方式中和促进免疫攻击的物质,例如可溶性物质,通常并且内源性可溶性物质。
[0796]
53.根据实施方式44-52中任一项所述的治疗化合物,其中,效应物分子结合部分降低atp或amp的可用性。
[0797]
54.根据实施方式44-53中任一项所述的治疗化合物,其中,sm结合/调节部分结合或包括消耗促进免疫效应细胞功能的组分例如atp或amp的物质,例如cd39或cd73。
[0798]
55.根据实施方式44-54中任一项所述的治疗化合物,其中,sm结合/调节部分包括cd39分子。
[0799]
56.根据实施方式44-54中任一项所述的治疗化合物,其中,sm结合/调节部分包括cd73分子。
[0800]
57.根据实施方式44-54中任一项所述的治疗化合物,其中,sm结合/调节部分包括抗cd39分子。
[0801]
58.根据实施方式44-54中任一项所述的治疗化合物,其中,sm结合/调节部分包括抗cd73抗体分子。
[0802]
59.根据实施方式44-54中任一项所述的治疗化合物,其中,效应物分子结合部分包括免疫抑制物质,例如免疫抑制蛋白的片段。
[0803]
60.根据实施方式44-54中任一项所述的治疗化合物,其中,sm结合/调节部分包括碱性磷酸酶分子。
[0804]
61.根据实施方式1所述的治疗化合物,其中,所述化合物从n末端到c末端具有下式:
[0805]
r1
‑‑‑
接头区a—r2或r3—接头区b—r4
[0806]
其中,
[0807]
r1、r2、r3和r4各自独立地包括效应物结合/调节部分,例如icim结合/调节部分、
iic结合/调节部分或sm结合/调节部分;特异性靶向部分;或不存在;前提是存在效应物结合/调节部分和特异性靶向部分。
[0808]
62.根据实施方式61所述的治疗化合物,其中,接头区a和接头区b中的每一个包括fc区。
[0809]
63.根据实施方式61所述的治疗化合物,其中,r1和r2中的一个是抗pd-1抗体并且r1和r2中的一个是抗madcam抗体。
[0810]
64.根据实施方式61所述的治疗化合物,其中,r1中的一个是抗pd-1抗体并且一个r2是抗madcam抗体。
[0811]
65.根据实施方式61所述的治疗化合物,其中,r1中的一个是抗madcam抗体并且一个r2是抗pd-1抗体。
[0812]
66.根据实施方式61所述的治疗化合物,其中,r3和r4中的一个是抗pd-1抗体并且r3和r4中的一个是抗madcam抗体。
[0813]
67.根据实施方式61所述的治疗化合物,其中,r3中的一个是抗pd-1抗体并且一个r4是抗madcam抗体。
[0814]
68.根据实施方式61所述的治疗化合物,其中,r3中的一个是抗madcam抗体并且一个r4是抗pd-1抗体。
[0815]
69.根据实施方式61-68中任一项所述的治疗化合物,其中不存在接头。
[0816]
70.根据实施方式61-68中任一项所述的治疗化合物,其中,接头是fc区。
[0817]
71.根据实施方式61-68中任一项所述的治疗化合物,其中,接头是甘氨酸/丝氨酸接头,诸如1、2、3、4或5个ggggs(seq id no:23)的重复。
[0818]
72.根据实施方式61-68中任一项所述的治疗化合物,其中,接头包括fc区和甘氨酸/丝氨酸接头,诸如1、2、3、4或5个ggggs(seq id no:23)的重复。
[0819]
73.根据实施方式61-72中任一项所述的治疗化合物,其中,所述pd-1抗体是pd-1激动剂。
[0820]
74.根据实施方式61所述的治疗化合物,其中:
[0821]
r1和r3独立地包括功能性抗pd-1抗体分子(pd-1的激动剂);并且r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0822]
75.根据实施方式73和74中任一项所述的治疗化合物,其中:
[0823]
r1和r3独立地包括特异性靶向部分,例如抗组织抗原抗体;并且r2和r4独立地包括功能性抗pd-1抗体分子(pd-1的激动剂)。
[0824]
76.根据实施方式73和74中任一项所述的治疗化合物,其中:
[0825]
r1、r2、r3和r4各自独立地包括:sm结合/调节部分,其调节例如结合和抑制、隔离、降解或以其他方式中和调节免疫应答的物质,例如可溶性分子,例如atp或amp,例如cd39分子或cd73分子;特异性靶向部分;或不存在;
[0826]
前提是存在sm结合/调节部分和特异性靶向部分。
[0827]
77.根据实施方式61所述的治疗化合物,其中:
[0828]
r1和r3独立地包括cd39分子或cd73分子;并且
[0829]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0830]
78.根据实施方式77所述的治疗化合物,其中:
[0831]
r1和r3各自包括cd39分子;并且
[0832]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0833]
79.根据实施方式61或77所述的治疗化合物,其中:
[0834]
r1和r3各自包括cd73分子;并且
[0835]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0836]
80.根据实施方式61所述的治疗化合物,其中:
[0837]
r1和r3中的一个包括cd39分子,并且另一个包括cd73分子;并且
[0838]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0839]
81.根据实施方式61所述的治疗化合物,其中:
[0840]
r1、r2、r3和r4各自独立地包括:hla-g分子;特异性靶向部分;或不存在;
[0841]
前提是存在hla-g分子和特异性靶向部分。
[0842]
82.根据实施方式61或81所述的治疗化合物,其中:
[0843]
r1和r3各自包括hlg-a分子;并且
[0844]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0845]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0846]
83.根据实施方式81和82中任一项所述的治疗化合物,其中:
[0847]
r1和r3各自包括激动性抗lilrb1抗体分子;并且
[0848]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0849]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0850]
84.根据实施方式81和82中任一项所述的治疗化合物,其中:
[0851]
r1和r3各自包括激动性抗kir2dl4抗体分子;并且
[0852]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0853]
在一些实施方式中,接头a和接头b包括fc部分(例如,自配对fc部分或不或基本上不自配对的fc部分)。
[0854]
85.根据实施方式81-84中任一项所述的治疗化合物,其中:
[0855]
r1和r3各自包括激动性抗lilrb2抗体分子;并且
[0856]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0857]
86.根据实施方式81-84中任一项所述的治疗化合物,其中:
[0858]
r1和r3各自包括激动性抗nkg2a抗体分子;并且
[0859]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0860]
87.根据实施方式81-84中任一项所述的治疗化合物,其中:
[0861]
r1和r3中的一个包括选自以下的第一部分,而另一个包括选自以下的不同部分:拮抗性抗lilrb1抗体分子、激动性抗kr2dl4抗体分子和激动性抗nkg2a抗体分子;并且
[0862]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0863]
88.根据实施方式81-84中任一项所述的治疗化合物,其中:
[0864]
r1和r3中的一个包括拮抗性抗lilrb1抗体分子,并且另一个包括激动性抗kr2dl4抗体分子;并且
[0865]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0866]
89.根据实施方式81-84中任一项所述的治疗化合物,其中:
[0867]
r1和r3中的一个包括拮抗性抗lilrb1抗体分子,并且另一个包括激动性抗nkg2a抗体分子;并且
[0868]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0869]
90.根据实施方式81-84中任一项所述的治疗化合物,其中:
[0870]
r1、r2、r3和r4各自独立地包括:il-2突变蛋白分子;特异性靶向部分;或不存在;并且
[0871]
前提是存il-2突变蛋白分子和特异性靶向部分。
[0872]
91.根据实施方式90所述的治疗化合物,其中:
[0873]
r1和r3各自包括il-2突变蛋白分子;并且
[0874]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0875]
92.根据实施方式90或91所述的治疗化合物,其中:
[0876]
r1和r3中的一个包括madcam结合分子,例如抗madcam抗体分子或gitr结合分子,例如抗gitr抗体分子,并且另一个包括il-2突变蛋白分子;并且
[0877]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0878]
93.根据实施方式90或91所述的治疗化合物,其中:
[0879]
r1和r3中的一个包括garp结合分子,例如抗garp抗体分子,并且另一个包括il-2突变蛋白分子;并且
[0880]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0881]
94.根据实施方式90或91所述的治疗化合物,其中:
[0882]
r1和r3中的一个包括garp结合分子,例如抗garp抗体分子或gitr结合分子,例如抗gitr抗体分子,并且另一个包括il-2突变蛋白分子;并且
[0883]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0884]
95.根据实施方式90或91所述的治疗化合物,其中:
[0885]
r1和r3中的一个包括garp结合分子,例如抗garp抗体分子,并且另一个包括il-2突变蛋白分子;并且
[0886]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0887]
96.根据实施方式90或91所述的治疗化合物,其中:
[0888]
r1和r3中的一个包括gitr结合分子,例如抗gitr抗体分子,以及另一个包括il-2突变蛋白分子;并且
[0889]
r2和r4独立地包括特异性靶向部分,例如针对组织抗原的scfv分子。
[0890]
97.根据实施方式1所述的治疗化合物,其中,所述化合物是多肽或蛋白质,其中所述多肽或蛋白质包括结合靶细胞的靶向部分以及效应物结合/调节部分,其中所述效应物结合/调节部分是il-2突变多肽(il-2突变蛋白)。
[0891]
98.根据实施方式97所述的治疗化合物,其中,所述靶向部分包括与靶细胞表面上的靶蛋白结合的抗体。
[0892]
99.根据实施方式98所述的治疗化合物,其中,所述抗体是与madcam、oat1(slc22a6)、oct2(slc22a2)、fxyd2、tspan7、dpp6、hepacam2、tmem27或gpr119结合的抗体。
[0893]
100.根据实施方式98所述的治疗化合物,其中,所述il-2突变蛋白与免疫细胞表达的受体结合。
[0894]
101.根据实施方式98所述的治疗化合物,其中,所述免疫细胞导致有害的免疫应答。
[0895]
102.根据实施方式97-101中任一项所述的治疗化合物,其中所述免疫细胞引起疾病病理学。
[0896]
103.根据实施方式97-102中任一项所述的治疗化合物,其中,靶向部分包括抗madcam抗体。
[0897]
104.根据实施方式97所述的治疗化合物,其中,所述化合物从n末端到c末端具有下式:
[0898]
r1
‑‑‑
接头区a—r2或r3—接头区b—r4
[0899]
其中,
[0900]
r1、r2、r3和r4各自独立地包括所述效应物结合/调节部分、所述靶向部分或不存在。
[0901]
105.根据实施方式104所述的治疗化合物,其中,接头区a和接头区b中的每一个包括fc区。
[0902]
106.根据实施方式104或105所述的治疗化合物,其中,r1和r2中的一个是il-突变蛋白抗体并且r1和r2中的一个是抗madcam抗体。
[0903]
107.根据实施方式104、105或106所述的治疗化合物,其中,r1是il-突变蛋白并且r2是抗madcam抗体。
[0904]
108.根据实施方式104、105或106所述的治疗化合物,其中,r1中的一个是抗madcam抗体并且一个r2是抗pd-1抗体。
[0905]
109.根据实施方式104、105或106所述的治疗化合物,其中,r3和r4中的一个是il-2突变蛋白并且r3和r4中的一个是抗madcam抗体。
[0906]
110.根据实施方式104、105或106所述的治疗化合物,其中,r3是il-2突变蛋白并且r4是抗madcam抗体。
[0907]
111.根据实施方式104、105或106所述的治疗化合物,其中,r3是抗madcam抗体并且一个r4是il-2突变蛋白。
[0908]
112.根据实施方式104-111中任一项所述的治疗化合物,其中不存在接头。
[0909]
113.根据实施方式104-111中任一项所述的治疗化合物,其中,所述接头是或包括fc区。
[0910]
114.根据实施方式104-111中任一项所述的治疗化合物,其中,所述接头包括甘氨酸/丝氨酸接头。
[0911]
115.根据实施方式104-111所述的治疗化合物,其中,所述接头包括ggggsggggsggggsggggs(seq id no:22)、ggggsggggsggggs(seq id no:30)、ggggsggggs(seq id no:619)或ggggs(seq id no:23)的序列。
[0912]
116.根据实施方式97所述的治疗化合物,其中,所述il-2突变蛋白包括seq id no:6的il-2序列,其中肽包括在对应于seq id no:6的位置53、56、80或118的位置处的突变。
[0913]
117.根据实施方式97-116中任一项所述的治疗化合物,其中,所述il-2突变蛋白包括seq id no:6的il-2序列,其中肽包括在对应于seq id no:6的位置53、56、80或118的位置处的突变。
[0914]
118.根据实施方式116所述的治疗化合物,其中,所述突变是位置53、56、80或118处的l到i突变。
[0915]
119.根据实施方式117所述的治疗化合物,其中,所述突变是位置53、56、80或118处的l到i突变。
[0916]
120.根据实施方式97-119中任一项所述的治疗化合物,其中,il-2突变蛋白进一步包括在29、31、35、37、48、69、71、74、88和125的一个或多个位置处的突变,其对应于seq id no:6中的那些位置。
[0917]
121.根据实施方式97-120中任一项所述的治疗化合物,其中,il-2突变蛋白进一步包括在位置e15、h16、q22、d84、e95或q126中的一个或多个位置处的突变,或者位置e15、h16、q22、d84、e95或q126中的1、2、3、4、5个或每一个是野生型。
[0918]
122.根据实施方式97-121中任一项所述的治疗化合物,其中,所述突变蛋白中的突变是e15q、h16n、q22e、d84n、e95q或q126e中的一个或多个。
[0919]
123.根据实施方式97-122中任一项所述的治疗化合物,其中,所述突变蛋白包括seq id no:6中的n29s突变。
[0920]
124.根据实施方式97-123中任一项所述的治疗化合物,其中,所述突变蛋白包括y31s或y51h突变。
[0921]
125.根据实施方式97-124中任一项所述的治疗化合物,其中,所述突变蛋白包括k35r突变。
[0922]
126.根据实施方式97-125中任一项所述的治疗化合物,其中,所述突变蛋白包括t37a突变。
[0923]
127.根据实施方式97-126中任一项所述的治疗化合物,其中,所述突变蛋白包括k48e突变。
[0924]
128.根据实施方式97-127中任一项所述的治疗化合物,其中,所述突变蛋白包括v69a突变。
[0925]
129.根据实施方式97-128中任一项所述的治疗化合物,其中,所述突变蛋白包括n71r突变。
[0926]
130.根据实施方式97-129中任一项所述的治疗化合物,其中,所述突变蛋白包括q74p突变。
[0927]
131.根据实施方式97-130中任一项所述的治疗化合物,其中,所述突变蛋白包括n88d或n88r突变。
[0928]
132.根据实施方式97-131中任一项所述的治疗化合物,其中,所述突变蛋白包括c125a或c125s突变。
[0929]
133.根据实施方式97-132中任一项所述的治疗化合物,其中,所述il-2突变蛋白与fc肽融合或连接。
[0930]
134.根据实施方式133所述的治疗化合物,其中,所述fc肽包括在l234、l247、l235、l248、g237和g250的一个或多个位置处的突变。
[0931]
135.根据实施方式134所述的治疗化合物,其中,所述突变是l到a或g到a的突变。
[0932]
136.根据实施方式134所述的治疗化合物,其中,所述fc肽包括l247a、l248a和/或g250a突变(kabat编号)。
[0933]
137.根据实施方式134所述的治疗化合物,其中,所述fc肽包括l234a突变、l235a突变和/或g237a突变(eu编号)。
[0934]
138.根据实施方式97所述的治疗化合物,其中,所述化合物包括多肽,所述多肽包括形成所述多肽的第一链和第二链,其中
[0935]
所述第一链包括:
[0936]vh-h
c-接头-c1,其中vh是可变重结构域,其通过所述第二链的v
l
结构域与靶细胞结合;hc是包括ch1-ch2-ch3结构域的抗体的重链,所述接头是甘氨酸/丝氨酸接头,并且c1是在n末端或c末端方向与fc蛋白融合或连接的il-2突变蛋白;并且
[0937]
所述第二链包括:
[0938]vl-lc,其中v
l
是可变轻链结构域,其通过第一链的vh结构域与靶细胞结合,并且lc结构域是轻链ck结构域。
[0939]
139.根据实施方式138所述的治疗化合物,其中,所述vh和vl结构域是与细胞上表达的madcam结合的抗madcam可变结构域。
[0940]
140.根据实施方式138或139所述的治疗化合物,其中,所述il-2突变蛋白包括在对应于seq id no:6的位置53、56、80或118的位置处的突变。
[0941]
141.根据实施方式140所述的治疗化合物,其中,所述突变是位置53、56、80或118处的l到i突变。
[0942]
142.根据实施方式140或141所述的治疗化合物,其中,所述突变蛋白进一步包括在对应于位置69、75、88和/或125或其任何组合的位置处的突变。
[0943]
143.根据实施方式140或141所述的治疗化合物,其中,所述il-2突变蛋白包括选自由以下组成的组的突变:l53i、l56i、l80i和l118i中的一个和v69a、q74p、n88d或n88r,以及任选的c125a或c125s的突变。
[0944]
144.根据实施方式143所述的治疗化合物,其中,所述il-2突变蛋白包括l53i突变。
[0945]
145.根据实施方式143所述的治疗化合物,其中,所述il-2突变蛋白包括l56i突变。
[0946]
146.根据实施方式143所述的治疗化合物,其中,所述il-2突变蛋白包括l80i突变。
[0947]
147.根据实施方式143所述的治疗化合物,其中,所述il-2突变蛋白包括l118i突变。
[0948]
148.根据实施方式143所述的治疗化合物,其中,所述il-2突变蛋白不包括任何其他突变。
[0949]
149.根据实施方式138-148中任一项所述的治疗化合物,其中,所述fc蛋白包括l247a、l248a和g250a突变或根据kabat编号的l234a突变、l235a突变和/或g237a突变。
[0950]
150.根据实施方式138-149中任一项所述的治疗化合物,其中,所述接头包括ggggsggggsggggs(seq id no:30)或ggggsggggsggggsggggs(seq id no:22)的序列。
[0951]
151.根据实施方式138-149中任一项所述的治疗化合物,其中,所述多肽包括包含本文所述的序列的fc肽。
[0952]
152.根据实施方式81-84中任一项所述的治疗化合物,其中:
[0953]
r1、r2、r3和r4中的一个包括抗bcr抗体分子,例如拮抗性抗bcr抗体分子,一个包括抗fcrl抗体分子,并且一个包括特异性靶向部分。
[0954]
153.根据实施方式152所述的治疗化合物,其中:
[0955]
抗fcrl分子包括:抗fcrl抗体分子,例如针对fcrl1、fcrl2、fcrl3、fcrl4、fcrl5或fcrl6的激动性抗fcrl抗体分子。
[0956]
154.根据实施方式81-84中任一项所述的治疗化合物,其中:
[0957]
r1、r2、r3和r4各自独立地包括:
[0958]
i)最小化或抑制t细胞活性、扩增或功能的效应物结合/调节部分(t细胞效应物结合/调节部分),例如icim结合/调节部分、iic结合/调节部分或sm结合/调节部分;
[0959]
ii)最小化或抑制b细胞活性、扩增或功能的效应物结合/调节部分(b细胞效应物结合/调节部分),例如icim结合/调节部分、iic调节部分或sm结合/调节部分;
[0960]
iii)特异性靶向部分;或
[0961]
iv)不存在;前提是存在t细胞效应物结合/调节部分、b细胞效应物结合/调节部分和特异性靶向部分。
[0962]
155.根据实施方式154所述的治疗化合物,其中:
[0963]
r1、r2、r3和r4中的一个包括激动性抗pd-1抗体并且一个包括hla-g分子。
[0964]
156.根据实施方式154-155所述的治疗化合物,其中:
[0965]
r1、r2、r3和r4中的一个包括sm结合/调节部分,例如cd39分子或cd73分子。
[0966]
157.根据实施方式154-156中任一项所述的治疗化合物,其中:
[0967]
r1、r2、r3和r4中的一个包括结合、激活或维持调节性免疫细胞例如treg细胞或breg细胞的实体。
[0968]
158.实施方式154-157中任一项的治疗化合物,其中:
[0969]
r1、r2、r3和r4中的一个包括激动性抗pd-1抗体或一个包括hla-g分子。
[0970]
159.根据实施方式158所述的治疗化合物,其中:
[0971]
r1、r2、r3和r4中的一个包括激动性抗pd-1抗体,一个包括hla-g分子,并且一个包括cd39分子或cd73分子。
[0972]
160.根据实施方式1-159中任一项所述的治疗化合物,其中,所述效应物结合/调节部分包括多肽。
[0973]
161.根据实施方式1-160中任一项所述的治疗化合物,其中,所述效应物结合/调节部分包括具有至少5、10、20、30、40、50、150、200或250个氨基酸残基的多肽。
[0974]
162.根据实施方式1-161中任一项所述的治疗化合物,其中,所述效应物结合/调节部分具有的分子量为5、10、15、20或40kd。
[0975]
163.根据实施方式1-162中任一项所述的治疗化合物,其中,所述效应物结合/调节部分不包括载脂蛋白ciii、蛋白激酶a、src激酶或β1整合素的表达的抑制剂。
[0976]
164.根据实施方式1-162中任一项所述的治疗化合物,其中,所述效应物结合/调节部分不包括载脂蛋白ciii、蛋白激酶a、src激酶或β1整合素的活性的抑制剂。
[0977]
165.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向选自肺、皮肤、胰腺、视网膜、前列腺、卵巢、淋巴结、肾上腺、肝脏或肠道组织的组织。
[0978]
166.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向肾小管细胞,例如近侧肾小管上皮细胞。
[0979]
167.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向tie-2、apn、tem4、tem6、icam-1、核素p2z受体、trk-a、flj10849、hspa12b、app或ox-45。
[0980]
168.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向管腔表达的蛋白质。
[0981]
169.根据实施方式1-163中任一项所述的治疗化合物,其中,所述供体靶标不包括心脏特异性靶标。
[0982]
170.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向肺组织。
[0983]
171.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向肾组织。
[0984]
172.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向胰腺肺组织。
[0985]
173.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向肠道组织。
[0986]
174.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向前列腺组织。
[0987]
175.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向脑组织。
[0988]
176.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向cd71。
[0989]
177.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向cd90。
[0990]
178.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向madcam。
[0991]
179.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向白蛋白。
[0992]
180.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向碳酸酐酶iv。
[0993]
181.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向zg16-p。
[0994]
182.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向二肽基肽酶iv。
[0995]
183.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特
异性靶向血管内皮细胞膜的腔表面。
[0996]
184.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向心脏组织。
[0997]
185.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向肿瘤、实体瘤或实体瘤的血管。
[0998]
186.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向皮肤组织。
[0999]
187.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向表皮组织。
[1000]
188.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向基膜。
[1001]
189.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向dsg多肽。
[1002]
190.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向dsg1。
[1003]
191.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向dsg3。
[1004]
192.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向bp180。
[1005]
193.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不特异性靶向桥粒芯糖蛋白。
[1006]
194.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不包括补体调节剂,例如补体抑制剂,例如但不限于美国专利号8,454,963中描述的那些,该专利通过援引以其整体并入本文。
[1007]
195.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不包括显像剂。
[1008]
196.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不包括选自由以下组成的组的显像剂:放射性试剂、放射性同位素、放射性药物、造影剂、纳米颗粒;酶、辅基、荧光材料、发光材料和生物发光材料,例如但不限于美国专利号8,815,235中描述的那些,该专利通过援引以其整体并入本文。
[1009]
197.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不包括放射性核素,诸如但不限于美国专利号6,232,287中描述的那些,该专利通过援引以其整体并入本文。
[1010]
198.根据实施方式1-163中任一项所述的治疗化合物,其不被与其结合的供体细胞内化。
[1011]
199.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不进入被特异性靶向部分靶向的细胞。
[1012]
200.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不杀伤被特异性靶向部分靶向的细胞。
[1013]
201.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不进入效应物结合/调节部分所结合的细胞。
[1014]
202.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不杀伤效应物结合/调节部分所结合的细胞。
[1015]
203.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不包括自身抗原肽或多肽。
[1016]
204.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不包括自身抗原肽或多肽,例如不包括受试者针对其具有自身抗体的肽或多肽。
[1017]
205.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不包括源自患有自身免疫性疾患的哺乳动物例如人的抗体分子。
[1018]
206.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不包括源自患有急性粘膜皮肤pv的哺乳动物例如人的抗体分子。
[1019]
207.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不包括源自患有古德帕斯丘病的哺乳动物例如人的抗体分子。
[1020]
208.根据实施方式1-163中任一项所述的治疗化合物,其中,所述治疗化合物不包括源自患有寻常型天疱疮的哺乳动物例如人的抗体分子。
[1021]
209.根据实施方式1-208中任一项所述的治疗化合物,包括供体特异性靶向部分。
[1022]
210.根据实施方式209中任一项所述的治疗化合物,其优先定位于植入的供体组织,而不是接受者的组织。
[1023]
211.根据实施方式209-210所述的治疗化合物,其中,所述供体特异性靶向部分为来自供体的移植组织(例如器官)提供位点特异性免疫赦免。
[1024]
212.根据实施方式209-211所述的治疗化合物,其中,所述供体特异性靶向部分结合供体中基因座处存在的等位基因的产物,例如多肽,所述等位基因不存在于接受者中的基因座处。
[1025]
213.根据实施方式209-212中任一项所述的治疗化合物,其中,与受试者组织上表达的基因的等位基因相比,所述供体特异性靶向部分优先结合在供体组织(例如移植组织例如器官)上表达的基因的等位基因。
[1026]
214.根据实施方式209-213所述的治疗化合物,其中,所述供体特异性靶向部分具有的对供体组织例如移植组织例如器官上表达的基因的等位基因的结合亲合力是其对于受试者组织上表达的基因的等位基因的亲合力的至少2、4、5、10、50、100、500、1,000、5,000或10,000倍。
[1027]
215.根据实施方式209-214中任一项所述的治疗化合物,其中,所述供体特异性靶向部分结合供体中基因座处存在的等位基因的产物,例如多肽,所述等位基因不存在于接受者中的基因座处。
[1028]
216.根据实施方式209-215中任一项所述的治疗化合物,其中,所述结合是足够特异性的,使得例如在治疗化合物的临床有效剂量下,发生有害的、实质性的或临床上不可接受的全身性免疫抑制。
[1029]
217.根据实施方式209-216中任一项所述的治疗化合物,其中,所述治疗化合物在靶位点积累,例如供体特异性靶向部分的结合导致治疗化合物在靶位点积累。
[1030]
218.根据实施方式209-217中任一项所述的治疗化合物,其中,所述供体特异性靶向部分结合选自表2的基因座的等位基因的产物,例如hla基因座,例如hla-a、hla-b、hla-c、hla-dp、hla-dq或hla-dr基因座,所述等位基因存在于供体中但不存在于接受者中。hla-a、hla-b、hla-c、hla-dp、hla-dq或hla-dr基因座。
[1031]
219.根据实施方式209-218中任一项所述的治疗化合物,其中,所述供体特异性靶向部分结合hla a的等位基因、hla-b的等位基因、hla-c的等位基因、hla-dp的等位基因、hla-的等位基因、或hla-的等位基因。
[1032]
220.根据实施方式209-219中任一项所述的治疗化合物,其中,所述治疗化合物适用于治疗具有、将具有或需要移植物的受试者。
[1033]
221.根据实施方式220所述的治疗化合物,其中,所述移植物包括器官例如肝、肾、心脏、胰腺、胸腺、皮肤或肺的全部或部分。
[1034]
222.根据实施方式209-221中任一项所述的治疗化合物,其中,所述供体特异性靶向部分包括抗体分子。
[1035]
223.根据实施方式209-221中任一项所述的治疗化合物,其中,所述供体特异性靶向部分包括靶特异性结合多肽或靶配体结合分子。
[1036]
224.根据实施方式1-223中任一项所述的治疗化合物,包括组织特异性靶向部分。
[1037]
225.根据实施方式224所述的治疗化合物,其中,所述组织特异性靶向部分是特异性结合madcam的分子。
[1038]
226.根据实施方式224所述的治疗化合物,其中,所述组织特异性靶向部分是特异性结合madcam的抗体。
[1039]
227.根据实施方式224-226中任一项所述的治疗化合物,其中,所述治疗化合物适合于治疗患有自身免疫性疾患(例如本文所述的自身免疫性疾患)或处于患自身免疫性疾患的风险或升高的患病风险中的受试者。
[1040]
228.根据实施方式224-227中任一项所述的治疗化合物,其中,所述治疗化合物在靶位点积累,例如组织特异性靶向部分的结合导致治疗化合物在靶位点积累。
[1041]
229.根据实施方式224-228中任一项所述的治疗化合物,其中,所述治疗化合物优先定位于靶组织而不是受试者的其他组织。
[1042]
230.根据实施方式224-229中任一项所述的治疗化合物,其中,所述治疗化合物为受试者靶组织提供位点特异性免疫赦免,例如遭受有害的免疫攻击或处于有害的免疫攻击的风险或升高的风险中的靶组织,例如,在自身免疫性疾患中。
[1043]
231.根据实施方式224-229中任一项所述的治疗化合物,其中,所述组织特异性靶向部分作为治疗化合物的组分优先结合遭受有害的免疫攻击的受试者靶组织,例如,在自身免疫性疾患中。
[1044]
232.根据实施方式224-231中任一项所述的治疗化合物,其中,组织特异性靶向部分与不存在于靶组织外部,或以足够低的水平存在的产物(例如多肽)结合,其在治疗性分子的治疗浓度下,不存在或基本上不存在不可接受的免疫抑制水平。
[1045]
233.根据实施方式224-232中任一项所述的治疗化合物,其中,所述组织特异性靶向部分结合在靶组织中比在非靶组织中更丰富的产物或产物上的位点。
[1046]
234.根据实施方式224-233中任一项所述的治疗化合物,其中,所述治疗化合物结
合基本上仅在靶组织上存在或表达的产物或产物上的位点。
[1047]
235.根据实施方式224-234中任一项所述的治疗化合物,其中,所述特异性靶向部分结合的产物或产物上的位点充分限于靶组织,在治疗化合物的治疗有效水平下,受试者不会遭受不可接受的水平例如临床显著水平的全身免疫抑制。
[1048]
236.根据实施方式224-235中任一项所述的治疗化合物,其中,所述治疗化合物优先结合靶组织或靶组织抗原,例如,对于靶抗原或组织,具有的对靶组织或抗原的结合亲合力比它对存在于靶组织外部的非靶组织或抗原的亲合力大,例如是其至少2、4、5、10、50、100、500、1,000、5,000或10,000倍。
[1049]
237.根据实施方式224-236中任一项所述的治疗化合物,其中,所述组织特异性靶向部分结合存在于预定位点,例如自身免疫性疾患中有害免疫应答的位点的产物,例如多肽产物,或产物上的位点。
[1050]
238.根据实施方式224-237中任一项所述的治疗化合物,其中,所述治疗化合物适合于治疗患有1型糖尿病或处于患1型糖尿病的风险或升高的风险中的受试者。
[1051]
239.根据实施方式224-238中任一项所述的治疗化合物,其中,所述靶组织包括胰腺组织,例如胰岛或胰腺β细胞、肠组织(例如肠内皮细胞)、肾组织(例如肾上皮细胞)或肝组织(例如肝上皮细胞)。
[1052]
240.根据实施方式224-239中任一项所述的治疗化合物,其中,所述效应物结合/调节部分或靶向部分结合选自本文所述的多肽,诸如表3中所列的那些,例如sez6l2、lrp11、disp2、slc30a8、fxyd2、tspan7或tmem27。
[1053]
241.根据实施方式224-236中任一项所述的治疗化合物,其中,所述治疗化合物适合于治疗患有多发性硬化症或处于患多发性硬化症的风险或升高的风险中的受试者。
[1054]
242.根据实施方式241所述的治疗化合物,其中,所述靶组织包括cns组织、髓鞘或少突胶质细胞的髓鞘。
[1055]
243.根据实施方式241-242中任一项所述的治疗化合物,其中,所述效应物结合/调节部分或靶向部分结合选自本文所述的那些的多肽并且包括但不限于表3的多肽,例如mog、plp或mbp。
[1056]
244.根据实施方式224-236中任一项所述的治疗化合物,其中,所述治疗化合物适合于治疗患有心肌炎或处于患心肌炎的风险或升高的风险中的受试者。
[1057]
245.根据实施方式244所述的治疗化合物,其中,所述靶组织包括心肌细胞、单核细胞、巨噬细胞或骨髓细胞。
[1058]
246.根据实施方式244-245所述的治疗化合物,其中,所述效应物结合/调节部分或靶向部分结合本文所述的多肽,包括但不限于选自表3的那些,例如sirpa(cd172a)。
[1059]
247.根据实施方式224-236中任一项所述的治疗化合物,其中,所述治疗化合物适合于治疗患有以下、或处于患以下的风险或升高的风险中的受试者:炎症性肠病、自身免疫性肝炎(aih);原发性硬化性胆管炎(psc);原发性胆汁性硬化症;(pbc);移植物。
[1060]
248.根据实施方式224-236中任一项所述的治疗化合物,其中,所述受试者患有克罗恩病或溃疡性结肠炎、处于患克罗恩病或溃疡性结肠炎的风险或升高的风险中。
[1061]
249.根据实施方式247或248所述的治疗化合物,其中,所述靶组织包括肠细胞,例如肠上皮细胞,或肝细胞,例如肝上皮细胞。
[1062]
250.根据实施方式247-249所述的治疗化合物,其中,所述效应物结合/调节部分结合本文所述的多肽,包括但不限于选自表3的那些,例如pd-1。
[1063]
251.根据实施方式247-249所述的治疗化合物,其中,所述靶向部分结合如本文所述的多肽,包括但不限于madcam。
[1064]
252.根据实施方式224-236中任一项所述的治疗化合物,其中,所述治疗化合物适合于治疗患有类风湿性关节炎、或处于患类风湿性关节炎的风险或升高的风险的受试者。
[1065]
253.根据实施方式252所述的治疗化合物,其中,所述靶组织包括心肌细胞、单核细胞、巨噬细胞或骨髓细胞。
[1066]
254.根据实施方式252或253所述的治疗化合物,其中,所述效应物结合/调节部分或靶向部分结合选自表3的多肽,例如sirpa(cd172a)。
[1067]
255.根据实施方式224-254中任一项所述的治疗化合物,其中,所述组织特异性靶向部分包括抗体分子。
[1068]
256.根据实施方式224-254中任一项所述的治疗化合物,其中,所述组织特异性靶向部分包括靶特异性结合多肽或靶配体结合分子。
[1069]
257.根据实施方式224-254中任一项所述的治疗化合物,其中,所述组织特异性靶向部分包括结合madcam的靶特异性结合多肽。
[1070]
258.根据实施方式1-257中任一项所述的治疗化合物,其中,所述治疗化合物结合免疫效应细胞例如t细胞、b细胞、nk细胞或其他免疫细胞的细胞表面分子,所述细胞传播促免疫应答。
[1071]
259.根据实施方式1-258中任一项所述的治疗化合物,其中,所述治疗化合物降低免疫效应细胞例如t细胞、b细胞、nk细胞或其他免疫细胞传播促免疫应答的能力。
[1072]
260.根据实施方式1-259中任一项所述的治疗化合物,其中,所述特异性靶向部分靶向哺乳动物靶标,例如哺乳动物多肽,并且所述效应物结合/调节部分结合/调节哺乳动物免疫组分,例如人免疫细胞,例如哺乳动物b细胞、t细胞或巨噬细胞。
[1073]
261.根据实施方式1-260中任一项所述的治疗化合物,其中,所述特异性靶向部分靶向人靶标,例如人多肽,并且所述效应物结合/调节部分结合/调节人免疫组分,例如人免疫细胞,例如人b细胞、t细胞或巨噬细胞。
[1074]
262.根据实施方式1-261中任一项所述的治疗化合物,其中,所述治疗化合物被配置用于人。
[1075]
263.根据实施方式1-260中任一项所述的治疗化合物,其中,所述治疗化合物被配置用于非人哺乳动物。
[1076]
264.根据实施方式1-263中任一项所述的治疗化合物,其中,所述治疗化合物例如效应物结合/调节部分包括pd-1激动剂。
[1077]
265.根据前述实施方式中任一项所述的治疗化合物,其中,所述治疗化合物包括seq id no:15的il-2突变蛋白,其中所述突变蛋白包括在位置73、76、100或138处的突变。
[1078]
266.根据实施方式265所述的治疗化合物,其中,所述突变是位置73、76、100或138处的l到i突变。
[1079]
267.根据实施方式265或266所述的治疗化合物,其中,所述il-2突变蛋白进一步包括在位置49、51、55、57、68、89、91、94、108和145中的一个或多个位置处的突变。
[1080]
268.根据实施方式265-267中任一项所述的治疗化合物,其中,所述突变蛋白进一步包括在位置e35、h36、q42、d104、e115或q146中的一个或多个位置处的突变,或者e35、h36、q42、d104、e115或q146中的1、2、3、4、5个或每一个是野生型。
[1081]
269.根据实施方式268所述的治疗化合物,其中,所述突变是e35q、h36n、q42e、d104n、e115q或q146e中的一个或多个。
[1082]
270.根据实施方式265-269中任一项所述的治疗化合物,其中,所述il-2突变蛋白包括n49s突变。
[1083]
271.根据实施方式265-270中任一项所述的治疗化合物,其中,所述il-2突变蛋白包括y51s或y51h突变。
[1084]
272.根据实施方式265-271中任一项所述的治疗化合物,其中,所述il-2突变蛋白包括k55r突变。
[1085]
273.根据实施方式265-272中任一项所述的治疗化合物,其中,所述il-2突变蛋白包括t57a突变。
[1086]
274.根据实施方式265-272中任一项所述的治疗化合物,其中,所述il-2突变蛋白包括k68e突变、v89a(v69a)突变、n91r(n71r)突变、q94p或q74p突变、(n88d)或n108r(n88r)突变、c145a(c125a)或c145s(c125s)突变。
[1087]
275.根据实施例265-274中任一项所述的治疗化合物,其中,所述治疗化合物包括seq id no:6的il-2突变蛋白,其中所述突变蛋白包括在位置53、56、80或118处的突变和实施方式265-274中所述的突变中的一个或多个。
[1088]
276.根据实施方式265-275中任一项所述的治疗化合物,其中,所述il-2突变蛋白与fc肽融合或连接。
[1089]
277.根据实施方式276所述的治疗化合物,其中,所述fc肽包括在l234、l247、l235、l248、g237和g250(eu编号)的一个或多个位置处的突变。
[1090]
278.一种治疗患有炎性肠病的受试者的方法,所述方法包括向所述受试者给药实施方式1-277中任一项的治疗化合物以治疗炎性肠病。
[1091]
279.根据实施方式278所述的方法,其中,所述患有炎性肠病的受试者患有克罗恩病。
[1092]
280.根据实施方式278所述的方法,其中,所述患有炎性肠病的受试者患有溃疡性结肠炎。
[1093]
281.一种治疗患有自身免疫性肝炎的受试者的方法,所述方法包括向所述受试者给药实施方式1-277中任一项的治疗化合物以治疗所述自身免疫性肝炎。
[1094]
282.一种治疗原发性硬化性胆管炎的方法,所述方法包括向所述受试者给药实施方式1-277中任一项的治疗化合物以治疗所述原发性硬化性胆管炎。
[1095]
283.一种治疗1型糖尿病的方法,所述方法包括给药实施方式1-277中任一项的治疗化合物,从而治疗所述受试者以治疗所述1型糖尿病。
[1096]
284.一种治疗移植受试者的方法,包括向所述受试者给药治疗有效量的实施方式1-277中任一项的治疗化合物,
[1097]
从而治疗移植(接受者)受试者。
[1098]
285.一种治疗具有移植的供体组织的受试者中的gvhd的方法,包括向所述受试者
给药治疗有效量的实施方式1-277中任一项的治疗化合物。
[1099]
286.根据实施方式285所述的方法,其中,在接受移植物之前;在出现gvhd的症状之前;在接受移植物之后或与之同时;或在出现gvhd的症状之后或与之同时向所述受试者给药所述治疗化合物。
[1100]
287.一种治疗患有自身免疫性疾患或处于患自身免疫性疾患的风险或升高的风险中的受试者的方法,包括给药治疗有效量的实施方式1-277中任一项的治疗化合物,从而治疗所述受试者。
[1101]
288.根据实施方式287所述的方法,其中,所述受试者已经接受、将接受或需要同种异体移植供体组织。
[1102]
289.根据实施方式287-288中任一项所述的方法,其中,所述供体组织包括实体器官,例如肝、肾、心脏、胰腺、胸腺或肺。
[1103]
290.根据实施方式287-288中任一项所述的方法,其中,所述供体组织包括器官例如肝、肾、心脏、胰腺、胸腺或肺的全部或部分。
[1104]
291.根据实施方案287-288中任一项所述的方法,其中,所述供体组织包括皮肤。
[1105]
292.根据实施方式287-288中任一项所述的方法,其中,所述供体组织不包括皮肤。
[1106]
293.根据实施方式287-292中任一项所述的方法,其中,所述供体组织呈递或表达基因座的等位基因的产物,所述等位基因在受试者中不存在或不表达。
[1107]
294.根据实施方式287-292中任一项所述的方法,其中,所述供体组织呈递或表达选自表2的基因座的等位基因的产物,例如hla基因座,例如hla-a、hla-b、hla-c、hla-dp、hla-dq或hla-dr基因座,所述等位基因在受试者中不存在或不表达。
[1108]
295.根据实施方式287-294中任一项所述的方法,包括将移植组织引入到受试者中。
[1109]
296.根据实施方式278-295中任一项所述的方法,包括在远离靶位点的位点处,例如在外周循环或淋巴管系统中监测受试者的免疫细胞失活(例如,监测免疫抑制检查点分子的有害激动)。
[1110]
297.根据实施方式278-296中任一项所述的方法,包括在远离靶位点的位点处,例如在外周循环或淋巴管系统中监测受试者的免疫细胞激活(例如,监测免疫抑制检查点分子的有害拮抗)。
[1111]
298.根据实施方式278-297中任一项所述的方法,其中,响应于监测结果,为受试者选择治疗过程,例如增加治疗化合物的剂量、减少治疗化合物的剂量、用治疗化合物继续治疗而不改变剂量。
[1112]
299.根据实施方式278-298中任一项所述的方法,包括向接受者给药实施方式1-277的化合物。
[1113]
300.根据实施方式278-298中任一项所述的方法,其中,给药包括全身给药,例如,至外周循环系统。
[1114]
301.根据实施方式278-298中任一项所述的方法,其中给药包括区域性给药,例如,至靶组织、供体组织、或靶组织或供体组织位于或将位于的部位。
[1115]
302.根据实施方式301中任一项所述的方法,包括在将供体组织引入到接受者之
前向接受者给药治疗化合物。
[1116]
303.根据实施方式301中任一项所述的方法,包括在将供体组织引入到接受者之后向接受者给药治疗化合物。
[1117]
304.根据实施方式295中任一项所述的方法,包括在将供体组织引入到接受者的同时向接受者给药治疗化合物。
[1118]
305.根据实施方式295所述的方法,包括在将供体组织引入到接受者之前使治疗化合物与供体组织接触。
[1119]
306.根据实施方式295中任一项所述的方法,包括向受试者提供治疗化合物,其中移植组织在引入到受试者之前已经与治疗化合物接触。
[1120]
307.根据实施方式295中任一项所述的方法,包括在将供体组织引入到接受者之后,使治疗化合物与供体组织接触,例如通过局部给药至供体组织。
[1121]
308.根据实施方式278-307中任一项所述的方法,包括给药本文提供的治疗化合物,使得治疗水平存在至少1、5、10、14或28天,例如连续或非连续天。
[1122]
309.根据实施方式278-308中任一项所述的方法,其中,所述受试者未接受非靶向免疫抑制剂。
[1123]
310.根据实施方式278-308中任一项所述的方法,其中,在初始给药治疗化合物之前,受试者在至少1、15、30、60或90天内未接受非靶向免疫抑制剂。
[1124]
311.根据实施方式295中任一项所述的方法,其中,在引入移植组织之前,受试者在至少1、15、30、60或90天内未接收非靶向免疫抑制剂。
[1125]
312.根据实施方式278-311中任一项的方法,其中,在初始给药治疗化合物之后,受试者在至少1、15、30、60、90或180天内未接受非靶向免疫抑制剂。
[1126]
313.根据实施方式278-311中任一项所述的方法,其中,在引入移植组织之后,受试者在至少1、15、30、60、90或180天之内未接收非靶向免疫抑制剂。
[1127]
314.根据实施方式278-313中任一项所述的方法,包括向受试者给药非靶向免疫抑制剂。
[1128]
315.根据实施方式278-314中任一项所述的方法,其中,在初始给药治疗化合物之前,受试者接受非靶向免疫抑制剂至少1、15、30、60或90天。
[1129]
316.根据实施方式295中任一项所述的方法,其中,在引入移植组织之前,受试者接收非靶向免疫抑制剂至少1、15、30、60或90天。
[1130]
317.根据实施方式316中任一项所述的方法,其中,在初始给药治疗化合物之后,受试者接受非靶向免疫抑制剂至少1、15、30、60、90或180天。
[1131]
318.根据实施方式278-317中任一项所述的方法,其中,在引入移植组织之后,受试者接收非靶向免疫抑制剂至少1、15、30、60、90或180天。
[1132]
319.根据实施方式278-317中任一项所述的方法,其中,在初始给药治疗化合物之前,受试者接受非靶向免疫抑制剂,但不超过1、15、30、60、90或180天。
[1133]
320.根据实施方式295中任一项所述的方法,其中,在引入移植组织之前,受试者接收非靶向免疫抑制剂,但不超过过1、15、30、60、90或180天。
[1134]
321.根据实施方式278-320中任一项所述的方法,其中,在初始给药治疗化合物之后,受试者接受非靶向免疫抑制剂,但不超过1、15、30、60、90或180天。
[1135]
322.根据实施方式295中任一项所述的方法,其中,在引入移植组织之后,受试者接收非靶向免疫抑制剂,但不超过过1、15、30、60、90或180天。
[1136]
323.根据实施方式295所述的方法,其中,监测受试者对移植组织的排斥。
[1137]
324.根据实施方式278-323中任一项所述的方法,选择非靶向免疫抑制剂的剂量,或其中响应于监测,选择非靶向免疫抑制剂的剂量。
[1138]
325.根据实施方式324所述的方法,其中,给药所述剂量。
[1139]
326.根据实施方式325所述的方法,其中,所选剂量为零,即不给药非靶向免疫抑制剂。
[1140]
327.根据实施方式325所述的方法,其中,所选剂量是非零的,即给药非靶向免疫抑制剂。
[1141]
328.根据实施方式325所述的方法,其中,所述剂量小于在不给药治疗化合物的情况下给药的剂量。
[1142]
329.根据实施方式278-328中任一项所述的方法,其中,所述受试者是哺乳动物,例如非人哺乳动物。
[1143]
330.根据实施方式278-328中任一项所述的方法,其中,所述受试者是人。
[1144]
331.根据实施方式295的方法,其中,供体和受试者在hla基因座例如主要或次要基因座处错配。
[1145]
332.根据实施方式331所述的方法,其中,所述受试者是哺乳动物,例如非人哺乳动物。
[1146]
333.根据实施方式331所述的方法,其中,所述受试者是人。
[1147]
334.一种治疗患有自身免疫性疾患或处于患自身免疫性疾患的风险或升高的风险中的受试者的方法,包括给药治疗有效量的实施方式1-277中任一项的治疗化合物,从而治疗所述受试者。
[1148]
335.根据实施方式334所述的方法,其中,在自身免疫性疾患的症状发作之前或发作确定之前开始提供治疗化合物。
[1149]
336.根据实施方式334-335中任一项所述的方法,其中,在自身免疫性疾患的症状发作之后或发作确定之后开始提供治疗化合物。
[1150]
337.根据实施方式334-336所述的方法,其中,自身免疫性疾患包括1型糖尿病。
[1151]
338.根据实施方式334-337中任一项所述的治疗化合物,其中,所述靶组织包括胰岛或胰腺β细胞、肠组织(例如肠内皮细胞)、肾组织(例如肾上皮细胞)或肝组织(例如肝上皮细胞)。
[1152]
339.根据实施方式334-338中任一项所述的治疗化合物,其中,所述效应物结合/调节部分或靶向部分结合选自表3的多肽,例如madcam、oat1、oct、dpp6、sez6l2、lrp11、disp2、slc30a8、fxyd2、tspan7或tmem27多肽。
[1153]
340.根据实施方式334-339中任一项所述的方法,其中,在1型糖尿病的症状发作之前或发作确定之前开始提供治疗化合物。
[1154]
341.根据实施方式334-340中任一项所述的方法,其中,在具有预定特征或症状之前或在确定为具有预定特征或症状的受试者之前开始提供治疗化合物。
[1155]
342.根据实施方式334-341中任一项所述的方法,其中,在1型糖尿病的症状发作
之后或发作确定之后开始提供治疗化合物。
[1156]
343.根据实施方式334-342中任一项所述的方法,其中,在具有预定特征或症状之后或在确定为具有预定特征或症状的受试者之后开始提供治疗化合物。
[1157]
344.根据实施方式334-343中任一项所述的方法,其中,所述治疗化合物是实施方式1-277中任一项的治疗化合物。
[1158]
345.根据实施方式334-339中任一项所述的方法,其中,所述治疗化合物适合于治疗患有多发性硬化症或处于患多发性硬化症的风险或升高的风险中的受试者。
[1159]
346.根据实施方式345所述的方法,其中,所述靶组织包括cns组织、髓鞘或少突胶质细胞的髓鞘。
[1160]
347.根据实施方式345或346中任一项所述的方法,其中,所述效应物结合/调节部分或靶向部分结合选自表3的多肽,例如mog、plp或mbp多肽。
[1161]
348.根据实施方式345-347中任一项所述的方法,其中,在多发性硬化症的症状发作之前或发作确定之前开始提供治疗化合物。
[1162]
349.根据实施方式345-347中任一项所述的方法,其中,在具有预定特征或症状之前或在确定为预定特征或症状的受试者之前开始提供治疗化合物。
[1163]
350.根据实施方式345-347中任一项所述的方法,其中,在多发性硬化症的症状发作之后或发作确定之后开始提供治疗化合物。
[1164]
351.根据实施方式345-347中任一项所述的方法,其中,在具有预定特征或症状之后或在确定为具有预定特征或症状的受试者之后开始提供治疗化合物。
[1165]
352.根据实施方式345-351中任一项所述的方法,其中,所述治疗化合物是实施方式1-277中任一项的治疗化合物。
[1166]
353.根据实施方式334-339中任一项所述的方法,其中,所述治疗化合物适合于治疗患有心肌炎或处于患心肌炎的风险或升高的风险中的受试者。
[1167]
354.根据实施方式353所述的方法,其中,所述靶组织包括心肌细胞、单核细胞、巨噬细胞或骨髓细胞。
[1168]
355.根据实施方式353或354所述的方法,其中,所述效应物结合/调节部分或靶向部分结合选自表3的多肽,例如sirpa(cd172a)多肽。
[1169]
356.根据实施方式353-355中任一项所述的方法,其中在心肌炎的症状发作之前或发作确定之前开始提供治疗化合物。
[1170]
357.根据实施方式353-355中任一项所述的方法,其中,在具有预定特征或症状的受试者之前或确定之前开始提供治疗化合物。
[1171]
358.根据实施方式353-355中任一项所述的方法,其中,在心肌炎的症状发作之后或发作确定之后开始提供治疗化合物。
[1172]
359.根据实施方式353-355中任一项所述的方法,其中,在具有预定特征或症状之后或在确定为具有预定特征或症状的受试者之后开始提供治疗化合物。
[1173]
360.根据实施方式353-359中任一项所述的方法,其中,所述治疗化合物是实施方式1-277中任一项的治疗化合物。
[1174]
361.根据实施方式334-339中任一项所述的方法,其中,所述治疗化合物适合于治疗患有类风湿性关节炎或处于患类风湿性关节炎的风险或升高的风险中的受试者。
[1175]
362.根据实施方式361所述的方法,其中,所述靶组织包括心肌细胞、单核细胞、巨噬细胞或骨髓细胞。
[1176]
363.根据实施方式361或362所述的方法,其中,所述效应物结合/调节部分或靶向部分结合选自表3的多肽,例如sirpa(cd172a)多肽。
[1177]
364.根据实施方式361-363所述的方法,其中,在类风湿性关节炎的症状发作之前或发作确定之前开始提供治疗化合物。
[1178]
365.根据实施方式361-363所述的方法,其中,在具有预定特征或症状之前或在确定为具有预定特征或症状的受试者之前开始提供治疗化合物。
[1179]
366.根据实施方式361-363所述的方法,其中,在类风湿性关节炎的症状发作之后或发作确定之后开始提供治疗化合物。
[1180]
367.根据实施方式361-363所述的方法,其中,在具有预定特征或症状之后或在确定为具有预定特征或症状的受试者之后开始提供治疗化合物。
[1181]
368.根据实施方式361-367所述的方法,其中,所述治疗化合物是实施方式1-277中任一项的治疗化合物。
[1182]
369.根据实施方式278-368中任一项所述的方法,包括在远离靶位点的位点处,例如在外周循环或淋巴管系统中监测受试者的免疫细胞失活(例如,监测免疫抑制检查点分子的有害激动)。
[1183]
370.根据实施方式278-369中任一项所述的方法,包括在远离靶位点的位点处,例如在外周循环或淋巴管系统中监测受试者的免疫细胞激活(例如,监测免疫抑制检查点分子的有害拮抗)。
[1184]
371.根据实施方式278-370中任一项所述的方法,其中,响应于监测结果,为受试者选择治疗过程,例如增加治疗化合物的剂量、减少治疗化合物的剂量、用治疗化合物继续治疗而不改变剂量。
[1185]
372.根据实施方式278-371中任一项所述的方法,其中,监测所述受试者的靶组织的自身免疫攻击。
[1186]
373.根据实施方式372所述的方法,其中,响应于所述监测,选择治疗化合物的剂量。
[1187]
374.根据实施方式373所述的方法,其中,给药所述剂量。
[1188]
375.根据实施方式372所述的方法,其中,选择的剂量为零,即停止给药治疗化合物。
[1189]
376.根据实施方式372所述的方法,其中,选择的剂量是非零的。
[1190]
377.根据实施方式372所述的方法,其中,选择的剂量是增加的剂量。
[1191]
378.根据实施方式372所述的方法,其中,选择的剂量是减少的剂量。
[1192]
379.根据实施方式278-378中任一项所述的方法,其中,给药包括全身给药,例如,至外周循环系统。
[1193]
380.根据实施方式278-379中任一项所述的方法,其中,给药包括局部给药,例如,至靶组织。
[1194]
381.根据实施方式278-380中任一项所述的方法,包括给药本文提供的治疗化合物,使得治疗水平存在至少1、5、10、14或28天,例如连续或非连续天。
[1195]
382.根据实施方式278-381中任一项所述的方法,其中,所述受试者是哺乳动物,例如非人哺乳动物。
[1196]
383.根据实施方式278-381中任一项所述的方法,其中,所述受试者是人。
[1197]
384.一种编码实施方式1-277中任一项的治疗化合物的核酸分子或多个核酸分子。
[1198]
385.包括实施方式384的核酸分子的一种载体或多种载体。
[1199]
386.一种包括实施方式384的核酸分子或实施方式385的载体的细胞。
[1200]
387.一种制备治疗化合物的方法,包括培养实施方式386的细胞以制备治疗化合物。
[1201]
388.一种制备编码实施方式1-277中任一项的治疗化合物的核酸序列的方法,包括
[1202]
a)提供包括编码靶向部分的序列的载体,并将编码效应物结合/调节部分的序列插入到载体中以形成编码治疗化合物的序列;或
[1203]
b)提供包括编码效应物结合/调节部分的序列的载体,并将编码靶向部分的序列插入到载体中以形成编码治疗化合物的序列,
[1204]
从而产生编码治疗化合物的序列。
[1205]
389.根据实施方式388所述的方法,其中,响应于受试者的需要选择靶向部分。
[1206]
390.根据实施方式388或389所述的方法,其中,响应于受试者的需要选择效应物结合/调节部分。
[1207]
391.根据实施方式388或389中任一项所述的方法,进一步包括表达编码治疗化合物的序列以产生治疗化合物。
[1208]
392.根据实施方式388-391中任一项所述的方法,进一步包括将所述序列或由所述序列制成的多肽转移至另一实体,例如将向受试者给药所述治疗化合物的医疗保健提供者。
[1209]
393.一种治疗受试者的方法,包括:
[1210]
获得,例如从另一实体接收,治疗化合物或编码治疗化合物的核酸,其通过本文提供的但不限于实施方式388-392的任何方法制备;
[1211]
向所述受试者给药治疗化合物或编码治疗化合物的核酸,
[1212]
从而治疗所述受试者。
[1213]
394.根据实施方式所述393的方法,进一步包括将治疗化合物或编码治疗化合物的核酸确定为另一实体,例如将制备治疗化合物或编码治疗化合物的核酸的实体。
[1214]
395.根据实施方式393或394所述的方法,进一步包括从另一个实体请求治疗化合物或编码治疗化合物的核酸,例如制备治疗化合物或编码治疗化合物的核酸的实体。
[1215]
396.根据实施方式393-395中任一项所述的方法,其中,所述受试者患有自身免疫疾患并且所述治疗化合物不包括所述自身免疫疾患的特征性自身抗原肽或多肽,例如,不包括受试者对其具有自身抗体的肽或多肽。
[1216]
397.根据实施方式97所述的治疗化合物,其中,所述化合物从n末端到c末端具有下式:
[1217]
a1
‑‑‑
接头a
‑‑‑
a2
‑‑‑
接头b
‑‑‑
a3或a3
‑‑‑
接头a
‑‑‑
a2
‑‑‑
接头b
‑‑‑
a1,
[1218]
其中,
[1219]
a1和a3各自独立地包括效应物结合/调节部分或靶向部分,
[1220]
a2包括fc区,并且
[1221]
接头a和接头b各自是独立的接头。
[1222]
398.根据实施方式397所述的治疗化合物,其中,接头区a和接头区b中的每一个包括独立的接头。
[1223]
399.根据实施方式397所述的治疗化合物,其中a1是抗madcam抗体并且a3是il-突变蛋白抗体。
[1224]
400.根据实施方式397所述的治疗化合物,其中,a2包括fc区。
[1225]
401.根据实施方式397-400所述的治疗化合物,其中,接头a和接头b各自独立地为甘氨酸/丝氨酸接头。
[1226]
402.根据实施方式397-401所述的治疗化合物,其中,所述接头a和接头b各自独立地包括ggggsggggsggggsggggs(seq id no:22)、ggggsggggsggggs(seq id no:30)、ggggsggggs(seq id no:619)或ggggs(seq id no:23)。
[1227]
以下实施例是对本文所述的化合物、组合物和方法的说明而非限制。本领域技术人员已知的其他合适的修改和改编在以下实施方式的范围内。
[1228]
实施例
[1229]
实施例1:hla靶向pd-1激动治疗化合物。
[1230]
hla靶向pd-1激动治疗剂的工程化
[1231]
通过克隆来自bb7.2杂交瘤(atcc)的ig重链和轻链的可变区并转化为单链ab(scfv)来获得对hla-a2具有特异性的结合结构域。可以通过评估与表达其他hla-a等位基因的细胞相比的bb7.2与表达hla-a2的细胞的结合来确认scfv的活性和特异性。通过系统地估计对应于氨基酸68-114,pd-l1 igv结构域的氨基酸3'和5'的需求来确定pd-1结合活性所需的最小pd-l1残基。设计表达构建体并合成和纯化蛋白质,通过biacore测试pd-1结合活性。pd-l1 igv结构域与pd-1结合所需的最少必需氨基酸称为pd-l1-igv。为了产生bb7.2 scfv和pd-l1-igv双特异性分子,合成编码双特异性单链抗体bb7.2 x pd-l1-igv的dna片段,其结构域排列为vl
bb7.2-vh
bb7.2-pd-l1-igv-igg4fc,并被克隆到含有dhfr选择盒的表达载体中。
[1232]
将表达载体质粒dna瞬时转染到293t细胞中,并使用蛋白a/g柱从上清液中纯化bb7.2 x pd-l1-igv双特异性抗体。通过聚丙烯酰胺凝胶评估bb7.2 x pd-l1-igv双特异性抗体的完整性。通过elisa和基于细胞的facs测定评估bb7.2 scfv结构域与hla-a2的结合以及pd-l1-igv结构域与pd-1的结合。
[1233]
使用混合淋巴细胞反应(mlr)测定评估bb7.2 x pd-l1-igv双特异性抗体的体外功能。在96孔板形式中,将来自hla-a2
+
供体的100,000个经辐射的人pbmc等分到每个孔,并用作活化剂。然后将hla-a1-应答t细胞与增加量的bb7.2 x pd-l1-igv双特异性抗体一起加入。通过brdu掺入评估应答t细胞在72小时内增殖的能力,并且其中通过elisa评估在共培养上清液中额外估计ifng和il2细胞因子产生。发现bb7.2 x pd-l1-igv双特异性抗体抑制mlr反应,如通过抑制hla-a2-应答t细胞增殖和细胞因子产生证明的。
[1234]
使用皮肤同种异体移植物耐受的小鼠模型评估bb7.2 x pd-l1-igv双特异性抗体
的体内功能。使c57bl/6-tg(hla-a2.1)1enge/j(jackson laboratories,巴港(bar harbor),缅因州(maine))小鼠品系与balb/cj杂交,其中f1后代表达hla-a2.1转基因并作为同种异体移植物供体。将c57bl/6j小鼠剃毛并通过手术移植从安乐死的c57bl/6-tg(hla-a2.1)1enge/j x balb/cj f1小鼠中取出的皮肤。同时,宿主小鼠开始接受被工程化以包含鼠igg1 fc的bb7.2 x pd-l1-igv双特异性抗体,或者仅bb7.2或仅pd-l1-igv对照的腹腔内注射。监测皮肤同种异体排斥或认可30天,其中对宿主实施安乐死,并对淋巴结和同种异体移植物驻留淋巴细胞群进行量化。
[1235]
实施例2:cd39和/或cd73作为效应物结构域在感兴趣的细胞类型或组织周围产生嘌呤能光晕
[1236]
将cd39和/或cd73的催化活性片段与靶向结构域融合。在靶位点结合和积累后,cd39将atp磷酸水解为amp。在靶位点结合和积累后,cd73将细胞外amp去磷酸化为腺苷。已发现适用于本文的cd39的可溶性催化活性形式在人和鼠血液中循环,参见例如yegutkin et al.faseb j.2012 sep;26(9):3875-83。可溶性重组cd39片段也描述于以下中:inhibition of platelet function by recombinant soluble ecto-adpase/cd39,gayle,et al.,j clin invest.1998 may 1;101(9):1851
–
1859。合适的cd73分子包括cd73的可溶性形式,其可以通过蛋白水解切割或剪切应力对gpi锚的水解而从内皮细胞膜脱落,参见例如参考文献:yegutkin g,bodin p,burnstock g.effect of shear stress on the release of soluble ecto-enzymes atpase and 5
’‑
nucleotidase along with endogenous atp from vascular endothelial cells.br j pharmacol 2000;129:921
–
6。
[1237]
atp到amp或amp到腺苷的局部催化将耗尽暴发性t效应细胞功能所需的局部能量储存。treg功能不应受到atp耗尽的影响,因为它们依赖氧化磷酸化来满足能量需求(需要较少的atp),其中t记忆和其他效应细胞应受到影响,因为它们依赖糖酵解(需要高atp使用)来实现暴发性功能。
[1238]
实施例3:测量抗体诱导的pd-1信号传导。
[1239]
jurkat细胞稳定表达2种构建体,1)与b-半乳糖苷酶融合的人pd-1多肽,其可以称为“酶供体”和2)与b-半乳糖苷酶融合的shp-2多肽,其可称为“酶受体”pd-1抗体与细胞接触,并且当pd-1接合时,shp-2被募集到pd-1。酶受体和酶供体形成可以被测定的完全活性的b-半乳糖苷酶。该测定可以用于显示pd-1信号传导的激活。
[1240]
实施例4:测量pd-1激动。pd-1激动剂抑制t细胞激活。不受任何特定理论的束缚,pd-1激动抑制抗cd3诱导的t细胞激活。将人或小鼠细胞用pha(对于人t细胞)或cona(对于小鼠t细胞)进行预激活,使得它们表达pd-1。然后在抗pd-1(或pd-l1)的存在下,用抗cd3“重新激活”t细胞以用于pd-1激动测定。相对于单独的抗cd3刺激,在存在抗cd3的情况下接收pd-1激动剂信号传导的t细胞将显示出降低的激活。激活可以通过增殖或细胞因子产生(il-2、ifng、il-17)或可能其他标志物(诸如cd69活化标志物)读取出。
[1241]
实施例5:抗madcam/小鼠pd-l1融合蛋白的表达和功能不受分子构型的影响。
[1242]
包括抗小鼠madcam ab/小鼠pd-l1分子的双特异性融合分子以两个方向表达。第一方向由以下组成:抗小鼠madcam igg与在其重链c末端融合的小鼠pd-l1。第二方向由以下组成:在ig fc结构域n末端融合的小鼠pd-l1与在c末端融合的抗小鼠madcam scfv。发现这两种分子在哺乳动物表达体系中都能很好地表达。还发现这些分子可以同时在两个方向
上与其各自的结合配偶体madcam或pd-1结合。这些结果表明,由与pd-l1融合的抗madcam抗体组成的分子可以以其中pd-l1在n末端或c末端与fc融合并保留适当的功能结合活性的构型表达。
[1243]
简而言之,将含有编码单个多肽的单个基因的ptt5载体转染到hek293expi细胞中,该单个多肽具有与人igg1 fc结构域的n末端融合的小鼠pd-l1和c末端融合的抗madcam scfv meca-89。或者,两种质粒以等摩尔比共转染。第一质粒编码meca-89的轻链,并且第2质粒编码具有c末端融合的小鼠pd-l1的meca-89的全长igg1重链。5-7天后,收获表达分子的细胞培养上清液,并通过经由0.22um过滤装置的离心和过滤澄清。将双特异性分子捕获在proa树脂上。将树脂用pbs ph 7.4洗涤,并将捕获的分子用100mm甘氨酸ph 2.5洗脱,用十分之一体积的1m tris ph 8.5中和。蛋白质是更换为pbs ph 7.4的缓冲液,并在superdex 200 3.2/300上通过尺寸排阻色谱法进行分析。在bis-tris 4-12%凝胶上通过还原和非还原sds-page进行对1ug纯化材料的分析。
[1244]
两种蛋白质,无论方向如何,均以超过10mg/l表达,并且在纯化后均是超过95%单分散的,如通过尺寸排阻色谱和还原/非还原sds-page所示的。因此,这证明了在fc结构域的n和c末端具有不同免疫调节剂和组织靶向部分的双功能双特异性分子的产生和活性。这也特别表明pd-1激动剂和结合配偶体可以在ig fc结构域的n或c末端表达。
[1245]
实施例6:包括与madcam拴系的pd-1激动剂原型的双特异性分子可以同时结合madcam和pd-1。
[1246]
简而言之,将免疫吸附板用pbs ph 7.4中的浓度的小鼠pd-1以75ul/孔涂覆过夜,并且在4℃孵育过夜。将孔用含有0.05%tween-20的pbs ph 7.4(洗涤缓冲液)洗涤三次,以及然后用200ul/孔的pbs ph 7.4中的1%bsa(封闭缓冲液)在室温下封闭两小时。在用洗涤缓冲液洗涤三次后,将在n末端或c末端包括pd-1激动剂原型的两种双特异性分子在含有1%bsa和0.05%tween-20的pbs(测定缓冲液)中稀释至1nm、10nm和100nm。将稀释的材料以75ul/孔添加到小鼠pd-1涂覆的板中,在室温下持续1小时。用洗涤缓冲液洗涤三次后,将在测定缓冲液中为10nm的浓度的小鼠madcam以75ul/孔添加到板中,在室温下持续1小时。用洗涤缓冲液洗涤三次后,将在测定缓冲液中稀释至的山羊生物素化抗小鼠madcam多克隆抗体以75ul/孔添加到板中,在室温下持续1小时。用洗涤缓冲液洗涤三次后,将在测定缓冲液中以1:5000稀释的高灵敏度链霉亲和素hrp以75ul/孔添加到板中,在室温下持续15分钟。用洗涤缓冲液洗涤三次并用洗涤缓冲液(不含tween-20)洗涤1次后,将测定用tmb显色,并用1n hcl终止。测量od 450nm。实验包括在不存在小鼠pd-1的情况下与板/块的非特异性结合的适当对照,以及无madcam对照和单特异性对照,它们无法在小鼠pd-1和小鼠madcam之间形成桥接。
[1247]
结果表明,在1nm、10nm和100nm的浓度下,这两种双特异性分子能够同时与小鼠madcam和小鼠pd-l1相互作用,而单特异性对照不产生桥接信号。此外,当板表面上不存在小鼠pd-1时,在任何测试浓度下,均不存在任何化合物与madcam的结合,表明没有任何测试化合物与板表面发生非特异性相互作用。因此,这些结果表明,靶向结合madcam和pd-1二者的双特异性分子可以成功结合这两种分子。虽然实验是用pd-l1作为pd-1抗体的替代品进行的,但预计pd-1抗体将以类似的方式发挥作用。
[1248]
实施例7:在pd-1激动剂测定中双特异性pd-l1原型分子抑制t细胞。
[1249]
对模拟pd-1激动剂抗体的双特异性分子进行了测试,以证明pd-1激动可以抑制t细胞。简而言之,处死7周龄雌性c57lb/6小鼠并分离它们的脾细胞。将脾细胞暴露于cona3天,以及然后在存在或不存在pd-1型分子的情况下暴露于抗cd3,在本实施例中,该分子为使用抗人igg栓系至板的pd-l1双特异性分子。然后将t细胞引入到pd-l1双特异性分子。发现模拟pd-1抗体的pd-l1是t细胞激动剂并抑制t细胞激活。使用与抗madcam抗体融合的pd-l1双特异性分子重复相同的实验,抗madcam抗体通过与用madcam包被的板的相互作用而栓系至板。发现pd-1激动剂模拟物pd-l1/抗madcam抗体是t细胞活性的有效激动剂。这些结果表明,当分子被通过分子末端的madcam抗体组分捕获时,模拟pd-1抗体/madcamab融合蛋白的双特异性分子可以对原代小鼠t细胞母细胞发挥功能性抑制信号。
[1250]
实施例8:在pd-1激动剂测定中,具有不同组织拴系的双特异性pd-1原型分子可以抑制t细胞。pd-l1的融合分子被用作pd-1抗体的替代品,并与i类h-2kk抗体连接。mhc i类h-2kk栓系的pd-l1分子具有功能性结合,类似于实施例6和7中描述的数据。简而言之,将来自c57bl/6小鼠的脾细胞用伴刀豆球蛋白a(cona)和il-2刺激3天。将板在4c下用抗cd3(2c11)涂覆过夜,洗涤。将板在37c用抗人igg涂覆3小时并洗涤。添加单特异性抗h-2kk(16-3-22)或双特异性抗h-2kk:mpd-l1并在37c下孵育3小时并洗涤。所有测试物品都包含人igg1-fc部分。添加pbs(无tx)以确定测定背景。将cona母细胞洗涤2次,添加到板中并在37c下孵育。24小时后去除上清液。通过msd确定ifng水平。48小时后,通过cell titer-glo分析细胞活力/代谢。当通过igg fc结构域捕获时,mhc i类栓系的pd-l1双特异性可以在小鼠pd-1激动测定中减弱t细胞激活。因此,该实施例证明,当分子通过不同的组织拴系(在这种情况下是mhc i类h-2kk的小鼠抗体)被捕获时,不同的双特异性原型分子可以向原代小鼠t细胞母细胞施加功能性抑制信号传导。因此,该数据证明栓系不是madcam特异性的,并且可以充当本文提供的靶向部分的其他分子是可能的。
[1251]
实施例9:pd-1激动剂可以在jurkat细胞中诱导信号传导
[1252]
将表达与β-半乳糖苷酶供体融合的人pd-1和与β-半乳糖苷酶受体融合的shp-2二者的jurkat细胞添加到板中的测试条件中并孵育2小时。激动剂pd-1抗体诱导信号传导和shp-2募集、酶互补和活性β-半乳糖苷酶的形成。添加β-半乳糖苷酶底物并且可以在标准发光读板器上测量化学发光。通过化学发光测量激动作用,其中测量的化学发光越多表明激动作用越大。
[1253]
在该测定中测量了pd-1/madcam双特异性分子的激动作用。cl10(ucb)和cc-90006(celgene/anaptys)用作pd-1激动剂抗体。在ig捕获测定形式的功能测定中,两者均具有活性并表现出pd-1激动作用。简而言之,将板在4c下用抗人igg涂覆过夜并洗涤。添加抗破伤风毒素(tt)或基准激动剂抗pd-1单克隆抗体cl10或cc-90006,并在37c下孵育1小时并洗涤。所有测试物品都包含人igg1-fc。添加培养基(无tx)以确定测定背景。将板洗涤3次。添加表达与b-半乳糖苷酶供体融合的人pd-1和与b-半乳糖苷酶受体融合的shp-2二者的jurkat细胞中并孵育2小时。激动剂pd-1抗体诱导信号传导和shp-2募集、酶互补和活性b-半乳糖苷酶的形成。添加b-半乳糖苷酶底物并且在标准发光读板器上测量化学发光。在改良的jurkat报告基因测定中,两种人pd-1激动剂抗体(cl10和cc-90006)结合并诱导信号传导(用于激动作用的替代物)。因此,该测定是一种功能性pd-1激动测定。cl10:meca89(meca89是已知的madcam抗体)是一种新型双特异性分子,通过将madcam抗体meca89[scfv]
与cl10重链的c末端融合而产生。当通过igg fc结构域捕获时,发现该融合蛋白具有活性并在功能测定中表现出pd-1激动作用,仅cl10蛋白也是如此。然而,仅cl10:meca89在使用madcam蛋白作为捕获物的功能测定形式中具有活性(单特异性组分不发出信号传导)。
[1254]
简而言之,将板在4c下用抗人igg或重组mmadcam-1涂覆过夜并洗涤。添加单特异性抗破伤风毒素(tt)、抗madcam-1(meca89)或激动剂抗pd-1(cl10)或双特异性cl10:meca89,并在37c下孵育1小时并洗涤。所有测试物品都包含人igg1-fc部分。添加pbs(无tx)以确定测定背景。将板洗涤2次。添加表达与b-半乳糖苷酶供体融合的人pd-1和与b-半乳糖苷酶受体融合的shp-2二者的jurkat细胞中并孵育2小时。激动剂pd-1抗体诱导信号传导和shp-2募集、酶互补和活性b-半乳糖苷酶的形成。添加b-半乳糖苷酶底物并且在标准发光读板器上测量化学发光。结果:当板用抗igg fc捕获涂覆时,cl10和madcam栓系的cl10双特异性分子两者都可以在jurkat报告基因测定中诱导pd-1信号传导,但当板用重组madcam蛋白涂覆时,仅madcam栓系的双特异性可以在报告基因测定中诱导pd-1信号传导。这些结果表明,与madcam栓系并包含pd-1激动剂抗体的分子是功能性的,这与用pd-l1作为pd-1激动剂替代物所显示的结果相似。
[1255]
实施例10:pd-1激动剂抗体的产生
[1256]
在条件下将pd-1缺陷小鼠用小鼠pd-1进行免疫以产生针对pd-1的免疫应答。产生并鉴定了与小鼠pd-1结合的54个杂交瘤。根据实施例4和6中描述的方法分析由不同杂交瘤产生的抗体的t细胞激动作用。在54个杂交瘤中至少有6个被鉴定为pd-1激动剂。还测试了抗体与pd-1的结合,并发现在与pd-l1结合位点相同的位点结合。
[1257]
简而言之,使用以下测定确定与pd-l1结合位点的结合。免疫吸附板用1x pbs,ph 7.4中的75μl的重组小鼠pd-l1-fc(2μg/ml)涂覆过夜。然后将板用1x pbs洗涤3次并在室温下用补充有1%bsa的1x pbs封闭2小时。将重组小鼠pd-1-fc(1nm)与100nm的指示的抗小鼠pd-1抗体一起在补充有1%bsa和0.05%tween20的1x pbs(测定缓冲液)中在室温下孵育1小时,摇动。封闭后,将板用补充有0.05%tween20 pbst的1x pbs洗涤3次,并将抗体-pd-1缀合物与板结合的小鼠pd-l1孵育。用pbst洗掉未结合的pd-1后,将板与75μl的生物素化的多克隆抗pd-1抗体(0.5μg/ml)在测定缓冲液中孵育,然后用也在检测定冲液中稀释的1:5000链霉亲和素hrp进行扩增。将板用pbst洗涤三次,然后用1x pbs洗涤三次,然后添加100μl tmb然后添加100μl 1m hcl以停止显影。在450nm下读取吸光度并相对于不存在抗体时pd-1与pd-l1的结合进行归一化。结果表明活性抗体与pd-l1结合位点结合。无活性抗体不与pd-l1结合位点结合。因此,除了本文描述的先前鉴定的pd-1激动剂抗体外,该实施例证明了产生作为激动剂的抗pd-1抗体的能力。
[1258]
实施例11:栓系的抗pd-1抗体充当pd-1激动剂。
[1259]
人抗体scfv噬菌体文库在迭代选择轮次中针对重组人、小鼠和食蟹猴pd-1蛋白进行淘选,以富集识别所有上述三种物种pd-1直系同源物的抗体克隆。scfv克隆以nt-vh-接头-vl-ct形式配置,并通过piii外壳蛋白与m13噬菌体表面融合。选择后,筛选克隆scfv与cho细胞表面表达的人、小鼠和食蟹猴pd-1的结合。使用标准分子生物学技术将发现对所有三种细胞表面表达的pd-1物种直系同源物具有交叉反应性的克隆转化为人igg1形式,其中每个分子总共由四个多肽链(2个重链和2个轻链)构成。如所提供的,两条轻链彼此相同,并且两条重链彼此相同。
[1260]
两条相同的重链均二聚化并且两条相同的轻链与每条重链配对以形成完整的人igg1。fc结构域包含l234a、l235a和g237a突变以消除相互作用。转化的人igg1抗pd-1抗体在hek293expi细胞中转染和表达,并通过蛋白a色谱法纯化。使用纳米滴分光光度计结合抗体特异性消光系数确定蛋白质浓度。在pbs ph 7.4中配制抗体。
[1261]
接下来在本文所述的jurkat测定中测试抗pd-1抗体的激动剂活性。简而言之,组织培养板用抗igg涂覆或不包被。对于捕获形式,将测试制品或对照以100nm、25nm或12.5nm添加到抗igg涂覆的孔中,并在37c下孵育3小时。洗涤板并添加jurkat pd-1细胞。对于可溶性形式,将可溶性测试制品或对照以100nm、25nm或12.5nm添加到已经含有jurkat pd1细胞的孔中。在读板器中测量发光。结果表明,当抗pd-1抗体通过抗igg捕获时,十二种人/小鼠交叉反应性pd-1抗体中有九种在jurkat测定中显示出剂量依赖性活性,但在可溶性形式中没有。该数据表明,抗pd-1抗体在通过靶向部分栓系到其靶标时可以作为激动剂。
[1262]
总之,不受任何特定理论的束缚,本文提供的数据证明pd-1激动剂/madcam双特异性分子可以结合madcam和pd-1二者并且还激动t细胞活性。因此,该分子可以用于治疗本文提供的各种病症并提供局部和/或组织特异性免疫调节以及t细胞应答的下调。
[1263]
实施例12:il-2突变蛋白的产生
[1264]
将包含编码在n末端(seq id no:57)或c末端(seq id no:58)与人igg1 fc结构域融合的人il-2m多肽的单个基因的ptt5载体转染到hek293expi细胞中。5-7天后,收获表达il-2m的细胞培养上清液,并通过经由0.22um过滤装置的离心和过滤澄清。将il-2m捕获在proa树脂上。将树脂用pbs ph 7.4洗涤,并且捕获的蛋白质用0.25%乙酸ph 3.5洗脱,用十分之一体积的1m tris ph 8.0中和。将蛋白质缓冲液更换为30mm hepes 150mm nacl ph 7,并在superdex 200 3.2/300柱上通过尺寸排阻色谱法进行分析。在bis-tris 4-12%凝胶上通过还原和非还原sds-page进行对5ug纯化材料的分析。il-2m以超过10mg/l表达,并且在纯化后均是超过95%单分散的,如通过尺寸排阻色谱法和还原/非还原sds-page所示的。
[1265]
实施例13:il-2m分子可以结合cd25
[1266]
将免疫吸附板用pbs ph 7.4中的浓度的cd25以75ul/孔涂覆过夜,并且在4℃孵育过夜。将孔用含有0.05%tween-20的pbs ph 7.4(洗涤缓冲液)洗涤三次,以及然后用200ul/孔的pbs ph 7.4中的1%bsa(封闭缓冲液)在室温下封闭两小时。用洗涤缓冲液洗涤三次后,将实施例12的il-2m分子在含有1%bsa和0.05%tween-20的pbs(测定缓冲液)中稀释至十一-二倍连续稀释,其中2nm是最高浓度。将稀释的材料以75ul/孔添加到cd25涂覆的板中,在室温下持续1小时。用洗涤缓冲液洗涤三次后,将在测定缓冲液中稀释至的山羊生物素化抗il-2多克隆抗体以75ul/孔添加到板中,在室温下持续1小时。用洗涤缓冲液洗涤三次后,将在测定缓冲液中以1:5000稀释的高灵敏度链霉亲和素hrp以75ul/孔添加到板中,在室温下持续15分钟。用洗涤缓冲液洗涤三次并用洗涤缓冲液(不含tween-20)洗涤1次后,将测定用tmb显色,并用1n hcl终止。测量od 450nm。该实验包括在不存在cd25的情况下用于il-2m分子与板/块的非特异性结合的适当对照和不能结合cd25的阴性对照分子。
[1267]
结果表明,在2nm-1.9pm的浓度下,il-2m分子能够以亚纳摩尔ec50结合cd25。此外,当板表面不存在cd25时,在任何测试浓度下未检测到任何化合物,表明没有任何测试化
合物与板表面发生非特异性相互作用(数据未示出)。
[1268]
实施例14:体外p-stat5测定以确定il-2m分子的效力和选择性。使用ficoll-paque premium和sepmate管从新鲜分离的肝素化人全血中制备外周血单核细胞(pbmc)。在野生型il-2或实施例12的il-2m存在下,将pbmc在10%胎牛血清rpmi培养基中培养20分钟,以及然后用bd cytofix固定10分钟。
[1269]
固定的细胞依次用bd perm iii,以及然后用biolegend foxp3透化缓冲液透化。用人血清封闭10分钟后,将细胞用磷酸-stat5fitc、cd25pe、foxp3af647和cd4percp cy5.5的抗体染色30分钟,然后在带有读板器的attune nxt上采集。实施例12的il-2m有效且选择性地诱导treg而非teff中的stat5磷酸化。
[1270]
实施例15:用于产生双特异性madcam栓系的il-2m分子的方法
[1271]
将包含编码单个b0001多肽的单个基因的ptt5载体转染到hek293expi细胞中,该多肽包括用ggggsggggsggggs(seq id no:30)接头与本文提供的具有lala突变的fc蛋白融合的具有n88d、v69a和q74p突变的il-2突变蛋白,以及用ggggsggggsggggsggggs(seq id no:22)接头与madcam或类似分子结合的scfv抗体,b0002,其具有在n末端与人igg1 fc结构域融合的人il-2m和c末端融合的抗mmadcam scfv meca-89。对于b0003,两种质粒以等摩尔比共转染。第一质粒编码meca-89的轻链,并且第2质粒编码具有c末端融合的人il-2m的meca-89的全长igg1重链。5-7天后,收获表达b0001、b0002和b0003的细胞培养上清液,并通过经由0.22um过滤装置的离心和过滤澄清。将b0001、b0002和b0003捕获在proa树脂上。将树脂用pbs ph 7.4洗涤,并且捕获的蛋白质用0.25%乙酸ph 3.5洗脱,用十分之一体积的1m tris ph 8.0中和。将蛋白质缓冲液更换为30mm hepes 150mm nacl ph 7,并在superdex 200 3.2/300上通过尺寸排阻色谱法进行分析。在bis-tris 4-12%凝胶上通过还原和非还原sds-page进行对1ug纯化材料的分析。
[1272]
b0001、b0002和b0003以超过8mg/l表达,并且在纯化后均是超过95%单分散的,如通过尺寸排阻色谱法和还原/非还原sds-page所示的。该实验表明,可以产生在n末端或c末端带有免疫调节剂的双功能双特异性分子,并且il-2m蛋白的位置(在n末端或c末端)不会显著改变表达,以及因此,任何一种形式都可以使用。
[1273]
实施例16:双特异性madcam栓系il-2m分子可以同时结合madcam和cd25
[1274]
将免疫吸附板用pbs ph 7.4中的浓度的重组小鼠madcam-1以75ul/孔涂覆过夜,并且在4℃孵育过夜。将孔用含有0.05%tween-20的pbs ph 7.4(洗涤缓冲液)洗涤三次,以及然后用200ul/孔的pbs ph 7.4中的1%bsa(封闭缓冲液)在室温下封闭两小时。用洗涤缓冲液洗涤三次后,将b0001、b0002、b0003在含有1%bsa和0.05%tween-20的pbs(测定缓冲液)中稀释至1nm、10nm和100nm。将稀释的材料以75ul/孔添加到小鼠madcam-1涂覆的板中,在室温下持续1小时。用洗涤缓冲液洗涤三次后,将在测定缓冲液中为10nm的浓度的人cd25以75ul/孔添加到板中,在室温下持续1小时。用洗涤缓冲液洗涤三次后,将在测定缓冲液中稀释至的山羊生物素化抗人cd25多克隆抗体以75ul/孔添加到板中,在室温下持续1小时。用洗涤缓冲液洗涤三次后,将在测定缓冲液中以1:5000稀释的高灵敏度链霉亲和素hrp以75ul/孔添加到板中,在室温下持续15分钟。用洗涤缓冲液洗涤三次并用洗涤缓冲液(不含tween-20)洗涤1次后,将测定用tmb显色,并用1n hcl终止。测量od 450nm。实验包括在不存在小鼠madcam-1的情况下实施例15的蛋白质与板/块的非特异性结
合的适当对照,以及无cd25对照和单特异性对照,它们无法在人cd25和小鼠madcam之间形成桥接。
[1275]
发现在1nm、10nm和100nm的浓度下,实施例15的双特异性分子能够同时与小鼠madcam和人cd25相互作用,而单特异性对照不产生桥接信号传导。此外,当板表面上不存在小鼠madcam-1时,在任何测试浓度下,均不存在任何化合物与cd25的结合,表明没有任何测试化合物与板表面发生非特异性相互作用。这些结果表明双特异性分子可以在功能结合测定(诸如elisa)中同时结合madcam和cd25两者。
[1276]
实施例17:体外p-stat5测定证明双特异性madcam栓系的il-2m当在溶液中或栓系时的活性和选择性
[1277]
将重组小鼠madcam在96孔高结合板(corning)的孔上涂覆过夜。用pbs洗涤2次后,将板用10%fbs rpmi培养基封闭1小时。捕获实施例15的madcam栓系的il-2m双特异性或未栓系的il-2m对照(诸如实施例12中制备的那些)1小时。用pbs洗涤2次后,用捕获的il-2m或用于比较溶液中的il-2m刺激新鲜分离的人pbmc 60分钟。然后将细胞用bd cytofix固定10分钟,依次用bd perm iii和biolegend foxp3透化缓冲液透化,用人血清封闭,并用抗磷酸-stat5fitc(cst)、cd25pe、foxp3af647和cd4percp cy5.5(bd)的抗体染色30分钟并在带有读板器的attune nxt采集。在溶液中,两种分子具有的对treg与teff的活性和选择性相当。用小鼠madcam涂覆的板能够捕获实施例15的双特异性分子并且捕获/固定的双特异性分子仍然能够相对于t
eff
选择性地激活t
reg
。本实施例证明,madcam栓系的il-2m分子在溶液中或被捕获/固定时可以保持生物活性和选择性。
[1278]
实施例18:il-2突变蛋白的免疫原性
[1279]
使用netmhciipan 3.2软件分析il-2突变蛋白序列,该软件可在www“dot”cbs“dot”dtu“dot”dk/services/netmhciipan/中找到。人工神经网络用于确定肽对mhc ii类等位基因的亲和力。在该分析中,与mhc ii类分子潜在直接相互作用的9个残基肽被识别为结合核心。与结合核心相邻的残基具有间接影响结合的潜力,也作为掩蔽残基进行了检查。当它们对mhc ii类分子的预测kd低于50nm时,包括结合核心和掩蔽残基两者的肽被标记为强结合剂。强结合剂更有可能引入t细胞免疫原性。
[1280]
在计算机分析中总共包括了在北美和欧洲具有高度代表性的9个mhcii等位基因。测试的il-2m(il-2突变蛋白)分子的组包括具有l53i、l56i、l80i或l118i突变的il-2突变蛋白。仅mhcii等位基因drb1_1101、drb1_1501、drb1_0701和drb1_0101与任何评估的分子产生命中。drb_1501的肽命中在所有测试构建体之间是相同的,包括具有c125s突变的野生型il-2。l80i的添加去除了drb1-0101的1个t细胞表位[alnlapsknfhlrpr(seq id no:626)],并适度降低了其他两个t细胞表位[eealnlapsknfhlr(seq id no:627)和ealnlapsknfhlrp(seq id no:628)]的亲合力。对于mhcii等位基因drb1-0701,l80i去除1个t细胞表位[eealnlapsknfhlr(seq id no:627)]。因此,数据表明包括l80i突变的il-2突变蛋白应该具有较低的免疫原性,这是来自计算机分析的令人惊讶和出乎意料的结果。
[1281]
实施例19:额外的il-2突变蛋白的产生
[1282]
将包含单个基因的ptt5载体转染到hek293expi细胞中,该基因编码seq id no:53、seq id no:54、seq id no:55、seq id no:56的单个il-2m(il-2突变蛋白)(以及il-2m对照;seq id no:50)多肽,该多肽具有在n末端与人igg1 fc结构域融合的人il-2m。5-7天
后,收获表达seq id no:53、seq id no:54、seq id no:55、seq id no:56(和il-2m对照;seq id no:50)的细胞培养上清液,并通过经由0.22um过滤装置的离心和过滤澄清。将seq id no:53、seq id no:54、seq id no:55、seq id no:56(和il-2m对照;seq id no:50)捕获在proa树脂上。将树脂用pbs ph 7.4洗涤,并且捕获的蛋白质用0.25%乙酸ph 3.5洗脱,用十分之一体积的1m tris ph 8.0中和。将蛋白质缓冲液更换为30mm hepes 150mm nacl ph 7,并在superdex 200 3.2/300柱上通过尺寸排阻色谱法进行分析。在bis-tris 4-12%凝胶上通过还原和非还原sds-page进行对5ug纯化材料的分析。
[1283]
il-2m seq id no:53、seq id no:54、seq id no:55、seq id no:56(以及il-2m对照;seq id no:50)以超过45mg/l表达,并且在纯化后均是超过95%单分散的,如通过尺寸排阻色谱法和还原/非还原sds-page所示的。
[1284]
实施例20:实施例19的il-2m可以结合cd25
[1285]
将免疫吸附板用pbs ph 7.4中的浓度的cd25以75ul/孔涂覆过夜,并且在4℃孵育过夜。将孔用含有0.05%tween-20的pbs ph 7.4(洗涤缓冲液)洗涤三次,以及然后用200ul/孔的pbs ph 7.4中的1%bsa(封闭缓冲液)在室温下封闭两小时。用洗涤缓冲液洗涤三次后,将il-2m seq id no:53、seq id no:54、seq id no:55、seq id no:56在含有1%bsa和0.05%tween-20的pbs(测定缓冲液)中稀释至十一-二倍连续稀释,其中2nm是最高浓度。将稀释的材料以75ul/孔添加到cd25涂覆的板中,在室温下持续1小时。用洗涤缓冲液洗涤三次后,将在测定缓冲液中稀释至的山羊生物素化抗il-2多克隆抗体以75ul/孔添加到板中,在室温下持续1小时。用洗涤缓冲液洗涤三次后,将在测定缓冲液中以1:5000稀释的高灵敏度链霉亲和素hrp以75ul/孔添加到板中,在室温下持续15分钟。用洗涤缓冲液洗涤三次并用洗涤缓冲液(不含tween-20)洗涤1次后,将测定用tmb显色,并用1n hcl终止。测量od 450nm。该实验包括在不存在cd25的情况下用于分子与板/块的非特异性结合的适当对照。结果表明,在2nm-1.9pm的浓度下,实施例19的突变蛋白能够以亚纳摩尔ec50结合cd25。此外,当板表面不存在cd25时,在任何测试浓度下未检测到任何化合物,表明没有任何测试化合物与板表面发生非特异性相互作用。因此,实施例19的突变蛋白可以结合cd25。
[1286]
实施例21:实施例19的il-2突变蛋白是有效力的和选择性的
[1287]
使用ficoll-paque premium和sepmate管从新鲜分离的肝素化人全血中制备外周血单核细胞(pbmc)。在野生型il-2或实施例19的突变存在下,将pbmc在10%胎牛血清rpmi培养基中培养20分钟,以及然后用bd cytofix固定10分钟。固定的细胞依次用bd perm iii,以及然后用biolegend foxp3透化缓冲液透化。用人血清封闭10分钟后,将细胞用磷酸-stat5fitc(cst)、cd25pe、foxp3af647和cd4percp cy5.5(所有bd)的抗体染色30分钟,然后在带有读板器的attune nxt上采集。发现实施例19的il-2突变蛋白是有效力的并且相对于teff对treg具有选择性。发现包括l118i突变的突变蛋白与其他突变蛋白相比具有增加的活性和选择性。
[1288]
实施例22:il-2突变蛋白在人源化小鼠中扩增treg
[1289]
用人cd34+造血干细胞人源化的nsg小鼠购自jackson labs。在第0天和第7天,向小鼠皮下给药1ug的il-2突变蛋白(seq id no:50)或其他il-2突变蛋白seq id no:53、seq id no:54、seq id no:55或seq id no:56。在第7天,对小鼠实施安乐死并收集全血和脾脏。
将全血等分到96孔深孔板中,并使用bd fix lyse固定10分钟。使用70um过滤器(bd)分离脾细胞,并使用来自biolegend的rbc裂解缓冲液裂解红细胞。用2%胎牛血清pbs洗涤后,将脾细胞用近红外活死染料(invitrogen)标记20分钟,以及然后使用biolegend固定缓冲液固定20分钟。然后将全血细胞和脾细胞两者使用biolegend foxp3透化缓冲液进行透化,用人血清封闭,并用抗人cd8a fitc(bl)、人cd25pe(bd)、人foxp3af647(bd)cd4percp cy5.5(bd)、人siglec-8pe cy7(bl)、人cd3bv421(bl)、人cd45bv605(bl)、人cd56bv785(bl)和小鼠cd45(bv711)的抗体染色30分钟,并在具有读板器的attune nxt上采集。
[1290]
与载剂对照相比,il-2m seq id no:54和seq id no:56选择性诱导小鼠脾脏和全血中的treg(通过具有dunn's多重比较检验的anova,p《0.0005)。其他il-2m也增加了treg的频率,尽管与载剂组相比这些变化没有统计学意义。cd56pos nk细胞、cd3pos t细胞、cd8pos细胞毒性t淋巴细胞、cd4pos辅助性t细胞或cd25lo/foxp3neg t效应物在给药seq id no:54和seq id no:56的小鼠中的频率没有显著变化。这些结果证明il-2突变蛋白增加了调节性t细胞的频率。
[1291]
实施例23:双特异性mmadcam栓系的il-2m分子的产生
[1292]
产生了双特异性madcam-il-2突变蛋白,其中该抗体是meca89的重链和轻链。这是使用以等摩尔比共转染编码重链和轻链的两种质粒产生的。第一质粒编码meca-89的轻链,并且第二质粒编码在c末端与包括l118i突变的人il-2m融合的meca-89的全长igg1重链。3-5天后,收获表达双特异性的细胞培养上清液,并通过经由0.22um过滤装置的离心和过滤澄清。将双特异性捕获在proa树脂上。将树脂用pbs ph 7.4洗涤,并且捕获的蛋白质用0.25%乙酸ph 3.5洗脱,用十分之一体积的1m tris ph 8.0中和。将蛋白质缓冲液更换为30mm hepes 150mm nacl ph 7,并在advancebio sec柱上通过尺寸排阻色谱法进行分析。在bis-tris 4-12%凝胶上通过还原和非还原sds-page进行对1ug纯化材料的分析。
[1293]
双特异性分子以17mg/l表达,并且在纯化后是超过95%单分散的,如通过尺寸排阻色谱法和还原/非还原sds-page所示的。这些结果表明它能够产生在c末端具有免疫调节剂的双功能双特异性分子。
[1294]
实施例24:madcam抗体的产生。
[1295]
人抗体scfv噬菌体文库在迭代选择轮次中针对重组人、小鼠和食蟹猴madcam蛋白进行淘选,以富集识别所有上述三种物种madcam直系同源物的抗体克隆。scfv克隆以nt-vh-接头-vl-ct形式配置,并通过piii外壳蛋白与m13噬菌体表面融合。选择后,通过elisa筛选克隆scfv与cho细胞表面表达的人、小鼠和食蟹猴madcam的结合。使用标准分子生物学技术或基因合成将发现对所有三种细胞表面表达的madcam物种直系同源物具有交叉反应性的克隆转化为人igg1形式,其中每个分子总共由四个多肽链(2个重链和2个轻链)构成。两条轻链彼此相同,并且两条重链彼此相同。两条相同的重链(1和2)均二聚化并且两条相同的轻链(3和4)与每条重链配对以形成完整的人igg1。fc结构域包含l234a、l235a和g237a突变以消除相互作用。形式可以表示如下:
[1296]
链1:nt-vh1-ch1-ch2-ch3-ct
[1297]
链2:nt-vh1-ch1-ch2-ch3-ct
[1298]
链3:nt-vk1-ck-ct
[1299]
链4:nt-vk1-ck-ct
no:54或seq id no:53的il-2突变蛋白。这些结果表明il-2可以在treg中诱导持久和选择性的信号传导,这将导致更大的体内treg扩增,并允许减少给药频率以实现treg扩增。
[1311]
实施例27:体外p-stat5测定证明双特异性hu.madcam栓系的il-2muteins当在溶液中或栓系时的活性和选择性
[1312]
将重组人madcam在96孔高结合板(corning)的孔上涂覆过夜。用pbs洗涤2次后,将板用10%fbs rpmi培养基封闭1小时。捕获madcam栓系的il-2m突变蛋白双特异性或未栓系的il-2m对照1小时。用pbs洗涤2次后,用捕获的il-2mm或用于比较溶液中的il-2mm刺激新鲜分离的人pbmc 60分钟。然后将细胞用bd cytofix固定10分钟,依次用bd perm iii和biolegend foxp3透化缓冲液透化,用人血清封闭,并用抗磷酸-stat5fitc(cst)、cd25 pe、foxp3 af647和cd4 percp cy5.5(bd)的抗体染色30分钟并在带有读板器的attune nxt采集。
[1313]
结果:在溶液中,与人madcam栓系的il-2m双特异性和对照具有的对treg与teff的活性和选择性相当。用madcam涂覆的板能够捕获双特异性,并且捕获/固定的双特异性仍然能够相对于teff选择性激活treg。本实施例表明,靶向人madcam的il-2mm双特异性在溶液中或被捕获/固定时可以保持生物活性和选择性。
[1314]
实施例28:il-2突变蛋白在人treg中诱导pstat5。将来自六名健康供体的肝素化全血的纯化pbmc用il-2突变蛋白的系列稀释液在37c下处理30分钟,所述突变蛋白包括seq id no:59的序列,其中x3是i并且x1、x2和x4是l,或seq id no:59的序列,其中x4是i并且是x1、x2和x3是l。将细胞固定、洗涤、透化和洗涤。将细胞用检测表面标志物和细胞内/核标志物(pstat5和foxp3)两者的抗体染色。在attune nxt细胞仪上收集数据。将treg门控为单核、单峰、cd3pos、cd4pos、cd25hi、foxp3pos。测量了表达磷酸化stat5的门控的treg的百分比。最佳拟合曲线拟合pstat5的剂量反应,并确定ec50值。确定了所有6个供体的平均ec50值,对于seq id no:59的il-2,其中x3是i并且x1、x2和x4式l(37.26
±
7.30;n=16)并且对于seq id no:59的il-2,其中x4是i并且x1、x2和x3式l(23.11
±
5.35;n=15)。数据表明il-2突变蛋白可以在人treg中诱导pstat5。包括seq id no:59的序列的il-2(其中x4是i并且x1、x2和x3是l)比包括seq id no:39的il-2序列更有效,但两者都对多个细胞群具有活性。
[1315]
实施例29:il-2突变蛋白在体外诱导猴pbmc中的pstat5。将来自三个健康猴子的肝素化全血的纯化pbmc用il-2突变蛋白的系列稀释液在37c下处理60分钟,所述突变蛋白包括seq id no:59的序列,其中x3是i并且x1、x2和x4是l,或seq id no:59的序列,其中x4是i并且是x1、x2和x3是l。在il-2突变蛋白处理的最后30min添加荧光染料缀合的抗cd25和抗cd4。将细胞固定、洗涤、透化和洗涤。将细胞用检测表面标志物和细胞内/核标志物(pstat5和foxp3)两者的其余抗体染色。在attune nxt细胞仪上收集数据。将treg门控为单核、单峰、cd4pos、cd25hi、foxp3pos。测量了表达磷酸化stat5的门控的treg的百分比。发现il-2突变蛋白在猴中诱导pstat5。
[1316]
实施例30:il-2突变蛋白在体内诱导扩增treg细胞并诱导treg增殖。在给药seq id no:59的il-2突变蛋白(其中x3是i并且x1、x2和x4是l)或seq id no:59的序列(其中x4是i并且x1、x2和x3是l)(2个时间点/食蟹猴,5只食蟹猴)之前,以及在给药seq id no:59(其中x3是i并且x1、x2和x4是l(5个时间点/食蟹猴,2只食蟹猴)或seq id no:59(其中x4是i并且x1、x2和x3是l)(5个时间点/食蟹猴,3只食蟹猴)之后,从猴(食蟹猴)收集静脉全血到k2edta
管中。将样品分成两份,并且分别对两个facs组进行染色。一个是“treg组”,以及一个是通用免疫表型分型组。在固定和透化之后,裂解rbc并对细胞进行表面和细胞内标志物的染色。对于fac分析,通过advia确定总细胞数/ul。然后用总数/ul和总数的%计算给定亚群的细胞数/ul。对于每只猴,取两次给药前出血的给定细胞类型的平均数/ul的平均值并用于将给药后出血归一化,使得确定“相对于给药前的倍数变化”。为了分析血清细胞因子和趋化因子,将来自k2edta全血的血浆冷冻直至研究结束。趋化因子和细胞因子量通过多重msd测定使用标准对照的连续稀释进行量化。mcp-1和ip-10的平均值和范围在给药前出血中确定。发现两种突变蛋白都能在猴中扩增treg并诱导treg增殖。这些结果表明il-2突变蛋白在类似于人的体内动物模型中发挥作用。还发现两种分子均未显著扩增猴(非人灵长类动物)中的tconv细胞、cd4细胞(t天然)或cd8细胞(细胞毒性t)、nk细胞。还发现两种分子均未显著诱导血清趋化因子。该数据表明,il-2突变蛋白可以扩增treg细胞并诱导treg细胞增殖,而不会导致其他途径的有害扩增或激活。因此,il-2突变蛋白对于treg扩增和增殖具有惊人的效力、有效性和选择性。
[1317]
总之,本文提供的实施方式和实施例证明,可以靶向某些组织的il-2突变蛋白可以按预期发挥作用并用于治疗本文所述的疾病和病症。此外,本文提供的实施例证明了令人惊讶和出乎意料的结果,即包括madcam抗体和il-2突变蛋白的双特异性分子可以起到相对于teff选择性和有效力地激活treg的作用,这表明该分子可以用于治疗或改善本文所述的病症。实施例还证明,当单独使用(或与fc蛋白连接)时,il-2突变蛋白可以起到相对于teff选择性地和有效力地激活treg的作用,如本文所提供的。
[1318]
实施例31:抗体与madcam结合。测试了本文提供的某些抗体与madcam结合的能力。下表提供了针对多种靶标的结合信息和其他活性。测试了scfv或igg形式的抗体与表达madcam的人或小鼠细胞以及与食蟹猴madcam蛋白结合的能力。结果表示为无显著结合的
“‑”
或不同水平的结合(例如,“+”、“++”和“+++”)。
[1319]
[1320]
[1321]
[1322][1323]
[1324]
[1325]
[1326][1327]
实施例32:包括madcam抗体和il-2突变蛋白的双特异性分子在小鼠中sc给药后特异性定位于肠道中的高内皮微静脉(hev)。向小鼠皮下给药未栓系的il-2m或madcam栓系的il-2m。4天后收获肠组织,并对人igg1进行染色(以检测未栓系和栓系的分子的测试制品ig骨架),或针对meca367进行染色(以检测表达madcam的hev)。发现只有madcam栓系的il-2m分子特异性定位于hev,而未栓系的il-2m在相同组织中没有表现出可检测的或显著的定位。
[1328]
实施例33:双特异性madcam-il2m不阻断madcam:α4/β7相互作用,并且因此不影响细胞运输。测试了madcam栓系的il-2m分子以确定它是否阻断了α4/β7整合素与madcam的结合。该测定表明它没有。还发现双特异性因此对细胞运输没有影响。结合活性通过elisa或细胞相互作用测定进行。
[1329]
实施例34:栓系到madcam抗体的il-2m是功能性的。将cho细胞用人或小鼠madcam转染以产生表达madcam的cho细胞,其然后在板上生长。添加测试制品,使其粘合,然后洗掉未附连的测试制品。添加人pbmc,30min后通过facs评估stat5treg的磷酸化是pstat5+,显示被il-2m激活,tconv细胞保持失活,尽管推测细胞表面双特异性的局部浓度很高。
[1330]
实施例35:madcam栓系的il2m在人源化小鼠中的tnbs诱导的结肠炎中改善体重减
轻,类似于低剂量il-2。将小鼠用tnbs d-7增敏,用tnbs d0致敏。从d-7到d3,每天向小鼠给药低剂量的il-2(+ve对照)或载剂(-ve对照)。向小鼠给药madcam栓系的il2m d-7和d0。发现madcam栓系的il2m对体重减轻的减弱类似于ld il-2对体重减轻的减弱。因此,这些结果表明,如前面实施例所述,拴系方法是功能性的,即使它专门定位于hev。
[1331]
实施例22-24中描述的madcam-栓系的il2m的形式是其中madcam组分是在重链的c末端融合的具有il-2突变蛋白部分的igg。然而,il-2突变蛋白如本文所述在其n末端具有fc部分,诸如seq id no:56。双特异性的形式是多链多肽,其可以以下形式表示:重链:nt-[vh_madcam]-[ch1-ch2-ch3]-[接头b]-[il-2_突变蛋白]-ct,其中
[1332]
nt=n末端
[1333]
[vh_madcam]=本文提供的任何vh结构域或包括如表6或表7中描述的cdr1、cdr2或cdr3的vh结构域;
[1334]
[ch1-ch2-ch3]=人igg1恒定重1(ch1)、恒定重2(ch2)和恒定重3(ch3)结构域,其可以具有以下序列:astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapeaagapsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg(seq id no:44);
[1335]
[接头_b]=ggggs(seq id no:23),其也可以是ggggsggggsggggs(seq id no:30);
[1336]
[il-2_突变蛋白]=本文提供的任何il2突变蛋白,包括但不限于seq id no:56;并且
[1337]
ct=c末端。
[1338]
该分子还可以具有以下轻链形式:
[1339]
轻链:nt-[vk_madcam]-[ck]-ct,其中
[1340]
nt=n末端;
[1341]
[vk_madcam]=如表6或表7所示;
[1342]
[ck]=人恒定κ结构域,其可以具有以下序列:
[1343]
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq idno:45);并且
[1344]
ct=c末端。
[1345]
实施例36:测试各种madcam抗体与不同种类的madcam结合的能力。包含表6的抗体6、抗体59、抗体63的cdr的抗体。虽然抗体以表6所示的scfv格式进行测试,但madcam抗体也可以如表7所示是vh/vl格式。发现这些抗体能够与人和食蟹猴madcam两者结合,并且除了抗体克隆6外,它们还可以与小鼠madcam结合。抗体可以以纳摩尔到微摩尔范围内的kd结合madcam。
[1346]
实施例37:抗体的表位作图
[1347]
将人或鼠madcam-avitag/多组氨酸标签以0.5ug/ml在五-his生物传感器上固定上180s。在测定缓冲液(1x pbs中1%bsa和0.05%tween-20)中建立基线步骤120秒。缔合的第一步骤在具有40nm分子的孔中进行,所述分子包括表6的抗体6、抗体59、抗体63以及其他
madcam抗体(来自pf-00547659(整合素阻断抗体(pfizer;pullen et al.,br j pharmacol.2009 may;157(2):281-93)、meca89(非整合素阻断剂)和meca367(整合素阻断剂))的抗体cdr。
[1348]
发现表6的抗体59与抗体6竞争人madcam结合。表6的抗体63不与表6的抗体59或抗体6竞争人madcam结合。抗体63与pfizer基准抗体竞争,而其他抗体不与pfizer基准抗体竞争。结果还表明,抗体59不与抗体63竞争小鼠madcam结合。抗体63与meca367竞争,但不与meca89竞争。抗体59与meca89竞争,但不与meca367竞争。该数据说明抗体与不同的表位结合。
[1349]
实施例38:madcam-il2突变蛋白分子对通过人蛋白质阵列(retrogenix)与madcam和il-2的结合具有特异性。将编码zsgreen1和全长人质膜蛋白或细胞表面栓系的人分泌蛋白的5528个表达载体在16个微阵列载玻片上一式两份排列。人hek293细胞用于反向转染/表达。细胞固定后,将测试抗体添加到每个载玻片中。包括抗体59和包括l118i突变的il-2突变蛋白以及抗体63和包括l118i突变的il-2突变蛋白的测试分子作为组合筛选。通过使用与预筛选中使用的相同的荧光二抗进行结合检测。使用imagequant软件对荧光图像进行分析和定量(用于转染)。蛋白质'命中'被定义为与背景水平相比显示出升高的信号的重复点。这是通过使用imagequant软件上的网格图像进行目视检查来实现的。命中被分类为“强、中、弱或非常弱”,这取决于重复点的强度。发现这两种分子仅与其两种主要靶标发生特异性相互作用—仅il2ra(强强度)和madcam1的2种同工型(中等/强强度)。没有检测到其他显著的相互作用。这些结果证明双特异性分子能够与其各自的靶标结合。分子从n末端到c末端的形式是madcam抗体-il-2突变蛋白,然而,也发现反向形式具有活性并且能够结合它们各自的靶标。
[1350]
实施例40:稳定性在4c下测试某些双特异性分子的稳定性。发现包括抗体59或抗体63以及包括l118i突变的il-2突变蛋白的双特异性在4c下稳定至少28天。
[1351]
实施例41:madcam-il2突变蛋白双特异性降低来自异种移植物抗宿主病小鼠的肝组织中的tnf-α水平。在治疗前35天,向免疫功能低下的nsg小鼠植入人pbmc。将小鼠用madcam-il-2突变蛋白双特异性(0.03mg/kg)治疗一周并处死。将结肠组织匀浆并在结肠裂解物中通过elisa测量tnf-α浓度。将值相对于总蛋白质浓度进行归一化,以说明组织等分试样尺寸的差异。载剂和未栓系的il-2突变蛋白在结肠裂解物中的tnf-α水平分别为0.982
±
0.271和0.912
±
0.199(pg/mg)
±
s.e.m),而双特异性madcam抗体59和包括l118i突变的il-2突变蛋白所见的tnf-α水平较低(0.538
±
0.167(pg/mg)
±
s.e.m)。因此,双特异性和靶向表达madcam的结肠可以以位点特异性方式降低tnf-α的产生。靶组织中这种促炎症细胞因子水平降低意味着madcam-il2突变蛋白的治疗效果和诱导免疫耐受。
[1352]
实施例42:madcam-il2突变蛋白双特异性增加来自异种移植物抗宿主病小鼠的结肠组织中的foxp3基因表达。在治疗前27天,向免疫功能低下的nsg小鼠植入人pbmc。小鼠用madcam-il-2突变蛋白双特异性(与实施例41中相同的分子)(0.1mg/kg)治疗一周并处死。将肝组织均质化,并通过qrt-pcr在肝裂解物中测量人foxp3表达。基因表达相对于人gapdh水平进行归一化。发现载剂的foxp3水平为1.32
±
0.36,而发现madcam抗体59和包括l118i突变的il-2突变蛋白将foxp3水平增加至2.21
±
0.36。数据代表平均值
±
s.e.m.靶组织中foxp3表达的增加表明调节性t细胞增加了。
[1353]
本文提供的实施例证明本文提供的分子可以用于特异性定位治疗剂,诸如il-2m以及还有其他治疗剂分子,诸如本文描述的具有特异性和治疗效果的那些,诸如tnf-α的降低以及t调节细胞的增加,例如可以通过fox3p表达的增加来监测。
[1354]
本文引用的每个和每项专利、专利申请和出版物的公开内容均通过援引以其整体并入本文。虽然已经参考特定方面公开了各种实施方式,但是很明显,本领域的其他技术人员可以在不脱离实施方式的真实精神和范围的情况下设计出这些实施方式的其他方面和变型。所附权利要求旨在解释为包括所有这样的方面和等效变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1