酵母属来源的阿魏酸脱羧酶突变体、和使用该突变体的不饱和烃化合物的制造方法与流程
1.本发明涉及在属于酵母属(saccharomyces)的细菌来源的阿魏酸脱羧酶中398位的氨基酸被替换成谷氨酰胺等其他氨基酸的脱羧酶、编码该脱羧酶的dna、插入有该dna的载体、导入有所述dna或所述载体的宿主细胞。本发明还涉及使用所述脱羧酶或所述宿主细胞的不饱和烃化合物的制造方法。进而本发明还涉及包含所述脱羧酶、所述dna或所述载体的用于促进不饱和烃化合物的生成的制剂。本发明还涉及所述脱羧酶的制造方法。
背景技术:
2.由于丁二烯(1,3-丁二烯)作为各种合成橡胶(丁二烯橡胶、丁苯橡胶、丁腈橡胶等)、聚合物树脂(abs树脂、尼龙66等)这样的各种高分子化合物的原料使用,因此在化学产业中可以说是极其重要的有机化合物。此外,这些以丁二烯作为原料的高分子化合物不仅广泛利用于汽车用轮胎等工业用品,而且也广泛利用于服装类等生活用品。因此,丁二烯的需求逐年增加,其年需求为1300万吨,此外市场规模也达到150亿美元。
3.一直以来,丁二烯主要通过将在从石油制造乙烯和丙烯时副生的c4馏分进行纯化来制造。然而,因为石油等化石燃料的枯竭、温室效应气体排放引起的地球变暖等环境问题,为了应对上述不断增加的丁二烯需求,实现可持续的丁二烯制造的必要性提高。进而,作为其对策,从作为可再生资源的来源于生物质资源的物质,利用酶制造丁二烯的方法的开发盛行。
4.例如,在专利文献1中,公开了以木糖作为原料,使用具有能够将其转换成巴豆醇等的酶活性的微生物,来制造丁二烯的方法。此外,在专利文献2中,公开了以木糖作为原料,使用具有能够将其转换成2,3-丁二醇的酶活性的微生物,来制造丁二烯的方法。这样,尝试了多种利用了酶的丁二烯等不饱和烃化合物的制造。
5.进而,本发明者们搞清楚了,可以将由阿魏酸脱羧酶(fdc)参与的阿魏酸的脱羧反应而生成4-乙烯基愈创木酚(4vg)的方法(参照非专利文献1和下述式)应用于丁二烯等不饱和烃化合物的制造(专利文献3)。
[0006][0007]
即,本发明者们发现了,通过在fdc的氨基酸中导入突变,将该酶的底物特异性从原来的针对阿魏酸变成针对粘康酸等,从而能够经过下述式所示那样的脱羧反应来制造丁二烯等。
[0008][0009]
更具体地,本发明者们从前,在曲霉属来源的fdc(由序列号5所记载的氨基酸序列组成的脱羧酶)的各个部位导入伴有氨基酸替换的突变,而制备了突变体。并且,对于这些突变体,评价了与以粘康酸作为底物的丁二烯的生成有关的催化活性。其结果搞清楚了,通过在曲霉属来源的fdc中将395位的苏氨酸替换成其他氨基酸(谷氨酰胺、组氨酸、天冬酰胺、赖氨酸、丝氨酸或精氨酸),从而大体上与丁二烯的生成有关的催化活性提高(与突变导入前的野生型的fdc相比,催化活性至少提高约3倍)。还发现了,通过除了所述395位的氨基酸替换之外,将394位的酪氨酸替换成其他氨基酸(苯丙氨酸、甲硫氨酸、色氨酸、亮氨酸、异亮氨酸、组氨酸、苏氨酸、精氨酸或天冬酰胺),从而与1,3-丁二烯的生成有关的催化活性能够进一步提高(专利文献3)。
[0010]
现有技术文献
[0011]
专利文献
[0012]
专利文献1:日本特开2014-30376号公报
[0013]
专利文献2:日本特开2015-228804号公报
[0014]
专利文献3:国际公开第2019-022083号
[0015]
非专利文献
[0016]
非专利文献1:karl a.p.payne等,nature,2015年6月25日发行,522卷,7557号,497~501页
技术实现要素:
[0017]
发明所要解决的课题
[0018]
本发明的目的是提供能够以高生产性制造丁二烯等不饱和烃化合物的酶。
[0019]
用于解决课题的方法
[0020]
本发明者们为了实现上述目的,对于各种微生物来源的阿魏酸脱羧酶(fdc)评价了它们的与不饱和烃化合物生成有关的催化活性。其结果发现,酿酒酵母(saccharomyces cerevisiae)来源野生型fdc(由序列号2所记载的氨基酸序列组成的脱羧酶)的所述催化活性与专利文献3中公开的曲霉属来源的野生型fdc相比悬殊地(约20倍)高。
[0021]
进而搞清楚了,通过在酿酒酵母来源的fdc的398位将该部位的异亮氨酸替换成其他氨基酸(谷氨酰胺、甲硫氨酸、天冬酰胺、苯丙氨酸、组氨酸或苏氨酸),从而大体上与丁二烯的生成有关的催化活性提高(与突变导入前的野生型fdc相比,催化活性提高至少约3倍)。特别是发现,将所述部位替换成谷氨酰胺的fdc突变体和将所述部位替换成甲硫氨酸
的fdc突变体,各自的所述催化活性与酿酒酵母来源野生型fdc相比提高到9.3倍和16.4倍。
[0022]
进而,也制作了在这些将398位替换成其他氨基酸的酵母属来源的fdc中进一步将397位的苯丙氨酸替换成其他氨基酸的突变体,对于它们也评价了所述催化活性。其结果表明,通过除了所述398位的氨基酸替换之外,将397位替换成其他氨基酸,所述催化活性能够进一步提高。特别是在将398位替换成谷氨酰胺的突变体中将397位替换成组氨酸或甲硫氨酸的情况下,与酿酒酵母来源野生型fdc相比,所述催化活性分别提高到75.1倍和33.8倍。另外发现,在将398位替换成甲硫氨酸的突变体中将397位替换成组氨酸的情况下,与酿酒酵母来源野生型fdc相比,所述催化活性提高到37.3倍。
[0023]
进而发现,通过在将前述398位和397位的氨基酸分别替换成其他氨基酸的突变体中将286位、334位、440位、189位或326位的氨基酸分别替换成其他氨基酸,从而所述催化活性进一步提高,从而完成了本发明。
[0024]
即,本发明涉及在酵母属来源的fdc中398位的氨基酸被替换成谷氨酰胺等其他氨基酸的脱羧酶、及其制造方法,进一步涉及编码该脱羧酶的dna、插入有该dna的载体、导入有该dna或该载体的宿主细胞。另外,本发明涉及使用所述脱羧酶或所述宿主细胞的不饱和烃化合物的制造方法。进而本发明还涉及包含所述脱羧酶、所述dna或所述载体的用于促进不饱和烃化合物的生成的制剂。
[0025]
更具体地,本发明提供以下发明。
[0026]
<1>酵母属来源的阿魏酸脱羧酶,其中,序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸被替换成谷氨酰胺、甲硫氨酸、天冬酰胺、苯丙氨酸、组氨酸或苏氨酸,并且该阿魏酸脱羧酶具有生成下述式(2)或(5)所示的不饱和烃化合物、或它们的几何异构体的催化活性,
[0027][0028]
式(2)和(5)中,“r
1”、“r
2”、“r
3”和“r
4”各自独立地表示氢原子、碳原子数1~5的直链状或支链状的烷基、碳原子数1~5的直链状或支链状的烷氧基或羟基;“a”表示可以被取代的碳原子数0~5的直链状烃基,在碳原子数为2~5的情况下,相邻的碳原子之间可以形成双键。
[0029]
<2>根据<1>所述的阿魏酸脱羧酶,进一步序列号2所记载的氨基酸序列的397位或与该部位对应的氨基酸被替换成组氨酸或甲硫氨酸。
[0030]
<3>编码<1>或<2>所述的阿魏酸脱羧酶的dna。
[0031]
<4>包含<3>所述的dna的载体。
[0032]
<5>导入有<3>所述的dna或<4>所述的载体的宿主细胞。
[0033]
<6>下述式(2)所示的不饱和烃化合物或其几何异构体的制造方法,包括:在<1
>或<2>所述的阿魏酸脱羧酶的存在下,使下述式(1)所示的不饱和烃二羧酸化合物或其几何异构体脱羧的工序,
[0034][0035]
式(1)和(2)中,“r
1”和“r
2”各自独立地表示氢原子、碳原子数1~5的直链状或支链状的烷基、碳原子数1~5的直链状或支链状的烷氧基或羟基;“a”表示可以被取代的碳原子数0~5的直链状烃基,在碳原子数为2~5的情况下,相邻的碳原子之间可以形成双键。
[0036]
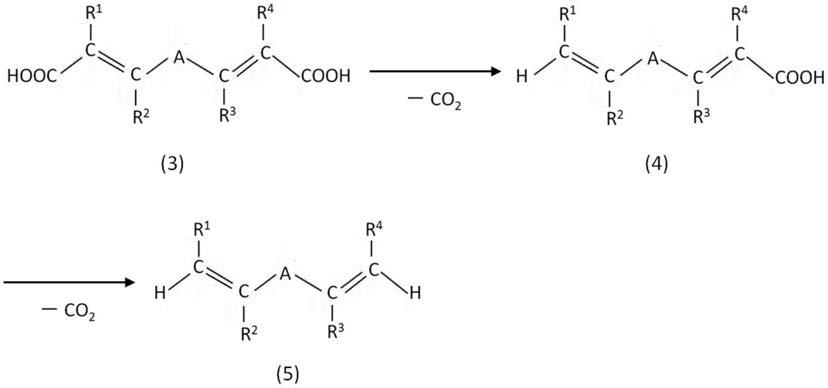
<7>下述式(5)所示的不饱和烃化合物或其几何异构体的制造方法,包括:在<1>或<2>所述的阿魏酸脱羧酶的存在下,使下述式(3)所示的不饱和烃二羧酸化合物或其几何异构体脱羧的工序,
[0037][0038]
式(3)~(5)中,“r
1”、“r
2”、“r
3”和“r
4”各自独立地表示氢原子、碳原子数1~5的直链状或支链状的烷基、碳原子数1~5的直链状或支链状的烷氧基或羟基;“a”表示可以被取代的碳原子数0~5的直链状烃基,在碳原子数为2~5的情况下,相邻的碳原子之间可以形成双键。
[0039]
<8>不饱和烃化合物的制造方法,包括:培养<5>所述的宿主细胞,采集在该宿主细胞和/或其培养物中生成的下述式(2)或(5)所示的不饱和烃化合物、或它们的几何异构体的工序,
[0040]
[0041]
式(2)和(5)中,“r
1”、“r
2”、“r
3”和“r
4”各自独立地表示氢原子、碳原子数1~5的直链状或支链状的烷基、碳原子数1~5的直链状或支链状的烷氧基或羟基;“a”表示可以被取代的碳原子数0~5的直链状烃基,在碳原子数为2~5的情况下,相邻的碳原子之间可以形成双键。
[0042]
<9>用于使下述式(1)所示的不饱和烃二羧酸化合物或其几何异构体脱羧、促进下述式(2)所示的不饱和烃化合物或其几何异构体的生成的制剂,包含<1>或<2>所述的阿魏酸脱羧酶、<3>所述的dna或<4>所述的载体,
[0043][0044]
式(1)和(2)中,“r
1”和“r
2”各自独立地表示氢原子、碳原子数1~5的直链状或支链状的烷基、碳原子数1~5的直链状或支链状的烷氧基或羟基;“a”表示可以被取代的碳原子数0~5的直链状烃基,在碳原子数为2~5的情况下,相邻的碳原子之间可以形成双键。
[0045]
<10>用于使下述式(3)所示的不饱和烃二羧酸化合物或其几何异构体脱羧、促进下述式(5)所示的不饱和烃化合物或其几何异构体的生成的制剂,包含<1>或<2>所述的阿魏酸脱羧酶、<3>所述的dna或<4>所述的载体,
[0046][0047]
式(3)~(5)中,“r
1”、“r
2”、“r
3”和“r
4”各自独立地表示氢原子、碳原子数1~5的直链状或支链状的烷基、碳原子数1~5的直链状或支链状的烷氧基或羟基;“a”表示可以被取代的碳原子数0~5的直链状烃基,在碳原子数为2~5的情况下,相邻的碳原子之间可以形成双键。
[0048]
<11>根据<9>或<10>所述的制剂,所述阿魏酸脱羧酶是序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸为谷氨酰胺或甲硫氨酸、且序列号2所记载的氨基酸序列的397位或与该部位对应的氨基酸为组氨酸或甲硫氨酸的阿魏酸脱羧酶。
[0049]
<12>酵母属来源的阿魏酸脱羧酶的突变体的制造方法,包括:培养<5>所述的宿主细胞,采集在该宿主细胞中表达的蛋白质的工序。
[0050]
<13>阿魏酸脱羧酶的制造方法,所述阿魏酸脱羧酶是生成下述式(2)或(5)所示
的不饱和烃化合物、或它们的几何异构体的催化活性提高了的阿魏酸脱羧酶,该制造方法包括:在酵母属来源的阿魏酸脱羧酶中,使序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸替换成谷氨酰胺、甲硫氨酸、天冬酰胺、苯丙氨酸、组氨酸或苏氨酸的工序,
[0051][0052]
式(2)和(5)中,“r
1”、“r
2”、“r
3”和“r
4”各自独立地表示氢原子、碳原子数1~5的直链状或支链状的烷基、碳原子数1~5的直链状或支链状的烷氧基或羟基;“a”表示可以被取代的碳原子数0~5的直链状烃基,在碳原子数为2~5的情况下,相邻的碳原子之间可以形成双键。
[0053]
<14>根据<13>所述的制造方法,在所述阿魏酸脱羧酶中,进一步使序列号2所记载的氨基酸序列的397位或与该部位对应的氨基酸替换成组氨酸或甲硫氨酸。
[0054]
发明的效果
[0055]
根据本发明,能够提供能够以高生产性制造丁二烯等不饱和烃化合物的酶、以及使用了该酶的不饱和烃化合物的制造方法。
具体实施方式
[0056]
<阿魏酸脱羧酶突变体>
[0057]
如后述的实施例所示,酵母属来源的阿魏酸脱羧酶(fdc)与专利文献3中公开的曲霉属来源的阿魏酸脱羧酶相比促进生成下述式(2)或式(5)所示的不饱和烃化合物、或它们的几何异构体的下述反应的催化活性(也称为“生成不饱和烃化合物的催化活性”)高约20倍。
[0058]
进而发现,通过在酿酒酵母(saccharomyces cerevisiae)来源的fdc(由序列号2所记载的氨基酸序列组成的脱羧酶)中将398位的氨基酸替换成其他氨基酸(谷氨酰胺、甲硫氨酸、天冬酰胺、苯丙氨酸、组氨酸或苏氨酸),所述催化活性进一步提高。
[0059][0060]
因此,本发明提供序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸被替换成谷氨酰胺、甲硫氨酸、天冬酰胺、苯丙氨酸、组氨酸或苏氨酸,并且具有生成所述式(2)或(5)所示的不饱和烃化合物、或它们的几何异构体的催化活性的酵母属来源的阿魏酸脱羧酶(以下,也称为本发明的fdc突变体)。
[0061]
所谓“阿魏酸脱羧酶(fdc)”,通常是作为ec编号:4.1.1.102登记的酶,是指催化将阿魏酸脱羧而生成4-乙烯基愈创木酚(4vg)的下述反应的酶。
[0062][0063]
在本发明的fdc突变体中,作为实施了氨基酸替换的fdc,只要是酵母属来源的即可。本发明中所谓“酵母属”,是指属于酵母属(saccharomyces)的细菌,可列举例如,酿酒酵母(saccharomyces cerevisiae)、saccharomyces kudriavzevii、真贝酵母(saccharomyces eubayanus)、贝酵母(saccharomyces bayanus)、布拉迪酵母(saccharomyces boulardii)、博伊丁酵母(saccharomyces bulderi)、里约酵母(saccharomyces cariocanus)、saccharomyces cariocus、薛瓦酵母(saccharomyces chevalieri)、saccharomyces dairenensis、椭圆酵母(saccharomyces ellipsoideus)、saccharomyces florentinus、克鲁维酵母(saccharomyces kluyveri)、saccharomyces martiniae、saccharomyces monacensis、saccharomyces norbensis、奇异酵母(saccharomyces paradoxus)、巴斯德酵母(saccharomyces pastorianus)、saccharomyces spencerorum、saccharomyces turicensis、单孢酵母(saccharomyces unisporus)、葡萄汁酵母(saccharomyces uvarum)、saccharomyces zonatus。
[0064]
作为酵母属来源的fdc,可列举例如,酿酒酵母(saccharomyces cerevisiae)
(atcc 204508/s288c株)(面包酵母)来源的fdc(uniprot id:q03034、由序列号2所记载的氨基酸序列组成的fdc)、以及在uniprot上对应于“ferulic acid decarboxylase(阿魏酸脱羧酶)”的酵母属来源的蛋白质,更具体可列举下述表1所记载的fdc。此外,请理解,在自然界中通过核苷酸序列突变,从而可以产生蛋白质的氨基酸序列的变化。
[0065]
[0066]
在表1所记载的fdc中,作为实施氨基酸替换的fdc,优选为酿酒酵母(saccharomyces cerevisiae)来源的fdc,更优选为由序列号2所记载的氨基酸序列组成的蛋白质。
[0067]
另外,本发明中,被导入伴有氨基酸替换的突变的酵母属来源的fdc,与序列号2所记载的氨基酸序列的同一性优选为80%以上(例如,81%以上、82%以上、83%以上、84%以上),更优选为85%以上(例如,86%以上、87%以上、88%以上、89%以上),进一步优选为90%以上(例如,91%以上、92%以上、93%以上、94%以上),更优选为95%以上(例如,96%以上、97%以上、98%以上、99%以上)。此外,本发明中所谓“同一性”,是指该fdc与序列号2所记载的氨基酸序列一致的氨基酸数相对于所述酵母属来源的fdc的氨基酸总数的比例(%)。
[0068]
本发明中,被导入上述酵母属来源的fdc中的伴有氨基酸替换的突变不限于后述的实施例所示那样的人工突变,也可以是自然产生的突变。另外,如后述的实施例所示,被导入序列号2所记载的氨基酸序列的398位或与其对应的部位的突变只要伴有向谷氨酰胺、甲硫氨酸、天冬酰胺、苯丙氨酸、组氨酸或苏氨酸的替换即可,但从生成不饱和烃化合物的催化活性更高这样的观点考虑,优选为向谷氨酰胺或甲硫氨酸的替换,特别优选为向谷氨酰胺的替换。
[0069]
本发明的fdc突变体可以是导入了除了前述的序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸以外的突变的突变体。即,本发明的fdc突变体也包含由在酵母属来源的fdc的氨基酸序列(序列号2所记载的氨基酸序列等)的398位以外替换、缺失、添加、和/或插入1个或多个氨基酸的氨基酸序列组成的蛋白质。其中,所谓“多个”不特别限制,通常为2~100个、优选为2~50个、更优选为2~40个、进一步优选为2~30个、更优选为2~20个、进一步优选为2~10个(例如,2~8个、2~4个、2个)。
[0070]
作为该突变,本发明的fdc突变体只要具有生成不饱和烃化合物的催化活性就不特别限制,可列举例如,伴有如下的氨基酸替换的突变。
[0071]
如后述的实施例所示,在本发明的fdc突变体中,从处于生成不饱和烃化合物的催化活性更容易变高的倾向考虑,进一步优选除了前述398位的氨基酸替换之外,序列号2所记载的氨基酸序列的397位或与该部位对应的氨基酸被替换成组氨酸、甲硫氨酸、酪氨酸或亮氨酸,更优选被替换成组氨酸或甲硫氨酸,特别优选被替换成组氨酸。
[0072]
另外,如后述的实施例所示,在本发明的fdc突变体中,从处于生成不饱和烃化合物的催化活性更容易变高的倾向考虑,进一步优选除了上述398位和397位的氨基酸替换之外,序列号2所记载的氨基酸序列的334位或与该部位对应的氨基酸被替换成异亮氨酸、序列号2所记载的氨基酸序列的286位或与该部位对应的氨基酸被替换成亮氨酸、序列号2所记载的氨基酸序列的440位或与该部位对应的氨基酸被替换成苏氨酸、序列号2所记载的氨基酸序列的189位或与该部位对应的氨基酸被替换成甲硫氨酸、或序列号2所记载的氨基酸序列的326位或与该部位对应的氨基酸被替换成亮氨酸,更优选序列号2所记载的氨基酸序列的334位或与该部位对应的氨基酸被替换成异亮氨酸、或序列号2所记载的氨基酸序列的286位或与该部位对应的氨基酸被替换成亮氨酸。
[0073]
作为本发明的fdc突变体,更具体地,优选
[0074]
序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸被替换成谷氨酰
胺、并且该氨基酸序列的397位或与该部位对应的氨基酸被替换成组氨酸的酵母属来源的fdc突变体,
[0075]
序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸被替换成谷氨酰胺、并且该氨基酸序列的397位或与该部位对应的氨基酸被替换成甲硫氨酸的酵母属来源的fdc突变体,或
[0076]
序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸被替换成甲硫氨酸、并且该氨基酸序列的397位或与该部位对应的氨基酸被替换成组氨酸的酵母属来源的fdc突变体。
[0077]
另外,更优选序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸被替换成谷氨酰胺、该氨基酸序列的397位或与该部位对应的氨基酸被替换成组氨酸、并且该氨基酸序列的286位或与该部位对应的氨基酸被替换成亮氨酸的酵母属来源的fdc突变体,或
[0078]
序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸被替换成谷氨酰胺、并且该氨基酸序列的397位或与该部位对应的氨基酸被替换成组氨酸、并且该氨基酸序列的334位或与该部位对应的氨基酸被替换成异亮氨酸的酵母属来源的fdc突变体。
[0079]
此外,在本发明中,所谓“对应的部位”,是在利用核苷酸和氨基酸序列分析软件(genetyx-mac,sequencher等)、blast(http://blast.ncbi.nlm.nih.gov/blast.cgi),使序列号2所记载的氨基酸序列、与来源于属于酵母属的其他细菌的fdc等的氨基酸序列排列时,与序列号2所记载的氨基酸序列的398位的异亮氨酸等位于同等位置的部位。
[0080]
另外,本发明的fdc突变体是否具有生成不饱和烃化合物的催化活性,例如,如后述的实施例所示那样,可以通过利用气相色谱质谱分析(gc-ms),对不饱和烃化合物的量进行直接测定来判定。进一步,通过与由序列号2所记载的氨基酸序列组成的fdc等酵母属来源的野生型fdc中的量进行比较,也可以判定生成不饱和烃化合物的催化活性是否高于该野生型fdc。
[0081]
本发明的fdc突变体在生成不饱和烃化合物的催化活性方面,优选相对于酵母属来源的野生型fdc(例如,由序列号2所记载的氨基酸序列组成的fdc)为2倍以上(例如,3倍以上、4倍以上、5倍以上、6倍以上、7倍以上、8倍以上、9倍以上),更优选为10倍以上(例如,20倍以上、30倍以上、40倍以上),进一步优选为50倍以上(例如,60倍以上、70倍以上、80倍以上、90倍以上),更优选为100倍以上。
[0082]
另外,本发明的fdc突变体在生成不饱和烃化合物的催化活性方面,优选相对于由序列号5所记载的氨基酸序列组成的fdc(曲霉属来源的野生型fdc)为30倍以上(例如,40倍以上、50倍以上、60倍以上、70倍以上、80倍以上、90以上),更优选为100倍以上(例如,200倍以上、300倍以上、400倍以上),进一步优选为500倍以上(例如,600倍以上、700倍以上、800倍以上、900倍以上),进一步优选为1000倍以上(例如,1100倍以上、1200倍以上、1300倍以上、1400倍以上),更优选为1500倍以上(例如,1600倍以上、1700倍以上、1800倍以上、1900倍以上),特别优选为2000倍以上。
[0083]
作为本发明的fdc突变体,可以仅使用1种序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸为谷氨酰胺等的酵母属来源的阿魏酸脱羧酶,但也可以将2种以上的本发明的fdc突变体联合使用。进而,如专利文献3所示,从更容易促进不饱和烃羧酸化合物的脱羧这样的观点考虑,可以与序列号2所记载的氨基酸序列的398位或与该部位对应的
氨基酸为苏氨酸的fdc联合使用。将序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸为苏氨酸的fdc的例子示于下述表2~6。
[0084]
表2
[0085]
[0086]
表3
[0087][0088]
表4
[0089][0090]
表5
[0091][0092]
表6
[0093][0094]
本发明的fdc突变体可以直接或间接地添加其他化合物。作为这样的添加,没有特别限制,可以为基因水平的添加,也可以为化学添加。此外关于所添加的部位,也没有特别限制,可以为本发明的fdc突变体的氨基末端(以下也称为“n末端”)和羧基末端(以下也称
为“c末端”)的任一者,也可以为这两者。基因水平的添加通过使用对编码本发明的fdc突变体的dna适合阅读框地添加编码其他蛋白质的dna而得的dna来实现。作为这样操作而添加的“其他蛋白质”,没有特别限制,在出于使本发明的fdc突变体的纯化容易的目的的情况下,适合使用多聚组氨酸(his-)标签(tag)蛋白质、flag-标签蛋白质(注册商标,sigma-aldrich社)、谷胱甘肽-s-转移酶(gst)等纯化用标签蛋白质,此外在出于使本发明的fdc突变体的检测容易的目的的情况下,适合使用gfp等荧光蛋白质、荧光素酶等化学发光蛋白质等检测用标签蛋白质。化学添加可以为共价键,也可以为非共价键。作为“共价键”,没有特别限制,可举出例如,氨基与羧基的酰胺键、氨基与卤代烷基的烷基胺键、硫醇彼此间的二硫键、硫醇基与马来酰亚胺基或卤代烷基的硫醚键。作为“非共价键”,可举出例如,生物素-抗生物素蛋白间键。此外,作为这样操作而化学添加的“其他化合物”,在出于使本发明的fdc突变体的检测容易的目的的情况下,适合使用例如,cy3、若丹明等荧光色素。
[0095]
另外,本发明的fdc突变体可以与其他成分混合使用。作为其他成分,没有特别限制,可举出例如,灭菌水、生理盐水、植物油、表面活性剂、脂质、助溶剂、缓冲剂、蛋白酶抑制剂、保存剂。
[0096]
<编码本发明的fdc突变体的dna、和具有该dna的载体>
[0097]
对于编码本发明的fdc突变体的dna等进行说明。通过导入这样的dna,能够转化宿主细胞,在该细胞中制造本发明的fdc突变体,进而制造不饱和烃化合物。
[0098]
本发明的dna只要编码上述本发明的fdc突变体,就既可以是在天然dna中导入了突变的dna,也可以是由人工设计的核苷酸序列组成的dna。进一步,对其形态没有特别限制,除了cdna以外,还包含基因组dna、和化学合成dna。这些dna的制备对于本领域技术人员而言能够利用常规手段进行。基因组dna例如可以如下制备:从酵母属提取基因组dna,制作基因组文库(作为载体,可以利用质粒、噬菌体、粘粒、bac、pac等),将其展开,使用以fdc基因的核苷酸序列(例如,序列号1所记载的核苷酸序列)为基础制备的探针进行集落杂交或噬斑杂交来制备。另外,也可以通过制作对fdc基因特异性的引物,进行利用该引物的pcr来制备。另外,cdna可以通过例如,以从酵母属提取的mrna为基础合成cdna,将其插入到λzap等载体而制作cdna文库,将其展开,与上述同样地进行集落杂交或噬斑杂交,另外通过进行pcr,从而制备。并且,关于在这样制备的dna中导入将序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸替换成谷氨酰胺等的突变,只要是本领域技术人员,就能够通过利用公知的定点诱变法来进行。作为定点诱变法,可举出例如,kunkel法(kunkel,t.a.,proc natl acad sci usa,1985年,82卷,2号,488~492页)、soe(splicing-by-overlap-extention,重叠延伸剪接)-pcr法(ho,s.n.,hunt,h.d.,horton,r.m.,pullen,j.k.,and pease,l.r.,gene,1989年,77卷,51~59页)。另外,只要是本领域技术人员,就能够人工设计编码将fdc的398位或与该部位对应的氨基酸替换成了谷氨酰胺等的蛋白质的核苷酸序列,基于该序列信息,使用自动核酸合成仪,化学合成本发明的dna。
[0099]
进而,本发明的dna从在宿主细胞中进一步提高所编码的fdc突变体的表达效率这样的观点考虑,可以根据该宿主细胞的种类,而采用将密码子进行了最佳化的编码本发明的fdc突变体的dna的方案。
[0100]
为了能够在宿主细胞内复制上述dna,也可以采用插入有该dna的载体的方案。在本发明中,“载体”可以作为自主复制载体、即染色体外的独立体而存在,可以基于其复制不
依赖于染色体的复制的例如质粒而构建。此外,载体也可以是在导入到宿主细胞时,整合到该宿主细胞的基因组中,与整合了该载体的染色体一起被复制的载体。
[0101]
作为这样的载体,可举出例如,质粒、噬菌体dna。此外,作为质粒,可举出来源于大肠杆菌的质粒(pet22、pbr322、pbr325、puc118、puc119、puc18、puc19等)、来源于酵母的质粒(yep13、yep24、ycp50等)、来源于枯草杆菌的质粒(pub110、ptp5等)。作为噬菌体dna,可举出λ噬菌体(charon4a、charon21a、embl3、embl4、λgt10、λgt11、λzap等)。进一步,如果宿主细胞来源于昆虫,则也可以使用杆状病毒等昆虫病毒载体作为本发明的载体,如果来源于植物,则也可以使用t-dna等作为本发明的载体,如果来源于动物,则也可以使用反转录病毒、腺病毒载体等动物病毒载体作为本发明的载体。此外,本发明的载体构建的步骤和方法可以使用在基因工程的领域中惯用的步骤和方法。例如,在将本发明的dna插入到载体时,采用首先将经纯化的dna用适当的限制性酶切断,插入到适当的载体的限制性酶位点或多克隆位点而与载体连接的方法等。
[0102]
另外,本发明的载体可以是以能够在宿主细胞内表达的状态包含由所述dna编码的fdc突变体的表达载体的形态。本发明的“表达载体”为了将其导入宿主细胞而表达本发明的fdc突变体,期望除了上述dna以外,还包含控制其表达的dna序列、用于选择被转化的宿主细胞的基因标志物等。作为控制表达的dna序列,启动子、增强子、剪接信号、多聚a添加信号、核糖体结合序列(sd序列)和终止子等包含于其中。启动子只要在宿主细胞中显示转录活性,就没有特别限定,可以作为控制编码与宿主细胞同种或不同种的任一蛋白质的基因表达的dna序列而获得。此外,除了上述控制表达的dna序列以外,还可以包含诱导表达的dna序列。作为这样的诱导表达的dna序列,在宿主细胞为细菌的情况下,可举出能够通过异丙基-β-d-硫代半乳糖吡喃苷(iptg)的添加来诱导配置在下游的基因的表达的乳糖操纵子。本发明中的基因标志物可以根据被转化的宿主细胞的选择方法而适当选择,例如可以利用编码耐药性的基因、与营养缺陷性互补的基因。
[0103]
此外,本发明的dna或载体可以与其他成分混合使用。作为其他成分,没有特别限制,可举出例如,灭菌水、生理盐水、植物油、表面活性剂、脂质、助溶剂、缓冲剂、dnase(脱氧核糖核酸酶)抑制剂、保存剂。
[0104]
<导入有本发明的dna等的宿主细胞>
[0105]
对于导入有本发明的dna或载体的宿主细胞进行说明。如果使用通过上述dna或载体的导入而被转化的宿主细胞,则能够制造本发明的fdc突变体,进而也能够制造上述式(2)或式(5)所示的不饱和烃化合物、或它们的几何异构体。
[0106]
被导入本发明的dna或载体的宿主细胞没有特别限定,可举出例如,微生物(大肠杆菌、芽殖酵母、裂殖酵母、枯草杆菌、放线菌、丝状菌等)、植物细胞、昆虫细胞、动物细胞,从在比较廉价的培养基中在短时间显示高增殖性、进而能够有助于高生产性地制造上述式(2)或式(5)所示的不饱和烃化合物、或它们的几何异构体这样的观点考虑,优选利用微生物作为宿主细胞,更优选利用大肠杆菌。
[0107]
此外,从诱导黄素单核苷酸(fmn)的异戊二烯化(prenylation)、产生有助于上述式(2)或式(5)所示的不饱和烃化合物、或它们的几何异构体的生产性提高的prfmn或其异构体这样的观点考虑,被导入本发明的dna或载体的宿主细胞优选为保持有黄素异戊烯基转移酶的细胞。
[0108]
此外,从在丁二烯的制造中,易于以葡萄糖作为原料而生成成为本发明的fdc突变体的底物的粘康酸这样的观点考虑,被导入本发明的dna或载体的宿主细胞优选为从葡萄糖经由3-脱氢莽草酸和儿茶酚而生物合成粘康酸的途径被激活的细胞。作为这样的细胞,可举出例如,磷酸转移酶系酶和丙酮酸激酶的活性被抑制,并且具有能够由分支酸或异分支酸合成芳香族化合物的酶的细胞(例如,国际公开2017/033965所记载的微生物)、kruyer ns等,curr opin biotechnol.2017年,jun;45:136~143页所记载的大肠杆菌、恶臭假单胞菌或芽殖酵母。
[0109]
本发明的dna或载体的导入也可以按照该领域中惯用的方法实施。例如,作为对大肠杆菌等微生物导入的方法,可举出热休克法、电穿孔法、原生质球法、乙酸锂法,作为向植物细胞导入的方法,可举出使用土壤杆菌的方法、粒子枪法,作为向昆虫细胞导入的方法,可举出使用杆状病毒的方法、电穿孔法,作为向动物细胞导入的方法,可举出磷酸钙法、脂质转染法、电穿孔法。
[0110]
这样操作而导入到宿主细胞内的dna等在宿主细胞内可以通过随机插入到其基因组dna中来保持,也可以通过同源重组来保持,此外如果是载体,则可以作为其基因组dna外的独立体被复制而保持。
[0111]
此外,导入有本发明的dna或载体的宿主细胞,利用在后述的实施例中所示的方法测定的生成丁二烯的催化活性优选为30μm以上(例如,40μm以上、50μm以上、60μm倍以上、70μm以上、80μm以上、90μm以上),更优选为100μm以上(例如,200μm以上、300μm以上、400μm以上),进一步优选为500μm以上(例如,600μm以上、700μm以上、800μm以上、900μm以上),更优选为1mm以上(例如,1.5mm以上、2mm以上、2.5mm以上),特别优选为3mm以上。
[0112]
<不饱和烃化合物的制造方法1>
[0113]
如上所述,本发明的fdc突变体具有高的生成不饱和烃化合物的催化活性。因此,提供下述式(2)或(5)所示的不饱和烃化合物或其几何异构体的制造方法,包括在本发明的fdc突变体的存在下,使下述式(1)或(3)所示的不饱和烃二羧酸化合物、或其几何异构体脱羧的工序。
[0114][0115]
[0116]
在本发明中,通过上述反应生成的“不饱和烃化合物或其几何异构体”是指如上述式(2)和式(5)所示那样,具有至少1个碳间双键的烃化合物,可以为导入有碳原子数1~5的直链状或支链状的烷基、碳原子数1~5的直链状或支链状的烷氧基或羟基的化合物。作为这样的化合物,可举出例如,丁二烯(1,3-丁二烯),2,4-戊二烯酸、异巴豆酸、3-甲基异巴豆酸、3-戊烯酸、10-十一碳烯酸。
[0117]
在本发明中,成为不饱和烃化合物生成的原料的“不饱和烃二羧酸化合物或其几何异构体”是指如上述式(1)和(3)所示那样,具有至少1个碳间双键,并且具有至少2个羧基的烃化合物,可以为导入有碳原子数1~5的直链状或支链状的烷基、碳原子数1~5的直链状或支链状的烷氧基或羟基的化合物。作为这样的化合物,可举出例如,顺,顺-粘康酸、顺,反-粘康酸、反,反-粘康酸、戊烯二酸、2-甲基戊烯二酸、3-甲基戊烯二酸、愈伤酸。
[0118]
这样的上述式(1)和式(3)所示的化合物、以及它们的几何异构体如后述实施例中所示那样,可以作为市售的制品而购入。此外,只要是本领域技术人员,就可以适当参考公知的合成方法(例如,kiyoshi kudo等,石油学会志,1994年07月13日发行,38卷,1号,48~51页所记载的方法)来合成。
[0119]
上述式(1)和(2)所示的化合物、以及它们的几何异构体中的“r
1”和“r
2”、或上述式(3)~(5)所示的化合物、以及它们的几何异构体中的“r
1”、“r
2”、“r
3”和“r
4”各自独立地表示氢原子、碳原子数1~5的直链状或支链状的烷基、碳原子数1~5的直链状或支链状的烷氧基或羟基。
[0120]
作为“碳原子数1~5的直链状或支链状的烷基”,可举出例如,甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基。
[0121]
作为“碳原子数1~5的直链状或支链状的烷氧基”,可举出例如,甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基、正戊氧基、异戊氧基、正戊氧基、1,2-二甲基丙氧基。
[0122]
另外,上述式(1)~(5)所示的化合物、以及它们的几何异构体中的“a”表示可以被取代的碳原子数0~5的直链状烃基。此外,所谓“可以被取代的碳原子数0的直链状烃基”,是指在上述式(1)~式(5)所示的化合物、以及它们的几何异构体中经由“a”而结合的碳原子彼此不经由“a”而直接结合。进一步,在可以被取代的直链状烃基的碳原子数为2~5的情况下,可以在相邻的碳原子之间形成至少1个双键。另外,“a”中所谓烃基可以具有的取代基,可举出例如,碳原子数1~5的直链状或支链状的烷基、碳原子数1~5的直链状或支链状的烷氧基、羟基、卤原子(例如,氟、氯、溴、碘)、硝基、氰基、氨基、羧基、甲酰基。
[0123]
关于在本发明的fdc突变体的存在下使不饱和烃二羧酸化合物脱羧的条件,只要是促进该脱羧、能生成不饱和烃化合物的条件即可,只要是本领域技术人员,就可以适当调整反应液的组成、反应液的ph、反应温度、反应时间等来设定。
[0124]
例如,作为添加了本发明的fdc突变体、和作为其底物的不饱和烃二羧酸化合物的反应液,只要不妨碍上述反应,就没有特别限制,优选可举出ph6~8的缓冲液,更优选可举出ph6~7的包含氯化钾和磷酸钠的缓冲液。进一步,从更易于促进上述反应这样的观点考虑,优选包含经异戊二烯化(prenylation)的黄素单核苷酸(prfmn)或其异构体(prfmn
ketimine
,prfmn
iminiu
,关于这些prfmn及其异构体参照非专利文献1)。
[0125]
另外,作为在这样的反应中使用的本发明的fdc突变体,可以仅使用1种序列号2所
记载的氨基酸序列的398位或与该部位对应的氨基酸被替换成谷氨酰胺等的酵母属来源的fdc,也可以将2种以上的本发明的fdc突变体联合使用。进而,如专利文献3所示,从更容易促进不饱和烃羧酸化合物的脱羧这样的观点考虑,优选联合使用序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸为苏氨酸的阿魏酸脱羧酶。
[0126]
另外,作为反应温度,只要不妨碍上述反应,也就没有特别限制,通常为20~40℃,优选为25~37℃。进一步作为反应时间,只要是能够生成上述不饱和烃化合物的时间即可,没有特别限制,但通常为30分钟~7天,优选为12小时~2天。
[0127]
另外,在这样的条件下生成的上述不饱和烃化合物由于大体上来说容易气化,因此可以通过挥发性气体的公知的回收、纯化方法采集。作为这样的采集方法,可举出气提、分馏、吸附、脱附、渗透蒸发、吸附于固相的异戊二烯的利用热或真空进行的从固相的脱附、通过溶剂进行的提取、或色谱(例如,气相色谱)等。此外,即使在生成的烯烃化合物为液体的情况下,也可以适当利用公知的回收、纯化方法(蒸馏、色谱等)而采集。进一步这些方法可以单独进行,此外可以适当组合而多阶段地实施。
[0128]
<不饱和烃化合物的制造方法2>
[0129]
如上所述,通过将以表达本发明的fdc突变体的方式转化而得的宿主细胞进行培养,可以生产性高地制造不饱和烃化合物。因此,在本发明中,也提供不饱和烃化合物的制造方法,包括培养导入有编码本发明的fdc突变体的dna或载体的宿主细胞,采集在该宿主细胞和/或其培养物中生成的上述式(2)或(5)所示的不饱和烃化合物、或它们的几何异构体的工序。
[0130]
关于“导入有编码本发明的fdc突变体的dna或载体的宿主细胞”,如上所述,但作为这样的宿主细胞中表达的本发明的fdc突变体,可以是仅1种序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸被替换成谷氨酰胺等的酵母属来源的fdc,也可以是2种以上的本发明的fdc突变体。进而,如专利文献3所示,从更容易促进不饱和烃羧酸化合物的脱羧这样的观点考虑,优选所述宿主细胞中也表达序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸为苏氨酸的阿魏酸脱羧酶。
[0131]
关于上述细胞的培养条件,如后所述,但优选在培养基中添加作为本发明的脱羧酶的底物的由上述式(1)或式(3)所示的不饱和烃二羧酸化合物、或它们的几何异构体。培养温度可以根据所使用的宿主细胞的种类而适当设计变更,但通常为20~40℃,优选为25~37℃。
[0132]
本发明中,所谓“培养物”,是通过将宿主细胞用培养基进行培养而获得的、含有增殖了的宿主细胞、该宿主细胞的分泌产物和该宿主细胞的代谢产物等的培养基,包括它们的稀释物、浓缩物。
[0133]
关于从这样的宿主细胞和/或培养物采集不饱和烃化合物,也没有特别限制,可以使用上述公知的回收、纯化方法进行。此外,作为采集的时期,根据所使用的宿主细胞的种类而适当调整,只要是不饱和烃化合物能够生成的时间即可,但通常为30分钟~7天,优选为12小时~2天。
[0134]
<用于促进不饱和烃化合物的生成的制剂>
[0135]
如上所述,通过使用本发明的fdc突变体、编码该fdc突变体的dna或插入有该dna的载体,能够使上述式(1)或式(3)所示的不饱和烃二羧酸化合物、或它们的几何异构体脱
羧,促进上述式(2)或式(5)所示的不饱和烃化合物、或它们的几何异构体的生成。
[0136]
因此,本发明提供用于使上述式(1)所示的不饱和烃二羧酸化合物或其几何异构体脱羧、促进上述式(2)所示的不饱和烃化合物或其几何异构体的生成的制剂,或者用于使上述式(3)所示的不饱和烃二羧酸化合物或其几何异构体脱羧、促进上述式(5)所示的不饱和烃化合物或其几何异构体的生成的制剂,包含:本发明的fdc突变体、编码该fdc突变体的dna或插入有该dna的载体。
[0137]
作为这样的制剂,只要包含本发明的fdc突变体等即可,也可以与其他成分混合使用。作为这样的其他成分,没有特别限制,可举出例如,灭菌水、生理盐水、植物油、表面活性剂、脂质、助溶剂、缓冲剂、蛋白酶抑制剂、dnase抑制剂、保存剂。
[0138]
另外,本发明也可以提供包含这样的制剂的试剂盒。在本发明的试剂盒中,上述制剂可以以被导入本发明的dna等而被转化了的上述宿主细胞的方式包含。进而,除了这样的制剂以外,上述式(1)或式(3)所示的化合物、或它们的几何异构体、用于导入本发明的dna等的宿主细胞、用于培养该宿主细胞的培养基、和它们的使用说明书等也可以包含于本发明的试剂盒中。此外,这样的使用说明书是用于将本发明的制剂等利用于上述不饱和烃化合物的制造方法的说明书。说明书可以包含例如,本发明的制造方法的实验方法、实验条件、和与本发明的制剂等有关的信息(例如,显示载体的核苷酸序列等的载体图谱等信息、本发明的fdc突变体的序列信息、宿主细胞的来源、性质、该宿主细胞的培养条件等信息)。
[0139]
<本发明的fdc突变体的制造方法>
[0140]
如后述的实施例所示,通过培养导入有编码本发明的fdc突变体的dna等的宿主细胞,能够在该宿主细胞内制造该fdc突变体。
[0141]
因此,本发明还能够提供本发明的fdc突变体的制造方法,包括:培养导入有编码本发明的fdc突变体的dna或包含该dna的载体的宿主细胞,采集该宿主细胞中表达的蛋白质的工序。
[0142]
在本发明中,“培养宿主细胞”的条件只要是上述宿主细胞能够制造本发明的fdc突变体的条件即可,只要是本领域技术人员,就能够根据宿主细胞的种类、所使用的培养基等,来适当调整温度、空气添加的有无、氧的浓度、二氧化碳的浓度、培养基的ph、培养温度、培养时间、湿度等而进行设定。
[0143]
作为这样的培养基,只要含有宿主细胞能够同化的物质即可,可举出碳源、氮源、硫源、无机盐类、金属、蛋白胨、酵母提取物、肉提取物、酪蛋白水解物、血清等作为含有物。此外,也可以在这样的培养基中添加例如,用于诱导编码本发明的fdc突变体的dna的表达的iptg、与本发明的载体能够编码的耐药性基因对应的抗生素(例如,氨苄青霉素)、与本发明的载体能够编码的与营养缺陷性互补的基因对应的营养物(例如,精氨酸、组氨酸)。
[0144]
并且,作为从这样操作而培养的宿主细胞“采集在该细胞中表达的蛋白质”的方法,可举出例如,将宿主细胞通过过滤、离心分离等从培养基回收,将回收的宿主细胞通过细胞溶解、磨碎处理或加压破碎等进行处理,进一步通过超滤处理、盐析、硫酸铵沉淀等溶剂沉淀、色谱(例如,凝胶色谱、离子交换色谱、亲和色谱)等,将在宿主细胞中表达的蛋白质进行纯化、浓缩的方法。此外,在对本发明的fdc突变体添加上述纯化标签蛋白质的情况下,也可以使用该标签蛋白质吸附的底物进行纯化而采集。进一步这些纯化、浓缩方法也可以单独进行,此外可以适当组合而多阶段实施。
[0145]
另外,本发明的fdc突变体不限定于上述生物学合成,也可以使用本发明的dna等和无细胞蛋白质合成系统而制造。作为这样的无细胞蛋白质合成系统,没有特别限制,可举出例如,来源于小麦胚芽、来源于大肠杆菌、来源于兔网织红细胞、来源于昆虫细胞的合成系统。进一步只要是本领域技术人员,也可以使用市售的肽合成仪等,化学合成本发明的fdc突变体。
[0146]
另外,本发明还提供生成上述式(2)或(5)所示的不饱和烃化合物、或它们的几何异构体的催化活性提高了的阿魏酸脱羧酶突变体的制造方法,该制造方法包括:在酵母属来源的阿魏酸脱羧酶中,将序列号2所记载的氨基酸序列的398或与该部位对应的氨基酸替换成谷氨酰胺等,优选进一步替换其他部位的氨基酸(例如,上述的、序列号2所记载的氨基酸序列的397位或与该部位对应的氨基酸等)的工序。
[0147]
所谓“生成上述式(2)或(5)所示的不饱和烃化合物、或它们的几何异构体的催化活性提高了的阿魏酸脱羧酶”,是指通过在序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸导入突变,优选通过进一步在上述其他部位的氨基酸导入突变,从而生成不饱和烃化合物的催化活性高于上述导入前的fdc,其比较对象通常为上述的酵母属来源的野生型fdc。
[0148]
此外,作为被导入序列号2所记载的氨基酸序列的398位或与该部位对应的氨基酸、或者其他部位的氨基酸(序列号2所记载的氨基酸序列的397位或与该部位对应的氨基酸等)的突变、即向谷氨酰胺等或组氨酸等的替换的适合方案,参照上述的<本发明的脱羧酶>的记载。
[0149]
fdc中的“向谷氨酰胺等或组氨酸等的替换”可以通过编码的dna的改变来进行。“dna的改变”如上所述,可以使用本领域技术人员公知的方法适当实施,所述公知的方法例如,定点诱变法、基于被改变了的序列信息的dna的化学合成法。另外,“向谷氨酰胺等或组氨酸等的替换”如上所述,也可以使用肽的化学合成法进行。另外,通过这样的突变导入而生成不饱和烃化合物的催化活性是否提高,如上所述,可以通过gc-ms分析等进行评价。
[0150]
实施例
[0151]
以下,基于实施例更具体地说明本发明,但本发明不限定于以下实施例。
[0152]
(实施例1)
[0153]
本发明者们如专利文献3所示,发现了通过在曲霉属来源的阿魏酸脱羧酶(fdc)中导入伴有氨基酸替换的突变,从而与以粘康酸作为底物的丁二烯的生成有关的催化活性提高。
[0154]
这次,为了挑选更适合的fdc,对于各种微生物来源的fdc通过下述所示的方法分析了上述催化活性。
[0155]
<质粒载体的制备>
[0156]
首先,为了使各种微生物来源的fdc在大肠杆菌中高效地表达,利用使多聚组氨酸标签融合于编码上述fdc的野生型核苷酸序列的c末端的形态,考虑大肠杆菌中的密码子的使用频率而进行了改变(将序列改变后的核苷酸序列示于序列号3)。
[0157]
接着,按照常规方法化学合成包含这样的改变核苷酸序列的dna。进而,将这样操作而制备的dna与pet22b(+)载体(novagen社制)通过gibson assembly法(使用new england biolabs社的试剂盒nebuilder hifi dna assembly master mix(注册商标))而
连接,从而制备出能够在大肠杆菌中表达该各种野生型的fdc的质粒载体(fdc载体)。同样地操作,将从大肠杆菌(k-12)株将编码黄素异戊烯基转移酶(以下也称为“ubix”)的基因(序列号6)通过聚合酶链反应(polymerase chain reaction)法扩增而得的dna与pcoladuet载体(novagen社制)通过gibson assembly法而连接,从而制备出能够在大肠杆菌中表达该野生型的ubix的质粒载体(ubix载体)。
[0158]
<酶反应溶液的制备和酶活性的测定>
[0159]
将如上述那样制备的载体(5μg的fdc载体、与5μg的ubix载体)通过热休克法导入到大肠杆菌c41(de3)株(lucigen corporation社制,100μl)中,制备出共表达野生型的fdc与ubix的转化体。
[0160]
然后,将这些转化体分别在添加了氨苄青霉素和卡那霉素的lb培养基中培养6小时。另外,通过这样的6小时的培养(预培养),这些转化体的增殖达到极限。因此,后述的酶反应开始时刻的菌体量在这些转化体间变得均匀。
[0161]
另外,在12g/l胰蛋白胨、24g/l酵母提取物、10g/l甘油、9.4g/l磷酸氢二钾、2.2g/l磷酸二氢钾、20g/l乳糖、100mg/l氨苄青霉素和50mg/l卡那霉素中,以终浓度为0.5mm的方式添加作为底物的顺,顺-粘康酸(
シグマアルドリッチ
社制),制备出酶反应用培养基。
[0162]
然后,在顶空型气相色谱质谱分析仪(hs/gsms)用的10ml瓶中,添加上述培养了6小时的大肠杆菌培养液100μl和上述酶反应用培养基2.5ml,在刚添加后立即关闭瓶的盖,在37℃、振荡速度180rpm下进一步培养。通过gc-ms(制品名:gcms-qp ultra,岛津制作所社制)测定了表示在开始该培养18小时后在瓶的顶部空间(headspace)中生成的丁二烯(1,3-丁二烯)量的峰面积。然后,基于所得的测定值,将各种微生物来源的fdc中的丁二烯生成量与曲霉属来源的fdc中的生成量进行比较。
[0163]
其结果没有在图表中显示,但例如,在汉斯德巴氏酵母菌(debaryomyces hansenii)来源的fdc(uniprot id:q6bjq8)中,检测到与曲霉属来源的fdc相比为约0.2倍的活性,另外在colletotrichumchlorophyte来源的fdc(uniprot id:a0a1a3fmk0)中检测到与曲霉属来源的fdc相比为约4倍的活性。其中,在酿酒酵母(saccharomyces cerevisiae)来源的fdc(序列号2所记载的氨基酸序列)中,检测到与曲霉属来源的fdc相比为悬殊(约19.6倍)的活性(丁二烯生成量:24.5μm)。
[0164]
(实施例2)
[0165]
如实施例1所示,在酿酒酵母来源的野生型fdc中确认了高的丁二烯的生成催化活性。因此,为了进一步提高该高催化活性,与专利文献3同样地,在酿酒酵母来源的野生型fdc中,导入了将398位的异亮氨酸和/或397位的苯丙氨酸分别替换成其他氨基酸的突变。此外,酿酒酵母来源的fdc的398位和397位分别相当于曲霉属来源的fdc的395位和394位(参照专利文献3)。然后,对于所得的突变导入体,评价所述催化活性。
[0166]
具体地,设计、合成编码导入有各突变的氨基酸序列的引物。然后,以实施例1中制备的、编码酿酒酵母来源的野生型fdc的载体作为模板,使用所述引物,按照gibson assembly法的方案,制备能够将导入有各突变的fdc以在其c末端融合有多聚组氨酸标签的形态在大肠杆菌中表达的质粒载体(fdc改变体载体)。然后,通过上述<酶反应溶液的制备和酶活性的测定>,代替野生型fdc载体的而导入fdc改变体载体,制备转化体,测定酶活性。所得的结果示于表7。
[0167]
表7
[0168][0169]
由表7所示的结果表明,通过在酿酒酵母来源的fdc的398位,将该部位的异亮氨酸替换成其他氨基酸(谷氨酰胺、甲硫氨酸、天冬酰胺、苯丙氨酸、组氨酸或苏氨酸),从而大体上与丁二烯的生成有关的催化活性提高(与突变导入前的野生型的fdc相比,催化活性至少提高约3倍)。特别是将所述部位替换成谷氨酰胺的fdc突变体和将所述部位替换成甲硫氨酸的fdc突变体,所述催化活性分别提高到9.3倍和16.4倍。
[0170]
进而,如表7所示,还表明通过除了所述398位的氨基酸替换之外,将397位替换成其他氨基酸,从而所述催化活性能够进一步提高。特别是在将398位替换成谷氨酰胺的突变体中将397位替换成组氨酸或甲硫氨酸的情况下,与野生型的fdc相比,所述催化活性提高75.1倍和33.8倍。另外,在将398位替换成甲硫氨酸的突变体中将397位替换成组氨酸的情况下,与野生型的fdc相比,所述催化活性提高37.3倍。
[0171]
此外,在将397位替换成组氨酸、398位替换成谷氨酰胺的突变体中,在使底物(粘康酸)的浓度为10倍(5.0mm)的情况下的丁二烯的生成量为2.07mm。
[0172]
(实施例3)
[0173]
在实施例2中特别确认了催化活性的提高的双重突变体(f397h/i398q、f397m/i398q、f397h/i398m)中,将各种部位的氨基酸替换成其他氨基酸而制备了3重突变体,评价了它们的酶活性。
[0174]
其结果虽未图示,但表明,通过将286位、334位或440位的氨基酸分别替换成其他氨基酸,从而所述催化活性进一步提高。例如,通过在f397h/i398q中将189位的异亮氨酸替换成甲硫氨酸,从而与突变导入前相比催化活性提高1.2倍;通过将286位的甲硫氨酸替换成亮氨酸,从而与突变导入前相比催化活性提高1.5倍;通过将326位的苏氨酸替换成亮氨酸,从而与突变导入前相比催化活性提高1.1倍;通过将334位的缬氨酸替换成异亮氨酸,从而与突变导入前相比催化活性提高1.5倍。另外,通过在f397m/i398q和f397h/i398m中将334位的缬氨酸替换成异亮氨酸,从而与突变导入前相比催化活性分别提高1.1倍。
[0175]
产业可利用性
[0176]
如以上说明的那样,根据本发明,能够提供能够以高生产性制造丁二烯等不饱和烃化合物的酶、以及使用了该酶的不饱和烃化合物的制造方法。此外,根据本发明,可以不依靠化学合成、通过生物合成而制造不饱和烃化合物,因此对环境的负荷少。因此,本发明在丁二烯这样的合成橡胶等各种合成聚合物的原料的制造中是极其有用的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1