包含透明质酸和聚乙二醇的生物相容性水凝胶
1.本技术要求于2019年7月24日提交的韩国专利申请第10-2019-0089858号的优先权,其全部内容为本技术的参考。
2.本发明涉及含有透明质酸和聚乙二醇的生物相容性水凝胶,并且更特别涉及仅通过辐射照射而不添加反应器、化学交联剂等以诱导透明质酸与聚乙二醇的分子间和/或分子内交联来制备的生物相容性水凝胶,及其制备方法和用途。
背景技术:
3.近来,可注射水凝胶在医学领域备受关注,且有望得到广泛应用,如从医用填充剂中释放生理活性物质的释放系统,以及利用三维结构的器官/组织再生。这些可注射水凝胶具有无需外科手术而是使用注射器等简便地注射到体内的优点。一般而言,可注射的水凝胶与用注射器进行植入的体外流体具有相同的特性,并且为了操作方便需要具有流动性,以及注射到体内,并且应该在一个位置凝胶化,使得其形状通过化学或物理交联而不杂乱无章。也就是在植入后,可注射的水凝胶用作用于细胞或药物的持续释放的药物递送系统,以及维持细胞生长的支持物,或者需要通过在皮肤软组织中保持一定形状来呈现美容效果。
4.另一方面,这种水凝胶通常是通过向聚合物材料中添加诸如交联剂和/或固化剂的化学材料并使其交联来制备的。然而,由于在交联反应中使用的交联剂和/或固化剂对生物体有害,因此当将使用这种交联剂和/或固化剂制备的水凝胶用于活体时,存在所述水凝胶可能引起有害作用的问题。特别地,这种水凝胶不适合用作医疗和药物材料,例如伤口敷料、药物递送载体、隐形眼镜、软骨、肠道抗粘连剂等。另外,在使用交联剂和/或固化剂时,在水凝胶制备完成后需要将水凝胶中剩余的交联剂和/或固化剂除去,因此制备工艺复杂,且制备成本增加。
5.因此,正在持续进行不使用交联剂和/或固化剂来制备源自聚合物的水凝胶的努力,并且由于这些努力,已经报道了通过对合成聚合物照射辐射来制备水凝胶的结果。
6.然而,由于源自合成聚合物的水凝胶在生物相容性和生物降解性方面不适合用于医疗目的,因此需要开发仅通过生物相容性分子的分子内或分子间交联而无需使用交联剂、固化剂、有机溶剂等而形成的水凝胶。
7.另一方面,透明质酸是作为一种多糖的生物聚合物材料,其中由n-乙酰氨基葡萄糖和d-葡糖醛酸构成的重复单元线性连接。透明质酸最初从充填在动物眼球中的液体中分离出来,进而已知大量存在于动物的胎盘、关节的滑液、胸膜液、皮肤和公鸡的鸡冠中,甚至在马链球菌(streptococcus equi)、兽疫链球菌(streptococcus zooepidemecus)等链球菌微生物中产生。
8.由于其具有优异的生物相容性和在溶液中高粘弹性,因此已将透明质酸不仅广泛用于如化妆品添加剂的化妆品应用,还被广泛用于如眼科手术助剂、关节功能改善剂、药物递送材料和滴眼液的多种药物用途。然而,由于透明质酸本身在体内或在如酸性和碱性的
条件下易分解,且其用途非常受限,因此在制备基于透明质酸的水凝胶时,一般会加入化学交联剂(wo2013/055832)。
9.特别地,本领域熟知生物相容性聚合物如羧甲基纤维素、甲基纤维素、羟乙基纤维素和羧甲基淀粉可通过照射辐射形成凝胶(nuclear instruments and methods in physics research b 208(2003)320324,carbohydrate polymers 112(2014)412-415,nuclear instruments and methods in physics research b211(2003)533544等)。在透明质酸的情况下,通过照射辐射降低分子量和降低粘度,从而容易发生降解反应(韩国专利公开号10-2008-0086016等),但是仍未提供通过辐射照射来制备基于透明质酸的水凝胶,即仍未提供仅通过辐射而不添加化学交联剂、有机化学品等制备的基于透明质酸的水凝胶。
10.发明公开
11.技术问题
12.因此,本发明人反复进行了许多研究,以提供仅通过辐射照射而不使用化学交联剂、有机化学材料等来制备的基于透明质酸的生物相容性水凝胶,结果发现将另一种生物相容性聚合物(聚乙二醇)一起用于在特定制备条件下制备表现出各种物理性质的透明质酸-聚乙二醇水凝胶,从而完成了本发明。
13.因此,本发明的一个目的是提供水凝胶,其仅通过透明质酸和聚乙二醇(peg)的分子间交联、分子内交联,或者分子间和分子内交联形成。
14.本发明的另一个目的是提供制备仅通过透明质酸和聚乙二醇(peg)的分子间交联、分子内交联,或者分子间和分子内交联形成的水凝胶的方法,其包括:(a)通过将透明质酸和聚乙二醇加入水中来制备溶液;以及(b)通过对步骤(a)中制备的所述溶液照射辐射来诱导所述材料的交联。
15.本发明的再一个目的是提供包含所述水凝胶的细胞载体、药物载体、抗粘连剂、细胞支持物、牙科填充剂、矫形外科(orthopedic)填充剂、伤口敷料或皮肤填充剂。
16.本发明的另一个目的是提供用于伤口部位的皮肤施用的组合物,其包含所述水凝胶作为活性成分。
17.另外,本发明的另一目的是提供用于伤口部位的皮肤施用的组合物,其由所述水凝胶组成。
18.此外,本发明的另一个目的是提供用于伤口部位的皮肤施用的组合物,其基本上由所述水凝胶组成。
19.本发明的另一个目的是提供所述水凝胶在制备用于伤口部位的皮肤施用的药剂中的用途。
20.本发明的另一个目的是提供治疗伤口部位的方法,其通过将有效量的包含所述水凝胶作为活性成分的组合物施用于需要其的个体的皮肤上来进行。
21.技术方案
22.为了实现本发明的目的,本发明提供水凝胶,其仅通过透明质酸与聚乙二醇(peg)的分子间交联、分子内交联,或者分子间和分子内交联形成。
23.为了实现本发明的另一个目的,本发明提供制备仅通过透明质酸和聚乙二醇(peg)的分子间交联、分子内交联,或者分子间和分子内交联形成的水凝胶的方法,其包括:
(a)通过将透明质酸和聚乙二醇加入水中来制备溶液;以及(b)通过对步骤(a)中制备的所述溶液照射辐射来诱导所述材料的交联。
24.为了实现本发明的另一个目的,本发明提供包含所述水凝胶的细胞载体、药物载体、抗粘连剂、细胞支持物、牙科填充剂、矫形外科填充剂、伤口敷料或皮肤填充剂。
25.为了实现本发明的另一个目的,本发明提供用于伤口部位的皮肤施用的组合物,其包含所述水凝胶作为活性成分。
26.此外,本发明提供伤口部位的皮肤施用组合物,其由所述水凝胶组成。
27.此外,本发明提供用于伤口部位的皮肤施用的组合物,其基本上由所述水凝胶组成。
28.为了实现本发明的另一目的,本发明提供所述水凝胶在制备用于伤口部位的皮肤施用的药剂中的用途。
29.为了实现本发明的另一个目的,本发明提供治疗伤口部位的方法,其通过将有效量的包含所述水凝胶作为活性成分的组合物施用于需要其的个体的皮肤上来进行。
30.在下文中,会详细描述本发明。
31.本发明提供水凝胶,其仅通过透明质酸和聚乙二醇(peg)的分子间交联、分子内交联,或者分子间和分子内交联形成。
32.在使用聚合物制备水凝胶的方法中,通常使用交联剂来诱导聚合物的交联。在使用交联剂诱导聚合物交联的方法的情况下,由于交联剂介导分子间或分子内的键合,因此交联剂可能混合入水凝胶中,并且这可能存在问题,由于交联剂的浓度高,因此交联剂可能以活性状态残留在反应物中,或者存在反应后残留未反应产物,由此,在水凝胶制备过程中需要纯化处理。此外,残留在水凝胶中的交联剂在向体内给药后可能会引起多种副作用。然而,本发明人证实,在特定条件下将电子束照射到透明质酸和聚乙二醇的混合物以诱导透明质酸和/或聚乙二醇的分子间或分子内交联并形成水凝胶。仅通过透明质酸和/或聚乙二醇本身结合形成的水凝胶,而不含有如用于分子中物理交联而额外添加的交联剂或金属阳离子的外部材料,在相关技术中尚未报道,但由本发明人通过本发明首次公开。
33.另一方面,所有医用材料以及聚合物材料均绝对需要生物相容性,而这种生物相容性可以分为两个方面。广义的生物相容性是指对活体具有期望的功能和安全性,而狭义的生物相容性是指对活体的生物安全性,即无毒性和灭菌的。
34.然而,由于本发明的生物相容性水凝胶仅通过透明质酸和/或聚乙二醇的分子间或分子内交联形成,因此优点是不具有根据常规方法制备的基于透明质酸的水凝胶的问题并且具有非常优异的生物相容性。此外,由于在制备本发明的水凝胶的方法中可以通过在水溶液中照射电子束来制备水凝胶而不使用所有有机溶剂,因此在制备方法中不需要可能发生污染或复杂的处理,因此所述水凝胶对于工业用途是非常有用的。
35.即,本发明提供的水凝胶不与任何额外引入至透明质酸和聚乙二醇的官能团结合,并且除透明质酸和聚乙二醇外,没有交联剂直接参与或介导交联。
36.在本发明中,作为生物相容性水凝胶的原料的透明质酸,由于其化学结构中存在多官能团,因此在作为药物载体等中是非常有用的,并且由于诸如生物相容性和生物降解性的物理化学特性而具有比医学领域中的合成聚合物更优异的适用性(materials science and engineering c 68(2016)964-981)。
37.在本发明中,所述透明质酸包括所有的透明质酸、透明质酸盐,或者透明质酸与透明质酸盐的混合物。所述透明质酸盐可以是选自透明质酸钠、透明质酸钾、透明质酸钙、透明质酸镁、透明质酸锌、透明质酸钴和透明质酸四丁基铵中的至少一种,但不限于此。
38.在本发明中,聚乙二醇在药物递送领域和组织工程方面具有诸多优势,并且具有代表性的是在有机溶剂中的溶解度高且无毒,并且表现优异的生物相容性、无免疫反应的排斥,并且作为药物载体易于捕获和释放药物,且已经作为由美国食品和药品安全管理局批准用于人体的材料用于药物制剂工业。此外,聚乙二醇改善了亲水性聚合物中用于血液接触的聚合物的生物相容性,并且具有最大的抑制蛋白质吸附的作用,作为生物材料有很多用途[j.h.lee,j.kopecek和j.d.andrade,j.biomed.mater.res.,23(1989)351]。
[0039]
本发明提供的水凝胶可特别特征在于通过包括以下步骤的方法制备:
[0040]
(a)通过将透明质酸和聚乙二醇加入水中来制备溶液;以及
[0041]
(b)通过对步骤(a)中制备的所述溶液照射辐射来诱导所述材料的交联。
[0042]
根据各种实施方案,本发明人已经确立了仅通过透明质酸和聚乙二醇的分子间交联和/或分子内交联组成的水凝胶的制备条件,其通过辐射下照射来进行。
[0043]
根据本发明的实施方案,证实了非常重要的是组合各种条件以通过使用辐射下照射来诱导透明质酸和聚乙二醇的分子间交联和/或分子内交联以产生水凝胶。具体而言,证实了当透明质酸的分子量/浓度、聚乙二醇的分子量/浓度、能量照射量和能量强度不满足某些条件时,根本不形成所述水凝胶。此外,已证实可以通过适当控制这些条件来制备表现各种物理性质的水凝胶。
[0044]
根据本发明的另一实施方案,当将分子量为2至50kda的聚乙二醇以0.6至3%(w/v)的浓度加入水中时,不管要一起加入的透明质酸的浓度和分子量为何,通过控制辐射量和强度都形成了具有各种物理性质的水凝胶。
[0045]
特别地,证实了随着用于制备水凝胶的聚乙二醇的分子量增加,即使在较低的辐射剂量条件下也存在产生水凝胶的趋势。此外,证实了随着照射的辐射能量的强度增加,即使在较低浓度的聚乙二醇水溶液下也形成水凝胶。
[0046]
因此,在本发明的步骤(a)中,可以使用分子量为2至50kda的聚乙二醇,优选可以使用分子量为3至40kda的聚乙二醇,并且最优选可以使用分子量为3至35kda的聚乙二醇。
[0047]
此外,在本发明的步骤(a)中,可以将聚乙二醇以0.6至3%(w/v)的浓度,优选以0.8至2%(w/v)的浓度,更优选以0.8至1.5%(w/v)的浓度,并且最优选以0.9至1.2%(w/v)的浓度加入水中。
[0048]
因此,本发明的步骤(a)中使用的透明质酸的分子量以及水溶液中的透明质酸的浓度没有特别限定,但是可以使用分子量为50至3000kda的透明质酸,优选可以使用分子量为70至2700kda的透明质酸,并且最优选可以使用分子量为100至2500kda的透明质酸。
[0049]
在本发明的优选实施方案中,步骤(a)中聚乙二醇的浓度(w/v)等于或大于透明质酸的浓度(w/v)。
[0050]
同时,本发明的步骤(b)是通过对步骤(a)中制备的所述溶液照射辐射来诱导所述材料交联的步骤。
[0051]
通过辐射照射形成的水凝胶的优点是没有通过化学方法制备的水凝胶中所存在的残留毒性的问题,以及在交联的同时可以获得灭菌效果。在这种情况下,所使用的辐射可
以是选自γ射线、紫外线、x射线和电子束中的至少一种,并且优选电子束。
[0052]
根据本发明的实施方案,证实了在步骤(b)中为了形成水凝胶所照射的辐射的剂量和/或能量强度可以根据步骤(a)中所使用的透明质酸的分子量/浓度和聚乙二醇的分子量/浓度而变化。此外,证实了即使在形成水凝胶的条件下,水凝胶的物理性质也会随着所照射的辐射的剂量和/或能量强度而变化。证实了在预定范围内随着辐射剂量增加,会形成更坚硬的水凝胶,但证实当辐射剂量超过预定范围时,水凝胶中的交联被部分裂解,使得形成刚性程度降低的水凝胶。
[0053]
尽管在本发明的步骤(b)中所照射的辐射剂量和能量强度的范围没有特别限制,但辐射剂量可以优选为2至500kgy,更优选为5至300kgy,最优选为5至200kgy。另外,辐射的能量强度可以为0.5至20mev,优选为1至10mev,进一步优选为1至5mev,并且最优选为1至2.5mev。
[0054]
本发明提供的制备水凝胶的具体制备条件,即结合透明质酸的分子量/浓度、聚乙二醇的分子量/浓度、辐射剂量和辐射能量强度的具体实例,在本发明的实施例中具体呈现。
[0055]
此外,本发明提供制备仅通过透明质酸和聚乙二醇(peg)的分子间交联、分子内交联,或者分子间和分子内交联形成的水凝胶的方法,其包括以下步骤:
[0056]
(a)通过将透明质酸和聚乙二醇加入水中来制备溶液;以及
[0057]
(b)通过对步骤(a)中制备的所述溶液照射辐射来诱导所述材料的交联。
[0058]
可以与上述相同的方式应用所述制备方法的各个步骤的详细描述。
[0059]
本发明提供包含所述水凝胶的细胞载体、药物载体、抗粘连剂、细胞支持物、牙科填充剂、矫形外科填充剂、伤口敷料(片型、凝胶型、喷雾型、乳膏型等)或皮肤填充剂。
[0060]
在本发明中,由于可以通过根据所需用途在上述范围内改变制备条件来提供满足各种物理性质的水凝胶,因此可以提供具有适用于各个用途的粘弹性和体内分解期限的水凝胶。此外,由于在制备过程中不使用任何化学交联剂和有机化学材料,因此生物相容性非常优异,使得所述水凝胶可以用于多种目的。
[0061]
由于生物相容性水凝胶已广泛用于细胞载体、药物载体、抗粘连剂、细胞支持物、牙科填充剂、矫形外科填充剂、伤口敷料(片型、凝胶型、喷雾型、乳膏型等)、皮肤填充剂等。由于本领域对此进行了积极的研究,对于本领域技术人员来说,本发明提供的水凝胶也可以用于这些用途是明显的。
[0062]
根据本发明的实施方案,已经证实本发明提供的水凝胶具有在体内在预定时间内维持其体积和形状的非常优异的性质,以便具有作为皮肤填充剂应用的可能性。
[0063]
因此,优选将本发明的水凝胶注射到皮肤的真皮层中以用作用于改善皱纹、改善唇部轮廓、改善痤疮疤痕和填充皮肤凹陷和/或疤痕的皮肤填充剂。
[0064]
本发明提供的细胞载体、药物载体、抗粘连剂、细胞支持物、牙科填充剂、矫形外科填充剂、伤口敷料(片型、凝胶型、喷雾型、乳膏型等)或皮肤填充剂可另外包含除了水凝胶以外的多种一般添加剂。尽管这些添加剂的类型没有特别限定,但可以包含例如染料、着色颜料、植物油、增稠剂、ph调节剂、渗透压调节剂、维生素、抗氧化剂、无机盐、防腐剂、增溶剂、等渗剂、助悬剂、乳化剂、稳定剂、麻醉剂等。
[0065]
此外,本发明提供用于伤口部位的皮肤施用的组合物,其包含所述水凝胶作为活
性成分。
[0066]
本发明的“伤口”是指组织的连续性被外部压力破坏的状态。所述伤口包括擦伤、瘀伤、撕裂伤、刀造成的割伤等。
[0067]
所述用于伤口部位的皮肤施用的组合物可以另外包含能够有助于伤口愈合的已知药物、消毒剂等,并且可以配制成伤口敷料并以片型、凝胶型、喷雾型或乳膏型伤口敷料使用。
[0068]
在本发明的一个方面,用于伤口部位的皮肤施用的组合物可以包含但不限于上述本发明的水凝胶,但可以包含使用优选分子量为500kda或更高,且最优选分子量为1000kda或更高的透明质酸制备的水凝胶。
[0069]
在本发明的另一个方面,用于伤口部位的皮肤施用的组合物可以包含但不限于上述本发明的水凝胶,但可以包含透明质酸与聚乙二醇的浓度比(w/v)为1∶1至4,优选1∶1至3,且最优选1∶1至2的水凝胶。
[0070]
本发明提供所述水凝胶在制备用于伤口部位的皮肤施用的药剂中的用途。
[0071]
本发明提供治疗伤口部位的方法,其通过将有效量的包含所述水凝胶作为活性成分的组合物施用于需要其的个体的皮肤上来进行。
[0072]
本发明的“有效剂量”是指当给药于个体时表现出改善、治疗、检测和诊断所述伤口或者抑制或减少所述伤口进展的效果的量。所述“个体”可以是动物,优选哺乳动物,特别是包括人在内的动物,并且也可以是来源于动物的细胞、组织和器官。所述个体可以是需要所述效果的患者。
[0073]
本发明的“治疗”泛指改善伤口部位或由伤口导致的症状,并且可包括治疗或基本上预防伤口,或者改善其状况,并且包括减轻、治疗或预防源自所述疾病的一个症状或大部分症状,但不限于此。
[0074]
本文中的术语“包含”以与“包括”或“特征在于”相同的含义使用,并且不排除在根据本发明的组合物或方法中未具体提及的其它成分或方法步骤。除非另有说明,术语“由...组成”是指排除其它元件、步骤或成分等。术语“基本上由...组成”是指除了在所述组合物或方法的范围内描述的材料或步骤之外,还包括基本上不影响其基本性质的材料或步骤。
[0075]
有益效果
[0076]
由于本发明的水凝胶是通过电子束诱导透明质酸和聚乙二醇的分子间和/或分子内交联而制备的,因此不存在由于混合了有机溶剂或交联剂而在人体中具有毒性的风险,在制备过程中不需要单独的纯化程序,并且只需在短时间内照射电子束即可大量生产,因此即使在生产率方面也非常优异。此外,由于本发明的水凝胶具有非常优异的生物相容性,因此可以非常有效地用于细胞载体、药物载体、抗粘连剂、细胞支持物、牙科填充剂、矫形外科填充剂、伤口敷料、皮肤填充剂等的开发。
[0077]
[附图描述]
[0078]
图1是目测通过100kda透明质酸(ha)和3kda peg的浓度和电子束剂量是否形成水凝胶的图示(y:水凝胶形成/n:无水凝胶形成)。
[0079]
图2是目测通过100kda ha和10kda peg的浓度和电子束剂量是否形成水凝胶的图示(y:水凝胶形成/n:无水凝胶形成)。
[0080]
图3是目测通过100kda ha和20kda peg的浓度和电子束剂量是否形成水凝胶的图示(y:水凝胶形成/n:无水凝胶形成)。
[0081]
图4是目测通过100kda ha和35kda peg的浓度和电子束剂量是否形成水凝胶的图示(y:水凝胶形成/n:无水凝胶形成)。
[0082]
图5是证实甚至将本发明的方法应用于大量生产时是否形成水凝胶的结果。
[0083]
图6至图9是用扫描电子显微镜观察在指定条件下形成的水凝胶的孔径的图。
[0084]
图10是评估对1%100kda ha和1%20kda peg照射100kgy电子束而制成的水凝胶的各溶剂的溶胀比的结果。
[0085]
图11是示例说明目测通过将在指定条件下形成的水凝胶插入到动物腹腔中放置1周后分解程度的实验方法的图。
[0086]
图12是目测通过将在指定条件下形成的水凝胶插入到动物腹腔中放置1周后分解程度的图。
[0087]
图13至图22是通过观察将在指定条件下形成的水凝胶插入到动物前额或后背后随时间的形状保持度来目测作为活体中的填充剂的适用性的结果。
[0088]
图23是目测在指定条件下形成的ha-peg水凝胶片以评估作为伤口敷料的功效的图。
[0089]
图24是在伤口动物模型的伤口部位贴敷本发明的ha-peg水凝胶伤口敷料后,目测伤口随时间的愈合程度的结果。
[0090]
图25是显示在伤口动物模型的伤口部位贴敷本发明的ha-peg水凝胶伤口敷料之后随时间测量的伤口面积的结果图。
[0091]
图26是通过在伤口动物模型的伤口部位贴敷本发明的ha-peg水凝胶伤口敷料来使伤口愈合后,测量愈合皮肤的厚度的结果。
[0092]
发明模式
[0093]
在下文中,将通过以下实施例详细描述本发明。然而,以下实施例仅为本发明的示例说明,并且本发明的内容不限于以下实施例。
[0094]
实施例1:通过电子束照射制备透明质酸(ha)-聚乙二醇(peg)水凝胶
[0095]
本发明人在以下各种条件下进行了实验,在不添加交联剂下,仅通过电子束照射制备了ha-peg复合水凝胶。在下文的实施例结果中,以y表示其中形成水凝胶的情况,并且以n表示未形成水凝胶的情况。另外,水凝胶也以本体凝胶(bulk gel)表示。
[0096]
首先,在将100kda的透明质酸和0.6kda至35kda的peg混合的条件下,根据各浓度和电子束剂量的结果可以总结在下表和照片中。
[0097]
在0.6kda和1kda的peg中,证实了在进行实验的所有条件下都没有形成凝胶。
[0098][0099]
[0100][0101]
在使用3kda peg的实验中,从50kgy的电子束剂量开始形成水凝胶,并且证实了随着透明质酸浓度降低而更好地形成凝胶的趋势。尽管即使在100kgy也形成了水凝胶,但通过对应于各个条件的凝胶照片也证实了形成比在50和200kgy下所形成的水凝胶略微更高粘度的凝胶的趋势(图1)。通过这个部分,证实了随着电子束剂量的略微增加,交联增加,因此没有形成更硬的凝胶。
[0102][0103]
即使在使用10kda peg的实验中,也证实了透明质酸的浓度越低,水凝胶在越低的电子束剂量(10kgy)下开始形成,并且再次证实水凝胶在50kgy和100kgy下形成,但在200kgy下形成硬度略低的水凝胶,因此即使交联随着电子束剂量的增加而略微增加,但没有形成硬水凝胶。
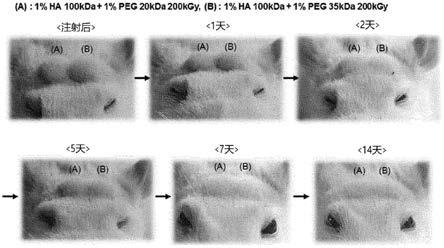
[0104][0105]
在使用20kda peg的实验中,当透明质酸浓度为0.1%时,从5kgy的剂量开始硬度稍弱,但开始形成水凝胶。另外,在50kgy和100kgy下形成水凝胶,但在200kgy下形成硬度略低的水凝胶,因此证实了与使用10kda peg的实验结果相同的趋势(图3)。
[0106][0107][0108]
即使在使用35kda peg的实验中,与使用20kda peg的结果类似,当透明质酸的浓度为0.1%时,从5kgy的剂量开始形成水凝胶。
[0109]
当透明质酸的浓度为0.1%和0.5%时,证实在50kgy和100kgy下形成强硬度的水凝胶,但在200kgy下形成硬度较弱的水凝胶。
[0110][0111]
同时,还通过选择一些良好地形成凝胶的条件,进行了合成大量凝胶的实验,并且证实可以容易地大量(而不是少量)合成具有相同特性的凝胶(图5)。
[0112]
以前,虽然浓度固定在1%,但实验是在其中浓度为0.1%、0.5%和1%的100kda透明质酸与不同分子量(0.6至35kda)的peg混合的条件下进行的,另一方面,虽然将100kda透明质酸的浓度固定为1%,但将不同分子量的peg的浓度变为0.1%、0.5%、1%,以证实在各条件下凝胶的形成。
[0113]
首先,在0.6kda和1kda的peg中,证实了在进行实验的所有条件下都没有形成凝胶。
[0114][0115]
[0116]
在使用3kda peg的实验中,仅在其中与1%浓度的peg混合在一起的条件下形成凝胶,并且证实了仅在应用100kgy和200kgy剂量的条件下形成水凝胶。
[0117][0118]
即使在10kda的peg中,也证实了只有在其中与1%浓度的peg混合在一起的条件下才能形成凝胶,并且在50kgy和100kgy下照射的样品形成水凝胶,但在200kgy下照射的样品形成硬度稍弱的水凝胶。
[0119][0120]
即使在20kda的peg中,证实在与1%peg混合的条件下以50kgy和100kgy照射的样品形成水凝胶,但以200kgy照射的样品形成硬度稍弱的水凝胶,并且证实了与使用10kda peg的实验结果相同的趋势。
[0121][0122]
证实了即使在35kda的peg中,由在与1%peg混合的条件下用10kgy照射的样品形成硬度稍弱的水凝胶,并且证实了用50kgy和100kgy照射的样品形成水凝胶,但以200kgy照射的样品形成硬度稍弱的水凝胶。
[0123]
总结这些结果,在与1%的100kda透明质酸混合的条件下,通过电子束照射形成凝胶时根据peg的分子量而存在差异,但非常重要的是peg的浓度为1%,甚至不止于此。由于证实在与10kda或更高的peg混合的条件下,在200kgy下,水凝胶的硬度略有降低,因此再次证实即使随着电子束剂量增加,交联略微增加,但未形成更硬的水凝胶。
[0124][0125]
接着,进行了比较电子束照射能量的实验。目前为止,实验是通过将所有电子束照射能量固定为1 mev进行的,但进行了其中能量变为2.5mev且其它条件保持相同的实验,以证实在电子束照射条件下所表现的凝胶形成的差异。
[0126]
首先,在0.6kda peg中,证实在进行实验的所有条件下都没有形成凝胶。
[0127][0128]
接着,在使用1kda peg的实验中,证实了电子束照射能量强度的差异,但证实了与在1mev下不同,当在2.5mev下对1%浓度的1kda peg用300kgy电子束照射时形成水凝胶。
[0129][0130][0131]
在使用3kda peg的实验中,证实了在使用0.5%peg的所有条件下都没有形成凝胶,并且在使用1%peg的条件下,存在水凝胶从100kgy开始在1mev和2.5mev下均形成的相同趋势。
[0132][0133]
即使在使用10kd peg的实验中,也证实了在使用0.5%peg的所有条件下均未形成凝胶,并且在使用1%peg的条件下,存在从50kgy开始在1mev和2.5mev条件下均形成水凝胶的相同趋势。
[0134][0135]
类似地,即使在便用20kda peg的实验中,在便用0.5%peg的所有条件下均未形成凝胶,但在使用1%peg的条件下,证实根据电子束照射能量的强度而有差异,并且与1mev不同,证实在2.5mev下从10kgy开始形成水凝胶的差异。
[0136][0137]
即使在使用35kda peg的实验中,类似地证实了在使用0.5%peg的所有条件下均未形成凝胶,并且在使用1%peg的条件下,在1mev和2.5mev下均从10kgy开始形成水凝胶。然而,已证实使用2.5mev在200kgy和300kgy下所形成的水凝胶比在1mev下所形成的水凝胶的硬度稍高。
[0138][0139][0140]
总结以上结果,可以预测随着电子束照射能量的增加,能量会更深入地传递到样品中,从而更容易形成凝胶。
[0141]
接着,使用1%的分子量较高的2500kda透明质酸,在5kgy至200kgy的照射剂量范围内,在与不同浓度的peg混合的条件下进行电子束照射实验。
[0142]
在0.6kda和1kda的peg中,证实了在进行实验的所有条件下均未形成凝胶。
[0143]
[0144][0145]
在使用3kda peg的实验中,证实了在混合1%peg并以100kgy照射的条件下形成水凝胶,而也证实了当以200kgy照射时,形成了硬度稍弱的水凝胶。证实了即使随着电子束剂量的增加,交联进一步增加,但也没有形成硬水凝胶。
[0146][0147]
即使在10kda的peg中,也只在其中混合1%peg的条件下形成凝胶,但与此不同的是,证实了在50kgy照射条件下形成了水凝胶,并证实了水凝胶在100kgy和200kgy下均形成。
[0148][0149]
证实了即使在20kda peg中,在其中混合1%的20kda peg和以50kgy照射的条件下形成水凝胶,其趋势与在其中混合10kda peg的条件下相同,并且证实水凝胶在100kgy和200kgy下均形成。证实了10kda和20kda的peg在电子束照射实验条件下没有显示出显著差异。
[0150][0151]
即使在35kda的peg中,结果也与10kda和20kda的peg类似,但水凝胶是从其中混合1%的peg并以10kgy照射的条件开始形成。因此,证实了随着混合的peg的分子量增加,凝胶开始由较低的电子束剂量形成。
[0152][0153]
当总结所述结果时,证实使用100kda透明质酸的结果趋势总体上几乎相同,并且证实即使使用比分子量大得多的2500kda的透明质酸,凝胶也仅在其中混合1%peg的条件
下形成。此外,证实随着混合的peg分子量的增加,凝胶也开始从较低的电子束剂量形成。此外,在使用3kda peg的实验中,证实在100kgy照射条件下形成水凝胶,但当以200kgy照射时,形成的水凝胶硬度略低,因此与上述实验相同方式再次证实,即使随着电子束剂量的增加,交联增加,但也不会形成更硬的水凝胶。
[0154]
实施例2:通过电子束照射形成的ha-peg水凝胶的孔隙观察和保水性的确证
[0155]
为了确定通过电子束照射形成的透明质酸-peg水凝胶的孔径大小,将水凝胶样品冷冻干燥,用刀片切成两半,然后涂上锇,之后通过扫描电子显微镜(sem)证实孔的大小和厚度。在通过sem的分析实验中,使用了通过对1%10kda peg、20kda peg和35kda peg以及1%100kda透明质酸以100kgy和200kgy照射来制备的透明质酸-peg水凝胶。
[0156]
首先,当通过sem描述通过对与1%100kda透明质酸混合的l%10kda peg以100kgy和200kgy照射来制备的透明质酸-peg水凝胶时,证实了通过冷冻干燥制备的样品的厚度随着电子束剂量的增加而略微变薄,并且证实在孔的大小或在形成孔的膜之间的厚度没有显著差异(图6)。
[0157]
接着,当描述通过对与1%100kda透明质酸混合的1%20kda peg以100kgy和200kgy照射来制备的透明质酸-peg水凝胶时,再次证实通过冷冻干燥形成的样品的厚度随着电子束剂量的增加而变薄。证实了孔的大小也有所减小,并且形成孔的膜的厚度变得更厚(图7)。
[0158]
最后,证实了通过对与1%100kda透明质酸混合的1%35kda peg以100kgy和200kgy照射来制备的透明质酸-peg水凝胶,与20kda peg的结果类似,证实了冻干样品的厚度随着电子束剂量的增加而变薄,并且证实孔的大小也减小,且形成孔的膜厚度没有显著差异(图8)。
[0159]
接着,待冻干样品的量足以用于使厚度足够厚,然后进行实验以通过扫描电子显微镜通过对同一样品同样的方法证实与透明质酸混合的peg根据分子量和电子束剂量的差异。结果,证实了孔的大小随着混合的peg的分子量增加而增加,并且还清晰地证实了孔的大小随着电子束剂量的增加而减小的趋势(图9)。
[0160]
接着,进行实验以证实透明质酸-peg水凝胶可以保留多少溶剂(溶胀),并将通过对1%100kda透明质酸和1%20kda peg照射100kgy的电子束形成的水凝胶进行冷冻干燥以匹配相同的大小,然后加入各种类型的溶剂,如水、盐水、pbs、dmso、meoh、dmf、etoh和thf,以监测随着时间对每种溶剂的保留量以及其大小和重量,监测进行10小时。结果表明,透明质酸-peg水凝胶的重量在5分钟内达到最大值,迅速吸收了大部分溶剂,但根据溶剂的类型而有不同,并且证实与在其它溶剂中相比,在水中溶胀度最高,接下来透明质酸-peg水凝胶在基于水的溶剂中的溶胀能力依次为生理盐水和pbs。预计这样的结果是由于透明质酸-peg水凝胶中所含的透明质酸的优异的保水能力所致(图10)。
[0161]
实施例3:证实ha-peg水凝胶在体内分解
[0162]
接着,进行实验以证实透明质酸-peg水凝胶在体内的分解程度,并将通过用100kgy的电子束照射1%100kda透明质酸和1%20kda peg以及1%100kda透明质酸和1%35kda peg所形成的两种水凝胶切成宽和长分别为1cm,然后插入c57bl/6j小鼠腹腔,1周后切开腹部,并确证分解程度(图11)。
[0163]
结果证实,分解程度根据与透明质酸混合的peg的分子量而有所不同。1周后,当取
出插入的透明质酸-peg水凝胶并检查时,证实混合有20kda的peg的透明质酸-peg水凝胶(其分子量略小于混合有35kda的peg的透明质酸-peg水凝胶)分解略快,并且其尺寸减小。通过这些结果可以预测,在透明质酸-peg水凝胶中混合的peg的分子量越小,则在体内分解的趋势越快(图12)。
[0164]
实施例4:证实ha-peg水凝胶在活体作为填充剂的适用性
[0165]
为了进行使用通过电子束照射合成的透明质酸-peg水凝胶作为填充剂的功效评估,使用sd-大鼠制备动物模型。在气体麻醉下,将sd-大鼠前额的毛发去除干净,左侧和右侧的通过照射电子束所形成的样品类型彼此不同,并使用29g注射器注射50μl,然后通过照片彼此比较两个样品之间的功效。
[0166]
首先,将通过用200kgy电子束照射1%100kda透明质酸和1%20kda peg以及1%100kda透明质酸和1%35kda peg形成的水凝胶分别注射到sd-大鼠前额的左侧和右侧。
[0167]
证实了在两个样品保持至14天时体积维持的结果,但两个样品之间没有显著差异。因此,证实了分子量范围为20kda和35kda的peg与透明质酸混合而形成的水凝胶作为填充剂的功效是相似的(图13)。
[0168]
其后,将同一样品注射入另一只sd-大鼠的前额,再次证实器结果,并进行3周的监测。结果表明,与之前的实验一样,两个样品的体积直至14天仍明显维持,但在3周时,证实体积与第一次注射相比显著减小,通过照片有些难以清晰观察,但当用手触摸时确认两个样品中的体积在一定程度上维持。即使在重复实验中,也可以再次证实透明质酸-peg水凝胶作为填充剂的功效(图14)。
[0169]
接下来,通过对比在临床实践中实际用作填充剂的restylane co.,ltd.的名为skinboosters的产品与通过用200kgy电子束照射1%100kda透明质酸和1%35kda peg形成的透明质酸-peg水凝胶进行了实验。结果证实了两个样品的体积维持程度随着时间均逐渐减小,并且当进行长达3周的监测时,两个样品的体积均得以维持。尽管填充剂的功效和持久性根据相关技术领域中使用的填充剂产品的类型和用途而略有不同,但已证实具有与实验中使用的restylane co.,ltd的skinboosters产品相似的填充剂效果(图15)。
[0170]
接下来,通过使用在电子束剂量增加到300kgy而不是200kgy的条件下形成的透明质酸-peg水凝胶来证实作为填充剂的功效,并且结果证实与第一次注射相比体积缓慢减小,但当监测长达3周时,两个样品的体积得以维持。然而,由于根据电子束剂量形成的透明质酸-peg水凝胶的弹性和硬度有些不同,因此与使用200kgy的样品相比,使用300kgy的样品对于用作填充剂而言不够软。因此,证实注入有点僵硬,并且注入的填充剂的形状不是平滑的圆形而是稍微变形(图16)。
[0171]
甚至还使用当在电子束照射实验中使用的透明质酸浓度和peg分子量不同时制备的透明质酸-peg水凝胶进行填充剂功效实验。将用100kgy和200kgy电子束照射0.1%或0.5%100kda透明质酸和1%3kda peg而制备的水凝胶分别注入两只sd-大鼠的前额,但证实由于作为填充剂的效力不足,注射后体积迅速减小,并且14天后几乎没有体积维持。因此,证实了需要在电子束照射实验中使用适当浓度的透明质酸(图17)。
[0172]
另外,即使当通过将电子束照射实验中使用的透明质酸的分子量改变为2500kda进行实验时,合成了透明质酸-peg水凝胶,并且当使用所合成的透明质酸-peg水凝胶进行填充剂功效实验时,证实样品的所有体积均维持直至3周,并且结果与使用100kda透明质酸
制备的透明质酸-peg水凝胶中的结果几乎类似(图18)。
[0173]
当然,在使用2500kda透明质酸的透明质酸-peg水凝胶合成中,由于使用100kgy作为电子束剂量,因此很难与使用200kda的基于100kda透明质酸的透明质酸-peg水凝胶进行清晰比较,但证实了基于2500kda的透明质酸-peg水凝胶(由于分子量大而预期作为填充剂的效果非常优异)也足以用作填充剂。
[0174]
此外,在未照射电子束的透明质酸+peg样品的情况下,确认了甚至在注入sd-大鼠前额1天后,体积就迅速消失,并且结果证实了通过透明质酸和peg之间的交联形成水凝胶需要电子束照射处理(图19)。
[0175]
接着,评估了使用50kgy的电子束剂量制备的水凝胶作为填充剂的功效。
[0176]
在气体麻醉下,将sd-大鼠前额上的毛发去除干净,将通过用50kgy电子束照射1%2500kda透明质酸和1%35kda peg制备的本体凝胶注射入sd-大鼠前额的左侧和右侧(使用29g注射器注射100μl)。其后,使用照片和卡尺观察注射入填充剂的两侧的体积直至共90天,结果证实第一次注射后体积增加至约1.8倍,然后体积逐渐减小,但即使在90天后,其体积也保持在第一次注射时体积的约35%(图20)。
[0177]
除了sd-大鼠,还另外进行了使用c57bl试验小鼠的实验。将小鼠背部毛发去除干净后,将所制备的本体凝胶样品分别注射入小鼠背部左侧和右侧(用29g注射器注射100μl)。类似地,监测90天,结果证实即使在90天之后,体积也保持在第一次注射时体积的约59%(图21)。
[0178]
此外,进行了通过与restylane co.,ltd.的skinboosters产品(其已在临床实践中实际用作填充剂)比较作为填充剂的功效的实验。将balb/c小鼠背部毛发去除干净后,将restylane的填充剂产品注射入去除毛发的背部左侧,并将用50kgy电子束照射1%2500kda透明质酸和1%35kda peg制备的本体凝胶注射入其右侧(注射100μl)。共监测60天,结果证实两个样品的体积随着时间逐渐减小,并且通过照片证实两个样品的体积均维持直至60天。作为观察结果,证实根据本发明的方法制备的本体凝胶呈现出比restylane的产品更好的填充剂功效(图22)。
[0179]
实施例5:ha-peg水凝胶伤口敷料的功效
[0180]
为了评估根据本发明的ha-peg水凝胶作为伤口敷料的功效,首先制备伤口实验模型。在balb/c裸鼠背部左侧和右侧用直径8mm的活检打孔器造成伤口后,将4种类型的ha-peg水凝胶样品置于伤口上并用胶带包扎,然后每3天更换一次水凝胶样品以监测伤口大小,持续13天(图23)。在伤口敷料效力比较实验中,以未处理的对照组作为对照组进行实验。
[0181]
每3天更换一次水凝胶样品,检查伤口大小,共监测13天,观察各实验组伤口愈合程度和皮肤再生。结果表明,在用ha-peg#3和ha-peg#4水凝胶治疗的组中,证实了伤口愈合速度最快,并且在13天时疤痕尺寸较小(图24)。
[0182]
将监测期间各组的伤口面积按日期汇总在图表中,如图25所示,在用ha-peg#3和ha-peg#4的水凝胶治疗组中,在第13天与对照组相比,证实伤口面积和疤痕大小分别保持小1.65倍和2.3倍。
[0183]
因此,确认在伤口引起的初始炎症反应中,ha通过与纤维蛋白和血栓的相互作用促进结构骨架的形成,促进伤口愈合所需的细胞运动,并同时在肉芽组织中形成网络以诱
导细胞增殖和细胞组构,并帮助角质形成细胞(表皮的核心细胞)生长良好,以取得这些效果。
[0184]
测量伤口面积后,提取皮肤组织,并通过h&e染色测量皮肤组织的厚度,结果表明,在所有用ha-peg水凝胶处理的组中,证实了与对照组相比更薄的皮肤厚度。考虑到随着皮肤厚度的增加,胶原蛋白沉积导致的伤口厚度和形状不均匀的特点,证实了ha-peg水凝胶阻止胶原蛋白在皮肤中的沉积,以表现出伤口敷料效力(图26)。
[0185]
工业实用性
[0186]
由于本发明的水凝胶是通过电子束诱导透明质酸和聚乙二醇的分子间和/或分子内交联而制备的,因此不存在由于混合有机溶剂或交联剂而在人体产生毒性的风险,在制备过程中不需要单独的纯化处理,并且只需在短时间内照射电子束即可大量生产,因此即使在生产率方面也非常优异。此外,由于本发明的水凝胶具有非常优异的生物相容性,因此可非常有效地用于开发细胞载体、药物载体、抗粘连剂、细胞支持物、牙科填充剂、矫形外科填充剂、伤口敷料、皮肤填充剂等,因此工业实用性非常高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1