提升抗体对于抗原的亲和性的方法及其利用与流程
提升抗体对于抗原的亲和性的方法及其利用
【技术领域】
1.本发明涉及提升抗体对于抗原的亲和性的方法。本发明涉及与未改变的抗体相比而对于抗原的亲和性提升的抗体的制造方法。本发明涉及与未改变的抗体相比而对于抗原的亲和性提升的改变抗体。
背景技术:
2.以往已知,通过改变抗体的氨基酸序列,使该抗体对于抗原的亲和性改变的技术。例如,在专利文献1中,记载了通过将抗体的框架区域3的至少3个氨基酸残基设为荷电氨基酸残基来控制对于抗原的亲和性的方法。在此方法中,在维持互补性决定区域(cdr)的氨基酸序列的状态下,抗体对于抗原的亲和性提升。
3.【现有技术文献】
4.【专利文献】
5.专利文献1:美国专利申请公开第2018/0179298号说明书
6.【发明的概要】
7.【发明要解决的课题】
8.本发明旨在提供不改变cdr的氨基酸序列,通过改变框架区域(fr)的氨基酸残基来提升抗体对于抗原的亲和性的新的方法、及对于抗原的亲和性提升的新的抗体。
9.【用于解决课题的手段】
10.本发明人发现,抗体的轻链的fr的氨基酸序列中的各位置的指定的氨基酸残基的氨基酸频度的合计值、及所述fr中的各氨基酸残基的暴露于溶剂的表面积比率与抗体对于抗原的亲和性相关,从而完成本发明。
11.本发明提供提升抗体对于抗原的亲和性的方法,其包括:通过在未改变的抗体中,将选自由kabat法定义的轻链的第60、63、65、67、70、72、74、76、77、79及81位氨基酸残基的至少3个氨基酸残基设为荷电氨基酸残基,与未改变的抗体相比而提升对于抗原的亲和性,所述3个氨基酸残基含选自轻链的第60、74、76、77、79及81位氨基酸残基的至少1个。
12.本发明提供与未改变的抗体相比而对于抗原的亲和性提升的抗体的制造方法,其包括:在未改变的抗体中,将选自由kabat法定义的轻链的第60、63、65、67、70、72、74、76、77、79及81位氨基酸残基的至少3个氨基酸残基设为荷电氨基酸残基的工序,及回收在此工序中得到的抗体的工序,所述3个氨基酸残基含选自轻链的第60、74、76、77、79及81位氨基酸残基的至少1个。
13.本发明提供与未改变的抗体相比而对于抗原的亲和性提升的改变抗体。在此改变抗体中,选自未改变的抗体中的由kabat法定义的轻链的第60、63、65、67、70、72、74、76、77、79及81位氨基酸残基的至少3个氨基酸残基被设为荷电氨基酸残基,所述3个氨基酸残基含选自轻链的第60、74、76、77、79及81位氨基酸残基的至少1个。
14.【发明的效果】
15.根据本发明,提供对于抗原的亲和性提升的抗体。
16.【附图的简单的说明】
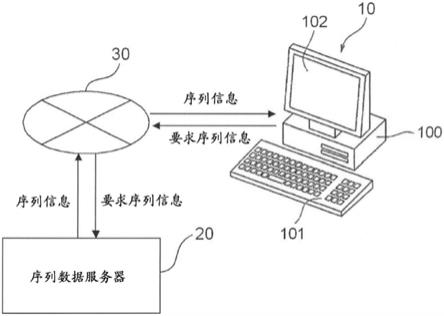
17.【图1】是氨基酸序列的解析系统的概略图。
18.【图2】是显示氨基酸序列的解析系统的硬件构成的图。
19.【图3】是显示利用氨基酸序列的解析装置的未改变的抗体的氨基酸序列的解析处理的流程图。
20.【图4】是显示解析结果的显示画面的一例的图。
21.【图5】是显示利用氨基酸序列的解析装置的用于确定抗体的改变位置的候选的氨基酸序列的解析处理的流程图。
22.【图6】是显示解析结果的显示画面的一例的图。
23.【图7】是显示利用氨基酸序列的解析装置的用于制成将抗体的改变位置的候选设为荷电氨基酸残基之时的序列的氨基酸序列的解析处理的流程图。
24.【图8】是显示利用氨基酸序列的解析装置的用于制成在cdr的电特性是中性时将抗体的改变位置的候选设为碱性氨基酸残基之时的序列的氨基酸序列的解析处理的流程图。
25.【图9】是将抗体的溶出液用sds-page分离而用考马斯亮蓝(cbb)染色的凝胶的照片。
【具体实施方式】
26.[1.提升抗体对于抗原的亲和性的方法]
[0027]
在本实施方式的提升抗体对于抗原的亲和性的方法(以下,也称为“亲和性的提升方法”)中,在抗体的轻链的fr的氨基酸序列中满足指定的条件的氨基酸残基之中,将至少3个氨基酸残基设为荷电氨基酸残基。由此,抗体对于抗原的亲和性与未改变的抗体相比提升。其中,将通过由上述的本发明提供的方法而变得对于抗原的亲和性提升的原来的抗体称为“未改变的抗体”。在本说明书中,“未改变的抗体”是指具有适用“亲和性的提升方法”之前的氨基酸序列的抗体。“未改变的抗体”不仅是具有天然的氨基酸序列的抗体(野生型的抗体),也含基于“亲和性的提升方法”以外的方法而人为变更氨基酸序列的抗体。
[0028]
在本实施方式中,未改变的抗体不特别限定。本实施方式的亲和性的提升方法由于无变更cdr的氨基酸序列的必要,也可为识别任何抗原的抗体。在优选的实施方式中,未改变的抗体是编码轻链的可变区域的基因的碱基序列是公知的或是能确认该碱基序列的抗体。具体而言,在公知的数据库中公开了抗体基因的碱基序列的抗体,或产生该抗体的杂交瘤是可得到的抗体。作为这样的数据库,可举出例如genebank、abysis、imgt等。抗体的类虽然可为igg、iga、igm、igd及ige之任一者,但优选为igg。未改变的抗体只要是具有含fr的可变区域,就也可处于抗体片段的形态。作为这样的抗体片段,可举出例如fab片段、f(ab')2片段、fab'片段、fd片段、fv片段、dab片段、单链抗体(scfv)、还原型igg(rigg)等。在它们之中,也特别优选fab片段。
[0029]
作为未改变的抗体的一例,人源化抗her2抗体(曲妥珠单抗)的轻链及重链的氨基酸序列、以及fab片段的重链的氨基酸序列示于表1。表1中,加下划线部表示可变区域,以灰色标记的部分表示cdr。
[0030]
【表1】
[0031][0032][0033]
野生型的人源化抗her2抗体的轻链的各cdr及可变区域的氨基酸序列如下所述。
[0034]
·
轻链cdr1:rasqdvntav a(seq id no:38)
[0035]
·
轻链cdr2:sasflys(seq id no:39)
[0036]
·
轻链cdr3:qqhyttppt(seq id no:40)
[0037]
·
可变区域:diqmtqspss lsasvgdrvt itcrasqdvn tavawyqqkp gkapklliys asflysgvps rfsgsrsgtd ftltisslqp edfatyycqq hyttpptfgq gtkveikrtv(seq id no:41)
[0038]
野生型的人源化抗her2抗体的重链的各cdr及可变区域的氨基酸序列如下所述。
[0039]
·
重链cdr1:dtyih(seq id no:42)
[0040]
·
重链cdr2:riyptngytr yadsvkg(seq id no:43)
[0041]
·
重链cdr3:wggdgfyamd y(seq id no:44)
[0042]
·
可变区域:evqlvesggg lvqpggslrl scaasgfnik dtyihwvrqa pgkglewvar iyptngytry adsvkgrfti sadtskntay lqmnslraed tavyycsrwg gdgfyamdyw gqgtlvtvss(seq id no:45)
[0043]
框架区域(fr)是指存在于抗体的轻链及重链的各自的可变区域的cdr以外的区域。fr发挥连接3个cdr的支架的作用,cdr的结构稳定性贡献。因此,fr的氨基酸序列在相同的种(species)的抗体间高度保守。在轻链及重链的各自的可变区域中,有cdr1、cdr2及cdr3的3个cdr和fr1、fr2、fr3及fr4的4个fr。这些从可变区域的n末端侧以fr1、cdr1、fr2、cdr2、fr3、cdr3及fr4的顺序排列。以下,在言及抗体的fr时,当无特别说明时,“框架区域”及“fr”这样的用语是指轻链的fr。
[0044]
在本实施方式的亲和性的提升方法中,在未改变的抗体的轻链的fr的氨基酸序列中满足指定的条件的氨基酸残基之中,将至少3个设为荷电氨基酸残基。满足指定的条件的氨基酸残基是指满足下述的(1)及(2)的条件两方的氨基酸残基。
[0045]
(1)在未改变的抗体的轻链的fr的氨基酸序列中处于精氨酸、丝氨酸、苏氨酸、缬氨酸、天冬氨酸及谷氨酸的氨基酸频度的合计值成为35%以上的位置。
[0046]
(2)在未改变的抗体的轻链的fr的氨基酸序列中,暴露于溶剂的表面积比率显示20%以上。
[0047]
在本说明书中,将在未改变的抗体中将满足上述的(1)及(2)的条件的氨基酸残基设为荷电氨基酸残基也称为“改变”或“改变”。以下,将由本实施方式的亲和性的提升方法改变未改变的抗体而得到的抗体也称为“改变抗体”。
[0048]
由于cdr与抗体的特异性相关,在本实施方式的亲和性的提升方法中,优选不变更cdr的氨基酸序列。即,改变抗体的cdr的氨基酸序列优选与未改变的抗体的cdr的氨基酸序列相同。
[0049]
在本实施方式中,改变抗体对于抗原的亲和性可由抗原抗体反应中的动力学参数评价,也可由elisa法等的免疫学测定法评价。作为动力学参数,可举出例如解离常数(kd)、结合速度常数(k
on
)及解离速度常数(k
off
)。在它们之中,也优选kd。在抗原抗体反应中的动力学参数可由表面等离子体共振(spr)技术等取得。在改变抗体的抗原抗体反应中的kd的值是与未改变的抗体相比而,例如,约1/2、约1/5、约1/10、约1/20、约1/50、约1/100或约1/1000。
[0050]
在本说明书中,“位置”是指某氨基酸序列中的氨基酸残基的位置。在本实施方式中,在fr的氨基酸序列中的位置是由对cdr的氨基酸残基进行编号的方法(以下,也称为“编号法”)定义的fr的氨基酸序列中的位置。编号法是用于定义cdr的边界及长度的方法,在现有技术领域中公知。由编号法向cdr的氨基酸残基附编号,则fr的氨基酸残基也会被附上编号。在本实施方式中,在fr的氨基酸序列中的位置由编号法附的编号表示。在本说明书中,“ln”(n是正整数)表示轻链氨基酸序列中的第n的位置。例如,l1是指轻链氨基酸序列的第1位置,l2是指轻链氨基酸序列的第2位置。
[0051]
作为编号法,可举出例如kabat法(kabat ea.等,sequences of proteins of immunological interest.,nih publication no.91-3242)、chothia法(chothia c.及lesk am.,canonical structures for the hypervariable regions of immunoglobulins.,j mol biol.,vol.196,p.901-917,1987)、imgt法(lefranc mp.等,developmental and comparative immunology 29(2005)185-203)、honergger法(honegger a.等,yet another numbering scheme for immunoglobulin variable domains:an automatic modeling and analysis tool.,j mol biol.,vol.309,p.657-670,2001)、abm法、contact法等。在本实施方式中,抗体的fr虽然可由任何编号法定义,但优选由kabat法定义。在未改变的抗体中,在kabat法中,轻链的fr1定义为由轻链的第1~23的氨基酸残基构成的区域,轻链的fr2定义为由轻链的第35~49的氨基酸残基构成的区域,轻链的fr3定义为由轻链的第57~88的氨基酸残基构成的区域,轻链的fr4定义为由轻链的第98~109的氨基酸残基构成的区域。
[0052]
氨基酸频度也称为氨基酸出现频度,是指将多个氨基酸序列比对,显示在这些氨基酸序列的各位置,指定的氨基酸以何程度出现的比例。氨基酸频度本身是公知的指标。氨基酸序列的比对是指将多个氨基酸序列能比较地对齐。氨基酸序列的比对可由例如clustalw、trebmal等的公知的多重比对程序等进行。另外,氨基酸频度的算出方法本身是
公知的,可由上述的多重比对程序等算出。氨基酸序列的比对及氨基酸频度的算出也可由abysis进行。abysis不仅可作为提供抗体的序列的数据库利用,还可作为用于解析及预测抗体的序列、结构及功能的软件利用。例如,在比对的多个氨基酸序列的指定的位置,某氨基酸出现在所述多个氨基酸序列的全部时,在该位置的所述氨基酸的氨基酸频度成为100%。在比对的多个氨基酸序列的指定的位置,某氨基酸出现在所述多个氨基酸序列之中的半数时,在该位置的所述氨基酸的氨基酸频度成为50%。在比对的多个氨基酸序列的指定的位置,某氨基酸一次都不出现的情况,在该位置的所述氨基酸的氨基酸频度成为0%。
[0053]
在本实施方式中,为了在未改变的抗体的fr中确定满足上述(1)的条件的氨基酸残基,取得多个参照抗体的轻链的氨基酸序列。通过比对取得的多个参照抗体的轻链的氨基酸序列,可取得参照抗体的轻链的fr的氨基酸序列中的各位置的氨基酸频度。从多个参照抗体取得的各位置的氨基酸频度可作为未改变的抗体的轻链的氨基酸序列中的对应的位置的氨基酸频度利用。参照抗体只要是与未改变的抗体氨基酸序列不同的抗体,就不特别限定。由于抗体的fr的氨基酸序列在相同的种的抗体间高度保守,参照抗体优选与未改变的抗体相同的种的抗体。参照抗体的轻链的氨基酸序列可从genebank、abysis、imgt等的公知的数据库取得。参照抗体的轻链的氨基酸序列的数不特别限定,例如1000以上、优选为10000以上。取得的多个参照抗体的轻链的氨基酸序列可为轻链整体的氨基酸序列,也可为轻链的一部分的氨基酸序列。轻链的一部分的氨基酸序列优选含fr1和/或fr3的氨基酸序列。
[0054]
比对取得的多个参照抗体的轻链的氨基酸序列而取得参照抗体的fr的氨基酸序列的各位置的精氨酸(r)、丝氨酸(s)、苏氨酸(t)、缬氨酸(v)、天冬氨酸(d)及谷氨酸(e)的各自的氨基酸频度。其中,“比对多个参照抗体的轻链的氨基酸序列”是指以多个参照抗体的轻链的氨基酸序列之间由指定的编号法附的fr中的氨基酸残基的编号一致的方式将所述多个参照抗体的轻链的氨基酸序列对齐。在本实施方式中,优选以由kabat法附的fr中的氨基酸残基的编号一致的方式将多个参照抗体的轻链的氨基酸序列对齐。对于各位置,合计r、s、t、v、d及e的氨基酸频度的值而算出合计值。例如,比对的多个参照抗体的轻链的氨基酸序列中的某1个位置的氨基酸频度的合计值x(%)可从出现在所述位置的r、s、t、v、d及e的数和取得的参照抗体的轻链的氨基酸序列的数由下述的式(i)算出。对于含比对的多个参照抗体的轻链的fr1和/或轻链的fr3的氨基酸序列的各位置而进行此计算。算出中使用的参照抗体的轻链的氨基酸序列的数也可每位置不同。例如,在l1中的x的值也可基于10000个参照抗体的轻链的氨基酸序列而算出,在l2中的x的值也可基于15000个参照抗体的轻链的氨基酸序列而算出。
[0055]
【数1】
[0056]
x=(((r的数)+(s的数)+(t的数)+(v的数)+(d的数)+(e的数))/(参照抗体的轻链的氨基酸序列的数))
×
100
……(i)[0057]
在比对的多个参照抗体的轻链的氨基酸序列中确定取得的氨基酸频度的合计值成为35%以上、优选37%以上的位置。进而,作为满足上述(1)的条件的氨基酸残基,确定在未改变的抗体的轻链的fr中处于与从多个参照抗体确定的位置相对应的位置的氨基酸残基。这样的氨基酸残基也可通过例如比对未改变的抗体的轻链的氨基酸序列和多个参照抗体的轻链的氨基酸序列确定。在多个参照抗体的轻链的氨基酸序列基于例如由kabat法定
义的fr而比对时,在未改变的抗体的fr中,确定由kabat法赋予的氨基酸残基的编号与上述的氨基酸频度的合计值成为35%以上的参照抗体的序列中的位置相同的氨基酸残基。
[0058]
在本实施方式中,满足上述(2)的条件的氨基酸残基基于未改变的抗体的轻链的氨基酸序列而确定。具体而言,首先,使用未改变的抗体的轻链的氨基酸序列而取得该未改变的抗体的轻链的三维结构数据。三维结构数据优选可含构成蛋白质的各氨基酸残基的坐标数据,由rasmol、jmol等的公知的分子图形学程序可视化蛋白质的立体结构的数据。三维结构数据也可对于未改变的抗体的轻链而进行x射线结晶结构解析、nmr解析等的公知的立体结构解析而取得。在优选的实施方式中,三维结构数据通过从pdb(protein data bank)、bmrb(biological magnetic resonance bank)等的公知的蛋白质立体结构数据库检索未改变的抗体的轻链的氨基酸序列入手。在有具有与未改变的抗体的轻链的氨基酸序列一致的序列的蛋白质时,在数据库下载所述蛋白质的三维结构数据。
[0059]
在蛋白质立体结构数据库中无未改变的抗体的轻链的三维结构数据时,也可取得对于所述三维结构数据的制成必要的信息,基于该信息而制成三维结构数据。例如,也可基于未改变的抗体的轻链的氨基酸序列而由同源性建模法等制成三维结构数据。在同源性建模法中,作为对于三维结构数据的制成必要的信息,使用与未改变的抗体的轻链的氨基酸序列具有至少20%的相同性、并且立体结构已知的抗体的轻链的氨基酸序列(以下,也称为“参照序列”)。在现有技术领域中已知,在氨基酸序列的相同性高的蛋白质之间立体结构互相类似。参照序列可例如从genebank、abysis、imgt等的公知的数据库取得。在同源性建模法中,比对未改变的抗体的轻链的氨基酸序列和参照序列,基于比对的结果而从参照序列的已知的结构构建未改变的抗体的轻链的三维结构。由同源性建模法的三维结构数据的制成本身是公知的,可由例如modeller等的公知的立体结构预测程序进行。
[0060]
接下来,基于取得的三维结构数据而取得未改变的抗体的fr的各氨基酸残基的暴露于溶剂的表面积比率。在现有技术领域中,暴露于溶剂的表面积定义为以与蛋白质分子的表面(范德华表面)相接的方式旋转推定水分子的探针球之时的该探针球的中心的轨迹面。暴露于溶剂的表面积本身是公知的指标。蛋白质的暴露于溶剂的表面积可从该蛋白质的三维结构数据由surface、getarea、discovery studio等的公知的程序或软件取得。另外,也可取得蛋白质中的各氨基酸残基的暴露于溶剂的表面积。蛋白质中的氨基酸残基的暴露于溶剂的表面积因所述氨基酸的侧链的大小而不同。从而,作为将蛋白质中的氨基酸残基的暴露于溶剂的表面积用该氨基酸的侧链的大小标准化的指标,使用暴露于溶剂的表面积比率。暴露于溶剂的表面积比率本身是公知的指标。例如,蛋白质a中的氨基酸x的暴露于溶剂的表面积比率y(%)由下述的式(ii)算出。式中,“ala-x-ala”是指由氨基酸x被2个丙氨酸所夹的序列构成的三肽。
[0061]
【数2】
[0062]
y=((蛋白质a中的氨基酸x的暴露于溶剂的表面积)/(ala-x-ala中的氨基酸x的暴露于溶剂的表面积))
×
100
……
(ii)
[0063]
进而,在未改变的抗体的fr的氨基酸序列中,确定取得的暴露于溶剂的表面积比率在20%以上、优选为25%以上氨基酸残基。由此,可在未改变的抗体的fr的氨基酸序列中确定处于r、s、t、v、d及e的氨基酸频度的合计值成为35%以上的位置并且暴露于溶剂的表面积比率显示20%以上的氨基酸残基。
[0064]
在满足上述的(1)及(2)的条件的氨基酸残基之中,设为荷电氨基酸残基的氨基酸残基的数是例如3、4、5、6、7、8、9、10、11、12、13、14、15、16、17或18。荷电氨基酸残基可为碱性氨基酸残基,也可为酸性氨基酸残基。优选荷电氨基酸残基是相同的电荷的氨基酸残基。荷电氨基酸残基可为相同的残基,也可为不同的残基。碱性氨基酸残基是指赖氨酸残基、精氨酸残基及组氨酸残基。酸性氨基酸残基是指天冬氨酸残基及谷氨酸残基。在本实施方式中,作为荷电氨基酸残基,优选碱性氨基酸残基,特别优选赖氨酸残基及精氨酸残基。
[0065]
在满足上述的(1)及(2)的条件的氨基酸残基之中,设为荷电氨基酸残基的氨基酸残基优选为中性氨基酸残基。中性氨基酸残基是指丙氨酸残基、天冬酰胺残基、异亮氨酸残基、甘氨酸残基、谷氨酰胺残基、半胱氨酸残基、苏氨酸残基、丝氨酸残基、酪氨酸残基、苯丙氨酸残基、脯氨酸残基、缬氨酸残基、甲硫氨酸残基、亮氨酸残基及色氨酸残基。
[0066]
在满足上述的(1)及(2)的条件的氨基酸残基是荷电氨基酸残基时,所述氨基酸残基也可原样不动。或者,在满足上述的(1)及(2)的条件的氨基酸残基是酸性氨基酸残基时,也可将所述氨基酸残基设为碱性氨基酸残基。另外,在满足上述的(1)及(2)的条件的氨基酸残基是碱性氨基酸残基时,也可将所述氨基酸残基设为酸性氨基酸残基。
[0067]
在本实施方式中,在基于未改变的抗体的cdr的氨基酸序列的cdr的电特性是中性时,也可将满足上述的(1)及(2)的条件的氨基酸残基设为荷电氨基酸残基。荷电氨基酸残基优选为碱性氨基酸残基。其中,cdr的电特性是指本发明人独自定义的指标,基于cdr的氨基酸序列中的荷电氨基酸残基的数而确定。具体而言,cdr的电特性由下述的式(iii)确定。
[0068]
z=[cdr的氨基酸序列中的碱性氨基酸残基的数]-[cdr的氨基酸序列中的酸性氨基酸残基的数]
…
(iii)
[0069]
(式中,z是-1、0或1之时,cdr的电特性是中性,
[0070]
z是2以上之时,cdr的电特性是正电荷,
[0071]
z是-2以下之时,cdr的电特性是负电荷)
[0072]
cdr的电特性也可基于轻链和/或重链的cdr的氨基酸序列而确定。在确定轻链的cdr的电特性时,在式(iii)中的cdr的氨基酸序列是指轻链的cdr1、cdr2及cdr3的全部氨基酸序列。另外,在确定重链的cdr的电特性时,在式(iii)中的cdr的氨基酸序列是指重链的cdr1、cdr2及cdr3的全部氨基酸序列。优选基于轻链及重链的两方的cdr的氨基酸序列而确定。此时,在上述的式(iii)中的cdr的氨基酸序列是指轻链的cdr1、cdr2及cdr3和重链的cdr1、cdr2及cdr3的全部氨基酸序列。在本实施方式中,在基于轻链及重链的两方的cdr的氨基酸序列而确定的电特性是中性的未改变的抗体中,也可将满足上述的(1)及(2)的条件的氨基酸残基的至少3个设为荷电氨基酸残基、优选碱性氨基酸残基。
[0073]
cdr的氨基酸序列可从公开抗体基因的序列的公共的数据库得到。或者,在有产生未改变的抗体的杂交瘤时,cdr的氨基酸序列可通过由公知的方法从该杂交瘤取得编码重链及轻链的核酸,对该核酸的碱基序列进行测序来得到。
[0074]
cdr的电特性因抗体而不同。例如,在kabat法中,在后述的实施例中使用的野生型(即未改变)的抗溶菌酶抗体的轻链的cdr中,有1个碱性氨基酸残基(精氨酸),无酸性氨基酸残基。另外,在重链的cdr中,碱性氨基酸残基(赖氨酸)有1个,酸性氨基酸残基(天冬氨酸)有3个。从而,野生型的抗溶菌酶抗体的cdr的电特性定义为中性(z=-1)。再者,基于chothia法的所述抗溶菌酶抗体的cdr的电特性成为负电荷。
ends)法合成编码轻链的多核苷酸。通过使用用于改变fr的至少3个氨基酸残基的引物由pcr法扩增此多核苷酸,取得编码改变fr的轻链的多核苷酸。将得到的多核苷酸整合到现有技术中公知的表达用载体,取得含编码改变抗体的多核苷酸的表达载体。表达载体的种类不特别限定,可为哺乳动物细胞用表达载体,也可为大肠杆菌用表达载体。通过向适当的宿主细胞(例如,哺乳动物细胞或大肠杆菌)转化或转染得到的表达载体,可得到亲和性提升的抗体。
[0089]
在得到作为单链抗体(scfv)的改变抗体时,如例如wo2013/084371所示,使用从上述的杂交瘤提取的rna,由逆转录反应及pcr法合成编码轻链可变区域的多核苷酸即可。将此多核苷酸由重叠延伸pcr法等连接而取得编码未改变的scfv的多核苷酸。通过使用用于改变fr的至少3个氨基酸残基的引物由pcr法扩增得到的多核苷酸,取得编码fr发生改变的scfv的多核苷酸。将得到的多核苷酸整合到现有技术中公知的表达载体,取得含编码处于scfv的形态的改变抗体的多核苷酸的表达载体。通过向适当的宿主细胞转化或转染得到的表达载体,可得到处于scfv的形态的改变抗体。
[0090]
在无产生未改变的抗体的杂交瘤时,由例如kohler及milstein,nature,vol.256,p.495-497,1975中记载的方法等的公知的方法制作产生抗体的杂交瘤即可。或者,也可使用从由目标抗原免疫的小鼠等的动物的脾脏取得的rna。在使用从脾脏取得的rna时,也可如例如fukunaga a及tsumoto k,protein eng.des.sel.2013,vol.26,pp.773-780所示,从编码得到的未改变的scfv的多核苷酸之中由噬菌体展示法等选择编码具有期望的亲和性的未改变的scfv的多核苷酸。
[0091]
[2.亲和性提升的抗体及其制造方法]
[0092]
本实施方式的与未改变的抗体相比而对于抗原的亲和性提升的抗体(以下,也称为“亲和性提升的抗体”)的特征在于,在未改变的抗体的轻链的fr的氨基酸序列中处于r、s、t、v、d及e的氨基酸频度的合计值成为35%以上的位置并且暴露于溶剂的表面积比率显示20%以上的氨基酸残基之中,将至少3个被设为荷电氨基酸残基。此亲和性提升的抗体与本实施方式的亲和性的提升方法的说明中所述的“改变抗体”相同。
[0093]
本实施方式的亲和性提升的抗体优选为未改变的抗体的轻链的fr1和/或fr3的氨基酸残基被设为荷电氨基酸残基的抗体。作为这样的抗体,可举出例如,在未改变的抗体中的由kabat法定义的轻链的第1、3、5、7、9、10、12、14、17、18、20、22、60、63、65、67、69、70、72、74、76、77、79及81氨基酸残基之中,至少3个被设为荷电氨基酸残基的抗体。在优选的实施方式中,亲和性提升的抗体是在未改变的抗体中的由kabat法定义的轻链的选自第3、5、9、17、18、20、22、60、63、65、67、70、72、74、76、77、79及81氨基酸残基的至少3个氨基酸残基被设为荷电氨基酸残基的抗体。在此抗体中,上述的3个氨基酸残基更优选含由kabat法定义的轻链的选自第3、5、9、17、18、20、22、60、74、76、77、79及81氨基酸残基的至少1个。荷电氨基酸残基优选为碱性氨基酸残基。
[0094]
在本实施方式的亲和性提升的抗体是未改变的抗体的轻链的fr1的氨基酸残基发生改变的抗体时,优选在未改变的抗体中的由kabat法定义的轻链的第3、5、9、17、18、20及22氨基酸残基之中至少3个被设为荷电氨基酸残基的抗体。作为这样的至少3个氨基酸残基,可举出例如上述的(1)~(4)之任一者的组合。
[0095]
在本实施方式的亲和性提升的抗体是未改变的抗体的轻链的fr1的氨基酸残基发
生改变的抗体时,优选在未改变的抗体中的由kabat法定义的轻链的第60、63、65、67、70、72、74、76、77、79及81氨基酸残基之中,至少3个被设为荷电氨基酸残基的抗体。特别是,优选由kabat法定义的轻链的选自第60、74、76、77、79及81氨基酸残基的至少3个被设为荷电氨基酸残基的抗体。作为这样的至少3个氨基酸残基,可举出例如上述的(5)~(8)之任一者的组合。
[0096]
本实施方式的亲和性提升的抗体可由本实施方式的与未改变的抗体相比而对于抗原的亲和性提升的抗体的制造方法(以下,也称为“制造方法”)得到。在本实施方式的制造方法中,首先,在抗体(未改变的抗体)的轻链的fr的氨基酸序列中,处于r、s、t、v、d及e的氨基酸频度的合计值成为35%以上的位置并且暴露于溶剂的表面积比率显示20%以上的氨基酸残基之中,将至少3个设为荷电氨基酸残基。改变此未改变的抗体中的氨基酸残基的工序与对于本实施方式的亲和性的提升方法而所述的相同。
[0097]
接下来,回收由上述的改变得到的抗体。例如,向含适当的可溶化剂的溶液溶解表达亲和性提升的抗体的宿主细胞而使抗体游离于该溶液中。在上述的宿主细胞将抗体分泌到培养基中时,回收培养上清。游离的抗体可由亲和性层析法等的现有技术中公知的方法回收。例如,在制造的抗体是igg时,可由使用蛋白a或g的亲和性层析法回收。也可根据需要,将回收的抗体由凝胶过滤等的现有技术中公知的方法纯化。
[0098]
[3.抗体的氨基酸序列的解析方法]
[0099]
在本发明的范围中,也含抗体的氨基酸序列的解析方法(以下,也称为“解析方法”)。在本实施方式的解析方法中,取得抗体的轻链的fr的氨基酸序列中的各位置的r、s、t、v、d及e的氨基酸频度的合计值和所述氨基酸序列中的各氨基酸残基的暴露于溶剂的表面积比率,输出取得的各位置的氨基酸频度的合计值及各氨基酸残基的暴露于溶剂的表面积比率。输出的信息,例如,在改变解析的抗体时,对于探讨要改变的氨基酸残基的候选有用。氨基酸频度的合计值及暴露于溶剂的表面积比率的详细与对于本实施方式的亲和性的提升方法而所述的相同。本实施方式的解析方法也可如例如使用图1所示的氨基酸序列的解析系统而实施。
[0100]
(氨基酸序列的解析系统的概要)
[0101]
接下来,参照附图说明氨基酸序列的解析系统的一例。但是,本实施方式不仅限定于此例中所示的形态。参照图1,氨基酸序列的解析系统具备氨基酸序列的解析装置10和序列数据服务器20。解析装置10和序列数据服务器20经内部网、互联网等的网络30连接。在图1中,解析装置10作为具备控制部100(计算机本体)、输入部101和显示部102的通用计算机系统显示,但不限定于此形态。
[0102]
经网络30而从解析装置10对于序列数据服务器20要求多个参照抗体的轻链的氨基酸序列、抗体的轻链的三维结构数据等的序列信息之时,它们的序列信息从序列数据20下载到解析装置10。序列数据服务器20具备收纳多个参照抗体的轻链的氨基酸序列的信息、抗体的轻链的三维结构数据等的氨基酸序列相关信息的数据库(以下,也称为“氨基酸序列数据库”)。序列数据服务器20也可为与利用解析装置10的使用者不同的第三者管理的外部数据服务器。作为从外部数据服务器能利用的数据库(以下,也称为“外部数据库”),可举出例如genebank、abysis、imgt、pdb、bmrb等。
[0103]
在图1中显示了1个序列数据服务器,但解析装置10也可与多个序列数据服务器相
连接。多个序列数据服务器也可具备各自不同的种类的氨基酸序列数据库。例如,某序列数据服务器具备含多个参照抗体的轻链的氨基酸序列的蛋白质的氨基酸序列信息相关数据库,别的序列数据服务器也可具备含抗体的轻链的蛋白质的三维结构数据相关数据库。
[0104]
解析装置10从由使用者的输入或后述的记忆介质40取得未改变的抗体的轻链的氨基酸序列。另外,解析装置10经网络30向序列数据服务器20要求多个参照抗体的轻链的氨基酸序列及抗体的轻链的三维结构数据。序列数据服务器20经网络30向解析装置10提供要求的数据。进而,解析装置10使用取得的序列,对未改变的抗体的氨基酸序列进行解析。
[0105]
(氨基酸序列的解析系统的硬件构成)
[0106]
参照图2,解析装置10的控制部100具备cpu(central processing unit)110、存储器111、记忆装置112、接口113、读取装置114和将这些能数据通信地连接的总线115。控制部100经接口113与输入部101及输出部102等的外部机器、及网络30能通信地连接。记忆介质40是cd-rom、usb存储器等的计算机能读取而非暂时的有形的记忆介质。序列数据服务器20具备控制部210、输入部211、输出部212、记忆部213和通信部214。在记忆部213中,收纳氨基酸序列数据库215。序列数据服务器20经通信部214与网络30能通信地连接。输入部101及211是例如鼠标、键盘等的输入装置。输出部102及212是例如液晶显示等的显示装置。
[0107]
cpu110执行记忆在存储器111或记忆装置112的本实施方式的计算机程序而进行后述的处理。存储器111含rom(read only memory)及ram(random access memory)。rom由例如掩模型rom、prom、eprom、eeprom等构成。在rom中,记录由cpu110执行的计算机程序及在所述计算机程序的执行中使用的数据。ram由例如sram、dram等构成。ram在记录在rom及记忆装置112的程序的读取中使用。另外,ram在执行这些程序之时,作为cpu110的作业区域利用。
[0108]
记忆装置112由例如硬盘构成。在记忆装置112中,收纳用于被cpu110执行的操作系统、应用程序等的程序及在所述程序的执行中使用的数据。作为应用程序,可举出例如本实施方式的计算机程序、用于执行氨基酸序列的比对的程序、用于执行氨基酸频度的算出的程序、用于执行暴露于溶剂的表面积比率的算出的程序等。另外,在记忆装置112中,也可记录氨基酸频度及暴露于溶剂的表面积比率的各自的阈值。
[0109]
读取装置114由cd-rom驱动器、dvd-rom驱动器、usb端口、sd卡读取器、cf卡读取器、记忆棒读取器、固态硬盘、软盘驱动器等构成。读取装置114可读取记录在记忆介质40的数据(例如,未改变的抗体和/或多个参照抗体的轻链的氨基酸序列和/或编码它们的核酸序列的信息等)、及计算机程序。
[0110]
(氨基酸序列的解析装置的处理顺序)
[0111]
参照图3,对于由解析装置10执行的抗体的氨基酸序列的解析处理进行说明。其中,以使用从外部数据库下载的多个参照抗体的轻链的氨基酸序列及未改变的抗体的轻链的三维结构数据,输出各位置的氨基酸频度的合计值及各氨基酸残基的暴露于溶剂的表面积比率的情况为例进行说明。但是,本实施方式不仅限定于此例。在以下的说明中,如无特别说明,控制部100进行的处理是指cpu110进行的处理。
[0112]
在步骤s10中,控制部100经网络30,从序列数据服务器20的氨基酸序列数据库215下载多个参照抗体的轻链的氨基酸序列的数据,记忆在记忆装置112。下载的氨基酸序列可为轻链全部的序列,也可为含fr1和/或fr3的氨基酸序列的轻链的一部分的序列。在使用者
具有已经多个参照抗体的轻链的氨基酸序列的数据时,控制部100也可代替下载而取得由使用者输入的所述氨基酸序列的数据。输入可由输入部101进行,也可通过向记忆装置112转送保存在记忆介质40的所述氨基酸序列的数据进行。
[0113]
在步骤s11中,控制部100比对取得的多个参照抗体的轻链的氨基酸序列。具体而言,控制部100将多个参照抗体的氨基酸序列以由kabat法附的fr中的氨基酸残基的编号一致的方式对齐。比对也可基于kabat法以外的编号法而进行。在步骤s12中,控制部100算出多个参照抗体的fr的氨基酸序列的各位置的r、s、t、v、d及e的氨基酸频度的合计值。此算出与对于本实施方式的亲和性的提升方法而所述的同样。
[0114]
在步骤s13中,控制部100取得未改变的抗体的轻链的氨基酸序列。取得的未改变的抗体的轻链的氨基酸序列可为轻链整体的氨基酸序列,也可为轻链的一部分的氨基酸序列。轻链的一部分的氨基酸序列优选含fr1和/或fr3的氨基酸序列,更优选还含cdr的氨基酸序列。在优选的实施方式中,控制部100取得未改变的抗体的轻链整体的氨基酸序列。此氨基酸序列可由使用者输入,也可预先保存在记忆介质40或记忆装置112。在未改变的抗体的轻链的氨基酸序列处于氨基酸序列数据库215内时,控制部100也可下载所述氨基酸序列的数据。在步骤s14中,控制部100在未改变的抗体的fr中,确定处于与从多个参照抗体确定的位置相对应的位置的氨基酸残基。控制部100也可比对确定未改变的抗体的轻链的氨基酸序列和多个参照抗体的轻链的氨基酸序列。由此,控制部100以算出的氨基酸频度的合计值作为未改变的抗体的fr的氨基酸序列的各位置的氨基酸频度的合计值取得,记忆在记忆装置112。
[0115]
在步骤s15中,控制部100基于未改变的抗体的轻链的氨基酸序列而从氨基酸序列数据库215下载未改变的抗体的轻链的三维结构数据。控制部100从氨基酸序列数据库215检索未改变的抗体的轻链的氨基酸序列,在有具有与未改变的抗体的轻链的氨基酸序列一致的序列的蛋白质时,在数据库下载所述蛋白质的三维结构数据,作为未改变的抗体的轻链的三维结构数据记忆在记忆装置112。
[0116]
在步骤s16中,控制部100基于取得的三维结构数据而算出未改变的抗体的fr的各氨基酸残基的暴露于溶剂的表面积比率而记忆在记忆装置112。此算出与对于本实施方式的亲和性的提升方法而所述的同样。在使用者具有未改变的抗体的轻链的三维结构数据时,控制部100也可代替下载而取得由使用者输入的三维结构数据。输入可由输入部101进行,也可通过向记忆装置112转送保存在记忆介质40的三维结构数据进行。在氨基酸序列数据库215中无未改变的抗体的轻链的三维结构数据时,控制部100也可从数据库取得对于所述三维结构数据的制成必要的信息,基于该信息而制成三维结构数据。具体而言,控制部100从氨基酸序列数据库215检索参照序列,下载该氨基酸序列。接下来,控制部100比对参照序列和未改变的抗体的氨基酸序列。进而,控制部100基于比对结果而从参照序列的已知的结构制成未改变的抗体的轻链的三维结构数据。三维结构数据的制成与对于本实施方式的亲和性的提升方法而所述的同样。
[0117]
在步骤s17中,控制部100向输出部102发送在步骤s14中确定的未改变的抗体的fr的氨基酸序列的各位置的氨基酸频度的合计值和在步骤s16中算出的未改变的抗体的fr的各氨基酸残基的暴露于溶剂的表面积比率。在图4显示显示在输出部102的解析结果的画面的一例。在此画面,显示未改变的抗体的fr1的氨基酸序列的各位置(l1~l23)的氨基酸频
度的合计值和暴露于溶剂的表面积比率。但是,画面的显示不限定于此例。
[0118]
在图3中所示的处理中,步骤s13也可进行到步骤s10、s11或s12之前。步骤s15及s16只要是在未改变的抗体的氨基酸序列的取得步骤(步骤s13)之后,就也可进行到步骤s10、s11或s12之前。步骤s10及s15只要是在未改变的抗体的氨基酸序列的取得步骤(步骤s13)之后,就也可同时进行。
[0119]
[4.确定抗体的改变位置的候选的方法]
[0120]
在本发明的范围中,还含确定抗体的改变位置的候选的方法(以下,也称为“特定方法”)。在本实施方式的特定方法中,取得抗体的轻链的fr的氨基酸序列中的各位置的r、s、t、v、d及e的氨基酸频度的合计值和所述氨基酸序列中的各氨基酸残基的暴露于溶剂的表面积比率,将处于氨基酸频度的合计值成为35%以上的位置并且暴露于溶剂的表面积比率显示20%以上的氨基酸残基确定为为了亲和性的提升而要改变的位置的候选。氨基酸频度的合计值及暴露于溶剂的表面积比率的详细与对于本实施方式的亲和性的提升方法而所述的相同。
[0121]
在抗体的轻链的氨基酸序列中,通过由本实施方式的特定方法确定的氨基酸残基之中,将至少3个设为荷电氨基酸残基,可与未改变的抗体相比提升抗体对于抗原的亲和性。进而,通过回收改变氨基酸残基的抗体,可得到抗体对于抗原的亲和性提升的改变抗体。氨基酸残基的改变及抗体的回收与对于本实施方式的亲和性的提升方法及本实施方式的制造方法而所述的相同。
[0122]
本实施方式的特定方法可与本实施方式的解析方法同样地,由如图1所示的氨基酸序列的解析系统实施。用于实施本实施方式的特定方法的氨基酸序列的解析系统的概略及硬件构成与对于本实施方式的解析方法而所述的相同。
[0123]
(氨基酸序列的解析装置的处理顺序)
[0124]
参照图5,对于由解析装置10执行的用于确定抗体的改变位置的候选的氨基酸序列的解析处理进行说明。其中,以使用从外部数据库下载的多个参照抗体的轻链的氨基酸序列及未改变的抗体的轻链的三维结构数据,算出各位置的氨基酸频度的合计值及各氨基酸残基的暴露于溶剂的表面积比率的情况为例进行说明。但是,本实施方式不仅限定于此例。在以下的说明中,如无特别说明,控制部100进行的处理是指cpu110进行的处理。步骤s20~s26与对于步骤s10~s16而所述的相同。
[0125]
在步骤s27中,控制部100在步骤s24中确定的未改变的抗体的fr的氨基酸序列的位置之中确定处于r、s、t、v、d及e的氨基酸频度的合计值成为35%以上的位置、并且在步骤s26中算出的暴露于溶剂的表面积比率显示20%以上的氨基酸残基。进而,在步骤s28中,控制部100向输出部102发送在步骤s27中确定的氨基酸残基。在图6显示显示在输出部102的解析结果的画面的一例。在此画面,显示未改变的抗体的轻链的fr1的氨基酸序列的各位置(l1~l23)的氨基酸频度的合计值和暴露于溶剂的表面积比率。在此画面,在步骤s27中确定的氨基酸残基的位置和各值以粗体字及标志强调显示。但是,画面的显示不限定于此例。确定的氨基酸残基作为未改变的抗体中的改变位置的候选向使用者提示。
[0126]
参照图7,对于由解析装置10执行的用于制成将抗体的改变位置的候选设为荷电氨基酸残基之时的序列的氨基酸序列的解析处理进行说明。其中,以使用从外部数据库下载的多个参照抗体的轻链的氨基酸序列及未改变的抗体的轻链的三维结构数据,算出各位
置的氨基酸频度的合计值及各氨基酸残基的暴露于溶剂的表面积比率的情况为例进行说明。但是,本实施方式不仅限定于此例。在以下的说明中,如无特别说明,控制部100进行的处理是指cpu110进行的处理。步骤s30~s36与对于步骤s10~s16而所述的相同,步骤s37与步骤s27相同。
[0127]
在步骤s38中,控制部100制成将在步骤s37中确定的氨基酸残基的至少3个设为荷电氨基酸残基之时的氨基酸序列和/或编码该序列的碱基序列。在制成氨基酸序列时,控制部100在步骤s33中取得的未改变的抗体的轻链的氨基酸序列中,制成将在步骤s37中确定的氨基酸残基的至少3个设为r、k、d或e的氨基酸序列(改变抗体的轻链的氨基酸序列)而记忆在记忆装置112。将哪个氨基酸残基设为荷电氨基酸残基可预先设定,也可由使用者确定。作为荷电氨基酸残基,在r、k、d及e之中,选择哪个可预先设定,也可由使用者确定。
[0128]
在制成编码改变抗体的轻链的氨基酸序列的碱基序列时,控制部100在步骤s33中取得的氨基酸序列中,制成将在步骤s37中确定的氨基酸残基的至少3个设为r、k、d或e的氨基酸序列,将其变换为碱基序列而记忆在记忆装置112。在对于1个氨基酸而有多个密码子时,选择哪个密码子可预先设定,也可由使用者确定。在制成碱基序列时,控制部100也可在步骤s33中取得编码未改变的抗体的轻链的碱基序列。在取得所述碱基序列时,控制部100也可通过将与步骤s37中确定的氨基酸残基相对应的密码子设为与荷电氨基酸残基相对应的密码子,制成编码改变抗体的轻链的氨基酸序列的碱基序列。进而,在步骤s39中,控制部100向输出部102发送在步骤s37中确定的氨基酸残基和在步骤s38中制成的改变抗体的轻链的氨基酸序列和/或编码其的碱基序列。
[0129]
在本实施方式的特定方法中,也可算出基于未改变的抗体的cdr的氨基酸序列的cdr的电特性输出。cdr的电特性与对于本实施方式的亲和性的提升方法而所述的相同。另外,在算出的cdr的电特性是中性时,作为改变位置的候选确定的氨基酸残基之中,也可制成将至少3个设为荷电氨基酸残基(优选碱性氨基酸残基)时的改变氨基酸序列而输出。
[0130]
参照图8,对于由解析装置10执行的用于制成在cdr的电特性是中性时将抗体的改变位置的候选设为碱性氨基酸残基之时的序列的氨基酸序列的解析处理进行说明。其中,以使用从外部数据库下载的多个参照抗体的轻链的氨基酸序列及未改变的抗体的轻链的三维结构数据,算出各位置的氨基酸频度的合计值及各氨基酸残基的暴露于溶剂的表面积比率的情况为例进行说明。但是,本实施方式不仅限定于此例。在以下的说明中,如无特别说明,控制部100进行的处理是指cpu110进行的处理。步骤s40~s46与对于步骤s10~s16而所述的相同,步骤s47与步骤s27相同。
[0131]
在步骤s48中,控制部100基于在步骤s43中取得的未改变的抗体的轻链的氨基酸序列而算出未改变的抗体的cdr的电特性。cdr的电特性由上述的式(iii)算出。在步骤s49中,判定算出的cdr的电特性是中性与否。在由上述的式(iii)算出的值是-1、0或1时,cdr的电特性被判定为中性,处理进行到步骤s50。在步骤s50中,控制部100制成将在步骤s47中确定的氨基酸残基的至少3个设为碱性氨基酸残基之时的氨基酸序列和/或编码该序列的碱基序列。进而,在步骤s51中,控制部100向输出部102发送在步骤s47中确定的氨基酸残基,在步骤s48中算出的cdr的电特性,在步骤s50中制成的改变抗体的轻链的氨基酸序列和/或编码其的碱基序列。在步骤s49中,在由上述的式(iii)算出的值是-2以下或2以上时,cdr的电特性被判定为不是中性,处理进行到步骤s52。在步骤s52中,控制部100向输出部102发送
在步骤s47中确定的氨基酸残基和在步骤s48中算出的cdr的电特性。
[0132]
接下来,将本发明由实施例详细地说明,但本发明不限定于这些实施例。
[0133]
【实施例】
[0134]
【实施例1:改变轻链的fr1或fr3的氨基酸残基的抗体的制作】
[0135]
将抗溶菌酶抗体的fr1或fr3的3个氨基酸残基取代为荷电氨基酸残基而制作各抗体的变体。
[0136]
(1)野生型抗溶菌酶抗体的基因取得
[0137]
向genscript日本株式会社委托抗溶菌酶抗体的基因的合成而取得含野生型抗溶菌酶抗体的基因的质粒dna。
[0138]
(2)抗溶菌酶抗体的变体的制作
[0139]
[试剂]
[0140]
qiaprep spin miniprep试剂盒(qiagen公司)
[0141]
primestar(注册商标)max dna polymerase(宝生物株式会社)
[0142]
ligation high ver.2(东洋纺株式会社)
[0143]
t4 polynucleotide kinase(东洋纺株式会社)
[0144]
dpn i(东洋纺株式会社)
[0145]
competent high dh5α(东洋纺株式会社)
[0146]
(2.1)引物的设计及pcr
[0147]
为了将野生型抗溶菌酶抗体的轻链fr1或fr3的指定的3个氨基酸残基取代为精氨酸残基,使用在上述(1)中得到的质粒及下述的碱基序列所表示的引物而实施pcr。再者,记载在各引物的名称的3个编号表示由kabat法定义的轻链的fr中被精氨酸残基取代的氨基酸残基的位置。以seq id no:1~11的引物作为正向引物使用,以seq id no:12~22的引物作为反向引物使用。
[0148]
[变体制作用引物]
[0149]
2、4、6变体for:5’agaaccagaa gcccggcgac cctctcggtc acccccggc 3’(seq id no:1)
[0150]
2、4、8变体for:5’agagcagagc gaccctctcg gtcacccccg gc 3’(seq id no:2)
[0151]
3、5、9变体for:5’gcccgcgcac cctctcggtc acccccggc 3’(seq id no:3)
[0152]
4、8、13变体for:5’ccctctcgag aacccccggc aactcggtgt cgc 3’(seq id no:4)
[0153]
5、9、22变体for:5’ggcaactcgg tgtcgctccg ctgccgcgcc tcgcagtcg 3’(seq id no:5)
[0154]
13、16、19变体for:5’aactcgcgat cgctctcgtg ccgcgcctcg cagtcg 3’(seq id no:6)
[0155]
16、21、23变体for:5’gtgtcgcgat cgcgacgcgc ctcgcagtcg atcggc 3’(seq id no:7)
[0156]
17、18、20变体for:5’ctctcgtgcc gcgcctcgca g 3’(seq id no:8)
[0157]
18、20、22变体for:5’cgctgccgcg cctcgcagtc gatcggc 3’(seq id no:9)
[0158]
19、21、23变体for:5’agatcgagac gcgcctcgca gtcgatcggc 3’(seq id no:10)
[0159]
63、65、67变体for:5’ggcaccgact tcaccctgtc g 3’(seq id no:11)
[0160]
2、4、6变体rev:5’gactctatct cctctggaca ttatgactga ggc 3’(seq id no:12)
[0161]
2、4、8变体rev:5’gggttctgac tctatctcct ctggacatta tgactgaggc 3’(seq id no:13)
[0162]
3、5、9变体rev:5’tctggcgcag gcggatatct cctctggaca ttatg 3’(seq id no:14)
[0163]
4、8、13变体rev:5’tcgctctgct ctgggttctg acgatatctc ctctggacat tatg3’(seq id no:15)
[0164]
5、9、22变体rev:5’gggggtgacc gagagggtgc gcgggctctg gcgcaggacgatatctcctc tgg 3’(seq id no:16)
[0165]
13、16、19变体rev:5’tcggggggtt cgcgagaggg tcgccgggct ctggg 3’(seq id no:17)
[0166]
16、21、23变体rev:5’cgagtttcgg ggggtgaccg agagggtcgc 3’(seq id no:18)
[0167]
17、18、20变体rev:5’gcgcacgcgg cggccggggg tgaccgagag gg 3’(seq id no:19)
[0168]
18、20、22变体rev:5’gaggcgcacg cggttgccgg gggtgaccga gaggg 3’(seq id no:20)
[0169]
19、21、23变体rev:5’cgatctcgag ttgccggggg tgaccgagag gg 3’(seq id no:21)
[0170]
63、65、67变体rev:5’tctgcctctg cctctgaagc gcgacgggat ccccg 3’(seq id no:22)
[0171]
以在上述(1)中得到的质粒作为模板使用而调制以下的组成的pcr反应液。
[0172]
[pcr反应液]
[0173]
primestar(注册商标)max dna polymerase12.5μl正向引物(10μm)1μl反向引物(10μm)1μl模板质粒(3ng/μl)1μl纯化水9.5μl合计25μl
[0174]
在下述的反应条件下向pcr反应附调制的pcr反应液。
[0175]
[反应条件]
[0176]
于98℃经10秒钟、
[0177]
于98℃经10秒钟、于54℃经10秒钟、及于72℃经45秒钟而进行30个循环、及
[0178]
于72℃经3分钟。
[0179]
向得到的pcr产物(25μl)添加1μl的dpni(10u/μl)而使pcr产物片段化。使用dpni处理完了的pcr产物而调制以下的组成的连接反应液。将该反应液于16℃温育1小时而进行连接反应。
[0180]
[连接反应液]
[0181]
dpni处理完了pcr产物2μlligation high ver.25μl
t4多核苷酸激酶1μl纯化水7μl合计15μl
[0182]
(2.2)转化、质粒提取及序列的确认
[0183]
向连接反应后的溶液(3μl)添加dh5α(30μl)而在冰上静置30分钟之后,将混合物于42℃加热45秒钟而进行热休克。再次、在冰上静置2分钟之后,将全量涂布到含有氨苄西林的lb板上。通过将该板于37℃温育16小时,得到大肠杆菌的转化体。将板上的单集落取到含有氨苄西林的lb液体培养基中,于37℃振荡培养16小时(250rpm)。从得到的大肠杆菌,使用qiaprep spin miniprep试剂盒而提取质粒。使用pcdna3.4载体引物确认得到的各质粒的碱基序列。以下,以这些质粒作为哺乳动物细胞表达用质粒使用。
[0184]
(3)在哺乳动物细胞中的表达
[0185]
[试剂]
[0186]
expi293(商标)细胞(invitrogen公司)
[0187]
expi293(商标)expression培养基(invitrogen公司)
[0188]
expifectamine(商标)293转染试剂盒(invitrogen公司)
[0189]
(3.1)转染
[0190]
将expi293细胞在5%co2气氛下、于37℃振荡培养(150rpm)而使增殖。准备对应于样品数的数的30ml的细胞培养物(3.0x 106个细胞/ml)。使用编码各变体的质粒及编码野生型的抗体的质粒而调制以下的组成的dna溶液,静置5分钟。
[0191]
[dna溶液]
[0192]
轻链质粒溶液相当于15μg的量(μl)重链质粒溶液相当于15μg的量(μl)opti-mem(商标)适量(ml)合计1.5ml
[0193]
调制以下的组成的转染试剂,静置5分钟。
[0194]
expifectamine试剂80μl轻链质粒溶液1420μl合计1.5ml
[0195]
将调制的dna溶液及转染试剂混合而静置20分钟。向细胞培养物(30ml)添加得到的混合液(3ml),在5%co2气氛下、于37℃振荡培养20小时(150rpm)。20小时后,向各培养物各自添加150μl及1.5ml的expifectamine(商标)转染增强子1及2,在5%co2气氛下、于37℃振荡培养6天(150rpm)。
[0196]
(3.2)抗体的回收及纯化
[0197]
将各细胞培养物以3000rpm离心5分钟处理而回收培养上清。在培养上清中,含从转染的expi293(商标)细胞分泌的各抗体。将得到的培养上清再次用15000
×
g离心10分钟处理而回收上清。对于得到的上清(30ml)添加100μl的抗体纯化用载体ni sepharose high performance(ge healthcare)而于室温反应2小时。回收载体而除去上清,添加tbs(1ml)而清洗载体。向载体添加1000μl的含100mm咪唑的tbs而溶出被载体捕获的抗体。将此溶出操作合计3次进行,取得抗体溶液。
[0198]
(4)亲和性的测定
[0199]
使用biacore(注册商标)t200(ge healthcare公司)测定制作的变体的亲和性。作为抗溶菌酶抗体的抗原,使用鸡卵清来源溶菌酶(sigma-aldrich公司)。向biacore(注册商标)用传感器芯片series s sensor chip cm5(ge healthcare公司)固定化抗原(固定化:50ru)。对抗体溶液进行稀释而调制30nm、15nm、7.5nm、3.75nm及1875nm的抗体溶液。向biacore(注册商标)t200(ge healthcare公司)输送各浓度的抗体溶液(association time 120秒钟及dissociation time1800秒钟)。使用biacore(注册商标)evaluation软件解析测定数据,取得各抗体的亲和性相关数据。各抗体的kd值示于表2。
[0200]
【表2】
[0201]
抗溶菌酶抗体kd(m)野生型1.31e-1063、65、67变体9.20e-1118、20、22变体6.52e-113、5、9变体7.23e-1117、18、20变体1.05e-105、9、22变体6.90e-11
[0202]
(5)结果
[0203]
如表2所示,改变轻链的fr3的63、65、67变体、改变轻链的fr1的18、20、22变体、3、5、9变体、17、18、20变体、18、20、22变体及5、9、22变体的kd值比野生型抗溶菌酶抗体的kd值变低。从而,表2中所示的变体通过将fr3或fr1的3个氨基酸残基设为碱性氨基酸残基,与野生型相比,对于抗原的亲和性提升。
[0204]
一方面,对于表2中未显示的变体,毕竟确认不到抗体的表达。将上述(3.2)中得到的溶出液由sds-page及cbb染色分析来确认表达。结果示于图9。如从图9得知,在泳道1及2中见到抗体的重链及轻链的条带。从而,确认到野生型抗体及63、65、67变体的表达。但是,由于在泳道3~8中见不到抗体的条带,确认不到2、4、6变体、2、4、8变体、4、8、13变体、19、21、23变体、13、16、19变体及16、21、23变体的表达。
[0205]
【实施例2:对于抗原的亲和性提升的抗体的特征】
[0206]
为了发现与对于抗原的亲和性提升的实施例1的变体共同的特征,本发明人算出轻链的fr1及fr3的各位置的氨基酸频度。另外,本发明人认为,氨基酸残基的侧链向抗体分子表面与抗原的亲和性的提升相关,算出轻链的fr1及fr3的各氨基酸残基的暴露于溶剂的表面积比率。
[0207]
(1)氨基酸频度
[0208]
从提供抗体的氨基酸序列的公共数据库的abysis下载约30,000个小鼠抗体的轻链的氨基酸序列作为参照抗体。将取得的参照抗体的轻链的氨基酸序列以由kabat法附的轻链的fr中的氨基酸残基的编号一致的方式比对。取得所取得的参照抗体的轻链的fr1及fr3的各位置的氨基酸频度。序列的比对及氨基酸频度由abysis取得。得知在与对于抗原的亲和性提升的由实施例1的变体改变的氨基酸残基相对应的位置,处于r、s、t、v、d及e的出现频度高的倾向。从而,在轻链的fr1及fr3的各位置,算出这些氨基酸频度的合计值。氨基酸频度的合计值由上述的式(i)算出。其中,附在取得的参照抗体的轻链的fr的由kabat法
的编号即使是野生型抗溶菌酶抗体的轻链的fr也相同。从而,从参照抗体的轻链的氨基酸序列得到的氨基酸频度的合计值作为对于野生型抗溶菌酶抗体的轻链的氨基酸序列的值使用。
[0209]
(2)暴露于溶剂的表面积比率
[0210]
从提供蛋白质的三维结构数据的公共数据库的pdb检索野生型抗溶菌酶抗体的轻链的氨基酸序列而下载所述抗体的轻链的三维结构数据。使用取得的三维结构数据,由discovery studio client v17.2.0.16349取得野生型抗溶菌酶抗体的轻链的fr1及fr3的各氨基酸残基的暴露于溶剂的表面积比率。再者,在discovery studio client v17.2.0.16349中,暴露于溶剂的表面积比率由上述的式(ii)算出。
[0211]
(3)结果
[0212]
在表3、表4a及b中显示了野生型抗溶菌酶抗体的轻链的fr1及fr3的各位置的r、s、t、v、d及e的各自的氨基酸频度和它们的合计值、及各氨基酸残基的暴露于溶剂的表面积比率。
[0213]
【表3】
[0214][0215][0216]
【表4a】
[0217][0218][0219]
【表4b】
[0220]
轻链的fr3的位置l81l82l83l84l85l86l87l88r0.030.010.000.010.050.000.010.09s0.040.001.000.651.410.020.620.05t0.170.010.750.4427.760.000.010.00v0.250.0611.700.6627.580.010.050.02d8.6099.260.740.0432.550.000.000.00e81.180.1934.300.011.680.000.000.00氨基酸频度的合计值(%)90.2799.5348.491.8191.030.030.690.16暴露于溶剂的表面积比率(%)77.621.497.438.3815.550.001.010.00
[0221]
从这些表发现了,作为与对于抗原的亲和性提升的实施例1的变体共同的特征,在抗体的轻链的fr的氨基酸序列中,满足下述的(a)及(b)的条件两方的氨基酸残基之中的3
个被设为荷电氨基酸残基。另外得知,由在实施例1中无法确认到表达的变体改变的氨基酸残基不满足下述的(a)和/或(b)的条件。
[0222]
(a)在抗体的轻链的fr的氨基酸序列中,处于精氨酸、丝氨酸、苏氨酸、缬氨酸、天冬氨酸及谷氨酸的氨基酸频度的合计值成为35%以上的位置。
[0223]
(b)在抗体的轻链的fr的氨基酸序列中,暴露于溶剂的表面积比率显示20%以上。
[0224]
【实施例3:改变轻链的fr3的氨基酸残基的抗体的制作】
[0225]
验证是否可通过将实施例2中发现的满足上述的(a)及(b)的条件两方的氨基酸残基之中的3个取代为荷电氨基酸残基来提升抗体对于抗原的亲和性。具体而言,制作与实施例1中制作的变体不同的抗溶菌酶抗体的变体,对它们的对于抗原的亲和性进行测定。
[0226]
(1)抗溶菌酶抗体的变体的制作
[0227]
从表4a及b选择野生型抗溶菌酶抗体的轻链fr3中改变的3个氨基酸残基。为了将选择的指定的3个氨基酸残基取代为精氨酸残基,使用下述的碱基序列所示的引物,与实施例1同样地实施pcr。以seq id no:23~28的引物作为正向引物使用,以seq id no:29~34的引物作为反向引物使用。
[0228]
[变体制作用引物]
[0229]
60、63、65变体for:5’gaggctcggg caccgacttc accctgtc 3’(seq id no:23)
[0230]
60、76、77变体for:5’tcgggcaccg acttcaccct gtcgatcaga agagtcgagacggaggac 3’(seq id no:24)
[0231]
65、67、70变体for:5’ccagattcac cctgtcgatc aacagcgtcg ag 3’(seq id no:25)
[0232]
67、70、72变体for:5’ccagattcag actgtcgatc aacagcgtcg agac 3’(seq id no:26)
[0233]
74、76、77变体for:5’agtcgagacg gaggacttcg g 3’(seq id no:27)
[0234]
77、79、81变体for:5’agaacgagag acttcggcat gtacttctgc 3’(seq id no:28)
[0235]
60、63、65变体rev:5’tgcctctgaa gcgtctcggg atccccgaga tc 3’(seq id no:29)
[0236]
60、76、77变体rev:5’gcccgagccg ctgaagcgtc tcgggatccc cgagatc 3’(seq id no:30)
[0237]
65、67、70变体rev:5’tgcctctgcc tctgccgctg aagc 3’(seq id no:31)
[0238]
67、70、72变体rev:5’tgcctctgcc cgagccgctg aag 3’(seq id no:32)
[0239]
74、76、77变体rev:5’cttctgattc tcagggtgaa gtcg 3’(seq id no:33)
[0240]
77、79、81变体rev:5’gactctgttg atcgacaggg tgaagtcg 3’(seq id no:34)
[0241]
使用得到的pcr产物,与实施例1同样地,取得含编码变体的轻链的基因的质粒和含编码野生型的重链的基因的质粒。使用这些质粒,与实施例1同样地,使各抗体在expi293(商标)细胞表达,纯化得到的培养上清而取得抗溶菌酶抗体的变体的溶液。
[0242]
(2)亲和性的测定
[0243]
使用biacore(注册商标)t200(ge healthcare公司)制作的变体的亲和性,与实施例1同样地测定。结果示于表5。
[0244]
【表5】
[0245]
抗溶菌酶抗体kd(m)野生型1.3e-1060、63、65变体6.6e-1167、70、72变体1.4e-1174、76、77变体5.6e-1177、79、81变体1.0e-1065、67、70变体2.0e-1160、76、77变体9.7e-11
[0246]
如表5所示,任何变体的kd值均比野生型抗溶菌酶抗体的kd值变低。从而提示,通过将实施例2中发现的满足上述的(a)及(b)的条件两方的氨基酸残基之中的3个取代为精氨酸残基,可提升抗体对于抗原的亲和性。
[0247]
【实施例4:改变轻链的fr1或fr3的氨基酸残基的抗体的制作(2)】
[0248]
作为未改变的抗体,使用与实施例1的抗溶菌酶抗体不同的克隆(hy-hel5)的小鼠抗溶菌酶抗体、小鼠抗甲状腺刺激激素(tsh)抗体、及人源化抗her2抗体(曲妥珠单抗)。验证是否可通过将这些抗体的轻链的fr1或fr3中满足上述的(a)及(b)的条件两方的氨基酸残基之中的3个取代为荷电氨基酸残基来提升抗体对于抗原的亲和性。
[0249]
(1)变体的制作
[0250]
(1.1)编码抗溶菌酶抗体(hy-hel5)的变体的轻链的基因的取得
[0251]
作为满足上述的(a)及(b)的条件两方的氨基酸残基,从表3选择轻链fr1的第3、5及9氨基酸残基。为了将这些氨基酸残基取代为组氨酸残基,使用下述的碱基序列所示的引物,与实施例1同样地实施pcr。以seq id no:46的引物作为正向引物使用,以seq id no:47的引物作为反向引物使用。
[0252]
3、5、9变体(his)for:5’catctgcacc aatcaccgca cattatgtcc gcatctc3’(seq id no:46)
[0253]
3、5、9变体(his)rev:5’tatgtcccct ctgctcataa tcacagaggc actg 3’(seq id no:47)
[0254]
(1.2)编码抗tsh抗体的变体的轻链的基因的取得
[0255]
作为野生型抗tsh抗体的轻链fr的氨基酸序列的各位置的r、s、t、v、d及e的氨基酸频度的合计值,使用记载在表3的氨基酸频度的合计值。抗tsh抗体的轻链fr的各氨基酸残基的暴露于溶剂的表面积比率与实施例2同样地,基于从数据库pdb下载的野生型抗tsh抗体的轻链的三维结构数据而取得。作为满足上述的(a)及(b)的条件两方的氨基酸残基,选择轻链fr1的第18、20及22氨基酸残基。为了将这些氨基酸残基取代为赖氨酸残基,使用下述的碱基序列所示的引物,与实施例1同样地实施pcr。以seq id no:48的引物作为正向引物使用,以seq id no:49的引物作为反向引物使用。
[0256]
18、20、22变体(lys)for:5’aaggccaaga ttaagtgcag atctaatcag agcgttg3’(seq id no:48)
[0257]
18、20、22变体(lys)rev:5’atctccaaga ctgacaggca gggagagtg 3’(seq id no:49)
[0258]
(1.3)编码人源化抗her2抗体的变体的轻链的基因的取得
[0259]
从数据库abysis下载约30,000个人抗体的轻链的氨基酸序列作为参照抗体。与实施例2同样地,比对取得的参照抗体的轻链的氨基酸序列而算出fr的氨基酸序列的各位置的r、s、t、v、d及e的氨基酸频度的合计值。抗her2抗体的轻链fr的各氨基酸残基的暴露于溶剂的表面积比率与实施例2同样地,基于从数据库pdb下载的人源化抗her2抗体的轻链的三维结构数据而取得。选择轻链fr3的第76、77及81氨基酸残基。为了将这些氨基酸残基取代为精氨酸残基,使用下述的碱基序列所示的引物,与实施例1同样地实施pcr。以seq id no:50的引物作为正向引物使用,以seq id no:51的引物作为反向引物使用。
[0260]
76、77、81变体(arg)for:5’cagccgagag acttcgccac gtattactg 3’(seq id no:50)
[0261]
76、77、81变体(arg)rev:5’cagtcttctg atcgtcaggg taaaatcggt ac 3’(seq id no:51)
[0262]
(1.4)各抗体的变体的取得
[0263]
使用得到的pcr产物,与实施例1同样地,取得含编码各抗体的变体的轻链的基因的质粒和含编码各抗体的野生型的重链的基因的质粒。使用这些质粒,与实施例1同样地使各抗体在expi293(商标)细胞表达,纯化得到的培养上清而取得各抗体的变体的溶液。人源化抗her2抗体的76、77、81变体(arg)的轻链的氨基酸序列示于seq id no:52。
[0264]
(2)亲和性的测定
[0265]
使用biacore(注册商标)t200(ge healthcare公司)制作的变体的亲和性,与实施例1同样地测定。在测定中,作为抗tsh抗体的抗原,使用tsh蛋白质(r&dsystems公司),作为抗her2抗体的抗原,使用her2蛋白质(r&d systems公司、货号:1129-er)。结果示于表6。表中,“比率”是指将野生型的kd值设为1之时的变异型的kd值的比。
[0266]
【表6】
[0267][0268][0269]
如表6所示,任何变体的kd值均比野生型的抗体的kd值变低。从而提示,对于与实施例1的抗溶菌酶抗体不同的抗体,也可通过改变满足上述的(a)及(b)的条件两方的氨基酸残基之中的3个来提升抗体对于抗原的亲和性。
[0270]
【符号的说明】
[0271]
10:氨基酸序列的解析装置
[0272]
20:序列数据服务器
[0273]
30:网络
[0274]
40:记忆介质
[0275]
100:控制部(计算机本体)
[0276]
101:输入部
[0277]
102:输出部
[0278]
110:cpu
[0279]
111:存储器
[0280]
112:记忆装置
[0281]
113:接口
[0282]
114:读取装置
[0283]
115:总线
[0284]
210:控制部
[0285]
211:输入部
[0286]
212:输出部
[0287]
213:记忆部
[0288]
214:通信部
[0289]
215:氨基酸序列数据库
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1