预测癌症细胞对解旋酶抑制剂敏感性的方法与流程
1.本发明涉及预测癌症细胞对解旋酶抑制剂敏感性的方法。此外,本发明涉及预测癌症患者对通过解旋酶抑制剂治疗的敏感性的方法、分选作为通过解旋酶抑制剂的癌症治疗的对象的癌症患者的方法、癌症的治疗方法、癌症的治疗中应用的化合物的筛选方法和癌症治疗剂。
背景技术:
2.近年来,通过基因组测序技术的快速进步,解读包含癌症细胞中固有的基因突变的基因组信息成为可能。其中,在抗癌症剂开发中,进行对产生如egfr基因突变、braf基因突变、alk融合基因等代表的功能获得型的基因突变的癌症细胞,特异性地抑制其功能的抑制剂的药物发现(非专利文献1~3)。以具有这些基因突变的癌症细胞为靶标的对相同癌症细胞的特异性治疗方法是对癌症的选择性高、效果高的治疗方法。
3.此外,例如,报告了在显示msi-h(高频率微卫星不稳定性)的癌症细胞中,其生存依赖于wrn(werner syndrome protein)(非专利文献4~7),认为抑制wrn的治疗可以特异性地以显示该msi-h的癌症细胞为靶标。
4.另一方面,在人的癌症细胞中发现的基因突变中,不仅包含上述的功能获得型,相反也包含功能缺失型的基因突变。功能缺失型的基因突变难以进行该基因突变特异性的药物发现,需要与以具有功能获得型的基因突变的癌症细胞为靶标的治疗不同的治疗策略。
5.作为可以特异性地以产生功能缺失型突变的癌症细胞为靶标的少数成功实例,列举对brca1/2缺陷型肿瘤的parp抑制剂(非专利文献8)。但是,目前依然尚未开发出特异性地以产生这些以外的功能缺失型突变的癌症细胞为靶标的治疗策略。
6.现有技术文献
7.非专利文献
8.非专利文献1:makoto maemondo等,nejm 2010jun 24;362(25),p.2380-2388
9.非专利文献2:paul b.chapman等,nejm 2011jun 30;364(26),p.2507-2516
10.非专利文献3:d.ross camidge等,j thorac oncol.2019jul;14(7),p.1233-1243
11.非专利文献4:lorn kategaya等,iscience 13,march 29,2019,p.488-497
12.非专利文献5:simone lieb等,elife 2019,8:e43333,doi:https://doi.org/10.7554/elife.43333
13.非专利文献6:edmond m.chan等,nature.2019april,568(7753),p.551-556
14.非专利文献7:fiona m behan等,nature.2019april,568(7753),p.511-516
15.非专利文献8:k.moore等,nejm 2018dec 27;379(26),p.2495-2505
16.发明概述
17.发明要解决的问题
18.本发明鉴于上述状况完成。本发明的目的是开发可以特异性地以产生功能缺失型突变的癌症细胞为靶标的治疗策略,更具体地,目的是开发特异性地以检测到选自由ttk突
变和rad50突变组成的第1组的至少1种突变、和/或选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的癌症细胞为靶标的治疗策略。
19.用于解决问题的手段
20.本发明人为解决上述问题反复深入研究,首先,关于约70株的癌症细胞株全面进行通过sirna的wrn的表达抑制,分析确认增殖的抑制的细胞株中共有的突变。其结果发现,进行产生选自由ttk突变和rad50突变组成的第1组的至少1种突变(优选地,功能缺失型突变)的癌症细胞中共有的、wrn等解旋酶的表达抑制或功能抑制时,该癌症细胞的增殖被显著抑制,另一方面,在ttk突变和rad50突变中的任一种都不产生的细胞中,不产生这样的增殖抑制。
21.进一步地,本发明人追加对象的癌症细胞株,关于包含上述约70株的癌症细胞株的约200株的癌症细胞株进行全面分析。其结果发现,进行除了选自上述第1组的突变还产生选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变(优选地,功能缺失型突变)的癌症细胞中共有的、解旋酶的表达抑制或功能抑制时,该癌症细胞的增殖被抑制。
22.此外,上述的突变是例如显示msi-h的癌症细胞中也高频率确认的突变的一部分。如上述,认为msi-h可以是用于选择成为抑制作为解旋酶的wrn的治疗的靶标的癌症细胞的指标(例如,非专利文献4~7)。但是,本发明人发现,在显示msi-h但不产生上述的突变、特别是选自上述第2组的突变中的任一种的癌症细胞中,不产生上述增殖抑制。因此,上述新发现的突变与是否显示msi-h无关,可以作为用于选择成为抑制解旋酶的治疗的靶标的癌症细胞的指标,并且可以作为用于选择前述癌症细胞的比msi-h更特异性的指标。
23.因此,本发明人发现,抑制解旋酶的治疗是用于以产生选自由ttk突变和rad50突变组成的第1组的至少1种突变、和/或选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的癌症细胞为靶标的治疗的有希望的方法。此外,由于在该治疗策略中,可以在以前述突变为指标分选癌症患者后施用解旋酶抑制剂,显然,基于伴随诊断的有效治疗是可能的。
24.进一步地,本发明人还发现,可以以是否抑制解旋酶为指标,进行产生前述突变的癌症的治疗中有用的药剂的筛选,从而完成本发明。
25.因此,本发明还涉及特异性地以产生选自由ttk突变和rad50突变组成的第1组的至少1种突变、和/或选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的癌症细胞为靶标的治疗方法和用于该治疗方法的伴随诊断,更详细地,提供以下发明。
26.1.27.预测癌症细胞对解旋酶抑制剂敏感性的方法,其包括:
28.将检测到选自由ttk突变和rad50突变组成的第1组的至少1种突变的癌症细胞预测为对解旋酶抑制剂具有敏感性的步骤。
29.2.30.预测癌症细胞对解旋酶抑制剂敏感性的方法,其包括:
31.(a)检测癌症细胞中选自由ttk突变和rad50突变组成的第1组的至少1种突变的有无的步骤,和
32.(b)将检测到前述突变的癌症细胞预测为对解旋酶抑制剂具有敏感性的步骤。
33.3.34.预测癌症患者对通过解旋酶抑制剂治疗的敏感性的方法,其包括:
35.将来自癌症患者的样品中包含的癌症细胞中检测到选自由ttk突变和rad50突变组成的第1组的至少1种突变的癌症患者预测为对通过解旋酶抑制剂治疗具有敏感性的步骤。
36.4.37.预测癌症患者对通过解旋酶抑制剂治疗的敏感性的方法,其包括:
38.(a)检测来自癌症患者的样品中包含的癌症细胞中选自由ttk突变和rad50突变组成的第1组的至少1种突变的有无的步骤,和
39.(b)将前述癌症细胞中检测到前述突变的癌症患者预测为对通过解旋酶抑制剂治疗具有敏感性的步骤。
40.5.41.分选作为通过解旋酶抑制剂的癌症治疗的对象的癌症患者的方法,其包括:
42.将来自癌症患者的样品中包含的癌症细胞中检测到选自由ttk突变和rad50突变组成的第1组的至少1种突变的癌症患者分选为通过解旋酶抑制剂的癌症治疗的对象的步骤。
43.6.44.分选作为通过解旋酶抑制剂的癌症治疗的对象的癌症患者的方法,其包括:
45.(a)检测来自癌症患者的样品中包含的癌症细胞中选自由ttk突变和rad50突变组成的第1组的至少1种突变的有无的步骤,和
46.(b)将前述癌症细胞中检测到前述突变的癌症患者分选为通过解旋酶抑制剂的癌症治疗的对象的步骤。
47.7.48.治疗癌症的方法,其包括:
49.对来自癌症患者的样品中包含的癌症细胞中检测到选自由ttk突变和rad50突变组成的第1组的至少1种突变的癌症患者施用解旋酶抑制剂的步骤。
50.8.51.治疗癌症的方法,其包括:
52.(a)检测来自癌症患者的样品中包含的癌症细胞中选自由ttk突变和rad50突变组成的第1组的至少1种突变的有无的步骤,和
53.(b)对前述癌症细胞中检测到前述突变的癌症患者施用解旋酶抑制剂的步骤。
54.9.55.[1]~[8]中任一项记载的方法,其中,前述解旋酶抑制剂是wrn抑制剂。
[0056]
[10]
[0057]
[1]~[9]中任一项记载的方法,其中,前述癌症细胞是进一步地检测到msh3突变的癌症细胞。
[0058]
[11]
[0059]
包含检测到选自由ttk突变和rad50突变组成的第1组的至少1种突变的癌症细胞
的癌症的治疗中应用的化合物的筛选方法,其包括:
[0060]
以是否抑制解旋酶为指标分选化合物的步骤。
[0061]
[12]
[0062]
癌症治疗剂,其为包含检测到选自ttk突变和rad50突变的至少1种突变的癌症细胞的癌症的治疗剂,其含有抑制解旋酶的化合物作为有效成分。
[0063]
[13]
[0064]
[11]中记载的方法,其中,前述解旋酶是wrn。
[0065]
[14]
[0066]
[12]中记载的癌症治疗剂,其中,前述解旋酶是wrn。
[0067]
[15]
[0068]
预测癌症细胞对解旋酶抑制剂敏感性的方法,其包括:
[0069]
将检测到选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的癌症细胞预测为对解旋酶抑制剂具有敏感性的步骤。
[0070]
[16]
[0071]
预测癌症细胞对解旋酶抑制剂敏感性的方法,其包括:
[0072]
(a)检测癌症细胞中选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的有无的步骤,和
[0073]
(b)将检测到前述突变的癌症细胞预测为对解旋酶抑制剂具有敏感性的步骤。
[0074]
[17]
[0075]
预测癌症患者对通过解旋酶抑制剂治疗的敏感性的方法,其包括:
[0076]
将来自癌症患者的样品中包含的癌症细胞中检测到选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的癌症患者预测为对通过解旋酶抑制剂治疗具有敏感性的步骤。
[0077]
[18]
[0078]
预测癌症患者对通过解旋酶抑制剂治疗的敏感性的方法,其包括:
[0079]
(a)检测来自癌症患者的样品中包含的癌症细胞中选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的有无的步骤,和
[0080]
(b)将前述癌症细胞中检测到前述突变的癌症患者预测为对通过解旋酶抑制剂治疗具有敏感性的步骤。
[0081]
[19]
[0082]
分选作为通过解旋酶抑制剂的癌症治疗的对象的癌症患者的方法,其包括:
[0083]
将来自癌症患者的样品中包含的癌症细胞中检测到选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的癌症患者分选为通过解旋酶抑制剂的癌症治疗的对象的步骤。
[0084]
[20]
[0085]
分选作为通过解旋酶抑制剂的癌症治疗的对象的癌症患者的方法,其包括:
[0086]
(a)检测来自癌症患者的样品中包含的癌症细胞中选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的有无的步骤,和
[0087]
(b)将前述癌症细胞中检测到前述突变的癌症患者分选为通过解旋酶抑制剂的癌
症治疗的对象的步骤。
[0088]
[21]
[0089]
治疗癌症的方法,其包括:
[0090]
对来自癌症患者的样品中包含的癌症细胞中检测到选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的癌症患者施用解旋酶抑制剂的步骤。
[0091]
[22]
[0092]
治疗癌症的方法,其包括:
[0093]
(a)检测来自癌症患者的样品中包含的癌症细胞中选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的有无的步骤,和
[0094]
(b)对前述癌症细胞中检测到前述突变的癌症患者施用解旋酶抑制剂的步骤。
[0095]
[23]
[0096]
权利要求[15]~[22]中任一项记载的方法,其中,前述解旋酶抑制剂是wrn抑制剂。
[0097]
[24]
[0098]
[15]~[23]中任一项记载的方法,其中,前述癌症细胞是进一步地检测到选自由exo1突变、rpa1突变、rpa2突变和rpa3突变组成的第3组的至少1种突变的癌症细胞。
[0099]
[25]
[0100]
包含检测到选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的癌症细胞的癌症的治疗中应用的化合物的筛选方法,其包括:
[0101]
以是否抑制解旋酶为指标分选化合物的步骤。
[0102]
[26]
[0103]
癌症治疗剂,其是包含检测到选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的癌症细胞的癌症的治疗剂,其含有抑制解旋酶的化合物作为有效成分。
[0104]
[27]
[0105]
[25]中记载的方法,其中,前述解旋酶是wrn。
[0106]
[28]
[0107]
[26]中记载的癌症治疗剂,其中,前述解旋酶是wrn。
[0108]
发明效果
[0109]
根据本发明,以选自由ttk突变和rad50突变组成的第1组的至少1种突变、和/或选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变为指标,有效地预测对通过解旋酶抑制剂的癌症治疗的敏感性成为可能。此外,根据本发明,检测来自癌症患者的样品中前述突变的有无,分选检测到该突变的患者后,可以对该患者实施通过解旋酶抑制剂的癌症的治疗。因此,大幅增加癌症的治疗成绩成为可能。此外,通过应用针对选自由ttk和rad50组成的第1组的至少1种的基因、和/或选自由rad50、mre11、nbn(编码nbs1的基因)、dna2和rbbp8(编码ctip的基因)组成的第2组的至少1种的基因的寡核苷酸探针和引物,以及针对选自由ttk蛋白质和rad50蛋白质组成的第1组的至少1种蛋白质、和/或选自由rad50蛋白质、mre11蛋白质、nbs1蛋白质、dna2蛋白质和ctip蛋白质组成的
第2组的至少1种蛋白质的抗体,有效进行通过上述突变的有无的检测的伴随诊断成为可能。
[0110]
附图简述
[0111]
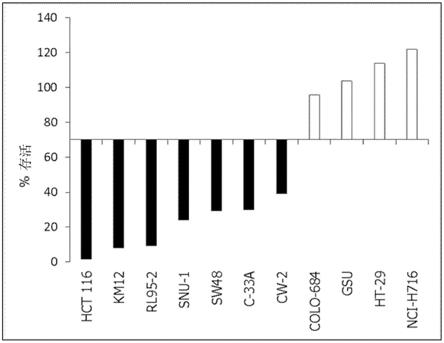
[图1]是显示试验例1中通过癌症细胞株的wrn表达抑制的细胞生存率的图。
[0112]
[图2]是显示试验例2中通过癌症细胞株的wrn表达抑制的细胞生存率的图。
[0113]
[图3]是显示试验例3中通过癌症细胞株的wrn表达抑制的细胞生存率的图。
[0114]
用于实施发明的方式
[0115]
以下,结合其优选实施方式详细说明本发明。
[0116]
《预测癌症细胞对解旋酶抑制剂敏感性的方法、预测癌症患者对通过解旋酶抑制剂治疗的敏感性的方法、分选作为通过解旋酶抑制剂的癌症治疗的对象的癌症患者的方法》
[0117]
本发明中发现,在产生选自由ttk突变和rad50突变组成的第1组的至少1种突变(本说明书中,根据情形称为“ttk突变和/或rad50突变”或“第1组的突变”)、优选地功能缺失型突变的癌症细胞中,抑制解旋酶时,可以抑制该癌症细胞的增殖。进一步地追加,发现也在产生选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变(本说明书中,根据情形称为“第2组的突变”)、优选地功能缺失型突变的癌症细胞中,抑制解旋酶时,可以抑制该癌症细胞的增殖。
[0118]
基于这些知识,以第1组的突变和/或第2组的突变为指标,可以预测癌症细胞对解旋酶抑制剂敏感性。因此,本发明提供:
[0119]
预测癌症细胞对解旋酶抑制剂敏感性的方法,其包括:
[0120]
(a)检测癌症细胞中选自由ttk突变和rad50突变组成的第1组的至少1种突变的有无的步骤,和
[0121]
(b)将检测到前述突变的癌症细胞预测为对解旋酶抑制剂具有敏感性的步骤;以及
[0122]
预测癌症细胞对解旋酶抑制剂敏感性的方法,其包括:
[0123]
(a)预测癌症细胞中选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的有无的步骤,和
[0124]
(b)将检测到前述突变的癌症细胞预测为对解旋酶抑制剂具有敏感性的步骤(以下,根据情形称将它们总称为“癌症细胞敏感性预测方法”)。
[0125]
此外,基于上述知识,以第1组的突变和/或第2组的突变为指标,可以预测对通过解旋酶抑制剂的癌症治疗的敏感性。因此,本发明提供:
[0126]
预测癌症患者对通过解旋酶抑制剂治疗的敏感性的方法,其包括:
[0127]
(a)检测来自癌症患者的样品中包含的癌症细胞中选自由ttk突变和rad50突变组成的第1组的至少1种突变的有无的步骤,和
[0128]
(b)将前述癌症细胞中检测到前述突变的癌症患者预测为对通过解旋酶抑制剂治疗具有敏感性的步骤;以及
[0129]
预测癌症患者对通过解旋酶抑制剂治疗的敏感性的方法,其包括:
[0130]
(a)检测来自癌症患者的样品中包含的癌症细胞中选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的有无的步骤,和
syndrome protein)。分别地,编码来自人的天然型wrn的基因组dna的典型的碱基序列显示于序列编号:1,来自人的天然型wrn的典型的氨基酸序列显示于序列编号:2。另外,即使是未产生伴随氨基酸序列的置换、缺失、插入、和添加等的突变的wrn基因(编码wrn的基因),也可因多态性等而在序列中产生个体差异。
[0146]
化合物抑制前述解旋酶的活性可以如下确认,例如,在包含荧光分子、用消光分子标记各链的双链dna和前述解旋酶的系统,即通过该解旋酶活性解开为单链dna时荧光分子和消光分子分离发生荧光的系统中,添加被检化合物,检测该荧光的产生的抑制(sommers ja等,a high-throughput screen to identify novel small molecule inhibitors of the werner syndrome helicase-nuclease(wrn),plos one.2019 jan 9;14(1):e0210525)。
[0147]
此外,化合物抑制前述解旋酶的表达可以如下确认,例如,检测用被检化合物处理的细胞中解旋酶(优选地wrn)的表达降低。作为解旋酶的表达降低的检测法,通常列举,以转录水平或翻译水平检测解旋酶的表达量,在与对照(例如,不用被检化合物处理的细胞的表达量)的比较中,确认比其表达量少的方法。
[0148]
在以转录水平检测前述解旋酶的表达量的方法中,首先,从用被检化合物处理的细胞配制rna或cdna。作为从前述细胞提取rna的方法,没有特别限制,可以适当选择应用公知方法,例如,列举应用苯酚和离液盐的提取方法(更具体地,应用trizol(invitrogen公司制)、isogen(和光纯药公司制)等市售试剂盒的提取方法),和应用其它市售试剂盒(rnaprep总rna提取试剂盒(beckman coulter公司制)、rneasy mini(qiagen公司制)、rna extraction kit(pharmacia biotech公司制)等)的方法。进一步地,作为来自提取的rna的cdna的配制中应用的逆转录酶,没有特别限制,例如,列举来自rav(rous伴随病毒)和amv(禽类成髓细胞性白血病病毒)等逆转录病毒的逆转录酶、和来自mmlv(莫洛尼鼠白血病病毒)等小鼠的逆转录病毒的逆转录酶。
[0149]
随后,将寡核苷酸引物或寡核苷酸探针分别应用于扩增反应或杂交反应,检测其扩增产物或杂合体产物。作为这样的方法,例如,可以利用rt-pcr法、rna印迹法、斑点印迹法、dna阵列法、原位杂交法、rna酶保护测定法、mrna-seq等。本领域技术人员基于编码前述解旋酶的cdna的碱基序列,可以通过常规方法设计适于各方法的寡核苷酸引物或寡核苷酸探针。
[0150]
在以翻译水平检测前述解旋酶的表达量的方法中,首先,从用被检化合物处理的细胞配制蛋白质样品。随后,应用对前述解旋酶有特异性的抗体进行抗原抗体反应,检测该解旋酶。在应用这样的抗体的蛋白质的检测法中,例如,对前述蛋白质样品添加对解旋酶有特异性的抗体进行抗原抗体反应,检测前述抗体与解旋酶的结合。在对解旋酶有特异性的抗体被标记的情形中,可以直接检测解旋酶,在不标记的情形中,进一步地,使识别该抗体的被标记分子(例如,二次抗体或蛋白a)作用,利用该分子的标记,可以间接检测解旋酶。作为这样的方法,例如,可以利用应用免疫组织化学(免疫染色)法、蛋白印迹法、elisa法、流式细胞术、成像细胞术、放射免疫测定、免疫沉淀法、抗体阵列的分析法等。
[0151]
使用的抗体的种类和来源等没有特别限制,优选单克隆抗体。只要可以以足够特异性检测解旋酶,也可以应用寡克隆抗体(数种~数十种抗体的混合物)或多克隆抗体。此外,也可以应用fab、fab’、f(ab’)2、fv、scfv、sc(fv)2、dsfv、和双抗体(diabody)等抗体的功
能片段或其多聚体(例如,二聚体、三聚体、四聚体、多聚体)。作为抗解旋酶抗体,可以是市售品。
[0152]
前述解旋酶的检测也可以使用质谱分析法(ms)进行。特别是通过与液相色谱连接的质谱分析仪(lc/ms)的分析由于灵敏而有利。通过质谱分析法的检测可以如下进行,例如,对前述蛋白质样品,标记该蛋白质,将标记的蛋白质分级,将分级的蛋白质提供给质谱分析,根据质谱分析值鉴定解旋酶。作为标记,可以应用本技术领域公知的同位素标记试剂,可以将适当的标记试剂作为市售品得到。此外,分级也可以通过本技术领域公知的方法进行,例如,可以应用市售的强阳离子柱等进行。
[0153]
作为本发明中的“抑制解旋酶的化合物”,没有特别限制,可以是公知的化合物,也可以是通过后述的筛选鉴定的化合物,优选选自化合物、多肽和多核苷酸的至少1种。
[0154]
作为前述化合物,列举低分子化合物(分子量不足900)、中分子化合物(分子量900~2000)。前述多肽中,除了由基因编码的全长多肽以外,也包含其片段和合成的多肽、环状多肽、糖肽、非天然型多肽。此外,前述多肽也包含抗体和抗原肽,作为前述抗体,可以是多克隆抗体也可以是单克隆抗体。前述抗体中,除了完全抗体以外,也包含抗体片段(例如,fab、fab’、f(ab’)2、fv、scfv、sc(fv)2、dsfv、和双抗体等)和其多聚体、结合抗体的可变区的低分子化抗体。作为前述多核苷酸,列举dna、rna、sirna,除了全长多核苷酸以外,也包含其片段和合成的多核苷酸。
[0155]
本发明中的“解旋酶抑制剂”相应于其特性可以是片剂、丸剂、散剂、颗粒剂、胶囊剂、液剂等各种剂型,此外,相应于其剂型,也可以进一步地含有药学上容许的灭菌水或生理盐水、植物油、溶剂、基质、乳化剂、悬浮剂、表面活性剂、稳定剂、香味剂、芳香剂、赋形剂、载体、防腐剂、粘合剂、稀释剂、等渗剂、镇痛剂、增量剂、崩解剂、缓冲剂、包衣剂、润滑剂、着色剂、甜味剂、增稠剂、矫味剂、增溶剂等添加成分,可以应用它们通过公知的制剂学方法制造。
[0156]
此外,在本发明涉及的解旋酶抑制剂中,前述抑制解旋酶的化合物的含量(前述化合物为2种以上的情形中它们的合计含量)可以相应于其剂型和使用目的适当调整。
[0157]
(第1组的突变、第2组的突变)
[0158]
〔ttk〕
[0159]
本发明中的“ttk”是编码参与中心体复制和有丝分裂检查点应答的控制的丝氨酸苏氨酸激酶(本说明书中,根据情形称为“ttk蛋白质”)的基因。分别地,来自人的天然型ttk基因组dna的典型的碱基序列显示于序列编号:3,来自人的天然型ttk蛋白质的典型的氨基酸序列显示于序列编号:4。另外,即使是未产生伴随氨基酸序列的置换、缺失、插入、和添加等的突变的ttk,也可因多态性等而在序列中产生个体差异。
[0160]
作为本发明中的“ttk突变”,列举ttk蛋白质的氨基酸序列中氨基酸的置换、缺失、插入、和添加。作为这样的ttk突变,只要ttk蛋白质本来具有的活性变化,则没有特别限制,优选引起ttk蛋白质活性的降低(包含ttk蛋白质活性的完全丧失(失活))的突变,即功能缺失型突变。ttk蛋白质活性的降低可以通过例如ttk中的错义突变、跨全区的无义突变、或ttk的全体或部分的缺失等基因结构的变化、基因表达量的变化产生,但不限于这些。
[0161]
ttk本来具有的基因结构和基因表达量是否变化可以通过例如下列方法:通过基因组dna的测序取得ttk的碱基序列;通过与ttk的核苷酸序列特异性地结合的寡核苷酸探
针的荧光检测;通过应用与ttk的核苷酸特异性地结合的寡核苷酸引物的pcr法的检测等,通过在与对照(例如,健康者或同一患者的非癌症组织)的比较中是否变化(优选地,是否产生功能缺失型突变,mrna的表达量的情形中是否减少)来确认和判定。
[0162]
ttk蛋白质本来具有的活性(功能活性)是否变化可以通过例如下列方法:通过应用与ttk蛋白质特异性地结合的抗体的免疫染色法或蛋白印迹法检测;和通过蛋白印迹法等判别通过免疫沉淀法等纯化的细胞内ttk蛋白质是否磷酸化底物肽的方法等,通过在与对照(例如,健康者或同一患者的非癌症组织)的比较中是否变化(优选地,是否降低,即,通过免疫染色法或蛋白印迹法检测的蛋白质的表达量的情形中与对照相比是否降低,通过蛋白印迹法检测的蛋白质的分子量的情形中与对照相比是否变化,磷酸化活性的情形中与对照相比是否降低)来确认和判定。
[0163]
作为引起这样的ttk蛋白质活性变化的具体的ttk突变的实例,例如,列举p.l84*(cosmic legacy mutation id:cosm1643150)、p.s162vfs*9(cosmic legacy mutation id:cosm3176137)、p.k192sfs*18(cosmic legacy mutation id:cosm1446079)、p.q193afs*33(cosmic legacy mutation id:cosm3176143)、p.r232sfs*26(cosmic legacy mutation id:cosm5895418)、p.q480hfs*30(cosmic legacy mutation id:cosm150902)、p.n606kfs*3(cosmic legacy mutation id:cosm7741406)、p.s618ifs*3(cosmic legacy mutation id:cosm6811382)、p.e851kfs*42(cosmic legacy mutation id:cosm3176214)、p.r854gfs*10(cosmic legacy mutation id:cosm1446097)、p.r854gfs*10(cosmic legacy mutation id:cosm3176218)、p.r854gfs*39(cosmic legacy mutation id:cosm252896)、p.r854kfs*11(cosmic legacy mutation id:cosm253159)、p.k857nfs*36(cosmic legacy mutation id:cosm273397)等。
[0164]
〔rad50〕
[0165]
本发明中的“rad50”是编码与下述mre11蛋白质和nbs1蛋白质共同形成复合物(mrn复合物)参与dna修复机制(特别是双链dna同源末端修复机制)的蛋白质(本说明书中,根据情形称为“rad50蛋白质”)的基因。分别地,来自人的天然型rad50基因组dna的典型的碱基序列显示于序列编号:5,来自人的天然型rad50蛋白质的典型的氨基酸序列显示于序列编号:6。另外,即使是未产生伴随氨基酸序列的置换、缺失、插入、和添加等的突变的rad50,也可因多态性等而在序列中产生个体差异。
[0166]
作为本发明中的“rad50突变”,列举rad50蛋白质的氨基酸序列中氨基酸的置换、缺失、插入、和添加。作为这样的rad50突变,只要rad50蛋白质本来具有的活性变化,则没有特别限制,优选引起rad50蛋白质活性的降低(包含rad50蛋白质活性的完全丧失(失活))的突变,即,功能缺失型突变。rad50蛋白质活性的降低例如可通过rad50中的错义突变、跨全区的无义突变、或rad50的全体或部分缺失等基因结构的变化、基因表达量的变化产生,但不限于这些。
[0167]
rad50本来具有的基因结构和基因表达量是否变化可以通过例如下列方法:通过基因组dna的测序取得rad50的碱基序列;通过与rad50的核苷酸序列特异性地结合的寡核苷酸探针的荧光检测;通过应用与rad50的核苷酸特异性地结合的寡核苷酸引物的pcr法的检测等,通过在与对照(例如,健康者或同一患者的非癌症组织)的比较中是否变化(优选地,是否产生功能缺失型突变,mrna的表达量的情形中是否减少)来确认和判定。
[0168]
rad50蛋白质本来具有的活性(功能活性)是否变化可以通过例如下列方法:通过应用与rad50蛋白质特异性地结合的抗体的免疫染色法或蛋白印迹法的检测;和通过蛋白印迹法等判别通过免疫沉淀法等纯化的细胞内rad50蛋白质是否与作为mrn复合物的构成蛋白质的mre11蛋白质和nbs1蛋白质结合的方法;和通过atpase活性测定法判别通过免疫沉淀法等纯化的细胞内rad50蛋白质是否具有atpase活性的方法等,通过与对照(例如,健康者或同一患者的非癌症组织)的比较中是否变化(优选地,是否降低,即,通过免疫染色法或蛋白印迹法检测的rad50蛋白质的表达量的情形中与对照是否降低,通过蛋白印迹法检测的蛋白质的分子量的情形中与对照相比是否变化,与通过蛋白印迹法检测的rad50蛋白质结合的mrn复合物的构成蛋白质mre11蛋白质或nbs1蛋白质的量与对照相比是否降低,atpase活性的情形中与对照相比活性是否降低)来确认和判定。
[0169]
作为引起这样的rad50蛋白质活性的变化的具体的rad50突变的实例,例如,列举p.a149gfs*10(cosmic legacy mutation id:cosm7087398)、p.c157lfs*7(cosmic legacy mutation id:cosm9001198)、p.s181ffs*7(cosmic legacy mutation id:cosm9008445)、p.k279efs*7(cosmic legacy mutation id:cosm5016099)、p.t410lfs*5(cosmic legacy mutation id:cosm6941414)、p.k425tfs*4(cosmic legacy mutation id:cosm9494174)、p.l439kfs*4(cosmic legacy mutation id:cosm1158978)、p.n459mfs*2(cosmic legacy mutation id:cosm8515312)、p.l541afs*7(cosmic legacy mutation id:cosm6971853)、p.r617efs*26(cosmic legacy mutation id:cosm4747889)、p.d675tfs*45(cosmic legacy mutation id:cosm5016101)、p.q689rfs*31(cosmic legacy mutation id:cosm6761894)、p.k722gfs*5(cosmic legacy mutation id:cosm6048265)、p.k722rfs*14(cosmic legacy mutation id:cosm1433045)、p.e723gfs*5(cosmic legacy mutation id:cosm4611459)、p.k722nfs*6、p.l929sfs*10(cosmic legacy mutation id:cosm1740881)、p.n934ifs*6(cosmic legacy mutation id:cosm1433049)、p.n934kfs*10(cosmic legacy mutation id:cosm1287518)、p.e995rfs*2(cosmic legacy mutation id:cosm6962279)、p.l1042ffs*15(cosmic legacy mutation id:cosm5617248)、p.y1182lfs*2(cosmic legacy mutation id:cosm1633926)等。
[0170]
〔mre11、nbn〕
[0171]
本发明中的“mre11(也已知为“mre11a”)”是编码与上述rad50蛋白质共同形成复合物(mrn复合物)的蛋白质(本说明书中,根据情形称为“mre11蛋白质”)的基因。mre11蛋白质是在dna的端部作为外切核酸酶、在内部部位作为内切核酸酶、可以分解dna的核酸酶。此外,本发明中的“nbn”是编码与上述rad50蛋白质共同形成复合物(mrn复合物)的蛋白质nbs1(本说明书中,根据情形称为“nbs1蛋白质”)的基因。这些蛋白质互相关联参与dna修复机制(特别是,双链dna同源末端修复机制)(例如,lei bian等,molecular cancer,(2019)18:169,doi:https://doi.org/10.1186/s12943-019-1100-5;kwi h koh等,laboratory investigation,(2005)85,p.1130-1138等)。即使它们中的任1种的功能缺失,mrn复合物自体的功能降低,上述dna修复机制不正常发挥功能,因此,第2组的突变中,关于编码形成该mrn复合物的蛋白质的rad50、mre11和nbn,特别优选检测它们中至少1种突变,更优选检测rad50突变和nbn突变中至少1种突变。
legacy mutation id:cosm6981006)、p.k219nfs*16(cosmic legacy mutation id:cosm1740923)、p.k233sfs*5(cosmic legacy mutation id:cosm9494223)、p.s240cfs*8(cosmic legacy mutation id:cosm6924583)、p.f3 16sfs*2(cosmic legacy mutation id:cosm7450031)、p.n440kfs*2(cosmic legacy mutation id:cosm7513565)、p.r466gfs*18(cosmic legacy mutation id:cosm1458550)、p.r466kfs*5(cosmic legacy mutation id:cosm8498945)、p.l490*(cosmic legacy mutation id:cosm2790257)、p.n503kfs*2(cosmic legacy mutation id:cosm9061551)、p.e505gfs*6(cosmic legacy mutation id:cosm7513880)、p.r551gfs*8(cosmic legacy mutation id:cosm1458549)、p.r551kfs*5(cosmic legacy mutation id:cosm6918499)、p.m553wfs*6(cosmic legacy mutation id:cosm6955358)、p.l654afs*5(cosmic legacy mutation id:cosm1458548)、p.a713gfs*29(cosmic legacy mutation id:cosm6983893)、p.n731ifs*20(cosmic legacy mutation id:cosm30401)等。
[0177]
〔dna2〕
[0178]
本发明中的“dna2”是编码与mrn复合物共同参与dna修复机制(特别是,双链dna同源末端修复机制)的蛋白质(本说明书中,根据情形称为“dna2蛋白质”)的基因。dna2蛋白质是在dna的端部作为外切核酸酶、在内部部位作为内切核酸酶、可以分解dna的核酸酶,此外,也是可以将双链dna解开为单链的解旋酶。分别地,来自人的天然型dna2基因组dna的典型的碱基序列显示于序列编号:13,来自人的天然型dna2蛋白质的典型的氨基酸序列显示于序列编号:14。另外,即使是未产生伴随氨基酸序列的置换、缺失、插入、和添加等的突变的dna2,也可因多态性等而在序列中产生个体差异。
[0179]
作为本发明中的“dna2突变”,列举dna2蛋白质的氨基酸序列中氨基酸的置换、缺失、插入、和添加。作为这样的dna2突变,只要dna2蛋白质本来具有的活性分别变化,则没有特别限制,优选引起dna2蛋白质活性的降低(包含dna2蛋白质活性的完全丧失(失活))的突变,即,能缺失型突变。dna2蛋白质活性的降低例如可通过dna2中的错义突变、跨全区的无义突变、或dna2的全体或部分的缺失等基因结构的变化、基因表达量的变化产生,但不限于这些。
[0180]
关于dna2本来具有的基因结构和基因表达量是否变化以及dna2蛋白质本来具有的活性(功能活性)是否变化,例如,可通过与作为确认和判定rad50本来具有的基因结构和基因表达量是否变化的方法、以及确认和判定rad50蛋白质本来具有的活性(功能活性)是否变化的方法列举的方法同样的方法来确认和判定。
[0181]
作为引起这样的dna2蛋白质活性的变化的具体的dna2突变的实例,列如,列举p.k590nfs*5(cosmic legacy mutation id:cosm8485077)、p.l697ffs*28(cosmic legacy mutation id:cosm1348694)、p.l776ffs*9(cosmic legacy mutation id:cosm5081629)、p.l776pfs*24(cosmic legacy mutation id:cosm7631030)、p.s779tfs*20(cosmic legacy mutation id:cosm4747435)、p.s779ffs*7(cosmic legacy mutation id:cosm5092627)、p.s779hfs*6(cosmic legacy mutation id:cosm295321)、p.s779ffs*21(cosmic legacy mutat1on id:cosm2159320)、p.v825cfs*5(cosmic legacy mutation id:cosm6645872)、p.i940lfs*8(cosmic legacy mutation id:cosm5423531)、p.s975vfs*4(cosmic legacy mutation id:cosm1727571)等。
[0182]
〔rbbp8〕
[0183]
本发明中的“rbbp8”是编码与mrn复合物共同参与dna修复机制(特别是,双链dna同源末端修复机制)的蛋白质ctip(本说明书中,根据情形称为“ctip蛋白质”)的基因。ctip蛋白质是在dna的内部部位作为内切核酸酶、可以分解dna的核酸酶。分别地,来自人的天然型rbbp8基因组dna(编码ctip的基因组dna)的典型的碱基序列显示于序列编号:15,来自人的天然型ctip蛋白质的典型的氨基酸序列显示于序列编号:16。另外,即使是未产生伴随氨基酸序列的置换、缺失、插入、和添加等的突变的rbbp8,也可因多态性等而在序列中产生个体差异。
[0184]
作为本发明中的“rbbp8突变”,列举ctip蛋白质的氨基酸序列中氨基酸的置换、缺失、插入、和添加。作为这样的rbbp8突变,只要ctip蛋白质本来具有的活性分别变化,则没有特别限制,优选引起ctip蛋白质活性的降低(包含ctip蛋白质活性的完全丧失(失活))的突变,即,功能缺失型突变。ctip蛋白质活性的降低例如可通过rbbp8中的错义突变、跨全区的无义突变、或rbbp8的全体或部分的缺失等基因结构的变化、基因表达量的变化产生,但不限于这些。
[0185]
关于rbbp8本来具有的基因结构和基因表达量是否变化、以及ctip蛋白质本来具有的活性(功能活性)是否变化,例如,可以通过与作为确认和判定rad50本来具有的基因结构和基因表达量是否变化的方法、以及确认和判定rad50蛋白质本来具有的活性(功能活性)是否变化的方法列举的方法同样的方法来确认和判定。
[0186]
作为引起这样的ctip蛋白质活性的变化的具体的rbbp8突变的实例,例如,列举p.r100pfs*8(cosmic legacy mutation id:cosm1744943)、p.h183pfs*11(cosmic legacy mutation id:cosm9138797)、p.s231m235del(cosmic legacy mutation id:cosm7203765)、p.l286tfs*24(cosmic legacy mutat1on id:cosm1 745525)、p.k357nfs*3(cosmic legacy mutation id:cosm8188329)、p.h358tfs*8(cosmic legacy mutation id:cosm1744941)、p.t375nfs*2(cosmic legacy mutation id:cosm8188329)、p.e455tfs*2(cosmic legacy mutation id:cosm4720593)、p.f479efs*4(cosmic legacy mutation id:cosm1263883)、p.f650kfs*16(cosmic legacy mutation id:cosm4189100)、p.v672efs*2(cosmic legacy mutation id:cosm1190926)、p.k801efs*14(cosmic legacy mutation id:cosm7088614)、p.e803rfs*12(cosmic legacy mutation id:cosm2885323)、p.l808tfs*7(cosmic legacy mutation id:cosm7513270)等。
[0187]
〔突变的检测〕
[0188]
作为本发明中的“ttk突变的检测”、“rad50突变的检测”、“mre11突变的检测”、“nbn突变的检测”、“dna2突变的检测”和“rbbp8突变的检测”的各方法,均无特别限制,分别独立地列举例如下述方法。
[0189]
本发明中的“突变的检测”表示检测基因组dna上各基因的突变,在该基因组dna上的突变反映于转录产物中碱基的变化和翻译产物中氨基酸的变化的情形中,前述基因的突变的检测中也包含检测这些转录产物和翻译产物中的该变化(即,间接检测)。
[0190]
本发明的方法的优选的方式是通过直接确定检测癌症细胞的各突变的基因区(检测第1组的突变的基因区:选自ttk基因区和rad50基因区的至少1种(本说明书中,根据情形
称为“第1组的基因区”);检测第2组的突变的基因区:选自rad50基因区、mre11基因区、nbn基因区、dna2基因区和rbbp8基因区的至少1种(本说明书中,根据情形称为“第2组的基因区”))的碱基序列检测突变的方法。本发明中的“ttk基因区”、“rad50基因区”、“mre11基因区”、“nbn基因区”、“dna2基因区”和“rbbp8基因区”分别意味着包含ttk的基因组dna上的一定区、包含rad50的基因组dna上的一定区、包含mre11的基因组dna上的一定区、包含nbn的基因组dna上的一定区、包含dna2的基因组dna上的一定区和包含rbbp8的基因组dna上的一定区。该区中也分别独立地包含各基因的表达控制区(例如,启动子区,增强子区)和各基因的3’末端非翻译区等。
[0191]
该方法中,首先,从生物学的样品配制dna样品。作为dna样品,列举基因组dna样品、和通过从rna逆转录配制的cdna样品。
[0192]
作为从生物学的样品提取基因组dna或rna的方法,没有特别限制,可以适当选择应用公知的方法,例如,作为提取基因组dna的方法,列举应用sds苯酚法(将在包含尿素的溶液或乙醇中保存的组织用蛋白质分解酶(蛋白酶k)、表面活性剂(sds)和苯酚使该组织的蛋白质变性,用乙醇从该组织沉淀dna提取的方法)、clean columns(注册商标、nextec公司制)、aquapure(注册商标、bio-rad公司制)、zr plant/seed dna kit(zymo research公司制)、aquagenomicsolution(注册商标、mo bi tec公司制)、prepgem(注册商标、zygem公司制)、buccalquick(注册商标、trimgen公司制)的dna提取方法。
[0193]
此外,作为从生物学的样品提取rna的方法和从提取的rna配制cdna的方法,列举与以转录水平检测解旋酶的表达量的方法中列举的方法同样的方法。
[0194]
在该方式中,随后,分离包含第1组的基因区或第2组的基因区的dna,确定分离的dna的碱基序列。对于该dna的分离,例如,可以应用以夹入第1组的基因区或第2组的基因区的全部或一部分的方式设计的一对寡核苷酸引物,以基因组dna或rna为模板通过pcr等进行。分离的dna的碱基序列的确定可以用maxam-gilbert法和sanger法等本领域技术人员公知的方法进行。
[0195]
通过将确定的dna或cdna的碱基序列与对照(例如,生物学的样品是来自癌症患者的样品的情形中,来自同一患者的非癌症组织的dna或cdna的碱基序列)比较,可以判别生物学的样品的癌症细胞中第1组的基因区或第2组的基因区的突变的有无。
[0196]
除了直接确定dna和cdna的碱基序列的方法以外,也可以通过可以检测突变的各种方法进行用于检测第1组的基因区或第2组的基因区的突变的方法。
[0197]
例如,本发明中突变的检测也可以通过如以下的方法进行。首先,从生物学的样品配制dna或cdna样品。随后,配制具有与包含第1组的基因区或第2组的基因区的突变部位的碱基序列互补的碱基序列、标记了报告荧光染料和猝灭荧光染料的寡核苷酸探针。并且,使前述寡核苷酸探针与前述dna或cdna样品杂交,进一步地,将杂交了前述寡核苷酸探针的前述dna或cdna样品作为模板,扩增包含第1组的基因区或第2组的基因区的前述突变部位的碱基序列。并且,通过伴随前述扩增的寡核苷酸探针的分解,检测前述报告荧光染料发生的荧光,随后,将检测的前述荧光与对照比较。作为这样的方法,列举双染料探针法,所谓的taqman(注册商标)探针法。
[0198]
进一步地,在其它方法中,从生物学的样品配制dna或cdna样品。随后,在包含插入dna双链间时发生荧光的嵌入剂的反应系统中,以前述dna或cdna样品为模板,扩增包含第1
组的基因区或第2组的基因区的突变部位的碱基序列。并且,使前述反应系统的温度变化,检测前述嵌入剂发生的荧光的强度的变动,将伴随检测的前述温度的变化的前述荧光的强度的变动与对照比较。作为这样的方法,列举hrm(high resolution melting,高分辨率熔解曲线分析)法。
[0199]
进一步地,在其它方法中,首先,从生物学的样品配制dna或cdna样品。随后,扩增包含第1组的基因区或第2组的基因区的全部或一部分的dna。进一步地,通过限制酶切割扩增的dna。随后,相应于其大小分离dna片段。随后,将检测的dna片段的大小与对照比较。作为这样的方法,例如,列举利用限制性片段长度多态性(restriction fragment length polymorphism/rflp)的方法和pcr-rflp法等。
[0200]
进一步地,在其它方法中,首先,从生物学的样品配制dna或cdna样品。随后,扩增包含第1组的基因区或第2组的基因区的全部或一部分的dna。进一步地,将扩增的dna解离为单链dna。随后,在非变性凝胶上分离解离的单链dna。将分离的单链dna在凝胶上的移动度与对照比较。作为这样的方法,例如,列举pcr-sscp(single-strand conformation polymorphism,单链构象多态性)法。
[0201]
进一步地,在其它方法中,首先,从生物学的样品配制dna或cdna样品。随后,扩增包含第1组的基因区或第2组的基因区的全部或一部分的dna。进一步地,将扩增的dna在dna变性剂的浓度逐渐增高的凝胶上分离。随后,将分离的dna在凝胶上的移动度与对照比较。作为这样的方法,例如,列举变性剂浓度梯度凝胶电泳(denaturant gradient gel electrophoresis:dgge)法。
[0202]
进一步地,作为其它方法,有应用包含从生物学的样品配制的第1组的基因区或第2组的基因区的突变部位的dna、和固定了与该dna杂交的寡核苷酸探针的基板的方法。作为这样的方法,例如,列举dna阵列法等。
[0203]
进一步地,在其它方法中,首先,从生物学的样品配制dna或cdna样品。此外,配制“具有与第1组的基因区或第2组的基因区的全部或一部分的碱基的1碱基3’侧的碱基和其3’侧的碱基序列互补的碱基序列的寡核苷酸引物”。随后,以该dna为模板,应用该引物,进行荧光标记ddntp引物延伸反应。随后,将引物延伸反应产物加入dna测序仪,基于延伸反应物的长度和荧光进行碱基序列确定。随后,根据dna测序仪的结果确定基因型。随后,将确定的基因型与对照比较。作为这样的方法,例如,列举sanger法。
[0204]
进一步地,在其它方法中,首先,从生物学的样品配制dna或cdna样品。随后,配制由5
’‑“
与第1组的基因区或第2组的基因区的全部或一部分的碱基和其5’侧的碱基序列互补的碱基序列
”‑“
不与第1组的基因区或第2组的基因区的全部或一部分的1碱基3’侧的碱基和其3’侧的碱基序列杂交的碱基序列
”‑3’
(侧翼序列(flap))组成的寡核苷酸探针。此外,配制“具有与第1组的基因区或第2组的基因区的全部或一部分的碱基和其3’侧的碱基序列互补的碱基序列的寡核苷酸探针”。随后,使上述2种寡核苷酸探针与配制的dna或cdna样品杂交。随后,用单链dna切割酶切割杂交的dna,使侧翼序列游离。作为单链dna切割酶,没有特别限制,例如,列举切割酶(cleavase)。本方法中,随后,使具有与侧翼序列互补的序列的寡核苷酸探针、即标记了报告荧光和猝灭荧光的寡核苷酸探针与侧翼序列杂交。随后,测定产生的荧光的强度。随后,将测定的荧光的强度与对照比较。作为这样的方法,例如,列举invader法。
[0205]
进一步地,在其它方法中,首先,从生物学的样品配制dna或cdna样品。随后,扩增包含第1组的基因区或第2组的基因区的全部或一部分的dna。并且,使扩增的dna解离为单链,仅分离解离的单链dna中的单个链。随后,从第1组的基因区或第2组的基因区的全部或一部分的碱基附近每次一个碱基进行延伸反应,使此时生成的焦磷酸酶促发光,测定发光的强度。并且,将测定的荧光的强度与对照比较。作为这样的方法,例如,列举pyrosequencing法。
[0206]
进一步地,在其它方法中,首先,从生物学的样品配制dna或cdna样品。随后,扩增包含第1组的基因区或第2组的基因区的全部或一部分的dna。随后,配制“具有与第1组的基因区或第2组的基因区的全部或一部分的碱基的1碱基3’侧的碱基和其3’侧的碱基序列互补的碱基序列的寡核苷酸引物”。随后,在荧光偏振染料标记的核苷酸存在下,以扩增的dna为模板,应用配制的引物进行单碱基延伸反应。并且,测定荧光的偏振度。随后,将测定的荧光的偏振度与对照比较。作为这样的方法,例如,列举acycloprime法。
[0207]
进一步地,在其它方法中,首先,从生物学的样品配制dna或cdna样品。随后,扩增包含第1组的基因区或第2组的基因区的全部或一部分的dna。随后,配制“具有与第1组的基因区或第2组的基因区的全部或一部分的碱基的1碱基3’侧的碱基和其3’侧的碱基序列互补的碱基序列的寡核苷酸引物”。随后,在荧光标记的核苷酸存在下,以扩增的dna为模板,应用配制的引物进行单碱基延伸反应。随后,判定单碱基延伸反应中使用的碱基种类。随后,将判定的碱基种类与对照比较。作为这样的方法,例如,列举snupe法。
[0208]
另外,只要突变伴随各蛋白质(检测第1组的突变的情形:选自ttk蛋白质和rad50蛋白质的至少1种(本说明书中,根据情形称为“第1组的蛋白质”);检测第2组的突变的情形:选自rad50蛋白质、mre11蛋白质、nbs1蛋白质、dna2蛋白质和ctip蛋白质的至少1种(本说明书中,根据情形称为“第2组的蛋白质”))中氨基酸的变化(例如,置换、缺失、插入、添加),则从生物学的样品配制的样品也可以是蛋白质。这样的情形中,检测突变时,可以利用应用与因上述突变产生氨基酸的变化的部位特异性地结合的分子(例如,抗体)的方法等。
[0209]
例如,在应用抗体的蛋白质的检测法中,首先,从生物学的样品配制蛋白质样品。随后,应用对第1组的蛋白质或第2组的蛋白质有特异性的抗体进行抗原抗体反应,检测第1组的蛋白质或第2组的蛋白质。作为应用这样的抗体的蛋白质的检测法,在以翻译水平检测解旋酶的表达量的方法中,可以将与作为应用抗体的蛋白质的检测法列举的方法同样的方法适合于第1组的蛋白质或第2组的蛋白质而调整和适当采用。在该方法中,若通过免疫组织化学,也有也可以同时得到组织中癌症细胞的形态和分布状态等附加信息的优点。
[0210]
使用的抗体的种类和来源等没有特别限制,优选单克隆抗体。只要能够以足够的特异性检测第1组的蛋白质或第2组的蛋白质,也可以应用寡克隆抗体(数种~数十种抗体的混合物)和多克隆抗体。此外,也可以应用fab、fab’、f(ab’)2、fv、scfv、sc(fv)2、dsfv、和双抗体等抗体的功能片段及其多聚体(例如,二聚体、三聚体、四聚体、多聚体)。作为抗ttk蛋白质抗体、抗rad50蛋白质抗体、抗mre11蛋白质抗体、抗nbs1蛋白质抗体、抗dna2蛋白质抗体和抗ctip蛋白质抗体,可分别为市售品。
[0211]
第1组的蛋白质或第2组的蛋白质的检测也可以使用质谱分析法(ms)进行。特别是,通过与液相色谱连接的质谱分析仪(lc/ms)的分析由于敏感而有利。作为通过质谱分析法的检测法,在以翻译水平检测解旋酶的表达量的方法中,可以将与作为通过质谱分析法
的检测法列举的方法同样的方法适合于第1组的蛋白质或第2组的蛋白质而调整并适当采用。
[0212]
第1组的蛋白质或第2组的蛋白质的检测也可以通过测定各蛋白质的活性进行。这些活性可以采用适当公知的方法或基于其的方法,例如,ttk蛋白质的磷酸化活性的测定可以通过用荧光物质等检测磷酸基而测定。此外,rad50蛋白质的atpase活性的测定可以通过利用发光adp测定而测定。例如,可以通过利用adp-glo(promega公司制)测定atpase活性。进一步地,mre11蛋白质的核酸酶活性的测定可以通过hela s3测定法、活性凝胶法、质粒测定法等测定。
[0213]
〔敏感性的预测
·
癌症患者的分选〕
[0214]
在如此进行从生物学的样品检测第1组的突变和/或检测第2组的突变的情形中,如果是该生物学的样品被判定为癌症细胞的情形,可以预测该细胞对解旋酶抑制剂具有敏感性,此外,在该生物学的样品是来自癌症患者的样品中包含的癌症细胞的情形中,可以将该癌症细胞中检测到前述突变的癌症患者预测为对通过解旋酶抑制剂治疗具有敏感性,进一步地,可以将该癌症患者分选为通过解旋酶抑制剂的癌症治疗的对象。
[0215]
此处,“对解旋酶抑制剂敏感性”和“对通过解旋酶抑制剂治疗的敏感性”是表示解旋酶抑制剂是否可对癌症细胞发挥治疗效果的指标。前述敏感性中包含通过前述解旋酶抑制剂促进前述癌症细胞的死亡和抑制增殖。该敏感性的预测中不仅可包含敏感性的有无的判定,也可包含敏感性可期待/不可期待等评价、具有敏感性的情形中其程度的评价(例如,高敏感性可期待、中度敏感性可期待等评价)。因此,也可以相应于第1组的突变和/或第2组的突变的种类和程度,例如,在中度敏感性可期待的水平,分选成为癌症治疗的对象的患者。
[0216]
另一方面,在从来自癌症患者的样品见不到第1组的突变和/或第2组的突变的情形中,可以将该患者从通过解旋酶抑制剂的癌症治疗的对象除去。通过其可以提高治疗的成功率。
[0217]
(msh3)
[0218]
此外,本发明中,在作为解旋酶抑制剂的靶标的癌症细胞是除具有第1组的突变和/或第2组的突变、更优选地第1组的突变(ttk突变和/或rad50突变)之外进一步具有msh3突变的癌症细胞的情形中,发现解旋酶抑制剂可同等或更好地抑制该癌症细胞的增殖。因此,在癌症细胞敏感性预测方法、癌症患者敏感性预测方法和癌症患者分选方法中,分别独立地,msh3突变的检测的有无也可以加入指标,本发明还提供:
[0219]
方法(癌症细胞敏感性预测方法),其为预测癌症细胞对解旋酶抑制剂敏感性的方法,其包括:
[0220]
(a)检测癌症细胞中选自由ttk突变和rad50突变组成的第1组的至少1种突变的有无的步骤,和
[0221]
(c)检测癌症细胞中msh3突变的有无的步骤,和
[0222]
(d)将除ttk突变和/或rad50突变还检测到msh3突变的癌症细胞预测为对解旋酶抑制剂具有敏感性的步骤;
[0223]
方法(癌症患者敏感性预测方法),其为预测癌症患者的对通过解旋酶抑制剂治疗的敏感性的方法,其包括:
[0224]
(a)检测来自癌症患者的样品中包含的癌症细胞中选自由ttk突变和rad50突变组成的第1组的至少1种突变的有无的步骤,和
[0225]
(c)检测来自癌症患者的样品中包含的癌症细胞中msh3突变的有无的步骤,和
[0226]
(d)将前述癌症细胞中除ttk突变和/或rad50突变外还检测到msh3突变的癌症患者预测为对通过解旋酶抑制剂治疗具有敏感性的步骤;
[0227]
方法(癌症患者分选方法),其为分选作为通过解旋酶抑制剂的癌症治疗的对象的癌症患者的方法,其包括:
[0228]
(a)检测来自癌症患者的样品中包含的癌症细胞中选自由ttk突变和rad50突变组成的第1组的至少1种突变的有无的步骤,和
[0229]
(c)检测来自癌症患者的样品中包含的癌症细胞中msh3突变的有无的步骤,和
[0230]
(d)将前述癌症细胞中除ttk突变和/或rad50突变还检测到msh3突变的癌症患者分选为通过解旋酶抑制剂的癌症治疗的对象的步骤。
[0231]
本发明中的“msh3”是编码错配修复蛋白质(本说明书中,根据情形称为“msh3蛋白质”)的基因。分别地,来自人的天然型msh3基因组dna的典型的碱基序列显示于序列编号:7,来自人的天然型msh3蛋白质的典型的氨基酸序列显示于序列编号:8。另外,即使是未产生伴随氨基酸序列的置换、缺失、插入、和添加等的突变的msh3,也可因多态性等而在序列中产生个体差异。
[0232]
作为本发明中的“msh3突变”,列举msh3蛋白质的氨基酸序列中氨基酸的置换、缺失、插入、和添加。作为这样的msh3突变,只要msh3蛋白质本来具有的活性变化,则没有特别限制,优选引起msh3蛋白质活性的降低(包含msh3蛋白质活性的完全丧失(失活))的突变,即,功能缺失型突变。msh3蛋白质活性的降低例如可通过msh3中的错义突变、跨全区的无义突变、或msh3的全体或部分的缺失等基因结构的变化、基因表达量的变化产生,但不限于这些。
[0233]
msh3本来具有的基因结构和基因表达量是否变化可以通过例如下列方法:通过基因组dna的测序取得msh3的碱基序列;通过与msh3的核苷酸序列特异性地结合的寡核苷酸探针的荧光检测;通过应用与msh3的核苷酸特异性地结合的寡核苷酸引物的pcr法的检测等,通过在与对照(例如,健康者或同一患者的非癌症组织)的比较中是否变化(优选地,功能缺失型突变是否产生,mrna的表达量的情形中是否减少)来确认和判定。
[0234]
msh3蛋白质本来具有的活性(功能活性)是否变化可以通过例如下列方法:通过应用与msh3蛋白质特异性地结合的抗体的免疫染色法或蛋白印迹法的检测;通过蛋白印迹法等判别通过免疫沉淀法等纯化的细胞内msh3蛋白质与mutsβ复合物的构成蛋白质msh2是否结合的方法;和通过atpase活性测定法判别通过免疫沉淀法等纯化的细胞内msh3蛋白质是否具有atpase活性的方法等,通过在与对照(例如,健康者或同一患者的非癌症组织)的比较中是否变化(优选地,是否降低,即,通过免疫染色法和蛋白印迹法检测的msh3蛋白质的表达量的情形中与对照相比是否降低,通过蛋白印迹法检测的蛋白质的分子量的情形中与对照相比是否变化,与通过蛋白印迹法检测的msh3蛋白质结合的mutsβ复合物的构成蛋白质msh2的量与对照相比是否降低,atpase活性的情形中与对照相比是否降低)来确认和判定。
[0235]
作为引起这样的msh3蛋白质活性的变化的具体的msh3突变的实例,例如,列举
p.a22rfs*3(cosmic legacy mutation id:cosm7212418)、p.p67qfs*13(cosmic legacy mutation id:cosm5989630)、p.p67qfs*13(cosmic legacy mutation id:cosm5356342)、p.v292mfs*15(cosmic legacy mutation id:cosm9494178)、p.k383gfs*20(cosmic legacy mutation id:cosm1568178)、p.k383rfs*32(cosmic legacy mutation id:cosm1438888)、p.l503wfs*5(cosmic legacy mutation id:cosm5835081)、p.p783ffs*19(cosmic legacy mutation id:cosm4188468)、p.e797sfs*3(cosmic legacy mutation id:cosm8468896)、p.n861mfs*6(cosmic legacy mutation id:cosm1438891)、p.l1006vfs*10(cosmic legacy mutation id:cosm3139259)、p.n1020imfs*40(cosmic legacy mutation id:cosm1438892)、p.g1062nfs*12(cosmic legacy mutation id:cosm9358418)、p.n212sfs*2(cosmic legacy mutation id:cosm9178646)、p.e261gfs*43(cosmic legacy mutation id:cosm5868883)、p.n385qfs*19(cosmic legacy mutation id:cosm1735453)、p.q406pfs*42(cosmic legacy mutation id:cosm9494259)、p.p740afs*28(cosmic legacy mutation id:cosm5701238)、p.i785yfs*18(cosmic legacy mutation id:cosm7513821)、p.l821ffs*3(cosmic legacy mutation id:cosm4603915)、p.n861kfs*8(cosmic legacy mutation id:cosm8183447)、p.n1020kfs*17(cosmic legacy mutation id:cosm8565481)、p.e1092rfs*24(cosmic legacy mutation id:cosm8851685)等。
[0236]
作为msh3突变的检测法,可以将与上述〔突变的检测〕中作为“ttk突变的检测”等方法列举的方法同样的方法适合于msh3突变而调整并适当采用。
[0237]
(第3组的突变)
[0238]
进一步地,本发明中,在作为解旋酶抑制剂的靶标的癌症细胞是除具有第1组的突变和/或第2组的突变、更优选地第2组的突变之外进一步地具有选自由exo1突变、rpa1突变、rpa2突变和rpa3突变组成的第3组的至少1种突变(本说明书中,根据情形称为“第3组的突变”)的癌症细胞的情形中,发现解旋酶抑制剂可同等或更好抑制该癌症细胞的增殖。因此,在癌症细胞敏感性预测方法、癌症患者敏感性预测方法和癌症患者分选方法中,分别独立地,第3组的突变的检测的有无也可以加入指标,本发明也提供:
[0239]
方法(癌症细胞敏感性预测方法),其为预测癌症细胞对解旋酶抑制剂敏感性的方法,其包括:
[0240]
(a)检测癌症细胞中选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的有无的步骤,和
[0241]
(c)检测癌症细胞中选自由exo1突变、rpa1突变、rpa2突变和rpa3突变组成的第3组的有无的步骤,和
[0242]
(d)将除第2组的突变外也检测到第3组的突变的癌症细胞预测为对解旋酶抑制剂具有敏感性的步骤;
[0243]
方法(癌症患者敏感性预测方法),其为预测癌症患者对通过解旋酶抑制剂治疗的敏感性的方法,其包括:
[0244]
(a)检测来自癌症患者的样品中包含的癌症细胞中选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的有无的步骤,和
[0245]
(c)检测来自癌症患者的样品中包含的癌症细胞中选自由exo1突变、rpa1突变、
mutation id:cosm6657048)、p.n159tfs*9(cosmic legacy mutation id:cosm5661778)、p.g190wfs*5(cosmic legacy mutation id:cosm392303)、p.f215lfs*9(cosmic legacy mutation id:cosm166045)、p.c508afs*13(cosmic legacy mutation id:cosm1340675)、p.c508lfs*7(cosmic legacy mutation id:cosm5207739)、p.r723ffs*20(cosmic legacy mutation id:cosm9226806)、p.d731tfs*4(cosmic legacy mutation id:cosm6657053)等。
[0257]
作为exo1突变的检测法,可以将与作为上述〔突变的检测〕中“ttk突变的检测”等方法列举的方法同样的方法适合于exo1突变而调整并适当采用。
[0258]
〔rpa1、rpa2、rpa3〕
[0259]
本发明中的“rpa1”、“rpa2”和“rpa3”是分别编码据报告通过彼此相互作用形成复制蛋白质rpa(replication protein)、与mrn复合物相互作用(例如,greg oakley等,biochemistry.,2009august 11,48(31),p.7473-7481;ting liu等,acta biochim biophys sin,2016,48(7),p.665-670等)的蛋白质(本说明书中,根据情形,分别称为“rpa1蛋白质”、“rpa2蛋白质”和“rpa1蛋白质”,根据情形称将它们总称为“rpa1~3蛋白质”)的基因。即使它们中任1种蛋白质的功能缺失,前述复合物自体的功能降低,上述dna修复机制不正常发挥功能,因此,在第3组的突变中,编码形成该复合物的蛋白质的rpa1、rpa2和rpa3(以下,根据情形总称为“rpa1~3”)中,特别优选检测它们中至少1种突变。
[0260]
分别地,来自人的天然型rpa1~3基因组dna的典型的碱基序列显示于序列编号:19、21、23,分别地,来自人的天然型rpa1~3蛋白质的典型的氨基酸序列显示于序列编号:20、22、24。另外,即使是未产生伴随氨基酸序列的置换、缺失、插入、和添加等的突变的rpa1、rpa2或rpa3,分别地,也可因多态性等而在序列中产生个体差异。
[0261]
作为本发明中的“rpa1突变”、“rpa2突变”和“rpa3突变”(以下,称为“rpa1~3突变”),分别地,列举rpa1~3蛋白质的氨基酸序列中氨基酸的置换、缺失、插入、和添加。作为这样的rpa1~3突变,分别地,只要rpa1~3蛋白质本来具有的活性变化,则没有特别限制,优选引起rpa1~3蛋白质活性的降低(包含rpa1~3蛋白质活性的完全丧失(失活))的突变,即,功能缺失型突变。rpa1~3蛋白质活性的降低分别地通过例如rpa1~3中的错义突变、跨全区的无义突变、或rpa1~3的全体或部分的缺失等基因结构的变化、基因表达量的变化产生,但不限于这些。
[0262]
rpa1~3本来具有的基因结构和基因表达量是否变化可通过例如下列方法:通过基因组dna的测序取得rpa1~3的碱基序列;通过与rpa1~3的核苷酸序列特异性地结合的寡核苷酸探针的荧光检测;通过应用与rpa1~3的核苷酸特异性地结合的寡核苷酸引物的pcr法的检测等,通过在与对照(例如,健康者或同一患者的非癌症组织)的比较中是否变化(优选地,是否产生功能缺失型突变,mrna的表达量的情形中是否减少)确认和判定。
[0263]
rpa1~3蛋白质本来具有的活性(功能活性)是否变化可通过例如下列方法:通过应用与rpa1~3蛋白质特异性地结合的抗体的免疫染色法或蛋白印迹法的检测;和过蛋白印迹法等判别通过免疫沉淀法等纯化的细胞内rpa1~3蛋白质与作为复合物的构成蛋白质的其以外的rpa1~3蛋白质是否结合的方法等,通过在与对照(例如,健康者或同一患者的非癌症组织)的比较中是否变化(优选地,是否降低,即,通过免疫染色法和蛋白印迹法检测的rpa1~3蛋白质的表达量的情形中与对照相比是否降低,通过蛋白印迹法检测的蛋白质
的分子量的情形中与对照相比是否变化,作为通过蛋白印迹法检测的复合物的构成蛋白质的其以外的rpa1~3蛋白质结合的量与对照相比是否降低)确认和判定。
[0264]
作为引起这样的rpa1~3蛋白质活性的变化的具体的rpa1突变的实例。例如,列举p.n274mfs*5(cosmic legacy mutation id:cosm4722502)、p.n338kfs*28(cosmic legacy mutation id:cosm1745322)、p.e363gfs*4(cosmic legacy mutation id:cosm6048715)、p.e418kfs*5(cosmic legacy mutation id:cosm111541)、p.e601vfs*53(cosmic legacy mutation id:cosm8515054)、p.s609rfs*46(cosmic legacy mutation id:cosm112025)等。此外,作为rpa2突变的实例,例如,列举p.g34afs*69(cosmic legacy mutation id:cosm8537429)、p.v127gfs*26(cosmic legacy mutation id:cosm907939)、p.e158gfs*5(cosmic legacy mutation id:cosm8220461)等。进一步地,作为rpa3突变的实例,例如,列举p.n50mfs*6(cosmic legacy mutation id:cosm3029082)、p.s64nfs*26(cosmic legacy mutation id:cosm6848181)等。
[0265]
作为rpa1~3突变的检测法,可以将与作为上述〔突变的检测〕中“ttk突变的检测”等方法列举的方法同样的方法分别适合于rpa1~3突变而调整并适当采用。
[0266]
(解旋酶)
[0267]
进一步地,在作为本发明涉及的解旋酶抑制剂的靶标的解旋酶不正常表达的情形和/或不正常发挥功能的情形中,担心无法有效实施通过解旋酶抑制剂的癌症治疗。因此,在癌症细胞敏感性预测方法、癌症患者敏感性预测方法和癌症患者分选方法中,进一步地,编码解旋酶的基因的突变和解旋酶的表达降低的检测也可以加入指标。
[0268]
作为编码解旋酶的基因的突变的检测法,可以将与作为上述〔突变的检测〕中“ttk突变的检测”等方法列举的方法同样的方法适合于编码解旋酶的基因(例如,wrn基因)的突变而调整并适当采用。此外,解旋酶的表达降低的检测法如上述。
[0269]
《治疗癌症的方法》
[0270]
本发明还提供:
[0271]
治疗癌症的方法,其包括:
[0272]
(a)检测来自癌症患者的样品中包含的癌症细胞中选自由ttk突变和rad50突变组成的第1组的至少1种突变的有无的步骤,和
[0273]
(b)对前述癌症细胞中检测到前述突变的癌症患者施用解旋酶抑制剂的步骤;以及
[0274]
治疗癌症的方法,其包括:
[0275]
(a)检测来自癌症患者的样品中包含的癌症细胞中选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的有无的步骤,和
[0276]
(b)对前述癌症细胞中检测到前述突变的癌症患者施用解旋酶抑制剂的步骤(本说明书中,根据情形称将它们总称为“癌症治疗方法”)。
[0277]
本发明的癌症治疗方法中,第1组的突变的检测、第2组的突变的检测和解旋酶抑制剂分别如上述。
[0278]
对癌症患者施用解旋酶抑制剂可以是经口施用,也可以是非经口施用(例如,静脉施用、动脉施用、局部施用)。
[0279]
此外,对癌症患者的解旋酶抑制剂的施用量只要是对抑制解旋酶治疗癌症有效的
量即可,相应于抑制解旋酶的化合物的性质、癌症患者的年龄、体重、症状、健康状态、癌症的进行状况等适当选择,因而不能一概而论,例如,在对人的施用的情形中,以抑制解旋酶的化合物的量,每1天0.001~100,000mg,优选地,0.01~5,000mg。对癌症患者的解旋酶抑制剂的施用频率也同样不能一概而论,例如,优选每1天1次、或分为2~4次施用,以适当间隔反复。前述施用量和施用频率可根据医生的判断按需要适当增减。
[0280]
由此,在癌症患者中具有第1组的突变和/或第2组的突变的癌症细胞中,进一步地,通过解旋酶被抑制、癌症细胞的死亡的促进和/或增殖的抑制,可以治疗癌症。
[0281]
作为成为治疗对象的癌症,例如,列举大肠癌、胃癌、宫颈癌、子宫癌、前列腺癌、乳癌、肺癌、膀胱癌、食道癌、头颈癌、肾癌、卵巢癌、淋巴瘤、腺样囊性癌、胰腺癌,但不限于这些癌症。
[0282]
《用于检测突变的有无的试剂》
[0283]
此外,本发明提供:在上述方法中,用于检测第1组的突变和/或第2组的突变的有无的试剂,其为:
[0284]
以下列中至少任一分子作为有效成分的试剂:
[0285]
(i)与选自由ttk和rad50组成的第1组的1种基因特异性地结合的寡核苷酸引物,
[0286]
(ii)与选自由ttk和rad50组成的第1组的1种基因特异性地结合的寡核苷酸探针,和
[0287]
(iii)与选自由ttk蛋白质和rad50蛋白质组成的第1组的1种蛋白质特异性地结合的抗体;以及
[0288]
以下列中至少任一分子作为有效成分的试剂:
[0289]
(i)与选自由rad50、mre11、nbn、dna2和rbbp8组成的第2组的1种基因特异性地结合的寡核苷酸引物,
[0290]
(ii)与选自由rad50、mre11、nbn、dna2和rbbp8组成的第2组的1种基因特异性地结合的寡核苷酸探针,和
[0291]
(iii)与选自由rad50蛋白质、mre11蛋白质、nbs1蛋白质、dna2蛋白质和ctip蛋白质组成的第2组的1种蛋白质特异性地结合的抗体。
[0292]
上述寡核苷酸引物可以基于各基因的基因组dna或cdna的碱基序列信息(例如,序列编号:3、5、9、11、13、15)以这样的方式设计:成为适于上述方法和扩增的区的引物,此外,尽可能不产生目的基因以外的基因的扩增产物。这样的寡核苷酸引物设计可以由本领域技术人员通过常规方法进行。寡核苷酸引物的长度是通常15~50个碱基长,优选地15~30个碱基长,但根据方法和目的可以比其长、也可以比其短。
[0293]
上述寡核苷酸探针可以基于各基因的基因组dna或cdna的碱基序列信息(例如,序列编号:3、5、9、11、13、15)以这样的方式设计:成为适于上述方法和杂交的区的探针,此外,尽可能不产生与目的基因以外的基因杂交。这样的寡核苷酸探针设计可以由本领域技术人员通过常规方法进行。寡核苷酸探针的长度是通常15~200个碱基长,优选地15~100个碱基长,进一步地优选地15~50个碱基长,但根据方法和目的可以比其长、也可以比其短。
[0294]
寡核苷酸探针优选适当标记和应用。作为标记的方法,可以示例应用t4多核苷酸激酶、通过将寡核苷酸的5’端以32p磷酸化来标记的方法,和应用klenow酶等dna聚合酶、以随机六聚体寡核苷酸为引物掺入通过32p等同位素、荧光染料、或生物素等标记的底物碱基
的方法(随机引发法等)。
[0295]
上述寡核苷酸引物和寡核苷酸探针可以通过例如市售的寡核苷酸合成仪制备。寡核苷酸探针也可以作为通过限制酶处理等取得的双链dna片段制备。此外,本发明的寡核苷酸引物和寡核苷酸探针可以不仅由天然的核苷酸(脱氧核糖核苷酸(dna)和核糖核苷酸(rna))构成,也可以由非天然型的核苷酸构成其一部分或全部。作为非天然型的核苷酸,列举pna(聚酰胺核酸)、lna(注册商标,锁核酸)、ena(注册商标、2
’‑
o,4
’‑
c-乙烯-桥接核酸)、和它们的复合物。
[0296]
与上述第1组的蛋白质或第2组的蛋白质特异性地结合的抗体如果是多克隆抗体,可以用抗原(各蛋白质(例如,ttk蛋白质等)、其部分肽、或表达它们的细胞等)免疫免疫动物,通过常规方法(例如,盐析、离心分离、透析、柱色谱等)从其抗血清纯化和取得。此外,单克隆抗体可以通过杂交瘤法或重组dna法制备。
[0297]
作为杂交瘤法,代表性地,列举kohler和milstein的方法(kohler&milstein,nature 1975;256:495)。该方法中在细胞融合步骤中使用的抗体产生细胞是用抗原(各蛋白质(例如,ttk蛋白质等)、其部分肽、或表达它们的细胞等)免疫的动物(例如,小鼠、大鼠、仓鼠、兔、猴、山羊)的脾细胞、淋巴结细胞、末梢血白细胞等。对从未免疫的动物预先分离的上述细胞或淋巴细胞等,通过使抗原在培养基中作用得到的抗体产生细胞也可以使用。作为骨髓瘤细胞,可以使用公知的各种细胞株。对于抗体产生细胞和骨髓瘤细胞,如果它们可以融合,可以来源于不同的动物种类,但优选地来源于同一动物种类。杂交瘤例如通过从用抗原免疫的小鼠得到的脾细胞和小鼠骨髓瘤细胞间的细胞融合产生,通过其后的筛选,可以得到产生对第1组的蛋白质或第2组的蛋白质有特异性的单克隆抗体的杂交瘤。针对第1组的蛋白质或第2组的蛋白质的单克隆抗体可以通过培养杂交瘤取得,或从施用杂交瘤的哺乳动物的腹水取得。
[0298]
重组dna法是将编码上述抗体的dna从杂交瘤或b细胞等克隆,整合到适当载体,将其导入宿主细胞(例如,哺乳类细胞株、大肠杆菌、酵母细胞、昆虫细胞、植物细胞等),将本发明的抗体作为重组抗体产生的方法(例如,p.j.delves,antibody production:essential techniques,1997 wiley、p.shepherd and c.dean monoclonal antibodies,2000 oxford university press,vandamme am等,eur.j.biochem.1990;192:767-775)。在编码抗体的dna的表达中,可以将编码重链或轻链的dna分别整合到表达载体中转化宿主细胞,也可以将编码重链和轻链的dna整合到单个表达载体中转化宿主细胞(wo94/11523号公报等)。可以培养上述宿主细胞、从宿主细胞内或培养液分离
·
纯化、以实质上纯的均一形态取得抗体。抗体的分离
·
纯化可以使用通常的多肽纯化中使用的方法。如果应用转基因动物制备技术制备整合了抗体基因的转基因动物(牛、山羊、绵羊或猪等),也可以从该转基因动物的乳汁大量取得来自抗体基因的单克隆抗体。
[0299]
基于如此得到的抗体或其基因,可以配制fab、fab’、f(ab’)2、fv、scfv、sc(fv)2、dsfv、和双抗体等抗体的功能片段及其多聚体(例如,二聚体、三聚体、四聚体、多聚体)。
[0300]
在直接检测与第1组的蛋白质或第2组的蛋白质结合的抗体量的情形中,得到的抗ttk蛋白质抗体、抗rad50蛋白质抗体、抗mre11蛋白质抗体、抗nbs1蛋白质抗体、抗dna2蛋白质抗体、抗ctip蛋白质抗体等直接通过酶、放射性同位素、荧光染料或抗生物素蛋白-生物素系统等标记和应用。另一方面,在实施利用二次抗体等检测与第1组的蛋白质或第2组的
蛋白质结合的抗体量的间接检测方法的情形中,得到的抗蛋白质抗体(例如,抗ttk蛋白质抗体等)(一次抗体)不需要标记,在检测时,可以应用识别该抗体的标记的分子(例如,二次抗体或蛋白a)。
[0301]
本发明的试剂中,除作为有效成分的上述分子外,按需要可以包含灭菌水或生理盐水、缓冲剂、防腐剂等作为试剂容许的其它成分。进一步地,可进一步包含用于msh3突变或第3组的突变的检测的各寡核苷酸引物、寡核苷酸探针和抗体中至少任一分子,或进一步组合包含该分子的试剂。
[0302]
《癌症的治疗中应用的化合物的筛选方法
·
癌症治疗剂》
[0303]
本发明还提供:
[0304]
在包含检测到选自由ttk突变和rad50突变组成的第1组的至少1种突变的癌症细胞的癌症的治疗中应用的化合物的筛选方法,其包括以是否抑制解旋酶为指标分选化合物的步骤;以及
[0305]
在包含检测到选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的癌症细胞的癌症的治疗中应用的化合物的筛选方法,其包括以是否抑制解旋酶为指标分选化合物的步骤(以下,根据情形称将它们总称为“化合物的筛选方法”)。
[0306]
此外,分别应用用上述化合物的筛选方法筛选的抑制解旋酶的化合物,还可提供:
[0307]
癌症治疗剂,其为包含检测到选自由ttk突变和rad50突变组成的第1组的至少1种突变的癌症细胞的癌症的治疗剂,其包含抑制解旋酶的化合物作为有效成分;以及
[0308]
癌症治疗剂,其为包含检测到选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变的癌症细胞的癌症的治疗剂,其包含抑制解旋酶的化合物作为有效成分(以下,根据情形称将它们总称为“癌症治疗剂”)。
[0309]
作为本发明的化合物的筛选方法中适用的被验化合物,没有特别限制,例如,列举选自作为上述抑制解旋酶的化合物的实例列举的化合物、多肽和多核苷酸的至少1种(但是否抑制解旋酶可以不已知)。此外,作为前述被检化合物,更具体地,例如,列举合成低分子化合物文库、基因文库的表达产物、肽文库、sirna、抗体、细菌释放物质、细胞(微生物、植物细胞、动物细胞)的提取液和培养上清、纯化或部分纯化多肽、海洋生物、植物或动物来源的提取物、随机噬菌体肽展示文库。此外,前述被验化合物也可以是公知的解旋酶抑制剂的衍生物。
[0310]
在以是否抑制解旋酶为指标分选化合物的方法(筛选)中,在上述解旋酶的活性或表达的抑制的确认系统中,可以使被验化合物作用,检测其后的解旋酶活性或表达。检测的结果与对照(例如,不添加被验化合物的情形)中解旋酶活性或表达比较,如果该活性或表达降低,可以评价为解旋酶被抑制。
[0311]
在前述筛选中,作为评价通过化合物的抑制的有无的“解旋酶”,没有特别限制,例如,列举recq解旋酶(recql1、blm、wrn、recql4/rts、recql5),优选recq解旋酶,更优选wrn(werner syndrome protein)。
[0312]
通过本发明的化合物的筛选方法鉴定的化合物通过与药学上容许的上述解旋酶抑制剂中列举的添加成分等适当混合,用公知的制剂学的方法制剂化,可以作为药品,作为癌症治疗剂。
实施例
[0313]
以下,基于试验例更具体地说明本发明,但本发明不限于以下实施例。
[0314]
(试验例1)
[0315]
1.实验材料和方法
[0316]
(1)细胞株
[0317]
首先,关于约70株癌症细胞株,进行通过sirna的wrn的表达抑制,分别选择确认增殖的抑制的细胞株和增殖未抑制的细胞株。在以下试验中显示,作为选择的细胞株的一部分,将hct 116、km12、sw48、cw-2、ht-29、nci-h716(大肠癌)、rl95-2、c-33a、colo-684(子宫癌)、snu-1、gsu(胃癌)用作试验对象的癌症细胞株的实例。
[0318]
hct 116是ttk、rad50和msh3全部具有突变的癌症细胞株。km12、rl95-2和c-33a是至少在ttk和rad50中具有突变的癌症细胞株。snu-1是至少在ttk和msh3中具有突变的癌症细胞株。sw48是至少在ttk中具有突变的癌症细胞株。cw-2是至少在rad50中具有突变的癌症细胞株。colo-684、gsu、ht-29和nci-h716是在ttk和rad50的任一中都没有突变、并且未报告msh3突变的癌症细胞株。这些癌症细胞株和其来源组织(tissue)、以及各癌症细胞株中ttk、rad50和msh3突变的信息(产生功能缺失型突变的基因突变的信息)在下述表1中显示。
[0319]
[表1]
[0320]
细胞株组织ttkrad50msh3hct 116结直肠截短突变*1截短突变*1截短突变*2km12结直肠截短突变*1截短突变*1n.i.rl95-2子宫截短突变*1截短突变*1n.i.snu-1胃截短突变*1野生型截短突变*3sw48结直肠截短突变*1野生型n.i.c-33a子宫截短突变*1截短突变*1n.i.cw-2结直肠野生型截短突变*1n.i.colo-684子宫野生型野生型n.i.gsu胃野生型野生型n.i.ht-29结直肠野生型野生型n.i.nci-h716结直肠野生型野生型n.i.
[0321]
表1中,“*1”显示为broad institute制备的癌症细胞株数据库:“癌细胞系百科全书(cancer cell line encyclopedia,ccle)”中、“*2”显示为mol cell.2018 jul 19;71(2)、p.319-331.e3中、“*3”显示为eur j cancer.2000 may;36(7)、p.925-931中分别公开的突变,“n.i.”显示与突变有关的信息未公知。
[0322]
(2)短干扰(si)rna
[0323]
在wrn的表达抑制中,应用on-targetplus individual sirna(dharmacon公司制)。在转染中,应用lipofectamine rnaimax(invitrogen公司制)。此外,分别地,被验物质应用wrn sirna(wrn sirna1、dharmacon公司商品代码:j-010378-06、序列编号:25),阴性对照应用非靶标化sirna(非靶标sirna1、dharmacon公司商品代码:d-001810-01、序列编号:26)。应用将5
×
sirna缓冲液(dharmacon公司制:b-002000-ub-100)用无核酸酶水
(ambion公司制:am9932)5倍稀释的1
×
sirna缓冲液溶解各sirna。
[0324]
(3)wrn的表达抑制试验
[0325]
在各癌症细胞株中,评价通过wrn表达抑制的细胞损害活性。应用下述表2记载的培养液以各细胞培养瓶(corning公司制:430641u)培养各细胞株,用pbs(nacalai tesque公司制:14249-24)洗涤细胞表面后,添加胰蛋白酶(nacalai tesque公司制:35554-64),在37℃温育5分钟后,用各培养液悬浮。用自动细胞计数器(chemometec公司制:nc-200)和via1-casette(chemometec公司制:941-0011)测定细胞数后,以成为下述表3显示的细胞浓度的方式用各培养液调整各细胞株液。在96孔板(greiner bio-one公司制)中将各细胞株液以100μl/每孔接种,以细胞数成为表3显示的接种数的方式分别接种。
[0326]
随后,将lipofectamine rnaimax(thermo fischer scienctific公司制:13778150)用opti-mem(thermo fischer scientific公司制:31985-062)50倍稀释后,与120nm被检物质(wrn sirna1)或非靶标化sirna(非靶标sirna1)等量混合。将混合液以20μl/每孔添加于接种上述细胞的板后,振荡板,分别转染终浓度10nm的sirna。
[0327]
用37℃培养箱培养7天后,50μl/每孔添加celltiter-glo2.0 cell viability assay(promega公司制:g9243),在室温温育5分钟后,应用envision(perkinelmer公司制)测定发光,测定作为细胞生存的标记物的细胞内atp量。以转染阴性对照培养7天后的各癌症细胞株中细胞内atp量为100%,算出通过wrn表达抑制的细胞生存率。各癌症细胞株的通过wrn表达抑制的细胞生存率(%存活)显示于图1。
[0328]
[表2]
[0329][0330]
[表3]
[0331]
细胞株细胞浓度(个/ml)接种数目(个/孔)hct 116150001500km12200002000rl95-2500005000snu-1200002000sw48500005000c-33a200002000cw-2500005000colo-684300003000
gsu300003000ht-29150001500ncl-h716500005000
[0332]
2.结果
[0333]
如图1所示,在wrn的表达抑制试验中,在具有ttk突变和rad50突变中至少任一突变的7个癌症细胞株的全部中,见到细胞生存率为70%以下(图1中特别是40%以下)、和显著的细胞生存率的降低。此外,关于进行试验的其它癌症细胞株也同样地,在具有ttk突变和rad50突变中至少任一突变的癌症细胞株中,见到显著的细胞生存率的降低。根据该结果显示,产生选自由ttk突变和rad50突变组成的组(第1组)的至少1种突变的癌症细胞株的生存强烈依赖于解旋酶的功能,在这些癌症细胞中明显的是,进行解旋酶的表达抑制时,该癌症细胞的增殖被显著抑制。
[0334]
(试验例2)
[0335]
1.实验材料和方法
[0336]
(1)细胞株
[0337]
进一步地,关于包含上述约70株癌症细胞株的约200株癌症细胞株,不进行通过sirna的wrn的表达抑制,分别选择确认增殖的抑制的细胞株和增殖不被抑制的细胞株。在以下试验中显示,作为选择的细胞株的一部分,将hct 116、km12、ls411n、snu-407、snu-c5、rko、cw-2、cck-81、ht-29(大肠癌)、rl95-2、an3 ca、c-33a、siha、jhuem-3(子宫癌)、im95、mkn1(胃癌)、tov-21g、pa-1(卵巢癌)用作以下试验对象的癌症细胞株的实例。
[0338]
hct 116是除上述ttk、rad50和msh3外还在至少dna2中具有突变(截短突变)的癌症细胞株。km12是除上述ttk和rad50外还在至少dna2、rbbp8和exo1中具有突变(截短突变)的癌症细胞株。ls411n是在至少mre11、dna2、rbbp8和exo1中具有突变(截短突变)的癌症细胞株。snu-407是在至少dna2、rbbp8和exo1中具有突变(截短突变)的癌症细胞株。snu-c5是在至少rad50中具有突变(截短突变)的癌症细胞株。rko是在至少rad50和rpa3中具有突变(截短突变)的癌症细胞株。cw-2是除上述rad50外还在至少rpa1中具有突变(截短突变)的癌症细胞株。cck-81是在至少rbbp8中具有突变(截短突变)的癌症细胞株。rl95-2是除上述rad50外还在至少dna2中具有突变(截短突变)的癌症细胞株。an3 ca是在至少dna2中具有突变(截短突变)的癌症细胞株。c-33a是除上述rad50外还在至少dna2、rpa1中具有突变(截短突变)的癌症细胞株。im95是在至少rad50、nbn、dna2和rbbp8中具有突变(截短突变)的癌症细胞株。tov-21g是在至少nbn中具有突变(截短突变)的癌症细胞株。ht-29、siha、jhuem-3、mkn1和pa-1是在ttk、rad50、mre11、nbn、dna2、rbbp8、exo1、rpa1、rpa2和rpa3的任一中都没有突变的癌症细胞株。这些癌症细胞株和其来源组织(tissue)、以及各癌症细胞株中rad50、mre11、nbn、dna2、rbbp8、exo1、rpa1和rpa3的截短突变的有无的信息在下述表4中显示。
[0339]
表4中记载的各突变是分别在broad institute制备的癌症细胞株数据库:“癌细胞系百科全书(ccle)”中公开的突变。此外,表4中“n.i.”显示与产生至少功能缺失型突变的截短突变有关的信息未公知。
[0340]
[表4]
[0341]
细胞株组织rad50mre11nbndna2rbbp8exo1rpa1rpa3
hct 116结直肠截短突变n.i.n.i.截短突变n.i.n.i.n.i.n.i.km12结直肠截短突变n.i.n.i.截短突变截短突变截短突变n.i.n.l.rl95-2子宫截短突变n.i.n.i.截短突变n.in.i.n.i.n.i.ls411n结直肠n.i截短突变n.i.截短突变截短突变截短突变n.i.n.i.snu-407结直肠n.i.n.i.n.i.截短突变截短突变截短突变n.i.n.i.an3 ca子宫n.i.n.i.n.i.截短突变n.i.n.i.n.i.n.i.c-33a子宫截短突变n.i.n.i.截短突变n.i.n.i.截短突变n.i.snu-c5结直肠截短突变n.i.n.i.n.i.n.i.n.i.n.i.n.i.rko结直肠截短突变n.i.n.i.n.i.n.i.n.i.n.i.截短突变cw-2结直肠截短突变n.in.i.n.in.i.n.i.截短突变n.i.cck-81结直肠n.i.n.i.n.i.n.i.截短突变n.i.n.i.n.i.tov-21g卵巢n.i.n.i.截短突变n.i.n.i.n.i.n.i.n.i.im95胃截短突变n.i.截短突变截短突变截短突变n.i.n.i.n.i.pa-1卵巢n.i.n.i.n.i.n.i.n.i.n.i.n.i.n.i.mkn1胃n.i.n.i.n.i.n.i.n.in.i.n.i.n.i.siha子宫n.i.n.i.n.i.n.i.n.i.n.i.n.i.n.i.jhuem-3子宫n.i.n.i.n.i.n.i.n.i.n.i.n.i.n.i.ht-29结直肠n.i.n.i.n.i.n.i.n.i.n.i.n.i.n.i.
[0342]
(2)短干扰(si)rna
[0343]
在wrn的表达抑制中,应用on-targetplus individual sirna(dharmacon公司制)。在转染中,应用lipofectamine rnaimax(invitrogen公司制)。此外,被验物质应用wrn sirna(wrn sirna1、dharmacon公司商品代码:j-010378-06、序列编号:25),阴性对照应用非靶标化sirna(非靶标sirna1、dharmacon公司商品代码:d-001810-01、序列编号:26)或非靶标化sirna(非靶标sirna2、dharmacon公司商品代码:d-001810-03、序列编号:27)。应用将5
×
sirna缓冲液(dharmacon公司制:b-002000-ub-100)用无核酸酶水(ambion公司制:am9932)5倍稀释的1
×
sirna缓冲液溶解各sirna。
[0344]
(3)wrn的表达抑制试验
[0345]
在各癌症细胞株中,评价通过wrn表达抑制的细胞损害活性。将各细胞株用下述表5记载的培养液分别以细胞培养瓶(corning公司制:430641u)培养,用pbs(nacalai tesque公司制:14249-24)洗涤细胞表面后,添加胰蛋白酶(nacalai tesque公司制:35554-64),在37℃温育5分钟后,应用各培养液悬浮。应用自动细胞计数器(chemometec公司制:nc-200)和via1-casette(chemometec公司制:941-0011)测定细胞数后,以细胞数成为下述表6所示接种数的方式,在96孔板(greiner bio-one公司制)中以100μl/每孔分别接种。
[0346]
随后,关于hct 116、km12、ls411n、snu-407、snu-c5、rko、cw-2、cck-81、ht-29、rl95-2、an3 ca、c-33a、siha、jhuem-3、im95和tov-21g,将lipofectamine rnaimax(thermo fischer scienctific公司制:13778150)用opti-mem(thermo fischer scientific公司制:31985-062)稀释50倍后,与120nm的被检物质(wrn sirna1)或非靶标化sirna(非靶标sirna1)等量混合。将混合液添加于接种了20μl/每孔上述细胞的板后,振荡板,分别转染终浓度10nm的sirna。此外,关于mkn1和pa-1,将lipofectamine rnaimax(thermo fischer scienctific公司制:13778150)用opti-mem(thermo fischer scientific公司制:31985-062)稀释50倍后,与12nm的被检物质(wrn sirnai)或非靶标化sirna(非靶标sirna2)等量混合。将混合液添加于接种了20μl/每孔上述细胞的板后,振荡板,分别转染终浓度1nm的
sirna。
[0347]
用37℃培养箱培养7天后,20μl/每孔添加celltiter-glo2.0 cell viability assay(promega公司制:g9243),在室温温育5分钟后,用envision(perkinelmer公司制)测定发光,测定作为细胞生存的标记物的细胞内atp量。以转染阴性对照培养7天后的各癌症细胞株中细胞内atp量为100%,算出通过wrn表达抑制的细胞生存率。各癌症细胞株的通过wrn表达抑制的细胞生存率(%存活)在图2中显示。
[0348]
[表5]
[0349][0350]
[表6]
[0351]
细胞株细胞浓度(个/ml)接种数目(个/孔)
hct116150001500km12200002000ls411n300003000snu-407200002000snu-c5200002000rko100001000cw-2500005000cck-81200002000ht-29150001500rl95-2500005000an3 ca300003000c-33a200002000siha200002000jhuem-3400004000im95300003000mkn1100001000tov-21g200002000pa-15000500
[0352]
2.结果
[0353]
如图2所示,在wrn的表达抑制试验中,在具有rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变中至少任一,特别是rad50突变、nbn突变、dna2突变和rbbp8突变中至少任一的突变的13个癌症细胞株的全部中,见到细胞生存率为70%以下,和细胞生存率的降低。此外,关于进行试验的其它癌症细胞株也同样地,在具有rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变中至少任一的突变的癌症细胞株中,见到显著的细胞生存率的降低。根据该结果显示,产生选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的组(第2组)的至少1种突变的癌症细胞株的生存强烈依赖于解旋酶的功能,在这些癌症细胞中明显的是,进行解旋酶的表达抑制时,该癌症细胞的增殖被显著抑制。
[0354]
(试验例3)
[0355]
1.实验材料和方法
[0356]
(1)细胞株
[0357]
将hct 116用作试验对象的癌症细胞株。hct 116如上述是在至少ttk、rad50、msh3和dna2中具有突变(截短突变)的癌症细胞株。
[0358]
(2)短干扰(si)rna
[0359]
在wrn的表达抑制中,应用on-targetplus individual sirna(dharmacon公司制)。在转染中,应用lipofectamine rnaimax(invitrogen公司制)。此外,sirna应用wrn sirna(wrn sirna2、dharmacon公司商品代码:j-010378-07、序列编号:28)。用将5
×
sirna缓冲液(dharmacon公司制:b-002000-ub-100)用无核酸酶水(ambion公司制:am9932)5倍稀释的1
×
sirna缓冲液溶解sirna。
[0360]
(3)转染
[0361]
在wrn的过剩表达中,应用viafect transfection reagent(promega公司制)。分别地,将pcmv-3tag-1a载体中克隆sirna抗性型的野生型wrn基因(序列编号:29)的质粒用作对照物质,将pcmv-3tag-1a载体中克隆作为sirna非抗性型的野生型wrn基因的编码上述来自人的天然型wrn的基因组dna的典型的碱基序列(序列编号:1)的质粒用作被验物质1,将pcmv-3tag-1a载体中克隆导入k577m的突变的缺失解旋酶活性的sirna抗性型k577mwrn基因(k577mwrn、序列编号:30)的质粒用作被验物质2。
[0362]
(4)wrn的挽救试验
[0363]
在hct 116癌症细胞株中,进行wrn表达抑制,分别评价过剩表达sirna抗性型的野生型wrn基因、或sirna非抗性型的野生型wrn基因、或sirna抗性型的k577mwrn基因时的细胞损害活性。首先,将hct 116细胞株用上述表2记载的培养液分别以细胞培养瓶(corning公司制:430641u)培养,应用pbs(nacalai tesque公司制:14249-24)洗涤细胞表面后,添加胰蛋白酶(nacalai tesque公司制:35554-64),在37℃温育5分钟后,应用前述培养液悬浮。应用自动细胞计数器(chemometec公司制:nc-200)和via1-casette(chemometec公司制:941-0011)测定细胞数后,用各培养液以成为7500个/76μl的方式调整,76μl/每孔接种。
[0364]
随后,应用opti-mem(thermo fischer scientific公司制:31985-062),以sirna(wrn sirna2)的终浓度为5nm、lipofectamine rnaimax(thermo fischer scienctific公司制:13778150)为100倍稀释的方式混合它们。将混合液在室温温育20分钟后,通过添加于接种19μl/每孔上述细胞的板,振荡板,转染终浓度1nm的sirna。
[0365]
次日,将0.1μg对照物质(sirna抗性型的野生型wrn基因的质粒)、或被验物质1(sirna非抗性型的野生型wrn基因的质粒)或被检物质2(sirna抗性型的k577mwrn基因的质粒)和0.3μl的viafect transfection reagent与10μl的opti-mem混合。将混合液在室温温育20分钟后,通过添加于转染了10μl/每孔上述sirna的孔,振荡板,分别过剩表达sirna抗性型的野生型wrn基因、sirna非抗性型的野生型wrn基因、或sirna抗性型的k577mwrn基因。
[0366]
用37℃培养箱培养6天后,50μl/每孔添加celltiter-glo2.0 cell viability assay(promega公司制:g9243),在室温温育5分钟后,应用envision(perkinelmer公司制)测定发光,测定作为细胞生存的标记物的细胞内atp量,算出其平均值(n=3(n1,n2,n3))。以转染对照物质培养6天后的各癌症细胞株中的细胞内atp量为100%,算出通过wrn表达抑制的细胞生存率。各癌症细胞株中转染对照物质、被验物质1、或被检物质2时的各细胞生存率(%存活)在图3中显示。对照物质与被验物质1或2之间以及被验物质1与被检物质2之间分别进行t检验。t检验的结果,在p<0.01的情形判定为有显著差异。
[0367]
2.结果
[0368]
如图3所示,对照物质(转染sirna抗性型的野生型wrn基因的质粒的株)、和被验物质1(转染sirna非抗性型的野生型wrn基因的质粒的株)或被检物质2(转染sirna抗性型的k577mwrn基因的质粒的株)之间见到显著差异,被验物质1与被检物质2之间未见到显著差异。根据这些结果和上述试验例1~2的结果显示,产生至少上述突变的癌症细胞的生存确实强烈依赖于wrn的解旋酶的功能,该癌症细胞中进行解旋酶的表达抑制时,显示该癌症细胞的增殖被显著抑制。
[0369]
产业上的可利用性
[0370]
如以上说明,根据本发明,以选自由ttk突变和rad50突变组成的第1组的至少1种
突变、和/或选自由rad50突变、mre11突变、nbn突变、dna2突变和rbbp8突变组成的第2组的至少1种突变为指标,可以有效地预测对通过解旋酶抑制剂的癌症治疗的敏感性。此外,根据本发明,在来自癌症患者的样品中检测前述突变的有无、分选检测到该突变的患者后,可以对该患者实施通过解旋酶抑制剂的癌症的治疗。因此,可以大幅提高癌症的治疗成绩。此外,通过应用针对选自由ttk和rad50组成的第1组的至少1种的基因、和/或选自由rad50、mre11、nbn、dna2和rbbp8组成的第2组的至少1种的基因的寡核苷酸探针和引物,以及针对选自由ttk蛋白质和rad50蛋白质组成的第1组的至少1种蛋白质、和/或选自由rad50蛋白质、mre11蛋白质、nbs1蛋白质、dna2蛋白质和ctip蛋白质组成的第2组的至少1种蛋白质的抗体,可以有效地进行通过上述突变有无的检测的伴随诊断。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1