对NECTIN-4具有特异性的抗体及其用途的制作方法
对nectin-4具有特异性的抗体及其用途
技术领域
1.本发明涉及对nectin-4具有特异性的抗体及其用途。
背景技术:
2.nectin-4是属于nectin蛋白质家族的表面分子,所述家族包含4个成员。nectin是细胞粘附分子,其在发育和成年期间对于上皮细胞、内皮细胞、免疫细胞和神经细胞的各种生物过程(例如极性、增殖、分化和迁移)起关键作用。它们参与人类的几种病理过程。它们是脊髓灰质炎病毒、单纯疱疹病毒和麻疹病毒的主要受体。
3.pvrl4/nectin-4与钙粘蛋白合作参与粘附连接的形成和维持。实际上,nectin-4是一种i型跨膜细胞粘附分子,在其细胞外区域由三个ig样结构域(v-c-c型)组成。它也是麻疹病毒的受体,介导其内吞作用。nectin-4在胎儿发育期间表达,其中与成人组织中其他nectins的广泛表达相比,在成人中表达下降。
4.已有研究表明(参见文献1、2、3、4、5、6),在包括乳腺癌的各种癌症中,nectin-4被重新表达为一种具有致癌特性的肿瘤相关抗原。特别地,nectin-4是主要在预后不良的肿瘤上的肿瘤相关抗原,分别占乳腺癌、卵巢癌和肺癌的50%、49%和86%。在乳腺肿瘤中,nectin-4主要在三阴性和erbb2+癌中表达。在患有这些癌症的患者的血清中,检测到可溶形式的nectin-4与不良预后相关。血清nectin-4水平在转移性发展期间增加,且在治疗后减少。
5.这些特征与nectin-4在各自的正常组织中的有限表达有关,表明在这些癌症中,nectin-4可能是抗体-药物偶联物(adc)的相关治疗靶点,如最近在膀胱癌、乳腺癌和胰腺癌中所报道(参考文献5、6)。
6.因此,现有技术已经描述了几种抗nectin-4抗体。特别地,enfortumab vedotin(asg-22me,例如来自seattle genetics的ha22-2mab)是靶向nectin-4的抗体-药物偶联物(adc),并且目前在进行用于治疗实体瘤患者的临床研究。
7.wo2017042210和wo2018158398也提供了抗nectin-4抗体(即n41 mab和14a5.2 mab),它们以相似的亲和力识别与ha22-2抗体识别的表位不同的表位,并且可用于癌症的治疗。
8.然而,这些抗体仅用于治疗应用。事实上,它们都不能用于免疫组化(ihc)染色,因此都不具有诊断应用。
9.可用于ihc的单克隆抗体在临床中具有很高的价值。特别地,在癌症领域,经ihc验证的mab被用于诊断癌症为良性或恶性,确定肿瘤的阶段和分级,并鉴定细胞类型和转移来源,以发现原发性肿瘤的位置。ihc验证的mab也广泛用于预测治疗反应,特别是在乳腺癌中。
10.在这种情况下,可用于治疗和诊断(即目标检测)目的的mab在临床是至关重要的,因为它们允许确定患者的治疗资格。此外,在诊断、预后和治疗中使用一种独特且相同的抗体在可靠性和开发成本方面具有相当大的价值。
11.因此,仍然需要开发通过免疫组化(ihc)测定用于诊断应用,同时具有优异的治疗性能的抗nectin-4。
12.发明概述
13.本公开涉及对nectin-4具有特异性的抗体及其用途。
14.特别是,本文公开了在ihc测定中选择性结合生物样品中的nectin-4的抗nectin-4抗体。更具体地,所述抗体在组织样品切片中选择性结合nectin-4,尤其是在固定的组织样品和更具体地甲醛固定的石蜡包埋(ffpe)组织样品中。因此,这种抗体可用于诊断和/或预后目的。
15.在一些实施方案中,本公开的抗nectin-4抗体结合nectin-4,特别是seq id no:1的人nectin-4,其明显的亲和力结合常数值(kd)小于10μg/ml,明显小于1μg/ml,小于100ng/ml,小于10ng/ml或小于5ng/ml。因此,这种抗体典型地可用于治疗应用。
16.在具体实施方案中,根据本公开的抗nectin-4mab与以下参考鼠抗体mab 5a12.2竞争结合nectin-4,所述参考鼠抗体mab 5a12.2可通过以保藏号cncm i-5407保藏于cncm的杂交瘤获得。
17.在具体实施方案中,根据本公开的抗nectin-4抗体包含含有抗体mab 5a12.2的6个cdr的重链和轻链,所述mab 5a12.2可通过以保藏号cncm i-5407保藏于cncm的杂交瘤获得。
18.典型地,本公开的抗nectin-4抗体包含:
[0019]-seq id no:2的hcdr1、seq id no:3的hcdr2、seq id no:4的hcdr3、seq id no:5的lcdr1、seq id no:6的lcdr2和seq id no:7的lcdr3;
[0020]-可变重链(vh)域和可变轻链域,其分别与seq id no:8和9的重链和轻链具有至少90%的同一性;和/或
[0021]-分别为seq id no:8和9的可变重链(vh)域和可变轻链域。
[0022]
在具体实施方案中,抗nectin-4抗体是人抗体、嵌合抗体或人源化抗体。
[0023]
在本公开的一些实施方案中,抗nectin-4抗体偶联至细胞毒性部分。
[0024]
本公开的另一方面涉及编码如上所述的任一种抗nectin-4抗体的重链和/或轻链的核酸分子。
[0025]
本公开还涉及包含此类核酸的宿主细胞,特别用于制造如上所述的任一种抗nectin-4抗体。
[0026]
本公开的另一方面涉及如上定义的抗nectin-4抗体,其用于治疗,特别是用于癌症治疗,特别用于乳腺癌、卵巢癌或肺癌治疗。典型地,癌症是转移性癌症。
[0027]
本公开还涵盖包含根据本公开的抗nectin-4抗体和至少药学上可接受的载体的组合物。
[0028]
本公开的另一个方面涉及用于诊断受试者中的癌症的体外方法,其包括使用如本文公开的抗nectin-44抗体对来自所述受试者的组织样品进行ihc测定,任选其中所述组织样品是来自所述受试者的固定的组织样品,特别是固定的包埋组织样品,更特别是甲醛固定的石蜡包埋(ffpe)组织样品。
[0029]
本公开的另一个方面涉及用于确定受试者用如本文所述的抗nectin-4抗体治疗的资格的体外方法,其包括使用所述抗nectin-4抗体对来自所述受试者的组织样品切片进
行ihc测定,任选其中所述组织样品切片是来自所述受试者的固定组织,尤其是固定的包埋组织样品切片,更特别是甲醛固定的石蜡包埋(ffpe)组织切片。
[0030]
本公开还涉及在有需要的受试者中治疗癌症的方法,其包括向受试者施用治疗有效量的如上定义的抗nectin-4抗体。在一个具体的实施方案中,所述用于治疗癌症的方法包括诊断癌症或确定患者用抗nectin-4抗体治疗的资格的在先步骤,包括在对来自所述受试者的组织样品切片进行的ihc测定中使用所述抗nectin-4抗体。特别是,本公开涵盖治疗患有或疑似患有癌症的患者的方法,所述方法包括:
[0031]
步骤1),即评估来自疑似患有癌症的受试者的组织样品中的nectin-4表达,或评估所述癌症患者对抗癌治疗剂的反应性,包括:
[0032]
(1a)使所述组织样品与本文公开的抗体或其抗原结合片段接触;
[0033]
(1b)检测所述抗体或其抗原结合片段与所述组织样品的结合;以及
[0034]
(1c)测定所述组织样品中nectin-4的表达,其中将所述组织样品中nectin-4的表达水平与nectin-4的参考表达水平进行比较;以及
[0035]
步骤2),即当观察到与参考相比增加的nectin-4表达水平时,向患者施用所述抗癌治疗剂;
[0036]
任选地,其中nectin-4的表达水平使用免疫组化(ihc)方法、免疫印迹测定、萤光激活的细胞分选(facs)测定或酶联免疫吸附测定(elisa)检测,
[0037]
任选地,其中所述抗癌治疗剂包含抗nectin-4抗体或抗nectin-4抗体的抗体药物偶联物,典型地是根据本公开的抗体或其变体。
[0038]
发明详述
[0039]
定义
[0040]
如本文所用,术语“nectin-4”具有其在本领域中的一般含义并且包括人nectin-4,特别是人nectin-4的天然序列多肽、亚型、嵌合多肽、所有同系物、片段和前体。天然nectin-4的氨基酸序列包括ncbi参考序列:np_112178.2。
[0041]
更具体地,术语“nectin-4”包括以下seqid:1的人nectin-4。
[0042]
mplslgaemwgpeawlllllllasftgrcpageletsdvvtvvlgqdaklpcfyrgdsgeqvgqvawarvdagegaqelallhskyglhvspayegrveqpppprnpldgsvllrnavqadegeyecrvstfpagsfqarlrlrvlvpplpslnpgpaleegqgltlaasctaegspapsvtwdtevkgttssrsfkhsrsaavtsefhlvpsrsmngqpltcvvshpgllqdqrithilhvsflaeasvrgledqnlwhigregamlkclsegqpppsynwtrldgplpsgvrvdgdtlgfpplttehsgiyvchvsnefssrdsqvtvdvldpqedsgkqvdlvsasvvvvgviaallfcllvvvvvlmsryhrrkaqqmtqkyeeeltltrensirrlhshhtdprsqpeesvglraeghpdslkdnsscsvmseepegrsystlttvreietqtellspgsgraeeeedqdegikqamnhfvqengtlrakptgngiyingrghlv
[0043]
如本文所用,术语“抗体”或“免疫球蛋白”具有相同的含义,且将在本公开中同等使用。
[0044]
如本文所用,术语“抗体”是指免疫球蛋白分子和免疫球蛋白分子的免疫活性部分,即,含有免疫特异性结合抗原的抗原结合位点的分子。因此,术语抗体不仅涵盖完整抗体分子,还涵盖抗体片段以及抗体和抗体片段的变体(包括衍生物)。
[0045]
在天然抗体中,两条重链通过二硫键相互连接,并且每条重链通过二硫键与轻链连接。有两种类型的轻链,lambda(1)和kappa(κ)。有五种主要的重链类别(或同种型),其决
定抗体分子的功能活性:igm、igd、igg、iga和ige。每条链含有不同的序列结构域。轻链包括两个结构域,可变结构域(vl)和恒定结构域(cl)。重链包括四个结构域,可变结构域(vh)和三个恒定结构域(ch1、ch2和ch3,统称为ch)。轻链(vl)和重链(vh)的可变区决定了对抗原的结合识别和特异性。轻链(cl)和重链(ch)的恒定区结构域赋予重要的生物学特性,例如抗体链结合、分泌、经胎盘移动、补体结合和与fc受体(fcr)结合。
[0046]
fv片段是免疫球蛋白的fab片段的n-末端部分,并且由一条轻链和一条重链的可变部分组成。抗体的特异性在于抗体结合位点和抗原决定簇之间的结构互补性。抗体结合位点由主要来自高变区或互补决定区(cdr)的残基组成。偶尔,来自非高变区或框架区(fr)的残基可参与抗体结合位点或影响整个结构域的结构并因此影响结合位点。互补决定区或cdr是指一起定义天然免疫球蛋白结合位点的天然fv区的结合亲和力和特异性的氨基酸序列。免疫球蛋白的轻链和重链各自具有三个cdr,分别称为l-cdr1、l-cdr2、l-cdr3和h-cdr1、h-cdr2、h-cdr3。因此,抗原结合位点典型地包括六个cdr,其包含来自重链和轻链v区的每一个的cdr组。框架区(fr)是指插入cdr之间的氨基酸序列。轻链和重链的可变区典型地包含4个框架区和3个以下序列的cdr fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。本文所用的术语“抗体”共同指免疫球蛋白或免疫球蛋白样分子,包括例如但不限于iga、igd、ige、igg和igm、其组合,以及在任何脊椎动物(例如哺乳动物,如人、山羊、兔和小鼠)以及非哺乳动物物种(如鲨鱼免疫球蛋白)的免疫应答过程中产生的类似分子。
[0047]
抗体可变结构域中的残基通常根据kabat et al设计的系统编号。该系统在kabat et al.,1987,in sequences of proteins of immunological interest,us department of health and human services,nih,usa(下文称为“kabat et al.”)中阐述。在本说明书中使用该编号系统。kabat残基命名并不总是直接对应于seq id序列中氨基酸残基的线性编号。实际的线性氨基酸序列可以含有比严格的kabat编号中更少或更多的氨基酸,所述kabat编号对应于基本可变结构域结构的结构组分(无论框架或互补决定区(cdr))的缩短或插入。对于给定抗体,残基的正确kabat编号可通过将抗体序列中的同源残基与“标准”kabat编号序列比对来确定。根据kabat编号系统,重链可变区的cdr位于残基31-35(h-cdr1)、残基50-65(h-cdr2)和残基95-102(h-cdr3),并且轻链可变区的cdr位于残基24-34(l-cdr1)、残基50-56(l-cdr2)和残基89-97(l-cdr3)。根据imgt编号的v(可变)结构域,在重链中,cdr1-imgt区域包含第26-33位;cdr2-imgt区包含第51-58位;并且cdr3-imgt区包含第97-109位。在轻链中,cdr1-imgt区包含第27-32位;cdr2-imgt区包含第50-52位;并且cdr3-imgt区包含第89-94位。
[0048]
在具体实施方案中,本文提供的抗体是抗体片段,并且更特别地,是包括本文公开的抗体的抗原结合结构域的任何蛋白质。抗体片段包括但不限于fv、fab、f(ab’)2、fab’、dsfv、scfv、sc(fv)2和双抗体。
[0049]
本文所用的“分离的抗体”是指基本上不含具有不同抗原特异性的其它抗体的抗体(例如,特异性结合nectin-4的分离的抗体基本上不含特异性结合nectin-4以外的其它抗原的抗体)。然而,特异性结合nectin-4的分离的抗体与其它抗原(如来自其它物种的相关nectin-4分子)具有交叉反应性。此外,分离的抗体可以基本上不含其它细胞物质和/或化学物质。
[0050]
抗体亲和力是指抗体通过其抗原结合位点(互补位)结合抗原(如本公开中的
nectin-4)上存在的表位的强度。nectin-4的表观亲和结合常数值(kd)可以通过流式细胞术通过测量抗体结合的饱和曲线和通过测定ec50值来评估。这在对表达nectin-4的细胞系(如癌细胞系)或表达重组nectin-4的细胞进行的实施例中说明(特别参见材料和方法部分)。
[0051]
如本文所用,术语“k
d”旨在表示平衡解离常数,其由kd与ka的比率(即kd/ka)获得并且表示为摩尔浓度(m)。kd值涉及抗体的浓度(特定实验所需的抗体量),因此kd值越低(浓度越低),抗体的亲和力越高。抗体的kd值也可以使用本领域公知的方法测定。例如,用于测定mab的kd值的方法可见于harlow,et al.,antibodies:a laboratory manual,cold spring harbor laboratory press,cold spring harbor,n.y.,1988),coligan et al.,eds.,current protocols in immunology,greene publishing assoc.和wiley interscience,n.y.,(1992,1993),and muller,meth.enzymol.92:589-601(1983),这些参考文献以其全文通过引入并入本文。用于测定抗体kd的方法是通过使用表面等离子体共振或使用生物传感器体系如或体系。典型地,使用表面等离子体共振分析,使用-2000或-3000(biacore,inc.,piscataway,nj)在25℃下,用固定抗原cm5芯片以约10响应单位(ru)测量kd。简言之,根据供应商的说明书,用n-乙基-n-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)活化羧甲基化葡聚糖生物传感器芯片(cm5,biacore,inc.)。用10mm乙酸钠(ph4.8)将抗原稀释至5pg/ml(约0.2μm),然后以5μl/分钟的流速注射,以获得约10响应单位(ru)的偶联蛋白。注射抗原后,注射1m乙醇胺以阻断未反应的基团。对于动力学测量,将fab的两倍连续稀释液(0.78nm-500nm)在具有0.05%聚山梨酯20(tween-20
tm
)表面活性剂(pbst)的pbs中在25℃下以约25μl/min的流速注射。结合速率(k
on
)和解离速率(k
0ff
)使用简单的一对一langmuir结合模型(评价软件3.2版)通过同时拟合结合和解离传感图来计算。将平衡解离常数(kd)计算为k
off
/k
on
比(参见,例如,chen et al.j.mol.biol.293:865-881,1999)。如果通过上述表面等离子体共振分析,结合速率超过106m-1
s-1
,则结合速率可以通过使用荧光猝灭技术(激发=295nm;emission=340nm,16nm带通)来测定,该技术在25℃的20nm抗ph 7.2的pbs中的抗原抗体(fab形式),在存在增加的抗原浓度的情况下,在光谱仪中测量,例如配备停止流的分光计(aviv instruments)或具有搅拌比色杯的8000-series slm-aminco
tm
分光光度计(thermospectronic)用搅拌的比色皿。
[0052]
本文所用的术语“kassoc”或“ka”是指特定抗体-抗原相互作用的结合速率,而本文所用的术语“kdis”或“kd”是指特定抗体-抗原相互作用的解离速率。
[0053]
本文所用的术语“单克隆抗体”或“单克隆抗体组合物”是指单分子组合物的抗体分子的制剂。单克隆抗体组合物对特定表位显示单一结合特异性和亲和力。
[0054]
如本文所用,术语“特异性”是指抗体可检测地结合存在于抗原(如nectin-4)上的表位的能力。在本公开中,尽管与非nectin-4蛋白或结构(如癌细胞上或其它细胞类型上存在的其它蛋白)具有相对较小的可检测反应性,但其典型地旨在表示结合如实施例中所述通常在癌细胞系(如sum190癌细胞系)中表达的人nectin-4的抗体或蛋白,优选具有如实施例和图2中测定的小于10μg/ml,尤其小于1μg/ml,小于100ng/ml,小于10ng/ml或小于5ng/ml的表观亲和结合常数值(kd)(或ec50)。典型地,表观亲和结合常数值(kd)不小于0.05ng/ml,特别是0.1ng/ml。通常,表观亲和结合常数值(kd)(其可以如实施例中所示测定)为
4-低组'(qs《100)。'nectin-4高组'是指潜在地适合用5a12.2衍生的adc治疗的组。因此,在一个实施方案中,如本文所公开的抗nectin4抗体表现出至少100的qs评分,如上文所述(也参见rabet et al.,2017,参考测定的实施)。
[0062]
术语“同一性”是指两个多肽分子之间或两个核酸分子之间的序列相似性。当两个比较序列中的位置被相同的碱基或相同的氨基酸残基占据时,则相应的分子在该位置是相同的。两个序列之间的同一性百分比对应于两个序列共有的匹配位置的数目除以比较的位置的数目并乘以100。通常,当两个序列被比对以给出最大同一性时进行比较。可以使用例如gcg(genetics computer group,program manual for the gcg package,version 7,madison,wisconsin)堆积程序或任何序列比较算法(如blast、fasta或clustalw),通过比对计算同一性。
[0063]
根据本公开的参考分子的功能性变体表现出基本上等于或优于参考分子(例如,5a12.2 mab)的相应功能性的功能性。基本上等于在本文中意味着所述功能变体保留参考分子的相应功能性质的至少约50%、60%、70%、80%、90%、95%或100%。
[0064]
在一个方面,本公开涉及抗nectin-4抗体,其中所述抗体具有以下性质中的至少一种且更具体地两者:
[0065]
(i)其以小于10μg/ml,尤其小于1μg/ml,小于100ng/ml,小于10ng/ml或小于5ng/ml的表观亲和结合常数值(kd)(或ec50)结合nectin-4,特别是sed id no:1的人nectin-4;
[0066]
(ii)其在免疫组化(ihc)测定中结合nectin-4。更具体地,所述抗体在ihc测定中选择性地结合生物样品切片中的nectin-4。
[0067]
可使用如实例中所述的ihc测定和/或亲和力测定在抗nectin-4抗体中筛选具有此类有利特性的本公开的抗nectin-4抗体。
[0068]
在某些实施方案中,癌症是癌瘤、淋巴瘤(包括何杰金氏淋巴瘤和非何杰金氏淋巴瘤)、胚细胞瘤、肉瘤、白血病、鳞状细胞癌、小细胞肺癌、非小细胞肺癌、肺腺癌、肺鳞状细胞癌、腹膜癌、肝细胞癌、胃肠癌、胰腺癌、神经胶质瘤、子宫颈癌、卵巢癌、肝癌、膀胱癌、肝细胞瘤、乳腺癌、结肠癌、结肠直肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌、肝癌、前列腺癌、外阴癌、甲状腺癌、肝癌、白血病和其它淋巴组织增生性病症,或各种类型的头颈癌。典型地,根据本公开的癌症包括局部或转移性乳腺癌、卵巢癌、膀胱癌、尿路上皮癌、胰腺癌和肺癌或癌肿。
[0069]
免疫组化(ihc)是使用与酶或荧光标记偶联的抗体使组织或组织切片中的蛋白质可视化的常规实验室技术。典型地,所述ihc测定在固定的组织切片上进行。可以使用甲醛(典型地4%)、中性缓冲福尔马林(典型地10%)实现固定。更具体地,组织切片被固定和包埋。在一个具体实施方案中,ihc测定是甲醛固定的石蜡包埋(ffpe)ihc测定。ihc技术进一步描述于免疫组织化学染色方法中。thomas boenisch,ed.(3rd ed.2001)。
[0070]“生物样品”是指从受试者或患者获得的相似细胞的集合。生物样品可以是组织或细胞样品。组织或细胞样品的来源可以是来自新鲜、冷冻和/或保存的器官或组织样品或活检或抽吸物的固体组织;血液或任何血液成分;体液,例如脑脊液、羊水、腹膜液或间质液;来自受试者妊娠或发育中的任何时间的细胞。生物样品也可以从体外组织或细胞培养物中获得。组织样品可以含有本质上不与组织天然混合的化合物,例如防腐剂、抗凝剂、缓冲剂、固定剂、营养物、抗生素等。本文生物样品的实例包括但不限于肿瘤活检、循环肿瘤细胞、血
清或血浆、循环血浆蛋白、腹水、原代细胞培养物或衍生自肿瘤或显示肿瘤样性质的细胞系,以及保存的肿瘤样品,例如福尔马林固定的石蜡包埋的肿瘤样品或冷冻肿瘤样品。在具体实施方案中,生物样品是组织样品,尤其是固定的组织样品,更特别是石蜡包埋的组织样品。
[0071]
在一些实施方案中,生物样品来自患有癌症,易患癌症或正在测试癌症的受试者。更具体地,该组织也是癌组织样品。“癌组织”在本文中是指从患有癌症的受试者获得的组织并且取自受癌症影响的器官或组织。在其它实施方案中,生物样品来自患有上述癌症的受试者,特别是患有局部或转移性乳腺癌、卵巢癌、膀胱癌、尿路上皮癌、胰腺癌和肺癌或癌肿。
[0072]
本文所用的“参考样品”、“参考细胞”、“参考组织”、“对照样品”、“对照细胞”或“对照组织”是指用于比较目的的样品、细胞、组织、标准品或水平。在一个实施方案中,参考样品、参考细胞、参考组织、对照样品、对照细胞或对照组织获自同一受试者或个体的机体的健康和/或非患病部分(例如组织或细胞)。例如,参考样品、参考细胞、参考组织、对照样品、对照细胞或对照组织可以是健康和/或非患病细胞或与患病细胞或组织相邻的组织(例如,与肿瘤相邻的细胞或组织)。在另一个实施方案中,参考样品获自相同受试者或个体的机体的未处理组织和/或细胞。在又一个实施方案中,参考样品、参考细胞、参考组织、对照样品、对照细胞或对照组织获自不是受试者或个体的个体的机体的健康和/或非患病部分(例如组织或细胞)。在另一个实施方案中,参考样品、参考细胞、参考组织、对照样品、对照细胞或对照组织获自不是受试者或个体的个体的机体的未处理组织和/或细胞。
[0073]
术语“检测”包括任何检测手段,包括直接和间接检测。术语“诊断”在本文中用于指分子或病理状态、疾病或病症(例如癌症)的鉴定或分类。例如,“诊断”可指鉴定特定的癌症类型。“诊断”还可以指癌症的特定亚型的分类,例如,通过组织病理学标准,或通过分子特征(例如,通过生物标志物(例如,特定基因或由所述基因编码的蛋白质)的一种或组合的表达表征的亚型)。
[0074]
术语“表达的水平”或“表达水平”通常可互换使用,并且通常是指生物样品中多核苷酸、mrna或氨基酸产物或蛋白质的量。“表达”通常是指将基因编码的信息转化为细胞中存在和操作的结构的过程。因此,根据本公开,基因(例如,nectin-4基因)的“表达”可指转录成多核苷酸、翻译成蛋白质或甚至翻译后修饰蛋白质。转录的多核苷酸、翻译的蛋白质或翻译后修饰的蛋白质的片段也应被认为是表达的,无论它们源自通过可变剪接产生的转录物或降解的转录物,或源自蛋白质的翻译后加工,例如通过蛋白水解。在一些实施方案中,“表达水平”是指如使用本领域已知或本文所述的方法测定的生物样品中的蛋白质(例如,nectin-4)的量,所述方法包括但不限于免疫组化(ihc)、免疫印迹(例如,蛋白质印迹)、免疫荧光(if)、流式细胞术(例如,facs
tm
)或酶联免疫吸附测定(elisa)。
[0075]“增加的表达”、“增加的表达水平”、“增加的水平”、“提高的表达”、“提高的表达水平”或“提高的水平”是指相对于对照,例如未患有疾病或病症(例如癌症)或内部对照(例如管家生物标志物)的个体,个体中生物标志物的增加的表达或增加的水平。
[0076]“降低的表达”、“降低的表达水平”、“降低的水平”、“减少的表达”、“减少的表达水平”或“减少的水平”是指相对于对照,例如未患有疾病或病症(例如癌症)或内部对照(例如管家生物标志物)的个体,个体中生物标志物的降低的表达或降低的水平。在一些实施方案
中,降低的表达很少或没有表达。
[0077]
本文所用的术语“一抗”是指特异性结合组织样品中的靶蛋白抗原的抗体。一抗通常是免疫组化方法中使用的第一抗体。一抗可以是免疫组化方法中使用的唯一抗体。本文所用的术语“二抗”是指特异性结合一抗,从而在一抗和后续试剂(如果有的话)之间形成桥的抗体。二抗通常是免疫组化方法中使用的第二抗体。
[0078]
参考抗体mab 5a12.2
[0079]
本文公开的抗体包括参照鼠单克隆抗体5a12.2,其由杂交瘤产生,根据布达佩斯条约的规定于2019年3月20日以相应的保藏号cncm i-5407保藏于微生物培养物保藏中心(cncm,institut pasteur,25 rue du docteur roux,75724 paris cedex 15,france)。
[0080]
在具体实施方案中,本发明的抗nectin-4抗体,优选人源化抗nectin-4抗体包含重链和轻链,所述重链和轻链包含抗体mab 5a12.2的6个cdr,所述mab 5a12.2可由以保藏号cncm i-5407保藏于cncm的杂交瘤获得。
[0081]
本公开还涉及包含上述参考抗体的相应vh和vl区的任何抗体,特别是人源化抗体。
[0082]
本公开还涉及可以保藏号cncm i-5407在cncm获得的所述杂交瘤。
[0083]
mab 5a12.2包含:
[0084]-seq id no:2的hcdr1、seq id no:3的hcdr2、seq id no:4的hcdr3、seq id no:5的lcdr1、seq id no:6的lcdr2和seq id no:7的lcdr3;和
[0085]-可变重链(vh)域和可变轻链域,其分别与seq id no:8和9的重链和轻链具有至少90%的同一性。
[0086]
参考抗体mab 5a12.2结合nectin-4胞外区中的igv样远端结构域(用于免疫小鼠的结构域)。典型地,所述参考抗体不与ha22-2mab(seattle genetics)或如w 02017042210和wo 2018158398中公开的任何抗体(特别是n41 mab和14a5.2 mab)交叉竞争结合nectin-4,表明本发明的抗体结合不同的表位。可以如实施例中所示进行交叉竞争性测定(参见材料和方法部分)。
[0087]
本文公开的其它抗体包括具有已通过氨基酸缺失、插入或取代而突变的氨基酸,但在cdr区中与参考mab 5a12.2的cdr区具有至少60、70、80、90、95、96、97、98、99或100%同一性的那些。典型地,根据本公开,与参考抗体mab 5a12.2的cdr序列相比,抗体可在一个或多个cdr中具有1,2,3或4个氨基酸变化(包括缺失、插入或取代)。
[0088]
在一些实施方案中,本公开的抗体是参考mab 5a12.2的突变变体,其具有与所述参考mab 5a12.2的相应6个cdr区100%相同的6个cdr区,并且其中所述突变变体抗体包括突变氨基酸序列,其中当与参考抗体的相应构架区相比时,fr1、fr2、fr3和fr4区中不超过1、2、3、4或5个氨基酸已通过氨基酸缺失、插入或取代而突变。
[0089]
功能性变体抗体
[0090]
在又一个实施方案中,本公开的功能性变体抗体具有全长重链和轻链氨基酸序列;或可变区重链和轻链氨基酸序列,或与上述抗体mab 5a12.2(如seq id no:2-7中所示)的相应氨基酸序列同源或更特定地相同的所有6个cdr区氨基酸序列,且其中所述功能性变体抗体保留原始mab 5a12.2抗体的所需功能特性。
[0091]
参考mab 5a12.2抗体的功能性变体,尤其是在本公开的单克隆抗体的上下文中使
用的vl、vh或cdr的功能性变体仍允许抗体保留至少相当大比例(至少约50%、60%、70%、80%、90%、95%或100%)的亲和力(典型地通过kd或结合ec50评估,如通过流式细胞术测量,例如在表达nectin-4的细胞系如癌细胞系上)和/或亲本抗体的选择性(例如:mab 5a12.2)和在一些情况下,本公开的这样的单克隆抗体可以与比亲本ab(例如:mab 5a12.2)更大的亲和力、选择性和/或特异性结合。
[0092]
在一些实施方案中,作为本文公开的参考mab 5a12.2抗体的功能变体的抗nectin4抗体具有分别与氨基酸序列seq id no:8和9具有至少90%同一性的可变重链(vh)结构域和可变轻链结构域。
[0093]
原始mab 5a12.2抗体的所需功能特性可选自下组:
[0094]
i.其以小于10μg/ml,尤其小于1μg/ml,小于100ng/ml,小于10ng/ml或小于5ng/ml(典型地为0.05ng-10μg/ml,尤其0.1ng-1μg/ml)的表观亲和结合常数值(kd)(或ec50)结合nectin-4,尤其结合seq id no:1的人nectin-4;
[0095]
ii.其在免疫组化(ihc)测定中结合nectin-4。更具体地,所述抗体在ihc测定中选择性地结合生物样品切片中的nectin-4。
[0096]
例如,本公开涉及参考mab 5a12.2的功能性变体抗体,其包含可变重链(vh)和可变轻链(v
l
)序列,其中cdr序列,即6个cdr区;hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、lcdr3与参考mab5a12.2的相应cdr序列(分别如seq id no:2-7中所定义)共享至少60%、70%、90%、95%或100%的序列同一性,其中所述功能性变体抗体特异性结合nectin-4,并且所述抗体表现出以下功能特性中的至少一种:
[0097]
(i)其以小于10μg/ml,尤其小于1μg/ml,小于100ng/ml,小于10ng/ml或小于5ng/ml(典型地为0.05ng-10μg/ml,尤其0.1ng-1μg/ml)的表观亲和结合常数值(kd)(或ec50)结合nectin-4;
[0098]
(ii)其在免疫组化(ihc)测定中结合nectin-4。更具体地,所述抗体在ihc测定中选择性地结合生物样品切片中的nectin-4。
[0099]
其进一步涉及mab 5a12.2参考抗体的功能性变体抗体,其包含与所述mab 5a12.2参考抗体的相应重链和轻链可变区至少80%、90%或至少95%、96%、97%、98%、99%或100%相同的重链可变区和轻链可变区(分别如seq id no 8和9中所示);功能性变体抗体特异性结合nectin-4,并且表现出以下功能特性中的至少一种:
[0100]
(i)其以小于10μg/ml,尤其小于1μg/ml,小于100ng/ml,小于10ng/ml或小于5ng/ml(典型地为0.05ng-10μg/ml,尤其0.1ng-1μg/ml)的表观亲和结合常数值(kd)(或ec50)结合nectin-4;
[0101]
(ii)其在免疫组化(ihc)测定中结合nectin-4。更具体地,所述抗体在ihc测定中选择性地结合生物样品切片中的nectin-4。
[0102]
在各种实施方案中,抗体可以表现出上述所需功能特性中的一种或两种。抗体可以是例如人抗体、人源化抗体或嵌合抗体。优选地,抗体或蛋白质是人源化人抗体,更优选人源化沉默抗体。
[0103]
如本文所用,术语“沉默”抗体是指在测量靶细胞的细胞裂解的体外adcc活性测定中测量时显示无adcc活性或低adcc活性的抗体。
[0104]
在一个实施方案中,术语“无或低adcc活性”是指沉默抗体显示的adcc活性低于相
应野生型(非沉默)抗体,例如野生型人igg1抗体所观察到的adcc活性的50%、例如低于10%。优选地,与对照fab抗体相比,在使用沉默抗体的体外adcc活性测定中没有观察到可检测的adcc活性。
[0105]
沉默效应子功能可通过抗体的fc恒定部分中的突变获得且已描述于本领域中:strohl 2009(lala&n297a);baudino 2008,d265a(baudino et al.,j.immunol.181(2008):6664-69,strohl,co biotechnology 20(2009):685-91)。沉默igg1抗体的实例包含在igg1fc氨基酸序列(eu编号)中第234、235和/或331位处减少adcc的突变。另一种沉默igg1抗体包含n297a突变,其产生无糖基化或非糖基化抗体。
[0106]
cdr变体的序列可通过大多数保守性替换与亲本抗体序列的cdr序列不同,例如变体中所有或10个或更多个,例如9个、8个、7个、6个、5个、4个、3个、2个或1个或更多个替换是保守性氨基酸残基替代。在本公开上下文中,保守性替换可以定义为如下所反映的氨基酸类别内的替换:
[0107]
脂族残基i、l、v和m。
[0108]
环烯基相关残基f、h、w和y。
[0109]
疏水性残基a、c、f、g、h、i、l、m、r、t、v、w和y。
[0110]
带负电荷的残基d和e。
[0111]
极性残基c、d、e、h、k、n、q、r、s和t。
[0112]
带正电荷的残基h、k和r。
[0113]
小残基a、c、d、g、n、p、s、t和v。
[0114]
非常小的残基a、g和s。
[0115]
涉及转角的残基a、c、d、e、g、h、k、n,q、r、s、p和涉及形成的残基t。
[0116]
柔性残基q、t、k、s、g、p、d、e和r。
[0117]
更多的保守性替换分组包括:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸和天冬酰胺-谷氨酰胺。与本参考抗体的cdr相比,变体cdr基本上保留了在亲水(hydropathic)/亲水性质和残基重量/大小方面的保守性。本领域通常理解亲水氨基酸指数在赋予蛋白质相互作用的生物学功能方面的重要性。已经接受的是,氨基酸的相对亲水特性有助于所得蛋白质的二级结构,这又限定了蛋白质与其他分子(例如酶、底物、受体、dna、抗体、抗原等)的相互作用。根据它们的疏水性和电荷特征,为每种氨基酸指定了亲水指数,它们是:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸/胱氨酸(+2.5);蛋氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸(-3.5);谷氨酰胺(-3.5);天冬氨酸(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9)和精氨酸(-4.5)。类似残基的保留也可以或替代地通过相似性得分来测量,如使用blast程序来测定(例如,可通过ncbi获得的blast 2.2.8,使用标准设置blosum62,open gap=11和extended gap=1)。合适的变体通常表现出与亲本肽至少约70%的同一性。根据本公开,第一氨基酸序列与第二氨基酸序列具有至少70%同一性是指第一序列与第二氨基酸序列具有70;71;72;73;74;75;76;77;78;79;80;81;82;83;84;85;86;87;88;89;90;91;92;93;94;95;96;97;98;99或100%同一性。根据本公开,第一氨基酸序列与第二氨基酸序列具有至少50%同一性是指第一序列与第二氨基酸序列具有50;51;52;53;54;55;56;57;58;59;60;61;62;
63;64;65;66;67;68;69;70;71;72;73;74;75;76;77;78;79;80;81;82;83;84;85;86;87;88;89;90;91;92;93;94;95;96;97;98;99或100%同一性。
[0118]
在一些实施方案中,本公开的抗体是嵌合抗体,典型地是嵌合小鼠/人抗体。术语“嵌合抗体”是指包含来源于非人动物的抗体的vh结构域和vl结构域,人抗体的ch结构域和cl结构域的单克隆抗体。作为非人动物,可以使用任何动物(如小鼠、大鼠、仓鼠、兔等等)。特别地,所述小鼠/人嵌合抗体可以包含本参考抗体的vh和vl结构域。
[0119]
在一些实施方案中,本公开的抗体是人源化抗体。在具体实施方案中,本公开的抗体是包含本参考抗体的6个cdr的人源化抗体。本文所用的术语“人源化抗体”是指这样的抗体,其中与亲本免疫球蛋白(例如鼠cdr)相比,构架区(fr)已被修饰以包含来自不同物种(例如人物种)的供体免疫球蛋白的fr。
[0120]
在一些实施方案中,本公开的抗体选自下组:fab、f(ab')2、fab'和scfv。如本文所用,术语“fab”表示具有约50,000的分子量和抗原结合活性的抗体片段,其中在通过用蛋白酶木瓜蛋白酶处理igg获得的片段中,h链的n末端侧的约一半和整个l链通过二硫键结合在一起。术语“f(ab')2”是指具有约100,000的分子量和抗原结合活性的抗体片段,在通过用蛋白酶胃蛋白酶处理igg获得的片段中,所述抗原结合活性略大于通过铰链区的二硫键结合的fab。术语“fab”是指具有约50,000的分子量和抗原结合活性的抗体片段,其通过切割f(ab')的铰链区的二硫键获得。单链fv("scfv")多肽是共价连接的vh:vl异二聚体,其通常由包括通过编码肽的接头连接的vh和vl编码基因的基因融合体表达。本公开的人scfv片段包括优选通过使用基因重组技术保持适当构象的cdr。
[0121]
具有突变氨基酸序列的功能性变体抗体可以通过编码核酸分子的诱变(例如,定点诱变或pcr介导的诱变),随后使用本文所述的功能测定测试所编码的改变的抗体的保留功能来获得(即,上文所述的功能)。
[0122]
交叉竞争参考mab 5a12.2的抗体
[0123]
具有本文公开的参考抗体mab 5a12.2的类似有利特性的另外的抗体可以基于它们在标准nectin-4竞争结合测定(参见参考文献7)中以统计学显著的方式与所述参考抗体mab 5a12.2交叉竞争(例如竞争性抑制其结合)的能力来鉴定。
[0124]
在一些实施方案中,可以首先筛选测试抗体对nectin-4的结合亲和力,例如使用例如噬菌体展示技术来自人重组抗体文库或来自表达用nectin-4抗原免疫的人可变区抗体的转基因小鼠。
[0125]
测试抗体竞争结合或抑制本公开抗体与人nectin-4结合的能力表明测试抗体可以与该抗体竞争结合人nectin-4;根据非限制性理论,这种抗体可以与其竞争的抗体结合人nectin-4上相同或相关(例如,结构上相似或空间上接近)的表位。如本文所用,当在等摩尔浓度的竞争抗体存在下,竞争抗体抑制本公开的抗体或抗原结合片段与nectin-4的结合超过50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98或99%时,则抗体“竞争”结合。
[0126]
在一些实施方案中,本公开的抗体或抗原结合片段结合nectin-4的一个或多个表位。在一些实施方案中,本发明抗体或抗原结合片段结合的表位是线性表位。然而,本发明抗体或抗原结合片段结合的表位典型地是非线性构象表位。
[0127]
在一些实施方案中,根据本公开的抗体结合至与ha22-2mab(seattle genetics)或如wo2017042210和wo2018158398中公开的任何抗体(尤其是n41 mab和14a5.2 mab)不同的表位。典型地,本文公开的抗体不与ha22-2 mab(seattle genetics)或wo2017042210和wo2018158398中公开的任何抗体(特别是n41 mab和14a5.2mab)交叉竞争结合nectin-4。可以如实施例中所示进行交叉竞争性测定(参见材料和方法部分)。
[0128]
在一个实施方案中,本公开提供了与本公开的参考抗体结合相同表位的抗体(即:mab 5a12.2)。
[0129]
可以通过本领域已知的任何方法测定本公开抗体的特异性结合。对于表位结合可使用许多不同的竞争性结合测定形式。可以使用的免疫测定包括但不限于使用诸如蛋白质印迹、放射免疫测定、elisa、“夹心”免疫测定、免疫沉淀测定、沉淀素测定、凝胶扩散沉淀素测定、免疫放射测定、荧光免疫测定、蛋白质a免疫测定和补体固定测定等技术的竞争测定系统。此类测定是常规的并且是本领域熟知的(参见例如ausubel等,eds,1994current protocols in molecular biology,vol.1,john wiley&sons,inc.,new york)。
[0130]
例如,为了筛选抗nectin-4抗体结合相同表位或与参考抗体mab 5a12.2竞争结合细胞(如表达nectin-4的癌细胞系)的能力,可用饱和浓度的所述参考抗体染色。洗涤后,测试不同剂量的测试抗-nectin-4mab扫描以测试它们与参照抗体的竞争潜力。与参考抗体竞争相同结合位点的mab在这种参考抗体存在下将不能识别nectin-4。数据可以表示为平均荧光强度。
[0131]
本公开的抗体通过本领域已知的任何技术产生,例如但不限于单独或组合的任何化学、生物学、遗传学或酶学技术。典型地,已知所需序列的氨基酸序列的情况下,本领域技术人员可通过产生多肽的标准技术容易地产生所述抗体。例如,可以使用公知的固相方法合成它们,优选使用可商购的肽合成装置(例如由applied biosystems,foster city,california制造的那种)并按照制造商的说明书。或者,可以通过本领域熟知的重组dna技术合成本公开的抗体。例如,在将编码抗体的dna序列整合入表达载体并将这些载体引入将表达所需抗体的合适的真核或原核宿主中后,可以获得作为dna表达产物的抗体,之后可以使用已知技术分离它们。
[0132]
在一个实施方案中,本公开提供了分离的抗体,其交叉阻断或被参考mab 5a12.2交叉阻断与nectin-4的结合,其中所述抗体:
[0133]
(i)以小于10μg/ml,尤其小于1μg/ml,小于100ng/ml,小于10ng/ml或小于5ng/ml的表观亲和结合常数值(kd)(或ec50)结合nectin-4;
[0134]
(ii)在免疫组化(ihc)测定中结合nectin-4。更具体地,所述抗体在ihc测定中选择性地结合生物样品切片中的nectin-4。
[0135]
在具体实施方案中,本公开提供了与本文所述的参考mab 5a12.2结合相同表位的抗体。
[0136]
在具体实施方案中,本公开提供不与ha22-2mab(seattle genetics)或如wo2017042210和wo2018158398中公开的任何抗体(尤其是n41 mab和14a5.2 mab)竞争结合nectin-4的抗体。
[0137]
典型地,与根据本公开的参考mab 5a12.2竞争结合nectin-4的抗体仍保留参考抗体(例如:mab 5a12.2)的至少相当大的比例(至少约50%、60%、70%、80%、90%、95%或
100%)的亲和力和/或选择性,和在一些情况下可能与大于参考抗体(例如:mab 5a12.2)的亲和力、选择性和/或特异性相关。
[0138]
在某些实施方案中,与参考mab 5a12.2竞争结合nectin-4的交叉阻断抗体是嵌合抗体、人源化抗体或人重组抗体。
[0139]
产生单克隆抗体的转染瘤的产生
[0140]
本公开的抗体通过本领域已知的任何技术产生,例如但不限于单独或组合的任何化学、生物学、遗传学或酶学技术。典型地,已知所需序列的氨基酸序列的情况下,本领域技术人员可通过产生多肽的标准技术容易地产生所述抗体。例如,可以使用公知的固相方法合成它们,优选使用可商购的肽合成装置(例如由applied biosystems,foster city,california制造的那种)并按照制造商的说明书。或者,可以通过本领域熟知的重组dna技术合成本公开的抗体。例如,在将编码抗体的dna序列整合入表达载体并将这些载体引入将表达所需抗体的合适的真核或原核宿主中后,可以获得作为dna表达产物的抗体,之后可以使用已知技术分离它们。
[0141]
因此,本公开的进一步的目的涉及编码如表1所示的根据本公开的抗体的核酸分子。更特别地,核酸分子编码本公开的抗体的重链或轻链。更特别地,所述核酸分子包含与编码参考抗体5a12.2的重链可变区(vh区)或轻链可变区(vl)的相应核酸具有至少70%、80%、90%、95%或100%同一性的vh或vl编码区。
[0142]
典型地,所述核酸是dna或rna分子,其可以包含于任何合适的载体,例如质粒、粘粒、附加体、人工染色体、噬菌体或病毒载体。如本文所用,术语“载体”、“克隆载体”和“表达载体”是指可以将dna或rna序列(例如外源基因)引入宿主细胞,以转化宿主并促进引入序列的表达(例如转录和翻译)的介质。因此,本发明的另一个目的涉及包含本公开核酸的载体。此类载体可包含调控元件,例如启动子、增强子、终止子等,以在施用于受试者时引起或指导所述抗体的表达。用于动物细胞的表达载体的启动子和增强子的实例包括sv40的早期启动子和增强子、moloney小鼠白血病病毒的ltr启动子和增强子、免疫球蛋白h链的启动子和增强子等。可以使用用于动物细胞的任何表达载体,只要可以插入并且表达编码人抗体c区的基因。合适载体的实例包括page107、page103、phsg274、pkcr,psg1βd2-4等。质粒的其他实例包括含有复制起点的复制质粒,或整合质粒,例如puc、pcdna、pbr等。病毒载体的其他实例包括腺病毒、逆转录病毒、疱疹病毒和aav载体。此类重组病毒可通过本领域已知的技术产生,例如通过转染包装细胞或通过用辅助质粒或病毒进行瞬时转染。病毒包装细胞的典型实例包括pa317细胞、psicrip细胞、gpenv+细胞、293细胞等。用于产生这种复制缺陷型重组病毒的详细方案可以在例如wo 95/14785、wo 96/22378、us 5,882,877、us 6,013,516、us 4,861,719、us 5,278,056和wo 94/19478中找到。
[0143]
本发明的进一步方面涉及通过根据如上所述的核酸和/或载体转染、感染或转化的宿主细胞。如本文所用,术语“转化”是指将“外源”(即外部或细胞外)基因、dna或rna序列引入宿主细胞,使得宿主细胞将表达引入的基因或序列以产生所需的物质,典型地是由引入的基因或序列编码的蛋白质或酶。接受并表达引入的dna或rna的宿主细胞被“转化”。
[0144]
本文公开的核酸可用于在合适的表达系统中生产本公开的抗体。术语“表达系统”是指在合适条件下的宿主细胞和相容载体,例如,其用于表达由载体携带并引入宿主细胞的外源dna编码的蛋白质。常见的表达系统包括大肠杆菌宿主细胞和质粒载体、昆虫宿主细
胞和杆状病毒载体,以及哺乳动物宿主细胞和载体。宿主细胞的其他实例包括但不限于原核细胞(例如细菌)和真核细胞(例如酵母细胞、哺乳动物细胞、昆虫细胞、植物细胞等)。具体实例包括大肠杆菌、克鲁维酵母或酵母菌、哺乳动物细胞系(例如vero细胞、cho细胞、3t3细胞、cos细胞等)以及原代或已建立的哺乳动物细胞培养物(例如,由淋巴母细胞、成纤维细胞、胚胎细胞、上皮细胞、神经细胞、脂肪细胞等产生)。实例还包括小鼠sp2/0-ag14细胞(atcc crl1581)、小鼠p3x63-ag8.653细胞(atcc crl1580)、其中二氢叶酸还原酶基因(下文称为“dhfr基因”)有缺陷的cho细胞(urlaub g等;1980)、大鼠yb2/3hl.p2.g11.16ag.20细胞(atcc crl1662,以下称为“yb2/0细胞”)等。
[0145]
本发明还涉及用于生产表达根据本公开的抗体的重组宿主细胞的方法,所述方法包括以下步骤:(i)将如上所述的重组核酸或载体体外或离体引入感受态宿主细胞,(ii)体外或离体培养获得的重组宿主细胞,和(iii)任选地,选择表达和/或分泌所述抗体的细胞。这些重组宿主细胞可用于生产本发明的抗体。
[0146]
通过常规免疫球蛋白纯化方法,例如蛋白a-sepharose、羟磷灰石层析、凝胶电泳、透析或亲和层析适当地从培养基分离本公开的抗体。
[0147]
在一些实施方案中,本公开的人嵌合抗体可以通过以下产生:获得编码如前所述的vl和vh结构域的核酸序列,通过将它们插入具有编码人抗体ch和人抗体cl的基因的用于动物细胞的表达载体来构建人嵌合抗体表达载体,通过将表达载体引入动物细胞来表达编码序列。作为人嵌合抗体的ch结构域,可以是属于人免疫球蛋白的任何区域,但igg类的那些是合适的,并且也可以使用属于igg类的任何一个亚类,例如igg1、igg2、igg3和igg4。另外,作为人嵌合抗体的cl,可以是属于ig的任何区域,也可以使用κ类或λ类的那些。产生嵌合抗体的方法涉及常规重组dna,且基因转染技术是本领域熟知的(参见morrison sl等人(1984)和专利文献us5,202,238;和us5,204,244)。
[0148]
本发明的人源化抗体可以通过以下来制备:如前所述获得编码cdr结构域的核酸序列,通过将它们插入具有编码(i)与人抗体相同的重链恒定区和重链可变框架区和(ii)与人抗体相同的轻链恒定区和轻链可变框架区的基因的表达载体来构建人源化抗体表达载体,和通过将表达载体引入合适细胞系来表达基因。人源化抗体表达载体可以是以下任一类型:编码抗体重链的基因和编码抗体轻链的基因存在于不同的载体上,或两个基因存在于相同载体上(串联型)。就构建人源化抗体表达载体的容易性、引入细胞系的容易性和细胞系中抗体h链和l链的表达水平之间的平衡而言,优选串联型的人源化抗体表达载体。串联型人源化抗体表达载体的实例包括pkantex93(wo 97/10354)、pee18等。
[0149]
基于常规重组dna和基因转染技术产生人源化抗体的方法是本领域熟知的(参见例如,riechmann l.等1988;neuberger ms.等1985)。可以使用本领域已知的多种技术将抗体人源化,包括例如cdr-移植(ep 239,400;pct公开wo91/09967;美国专利号5,225,539;5,530,101;和5,585,089)、镶饰(veneering)或表面重塑(resurfacing)(ep 592,106;ep 519,596;padlan ea(1991);studnicka gm等(1994);roguska ma等(1994))和链替换(美国专利号5,565,332)。用于制备此类抗体的一般重组dna技术也是已知的(参见欧洲专利申请ep 125023和国际专利申请wo 96/02576)。
[0150]
本公开的fab可以通过用蛋白酶(木瓜蛋白酶)处理与amh特异性反应的抗体而获得。此外,可以通过以下来生产fab:将编码抗体fab的dna插入用于原核表达系统或用于真
核表达系统的载体,并将载体引入原核生物或真核生物(视情况而定)以表达fab。
[0151]
本公开的f(ab')2可以通过用蛋白酶(胃蛋白酶)处理与amh特异性反应的抗体而获得。此外,f(ab')2可以通过用硫醚键或二硫键结合下述fab'来制备。
[0152]
本公开的fab'可以通过用还原剂二硫苏糖醇处理与amh特异性反应的f(ab')2而获得。此外,可以通过以下来生产fab':将编码抗体的fab'片段的dna插入原核生物的表达载体或真核生物的表达载体中,并将载体引入原核生物或真核生物(视情况而定)以进行表达。
[0153]
可以通过以下来生产本公开的scfv:获得如前所述编码vh和vl结构域的cdna,构建编码scfv的dna,将dna插入原核生物的表达载体或真核生物的表达载体,然后将表达载体引入原核生物或真核生物(视情况而定)以表达scfv。
[0154]
为产生人源化scfv片段,可以使用称为cdr移植的公知技术,其涉及从供体scfv片段选择互补决定区(cdr),并将它们移植到已知三维结构的人scfv片段框架上(参见例如,wo98/45322、wo87/02671、us5,859,205、us5,585,089、us4,816,567、ep0173494)。
[0155]
本公开的工程化抗体包括其中对vh和/或vl内的框架残基进行修饰,以例如改善抗体性质的抗体。典型地,进行这样的框架修饰以降低抗体的免疫原性。例如,一种方法是将一个或多个框架残基“回复突变”到相应的种系序列。更具体地,已经历体细胞突变的抗体可以含有与衍生抗体的种系序列不同的框架残基。可以通过将抗体框架序列与衍生抗体的种系序列进行比较来鉴定这些残基。为了使框架区序列恢复其种系构型,可以通过例如定点诱变或pcr介导的诱变将体细胞突变“回复突变”至种系序列。这种“回复突变”抗体也涵盖在本公开中。另一种类型的框架修饰涉及突变框架区内或甚至一个或多个cdr区内的一个或多个残基,以去除t细胞表位,从而降低抗体的潜在免疫原性。该方法也称为“去免疫化”,并且在carr等的美国专利公开号20030153043中进一步详细描述。
[0156]
fc工程化
[0157]
本文公开的抗体的特征可在于上述方面的一个或多个功能或结构特征,或所选功能和结构特征的任何组合。
[0158]
本发明的抗体可以是任何同种型。同种型的选择典型地由期望的效应子功能(例如adcc沉默)来指导。示例性的同种型是iggl、igg2、igg3和igg4。可以使用人轻链恒定区中的任一个,κ或λ。如果需要,可以通过已知方法转换本公开抗体的类别。典型地,类别转换技术可用于将一个igg亚类转换成另一个,例如从igg1转变为igg2。因此,为各种治疗用途,本公开抗体的效应子功能可以通过同种型转换为例如igg1、igg2、igg3、igg4、igd、iga、ige或igm抗体来改变。在一些实施方案中,本发明公开的抗体是全长抗体。在一些实施方案中,全长抗体是igg1抗体。在一些实施方案中,全长抗体是igg4抗体。在一些实施方案中,nectin-4特异性igg4抗体是稳定的igg4抗体。合适的稳定化igg4抗体的实例是其中人igg4重链恒定区第409位的精氨酸(在如上kabat等人的eu索引中指出)被赖氨酸、苏氨酸、甲硫氨酸或亮氨酸取代,优选赖氨酸(描述于wo 2006033386)和/或其中铰链区包含cys-pro-pro-cys序列的抗体。wo2008145142中公开了其它合适的稳定化igg4抗体。
[0159]
在一些实施方案中,本公开的抗体不包含诱导抗体依赖性细胞毒性(adcc)的fc部分。术语“fc结构域”、“fc部分”和“fc区”是指抗体重链的c-末端片段,例如来自人γ重链的约氨基酸(aa)230至约aa450或其在其它类型的抗体重链中的对应序列(例如人抗体的α、δ、
ε和μ),或其天然存在的同种异型。除非另有说明,本公开通篇使用免疫球蛋白的普遍接受的kabat氨基酸编号(参见kabat et al.(1991)sequences of protein of immunological interest,5th ed.,united states public health service,national institute of health,bethesda,md)。在一些实施方案中,本公开的抗体不包含能够基本上结合fcgriiia(cd16)多肽的fc结构域。在一些实施方案中,本公开的抗体缺乏fc结构域(例如缺乏ch2和/或ch3结构域)或包含igg2或igg4同种型的fc结构域。在一些实施方案中,本公开的抗体包含fab、fab'、fab'-sh、f(ab')2、fv、双抗体、单链抗体片段或包含多个不同抗体片段的多特异性抗体或由其组成。在一些实施方案中,本公开的抗体不与毒性部分连接。在一些实施方案中,选自氨基酸残基的一个或多个氨基酸可以被不同的氨基酸残基替代,使得抗体具有改变的c2q结合和/或降低或消除的补体依赖性细胞毒性(cdc)。在美国专利no.6,194,551中更详细地描述了这种方法。
[0160]
本公开预期的本发明抗体的另一种修饰是聚乙二醇化。可以将抗体聚乙二醇化以例如增加抗体的生物(例如血清)半衰期。为了使抗体聚乙二醇化,典型地在其中一个或多个peg基团与抗体或抗体片段连接的条件下,将抗体或其片段与聚乙二醇(peg),例如peg的反应性酯或醛衍生物反应。聚乙二醇化可以通过与反应性peg分子(或类似的反应性水溶性聚合物)的酰化反应或烷基化反应来进行。如本文所用,术语“聚乙二醇”旨在涵盖用于衍生其他蛋白质的peg的任何形式,例如单(c1-c10)烷氧基-或芳氧基-聚乙二醇或聚乙二醇-马来酰亚胺。在一些实施方案中,待聚乙二醇化的抗体是无糖基化的抗体。使蛋白质聚乙二醇化的方法是本领域已知的,并且可以应用于本公开的抗体。参见例如nishimura等的ep0154316和ishikawa等的ep0401384。
[0161]
本文预期的抗体的另一种修饰是将至少本公开抗体的抗原结合区与血清蛋白(例如人血清白蛋白)或其片段偶联或蛋白融合,以增加所得分子的半衰期。
[0162]
在一些实施方案中,本公开还提供多特异性抗体。本公开的多特异性抗体分子的示例性形式包括但不限于(i)通过化学异质偶联交联的两种抗体,一种具有对nectin-4的特异性,另一种具有对第二抗原的特异性;(ii)单一抗体,其包含两个不同抗原结合区;(iii)单链抗体,其包含两个不同的抗原结合区,例如通过额外的肽接头串联连接的两个scfv;(iv)双可变结构域抗体(dvd-ig),其中每个轻链和重链含有通过短肽键串联的两个可变结构域(wu et al.,generation and characterization of a dual variable domain immunoglobulin(dvd-ig
tm
)molecule,in:antibody engineering,springer berlin heidelberg(2010));(v)化学连接的双特异性(fab')2片段;(vi)tandab,其是两个单链双抗体的融合体,产生具有针对每种靶抗原的两个结合位点的四价双特异性抗体;(vii)flexibody,其是scfv与双抗体的组合,产生多价分子;(viii)所谓的“对接和锁定”分子,其基于蛋白激酶a中的“二聚化和对接结构域”,当应用于fab时,其可产生由连接至不同fab片段的两个相同fab片段组成的三价双特异性结合蛋白;(ix)所谓的scorpion分子,其包含例如与人fab-臂的两个末端融合的两个scfv;和(x)双抗体。双特异性抗体的另一种示例性形式是具有互补ch3结构域以迫使异二聚化的igg样分子。这种分子可以使用已知技术制备,例如已知为triomab/quadroma(trion pharma/fresenius biotech)、knob-into-hole(genentech)、crossmab(roche)and electrostatically-matched(amgen)、luz-y(genentech)、strand exchange engineered domain body(seedbody)(emd serono)、
biclonic(merus)和duobody(genmab a/s)技术的那些。在一些实施方案中,典型地使用duobody技术,通过受控fab臂交换获得或可获得双特异性抗体。在wo2008119353和wo2011131746(均genmaba/s)中描述了通过受控的fab-臂交换生产双特异性抗体的体外方法。在wo2008119353中描述的一个示例性方法中,双特异性抗体通过在还原条件下孵育时,在两个均包含igg4样ch3区的单特异性抗体之间的“fab-臂”或“半分子”交换(重链和连接的轻链的交换)而形成。所得产物是具有两个fab臂的双特异性抗体,其可包含不同的序列。在wo2011131746中描述的另一示例性方法中,本公开的双特异性抗体通过包括以下步骤的方法制备,其中第一和第二抗体中的至少一种是本公开的抗体:a)提供包含免疫球蛋白的fc区的第一抗体,所述fc区包含第一ch3区;b)提供包含免疫球蛋白的fc区的第二抗体,所述fc区包含第二ch3区;其中所述第一和第二ch3区的序列不同,并且使得所述第一和第二ch3区之间的异二聚体相互作用强于所述第一和第二ch3区的每个同二聚体相互作用;c)在还原条件下将所述第一抗体与所述第二抗体一起孵育;和d)获得所述双特异性抗体,其中第一抗体是本公开的抗体并且第二抗体具有不同的结合特异性,或反之亦然。还原条件可以例如通过加入还原剂来提供,所述还原剂例如选自2-巯基乙胺、二硫苏糖醇和三(2-羧乙基)膦。步骤d)还可以包括例如通过除去还原剂(例如通过脱盐)将条件恢复成非还原或较少还原。优选地,第一和第二ch3区的序列是不同的,仅包含几个相当保守的不对称突变,使得所述第一和第二ch3区之间的异二聚体相互作用强于所述第一和第二ch3区的每个同二聚体相互作用。在wo2011131746中提供了关于这些相互作用以及如何实现它们的更多细节,在此通过引用将其全文并入。以下是这些不对称突变的组合的示例性实施方案,任选地其中一个或两个fc-区具有igg1型。
[0163]
抗体-药物偶联物
[0164]
在一些实施方案中,本发明的抗体与治疗部分即药物偶联。治疗部分可以是例如细胞毒素、化学治疗剂、细胞因子、免疫抑制剂、免疫刺激剂、裂解肽或放射性同位素。此类偶联物在本文中称为“抗体-药物偶联物”或“adc”。
[0165]
在一些实施方案中,抗体与细胞毒性部分偶联。细胞毒性部分可以例如选自下组:紫杉醇;细胞松弛素b;短杆菌肽d;溴化乙锭;吐根碱;丝裂霉素;依托泊苷;替尼泊苷;长春新碱;长春碱;秋水仙碱;多柔比星;柔红霉素;二羟基蒽二酮;微管蛋白抑制剂(如美登素)或其类似物或衍生物;抗有丝分裂剂(如单甲基奥瑞他汀e或f)或其类似物或衍生物;海兔毒素10或15或其类似物;伊立替康或其类似物;米托蒽醌;光辉霉素;放线菌素d;1-脱氢睾酮;糖皮质激素;普鲁卡因;丁卡因;利多卡因;普萘洛尔;嘌呤霉素;卡奇霉素或其类似物或衍生物;抗代谢物,如甲氨喋呤、6巯基嘌呤、6硫鸟嘌呤、阿糖胞苷、氟达拉滨、5氟尿嘧啶、氨烯咪胺、羟基脲、天冬酰胺酶、吉西他滨或克拉屈滨;烷化剂,如二氯甲基二乙胺、硫代嘌呤、苯丁酸氮芥、美法仑、卡莫司汀(bsnu)、洛莫司汀(ccnu)、环磷酰胺、白消安、二溴甘露醇、链脲佐菌素、达卡巴嗪(dtic)、丙卡巴嗪、丝裂霉素c;铂类衍生物,如顺铂或卡铂;多卡霉素a、多卡霉素sa、雷切霉素(cc-1065)或其类似物或衍生物;抗生素,如放线菌素、博来霉素、柔红霉素、多柔比星、伊达比星、光霉素、丝裂霉素、米托蒽醌、普力霉素、安定霉素(amc);吡咯并[2,1-c][1,4]-苯并二氮杂卓(pdb);白喉毒素及相关分子如白喉a链及其活性片段和杂合分子、蓖麻毒素如蓖麻毒素a或去糖基化蓖麻毒素a链毒素、霍乱毒素、志贺样毒素如slt i、slt ii、slt iiv、lt毒素、c3毒素、志贺毒素、百日咳毒素、破伤风毒素、大豆bowman-birk
蛋白酶抑制剂、假单胞菌外毒素、阿罗林、皂草素、蒴莲根毒素、胶凝蛋白、相思豆毒素a链、蒴莲根毒素a链、α-八叠球菌(alpha-sarcin)、油桐(aleurites fordii)蛋白、石竹素蛋白、美洲商陆蛋白(如papi、papii和pap-s)、苦瓜(momordica charantia)抑制剂、泻果素、巴豆毒素、肥阜草(sapaonaria officinalis)抑制剂、白树毒素、米托菌素(mitogellin)、局限曲菌素、酚霉素和依诺霉素毒素;核糖核酸酶(rnase);dnase i、葡萄球菌内毒素a;商陆抗病毒蛋白;白喉毒素和假单胞菌内毒素。
[0166]
在一些实施方案中,所述抗体与奥瑞他汀或其肽类似物、衍生物或前药偶联。奥瑞他汀已经显示干扰微管动力学、gtp水解以及核和细胞分裂(woyke et al(2001)antimicrob.agents and chemother.45(12):3580-3584)并具有抗癌(us 5663149)和抗真菌活性(pettit et al,(1998)antimicrob.agents and chemother.42:2961-2965)。例如,奥瑞他汀e可与对乙酰基苯甲酸或苯甲酰戊酸反应以分别产生aeb和aevb。其它典型的奥瑞他汀衍生物包括afp、mmaf(单甲基奥瑞他汀f)和mmae(单甲基奥瑞他汀e)。合适的奥瑞他汀和奥瑞他汀类似物、衍生物和前药以及用于将奥瑞他汀偶联至ab的合适接头描述于例如美国专利号5,635,483、5,780,588和6,214,345以及国际专利申请公开wo02088172、wo2004010957、wo2005081711、wo2005084390、wo2006132670、wo03026577、wo200700860、wo207011968和wo205082023中。
[0167]
在一些实施方案中,抗体与mertansine(也称为emtansine或dm1)或其肽类似物、衍生物或前药偶联。mertansine是微管蛋白抑制剂,意味着它通过与微管蛋白结合来抑制微管的组装。
[0168]
在一些实施方案中,抗体与吡咯并[2,l-c][l,4]-苯并二氮杂卓(pdb)或其类似物、衍生物或前药偶联。合适的pdb和pdb衍生物以及相关技术描述于例如hartley j.a.et al,cancer res 2010;70(17):6849-6858;antonow d.et al,cancer j 2008;14(3):154-169;howard p.w.et al,bioorg med chemlett 2009;19:6463-6466和sagnou et al,bioorg med chemlett 2000;10(18):2083-2086。
[0169]
在一些实施方案中,所述抗体与细胞毒性部分偶联,所述细胞毒性部分选自下组:蒽环霉素、美登素、卡奇霉素、多卡霉素、雷切霉素(cc-1065)、海兔毒素10、海兔毒素15、依立替康、单甲基奥瑞他汀e、单甲基奥瑞他汀f、pdb或其任何类似物、衍生物或前药。
[0170]
在一些实施方案中,抗体与蒽环霉素或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与美登素或其类似物、衍生物或前药偶联。在一些实施方案中,所述抗体与卡奇霉素或其类似物、衍生物或前药偶联。在一些实施方案中,所述抗体与多卡霉素或其类似物、衍生物或前药偶联。在一些实施方案中,所述抗体与雷切霉素(cc-1065)或其类似物、衍生物或前药偶联。在一些实施方案中,所述抗体与海兔毒素10或其类似物、衍生物或前药偶联。在一些实施方案中,所述抗体与海兔毒素15或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与单甲基奥瑞他汀e或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与单甲基奥瑞他汀f或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与吡咯并[2,l-c][l,4]-苯并二氮杂卓(pdb)或其类似物、衍生物或前药偶联。在一些实施方案中,抗体与伊立替康或其类似物、衍生物或前药偶联。
[0171]
在一些实施方案中,抗体与核酸或核酸相关分子偶联。在一个这种实施方案中,偶联的核酸是细胞毒性核糖核酸酶(rnase)或脱氧核糖核酸酶(例如dnase i)、反义核酸、抑
制性rna分子(例如sirna分子)或免疫刺激性核酸(例如含免疫刺激性cpg基序的dna分子)。在一些实施方案中,抗体与适体或核酶偶联。
[0172]
在一些实施方案中,抗体例如作为融合蛋白与裂解肽(例如clip、马加宁2、蜂毒肽、天蚕素和p18)偶联。
[0173]
在一些实施方案中,抗体与细胞因子(例如il-2、il-4、il-6、il-7、il-10、il-12、il-13、il-15、il-18、il-23、il-24、il-27、il-28a、il-28b、il-29、kgf、ifna、ifn3、ifny、gm-csf、cd40l、flt3配体、干细胞因子、安西司亭和tnfa)偶联。
[0174]
在一些实施方案中,抗体与放射性同位素或含放射性同位素的螯合物偶联。例如,抗体可以与允许抗体与放射性同位素络合的螯合剂接头(例如dota、dtpa或噻西坦)偶联。抗体还可以或可选地包含一个或多个放射性标记的氨基酸或其他放射性标记的分子或与之偶联。放射性同位素的非限制性实例包括3h、
14
c、
15
n、
35
s、
90
y、"tc、
125
i、
131
i、
186
re、
213
bi、
225
ac和
227
th。为了治疗目的,可以使用发射β或α颗粒辐射的放射性同位素,例如131i、90y、211at、212bi、67cu、186re、188re和212pb。
[0175]
用于将分子与抗体偶联的技术是本领域公知的(参见例如,monoclonal antibodies and cancer therapy(reisfeld等编辑,alan r.liss,inc.,1985)中的arnon等,“monoclonal antibodies for immunotargeting of drugs in cancer therapy”;controlled drug delivery(robinson等编辑,marcel deiker,inc.,2nd ed.1987)中的hellstrom等,“antibodies for drug delivery”;monoclonal antibodies'84:biological and clinical applications(pinchera等编辑,1985)中的thorpe,“antibody carriers of cytotoxic agents in cancer therapy:a review”;monoclonal antibodies for cancer detection and therapy(baldwin等编辑,academic press,1985)中的“analysis,results,and future prospective of the therapeutic use of radiolabeled antibody in cancer therapy”;和thorpe等,1982,immunol.rev.62:119-58。还参见例如pct公开wo 89/12624)。典型地,核酸分子分别通过n-羟基琥珀酰亚胺酯或马来酰亚胺官能团与抗体上的赖氨酸或半胱氨酸共价连接。已经报道了使用工程化半胱氨酸或掺入非天然氨基酸的偶联方法可改善偶联物的同质性(axup,j.y.,bajjuri,k.m.,ritland,m.,hutchins,b.m.,kim,c.h.,kazane,s.a.,halder,r.,forsyth,j.s.,santidrian,a.f.,stafin,k.等(2012).synthesis of site-specific antibody-drug conjugates using unnatural amino acids.proc.natl.acad.sci.usa 109,16101
–
16106.;junutula,j.r.,flagella,k.m.,graham,r.a.,parsons,k.l.,ha,e.,raab,h.,bhakta,s.,nguyen,t.,dugger,d.l.,li,g.等(2010).engineered thio-trastuzumab-dm1 conjugate with an improved therapeutic index to target humanepidermal growth factor receptor 2-positive breast cancer.clin.cancer res.16,4769
–
4778.)。junutula等(2008)开发了称为“thiomab”(tdc)的基于半胱氨酸的位点特异性偶联物,据称与常规偶联方法相比显示出改善的治疗指数。已经探索了已掺入抗体中的非天然氨基酸与adc的偶联;然而,这种方法的普遍性尚未确定(axup等,2012)。特别地,本领域技术人员还可以设想用以下工程化的含fc多肽:含有酰基供体谷氨酰胺的标签(例如,含有gin的肽标签或q-标签)或通过多肽工程(例如,通过多肽上的氨基酸缺失、插入、取代或突变)使其具有反应性的内源性谷氨酰胺来工程化含有fc的多肽。然后,转谷氨酰胺酶可以与胺供体剂
(例如,包含或连接到反应性胺的小分子)共价交联,以形成稳定且均质的工程化的含fc多肽偶联物群,其中胺供体剂通过含有酰基供体谷氨酰胺的标签或可接近/暴露/反应性内源性谷氨酰胺位点特异性地与含fc多肽偶联(wo 2012059882)。
[0176]
药物组合物
[0177]
在另一个方面,本公开提供了组合物,例如药物组合物,其含有与药学上可接受的载体一起配制的本文公开的至少一种抗体。这样的组合物可以包括如上所述的一种抗体或(例如,两种或更多种不同的)抗体组合。本文公开的药物组合物也可在组合疗法中施用,即与其它试剂组合。
[0178]
例如,本公开的抗体典型地可与至少一种抗病毒剂、抗炎剂或另一种抗增殖剂组合。可用于组合疗法的治疗剂的实例在下文关于本公开的抗体的用途的部分中更详细地描述。
[0179]
如本文所用,“药学上可接受的载体”包括生理学上相容的任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。载体应适于静脉内、肌内、皮下、肠胃外、脊柱或表皮施用(例如,通过注射或输注)。在一个实施方案中,所述载体应适于皮下途径。
[0180]
根据施用途径,活性化合物(即抗体)可以用材料包衣以保护化合物免受可以使化合物失活的酸和其它天然条件的作用。药物组合物的形式、施用途径、剂量和方案自然取决于待治疗的病症、疾病的严重程度、患者的年龄、体重和性别等。
[0181]
本公开的药物组合物可以配制用于局部、口服、肠胃外、鼻内、静脉内、肌内、皮下或眼内施用等。
[0182]
嵌合抗原受体(car)
[0183]
本发明还提供了嵌合抗原受体(car),其包含本公开抗体的抗原结合结构域。典型地,所述嵌合抗原受体包含本公开抗体的至少一个vh和/或vl序列。本公开的嵌合抗原受体还包含细胞外铰链结构域、跨膜结构域和细胞内t细胞信号传导结构域。
[0184]
如本文所用,术语“嵌合抗原受体”或“car”具有其在本领域中的一般含义,是指人工构建的杂合蛋白或多肽,其含有与t细胞信号传导结构域连接的抗体(例如,scfv)的抗原结合结构域。car的特征包括利用单克隆抗体的抗原结合特性,以非mhc限制性方式将t细胞特异性和反应性重新定向到选定靶标的能力。非mhc限制性抗原识别为表达car的t细胞提供不依赖于抗原加工而识别抗原的能力,从而绕过肿瘤逃逸的主要机制。此外,当在t细胞中表达时,car有利地不与内源性t细胞受体(tcr)α和β链二聚化。
[0185]
在一些实施方案中,本公开提供包含抗原结合结构域的car,所述抗原结合结构域包含n41 mab抗体的单链可变片段(scfv),或由其组成或基本上由其组成。在一些实施方案中,抗原结合结构域包含接头肽。接头肽可位于轻链可变区和重链可变区之间。
[0186]
在一些实施方案中,car包含细胞外铰链结构域、跨膜结构域和选自cd28、4-1bb和cd3ζ细胞内结构域的细胞内t细胞信号传导结构域。cd28是t细胞共刺激中重要的t细胞标志物。4-1bb向t细胞传递有效的共刺激信号,促进t淋巴细胞的分化并增强其长期存活。cd3ζ与tcr结合产生信号,并含有基于免疫受体酪氨酸的活化基序(itam)。
[0187]
在一些实施方案中,本公开的嵌合抗原受体可以是糖基化的、酰胺化的、羧化的、磷酸化的、酯化的、n-酰化的、通过例如二硫桥环化的,或转化成酸加成盐和/或任选地二聚
化或聚合。
[0188]
本公开还提供编码本公开的嵌合抗原受体的核酸。在一些实施方案中,如上所述将核酸整合入载体。
[0189]
本公开还提供宿主细胞,其包含编码本公开的嵌合抗原受体的核酸。尽管宿主细胞可以是任何细胞类型,可以源自任何类型的组织,并且可以是任何发育阶段,宿主细胞是例如从外周血淋巴细胞(pbl)或外周血单核细胞(pbmc)中分离的t细胞。在一些实施方案中,t细胞可以是任何t细胞,例如培养的t细胞,例如原代t细胞,或来自培养的t细胞系的t细胞,例如jurkat、supt1等,或从哺乳动物获得的t细胞。如果从哺乳动物获得,t细胞可以从许多来源获得,包括但不限于血液、骨髓、淋巴结、胸腺或其他组织或液体。也可以富集或纯化t细胞。t细胞可以是任何类型的t细胞,并且可以是任何发育阶段,包括但不限于cd4+/cd8+双阳性t细胞、cd4+辅助t细胞例如th2细胞、cd8+t细胞(例如细胞毒性t细胞)、肿瘤浸润细胞、记忆t细胞、初始t细胞等。t细胞可以是cd8+t细胞或cd4+t细胞。
[0190]
如上所述制备的那些t细胞群可用于根据已知技术的过继性免疫疗法的方法和组合物中,或基于本公开内容对本领域技术人员显而易见的其变体中。参见例如,gruenberg等的美国专利申请公开号2003/0170238;还参见rosenberg的美国专利号4,690,915。癌症的过继性免疫疗法是指其中向携带肿瘤的宿主施用具有抗肿瘤反应性的免疫细胞的治疗方法,目的是细胞直接或间接介导已形成的肿瘤的消退。淋巴细胞,特别是t淋巴细胞的输注属于这一类。目前,大多数过继性免疫疗法是使用患者自身免疫细胞进行治疗的自体淋巴细胞疗法(alt)。这些疗法涉及处理患者自身的淋巴细胞,以增强免疫细胞介导的反应或识别机体内的特定抗原或外来物质,包括癌细胞。通过移除患者的淋巴细胞并将这些细胞体外暴露于生物制剂和药物以激活细胞的免疫功能来完成治疗。一旦自体细胞被激活,将这些离体的活化细胞重新输入患者体内以增强免疫系统,从而治疗癌症。在一些实施方案中,通过首先从其培养基中收获细胞,然后将细胞洗涤并以治疗有效量浓缩在适于施用的介质和容器系统(“药学上可接受的”载体)中来配制细胞。合适的输注介质可以是任何等渗介质制剂,典型地是生理盐水、normosol r(abbott)或plasma-lyte a(baxter),但也可以使用5%葡萄糖水溶液或林格氏乳酸盐。输注介质可以补充有人血清白蛋白。组合物中细胞的治疗有效量取决于具有所需特异性的t细胞的相对代表性、接受者的年龄和体重、靶向病症的严重程度和靶向ag的免疫原性。这些细胞量可低至约103/kg,优选5
×
103/kg;高达107/kg,优选108/kg。细胞数量将取决于组合物的最终用途,其中包含的细胞类型也是如此。例如,如果需要对特定ag具有特异性的细胞,那么该群体将含有大于70%,通常大于80%、85%和90-95%的此类细胞。对于本文提供的用途,细胞的体积通常为1升或更小,可以是500ml或更少,甚至250ml或100ml或更少。临床相关数量的免疫细胞可以分摊到累积等于或超过所需细胞总量的多次输注中。
[0191]
特别地,本公开的细胞特别适用于治疗癌症。因此,本公开的另一个目的涉及治疗有需要的受试者中的癌症的方法,其包括向受试者施用治疗有效量的本发明的细胞群。
[0192]
本发明的用途和方法
[0193]
本公开的抗体或蛋白质具有体外和体内诊断和治疗用途。例如,可以将这些分子施用于培养物中的细胞,例如体外或体内,或施用于受试者,例如体内,以治疗、预防或诊断疾病。
[0194]
所述方法特别适用于治疗、预防或诊断nectin-4相关疾病,特别适用于治疗、预防或诊断癌症。
[0195]
本公开还涉及制备用于预防或治疗癌症的药物的方法,所述药物包含先前章节中所述的抗nectin-4抗体或car。
[0196]
本文所用的“nectin-4相关病症”包括与异常nectin-4表达水平相关或以异常nectin-4表达水平为特征的病症和/或疾病。在一些实施方案中,“nectin-4相关病症”包括涉及表达nectin-4的细胞的病症。
[0197]
在一些实施方案中,本公开提供了通过使细胞与本公开的抗体接触来杀死表达nectin-4的细胞的方法。在一些实施方案中,本公开提供了用于杀死表达nectin-4的细胞的方法,其通过在能够诱导fc-介导的效应细胞应答(如cdc、adcc或adcp应答)的效应细胞存在下,使细胞与本公开的抗体接触。在该实施方案中,抗体典型地是全长的,并且是导致cdc或adcc应答的同种型,例如igg1同种型。在一些实施方案中,本公开提供了通过使细胞与本公开的adc接触来杀死表达nectin-4的细胞的方法。
[0198]
在一些实施方案中,本公开的抗体特别适用于治疗癌症。过度表达nectin-4的癌细胞实际上是本公开的抗体的良好靶标,因为每个细胞可结合更多的抗体。因此,在一个方面,涉及表达nectin-4的细胞的病症是癌症,即肿瘤发生性病症,例如特征在于存在表达nectin-4的肿瘤细胞的病症,包括例如其中细胞来自实体瘤或血液肿瘤的病症。特别地,本公开的抗体可用于治疗与nectin-4表达、过表达或活化相关的过度增殖性疾病。特别地,本公开的抗体特别适用于治疗乳腺癌、卵巢癌、膀胱癌、胰腺癌和肺癌或癌。本文所用的术语“乳腺癌”包括但不限于所有发展阶段的所有类型的乳腺癌,如转移性乳腺癌或乳腺癌。特别地,乳腺癌选自三阴性乳腺癌(tnbc),其通过雌激素和孕酮受体和人表皮生长因子受体-2(her2)的阴性免疫组织化学染色来区分,并且占所有乳腺癌的15%。本文所用的术语“卵巢癌”包括但不限于所有发展阶段的所有类型的卵巢癌,如转移性卵巢癌或卵巢癌。本文所用的术语“肺癌”包括但不限于所有发展阶段的所有类型的肺癌,如肺癌转移性肺癌、非小细胞肺癌或小细胞肺癌。
[0199]
在一些实施方案中,本公开的抗体特别适用于治疗转移性癌症。
[0200]
如本文所用,术语“治疗”是指预防或预防性治疗以及治愈性或疾病改善性治疗,包括治疗处于患病风险或怀疑患有该疾病的受试者以及生病或被诊断为患有疾病或医学病症的受试者,包括抑制临床复发。可以向患有医学病症或最终可能患有病症的受试者施用治疗,以预防、治愈、延迟病症或复发病症的一种或多种症状的发作、降低病症或复发病症的一种或多种症状的严重程度或缓解病症或复发病症的一种或多种症状,或者为了延长受试者的存活期超过在没有这种治疗的情况下预期的存活期。“治疗方案”是指疾病的治疗模式,例如治疗期间使用的剂量模式。治疗方案可包括诱导方案和维持方案。短语“诱导方案”或“诱导期”是指用于疾病初始治疗的治疗方案(或治疗方案的一部分)。诱导方案的一般目标是在治疗方案的初始阶段向受试者提供高水平的药物。诱导方案可以采用(部分或全部)“加载方案”,其可以包括施用比医生在维持方案期间使用的更大剂量的药物,比医生在维持方案期间更频繁地施用药物,或两者。短语“维持方案”或“维持期”是指用于在治疗疾病期间维持受试者,例如使受试者长期(数月或数年)保持缓解的治疗方案(或治疗方案的一部分)。维持方案可以采用连续治疗(例如以规律的间隔(例如每周、每月、每年等)施用
药物)或间歇治疗(例如中断治疗、间歇治疗、复发治疗或实现特定的预定标准(例如疾病表现等)时的治疗)。
[0201]
如本文所用,术语“治疗有效量”是指在必要的剂量和时间段内有效实现所需治疗结果的量。治疗有效量的本公开抗体可根据诸如以下因素而变化:个体的疾病状态、年龄、性别和体重,以及本公开的抗体在个体中引发所需应答的能力。治疗有效量也是其中治疗有益效果超过抗体或抗体部分的任何毒性或有害作用的量。本公开抗体的有效剂量和剂量方案取决于待治疗的疾病或病症,并且可由本领域技术人员确定。具有本领域普通技术的医生可以容易地确定和开出所需药物组合物的有效量。例如,医生可以以低于实现所需治疗效果所需的水平开始在药物组合物中使用的本公开抗体的剂量,并逐渐增加剂量直至达到所需效果。通常,本公开组合物的合适剂量将是这样:化合物的量是根据特定剂量方案有效产生治疗效果的最低剂量。这种有效剂量通常取决于上述因素。例如,用于治疗用途的治疗有效量可以通过其稳定疾病进展的能力来测量。典型地,化合物治疗自身免疫性疾病的能力例如在预测治疗自身免疫性疾病的功效的动物模型系统中评估。或者,组合物的这种性质可以通过熟练医生已知的体外测定法检查化合物抑制诱导免疫应答的能力来评估。治疗有效量的治疗化合物可以减小免疫或炎性应答,或减轻受试者的症状。本领域普通技术人员将能够基于诸如以下因素来测定这样的量:受试者的大小、受试者症状的严重性和所选择的特定组合物或施用途径。本公开抗体的治疗有效量的示例性、非限制性范围是约0.1-100mg/kg、例如约0.1-50mg/kg、例如约0.1-20mg/kg、例如约0.1-10mg/kg、例如约0.5、约0.3、约1、约3mg/kg、约5mg/kg或约8mg/kg。本公开抗体的治疗有效量的示例性、非限制性范围是0.02-100mg/kg、例如约0.02-30mg/kg、例如约0.05-10mg/kg或0.1-3mg/kg,例如约0.5-2mg/kg。可以例如静脉内、肌肉内、腹膜内或皮下施用,例如在靶标位点附近施用。调整上述治疗方法和用途中的剂量方案以提供最佳的所需反应(例如治疗反应)。例如,可以施用单次推注,可以随时间施用几个分开的剂量,或者可以根据治疗情况的紧急程度按比例减少或增加剂量。在一些实施方案中,在治疗期间,例如在预定义的时间点监测治疗功效。在一些实施方案中,可通过疾病区域的可视化或通过本文进一步描述的其他诊断方法监测功效,例如,通过使用例诸如本发明的标记抗体、衍生自本公开抗体的片段或小抗体进行一次或多次pet-ct扫描。如果需要,药物组合物的有效每日剂量可以作为两个、三个、四个、五个、六个或更多个亚剂量(任选地,以单位剂型),在一天中以适当的间隔分开施用。在一些实施方案中,本公开的挺热闹单克隆抗体通过长时间,例如超过24小时的缓慢连续输注施用,以使任何不希望的副作用最小化。还可以使用每周、每两周或每三周一次的给药期来施用有效剂量的本公开抗体。给药期可以限制在例如8周、12周或直到建立临床进展。作为非限制性实例,在治疗开始后的第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40天的至少一天,或在第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20周的至少一周,或其任意组合,每24、12、8、6、4或2小时使用单次或分次剂量,或其任何组合,可以用每日剂量为以下含量的本公开抗体提供根据本公开的治疗:每天约0.1-100mg/kg,例如0.2、0.5、0.9、1.0、1.1、1.5、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40、45、50、60、70、80、90或100mg/kg。
[0202]
本公开还提供了治疗应用,其中本公开的抗体与用于如上所述待治疗的疾病或病
症相关的至少一种其他治疗剂组合使用。这种施用可以是同时的、分开的或依次的。对于同时施用,根据需要试剂可以作为一个组合物或作为单独的组合物施用。其他治疗剂典型地与待治疗的病症有关。示例性治疗剂包括其他抗癌抗体或adc、细胞毒性剂、免疫疗法、化疗剂、抗血管生成剂、抗癌免疫原、细胞周期控制/凋亡调节剂、激素调节剂和下述其他试剂。
[0203]
典型地,本公开的抗体以药物组合物的形式向受试者施用,所述药物组合物包含药学上可接受的载体。可用于这些组合物的药学上可接受的载体包括但不限于:离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白(例如人血清白蛋白)、缓冲物质(例如磷酸盐)、甘氨酸、山梨酸、山梨酸钾、饱和植物脂肪酸的部分甘油酯混合物、水、盐或电解质如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐、胶体二氧化硅、三硅酸镁、聚乙烯吡咯烷酮、纤维素基物质、聚乙烯乙二醇、羧甲基纤维素钠、聚丙烯酸酯、蜡、聚乙烯-聚氧丙烯-嵌段聚合物、聚乙二醇和羊毛脂。为了用于向患者施用,将组合物配制成用于向患者施用。本公开的组合物可以通过以下施用:口服、胃肠外、通过吸入喷雾、局部、直肠、经鼻、经颊、阴道或通过植入型药盒。本文使用的包括皮下、静脉内、肌肉内、关节内、滑膜内、胸骨内、鞘内、肝内、病灶内和颅内注射或输注技术。本公开组合物的无菌可注射形式可以是水性或油性悬浮液。可以根据本领域已知的技术使用合适的分散剂或润湿剂和悬浮剂配制这些悬浮液。无菌可注射制剂还可以是在无毒的肠胃外可接受的稀释剂或溶剂中的无菌可注射溶液或悬浮液,例如作为1,3-丁二醇溶液。可以使用的可接受载体和溶剂包括水、林格氏溶液和等渗氯化钠溶液。另外,无菌的固定油通常用作溶剂或悬浮介质。为此目的,可以使用任何温和的固定油,包括合成的甘油单酯或甘油二酯。与天然的药学上可接受的油,例如橄榄油或蓖麻油,尤其是它们的聚氧乙基化形式一样,脂肪酸,例如油酸及其甘油酯衍生物可用于制备注射剂。这些油溶液或悬浮液还可含有长链醇类稀释剂或分散剂,例如羧甲基纤维素或通常用于配制药学上可接受的剂型(包括乳剂和混悬剂)的类似分散剂。通常用于制备药学上可接受的固体、液体或其它剂型的其他常用的表面活性剂,例如tween、span和其他乳化剂或生物利用度增强剂也可用于配制目的。本公开的组合物可以以任何口服可接受的剂型口服施用,包括但不限于胶囊、片剂、水性悬浮液或溶液。在口服用片剂的情况下,常用的载体包括乳糖和玉米淀粉。典型地,还添加润滑剂,例如硬脂酸镁。对于胶囊形式的口服施用,有用的稀释剂包括例如乳糖。当口服使用需要水性悬浮液时,将活性成分与乳化剂和悬浮剂组合。如果需要,还可以加入某些甜味剂、调味剂或着色剂。或者,本公开的组合物可以用于直肠施用的栓剂的形式施用。这些可以通过将试剂与合适的无刺激性赋形剂混合来制备,所述赋形剂在室温下为固体但在直肠温度下为液体,因此将在直肠中融化以释放药物。这种材料包括可可脂、蜂蜡和聚乙二醇。本公开的组合物也可局部施用,特别是当治疗靶标包括局部施用易于接近的区域或器官时,包括眼、皮肤或下肠道疾病。对于这些区域或器官中的每一个,容易制备合适的局部制剂。对于局部应用,组合物可以配制成合适的软膏,其含有悬浮或溶解在一种或多种载体中的活性组分。用于局部施用本公开化合物的载体包括但不限于矿物油、液体凡士林、白凡士林、丙二醇、聚氧乙烯、聚氧丙烯化合物、乳化蜡和水。或者,可以将组合物配制成合适的洗剂或霜剂,其含有悬浮或溶解在一种或多种药学上可接受的载体中的活性组分。合适的载体包括但不限于矿物油、脱水山梨糖醇单硬脂酸酯、聚山梨醇酯60、十六烷基酯蜡、鲸蜡硬脂醇、2-辛基十二烷醇、苯甲醇和水。用于下肠道的局部应用可以使用直肠栓剂制剂(参见上文)或以合适的灌肠制剂进行。也可以使用贴剂。本公开
的组合物还可以通过鼻气雾剂或吸入施用。这种组合物根据药物制剂领域熟知的技术制备,并且可以使用苯甲醇或其他合适的防腐剂、提高生物利用度的吸收促进剂、碳氟化合物和/或其他常规的增溶剂或分散剂制备为盐水溶液。
[0204]
例如,存在于本公开药物组合物中的抗体可以在100mg(10ml)或500mg(50ml)一次性使用小瓶中以10mg/ml的浓度提供。该产品配制为用于静脉内施用:9.0mg/ml氯化钠、7.35mg/ml柠檬酸钠二水合物、0.7mg/ml聚山梨醇酯80和无菌注射用水。将ph调节至6.5。本公开药物组合物中抗体的示例性合适剂量范围可为约1mg/m
2-500mg/m2。然而,应当理解,这些明细是示例性的,并且考虑到必须在临床试验中测定的药物组合物中特定抗体的亲和力和耐受性,可以调整最佳明细和方案。可以制备用于注射(例如,肌肉内静脉注射)的本公开的药物组合物以含有无菌缓冲水(例如对于肌肉内,1ml)和约1ng-约100mg,例如约50ng-约30mg或更优选约5mg-约25mg的本公开的抗nectin-4抗体。
[0205]
诊断和预后方法
[0206]
在一个实施方案中,本公开涉及检测来自受试者的生物样品中nectin-4的存在或表达水平的方法,其中所述方法包括:使生物样品与本文公开的抗nectin-4抗体接触并检测结合的抗体的存在。
[0207]
典型地,通过免疫组化进行检测。
[0208]
生物样品典型地如前所述,尤其是生物样品是固定的组织,更特别是ffpe组织。
[0209]
受试者典型地如前所述。
[0210]
本文所用的术语“检测”包括定量或定性检测。因此,本公开包括检测样品中nectin-4的存在和/或表达水平。抗体与nectin-4的选择性结合尤其通过膜染色的存在来建立,因为nectin-4是膜蛋白。
[0211]
在某些实施方案中,本文提供的抗nectin-4抗体可用于检测生物样品中nectin-4的存在。
[0212]
在一个实施方案中,提供了用于诊断或检测方法的本文公开的nectin-4抗体。在另一个实例中,本公开提供如先前描述的抗nectin-4抗体在制备用于诊断或检测方法的试剂中的用途。
[0213]
在一个实施方案中,例如,提供了如下所述的检测生物样品中nectin-4存在的方法。在某些实施方案中,所述方法包括在允许抗nectin-4抗体与nectin-4结合的条件下使生物样品与本文所述的nectin-4抗体接触,并检测抗nectin-4抗体和nectin-4之间是否形成复合物。这种方法可以是体外或体内方法。本公开的抗nectin-4抗体可用于例如免疫测定,包括例如免疫组化(ihc)、免疫荧光(if)、免疫印迹(例如蛋白质印迹)、流式细胞术(例如facs
tm
)和酶联免疫吸附测定(elisa)。更具体地,免疫测定是ihc,生物样品是固定的组织,特别是ffpe。
[0214]
在一个实施方案中,抗nectin-4抗体用于选择适合用抗nectin-4抗体(特别是用相同的抗nectin-4抗体)治疗的受试者,典型地,其中nectin-4是用于选择患者的生物标记。本公开还提供抗nectin-4抗体在诊断患有病症(例如癌症)的受试者的方法中的用途,所述方法包括:通过使从受试者获得的样品与本文之前所述的抗nectin-4抗体接触并检测结合的抗体的存在来测定样品中nectin-4的存在或表达水平。
[0215]
例如,所述方法提供抗nectin-4抗体在诊断患有癌症的受试者的方法中的用途,
所述方法包括:通过使样品与本文之前所述的抗nectin-4抗体接触并检测结合的抗体的存在来测定从受试者获得的样品中nectin-4的存在或表达水平。在一些实施方案中,样品选自下组:组织样品、全血样品、血清样品和血浆样品。更具体地,样品是组织样品,特别是固定的组织样品。在一些情况下,组织样品是肿瘤样品。
[0216]
本公开还提供了nectin-4抗体在制备用于诊断患有病症(例如癌症)的受试者的方法中的试剂中的用途,所述方法包括:通过使样品与本文公开的抗nectin-4抗体接触并检测结合的抗体的存在来测定从受试者获得的样品中nectin-4的存在或表达水平。在一些实施方案中,样品选自下组:组织样品、全血样品、血清样品和血浆样品。更具体地,样品是组织样品,尤其是固定的组织样品。在一些情况下,组织样品是肿瘤样品。
[0217]
在另一个实施方案中,本公开提供了用于鉴定患有可能对治疗有响应的病症(例如癌症)的受试者的方法,所述方法包括:通过使样品与本文公开的抗nectin-4抗体接触并检测结合的抗体的存在来测定从受试者获得的样品中nectin-4的存在或表达水平,其中样品中nectin-4的存在或表达水平指示受试者可能对治疗有响应。
[0218]
在一个实施方案中,本公开还提供了用于预测患有癌症的个体对用抗癌疗法治疗的响应性的方法。典型地,抗癌疗法包含如本文所述的抗nectin-4抗体(例如于细胞毒性部分偶联)或如本文之前定义的嵌合抗原受体(car)。该方法包括:通过使样品与本文公开的抗nectin-4抗体接触并检测结合的抗体的存在来测定从受试者获得的样品中nectin-4的存在或表达水平,其中样品中nectin-4的存在或表达水平表明受试者更可能对抗癌疗法的治疗有响应。在一些实施方案中,样品选自下组:组织样品、全血样品、血清样品和血浆样品。更具体地,样品是组织样品,尤其是固定的组织样品。在一些情况下,组织样品是肿瘤样品。
[0219]
本公开还涵盖用于监测接受如本文定义的抗nectin-4抗体或car的患者中的治疗功效的方法。所述方法包括在两个或多个时间点测定患者生物样品中nectin-4蛋白表达水平(或nectin-4浓度)。与在较早时间点在患者的生物样品中获得的值(因此典型地用作参考值)相比,在较晚时间点在患者的生物样品中更高的nectin-4蛋白表达水平(典型地通过测定所述生物样品中的nectin-4浓度来评估)的测量指示患者对治疗无响应。较低nectin-4蛋白水平表达(或nectin-4浓度)的测量指示患者对治疗有响应。在两个或更多个时间点测量相等的nectin-4蛋白水平(或nectin-4浓度)表明nectin-4相关疾病,典型地是癌症,在患者中不发展(即稳定)。
[0220]
更具体地,在如前所述的本公开的实施方案中,可以使用本公开的抗nectin-4抗体,使用ihc和染色方案来测定样品中nectin-4的存在和/或表达水平/量。组织切片的ihc染色已经显示是确定或检测样品中蛋白质存在的可靠方法。在一个实施方案中,使用包括以下的方法测定nectin-4的表达水平:(a)用本文公开的抗nectin-4抗体对样品(例如获自受试者的肿瘤样品)进行ihc分析;和(b)测定样品中nectin-4的存在和/或表达水平。在一些实施方案中,相对于参考测定ihc染色强度。在一些实施方案中,参考是参考值。在一些实施方案中,参考是参考样品(例如对照细胞系染色样品、来自非癌性患者的组织样品、已知具有预定的nectin-4表达水平的参考样品)。
[0221]
ihc可以与另外的技术(如形态学染色和/或原位杂交(例如fish))组合进行。ihc的两种一般方法是可用的;直接和间接测定。根据第一种测定法,直接测定抗体与靶抗原的
结合。该直接测定使用标记的试剂,例如荧光标记或酶标记的一抗,其可以在没有进一步抗体相互作用的情况下可视化。在典型的间接测定中,未偶联的一抗与抗原结合,然后标记的二抗与一抗结合。当二抗与酶标记偶联时,添加生色或荧光底物以提供抗原的可视化。由于几种二抗可与一抗上的不同表位反应而发生信号扩增。
[0222]
用于ihc的一抗和/或二抗典型地可用可检测部分标记。许多标签可用,通常可分为以下类别:(a)放射性同位素,例如
35
s、
14
c、
125
1、3h和
131
1;(b)胶体金颗粒;(c)荧光标记,包括但不限于稀土螯合物(铕螯合物)、德克萨斯红、罗丹明、荧光素、丹酰、丽丝胺、伞形酮、藻红蛋白、藻蓝蛋白或可商购的荧光团如spectrum orange7和spectrum green7和/或上述任何一种或多种的衍生物;(d)各种酶-底物标记是可获得的,并且美国专利号4,275,149提供了对其中一些的综述。酶标记的实例包括荧光素酶(例如,萤火虫荧光素酶和细菌荧光素酶;参见,例如,美国专利号4,737,456)、萤光素、2,3-二氢酞嗪二酮、苹果酸脱氢酶、脲酶、过氧化物酶如辣根过氧化物酶(hrpo)、碱性磷酸酶、β-半乳糖苷酶、葡糖淀粉酶、溶菌酶、糖氧化酶(例如,葡萄糖氧化酶、半乳糖氧化酶和葡萄糖-6-磷酸脱氢酶)、杂环氧化酶(如尿酸酶和黄嘌呤氧化酶)、乳过氧化物酶、微过氧化物酶等。酶-底物组合的实例包括,例如,辣根过氧化物酶(hrpo)与过氧化氢过氧化物酶作为底物;碱性磷酸酶(ap)与对硝基苯酯作为显色底物;和β-d-半乳糖苷酶(β-d-gal)与生色底物(例如,对硝基苯基-β-d-半乳糖苷酶)或荧光底物(例如,4-甲基伞形基-d-半乳糖苷酶)。关于这些的综述,参见例如美国专利4,275,149和4,31 8,980。
[0223]
如前所述,在癌症患者,尤其是患有乳腺癌的患者的血清中,可溶性形式的nectin-4的检测与不良预后有关。此外,已显示nectin-4的水平随转移发展而增加且在治疗后降低(参考文献1)。因此,在一些实施方案中,本公开涵盖用于预后患有癌症的受试者的临床结果的方法。所述方法包括通过使从受试者获得的样品与本文之前所述的抗nectin-4抗体接触并检测结合的抗体的存在来测定样品中nectin-4的存在或表达水平的步骤。典型地,检测到nectin-4和/或检测到所述样品中nectin-4的表达水平高于参考水平指示不良预后。或者,样品中不存在nectin-4或检测到nectin-4水平低于参考值表明预后良好。
[0224]
本公开还包括用于治疗癌症的方法,其包括(i)如上定义的诊断步骤,和(ii)如果检测到nectin-4和/或如果nectin-4的水平大于或等于参考值,则施用如上定义的抗体,尤其是与细胞毒性部分偶联的抗体,和/或施用如上定义的嵌合抗原受体或包含其的组合物的步骤。
[0225]
特别地,本公开包括治疗患有或疑似患有癌症的患者的方法,其包括:
[0226]
步骤1),即评估来自疑似患有癌症的受试者的组织样品中的nectin-4表达,或评估所述癌症患者对抗癌治疗剂的反应性,其包括:
[0227]
(1a)使所述组织样品与本文公开的抗体或其抗原结合片段接触;
[0228]
(1b)检测所述抗体或其抗原结合片段与所述组织样品的结合;以及
[0229]
(1c)测定所述组织样品中nectin-4的表达,其中将所述组织样品中nectin-4的表达水平与nectin-4的参考表达水平进行比较;以及
[0230]
步骤2),即当观察到与参考相比增加的nectin-4表达水平时,向患者施用所述抗癌治疗剂;
[0231]
任选地,其中nectin-4的表达水平使用免疫组化(ihc)方法、免疫印迹测定、萤光激活的细胞分选(facs)测定或酶联免疫吸附测定(elisa)检测,
[0232]
任选地,其中所述抗癌治疗剂包含抗nectin-4抗体或抗nectin-4抗体的抗体药物偶联物,典型地是根据本公开的抗体或其变体。
[0233]
在上述方法中,可以如上所定义选择参考值。本文定义的样品也可以如前所述获得。本文中的术语癌症意指如先前所定义,尤其是在本节中所定义。
[0234]
本公开将通过以下附图和实施例进一步说明。然而,这些实施例和附图不应以任何方式解释为限制本公开的范围。
[0235]
表1:本公开的序列:
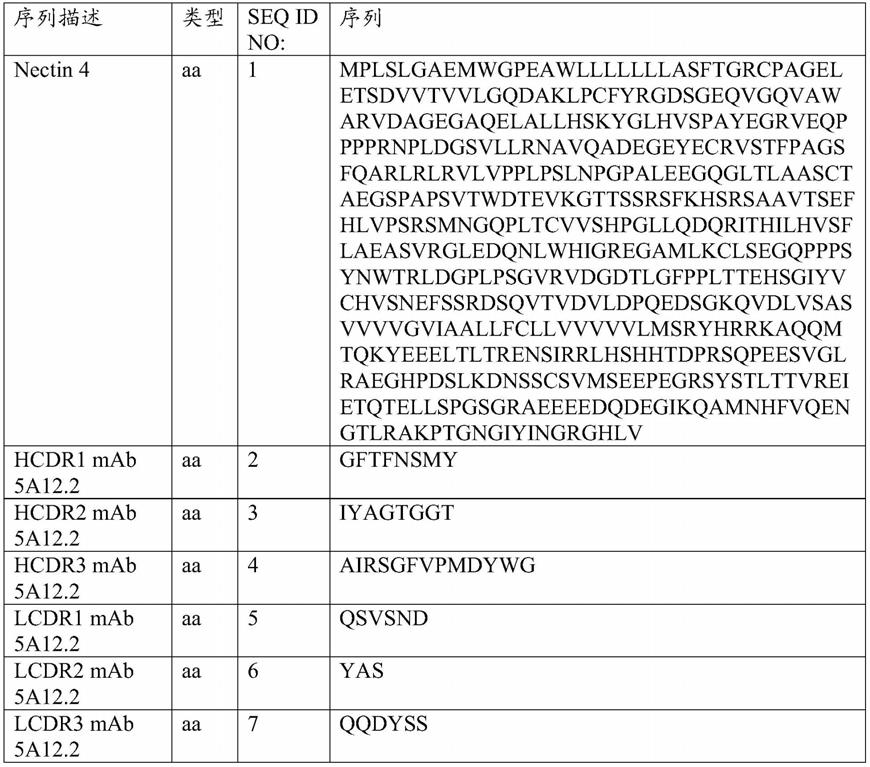
[0236]
下表中的cdr根据imgt命名法编号。
[0237]
[0238]
附图说明
[0239]
图1:5a12.2与nectin-4结合的竞争测定。
[0240]
a:在不同浓度的其它nectin-4mab存在下,通过elisa进行5a12.2-hrp mab与重组nectin-4蛋白的结合。没有检测到交叉抑制。
[0241]
b:总结了抗nectin-4mab之间的竞争的表。黑色:mab竞争。灰色:无mab竞争。5a12.2表位不同于n41mab、14a5.2和ha22.2
[0242]
图2:表观亲和结合常数(kd)值的测定:
[0243]
检测mab与sum190肿瘤细胞表达的细胞表面nectin-4的结合。使用graph pad prism软件计算表观亲和结合常数(kd)。f-max值对应于通过facs分析测量的最大荧光强度(a.u.)。
[0244]
图3:细胞细胞毒性分析:
[0245]
使用来自ats-bio的mab-zap试剂盒在sum190肿瘤细胞系上评估抗nectin-4mab的adc能力。使用graph pad prism软件计算ic50。
[0246]
图4:原发性三阴性乳腺癌患者样品中nectin-4的ihc染色:
[0247]
如材料和方法中所述用5a12.2 mab染色ffpe组织。通过将阳性细胞百分比(p)乘以强度(i)对nectin-4表达评分(快速评分,qs)。公式:qs=p x i。最大评分为300。左;t1:患者肿瘤1,t2:患者肿瘤2。右侧:按预期放大nectin-4的膜表达(箭头)。
具体实施方式
[0248]
材料和方法
[0249]
5a12.2杂交瘤的选择
[0250]
用重组人nectin-4-fc蛋白作为免疫原免疫balb/c小鼠。该蛋白质由nectin-4胞外区的igv远端结构域组成。免疫脾细胞与鼠x63ag8.653骨髓瘤细胞融合。通过facs在nectin-4转染的细胞和未转染的细胞上筛选杂交瘤上清液(~2000)。进一步筛选产生nectin-4抗体的杂交瘤的亲和力、荧光强度并与之前的nectin-4抗体比较。选择5a12.2作为具有改进特性的抗体。
[0251]
竞争测定
[0252]
通过elisa进行mab竞争测定。在+4℃下用0.125μg/ml重组nectin4vcc-fc蛋白包被96孔托盘过夜。在可变浓度的4种不同抗nectin-4mab(5a12、n41、14a5和ha22-2 mab)存在下,测量过氧化物酶偶联的5a12.2 mab(0.55μg/ml的5a12.2-hrp)的结合。
[0253]
流式细胞术:
[0254]
使用指定浓度的nectin-4单克隆抗体对sum190乳腺癌细胞系进行facs分析。然后,将细胞用藻红蛋白偶联的山羊抗小鼠抗体(beckman-coulter)染色。
[0255]
表观亲和结合常数(kd)值和最大荧光强度测定:
[0256]
使用连续稀释的单克隆抗体通过facs分析测定kd值。graph pad prism用于精确测量。通过facs分析测量最大荧光强度。
[0257]
基于adc的体外nectin-4靶向
[0258]
测试抗nectin-4单克隆抗体在sum190肿瘤细胞上诱导基于adc的细胞毒性的能力。按制造商(mab-zap kit,ats-bio)推荐的方法,用系列稀释的抗体和与皂草素偶联的山羊抗小鼠单克隆抗体一式三份孵育3000个细胞/孔来进行实验。为了分析效果,使用如制造商(biosource,ca,usa)推荐的alamarblue染色程序测量细胞生长。该测试结合了荧光氧化还原指示剂。荧光强度与细胞代谢减少成比例。在第5天通过将1/10体积的alamarblue溶液在37℃下孵育2小时并在595nm下读取(fluostar optima,bmg labtech)来测量alamarblue。
[0259]
在ffpe乳腺癌样品上的ihc染色
[0260]
将样品在4%甲醛中固定24至48。使用discovery hq程序:在95℃下,在ph8.0下进行抗原修复12min。以1μg/ml使用5a12 mab并在37℃孵育3小时。用来自roche的discovery xt ventana进行实验。使用discovery anti-mouse hq,discovery anti-hq和chromomap dab按照制造商的建议(roche diagnostics)进行染色的检测。
[0261]
结果
[0262]
本发明的结果公开了具有改进性质的新的抗nectin-4mab。名为5a12.2的该mab识别nectin-4胞外区中的igg样远端结构域。在表位识别方面,将它们的结合特性与其它已经获得专利的mab进行比较。(pct/ep2018/055109和pct/ep2106/071076)
[0263]
如图1a和b所示,5a12.2 mab识别不同于三种其它测试mab的表位,即n41、14a5.2和ha22.2。facs分析显示,与n41和14a5 mab相比,5a12.2 mab表现出更好的表观亲和力(图2,顶部)。有趣的是,5a12.2 mab的最大结合亲和力高于其它两种mab(图2,底部)。
[0264]
这些性质导致发明人比较该mab的adc性质。如图3顶部所示,当与毒素皂草素(一
种高度有效的核糖体功能抑制剂)偶联时,5a12.2mab具有细胞毒性。细胞毒性高于n41和14a5mab(图3,底部)。
[0265]
最后,进行ihc实验以评价5a12.2 mab识别和染色石蜡包埋组织的性质。如图4所示,在乳腺癌组织中的nectin-4表达很容易检测为预期的膜染色。据本发明人所知,这是第一种作用于ffpe组织的抗nectin-4mab。因此,5a12.2 mab代表nectin-4阳性肿瘤的诊断、预后和治疗的新选择。
[0266]
参考文献:
[0267]
1.fabre-lafay s et al.nectin-4 is a new histological and serological tumor associated marker for breast cancer.bmc cancer 2007;7:73.
[0268]
2.takano a et al.identification of nectin-4 oncoprotein as a diagnostic and therapeutic target for lung cancer.cancer res 2009;69:6694-6703.
[0269]
3.derycke ms et al.nectin 4 overexpression in ovarian cancer tissues and serum:potential role as a serum biomarker.am j clinpathol 2010;134:835-845.
[0270]
4.nishiwada s et al.nectin-4expression contributes to tumor proliferation,angiogenesis and patient prognosis in human pancreatic cancer.j expclin cancer res 2015;34:30.
[0271]
5.challita-eid pm et al.enfortumabvedotin antibody-drug conjugate targeting nectin-4 is a highly potent therapeutic agent in multiple preclinical cancer models.cancer res 2016;76:3003-3013.
[0272]
6.m-rabet et al.nectin-4:a new prognostic biomarker for efficient therapeutic targeting of primary and metastatic triple-negative breast cancer.ann oncol.2017apr 1;28(4):769-776
[0273]
7.fabre s et al.,prominent role of the ig-like v domain in trans-interactions of nectins.nectin-3 and nectin-4bind to the predicted c-c'-c"-d beta-strands of the nectin-1 v domain.j biol chem.2002 jul 26;277(30):27006-13。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1