三个具有线粒体/溶酶体双重靶向定位的溶致比色/溶致荧光探针
本发明属于分析化学技术领域,具体涉及三个具有线粒体/溶酶体双重靶向定位的溶剂比色/溶致荧光探针的制备方法及其在生物成像方面的应用。
背景技术:
溶剂在溶液分析体系中起着关键性的作用。它不仅强烈影响着化学反应速率、化学平衡及反应机理,而且对有机化合物的吸收和发射光谱等也能产生较大的影响[naderi,f.;farajtabar,a.,solvatochromismoffluoresceininaqueousaproticsolvents.journalofmolecularliquids,2016,221:102-107;mellmerma,sanpitaksereec,demirb,etal.solvent-enabledcontrolofreactivityforliquid-phasereactionsofbiomass-derivedcompounds.naturecatalysis,2018,1(3),199-207;zhangs,sheny,shaop,etal.kinetics,thermodynamics,andmechanismofanovelbiphasicsolventforco2capturefromfluegas.environmentalscience&technology,2018,52(6):3660-3668.]。近年来,溶剂致变色染料已被广泛应用于染色剂、分子识别、荧光探针等领域,特别在化学和生物研究领域已然成为一个新的研究热点。线粒体和溶酶体都是一种存在于真核细胞中的细胞器,在许多细胞过程中发挥着重要的作用。资料显示,线粒体和溶酶体有着紧密的联系,与多种人类疾病的发生有关[rovira-llopiss,banulsc,diaz-moralesn,etal.mitochondrialdynamicsintype2diabetes:pathophysiologicalimplications.redoxbiology,2017,11(c):637-645;bhargavap,schnellmannrg.mitochondrialenergeticsinthekidney.naturereviewsnephrology,2017,13(10):629-646;xuez,zhaoh,liuj,etal.imaginglysosomalphalterationinstressedcellswithasensitiveratiometricfluorescencesensor.acssensors,2017,2(3):436-442;wongyc,ysselsteind,kraincd.mitochondria-lysosomecontactsregulatemitochondrialfissionviarab7gtphydrolysis.nature,2018,554(7692):382-386.]。因此,设计和开发具有线粒体/溶酶体双重靶向定位能力的荧光探针是非常必要的。
随着荧光技术的深入研究,近年来科研工作者们报道了多种基于各种响应机理的溶剂化变色探针的合成及应用,包括推拉电子性质[collotm,bous,famtk,etal.probingpolarityandheterogeneityoflipiddropletsinlivecellsusingapush-pullfluorophore.analyticalchemistry,201891(3):1928-1935.]、聚集诱导发光[hai-taof,ying-xuey,jia-binx,etal.macrocyclesandcagesbasedontetraphenylethylenewithaggregation-inducedemissioneffect.chemicalsocietyreviews,2018,47(19):7452-7476.]、分子内部电荷转移[nootemj,sattayanonc,namuangruks,etal.solvatochromictriazaborolopyridiniumprobestowardultra-sensitivetracewaterdetectioninorganicsolvents.dyesandpigments,2020,181.]等,相比之下,基于基态分子内质子转移的溶剂化探针的报道少之又少。
技术实现要素:
本发明目的在于提供线粒体/溶酶体定位的荧光探针的制备方法,以及其溶剂化效应、细胞成像方面的应用。
本发明的实验技术方案如下:
本发明提供的三种线粒体/溶酶体定位的溶致变色荧光材料,其结构及检测机理为:
所述探针的制备步骤如下:
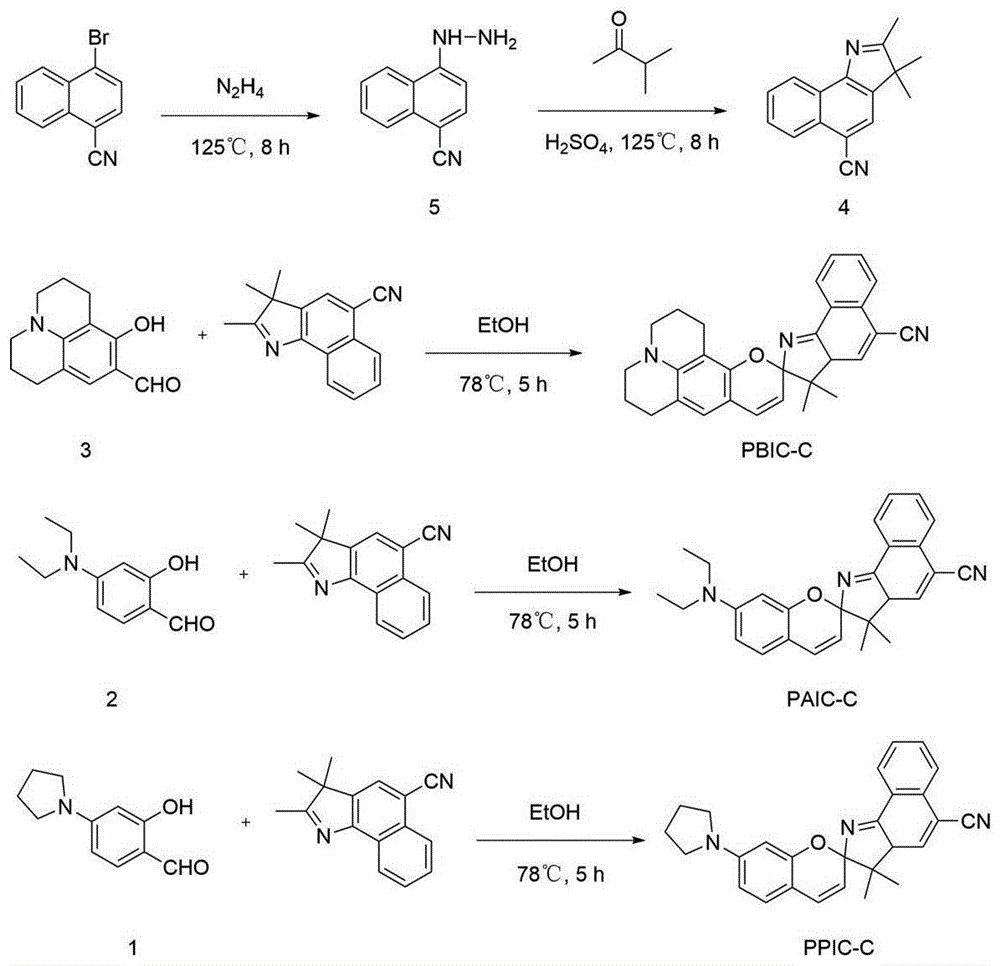
将1-溴-4-氰基萘和水合联氨分别加入到20ml乙二醇甲醚中,加热搅拌8小时。冷却后倒入冰水,抽滤,乙醇和水的混合液重结晶得产物5(产率:89%)。
将化合物5和浓硫酸加到甲基异丙基酮中,加热回流5小时,冷却后抽滤乙醇和水的混合物重结晶,过柱(石油醚:丙酮=10:1)得粉色固体4(产率:53%)。
制备化合物3,将3-氨基苯酚、nahco3和1-溴-3-氯丙烷溶于dmf中,70℃加热12h。冷却后加入冰水,然后用乙酸乙酯萃取,过柱(石油醚:乙酸乙酯=10:1)得中间产物。将三氯氧磷和中间产物的dmf溶液在冰水浴下搅拌0.5h。撤去冰水浴,室温搅拌1h后再加热至100℃再反应1h,冷却后加水猝灭,继续搅拌1h。用二氯甲烷萃取,过柱(石油醚:乙酸乙酯=10:1)得白色固体化合物3(59.9%)。
将化合物3和化合物4等比例加入乙醇中,回流5h。冷却后抽滤并乙醇重结晶,过柱(石油醚:乙酸乙酯=10:1),得绿色粉末状固体pbic-c(产率:48%)。
将4-(二乙氨基)水杨醛和化合物4等比例加入乙醇中,回流5h。冷却后抽滤,乙醇重结晶,过柱(石油醚:乙酸乙酯=10:1)得蓝色粉末状固体paic-c(产率:37%)。
制备化合物1,将3-氨基苯酚和k2co3加入到dmf中,然后加入1,4-二溴丁烷,80℃反应2h,过柱得中间产物。将三氯氧磷和中间产物的dmf溶液在冰水浴下搅拌0.5h。撤去冰水浴,室温搅拌24h,加水溶解,用二氯甲烷萃取,过柱(石油醚:乙酸乙酯=10:1)得白色固体化合物1(81.1%)。最后,将化合物1和化合物4等比例加入乙醇中,回流5h。冷却后抽滤,用二氯甲烷萃取,过柱(石油醚:乙酸乙酯=10:1)得紫色粉末状固体ppic-c(产率:88%)。
具体的反应合成路线如下:
三种探针的溶剂化效应及其在生物成像方面的应用
本发明的探针都具有较强的溶剂致变色特性,且具有较大的荧光量子产率。
图2、3、4分别是探针pbic-c、paic-c、ppic-c在不同溶剂中的紫外和荧光光谱以及其在自然光和手提紫外灯下的照片。结果显示,三种探针的紫外吸收光谱的溶剂化变色位移非常明显,不同溶剂间约有100nm的峰位移动,溶液颜色也呈现出鲜明的区别。
表1、2和3依次展示了所制备探针在不同极性溶剂中的光物理性质,包括最大吸光度λabs,max、最大发射λem,max、荧光量子产率qy和荧光寿命τ。以上结果表明,三种探针都具有较强的溶剂致变色特性,且具有较大的荧光量子产率。
我们分别对pbic-c和ppic-c在氯仿和二氯甲烷溶液中逐滴加入水来观察紫外光谱和溶液颜色变化,结果如图5和6所示。随着蒸馏水的滴加,探针初始位置处的吸收峰都在慢慢降低,而在600nm处均产生一个新峰。探针pbic-c的溶液颜色从深蓝色变为橘红色,探针ppic-c的溶液颜色从蓝色变为黄色。
为了揭示传感机理,我们进行了紫外光谱滴定和核磁实验,如图7-9所示,随着三氟乙酸的增加,在540nm处出现一个等吸收点,表明形成新的物种。我们认为可能发生了结构异化。此外,在加入三氟乙酸前后,对dmso-d6中的探针的1hnmr谱图进行了测定,我们发现,三氟乙酸的加入会导致探针的hb消失。
如图10-12所示,将三种探针在dmso、dmso+tfa、chcl3中的紫外吸收图谱分别放置同一坐标体系下观察变化。从以上实验结果,我们推测出可能的溶剂致变色机理,即探针在不同溶剂中存在两种可以进行可逆转换的异构体,如式ⅰ所示,在酸性或低极性溶剂下,原来关环的结构转变为开环,在大极性溶剂中,开环结构转变为关环结构。
表4是我们对三种探针的理论计算研究。我们可以发现,homo能级主要分布在苯并吡喃衍生物位置,而lumo中的分子轨道密度主要分布在含有强吸电子基氰基的受体框架上。探针的最低能量跃迁主要来自homo→lumo轨道跃迁,而且计算得到的最大吸收峰位置与实验测定结果吻合较好。
图13所示为所制备探针对线粒体和溶酶体的定位图像,从图中可以看出探针对线粒体和溶酶体都有很好的定位效果。
在dmso/h2o(1:1,v/v)条件下,我们测试了三种探针的光漂白特性,如图14所示,与商用的线粒体和溶酶体追踪染料相比,三种探针都具有较好的光稳定性。
综上所述,利用简单的有机合成方法,我们得到了三种能够进行线粒体和溶酶体双重靶向定位的溶致变色荧光材料。制备的探针具有较强的溶剂致变色特性,且具有较大的荧光量子产率。细胞实验表明所制备的探针具有很好的线粒体/溶酶体定位效果,为探索线粒体和溶酶体相关疾病的病理研究开辟了道路。
附图说明
图1探针pbic-c、paic-c和ppic-c的制备与设计路线
图2探针pbic-c在不同溶剂中的紫外可见吸收光谱、荧光发射光谱、自然光下和365nm手提紫外灯下溶液颜色变化照片。激发波长:540nm,探针浓度:10μm。
图3探针paic-c在不同溶剂中的紫外可见吸收光谱、荧光发射光谱、自然光下和365nm手提紫外灯下溶液颜色变化照片。激发波长:540nm,探针浓度:10μm。
图4探针ppic-c在不同溶剂中的紫外可见吸收光谱、荧光发射光谱、自然光下和365nm手提紫外灯下溶液颜色变化照片。激发波长:530nm,探针浓度:10μm。
图5探针pbic-c在不同溶剂中的光物理性质(包括最大吸光度λabs,max、最大发射λem,max、荧光量子产率qy和荧光寿命τ)。
图6探针paic-c在不同溶剂中的光物理性质(包括最大吸光度λabs,max、最大发射λem,max、荧光量子产率qy和荧光寿命τ)。
图7探针ppic-c在不同溶剂中的光物理性质(包括最大吸光度λabs,max、最大发射λem,max、荧光量子产率qy和荧光寿命τ)。
图8探针pbic-c分别在氯仿和二氯甲烷溶液中逐滴加入蒸馏水的紫外吸收光谱和自然光下颜色变化照片,探针浓度:10μm。
图9探针paic-c分别在氯仿和二氯甲烷溶液中逐滴加入蒸馏水的紫外吸收光谱和自然光下颜色变化照片,探针浓度:10μm。
图10探针pbic-c的紫外光谱滴定、单晶结构和核磁滴定实验
图11探针paic-c的紫外光谱滴定和核磁滴定实验
图12探针ppic-c的紫外光谱滴定和核磁滴定实验
图13探针pbic-c在dmso、dmso+tfa、chcl3中的紫外吸收光谱,探针浓度:10μm。
图14探针paic-c在dmso、dmso+tfa、chcl3中的紫外吸收光谱,探针浓度:10μm。
图15探针ppic-c在dmso、dmso+tfa、chcl3中的紫外吸收光谱,探针浓度:10μm。
图16探针的理论计算研究,采用pbe1pbe/6-31g*方法对密度泛函理论(td-dft)进行计算,得到三种探针的最大吸收峰和前线轨道。
图17探针的线粒体和溶酶体共定位荧光图像。greenchannel:λex=488nm,λem=520-560nm,formito-tracker;λex=504nm,λem=510-560nm,forlyso-tracker.redchannel:λex=560nm,λem=620-700nm,forpbic-c,paic-candppic-c;scalebars=10μm.
图18在dmso/h2o(1:1,v/v)条件下,三种探针和市售线粒体追踪器m7514、溶酶体跟踪器l7526的光褪色特性比较。
具体实施方式
实施例1:所述探针的制备步骤如下:
将1-溴-4-氰基萘和水合联氨分别加入到20ml乙二醇甲醚中,加热搅拌8小时。冷却后倒入冰水,抽滤,乙醇和水的混合液重结晶,得产物5(产率:89%)。结构表征为:1hnmr(400mhz,dmso):δh8.61(s,1h),8.26(d,j=8.5hz,1h),7.90(dd,j=19.5,8.2hz,2h),7.71-7.63(m,1h),7.55-7.46(m,1h),7.07(d,j=8.3hz,1h),4.48(s,2h).13cnmr(151mhz,dmso):δc151.91,135.49,133.43,128.93,125.62,124.84,122.86,120.78,120.27,102.89,93.4.
将化合物5和浓硫酸加到甲基异丙基酮中,加热回流5小时,冷却后抽滤乙醇和水的混合物重结晶,过柱(石油醚:丙酮=10:1)得粉色固体4(产率:53%)。1hnmr(600mhz,dmso):δh8.57(d,j=8.2hz,1h),8.41(s,1h),8.16(d,j=8.0hz,1h),7.84-7.74(m,2h),2.43(s,3h),1.38(s,6h).13cnmr(151mhz,dmso):δc195.00,152.79,142.04,133.14,129.18,128.26,127.97,125.92,125.07,124.41,118.76,105.43,55.75,22.10,16.19.
制备化合物3,将3-氨基苯酚、nahco3和1-溴-3-氯丙烷溶于dmf中,70℃加热12h。冷却后加入冰水,然后用乙酸乙酯萃取,过柱(石油醚:乙酸乙酯=10:1)得中间产物。将三氯氧磷和中间产物的dmf溶液在冰水浴下搅拌0.5h。撤去冰水浴,室温搅拌1h后再加热至100℃再反应1h,冷却后加水猝灭,继续搅拌1h。用二氯甲烷萃取,过柱(石油醚:乙酸乙酯=10:1)得白色固体化合物3(59.9%)。1hnmr(600mhz,dmso):δh11.85(s,1h),9.36(s,1h),6.98(s,1h),3.27(dd,j=12.2,7.0hz,4h),2.61(t,j=6.1hz,2h),2.54(t,j=6.4hz,2h),1.83(dd,j=11.9,6.1hz,4h).13cnmr(151mhz,dmso):δc192.13(s),158.88(s),149.72(s),131.41(s),113.87(s),110.47(s),104.66(s),50.00(s),49.55(s),26.99(s),21.50(s),20.41(s),19.74(s)。
将化合物3和化合物4等比例加入乙醇中,回流5h。冷却后抽滤并乙醇重结晶,过柱(石油醚:乙酸乙酯=10:1),得绿色粉末状固体pbic-c(产率:48%)。1hnmr(400mhz,dmso):δh8.64(d,j=7.7hz,1h),8.55(s,1h),8.39(s,1h),8.14(d,j=7.9hz,1h),7.94-7.73(m,2h),7.52(s,1h),7.00-6.85(m,1h),3.37(s,5h),2.77-2.55(m,4h),1.89(s,4h),1.57(s,6h).13cnmr(151mhz,dmso):δc133.37,129.58,127.98,125.24,124.38,118.99,103.25,50.03,27.15,25.10,21.59,21.24,20.59,15.61,0.57.hrms-esim/z:calcdforc29h27n3o[m+h]+,434.2227;found,434.2227.
实施例2:化合物3的合成将4-(二乙氨基)水杨醛和化合物4等比例加入乙醇中,回流5h。冷却后抽滤,乙醇重结晶,过柱(石油醚:乙酸乙酯=10:1)得蓝色粉末状固体paic-c(产率:37%)。1hnmr(400mhz,dmso):δh8.64(d,j=7.7hz,1h),8.40(s,2h),8.15(d,j=8.0hz,1h),7.88-7.62(m,3h),7.08(d,j=12.4hz,1h),6.42(s,1h),6.24(s,1h),3.44(d,j=6.6hz,5h),1.55(s,6h),1.16(s,6h).13cnmr(151mhz,dmso):δc133.35,129.41,127.93,127.79,125.16,124.52,119.01,103.77,97.45,56.50,44.84,24.28,19.03,13.17.hrms-esim/z:calcdforc27h27n3o[m+h]+,410.2227;found,410.2225.
实施例3:化合物4的合成
制备化合物1,将3-氨基苯酚和k2co3加入到dmf中,然后加入1,4-二溴丁烷,80℃反应2h,过柱得中间产物。将三氯氧磷和中间产物的dmf溶液在冰水浴下搅拌0.5h。撤去冰水浴,室温搅拌24h,加水溶解,用二氯甲烷萃取,过柱(石油醚:乙酸乙酯=10:1)得白色固体化合物1(81.1%)。1hnmr(600mhz,dmso):δh11.35(s,1h),9.62(s,1h),7.43(d,j=8.8hz,1h),6.23(dd,j=8.8,2.1hz,1h),5.93(d,j=2.0hz,1h),3.33(t,j=4.9hz,4h),1.95(t,j=6.6hz,4h).13cnmr(151mhz,dmso):δc191.47(s),163.65(s),153.85(s),134.43(s),111.91(s),105.80(s),97.05(s),47.95(s),25.31(s)。
最后,将化合物1和化合物4等比例加入乙醇中,回流5h。冷却后抽滤,用二氯甲烷萃取,过柱(石油醚:乙酸乙酯=10:1)得紫色粉末状固体ppic-c(产率:88%)。1hnmr(400mhz,dmso):δh8.66(d,j=6.0hz,2h),8.46(s,1h),8.24-8.15(m,1h),7.86(dd,j=13.3,6.1hz,3h),7.09(d,j=6.5hz,1h),6.43(s,1h),6.11(d,j=1.8hz,1h),3.46(s,5h),2.00(s,4h),1.62(s,6h).13cnmr(151mhz,dmso):δc133.26,129.77,128.16,125.34,124.24,118.74,104.21,97.66,56.50,51.86,48.55,25.24,19.02.hrms-esim/z:calcdforc27h25n3o[m+h]+,408.2070;found,408.2072.
探针的溶剂化效应及其在生物成像方面的应用
图2、3、4分别是探针pbic-c、paic-c、ppic-c在不同溶剂中的紫外和荧光光谱以及其在自然光和手提紫外灯下的照片。表1、2和3依次展示了所制备探针在不同极性溶剂中的光物理性质。以上结果表明,三种探针都具有较强的溶剂致变色特性,且具有较大的荧光量子产率。接着,我们分别对pbic-c和ppic-c在氯仿和二氯甲烷溶液中逐滴加入水来观察紫外光谱和溶液颜色变化,结果如图5和6所示。为了揭示传感机理,我们进行了紫外光谱滴定和核磁实验,如图7-9所示,随着三氟乙酸的增加,在540nm处出现一个等吸收点,表明形成新的物种。我们认为可能发生了结构异化。此外,对比氢谱,我们发现,三氟乙酸的加入会导致探针的hb消失。如图10-12所示,将三种探针在dmso、dmso+tfa、chcl3中的紫外图谱分别放置同一坐标体系下观察变化。从以上实验结果,我们推测出可能的溶剂致变色机理,即探针在不同溶剂中存在两种可以进行可逆转换的异构体,如式ⅰ所示,在酸性或低极性溶剂下,原来关环的结构转变为开环,在大极性溶剂中,开环结构转变为关环结构。表2是我们对三种探针的理论计算研究。图13所示为所制备探针对线粒体和溶酶体的定位图像,从图中可以看出探针对线粒体和溶酶体都有很好的定位效果,且与商用的线粒体和溶酶体追踪染料相比,三种探针都具有较好的光稳定性,如图14所示。
综上所述,利用简单的有机合成方法,我们得到了三种能够进行线粒体和溶酶体双重定位的溶致变色荧光材料。制备的探针具有较强的溶剂致变色特性,且具有较大的荧光量子产率。细胞实验表明所制备的探针具有很好地线粒体/溶酶体定位效果,为探索线粒体和溶酶体相关疾病的病理研究开辟了道路。
- 还没有人留言评论。精彩留言会获得点赞!