一种新型冠状病毒核酸的冻干型检测试剂及其制备方法与流程
1.本发明属于核酸检测技术领域,具体涉及一种新型冠状病毒核酸的冻干型检测试剂及其制备方法。
背景技术:
2.新型冠状病毒肺炎是由新型冠状病毒(sars-cov-2)引起的疾病。目前传染源主要是新型冠状病毒感染的患者,隐性感染者也可能成为传染源,主要经呼吸道飞沫传播和接触传播,人群普遍易感。新型冠状病毒属于β冠状病毒属。
3.聚合酶链式反应(polymerase chain reaction,pcr)是一种分子生物学技术,用于扩增特定的dna片段。利用dna在体外高温时变性会变成单链,低温时引物和单链按碱基互补配对的原则,再调温度至dna聚合酶最适反应温度,dna聚合酶沿着磷酸到五碳糖(5
’‑3’
) 的方向合成互补链。pcr的特点是:特异性强、灵敏度高、简便快捷、纯度要求低、广泛用于流行性疫病、基因疾病和肿瘤等的检测。
4.反转录pcr(reverse reaction,rt-pcr)又称为逆转录pcr,是将rna的(rt)和 cdna的聚合酶链式扩增反应(pcr)相结合的技术。能够使rna检测的灵敏度提高几个数量级,使一些极为微量rna样品检测分析成为可能。rt-pcr技术灵敏而且广泛用于检测细胞、组织中基因表达水平,细胞中rna病毒的含量和直接克隆特定基因的cdna序列等。
5.目前,多种新型冠状病毒核酸检测试剂的方法也广泛应用在病原体的检测上,但是新型冠状病毒核酸检测试剂在常温环境下保存不稳定,仅一个月就失效,在2-8℃条件下保存,保存期也只有3个月左右,而且在-20℃条件下的保存期也较不理想。这就要求新型冠状病毒核酸检测试剂在保存、运输和使用中尽可能在低温条件下进行,否则诊断试剂容易失效,因此试剂的室温保存和长途运输将会受到很大的限制,容易因诊断试剂保存温度不当而使其敏感性下降甚至完全失效,最终导致疫病的检测不及时而造成疫病流行,给全球、国家和社会造成很大的困扰。
6.目前,针对新型冠状病毒核酸检测试剂缺少能在4℃或者室温长期保存的方法,而将新型冠状病毒核酸检测试剂进行冻干后保存将会是一个延长保存期,常温储存和长途运输的一种很有效的方法。
7.然而在新型冠状病毒核酸检测试剂的冷冻干燥和贮藏过程中,很多因素(化学成分、冻结速率、冻结和脱水应力、玻璃化转变温度、干燥固体中剩余水分、贮藏环境的温度和湿度等)都会影响其中活性组分的稳定性甚至会导致失活。大多数的新型冠状病毒核酸检测试剂,都需要添加合适的冷冻干燥保护剂和添加剂,也就是所谓的冻干赋形剂,配制成混合液后,才能进行有效的冷冻干燥和贮藏。
8.因此,冻干的新型冠状病毒核酸检测试剂的检测方法的开发、冻干保护剂的开发、筛选及有效组合,还有冻干工艺曲线的方法开发及优化都是客观存在且亟需解决的问题,解决这个问题也是对社会、国家,全球非常有意义的事情。
技术实现要素:
9.本发明的主要目的在于提供一种新型冠状病毒核酸的冻干型检测试剂及其制备方法,以克服现有技术的不足。
10.为实现前述发明目的,本发明采用的技术方案包括:
11.本发明实施例提供了一种新型冠状病毒核酸的冻干型检测试剂的制备方法,其包括:将热启动taq dna聚合酶和/或热启动fast taq dna聚合酶、逆转录聚合酶、taq pcr缓冲液和/或fast taq pcr缓冲液、脱氧核糖核苷酸三磷酸、冻干保护剂以及引物组充分混合形成混合物,之后经冷冻干燥,制得新型冠状病毒核酸的冻干型检测试剂。
12.进一步的,所述冻干保护剂包括如下组分:甘露醇0.1-10.0wt%和/或山梨醇0.1-10.0wt%,海藻糖1.0-20.0wt%、蔗糖1.0-20.0wt%、葡聚糖0.1-10.0wt%中的任意一种或两种以上的组合,吐温20 0.01-1.0wt%、牛血清白蛋白0.01-2.0mg/ml和/或人血清白蛋白0.01-2.0mg/ml以及聚乙二醇0.1-10.0wt%。
13.进一步的,所述引物组包括以下至少一种引物对:第一引物对,其包括序列如seq idno.1所示的正向引物和如seq id no.2所示的反向引物;第二引物对,其包括序列如seq idno.3所示的正向引物和如seq id no.4所示的反向引物;第三引物对,其包括序列如seq idno.5所示的正向引物和如seq id no.6所示的反向引物;第四引物对,其包括序列如seq idno.7所示的正向引物和如seq id no.8所示的反向引物;第五引物对,其包括序列如seq idno.9所示的正向引物和如seq id no.10所示的反向引物;第六引物对,其包括序列如seqid no.11所示的正向引物和如seq id no.12所示的反向引物;第七引物对,其包括序列如 seq id no.13所示的正向引物和如seq id no.14所示的反向引物。
14.本发明实施例还提供了由前述方法制备的新型冠状病毒核酸的冻干型检测试剂。
15.本发明实施例还提供了前述的新型冠状病毒核酸的冻干型检测试剂于制备检测新型冠状病毒的产品中的用途。
16.本发明实施例还提供了一种产品,其包含前述的新型冠状病毒核酸的冻干型检测试剂,所述产品应用于检测新型冠状病毒的方法,并且所述方法包括:
17.提供待检测样本;
18.将所述待检测样本、前述的新型冠状病毒核酸的冻干型检测试剂与水混合,之后采用 rt-pcr方法,从而实现对待检测样本的检测和分析。
19.进一步的,所述rt-pcr方法具体包括:将混合所获样品依次进行下述操作:48-50℃逆转录处理5-20mim,95℃热激处理1-5mim,95℃变性处理10-40s,退火处理10-30s,68-72℃延伸处理1-60s/kb并循环25-45次、72℃延伸处理15-60s/kb,之后与4~12℃进行临时保存,其中,退火处理的温度取决于引物,不同的引物,退火温度不同。
20.本发明实施例还提供了一种冻干保护剂,其包括如下组分:甘露醇0.1-10.0wt%和/或山梨醇0.1-10.0wt%,海藻糖1.0-20.0wt%、蔗糖1.0-20.0wt%、葡聚糖0.1-10.0wt%中的任意一种或两种以上的组合,吐温20 0.01-1.0wt%、牛血清白蛋白0.01-2.0mg/ml和/或人血清白蛋白 0.01-2.0mg/ml以及聚乙二醇0.1-10.0wt%。
21.本发明实施例还提供了前述的冻干保护剂于制备新型冠状病毒核酸的冻干型检测试剂中的用途。
22.与现有技术相比,本发明的有益效果在于:
23.(1)本发明制备的新型冠状病毒核酸的冻干型检测试剂性能符合国际标准,与普通冻干样品相比,具有稳定性高,易运输、耐储存、操作方便,实验结果更理想等优点,该产品使用时、只需要添加实际样本或者模板和水,从而大大减少了操作者的工作量和操作上的误差;
24.(2)本发发明制备的新型冠状病毒核酸的冻干型检测试剂,可以实现单重和多重的、普通的和快速的one step rt-pcr的核酸检测,最短的反应时间为20分钟左右,最快出结果的时间为30分钟以内,实现新型冠状病毒核酸试剂的快速检测分析任务;
25.(3)本发发明筛选出合适的冻干保护剂配方及比例,保证新型冠状病毒核酸检测试剂冻干前后,扩增效果和灵敏度无差别,实现新型冠状病毒核酸检测试剂的常温存储和长途运输,大大的延长新型冠状病毒核酸检测试剂的保质期;
26.(4)本发明使用的冻干保护剂采用的原料成本低、操作简单、可以大规模生产,降低了生产成本,冻干后的新型冠状病毒核酸检测试剂能够在室温下长期保存,而不影响其扩增效率和灵敏度,能最大限度地减少制品在分装和冻干过程中各种因素对酶等活性物质的损伤,可有效提高试剂的稳定性,可有效的延长新型冠状病毒核酸检测试剂的保存期限,实现新型冠状病毒核酸检测试剂的室温保存和长途运输,使室温采样和检测实现可能,大大加快了检测速度,降低了新型冠状病毒核酸检测试剂的运输成本,解决了目前液态新型冠状病毒核酸检测试剂所带来的冷链运输、保存条件不当,检出率低等一系列问题,为国家、医院、定点检测机构减少新型冠状病毒核酸检测试剂保存的烦恼,同时也为基层现场的检测、一些非发达国家、高温国家和地区的正确使用新型冠状病毒核酸检测试剂成为可能;本发明中的冻干保护剂不仅具有保护生物制品活性的作用,而且具有赋形剂和抗氧化剂的作用,可在冻干过程中维持制品的稳定性;
27.(5)本发明对冻干的工艺进行了优化,在不影响冻干新型冠状病毒核酸检测试剂的有效扩增和灵敏度的前提下,优化了工艺参数,减少冻干总时间(由44h减少到18h),达到了节能环保的要求,同时降低了新型冠状病毒核酸检测试剂的生产成本;
28.(6)本发明制备的新型冠状病毒核酸的冻干型检测试剂,在不影响试剂正常扩增的前提和灵敏度下,加入有效的冻干保护剂,经过冻干工艺的开发和优化,最终成品为白色疏松体,复水后为澄明液体,无异物,保存期限最长达3年。
附图说明
29.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
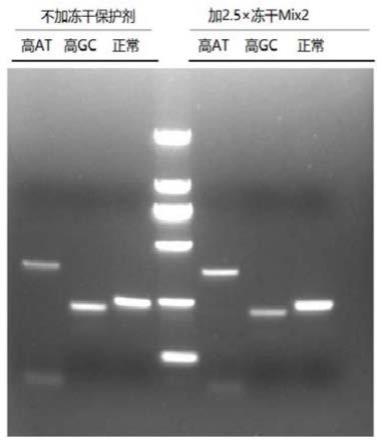
30.图1是本发明实施例1中不加冻干保护剂和添加冻干保护剂的新型冠状病毒核酸检测试剂检测样本的凝胶电泳对比图;
31.图2是本发明实施例2中不加冻干保护剂和添加冻干保护剂的新型冠状病毒核酸检测试剂检测样本的凝胶电泳对比图;
32.图3是本发明实施例3中不加冻干保护剂和添加冻干保护剂的新型冠状病毒核酸检测试剂检测样本的凝胶电泳对比图;
33.图4是本发明实施例4中不加冻干保护剂和添加冻干保护剂的新型冠状病毒核酸检测试剂检测样本的凝胶电泳对比图;
34.图5是本发明实施例5中不加冻干保护剂和添加冻干保护剂的新型冠状病毒核酸检测试剂检测样本的凝胶电泳对比图;
35.图6是本发明实施例6中不同浓度海藻糖冻干保护剂的新型冠状病毒核酸检测试剂检测样本的凝胶电泳对比图;
36.图7a-图7b分别为本发明实施例7中保存不同时间的不同的新型冻干型冠状病毒核酸检测试剂与待测样本混合后的凝胶电泳图。
具体实施方式
37.鉴于现有技术的缺陷,本案发明人经长期研究和大量实践,得以提出本发明的技术方案,下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
38.本发明实施例的一个方面提供了一种新型冠状病毒核酸的冻干型检测试剂的制备方法,其包括:将热启动taq dna聚合酶(hs taq)和/或热启动fast taq dna聚合酶(hs fast taq)、逆转录聚合酶(m-mlv)、taq pcr缓冲液(taq pcr buffer)和/或fast taq pcr缓冲液(fasttaq pcr buffer)、脱氧核糖核苷酸三磷酸(dntp)、冻干保护剂以及引物组充分混合形成混合物,之后经冷冻干燥,制得新型冠状病毒核酸的冻干型检测试剂。
39.本发明中的热启动taq dna聚合酶是由苏州工业园区龙兆生物科技研究院有限公司自主诱导表达、分离纯化和修饰的,可以用于冻干体系的酶,市面上的商品酶因含有某些物质,不能用于冻干。
40.在一些较为具体的实施方案中,所述混合物包括如下组分:热启动taq dna聚合酶 0.5-10μg/ml和/或热启动fast taq dna聚合酶0.5-10μg/ml、逆转录聚合酶0.5-6μg/ml、10
×
taqpcr缓冲液和/或10
×
fast taq pcr缓冲液、脱氧核糖核苷酸三磷酸0.1-0.5mmol/l、冻干保护剂0.01mol/l以及引物组0.1-0.5μmol/l。
41.在一些较为具体的实施方案中,所述冻干保护剂包括如下组分:甘露醇0.1-10.0wt%和/ 或山梨醇0.1-10.0wt%,海藻糖1.0-20.0wt%、蔗糖1.0-20.0wt%、葡聚糖0.1-10.0wt%中的任意一种或两种以上的组合,吐温20 0.01-1.0wt%、牛血清白蛋白0.01-2.0mg/ml和/或人血清白蛋白0.01-2.0mg/ml以及聚乙二醇0.1-10.0wt%。
42.进一步的,所述冻干保护剂包括如下组分:甘露醇0.1-10.0wt%、海藻糖1.0-20.0wt%、蔗糖1.0-20.0wt%、山梨醇0.1-10.0wt%、吐温20 0.01-1.0wt%、牛血清白蛋白0.01-2.0mg/ml、人血清白蛋白0.01-2.0mg/ml、葡聚糖0.1-10.0wt%以及聚乙二醇0.1-10.0wt%。
43.在一些较为具体的实施方案中,所述引物组包括以下至少一种引物对:
44.第一引物对(即引物对n),其包括序列如seq id no.1所示的正向引物(即n基因特异性正向引物f1)和如seq id no.2所示的反向引物(即n基因特异性反向引物r1);
45.第二引物对(即引物对e),其包括序列如seq id no.3所示的正向引物(即e基因特异性正向引物f1)和如seq id no.4所示的反向引物(即e基因特异性反向引物r1);
46.第三引物对(即引物对gapdh),其包括序列如seq id no.5所示的正向引物(即gapdh 特异性正向引物f)和如seq id no.6所示的反向引物(即gapdh特异性反向引物r);
47.第四引物对(即引物对at),其包括序列如seq id no.7所示的正向引物(即高at特异性正向引物f)和如seq id no.8所示的反向引物(即高at特异性反向引物r);
48.第五引物对(即引物对gc),其包括序列如seq id no.9所示的正向引物(即高gc特异性正向引物f)和如seq id no.10所示的反向引物(即高gc特异性反向引物r);
49.第六引物对(即引物对g),其包括序列如seq id no.11所示的正向引物(即特g异性正向引物f)和如seq id no.12所示的反向引物(即g特异性反向引物r);
50.第七引物对(即引物对o),其包括序列如seq id no.13所示的正向引物(即orf基因特异性正向引物f)和如seq id no.14所示的反向引物(即orf基因特异性反向引物r)。
51.在一些较为具体的实施方案中,所述制备方法还包括:将所述混合物于-45℃预冻2~10h,之后于-45~20℃进行一次干燥10~24h,然后于20~25℃进行二次干燥1~10h,获得所述新型冠状病毒核酸的冻干型检测试剂。
52.本发明实施例的另一个方面还提供了由前述方法制备的新型冠状病毒核酸的冻干型检测试剂。
53.本发明实施例的另一个方面还提供了前述的新型冠状病毒核酸的冻干型检测试剂于制备检测新型冠状病毒的产品中的用途。
54.本发明实施例的另一个方面还提供了一种产品,其包含前述的新型冠状病毒核酸的冻干型检测试剂,所述产品应用于检测新型冠状病毒的方法,并且所述方法包括:
55.提供待检测样本;
56.将所述待检测样本、前述的新型冠状病毒核酸的冻干型检测试剂与水混合,之后采用 rt-pcr方法,从而实现对待检测样本的检测和分析。
57.进一步的,所述rt-pcr方法具体包括:将混合所获样品依次进行下述操作:48-50℃逆转录处理5-20mim,95℃热激处理1-5mim,95℃变性处理10-40s,退火温度(tm℃)退火处理10-30s,68-72℃延伸处理1-60s/kb并循环25-45次、72℃延伸处理15-60s/kb,之后与4~12℃进行临时保存,其中,退火处理的温度(tm℃)取决于引物,不同的引物,退火温度不同。
58.本发明实施例的另一个方面还提供了一种冻干保护剂,其包括如下组分:甘露醇 0.1-10.0wt%和/或山梨醇0.1-10.0wt%,海藻糖1.0-20.0wt%、蔗糖1.0-20.0wt%、葡聚糖 0.1-10.0wt%中的任意一种或两种以上的组合,吐温20 0.01-1.0wt%、牛血清白蛋白 0.01-2.0mg/ml和/或人血清白蛋白0.01-2.0mg/ml以及聚乙二醇0.1-10.0wt%。
59.进一步的,所述冻干保护剂包括如下组分:甘露醇0.1-10.0wt%、海藻糖1.0-20.0wt%、蔗糖1.0-20.0wt%、山梨醇0.1-10.0wt%、吐温20 0.01-1.0wt%、牛血清白蛋白0.01-2.0mg/ml、人血清白蛋白0.01-2.0mg/ml、葡聚糖0.1-10.0wt%以及聚乙二醇0.1-10.0wt%。
60.本发明实施例的另一个方面还提供了前述的冻干保护剂于制备新型冠状病毒核酸的冻干型检测试剂中的用途。
61.本发明中,新型冠状病毒核酸的冻干型检测试剂的原理如下:在高效反转录酶的作用下,以rna为模板,以引物为起点合成与rna模板互补的cdna链。在热启动taq酶的作用
下,经高温变性、中温退火及延伸的循环,使特异dna片段的拷贝数放大,最终实现单重和多重的one step rt-pcr的核酸检测试剂的开发,也实现了普通的和快速的one step rt-pcr的核酸检测试剂的开发,最短反应时间为20分钟左右,最快出结果的时间为30分钟控制在以内,实现新型冠状病毒核酸试剂的快速检测和分析任务;
62.本发明筛选合适的冻干保护剂配方及比例,保证新型冠状病毒核酸检测试剂冻干前后,扩增效果无差别,扩增的灵敏度不受影响,实现新型冠状病毒核酸检测试剂的常温存储和长途运输,延长新型冠状病毒核酸检测试剂的保质期;新型冠状病毒核酸检测试剂的冷冻干燥过程是一个多步骤过程,会产生低温、冻结和脱水等多种效应;即使成功完成冷冻干燥过程后,在长期保存过程中也很难保证冻干新型冠状病毒核酸检测试剂活性组分的稳定性。为了防止在冷冻干燥和贮藏过程中活性组分的变性,本发明研究和探索了大量有效的保护添加剂。冻干保护剂的作用:在冻结和干燥过程中,可以防止活性组分发生变性的物质,如甘油、二甲亚砜(dmso)、海藻糖、蔗糖、聚乙烯吡咯烷酮(pvp)等;填充剂:能防止有效组分随水蒸气一起升华逸散,并使有效组分成形的物质,如甘露醇、乳糖、明胶等;聚合物是指由简单的小分子(称为单体),经过聚合反应,所形成的巨大分子。其分子量通常相当大,可能含数千到数十万个原子。有的聚合物形成链状,有的形成网状。聚合物具有能提高生物制品混合溶液的玻璃化转变温度等有利因素,因而在有些生物制品的配方中常常加入多种聚合物类保护剂。表面活性剂:通常把凡是能降低界面张力的,由亲水和亲油基组成的化合物,称为表面活性剂。它们分子中的碳氢链部分是造成溶于油的原因;而分子中的极性基(如-cooh,-oh)则对水有亲和力。当这些分子处于空气—水界面或油—水界面时,亲水基会定位在水相,而亲油基则指向气相或油相。表面活性剂可分为离子型和非离子型两大类。凡是溶于水时能电离成离子的,称为离子型表面活性剂;否则,称为非离子型表面活性剂。在冷冻干燥全过程中,表面活性剂既能在冻结和脱水过程中降低冰水界面张力所引起的冻结和脱水变性;又能在复水过程中对活性组分起到润湿剂和重褶皱剂的作用。
63.常用的保护剂有如下几类物质:
64.a)糖类/多元醇:蔗糖、海藻糖、甘露醇、乳糖、葡萄糖、麦芽糖等;
65.b)聚合物:hes、pvp、peg、葡聚糖、白蛋白等;
66.c)无水溶剂:乙烯乙二醇、甘油、dmso、dmf等;
67.d)表面活性剂:tween20、tween 80等;
68.e)氨基酸:l-丝氨酸、谷氨酸钠、丙氨酸、甘氨酸、肌氨酸等;
69.f)盐和胺:磷酸盐、醋酸盐、柠檬酸盐等。
70.本发明中,冻干是一个使物质稳定化的过程,在该过程中,首先使产品冷冻,然后将溶剂升华和解吸附,使产品中的含水量减少到不足以支持生物生长和发生化学反应的程度。新型冠状病毒核酸检测试剂的冻干具有高稳定性、易运输、耐储存、操作方便、实验结果更理想等优点。使用时只需要添加相应的实际样本或者模板和水,大大减少了操作者的工作量和操作上的误差。
71.本发明还进行了冻干工艺方法的开发及优化:在不影响冻干新型冠状病毒核酸检测试剂的有效扩增的前提下,不影响检测灵敏度的情况下,优化工艺参数,减少冻干总时间,达到节能环保的要求,同时也降低新型冠状病毒核酸检测试剂的生产成本。
72.在新型冠状病毒核酸检测试剂的冷冻干燥过程中,主要有三种效应会导致活性组
分的变性:低温效应、冻结效应和脱水效应。新型冠状病毒核酸检测试剂中活性组分在降温与复温过程的一定温度范围内会发生变性。
73.一、冻结效应(包括离子浓度的增加、冰晶的形成与生长、ph值变化以及相分离等)
74.1、在冻结过程中,不断结晶会导致溶液的浓度快速升高。小分子糖在最大冻结浓缩基质中的计算浓度高达80%。当溶液浓度发生变化时,离子浓度增加,促进了化学反应。
75.2、在冻结过程中,也会产生大量的冰-水界面。其中活性组分分子,如蛋白质,可能会被吸附到界面上,从而可能破坏蛋白质的天然褶皱结构,最终导致蛋白质变性。
76.3、在冻结过程中,溶液的ph值也会发生变化。如在添加有ph值为7的磷酸盐缓冲液 (nah2po4和na2hpo4的摩尔比为0.72)的蛋白质溶液冻结过程中,由于nah2po4的溶解度远远大于na2hpo4,当溶液达到三相共晶点时,它们之间的摩尔比为57,最终导致了ph值的很大改变。蛋白质发生物理聚集和化学变性。
77.二、脱水效应
78.1、水溶液中蛋白质经过充分水合作用后,在蛋白质分子表面附着一单层水,就是所说的水合层。一般来讲,参与完全水合作用的水含量为0.30-0.35g(水)/g(蛋白质)。而在冻干蛋白质产品中水的含量一般不超过10.00%,因此,必定有一部分结合水在干燥过程中被除去。
79.2、结合水的去除很可能破坏蛋白质的天然结构,最终导致蛋白质变性。是因为富含结合水的蛋白质在脱水过程中暴露在乏水环境中,将质子转化为带电羧酸基团,破坏了蛋白质中电荷平衡,电荷密度的降低可能促进蛋白质分子之间的疏水作用,从而使蛋白质发生聚集。
80.三、储藏过程
81.1、蛋白质凝聚:是冻干新型冠状病毒核酸检测试剂的活性组分在贮藏过程中发生变性的主要因素之一。导致蛋白质凝集可能是物理(非共价)相互作用,也可能是蛋白质发生化学凝集(共价)。
82.2、脱酰胺作用:也是蛋白质发生变性的主要途径之一。天冬酰胺(asn)和谷氨酰胺(gln) 是蛋白质中易于发生脱酰胺作用的两种氨基酸。
83.3、非酶褐变:也称作maillard反应。它使得还原性糖(如葡萄糖)与蛋白质中的赖氨酸 (lysine)和精氨酸(arginine)形成碳水络合物。
84.4、氧化反应:蛋白质中蛋氨酸met,胱氨酸cys,组氨酸his,色氨酸trp和酪氨酸tyr 残基的侧链是发生氧化反应的可能位置。
85.5、水解作用:冻干的蛋白质中含有极少量的水分,但在贮藏过程中仍然会发生水解作用。
86.四、冻干原理:真空冷冻干燥是指利用升华原理进行干燥的一种技术。被干燥物在低温下快速冻结,然后在适用的真空环境下,使冻结的水分子直接升华为蒸气逸出的过程,该过程称为冻干。冻干物在干燥前始终处于低温,同时冰晶均匀分布在物质中,升华过程不会因为脱水而发生浓缩现象,避免了由水蒸气产生的泡沫、氧化等副作用,干燥物质呈干海绵多孔状,体积基本不变,极易融水而恢复原状,最大程度防止干燥物质的物理化和生物学方面的变形。因此,冻干是一种对被干燥物性质影响最小、最安全的干燥方法。
87.五、冻干曲线程序的制定:生物制品经冷冻干燥后具有一定的物理形态,如均匀的
颜色、合格的残余水份含量、良好的溶解性、高的存活率或较长的保存期等。因此,不仅要对冻干过程和冻干后的密封保存进行控制,更重要的是对冷冻干燥过程的每一阶段的各参数进行全面的控制,才能得到优质的产品。冻干曲线和时序就是进行冷冻干燥过程控制的基本依据。
88.冻干曲线和时序不仅是手工操作冻干机的依据,也是自动控制冻干机操作的依据。冻干曲线是冻干箱板层温度与时间之间的关系曲线。一般以温度为纵坐标,时间为横坐标。它反映了在冻干过程中,不同时间板层温度的变化情况。冻干时序是在冻干过程中不同时间,各种设备的启闭运行情况。
89.制定冻干曲线以板层为依据是因为产品温度是受板层温度支配的。控制了板层温度也就控制了产品温度。制定冻干曲线要考虑下列因素:
90.产品的品种:产品不同则共熔点亦不同,共熔点低的产品要求预冻的温度低;加热时板层的温度亦相应要低些。有些产品受冷冻的影响较大,有些产品则影响较小。另外产品不同,对残余水份的要求也不同。为了长期保存产品,有些产品要求残余水份含量低些。有些则要求高些。残余水份含量要求低的产品,冻干时间需长些。残余水份含量要求高的产品,冻干时间可缩短。
91.制定冻干曲线和时序时要确定下列数据:
92.1、预冻:把物料溶液或者加好物料的西林瓶或者八连管或者定制模具放入物料盘,样品探头放到物料中,再把物料盘放到隔板上,预冻开始,大约6-10小时,视物料的多少和性质而定,正常物料冻到冰点之后在续冻2个小时即可。知道共晶点时可以观察样品温度的变化定预冻时间。
93.2、预冻速度:大部分机器不能进行控制,因此只能以预冻温度和装箱时间来决定预冻的速率,要求预冻的速率快,则冻干箱先降至降低的温度,然后才让产品进箱;要求预冻的速率慢,则产品进箱之后再让冻干箱降温。
94.3、预冻的最低温度:这个温度取决于产品的共熔点温度,预冻最低温度应低于该产品的共熔点温度的5℃~7℃。
95.4、预冻的时间:产品装量多,使用的容器底厚而不平整,不是把产品直接放在冻干箱板层上冻干,冻干箱冷冻机能力差,每一板层之间以及每一板层的个部分之间温差大的机器,则要求预冻时间长些。为了使箱内每一瓶产品全部冻实,一般要求在样品的温度达到预定的最低温度之后再保持1~2小时的时间。
96.5、冷凝器降温的时间:冷凝器要求在预冻末期,预冻尚未结束,抽真空之前开始降温。降温时间要由冷凝器机器的降温性能来决定,要求在预冻结束抽真空的时候,冷凝器的温度要达到-40℃左右,好的机器一般半小时后开始降温。冷凝器的降温通常从开始之后一直持续到冻干结束为止。温度始终应在-40℃以下。
97.6、抽真空时间:预冻好样品后按下真空计键,真空表显示正常大气压值(90kpa-110kpa), 锁紧门锁,关紧充气阀,按下真空泵键,真空泵开始运转。预冻结束就是开始抽真空的时间,要求在半小时左右的时间真空度能达到20pa。抽真空的同时,也是冻干箱冷凝器之间的真空阀打开的时候,真空泵和真空阀门打开同样一直持续到冻干结束为止。
98.7、预冻结束的时间:当物料被预冻至共熔点温度以下约2小时左右(视物料冻干量而定),通常在抽真空及进行程序控温启动之前结束。
99.8、开始加热时间:打开加热开关,真空干燥开始,(升华干燥阶段真空值在20pa左右为正常),真空度达到30pa以内,设定隔板温度,5-10℃为一个升温阶梯,一般升温到约35℃左右为宜。一直到干燥结束。一般认为开始加热的时间(实际上抽真空开始升华即已开始)。开始加热是在真空度达到10pa之后(接近1
×
10-1
毫米汞柱),开始加热;有些冻干机是在抽真空之后半小时开始进行程序控温,这时真空度已达到10pa甚至更低。
100.9、产品加热的最高许可温度:根据产品来决定,在升华时板层的加热温度可以超过产品的最高许可温度。因为这时产品仍停留在低温阶段,提高板层温度可促进升华;但冻干后期板层温度需下降到与产品的最高许可温度相一致,由于传热的温差,板层的温度可比产品的最高许可温度略高少许。
101.冻干的总时间:为预冻时间,加上升华时间和第二阶段工作的时间。总时间确定,冻干结束时间也确定。这个时间根据产品的品种,瓶子的品种、装箱方式、装量、机器性能等来决定,一般冷冻工作的时间较长,在18~24小时左右,有些特殊的产品需要几天的时间。
102.下面结合若干优选实施例及附图对本发明的技术方案做进一步详细说明,本实施例在以发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
103.下面所用的实施例中所采用的实验材料,如无特殊说明,均可由常规的生化试剂公司购买得到。
104.实施例1:单重新型冠状病毒核酸检测试剂
105.1、冻干的保护剂的组分如表1所示:
106.表1冻干保护剂配方:2.5
×
冻干mix1
[0107][0108]
2、新型冠状病毒核酸的冻干型检测试剂的制备:
[0109]
表2冻干型检测试剂的组分
[0110]
冻干型检测试剂的各组分如表2所示:
[0111][0112]
将冻干型检测试剂的各组分混合,之后经冷冻干燥,制得新型冠状病毒核酸的冻干型检测试剂,其中冷冻干燥的工艺如表3所示:共计34h,抽空段:2,恒温段:10;
[0113]
表3冷冻干燥工艺
[0114][0115]
3、将上述制备的冻干型检测试剂与待检测样本和水补足20μl,混合均匀,之后进行 hs-taq one step rt-pcr反应,具体步骤如表4所示:
[0116]
表4 hs-taq one step rt-pcr反应程序
[0117][0118][0119]
同时作为对比,使用不加冻干保护剂的新型冠状病毒核酸检测试剂,直接与待检测样本混合,之后进行hs-taq one step rt-pcr反应,结果如图1所示。
[0120]
实施例2:单重新型冠状病毒核酸检测试剂
[0121]
1、冻干的保护剂的组分如表5所示:
[0122]
表5冻干保护剂配方:2.5
×
冻干mix2
[0123][0124]
2、新型冠状病毒核酸的冻干型检测试剂的制备:
[0125]
表6冻干型检测试剂的组分
[0126]
冻干型检测试剂的各组分如表6所示:
[0127][0128]
将冻干型检测试剂的各组分混合,之后经冷冻干燥,制得新型冠状病毒核酸的冻干型检测试剂,其中冷冻干燥的工艺如表7所示:共计32h,抽空段:2,恒温段:11;
[0129]
表7冷冻干燥工艺
[0130][0131]
3、将上述制备的冻干型检测试剂与待检测样本和水补足20μl,混合均匀,之后进行 hs-taq one step rt-pcr反应,具体步骤如表8所示:
[0132]
表8 hs-taq one step rt-pcr反应程序
[0133][0134]
同时作为对比,使用不加冻干保护剂的新型冠状病毒核酸检测试剂,直接与待检
测样本混合,之后进行hs-taq one step rt-pcr反应,结果如图2所示。
[0135]
实施例3:单重新型冠状病毒核酸检测试剂
[0136]
1、冻干的保护剂的组分如表9所示:
[0137]
表9冻干保护剂配方:2.5
×
冻干mix3
[0138][0139][0140]
2、新型冠状病毒核酸的冻干型检测试剂的制备:
[0141]
表10冻干型检测试剂的组分
[0142]
冻干型检测试剂的各组分如表10所示:
[0143][0144]
将冻干型检测试剂的各组分混合,之后经冷冻干燥,制得新型冠状病毒核酸的冻干型检测试剂,其中冷冻干燥的工艺如表11所示:共计29小时,抽空段:2,恒温段:11;
[0145]
表11冷冻干燥工艺
[0146][0147]
[0148]
3、将上述制备的冻干型检测试剂与待检测样本和水补足20μl,混合均匀,之后进行 hs-taq one step rt-pcr反应,具体步骤如表12所示:
[0149]
表12 hs-taq one step rt-pcr反应程序
[0150][0151]
同时作为对比,使用不加冻干保护剂的新型冠状病毒核酸检测试剂,直接与待检测样本混合,之后进行hs-taq one step rt-pcr反应,结果如图3所示。
[0152]
实施例4:多重新型冠状病毒核酸检测试剂
[0153]
1、冻干的保护剂的组分如表13所示:
[0154]
表13冻干保护剂配方:2.5
×
冻干mix4
[0155][0156]
2、新型冠状病毒核酸的冻干型检测试剂的制备:
[0157]
表14冻干型检测试剂的组分
[0158]
冻干型检测试剂的各组分如表14所示:
[0159][0160][0161]
将冻干型检测试剂的各组分混合,之后经冷冻干燥,制得新型冠状病毒核酸的冻
干型检测试剂,其中冷冻干燥的工艺如表15所示:共计24小时,抽空段:2,恒温段:11;
[0162]
表15冷冻干燥工艺
[0163][0164]
3、将上述制备的冻干型检测试剂与待检测样本和水补足20μl,混合均匀,之后进行 hs-taq one step rt-pcr反应,具体步骤如表16所示:
[0165]
表16 hs-taq one step rt-pcr反应程序
[0166][0167][0168]
同时作为对比,使用不加冻干保护剂的新型冠状病毒核酸检测试剂,直接与待检测样本混合,之后进行hs-taq one step rt-pcr反应,结果如图4所示。
[0169]
实施例5:多重新型冠状病毒核酸检测试剂
[0170]
1、冻干的保护剂的组分如表17所示:
[0171]
表17冻干保护剂配方:2.5
×
冻干mix5
[0172][0173]
2、新型冠状病毒核酸的冻干型检测试剂的制备:
[0174]
表18冻干型检测试剂的组分
[0175]
冻干型检测试剂的各组分如表18所示:
[0176][0177]
将冻干型检测试剂的各组分混合,之后经冷冻干燥,制得新型冠状病毒核酸的冻干型检测试剂,其中冷冻干燥的工艺如表19所示:共计19h,抽空段:2,恒温段:11,如表20;
[0178]
表19冷冻干燥工艺
[0179][0180]
3、将上述制备的冻干型检测试剂与待检测样本和水补足20μl,混合均匀,之后进行 hs-taq one step rt-pcr反应,具体步骤如表20所示:
[0181]
表20 hs-taq one step rt-pcr反应程序
[0182][0183]
同时作为对比,使用不加冻干保护剂的新型冠状病毒核酸检测试剂,直接与待检测样本混合,之后进行hs-taq one step rt-pcr反应,结果如图5所示。
[0184]
实施例6:多重新型冠状病毒核酸检测试剂
[0185]
1、冻干的保护剂的组分如表21所示:
[0186]
表21冻干保护剂配方:2.5
×
冻干mix6
[0187][0188]
2、新型冠状病毒核酸的冻干型检测试剂的制备:
[0189]
表22冻干型检测试剂的组分
[0190]
冻干型检测试剂的各组分如表22所示:
[0191][0192]
将冻干型检测试剂的各组分混合,之后经冷冻干燥,制得新型冠状病毒核酸的冻干型检测试剂,其中冷冻干燥的工艺如表23所示:共计19小时,抽空段:2,恒温段:11,如表 20;
[0193]
表23冷冻干燥工艺
[0194][0195][0196]
3、将上述制备的冻干型检测试剂与待检测样本(细胞+病毒和拭子+病毒)和水补足20μl,混合均匀,之后进行hs-taq one step rt-pcr反应,具体步骤如表24所示:
[0197]
表24 hs-taq one step rt-pcr反应程序
[0198][0199]
4、以添加不同浓度的海藻糖作为对比,使用含有不同浓度海藻糖的冻干保护剂的新型冠状病毒核酸检测试剂,直接与待检测样本混合,之后进行hs-taq one step rt-pcr反应,结果如图6所示。
[0200]
5、图6表明:不同浓度的海藻糖的保护效果不同,2wt%和8wt%的海藻糖的效果好于中间浓度的海藻糖。
[0201]
实施例7:新型冠状病毒核酸检测试剂的稳定性考察实验
[0202]
1、冻干的保护剂的组分如表25所示:
[0203]
表25冻干保护剂配方:2.5
×
冻干mix7
[0204][0205][0206]
2、新型冠状病毒核酸的冻干型检测试剂的制备:
[0207]
表26冻干型检测试剂的组分
[0208]
冻干型检测试剂的各组分如表26所示:
[0209][0210]
表27冻干型检测试剂的组分
[0211]
冻干型检测试剂的各组分如表27所示:
[0212][0213]
分别将表26以及表27中的冻干型检测试剂的各组分混合,之后经冷冻干燥,制得新型冠状病毒核酸的冻干型检测试剂,其中冷冻干燥的工艺如表28所示:共计20h,抽空段:2,恒温段:12,如表28;
[0214]
表28冷冻干燥工艺
[0215]
[0216][0217]
3、将按照表26以及表27经冻干工艺制备的冻干型检测试剂进行密闭的封口保存,并且置于常温干燥环境下,保存不同时间后,再分别与待检测样本(k562总rna和假病毒)和水补足20μl,混合均匀,之后进行hs-taq one step rt-pcr反应,具体步骤如表28所示:
[0218]
表29 hs-taq one step rt-pcr反应程序
[0219][0220]
4、以保存0天的新型冻干型检测试剂作为对比,使用保存不同时间的不同的新型冻干型冠状病毒核酸检测试剂(分别由表26、表27的组分组成),直接与待检测样本混合,之后进行hs-taq one step rt-pcr反应,结果如图7a、图7b所示。(表26冻干型检测试剂的组分冻干后用来检测k562总rna,对应图7a;表27冻干型检测试剂的组分冻干后用来检测假病毒,对应图7b;)
[0221]
5、图7a-图7b表明:保存6个月后,新型冻干型冠状病毒核酸检测试剂的稳定性基本未受影响,新型冠状病毒核酸检测试剂依然可以进行有效检出。说明本发明制备的新型冠状病毒核酸的冻干型检测试剂保存期限长。
[0222]
此外,本案发明人还参照前述实施例,以本说明书述及的其它原料、工艺操作、工艺条件进行了试验,并均获得了较为理想的结果。
[0223]
本发明的各方面、实施例、特征及实例应视为在所有方面为说明性的且不打算限制本发明,本发明的范围仅由权利要求书界定。在不背离所主张的本发明的精神及范围的情况下,所属领域的技术人员将明了其它实施例、修改及使用。
[0224]
在本发明案中标题及章节的使用不意味着限制本发明;每一章节可应用于本发明的任何方面、实施例或特征。
[0225]
在本发明案通篇中,在将组合物描述为具有、包含或包括特定组份之处或者在将
过程描述为具有、包含或包括特定过程步骤之处,预期本发明教示的组合物也基本上由所叙述组份组成或由所叙述组份组成,且本发明教示的过程也基本上由所叙述过程步骤组成或由所叙述过程步骤组组成。
[0226]
应理解,各步骤的次序或执行特定动作的次序并非十分重要,只要本发明教示保持可操作即可。此外,可同时进行两个或两个以上步骤或动作。
[0227]
尽管已参考说明性实施例描述了本发明,但所属领域的技术人员将理解,在不背离本发明的精神及范围的情况下可做出各种其它改变、省略及/或添加且可用实质等效物替代所述实施例的元件。另外,可在不背离本发明的范围的情况下做出许多修改以使特定情形或材料适应本发明的教示。因此,本文并不打算将本发明限制于用于执行本发明的所揭示特定实施例,而是打算使本发明将包含归属于所附权利要求书的范围内的所有实施例。此外,除非具体陈述,否则术语第一、第二等的任何使用不表示任何次序或重要性,而是使用术语第一、第二等来区分一个元素与另一元素。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1