从表皮生长因子、凝集素和Tat蛋白衍生的支架蛋白的制作方法
本发明属于蛋白质工程领域。更具体的说,本发明涉及从表皮生长因子、凝集素和tat蛋白衍生的重组支架蛋白。
背景技术:
几十年来,通过生物技术,获得了许多能与靶分子特异性结合的亲和功能蛋白,被广泛应用于生物、医药、环境、农业、食品等诸多领域。在这些亲和功能蛋白中,抗体就是典型代表。长期以来,抗体已被深入地应用于临床疾病治疗、诊断及基础研究中,成为人类战胜疾病的有效工具。然而,抗体作为大分子蛋白,存在天然的局限性,如超大的分子量,低组织渗透性,稳定性差,生产成本高,使用剂量大及潜在的免疫原性等。为了克服这些问题,人们可以设计或选择某些蛋白质作为支架蛋白(或称母核蛋白),在保证支架蛋白主体结构不变的基础上,通过对其分子中8~30个氨基酸位点进行随机化突变,从而构建可供筛选的蛋白质组合文库,再通过噬菌体、酵母、细胞、核糖体、mrna、cdna或snap等展示技术,可以获得能与靶分子特异性结合的亲和功能蛋白。
现有支架蛋白如专利申请号为200780050902.4的源自嗜酸热硫化叶菌(sulfolobusacidocaldarius)衍生的支架蛋白sac7d,又如专利申请号为201180021908.5的金黄色葡萄球菌a蛋白z结构域衍生的支架蛋白、专利申请号为201180029216.5的iii型纤连蛋白结构域“fn3”衍生的支架蛋白,再如专利申请号为201480022070.5的植物半胱氨酸蛋白酶抑制剂衍生的支架蛋白以及胆汁三烯结合蛋白衍生的支架蛋白和锚蛋白重复序列衍生的支架蛋白等,已经展现出其巨大的潜在商业价值,并逐渐成为新的基础研究热点和技术创新点。
基于支架蛋白取得的亲和功能蛋白与抗体相比,具有以下优势:①分子量小,组织渗透性强,更快到达病灶部位;②分子稳定性好;③可以获得与靶标结合具有更高亲合力的结合物;④在辨别相关小分子之间微小差异方面,优于通过免疫获得的抗体;⑤作用靶点范围广;⑥低免疫源性;⑦可以采用工程化手段进行生产,成本低;⑧可以实现双靶点或多靶点特异性功能蛋白设计。
糖蛋白是含有寡糖链的蛋白质,由寡糖链与肽链中某些氨基酸残基以共价键连接而成。糖蛋白普遍存在于动物、植物及微生物中,种类繁多,功能广泛。糖蛋白主要有以下几种:①可溶性糖蛋白,包括存在于细胞内液、体液及腺体分泌的粘液中的酶、激素、抗体、补体、生长因子、干扰素、凝集素和毒素等蛋白质;②膜结合蛋白,包括酶、受体、凝集素及运载蛋白等。此类蛋白常参与细胞识别,可作为特定细胞或细胞在特定阶段的表面标志或表面抗原;③结构糖蛋白,包括如胶原及各种非胶原糖蛋白(纤粘连蛋白、层粘连蛋白等),为细胞外基质中的不溶性大分子糖蛋白。它们的功能不仅仅是作为细胞外基质的结构成分起支持、连接及缓冲作用,更重要的是参与细胞的识别、粘着及迁移,并调控细胞的增殖及分化。
表皮生长因子(epidermalgrowthfactor,egf)是由53个氨基酸组成的多肽,其中,位于egf分子中的20~31氨基酸残基(序列为:cmyiealdkyac)是受体结合域(receptorbindingdomain,rbd)。研究表明,egf的rbd与表皮生长因子受体(epidermalgrowthfactorreceptor,egfr)的结合具有高特异性、高选择性和高亲和力。作为最重要的配体,egf不但参与正常细胞的增殖和分化,而且还参与肿瘤的形成与演进。由于egfr与肺癌、乳腺癌、结肠癌、肝癌、卵巢癌、膀胱癌、脑胶质瘤以及头颈部肿瘤等肿瘤细胞的恶变、粘附、转移以及血管生成等密切相关,因此,egfr作为多种临床常见恶性肿瘤针对的靶点,已经被深入研究和临床应用,备受关注。
纤维胶凝蛋白(ficolin)是一种c型凝集素蛋白,是机体天然免疫中的关键分子。研究证实,ficolin含有胶原样结构域(collagen-likedomain,clr)和纤维蛋白原样结构域(fibrinogen-likedomain,fgd),fgd通过与病原微生物表面的脂多糖和甘露糖样结构产生相互作用,参与对病原微生物表面糖类配体的识别,而clr则具有激活补体凝集素途径和调理吞噬作用,在天然免疫中发挥重要的免疫作用。
甘露糖结合凝集素(mannan-bindinglectin,mbl)是一种ca2+依赖性c型凝集素蛋白,其结构从n端到c端依次分为:信号肽区、半胱氨酸富集区、胶原区、卷曲螺旋区(又称颈区)和糖基识别域(carbohydrate-recognitiondomain,crd)。其中,crd是mbl的识别功能区,可选择性识别并结合以甘露糖、n-乙酰甘露糖胺、n-乙酰葡糖胺、岩藻糖为糖基的糖蛋白,这些糖蛋白分布于细菌、病毒、真菌、寄生虫等多种病原微生物表面。当微生物进入人体后,mbl的crd识别并结合病原微生物表面糖蛋白,然后,通过mbl相关丝氨酸蛋白酶(mannan-bindinglectin-associatedserineproteases,masps)激活补体凝集素途径,调理吞噬作用,清除病原体和受感染细胞。因此,mbl在机体免疫防御和免疫监视过理中发挥重要作用。此外,mbl通过结合肿瘤细胞中的糖蛋白,或通过masps及补体等,与胃癌、肝癌、卵巢癌、肺癌、乳腺癌、结肠癌等恶性肿瘤的生长、侵袭和转移有关。由于mbl在炎症反应中发挥重要作用,它调控和制约着众多的炎症因子(il-1β、il-12、il-18和tnf-α等),导致组织对胰岛素反应的敏感性下降和糖脂代谢紊乱,所以,mbl与糖尿病的发生发展密切相关。
tat蛋白是人免疫缺陷病毒ⅰ型(humanimmunodeficiencyvirustype1,hiv-1)编码的重要调控蛋白之一,具有转录激活功能。tat蛋白由86~101个氨基酸组成(albinia.,etal.hiv-1tatproteinmimicryofchemokines.proc.natl.acad.sci.usa1998;95:13153–13158;opi,s.,etal.tathiv-1primaryandtertiarystructurescriticaltoimmuneresponseagainstnon-homologousvariants.j.biol.chem.2002;277:35915–35919),包含n-末端区、半胱氨酸富集区、碱性氨基酸富集区和c-末端区。
技术实现要素:
本发明的目的是提供一种非天然存在的从表皮生长因子、凝集素和tat蛋白衍生的重组支架蛋白。进一步地,重组支架蛋白是衍生于人表皮生长因子受体结合域的氨基酸序列、人纤维胶凝蛋白胶原样结构域的氨基酸序列、人甘露糖结合凝集素糖基识别域的氨基酸序列以及人免疫缺陷病毒ⅰ型tat蛋白的氨基酸序列。该支架蛋白具有糖蛋白结合活性、穿膜和核转位活性以及具有展示亲和功能蛋白的能力。为了实现以本发明提供的支架蛋白为基础来获得亲和功能蛋白的目的,在保证本发明所设计的支架蛋白的主体结构不变基础上,通过对其分子中8~30个氨基酸位点进行随机化突变,从而构建可供靶分子亲和筛选的蛋白质组合文库,再通过噬菌体、酵母、细胞、核糖体、mrna、cdna或snap等展示技术,可以获得能与靶分子特异性结合的亲和功能蛋白。
作为优选方案,所述靶分子为肽、蛋白质、寡糖、单链dna、双链dna、rna、金属离子、或碳水化合物中的一种。
作为优选方案,所述筛选过程采用噬菌体、酵母、细胞、核糖体、mrna、cdna或snap等展示技术。
一种支架蛋白,所述支架蛋白具有衍生于人表皮生长因子的受体结合域、人纤维胶凝蛋白的胶原样结构域、人甘露糖结合凝集素糖基识别域与hiv-1病毒的tat蛋白的氨基酸重组序列。
作为优选方案,所述支架蛋白中还包含至少一个异源肽序列,所述异源肽序列被插入所述支架蛋白的任意区域中。
作为优选方案,所述支架蛋白为seqidno1所示氨基酸序列的蛋白,或seqidno1序列中氨基酸残基被截短且有部分氨基酸残基被置换的变体,或seqidno1序列中氨基酸残基被缺失且有部分氨基酸残基被置换的变体;或支架蛋白为seqidno2所示氨基酸序列的蛋白,或seqidno2序列中氨基酸残基被截短且有部分氨基酸残基被置换的变体,或seqidno2序列中氨基酸残基被缺失且有部分氨基酸残基被置换的变体;或支架蛋白为seqidno3所示氨基酸序列的蛋白,或seqidno3序列中氨基酸残基被截短且有部分氨基酸残基被置换的变体,或seqidno3序列中氨基酸残基被缺失且有部分氨基酸残基被置换的变体;或支架蛋白为seqidno4所示氨基酸序列的蛋白,或seqidno4序列中氨基酸残基被截短且有部分氨基酸残基被置换的变体,或seqidno4序列中氨基酸残基被缺失且有部分氨基酸残基被置换的变体;或支架蛋白为seqidno5所示氨基酸序列的蛋白,或seqidno5序列中氨基酸残基被截短且有部分氨基酸残基被置换的变体,或seqidno5序列中氨基酸残基被缺失且有部分氨基酸残基被置换的变体;或支架蛋白为seqidno6所示氨基酸序列的蛋白,或seqidno6序列中氨基酸残基被截短且有部分氨基酸残基被置换的变体,或seqidno6序列中氨基酸残基被缺失且有部分氨基酸残基被置换的变体。
作为优选方案,其中所述变体的序列,分别与对应的seqidno1至seqidno6序列具有至少20%的同一性。
作为优选方案,其中所述变体的序列,分别与对应的seqidno1至seqidno6序列具有至少50%的同一性。
一种支架蛋白的应用,其特征在于,所述支架蛋白在靶向治疗的药物中的应用。
作为优选方案,利用本发明的支架蛋白为基础,通过展示技术,取得:①以病毒表面的糖蛋白为靶点的亲和功能蛋白在抗冠状病毒药物的应用;②以n-甲基-d-天冬氨酸受体为靶点的亲和功能蛋白在治疗糖尿病药物中的应用;③以血管内皮生长因子为靶点的亲和功能蛋白在治疗角膜新生血管增生药物中的应用;④以肿瘤坏死因子-α为靶点的亲和功能蛋白在治疗自身免疫性疾病药物中的应用;⑤以表皮生长因子受体-2为靶点的亲和功能蛋白在治疗恶性肿瘤药物中的应用;⑥以前蛋白转化酶枯草溶菌素9为靶点的亲和功能蛋白在降血脂药物中的应用。
本发明的优点在于:与现有的单一蛋白衍生的支架蛋白相比,本发明以四种多肽或蛋白(分别为人egf的rbd、人ficolin的clr、人mbl的crd与hiv-1病毒的tat蛋白)的重组蛋白为支架蛋白,并通过对重组的支架蛋白分子中氨基酸残基进行定向和随机化双重修饰而衍生出自然界不存在的新生亲和功能蛋白,获得的新生亲和功能蛋白能够保留亲代蛋白(支架蛋白)的有利生物物理学特性(即糖蛋白结合活性、穿膜和核转位活性),而且通过筛选获得对特定靶具有高亲和力和高特异性的新生亲和功能蛋白,用于疾病的靶向治疗。
附图说明
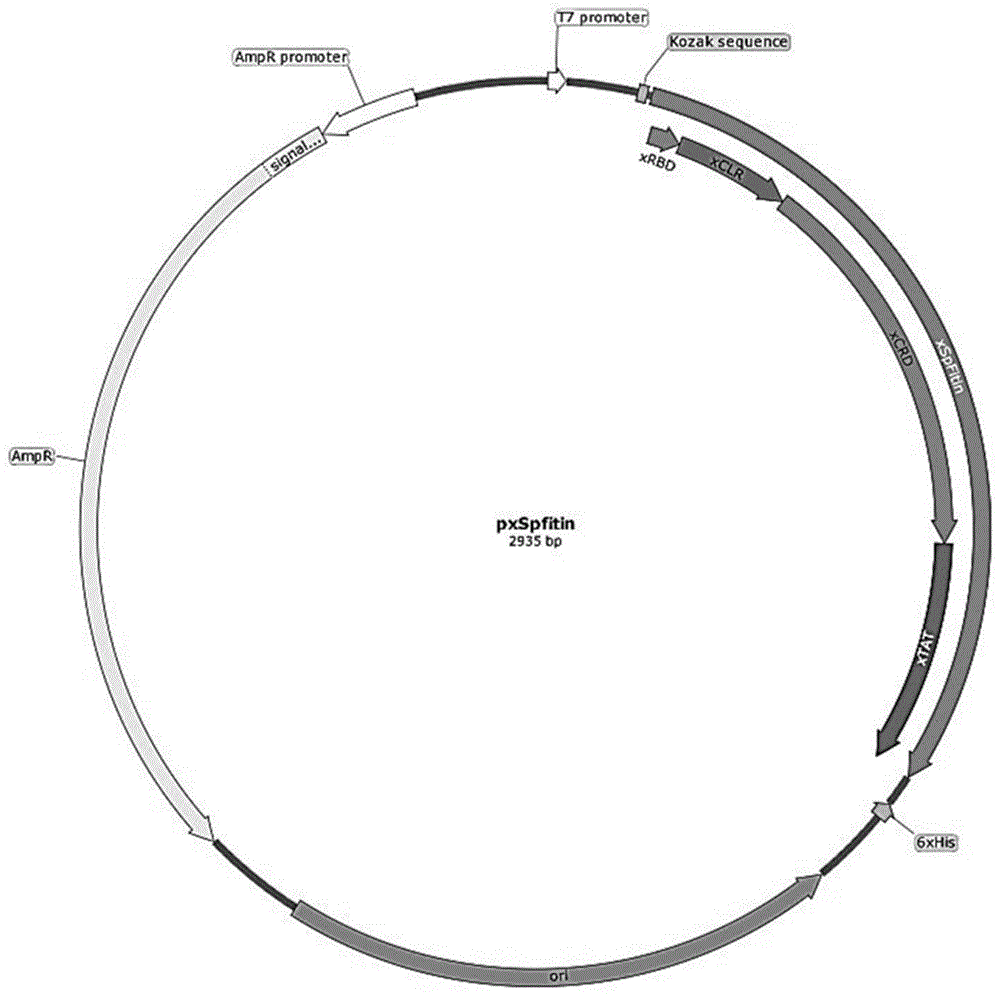
图1、冠状病毒s蛋白亲和功能蛋白spfitin表达载体pxspfintin的质粒图谱;
图2、冠状病毒s蛋白亲和功能蛋白spfitin的sds-page检测图;m:蛋白质分子量marker;1:ni-nta纯化前的表达产物;2:ni-nta纯化后的蛋白;
图3、spr检测冠状病毒s蛋白与亲和结合蛋白spfitin的相互作用曲线图;
图4、spfitin对动物感染病毒诱导的急性肺损伤发挥保护作用的组织病理图,4a为正常组;4b生理盐水对照组;4c为spfitin实验组;
图5、n-甲基-d-天冬氨酸受体亲和功能蛋白nmfitin表达载体pxnmfintin的质粒图谱;
图6、n-甲基-d-天冬氨酸受体亲和结合蛋白nmfitin的sds-page图;m:蛋白质分子量marker;1:ni-nta纯化前的表达产物;2:ni-nta纯化后的蛋白;
图7、nmfitin与细胞n-甲基-d-天冬氨酸受体结合活性的流式细胞仪检测图;
图8、nmfitin对胰岛β细胞分泌胰岛素影响的柱状图;
图9、nmfitin对糖尿病模型动物的血糖和血脂影响柱状图;9a为nmfitin对糖尿病模型动物的血脂影响柱状图,9b为nmfitin对糖尿病模型动物的血糖影响柱状图;
图10、血管内皮生长因子亲和结合蛋白vefitin表达载体pxvefintin的质粒图谱;
图11、血管内皮生长因子亲和结合蛋白vefitin的sds-page图;m:蛋白质分子量marker;1:ni-nta纯化前的表达产物;2:ni-nta纯化后的蛋白;
图12、spr检测血管内皮生长因子与亲和结合蛋白vefitin的相互作用曲线图;
图13、mtt法检测vefitin抑制血管内皮生长因子诱导的血管内皮细胞增殖的曲线图;
图14、vefitin和地塞米松治疗后角膜组织中相关因子的表达图;14a为westernblot检测vegf、vegfr-1和vegfr-2表达图;14b为vegf、vegfr-1和vegfr-2表达的柱状图;
图15、肿瘤坏死因子-α亲和结合蛋白tnfitin表达载体pxtnfintin的质粒图谱;
图16、sds-page检测肿瘤坏死因子-α亲和结合蛋白tnfitin的表达。m:蛋白质分子量marker;1:ni-nta纯化前的表达产物;2:ni-nta纯化后的蛋白;
图17、spr检测肿瘤坏死因子-α与亲和结合蛋白tnfitin的相互作用;
图18、亲和结合蛋白tnfitin对肿瘤坏死因子-α诱导的细胞毒产生的影响图;
图19、tnfitin对小鼠类风湿关节炎模型的治疗效果图;
图20、表皮生长因子受体-2的亲和结合蛋白hefitin表达载体pxhefintin的质粒图谱;
图21、表皮生长因子受体-2亲和结合蛋白hefitin的表达的sds-page图;m:蛋白质分子量marker;1:ni-nta纯化前的表达产物;2:ni-nta纯化后的蛋白;
图22、spr检测表皮生长因子受体-2与亲和结合蛋白hefitin的相互作用图;
图23、hefitin对肿瘤细胞增殖的抑制作用图;
图24、hefitin对荷瘤动物模型的抗肿瘤效果图;
图25、hefitin对荷瘤动物模型的存活分析图;
图26、前蛋白转化酶枯草溶菌素9亲和结合蛋白pcfitin表达载体pxpcfintin的质粒图谱;
图27、sds-page检测前蛋白转化酶枯草溶菌素9亲和结合蛋白pcfitin的表达;m:蛋白质分子量marker;1:ni-nta纯化前的表达产物;2:ni-nta纯化后的蛋白;
图28、spr检测前蛋白转化酶枯草溶菌素9与亲和结合蛋白pcfitin的相互作用图;
图29、pcfitin对细胞吸收低密度脂蛋白的影响;29a为dmem培养液组细胞经dii-ldl染色的荧光图;29b为dmem培养液组细胞核经hoechst33342染色的荧光图;29c为dmem培养液组细胞dii-ldl和hoechst33342双染色融合图;29d为anti-pcsk9对照组细胞经dii-ldl染色的荧光图;29e为anti-pcsk9对照组细胞核经hoechst33342染色的荧光图;29f为anti-pcsk9对照组细胞dii-ldl和hoechst33342双染色融合图;29g为pcfitin实验组细胞经dii-ldl染色的荧光图;29h为pcfitin实验组细胞核经hoechst33342染色的荧光图;29i为pcfitin实验组细胞dii-ldl和hoechst33342双染色融合图;
图30、pcfitin对小鼠肝组织中低密度脂蛋白受体表达的影响;30a为westernblot检测肝ldl受体表达水平图,图30b为动物肝细胞ldl-r的表达水平柱状图。
具体实施方式
以下结合具体实施例对本发明做进一步描述。应当指出,随着展示技术的不断发展和完善,对于本技术领域的普通技术人员来说,以下采用cdna展示技术筛选亲和功能蛋白的实施例仅用于说明本发明,同样也可以采用噬菌体、酵母、细胞、核糖体、mrna或snap等展示技术,以本发明所述的支架蛋白为基础,筛选出对本实施例以外的其它特定靶标具有高度亲和力和特异性的亲和功能蛋白。因此,在不脱离本发明原理的前提下,可以做出若干改变,所有在本发明范围内或等同本发明的范围内的改变均被本发明包含,视为本发明的保护范围。本发明实施例中无特别说明外,所用试剂及耗材均为市售商品。
实施例1:构建重组载体
首先设计cdna展示所需的5'-端非编码区序列:gatcccgcgaaattaatacgactcactataggggaagtatttttacaacaattaccaacaacaacaacaaacaacaacaacattacattttacattctacaactacaagccaccatggaattc(含t7启动子、烟草花叶病毒的5’-非编译区序列、kozak序列和编译启始密码子序列等),命名为t7ω。然后设计cdna展示所需的3'-端非编码区序列:tttccccgccgccccccgcccttgtccgccaagcttgtgatgatgatggtggtgagaccctccgcctgagcctccaccatcatttgtccatccttcatc(含6×his-tag、间隔序列和连接嘌呤霉素的连接子序列等),命名为tola_his。t7ω和tola_his中间有40bp的同源区,送基因合成公司合成。按照nebbuilderhifidnaassemblymastermix试剂盒(neb)操作说明书进行dna组装,分别加入等摩尔数的dna片段,然后加入dna组装混合液(总体积20μl),置于50℃,反应1h。取组装产物与质粒pmd18-t连接,16℃过夜,转化至dh5α感受态菌中,用质粒抽提试剂盒(takara)抽取阳性克隆质粒dna进行酶切鉴定和测序,测序正确后命名为pt7-tola重组载体。
实施例2:合成嘌呤霉素-生物素交联化合物
取20nm的嘌呤霉素片段(puromycinsegment,ps):(5’-thiol-modifierc6)-tc-(荧光素-dt)-(12碳聚乙二醇)4-cc-puromycin(bex),加入到4mm四氯苯酚和50mm磷酸缓冲液(ph7.0)中,室温下混匀,nap-5脱盐柱脱盐。另取10nm的生物素片段(biotinsegment,bs):cccggtgcagctgtttcatc-(biotin-dt)-cggaaacagctgcaccccccgccgccccccg-(amino-modifierc6dt)-cct(bex)和2μm的6-(马来酰亚胺基)己酸琥珀酰亚胺酯交联剂,加入0.2m磷酸缓冲液(ph7.0)中混匀,37℃孵育30min,4℃下乙醇沉淀去除过量的交联剂。沉淀物用70%预冷的乙醇洗两次,溶入0.2m磷酸缓冲液(ph7.0)中,加入ps,4℃搅拌过夜。加5mmdtt(二硫苏糖醇),37℃搅拌30min中止反应,乙醇沉淀去除过量的ps,沉淀物溶入磷酸缓冲液中,hplc纯化,取得ps-bs连接化合物。
实施例3:制备生物素(biotin)标记的蛋白-链霉亲和素(sa)磁珠
sa磁珠(invitrogen)用溶液a(焦磷酸二乙酯处理水,0.1mnaoh,0.05mnacl)和溶液b(焦磷酸二乙酯处理水,0.1mnacl)进行处理后,加入到2×结合缓冲液[20mmtris-hclph8.0,2mm乙二胺四乙酸(edta),2mnacl,0.2%tritonx-100]中,-20℃保存备用。分别取适量的冠状病毒s蛋白(spike)s1亚基、n-甲基-d-天冬氨酸受体(nmdar)、血管内皮生长因子(vegf)、肿瘤坏死因子-α(tnf-α)、表皮生长因子受体-2(her2)和前蛋白转化酶枯草溶菌素9(pcsk9)蛋白,溶入0.2m磷酸缓冲液(ph7.0)中,加足量sulfo-nhs-biotin(pierce),置冰上2h,反应生成spike-biotin、nmdar-biotin、vegf-biotin、tnf-α-biotin、her2-biotin和pcsk9-biotin化合物,再加sa磁珠,室温下反应15min,通过biotin与sa亲和结合,分别取得spike-biotin-sa磁珠、nmdar-biotin-sa磁珠、vegf-biotin-sa磁珠、tnf-α-biotin-sa磁珠、her2-biotin-sa磁珠和pcsk9-biotin-sa磁珠,-20℃保存备用。
实施例4:cdna展示冠状病毒s蛋白(spike)亲和功能蛋白spfitin
1、构建cdna展示基因库。冠状病毒棘突蛋白(s蛋白)是病毒表面最重要的糖蛋白,病毒通过s蛋白与宿主细胞上的受体结合感染细胞。研究发现,病毒的致病性与s蛋白密切相关。因此,病毒s蛋白成为抗冠状病毒药物的重要靶标。使用编码nns三联体(其中n=a、c、t或g,s=c或g)简并寡核苷酸,对编码seqidno1序列的9、10、150、152、152、163、164、165、166、184、185、186、187、188、189和190位置上的氨基酸残基基因进行随机化突变,并将设计的dna片段命名为spfitinlib,两端分别与t7ω和tola_his的dna片段有40bp的同源区,送基因合成公司合成。再以pt7-tola质粒为模板,以t7ω_f:ataacctttttaagagacttctgggga和t7ω_r:atgcgccatcgtat为上下游引物,pcr扩增t7ωdna片段(cdna展示所需的5'-端非编码区),用上游引物tola_his_f:gtacccatagg和下游引物tola_his_r:atacgatggcgcatttgtc进行pcr反应,扩增tola_hisdna片段(cdna展示所需的3'-端非编码区)。pcr反应体系为:25μl反应体系中加入pfupcrmix12.5μl,模板1μl,各引物1μl,ddh2o9.5μl。pcr反应条件为:94℃预变性3min;95℃变性30s,45℃退火30s,72℃延伸1min,25个循环;72℃延伸1min,琼脂糖凝胶电泳,回收试剂盒(promega)回收纯化dna。组装t7ω、spfitinlib和tola_hisdna片段,按照nebbuilderhifidnaassemblymastermix试剂盒(neb)操作说明书进行,分别加入等摩尔数的dna片段,然后加入dna组装混合液,置于50℃,反应1h。琼脂糖凝胶电泳,回收试剂盒(promega)回收纯化dna。
2、体外转录和交联反应。按照ribomaxtmlargescalernaproductionsystem-t7(promega)产品说明书,对回收的dna进行体外转录,生成mrna,并按照rneasyminikits(qiagen)试剂盒说明书操作进行纯化。然后,将纯化的mrna与ps-bs化合物互补交联,即在反应体系中加入转录产物、连接缓冲液(500mmtris-hclph7.5,100mmmgcl2,100mmdtt,10mmatp)、ps-bs化合物、rnase-freeh2o、t4多聚核苷酸激酶(neb)和t4rna连接酶(takara),25℃交联反应90min。用rneasyminelutecleanupkit(qiagen)纯化交联产物。
3、cdna体外展示。按照
4、亲和筛选。纯化的cdna-puromycin-protein转入筛选缓冲液(50mmtris-hclph7.6,1mmedta,500mmnacl,0.1%tween-20)中,加spike-biotin-sa磁珠,室温下轻摇1h,置于磁力架上进行亲和筛选,磁珠用筛选缓冲液冲洗5次,弃去未与spike蛋白结合的cdna-puromycin-protein。用筛选的产物作为模版,以t7ω_f和tola_his_r为引物进行pcr扩增,琼脂糖凝胶电泳,回收试剂盒(promega)回收纯化,产物用作下一轮循环,即转录-cdna体外展示-筛选。共进行6轮筛选。
5、spfitin基因的克隆表达纯化。将筛选回收的产物经ecori/hindⅲ双酶切处理,与pmd-18t质粒连接,在16℃下过夜,构建pxspfintin重组质粒(结构见图1),验证后转入感受态e.colibl21(de3)中诱导表达。接种重组单菌落于含氨苄青霉素的lb培养基中,37℃振荡培养过夜。再接种于新鲜含氨苄青霉素的2yt-a培养基,37℃振荡培养至d600为0.6~1.0,加异丙基-β-d-硫代半乳糖苷(iptg)诱导,37℃振荡培养3~6h。8000r/min离心10min收集菌体,悬于裂解缓冲液,经超声破碎、离心收集上清,产物用ni-nta亲和层析进行纯化。如图2所示,ni-nta纯化的产物,经sds-page检测出现单一条带,大小约32kda左右,说明获得了spike的亲和结合蛋白spfitin。
实施例5:spfitin与spike结合的亲和力
将spike蛋白s1亚基用枸橼酸钠溶液(ph5.5)稀释成10mm,按照氨基偶联试剂盒说明书,将各蛋白分别偶联到cm5传感芯上。取spfitin用hbs-ep缓冲液(gehealthcare)稀释成4.0nm、2.0nm、1.0nm、0.5nm和0.0nm。在25℃下,将不同浓度的spfitin溶液以30μl/min的流速分别流过spike蛋白s1亚基偶联芯片通道并与其作用,实时采集响应信号如图3所示。每种spfitin溶液浓度循环之后,芯片表面注入10mm的盐酸甘氨酸缓冲液(ph1.5)运行30s再生,循环完毕,获得spfitin与spike的结合亲和力kd为2.6nm,表明spfitin与spike的结合具有高亲和力。
实施例6:spfitin抑制携带spike重组腺病毒感染细胞的增殖效果
根据genbank中登录的冠状病毒基因序列(登录号为mn908947)编码的s蛋白基因,采用密码子最佳化和人源化的基因优化方法,对s蛋白基因进行优化,得到优化后的s蛋白基因序列,交基因公司分段合成并完成组装,pcr扩增,s蛋白基因克隆至pdc316-mcmv-egfp质粒中,获得pdc316-mcmv-egfp-s穿梭质粒。用质粒抽提试剂盒抽提质粒,并分别用nhei与hindiii进行酶切鉴定。取人胚肾293ad5+细胞,以5×105细胞/孔接种于6孔板中。用含10%小牛血清的dmem(dulbecco'smodifiedeaglemedium)培养基,置37℃培养24h。取admaxtm腺病毒系统的骨架质粒(pbhg1ox_e1,3cre)4μg和pdc316-mcmv-egfp-s穿梭质粒1μg,溶于无血清的dmem培养基300μl中,混匀。另取lipofectaminetm2000100μl溶解于无血清的dmem培养基300μl中,混匀。每孔加骨架质粒(pbh-glox-e1,3cre)4μl、pdc316-mcmv-egfp-s穿梭质粒1μl,以及lipofectaminetm10μl。继续培养24h,在荧光显微镜下观察绿色荧光细胞,确定转染效率。待细胞长满板孔后,转入25cm2细胞培养瓶中继续培养,长满后再转入75cm2细胞培养瓶培养,观察细胞出毒迹象。待细胞出现葡萄状聚团即细胞病变效应(cytopathiceffect,cpe)时,轻柔吹落细胞并收集,pbs重悬,并将细胞反复置于-80℃及37℃冻融3次,以充分释放细胞中的病毒。3000rpm离心5min,收集含病毒的上清液,-80℃保存备用。
取293ad5+细胞以1×104细胞/孔的数量置入96孔板中,用含10%胎牛血清的dmem培养基,37℃培养24h。每孔加含病毒的上清液后分组,spfitin实验组加spfitin至终浓度1μg/ml,空白对照组加培养基。37℃、5%c02培养箱中培养48小时。按照clontechadeno-xtmrapidtiterkit试剂盒说明书测定病毒滴度,评估spfitin对体外细胞的病毒增殖抑制作用。结果显示,空白对照组的病毒滴度为2.71±1.05×1010ifu/ml。spfitin实验组的病毒滴度为5.44±1.17×104ifu/ml,与空白对照组的病毒滴度相比,spfitin实验组明显降低,差异显著(p<0.05,t检验),说明spfitin具有抑制携带spike重组腺病毒感染细胞的增殖效果。
实施例7:spfitin对动物感染病毒诱导的急性肺损伤发挥保护作用
选取雄性昆明种小鼠,按0.1ml/kg体重经尾静脉注射含携带spike重组腺病毒的上清液,形成急性肺损伤动物模型,设为肺损伤组,此外,以尾静脉注射同体积pbs的动物为正常组。肺损伤模型组动物再随机分spfitin实验组和生理盐水对照组,每组6只小鼠。spfitin实验组动物按10mg/kg的剂量经尾静脉注射spfitin,对照组动物尾静脉注射0.2ml生理盐水,72h后取小鼠左肺行病理组织检查,小鼠右肺制备10%组织匀浆,用elisa检测肺组织中白细胞介素-6(il-6)、il-8、il-10和肿瘤坏死因子-α(tnf-α)炎性细胞因子水平。小鼠肺组织病理检查结果如图4a、4b和4c显示,生理盐水对照组动物肺出血改变,肺实变,肺组织损伤明显,与生理盐水组相比,spfitin实验组动物肺泡内充血、水肿明显减轻,表明spfitin对病毒感染产生的急性肺损伤具有保护作用。各组动物肺组织中il-6、il-8、il-10和tnf-α水平如下表:
表1:各组动物肺组织中il-6、il-8、il-10和tnf-α水平变化
从上表中可以看出,应用spfitin对病毒诱导的动物肺损伤进行治疗后,动物肺组织中炎性细胞因子(il-6、il-8、il-10和tnf-α)较生理盐水组下降,结果表明,spfitin对病毒诱导的小鼠肺损伤具有良好的治疗效果。
实施例8:cdna展示n-甲基-d-天冬氨酸受体(nmdar)的亲和功能蛋白nmfitin
使用编码nns三联体(其中n=a、c、t或g,s=c或g)简并寡核苷酸,对编码seqidno2序列的35、36、52、53、54、65、66、67、68、86、87、88、89、90、91和92位置上的氨基酸残基表达基因进行随机突变,并将设计的dna片段命名为nmfitinlib,两端分别与t7ω和tola_his的dna片段有40bp的同源区,送基因合成公司合成。再以pt7-tola质粒为模板,按照实施例4所述方法,利用nebbuilderhifidnaassemblymastermix试剂盒(neb)进行t7ω、nmfitinlib和tola_hisdna片段组装,构建cdna展示基因库、体外转录和交联反应以及cdna体外展示后,采用nmdar-biotin-sa磁珠,从cdna体外展示所形成的cdna-puromycin-protein复合物中亲和筛选出目的产物,再通过转录-cdna体外展示-筛选共6轮循环,产物经琼脂糖凝胶电泳,回收试剂盒(promega)回收纯化后,与pmd-18t质粒连接,在16℃下过夜,构建pxnmfintin重组质粒(结构见图5),验证后转入感受态e.colibl21(de3)中诱导表达,后经超声破碎、离心和ni-nta亲和层析纯化。如图6所示,表达产物经ni-nta纯化后,采用sds-page检测出现单一条带,大小约为32kda,提示取得了nmdar的亲和功能蛋白nmfitin。
实施例9:流式细胞术检测nmfitin与细胞nmdar的结合活性
用ripa(radio-immunoprecipitationassay)缓冲液[1%乙基苯基聚乙二醇(np-40),1%脱氧胆酸钠,0.1%sds,150mmnacl,25mmtris-hcl,ph7.4]将胃癌细胞sgc-7901、肝癌细胞smmc-772和正常人乳腺细胞mfc-10a裂解后,提取细胞总蛋白。4℃、13000r/min离心15min,取上清液,-20℃保存。bca蛋白定量试剂盒检测蛋白浓度,各取蛋白100μg进行sds-page电泳,稳压冰浴电转至硝酸纤维素膜上,5%脱脂牛奶封闭1h,一抗孵育4℃过夜(nmdar2b抗体1:100,gapdh抗体1:5000),1:5000稀释的辣根过氧化物酶标记的igg二抗(bio-rad)室温下温育2小时,增强化学发光(ecl)法显色检测nmdar表达。结果如图6所示,sgc-7901和smmc-772细胞nmdar呈阳性表达,而mfc-10a细胞nmdar为阴性表达。取sgc-7901、smmc-772和mfc-10a细胞胰酶消化,离心,重悬,计数。以每瓶1×107个细胞的数量置入细胞培养瓶中,37℃、co2培养箱中培养24h后分组。实验组用5μm异硫氰酸荧光素fitc标记试剂盒进行荧光标记的nmfitin孵育细胞,对照组fitc孵育细胞,37℃培养1h。pbs洗涤2遍,采用流式细胞仪(facscalibur)检测。结果显示如图7,用荧光标记的nmfitin孵育细胞后,nmdar阳性表达的sgc-7901和smmc-772细胞中,相对荧光强度比nmdar阴性表达的mfc-10a细胞高,说明荧光标记的nmfitin对nmdar阳性表达细胞的结合具有特异性。
实施例10:nmfitin促进胰岛细胞分泌胰岛素
取胰岛β细胞min-6以每瓶1×107个细胞的数量置入细胞培养瓶中,用含10%胎牛血清的dmem(dulbecco'smodifiedeaglemedium)培养基,37℃培养24h后分nmfitin+高糖实验组、nmfitin+低糖实验组、缓冲液+高糖对照组和缓冲液+低糖对照组。细胞弃培养基,用pbs洗1遍,加4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)缓冲液(15mmhepes,5mmkcl,120mmnacl,2mmcacl2,10μm甘氨酸,24mmnahco3和1mg/ml胎牛血清),nmfitin+高糖实验组在hepes缓冲液加10μmnmfitin和16.7mm葡萄糖,nmfitin+低糖实验组在hepes缓冲液中加10μmnmfitin和2mm葡萄糖,hepes+高糖实验组在hepes缓冲液中加16.7mm葡萄糖,hepes+低糖对照组在hepes缓冲液中加2mm葡萄糖,37℃孵育2h,取上清用胰岛素检测试剂盒(免疫层析法)检测细胞分泌的胰岛素,结果如图8所示,nmfitin可以促进min-6细胞胰岛素分泌,与hepes对照组相比显示出统计学差异。
实施例11:nmfitin对糖尿病模型动物的治疗效果
雌性sd大鼠腹腔注射50mg/kg链脲霉素建立糖尿病动物模型,每天给与高糖高脂饲料(100g白糖、17g猪油、250g鸡蛋及适量盐和维生素)适应性喂养3天后,随机分nmfitin实验组和生理盐水对照组,每组5只。实验组物按10mg/kg的剂量经尾静脉注射给药,对照组注射生理盐水,每周一次,每天采用高糖高脂喂养,3周后动物称重,取血检测血糖、甘油三脂(tg)、高密度脂蛋白(hdl)、低密度脂蛋白(ldl)和胰岛素水平,结果如图9所示,nmfitin组动物体重、血糖、血tg和血ldl值低于对照组,nmfitin组动物血胰岛素和hdl高于对照组,nmfitin组与生理盐水对照组相比显示出统计学差异(图9),表明nmfitin对链脲霉素诱导的胰岛细胞损伤具有修复作用,可以提高链脲霉素诱导的糖尿病动物血胰岛素水平,对血糖和血脂升高具有拮抗效果。
实施例12:cdna展示血管内皮生长因子(vegf)亲和结合蛋白vefitin
使用编码nns三联体(其中n=a、c、t或g,s=c或g)简并寡核苷酸,对编码seqidno3序列的121、122、138、139、140、151、152、153、154、172、173、174、175、176、177和178位置上的氨基酸残基表达基因进行随机化突变,并将设计的dna片段命名为vefitinlib,两端分别与t7ω和tola_his的dna片段有40bp的同源区,送基因合成公司合成。再以pt7-tola质粒为模板,依照实施例4所述方法,采用nebbuilderhifidnaassemblymastermix试剂盒(neb)进行t7ω、vefitinlib和tola_hisdna片段组装,构建cdna展示基因库、体外转录和交联反应以及cdna体外展示后,采用vegf-biotin-sa磁珠,从cdna体外展示所形成的cdna-puromycin-protein复合物中亲和筛选出目的产物,再通过转录-cdna体外展示-筛选共6轮循环,产物经琼脂糖凝胶电泳,回收试剂盒(promega)回收纯化后,与pmd-18t质粒连接,在16℃下过夜,构建pxvefintin重组质粒(结构见图10),转入感受态e.colibl21(de3)中诱导表达,后经超声破碎、离心和ni-nta亲和层析纯化。表达产物ni-nta亲和纯化前后采用sds-page检测。结果显示如图11,ni-nta亲和纯化后在约32kda处有一明显条带,说明获得了vegf亲和结合蛋白vefitin。
实施例13:vefitin与vegf结合的亲和力
将vegf用枸橼酸钠溶液(ph5.5)稀释成10mm,按照氨基偶联试剂盒说明书,将各蛋白分别偶联到cm5传感芯上。取vefitin用hbs-ep缓冲液(gehealthcare)稀释成1.6nm、0.8nm、0.4nm、0.2nm、0.1nm和0.0nm。在25℃下,将不同浓度的vefitin溶液以30μl/min的流速分别流过vegf偶联芯片通道并与其作用,实时采集响应信号,结果见图12。每种vefitin溶液浓度循环之后,芯片表面注入10mm的盐酸甘氨酸缓冲液(ph1.5)运行30s再生,循环完毕,获得vefitin与vegf的结合亲和力kd为0.45nm,表明vefitin与vegf结合具有高亲和力。
实施例14:vefitin对血管内皮细胞增殖的影响
取人肺癌细胞a549用含10%胎牛血清的dmem培养基培养至70%会合时,用无血清培养基再培养48h,收集培养上清,经0.22μm滤膜过滤后,于-80℃保存备用。取正常人脐静脉内皮细胞huvec,用备用的培养上清孵育细胞,汇合至80%时收集,即为肿瘤血管内皮细胞td-ec。
取huvec和td-ec细胞以每孔5×103个细胞的数量置入96孔培养板中,37℃孵育至细胞贴壁后分组。按5、10、15和20μg/ml不同浓度梯度的vefitin(用无血清dmem培养基稀释)加入实验组细胞中,对照组加入培养基。各组细胞设三个复孔,37℃培养48h。测定前弃去培养孔上清,每孔加入0.5mg/ml新配制的四甲基偶氮唑蓝(mtt)溶液10μl,37℃继续孵育48h,弃上清加二甲基亚砜(dmso)150ul,混匀后用dg3022型酶标仪,在490nm波长处测定细胞的a值,并计算细胞增殖抑制率(%)=(1-实验孔a值/对照孔a值)×100%。实验结果用细胞增殖抑制率表示如图13,vefitin对vegf诱导的血管内皮细胞增殖具有抑制作用,且随vefitin剂量的增加而增强。
实施例15:vefitin抑制大鼠角膜新生血管的治疗效果
采用碱烧伤方法制备大鼠角膜新生血管的动物模型。sd大鼠乙醚吸入麻醉,用浸入1mnaoh溶液的滤纸片,贴于大鼠的右眼角膜中央,之后,用生理盐水冲洗结膜囊并滴抗生素眼液预防感染,1%阿托品眼膏涂眼以防止虹膜后粘连。角膜被碱烧伤的动物分vefitin实验组、贝伐单抗对照组和生理盐水空白组,每组6只。各组在大鼠右眼的结膜下注射给药25μl,隔日一次,共7次。每日观察眼结膜充血状况、角膜水肿及角膜新生血管的生长情况。4周后(28天)测量并记录从角巩缘向心性生长的新生血管长度和数量,按公式:s=c/12×3.1416[r2-(r-l)2]计算新生血管面积,其中c为新生血管累积角膜的圆周钟点数,l为新生血管从角膜缘伸入角膜的最长血管长度,r为角膜半径。各组动物角膜新生血管生长面积比较情况见表2。
表2:各组动物角膜新生血管最长长度和增生面积
从上表中可以看出,vefitin组动物角膜新生血管的长度和面积均小于地塞米松对照组和生理盐水对照组(*p<0.05),说明应用vefitin后,可以抑制大鼠角膜新生血管增生。
此外,为了进一步了解vefitin抑制角膜新生血管增生,是否与靶向作用vegf后,通过阻断vegf与血管内皮生长因子受体-1(vegfr-1)或血管内皮生长因子受体-2(vegfr-2)相互作用有关。试验各组随机挑选2只大鼠,剪下角膜组织加液氮研磨成细粉,加预冷的ripa裂解液,匀浆,4℃下13000r/min离心15min,取上清,bca蛋白定量试剂盒检测蛋白浓度,各取蛋白100μg进行sds-page电泳,转至硝酸纤维素膜上,5%脱脂牛奶封闭1h,一抗孵育4℃过夜(vegf、vegfr-1和vegfr-2抗体1:100,gapdh抗体1:5000),1:5000稀释的辣根过氧化物酶标记的igg二抗(bio-rad)室温下温育2小时,增强化学发光(ecl)法显色检测vegf、vegfr-1和vegfr-2表达。结果与图14所示,vefitin可以明显降低角膜组织中的vegf、vegfr-1和vegfr-2表达,表明vefitin靶向结合vegf后,阻断vegf与其受体相互作用,从而发挥抑制角膜新生血管增生的效果。
实施例16:cdna展示肿瘤坏死因子-α(tnf-α)亲和结合蛋白tnfitin
tnf-α是一种促进炎症反应的细胞因子,与类风湿关节炎、银屑病、克罗恩病等多种自身免疫性疾病的发生和发展有关。因此,以tnf-α为靶点设计的药物,可有效阻断tnf-α介导的炎症反应过程,治疗相关疾病。本发明使用编码nns三联体(其中n=a、c、t或g,s=c或g)简并寡核苷酸,对编码seqidno4序列的133、134、150、151、152、163、164、165、166、184、185、186、187、188、189和190位置上的氨基酸残基表达基因进行随机化突变,并将设计的dna片段命名为tnfitinlib,两端分别与t7ω和tola_his的dna片段有40bp的同源区,送基因合成公司合成。再以pt7-tola质粒为模板,依实施例4所述的方法,利用nebbuilderhifidnaassemblymastermix试剂盒(neb)进行t7ω、tnfitinlib和tola_hisdna片段组装,构建cdna展示基因库、体外转录和交联反应以及cdna体外展示后,采用tnf-α-biotin-sa磁珠,从cdna体外展示所形成的cdna-puromycin-protein复合物中亲和筛选出目的产物,再通过转录-cdna体外展示-筛选共6轮循环,产物经琼脂糖凝胶电泳,回收试剂盒(promega)回收纯化后,与pmd-18t质粒连接,在16℃下过夜,构建pxtnfintin重组质粒(结构见图15),转入感受态e.colibl21(de3)中诱导表达,经超声破碎、离心和ni-nta亲和层析纯化。产物纯化前后通过sds-page检测,结果如图16显示,ni-nta纯化后产物在分子量约32kda处,出现单一条带,说明获得了tnf-α亲和结合蛋白tnfitin。
实施例17:tnfitin与tnf-α结合的亲和力
将tnf-α用枸橼酸钠溶液(ph5.5)稀释成10mm,按照氨基偶联试剂盒说明书,将各蛋白分别偶联到cm5传感芯上。取tnfitin用hbs-ep缓冲液(gehealthcare)稀释成500nm、100nm、50nm、10nm和5nm。在25℃下,将不同浓度的tnfitin溶液以30μl/min的流速分别流过tnf-α偶联芯片通道并与其作用,实时采集响应信号显示在图17。每种tnfitin溶液浓度循环之后,芯片表面注入10mm的盐酸甘氨酸缓冲液(ph1.5)运行30s再生,循环完毕,获得tnfitin与tnf-α的结合亲和力kd为6.3nm,表明tnfitin与tnf-α结合具有高亲和力。
实施例18:tnfitin抑制tnf-α介导的细胞毒效应
试验以鼠成纤维细胞l929为研究对象,判断tnfitin与tnf-α结合后,是否对tnf-α介导的细胞毒效应具有抑制作用。以每孔5×103个细胞数,将l929细胞置入96孔培养板中,加入10ng/mltnf-α后分tnfitin实验组和tnf-α对照组,实验组按10倍梯度稀释加入tnfitin,各设3个复孔,另设培养基空白对照组作为自然死亡对照。37℃培养48h后,每孔加入mtt溶液10μl,4h后加入dmso,用酶标仪检测取得细胞a值,按公式:t=(1-tnfitin实验孔或tnf-α对照孔a值/空白孔a值)计算细胞毒效应;并按公式计算细胞毒效应抑制率(%)=(1-ttnfitin/ttnf-α)×100%。结果如图18显示,tnfitin对tnf-α诱导的细胞毒效应具有抑制作用,且随tnfitin剂量的增加而增强。
实施例19:tnfitin对小鼠类风湿关节炎的治疗效果
按2g/l的浓度将牛ⅱ型胶原(cⅱ)溶于0.1m醋酸中,4℃下搅拌过夜,再与弗氏完全佐剂(4mg/ml)等体积混合、乳化,制成cⅱ乳剂。选取雄性昆明种小鼠,将cⅱ乳剂于小鼠的右后足跖皮内注射0.1ml致炎,3周(21天)后再次注射0.1ml建立关节炎动物模型。将造模成功的小鼠随机分为tnfitin实验组(8mg/kg)、地塞米松对照组(1mg/kg)和生理盐水对照组,每组10只。各组从致炎21天后开始给药,每2天腹腔注射1次,观察动物关节肿胀等情况,并对关节炎症情况进行评分(0分:无红肿;1分:小趾关节红肿;2分:趾关节和足跖肿胀;3分:踝关节以下的足爪肿;4分:包括踝关节在内的全部足爪肿胀),每只小鼠4个关节的炎症评分之和用关节炎指数(arthritisindex)表示,每4天评分1次,结果见图19。并在治疗4周(28天)后取动物血,采用关节炎因子(rf)和c反应蛋白(crp)elisa检测试剂盒进行测定血rf和crp含量,然后取动物关节滑膜液,并用tnf-α和白介素-10(il-10)elisa检测试剂盒检测进行关节滑膜液中tnf-α和il-10水平,结果见下表3:
表3:各组动物的血液和关节滑膜液中生化指标变化
从上表中可以看出,应用tnfitin和地塞米松对cⅱ诱导的动物关节炎治疗后,动物血中rf和crp较生理盐水组下降,关节滑膜液中tnf-α含量下降,但关节滑膜液中il-10水平上升。观察生理盐水组小鼠右后足肿胀越发明显,逐渐4只足趾都出现肿胀,足部皮肤充血,足趾变型,表现出跛行;并且,如图16所示,随着时间的推移,生理盐水对照组的关节炎指数逐渐增加,然而,应用tnfitin和地塞米松治疗后,治疗组的关节炎指数低于关节炎模型对照组,治疗组小鼠足趾肿胀、后足皮肤充血、跛行等临床症状明显减轻,多数小鼠的症状基本消失。结果表明,tnfitin对cⅱ诱导的小鼠类风湿关节炎具有良好的治疗效果。
实施例20:cdna展示表皮生长因子受体-2(her2)的亲和结合蛋白hefitin
使用编码nns三联体(其中n=a、c、t或g,s=c或g)简并寡核苷酸,对编码seqidno5序列的54、55、56、64、65、66、77、78、79、80、98、99、100、101、102和103位置上的氨基酸残基表达基因进行随机化突变,并将设计的dna片段命名为hefitinlib,两端分别与t7ω和tola_his的dna片段有40bp的同源区,送基因合成公司合成。再以pt7-tola质粒为模板,依照实施例4所述方法,利用nebbuilderhifidnaassemblymastermix试剂盒(neb)进行t7ω、hefitinlib和tola_hisdna片段组装,构建cdna展示基因库、体外转录和交联反应以及cdna体外展示后,采用her2-biotin-sa磁珠,从cdna体外展示所形成的cdna-puromycin-protein复合物中亲和筛选出目的产物,再通过转录-cdna体外展示-筛选共6轮循环,产物经琼脂糖凝胶电泳,回收试剂盒(promega)回收纯化后,与pmd-18t质粒连接,在16℃下过夜,构建pxhefintin重组质粒(结构见图20),转入感受态e.colibl21(de3)中诱导表达,后经超声破碎、离心和ni-nta亲和层析纯化。通过sds-page检测,发现ni-nta纯化后产物,出现单一条带,分子大小约为32kda,提示获得了her2亲和结合蛋白hefitin(如图21)。
实施例21:hefitin与her2结合的亲和力
将her2用枸橼酸钠溶液(ph5.5)稀释成10mm,按照氨基偶联试剂盒说明书,将各蛋白分别偶联到cm5传感芯上。取hefitin用hbs-ep缓冲液(gehealthcare)稀释成1.6nm、0.8nm、0.4nm、0.2nm、0.1nm和0.0nm。在25℃下,将不同浓度的hefitin溶液以30μl/min的流速分别流过her2偶联芯片通道并与其作用,实时采集响应信号,结果显示在图22。每种hefitin溶液浓度循环之后,芯片表面注入10mm的盐酸甘氨酸缓冲液(ph1.5)运行30s再生,循环完毕,获得hefitin与her2的结合亲和力kd为0.45nm,表明hefitin与her2结合具有高亲和力。
实施例22:hefitin抑制肿瘤细胞增殖活性
取对数生长期her2阳性表达的人乳腺癌细胞bt-474、人乳腺癌细胞mda-mb-453和her2阴性表达的人乳腺癌细胞mfc-7,以每孔5×103个细胞的数量置入96孔培养板中,37℃孵育至细胞贴壁后分组。hefitin实验组细胞中加入2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml、0.125μg/ml、0.0625μg/ml、0.03125μg/ml、0.015μg/ml和0μg/ml不同浓度梯度的hefitin(用无血清dmem培养基稀释),曲妥珠单抗(her2抗体)对照组细胞中也加入与hefitin组相同浓度梯度的曲妥珠单抗,另设空白对照组(培养基)作为自然死亡对照。各组细胞设三个复孔,37℃培养48h。每孔加入mtt溶液10μl,4h后加入dmso,用酶标仪检测取得细胞a值,并按公式:t=(1-hefitin实验孔或曲妥珠单抗对照孔a值/空白孔a值)×100计算细胞毒性。结果如图23显示,hefitin对细胞增殖具有抑制作用,且随hefitin剂量的增加而增强。
实施例23:hefitin抗肿瘤活性
取mda-mb-453细胞悬液接种至5~6周龄的spf级scid小鼠右侧近后肢皮下,2周后选择肿瘤生长良好且无坏死的动物,颈椎脱臼处死,无菌条件下取出实体瘤,切成小瘤块,移植至裸鼠右侧近后肢皮下。肿瘤移植后2周,选择肿癌生长良好的小鼠随机分hefitin实验组和生理盐水对照组,每组5只小鼠。移植肿瘤后第14天,按10mg/kg的剂量分别经动物尾静脉注射hefitin,每周(7天)一次,对照组动物尾静脉注射0.2ml生理盐水。给药前和给药后每周测量并记录瘤体的长径(a)和短径(b)2~3次,根据公式:v=(a×b2)/2计算肿瘤体积(v),然后计算出相对肿瘤体积rtv=vt/v0(其中v0为初次给药所测肿瘤体积,vt为每次测得的肿瘤体积)。再计算相对肿瘤增殖率t/c(%)=trtv/crtv×100%(trtv:实验组相对肿瘤体积;crtv:对照组相对肿瘤体积)。结果见图24,mda-mb-453为高度恶性的人乳腺癌细胞株,实验动物移植肿瘤后1周左右(第7天),可见生长的瘤体呈圆形、椭圆形和长条形等多种形态,肿瘤结节质地较硬,增长速度较快。分组治疗后观察,hefitin组初次治疗时(第7天)的肿瘤体积平均为234±56mm3,经过3次治疗后,从第21天开始,肿瘤体积明显缩小。到第35天时,肿瘤大小为110±48mm3,与生理盐水组的肿块大小(2288±120mm3)相比,差异显著(p<0.05)。由于mda-mb-53细胞株为高度恶性细胞株,肿瘤生长快。生理盐水组移植瘤小鼠因无有效治疗,给药后第3周左右陆续死亡。与生理盐水组相比,hefitin组动物的存活时间均明显延长(结果见图25)。
实施例24:cdna展示前蛋白转化酶枯草溶菌素9(pcsk9)亲和结合蛋白pcfitin
使用编码nns三联体(其中n=a、c、t或g,s=c或g)简并寡核苷酸,对编码seqidno6序列的140、141、142、150、151、152、163、164、165、166、184、185、186、187、188和189位置上的氨基酸残基表达基因进行随机化突变,并将设计的dna片段命名为pcfitinlib,两端分别与t7ω和tola_his的dna片段有40bp的同源区,送基因合成公司合成。再以pt7-tola质粒为模板,按照实施例4所述方法,利用nebbuilderhifidnaassemblymastermix试剂盒(neb)进行t7ω、pcfitinlib和tola_hisdna片段组装,构建cdna展示基因库、体外转录和交联反应以及cdna体外展示后,,采用pcsk9-biotin-sa磁珠,从cdna体外展示所形成的cdna-puromycin-protein复合物中亲和筛选出目的产物,再通过转录-cdna体外展示-筛选共6轮循环,产物经琼脂糖凝胶电泳,回收试剂盒(promega)回收纯化后,与pmd-18t质粒连接,在16℃下过夜,构建pxnmfintin重组质粒(结构见图26),转入感受态e.colibl21(de3)中诱导表达,后经超声破碎、离心和ni-nta亲和层析纯化。采用sds-page对表达产物进行检测,结果如图27所示。ni-nta纯化后产物出现单一明显条带,大小约为32kd,表明获得了pcsk9亲和结合蛋白pcfitin。
实施例25:pcfitin与pcsk9结合的亲和力
将pcsk9用枸橼酸钠溶液(ph5.5)稀释成10mm,按照氨基偶联试剂盒说明书,将各蛋白分别偶联到cm5传感芯上。取pcfitin用hbs-ep缓冲液(gehealthcare)稀释成1.6nm、0.8nm、0.4nm、0.2nm、0.1nm和0.0nm。在25℃下,将不同浓度的pcfitin溶液以30μl/min的流速分别流过pcsk9偶联芯片通道并与其作用,实时采集响应信号,结果如图28所示。每种pcfitin溶液浓度循环之后,芯片表面注入10mm的盐酸甘氨酸缓冲液(ph1.5)运行30s再生,循环完毕,获得pcfitin与pcsk9的结合亲和力kd为0.45nm,表明pcfitin与pcsk9结合具有高亲和力。
实施例26:pcfitin通过抑制pcsk9来促进细胞吸收低密度脂蛋白胆固醇(ldl-c)
肝细胞hepg2以每瓶1×107个细胞的数量置入培养瓶中,用含10%胎牛血清的dmem培养液培养24h,弃培养液,换无血清dmem培养液,细胞在加入50nmldl-c和45nmpcsk9之后分pcfitin实验组、anti-pcsk9(pcsk9单抗)对照组和空白培养基对照组。各组细胞取上清用cx7生化分析仪(beckman)检测ldl-c含量。取无菌盖玻片,置于6孔细胞培养板中,每孔加入1×105个肝细胞hepg2细胞,37℃培养24h,弃培养液,换无血清dmem培养液,细胞在加入45nmpcsk9之后分pcfitin实验组、对照组和空白对照组。pcfitin组加pcfitin至终浓度1μg/ml,对照组加anti-pcsk9至终浓度1μg/ml,之后,各组细胞再加10μg/mldii-ldl(sigma),37℃培养4h,用含0.4%牛血清白蛋白的pbs洗2次,然后用含4%多聚甲醛的pbs固定10min,pbs洗3次,hoechst33342染色20min,pbs洗3次,吸尽余液,滴加抗荧光猝灭液,荧光显微镜观察。各组细胞观察结果如图29。细胞吸收dii-ldl和hoechst33342后,dii染料使细胞呈红色荧光显色,hoechst33342染料使细胞核呈蓝色荧光显色,pcfitin和anti-pcsk9组与空白组相比红色荧光强度显著增高,表明pcfitin和anti-pcsk9促进hepg2细胞摄取dii-ldl。
实施例27:pcfitin抑制pcsk9对动物脂代谢产生的影响
选取雄性昆明种小鼠分pcfitin实验组、anti-pcsk9(pcsk9单抗)对照组和生理盐水空白组,每组6只,按10mg/kg的剂量经动物尾静脉注射给药,每周一次,每天采用高脂饲料(普通饲料+21%脂肪+0.15%胆固醇)喂养,2周(14天)后取动物血和肝脏检查。按照pcsk9elisakit(mbl)说明书介绍的方法测定血pcsk9水平,并且,采用cx7生化分析仪(beckman)检测血tc(总胆固醇)、tg(甘油三脂)、ldl-c(低密度脂蛋白胆固醇)和hdl-c(高密度脂蛋白胆固醇)水平。结果见下表4:
表4:各组动物血pcsk9、tc、tg、ldl-c和hdl-c水平比较
注:与空白组比较,*p<0.05。
从上表可以看出,pcfitin和anti-pcsk9组动物血pcsk9水平比生理盐水组明显降低,使pcfitin和anti-pcsk9组动物血tc、tg、和ldl-c水平下降,血hdl-c浓度上升,说明pcfitin和anti-pcsk9通过抑制pcsk9而影响脂代谢,从而达到降血脂效果。
动物肝脏则采用westernblot检测肝ldl受体表达水平,即用生理盐水洗去肝脏污血后滤纸吸干,称重,取0.5cm×0.5cm组织,经ripa裂解液处理后进行sds-page电泳,转膜,5%脱脂奶粉tbs-t溶液封闭1h,加anti-ldl-r一抗,4℃过夜,用辣根过氧化物酶标记的二抗孵育1h,显影。结果如图30a和图30b所示,pcfitin和anti-pcsk9组动物肝细胞ldl-r的表达水平明显高于生理盐水组。
序列表
<110>艾时斌
<120>从表皮生长因子、凝集素和tat蛋白衍生的支架蛋白
<160>6
<170>siposequencelisting1.0
<210>1
<211>292
<212>prt
<213>artificialsequence
<400>1
cysmettyrileglualaleuasplystyralacysmetgluproval
151015
aspproargleugluprotrplyshisproglyserglnprolysthr
202530
alaserasnasncystyrcyslysargcyscysleuhiscysglnval
354045
cysphethrlyslysglyleuglyilesertyrglyarglyslysarg
505560
argglnargargargalaproglnaspserlysthrhisglnvalser
65707580
leuserlysglnproalaserglnproargglyaspprothrglypro
859095
lysgluglycysproglyleuproglyalaproglyasplysglyglu
100105110
alaglythrasnglylysargglygluargglyproproglypropro
115120125
glylysalaglyproproglyproasnglyalaproglygluproser
130135140
proaspglyaspserserleualaalasergluarglysalaleugln
145150155160
thrglumetalaargilelyslystrpleuthrpheserleuglylys
165170175
glnvalglyasnlysphepheleuthrasnglygluilemetthrphe
180185190
glulysvallysalaleucysvallyspheglnalaservalalathr
195200205
proargasnalaalagluasnglyalaileglnasnleuilelysglu
210215220
glualapheleuglyilethraspglulysthrgluglyglnpheval
225230235240
aspleuthrglyasnargleuthrtyrthrasntrpasngluglyglu
245250255
proasnasnalaglyseraspgluaspcysvalleuleuleulysasn
260265270
glyglntrpasnaspvalprocysserthrserhisleualavalcys
275280285
glupheproile
290
<210>2
<211>292
<212>prt
<213>artificialsequence
<400>2
glycysproglyleuproglyalaproglyprolysglyglualagly
151015
thrasnglylysargglygluargglyproproglyproproglylys
202530
alaglyproproglyproasnglyalaproglygluproserproasp
354045
glyaspserserleualaalasergluarglysalaleuglnthrglu
505560
metalaargilelyslystrpleuthrpheserleuglylysglnval
65707580
glyasnlysphepheleuthrasnglygluilemetthrpheglulys
859095
vallysalaleucysvallyspheglnalaservalalathrproarg
100105110
asnalaalagluasnglyalaileglnasnleuilelysglugluala
115120125
pheleuglyilethraspglulysthrgluglyglnphevalaspleu
130135140
thrglyasnargleuthrtyrthrasntrpasngluglygluproasn
145150155160
asnalaglyseraspgluaspcysvalleuleuleulysasnglygln
165170175
trpasnaspvalprocysserthrserhisleualavalcysgluphe
180185190
proilecysmettyrileglualaleuasplystyralacysmetglu
195200205
provalaspproargleugluprotrplyshisproglyserglnpro
210215220
lysthralaserasnasncystyrcyslysargcyscysleuhiscys
225230235240
glnvalcysphethrlyslysglyleuglyilesertyrglyarglys
245250255
lysargargglnargargargalaproglnaspserlysthrhisgln
260265270
valserleuserlysglnproalaserglnproargglyaspprothr
275280285
glyprolysglu
290
<210>3
<211>292
<212>prt
<213>artificialsequence
<400>3
metgluprovalaspproargleugluprotrplyshisproglyser
151015
glnprolysthralaserasnasncystyrcyslysargcyscysleu
202530
hiscysglnvalcysphethrlyslysglyleuglyilesertyrgly
354045
arglyslysargargglnargargargalaproglnaspserlysthr
505560
hisglnvalserleuserlysglnproalaserglnproargglyasp
65707580
prothrglyprolysgluglycysproglyleuproglyalaprogly
859095
prolysglyglualaglythrasnglylysargglygluargglypro
100105110
proglyproproglylysalaglyproproglyproasnglyalapro
115120125
glygluproserproaspglyaspserserleualaalasergluarg
130135140
lysalaleuglnthrglumetalaargilelyslystrpleuthrphe
145150155160
serleuglylysglnvalglyasnlysphepheleuthrasnglyglu
165170175
ilemetthrpheglulysvallysalaleucysvallyspheglnala
180185190
servalalathrproargasnalaalagluasnglyalaileglnasn
195200205
leuilelysgluglualapheleuglyilethraspglulysthrglu
210215220
glyglnphevalaspleuthrglyasnargleuthrtyrthrasntrp
225230235240
asngluglygluproasnasnalaglyseraspgluaspcysvalleu
245250255
leuleulysasnglyglntrpasnaspvalprocysserthrserhis
260265270
leualavalcysglupheproilecysmettyrileglualaleuasp
275280285
lystyralacys
290
<210>4
<211>292
<212>prt
<213>artificialsequence
<400>4
cysmettyrileglualaleuasplystyralacysmetgluproval
151015
aspproargleugluprotrplyshisproglyserglnprolysthr
202530
alaserasnasncystyrcyslysargcyscysleuhiscysglnval
354045
cysphethrlyslysglyleuglyilesertyrglyarglyslysarg
505560
argglnargargargalaproglnaspserlysthrhisglnvalser
65707580
leuserlysglnproalaserglnproargglyaspprothrglypro
859095
lysgluglycysproglyleuproglyalaproglyprolysglyglu
100105110
alaglythrasnglylysargglygluargglyproproglypropro
115120125
glylysalaglyproproglyproasnglyalaproglygluproser
130135140
proaspglyaspserserleualaalasergluarglysalaleugln
145150155160
thrglumetalaargilelyslystrpleuthrpheserleuglylys
165170175
glnvalglyasnlysphepheleuthrasnglygluilemetthrphe
180185190
glulysvallysalaleucysvallyspheglnalaservalalathr
195200205
proargasnalaalagluasnglyalaileglnasnleuilelysglu
210215220
glualapheleuglyilethraspglulysthrgluglyglnpheval
225230235240
aspleuthrglyasnargleuthrtyrthrasntrpasngluglyglu
245250255
proasnasnalaglyseraspgluaspcysvalleuleuleulysasn
260265270
glyglntrpasnaspvalprocysserthrserhisleualavalcys
275280285
glupheproile
290
<210>5
<211>292
<212>prt
<213>artificialsequence
<400>5
glycysproglyleuproglyalaproglyasplysglyglualagly
151015
thrasnglylysargglygluargglyproproglyproproglylys
202530
alaglyproproglyproasnglyalaproglygluprocysmettyr
354045
ileglualaleuasplystyralacysserproaspglyaspserser
505560
leualaalasergluarglysalaleuglnthrglumetalaargile
65707580
lyslystrpleuthrpheserleuglylysglnvalglyasnlysphe
859095
pheleuthrasnglygluilemetthrpheglulysvallysalaleu
100105110
cysvallyspheglnalaservalalathrproargasnalaalaglu
115120125
asnglyalaileglnasnleuilelysgluglualapheleuglyile
130135140
thraspglulysthrgluglyglnphevalaspleuthrglyasnarg
145150155160
leuthrtyrthrasntrpasngluglygluproasnasnalaglyser
165170175
aspgluaspcysvalleuleuleulysasnglyglntrpasnaspval
180185190
procysserthrserhisleualavalcysglupheproilemetglu
195200205
provalaspproargleugluprotrplyshisproglyserglnpro
210215220
lysthralaserasnasncystyrcyslysargcyscysleuhiscys
225230235240
glnvalcysphethrlyslysglyleuglyilesertyrglyarglys
245250255
lysargargglnargargargalaproglnaspserlysthrhisgln
260265270
valserleuserlysglnproalaserglnproargglyaspprothr
275280285
glyprolysglu
290
<210>6
<211>292
<212>prt
<213>artificialsequence
<400>6
metgluprovalaspproargleugluprotrplyshisproglyser
151015
glnprolysthralaserasnasncystyrcyslysargcyscysleu
202530
hiscysglnvalcysphethrlyslysglyleuglyilesertyrgly
354045
arglyslysargargglnargargargalaproglnaspserlysthr
505560
hisglnvalserleuserlysglnproalaserglnproargglyasp
65707580
prothrglyprolysgluglycysproglyleuproglyalaprogly
859095
asplysglyglualaglythrasnglylysargglygluargglypro
100105110
proglyproproglylysalaglyproproglyproasnglyalapro
115120125
glygluprocysmettyrileglualaleuasplystyralacysser
130135140
proaspglyaspserserleualaalasergluarglysalaleugln
145150155160
thrglumetalaargilelyslystrpleuthrpheserleuglylys
165170175
glnvalglyasnlysphepheleuthrasnglygluilemetthrphe
180185190
glulysvallysalaleucysvallyspheglnalaservalalathr
195200205
proargasnalaalagluasnglyalaileglnasnleuilelysglu
210215220
glualapheleuglyilethraspglulysthrgluglyglnpheval
225230235240
aspleuthrglyasnargleuthrtyrthrasntrpasngluglyglu
245250255
proasnasnalaglyseraspgluaspcysvalleuleuleulysasn
260265270
glyglntrpasnaspvalprocysserthrserhisleualavalcys
275280285
glupheproile
290
- 还没有人留言评论。精彩留言会获得点赞!