评估三阴性乳腺癌对新辅助化疗药物敏感性和/或预后的标志物及其应用
本发明涉及生物医药领域,具体涉及评估三阴性乳腺癌对新辅助化疗药物敏感性和/或预后的标志物及其应用。
背景技术:
:公开该
背景技术:
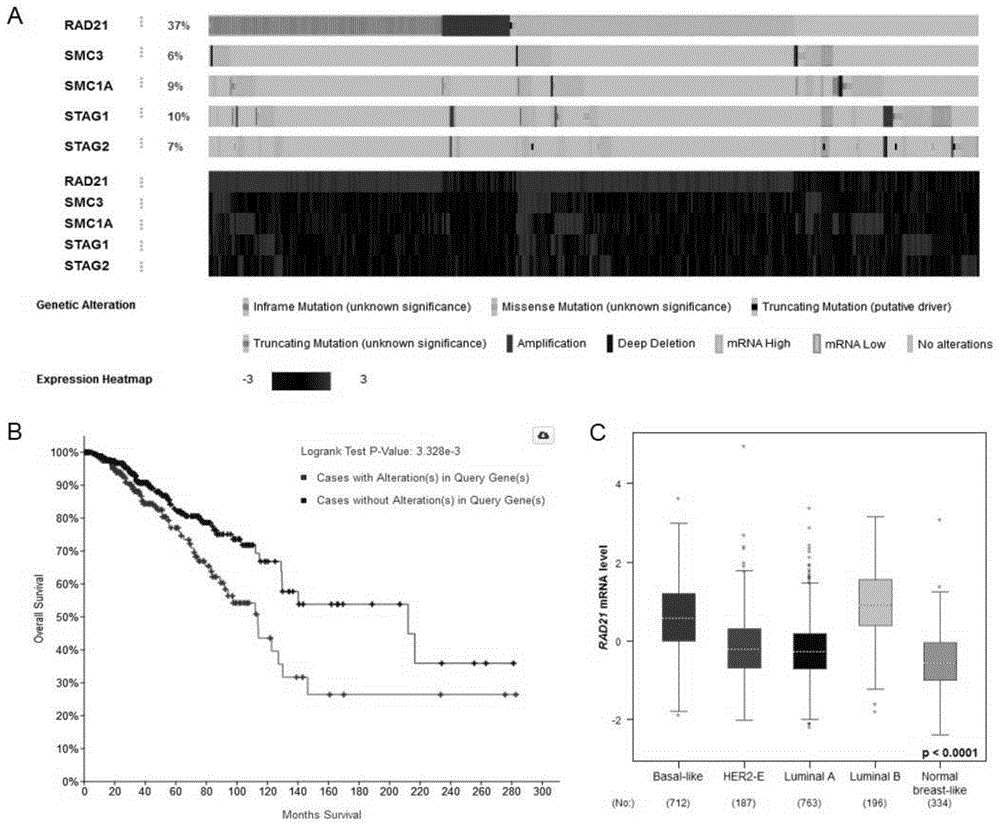
部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。乳腺癌位居女性恶性肿瘤发病率首位,占中国女性恶性肿瘤死亡率的第5位,严重威胁女性健康。乳腺癌死亡病例中大约90%源于乳腺癌转移。乳腺癌是一类高度异质性的恶性肿瘤,根据激素受体、her-2和ki67状态课分为四大类:luminala型、luminalb型、her-2阳性型和三阴性型。其中,三阴性乳腺癌(雌激素受体er、孕激素受体pr及her-2阴性)的恶性程度高、预后差,其主要治疗方式是化疗。新辅助化疗(neoadjuvantchemotherapy,nac)是指在实施乳腺癌手术治疗前进行的全身化疗,是局部晚期乳腺癌患者的标准疗法之一。nac的疗效和辅助化疗的疗效是一样的,但可以使部分不能保乳的患者获得保乳的机会,部分不可手术的患者获得手术的机会。研究表明,预后较差的三阴性乳腺癌(tnbc)和her2型乳腺癌患者如nac治疗获病理完全缓解(pcr),则无病生存期(dfs)改善显著。然而,接受化疗的三阴性乳腺癌患者容易产生化疗耐药,其中的分子机制尚不明确。三阴性乳腺癌患者的新辅助化疗方案是以蒽环类化疗药物和紫杉醇类化疗药物为基础的。含蒽环类药物的方案常用的有acf和cef方案,或ac和ce方案(adriamycin阿霉素/多柔比星,cyclophosphamide环磷酰胺,fu氟尿嘧啶,epirubicin表柔比星/表阿霉素)。乳腺癌细胞对化疗药物的敏感性影响治疗方案的选择和患者的预后。研究表明mdr1/abcb1、bcrp/abcg2、mrp/abccs等耐药相关基因高表达的患者容易产生化疗耐药性,而一些肿瘤相关的关键基因也可能通过调控化疗药物的代谢进而促进化疗耐药。因此,鉴定这些关键基因有助于发现新的预测化疗药物疗效的生物标志物,为乳腺癌患者的个体化治疗和预后判断提供重要的临床依据。cohesin是个巨大的环状蛋白质复合物,rad21是cohesin的核心亚基,它是smc1/smc3异二聚体和stag亚基之间唯一的物理连接,能够调节cohesin与染色质的结合或解离,参与维持细胞基因组稳定性和调控基因的转录表达。技术实现要素:本发明旨在探索rad21参与调控三阴性乳腺癌化疗耐药的分子机制,提供rad21和/或其蛋白在三阴性乳腺癌新辅助化疗反应疗效标志物中的应用。具体地,本发明的技术方案如下所述:在本发明的第一方面,本发明提供了一种体外评估三阴性乳腺癌对新辅助化疗药物敏感性和/或预后的标志物,所述标志物为rad21和/或其蛋白。所述新辅助化疗药物为阿霉素和/或5-氟尿嘧啶(5-fu)。在本发明的一些实施方式中,rad21基因或rad21蛋白的低表达降低乳腺癌细胞对阿霉素的摄入能力,降低乳腺癌细胞对药物的敏感性。在本发明的又一些实施方式中,rad21基因或rad21蛋白的低表达提高乳腺癌细胞对5-氟尿嘧啶的摄入能力,提高乳腺癌细胞对药物的敏感性。在本发明的实施方式中,发明人发现,通过检测乳腺癌标本中rad21基因或rad21蛋白的表达状况,可以预测三阴性乳腺癌患者对新辅助化疗药物阿霉素、5-氟尿嘧啶的反应性,有助于患者化疗方案的选择和化疗效果的评估。在进一步的实施方式中,发明人发现rad21可能通过负调控nrf2/abcc3影响乳腺癌细胞对阿霉素的摄入、caspase3的活化,进而促进乳腺癌细胞对阿霉素的敏感性。以及,rad21可能通过促进abhd5的表达、抑制caspase3的活化,进而增强乳腺癌细胞对5-氟尿嘧啶的抗性。在本发明的第二方面,本发明提供了rad21和/或其蛋白在作为评估三阴性乳腺癌对新辅助化疗药物敏感性和/或预后的标志物方面的应用。在本发明的第三方面,本发明提供了rad21和/或其蛋白在制备检测或筛选新辅助化疗药物敏感人群的试剂方面中的应用。在本发明的第五方面,本发明提供了rad21和/或其蛋白在制备评估三阴性乳腺癌新辅助化疗药物敏感性和/或预后的试剂中的应用。在本发明的第六方面,本发明提供了rad21和/或其蛋白在制备评估三阴性乳腺癌新辅助化疗药物敏感性和/或预后的试剂盒中的应用。在本发明的第七方面,本发明提供了一种体外评估三阴性乳腺癌对新辅助化疗药物敏感性和/或预后的试剂盒,其包括rad21和/或其蛋白表达量的检测相关试剂。在本发明的实施方式中,所述试剂盒检测乳腺癌组织或乳腺癌细胞系中的rad21基因或其蛋白的表达。本发明的优势在于:本发明首次发现了rad21与三阴性乳腺癌患者在预测新辅助化疗药物阿霉素、5-氟尿嘧啶反应性的重要价值。通过检测乳腺癌标本中rad21基因或rad21蛋白的表达状况,可以预测三阴性乳腺癌患者对新辅助化疗药物阿霉素、5-氟尿嘧啶的反应性,有助于患者化疗方案的选择和化疗效果的评估。本发明首次发现了rad21通过负调控nrf2/abcc3的表达增强了乳腺癌细胞对阿霉素的化疗敏感性。这表明rad21在三阴性乳腺癌细胞对基于阿霉素的新辅助化疗药物反应中可能起到重要作用。本发明首次发现了rad21通过正调控abhd5的表达降低了乳腺癌细胞对5-fu的化疗敏感性。这表明rad21在三阴性乳腺癌细胞对基于5-氟尿嘧啶的新辅助化疗药物反应中可能起到重要作用。附图说明构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。以下,结合附图来详细说明本发明的实施方案,其中:图1示出了rad21在乳腺癌的表达情况。图1a为乳腺癌tcga数据库分析cohesin复合物各组分rad21在乳腺癌组织的遗传改变,图1b为rad21与乳腺癌患者临床预后密切相关,图1c为在不同类型乳腺癌组织中rad21基因的mrna表达水平。图2示出了rad21对乳腺癌细胞增殖、迁移和侵袭的影响。图2a为rad21低表达抑制了乳腺癌细胞平板克隆形成能力,图2b为rad21低表达抑制了乳腺癌细胞的迁移和侵袭能力,图2c为rad21高表达促进乳腺癌细胞的迁移和侵袭能力。图3示出了为rad21对阿霉素(多柔比星)作用的乳腺癌细胞活力的影响。图3a-3b为rad21低表达、高表达的mda-mb-231细胞及对照细胞经不同浓度阿霉素作用48h的细胞存活率(cck-8实验);图3c为rad21低表达乳腺癌细胞mda-mb-231及对照细胞,经2μm阿霉素作用30min的阿霉素自发光检测;图3d为rad21低表达的mda-mb-231细胞及对照细胞经0.5μm阿霉素作用48h,蛋白电泳检测细胞凋亡相关caspase3蛋白的表达,结果表明rad21低表达mda-mb-231细胞与对照组相比,细胞凋亡减少;图3e为在mda-mb-231细胞rad21负调控nfe2l2和abcc3基因的表达,敲低rad21诱导mda-mb-231细胞nrf2、abcc3蛋白水平和mrna水平上调。图4示出了rad21对5-氟尿嘧啶作用的乳腺癌细胞活力的影响。图4a-4c为rad21低表达的mda-mb-231细胞及对照细胞经5-氟尿嘧啶作用48h的平板克隆形成率、细胞存活率(cck-8实验)及edu阳性细胞率,结果表明敲低rad21降低了mda-mb-231细胞的存活率、克隆形成能力以及5-fu诱导的细胞s期阻滞;图4d为rad21低表达的mda-mb-231细胞及对照细胞经不同浓度5-氟尿嘧啶作用48h,流式细胞术检测细胞凋亡比例明显增加;图4e-4f为在三阴性乳腺癌细胞mda-mb-231和bt549,rad21低表达引起abhd5表达水平降低;图4g为在经20μm的5-fu作用48h后,rad21低表达mda-mb-231细胞中abhd5的表达水平较对照组细胞明显降低。具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。本发明所使用的试剂或原料均可通过常规途径购买获得,如无特殊说明,本发明所使用的试剂或原料均按照本领域常规方式使用或者按照产品说明书使用。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。实施例1明确rad21在乳腺癌发生发展中的作用本实施例首先将tcga(thecancergenomeatlas)数据库内817例浸润性乳腺癌及正常样本(breastinvasivecarcinoma,tcga,cell2015)纳入本研究分析。其中,817例样本具有完整的外显子组测序(whole-exomesequencing)结果并配有相应的临床病理学信息;817例样本具有完整的rna-sequencing测序结果;816例样本具有完整的拷贝数变异cnv(copy-numberalterations)检测结果。应用cbioportal在线数据库,分析rad21基因在817例浸润性乳腺癌样本(tcga,cell2015)中的表达情况,并进一步进行rad21基因高表达组和低表达组在浸润性乳腺癌样本中的总体生存分析。应用ualcan在线数据库,在tcga乳腺癌及正常样本数据库中分析rad21基因的表达情况。发现在cohesin各组分中rad21在浸润性乳腺癌患者人群中存在最多变异,约37%患者的肿瘤组织中rad21发生基因扩增或mrna表达升高。而cohesion其它组分的变化在患者样本中相对较低,如存在smc1a变异的患者约占9%、存在stag1变化的患者约占10%等(图1a)。rad21基因在不同类型乳腺癌中的表达水平均明显高于正常组织样本(图1c)。在tcga浸润性乳腺癌样本中,rda21高表达组患者为530例,对照组为1374例。rad21高表达组生存月数的中位数为131.7,对照组为167.9,这表明rad21高表达的患者预后较差,rad21与浸润性乳腺癌患者的不良预后密切相关(图1b)。实施例2rad21低表达和过表达质粒构建、靶向rad21基因的sirnas(1)rad21低表达质粒2个rad21低表达质粒tet-onshrad21#1和#2购自济南博尚生物技术有限公司,质粒为pzip-tre3g-zsgreen-puro(v125u)。序列如下:tet-onshrad21#1:5‘-gccattactttacctgaagaat-3’tet-onshrad21#2:5‘-ccaaataccttcttgcagactg-3’(2)rad21过表达载体构建rad21全长cdna克隆(penter穿梭载体)购自维真生物科技有限公司,货号为ch886982。首先扩增rad21基因全长cdna片段,然后经bamhi和xhoi双酶切连入慢病毒载体pcmv-mir。(3)小干扰rnas序列(均购自上海吉玛有限公司)如下:rad21-57985'-ccaaauaccuucuugcaga-3'rad21-58025'-gcuuauaaugccauuacuu-3'rad21-58035'-gaagcauucauuaagauaa-3'实施例3rad21在乳腺癌化疗耐药中的生物学作用(1)慢病毒包装1.6ml无血清培养基中加入4μgpmd2.g,8μgpspax2,8μg目的dna,另一15ml离心管中加入1.6ml无血清培养基36μllip2000,充分混匀,室温静置5min;将两个离心管中的液体混合到一起,混合均匀,室温孵育20min;将混合液加至汇合度80%左右的293t细胞中,培养箱中培养,6h后弃液体加入培养基培养;培养24h后收取5ml病毒液,置于4℃保存,补齐至6ml,48h收取全部病毒液;将病毒液用0.22μm的滤器过滤,根据体积加入ployprene,-80℃保存。(2)构建细胞系将需要感染的细胞铺置6孔板中,在汇合度达到70%时每孔加入2ml病毒液,感染细胞48h;之后换成正常培养基继续培养,可根据情况传代,培养基中加入puromycin,连续筛选细胞两周可得到稳定转染目的质粒的细胞系;此时细胞可扩大培养,冻存,以备后期使用。(3)细胞培养mda-mb-231、mda-mb-468、bt549细胞于含10%fbs的dmem中培养。所有细胞均在37℃,5%co2条件下培养。(4)细胞瞬时转染小干扰rnamda-mb-231细胞瞬时转染靶向rad21的小干扰rna,小干扰rnas经8000rpm离心2min,将粉末聚集在管底,超净台内向试管中加入无菌的depc水,室温溶解30min,混匀,-80℃保存。转染前一天按5×104细胞/ml铺细胞;取7.5μlexfet2000(购自南京诺唯赞生物科技有限公司)与10μl小干扰rna分别在500μl的无血清培养基中混合均匀后静置5min;将含有exfect2000与小干扰rna的培养基混合均匀后静置20min;将细胞用pbs洗涤两次后加入1ml的无血清培养基与1ml的上述混合液,置于培养箱中培养6h;然后弃培养基,pbs洗涤后更换成含有10%fbs的培养基正常培养。转染48h后常规收获细胞,经real-timepcr和蛋白电泳检测rad21基因低表达的效果。(5)cck-8检测细胞存活率mda-mb-231/tet-on-shrad21细胞经dox诱导24h,231-pcmv-nc细胞,231-pcmc-rad21细胞用常规方法收集细胞后,计数铺96孔板,3000细胞/孔,每孔100μl细胞悬液,过夜培养;配制含药培养基,将阿霉素混合于含10%fbs血清的dmem中,工作液浓度分别为:0、0.1、0.2、0.4、0.8、1.2μm;药物作用48h后,每孔加入10μlcck8溶液,三小时后使用酶标仪测量吸光度,吸光度为450nm,测量前确保96孔板每个孔中无气泡,否则会影响测量结果。实验结果如图3、图4所示,结果发现:与对照细胞相比,rad21低表达降低mda-mb-231细胞对阿霉素的敏感性,而过表达rad21增加mda-mb-231细胞对阿霉素的敏感性;与对照细胞相比,rad21低表达mda-mb-231细胞对5-fu的敏感性增加。(6)平板克隆形成实验乳腺癌细胞计数后铺于六孔板,每孔1000个细胞,每孔2ml培养基;培养约10天形成单克隆后,终止培养进行染色;弃培养基后pbs洗涤细胞两次,每次约5min;加入甲醇固定细胞20min;pbs洗涤细胞两次每次5min;每孔加入2ml结晶紫室温染色30min或4℃过夜染色;弃结晶紫染液,三蒸水洗涤细胞至水无颜色,倒置于吸水纸上,完全晾干后拍照统计。实验设置对照组和5-fu加药组:5-fu加药组,5-fu作用浓度为10μm,48h后撤药;对照组加相同体积dmso。实验结果如图2所示,结果表明,与对照细胞相比,rad21低表达降低了mda-mb-231细胞的平板克隆形成能力;经10μm5-fu作用48h后,rad21低表达mda-mb-231细胞的克隆数与对照组相比明显减少,细胞对5-fu的敏感性明显增加。(7)细胞总蛋白的提取和定量①细胞总蛋白的提取:常规方法收集细胞后1500rpm离心5min,弃上清,加入1mlpbs重悬,7500rpm离心弃上清;加入适量预冷的wip裂解液(提前加入蛋白酶抑制剂pmsf以及两种磷酸酶抑制剂naf,no3vo4),充分混匀,冰上裂解30min,每隔5min涡旋振荡一次;30min后12000rpm4℃离心15min;将上清转移至标记好的1.5ml的微量离心管中,-80℃冰箱保存。②bca法进行蛋白定量:制备蛋白标准曲线:在标记好的1.5ml微量离心管中分别加入0、1、2、4、8、12、16μl的bsa溶液,用灭菌的pbs补齐至20μl,浓度依次为0、50、100、200、400、600、800μg/ml;制备待测样品管:在标记好的1.5ml微量离心管中加入18μl灭菌的pbs,后加入2μl对应的蛋白样品;制备bca工作液:根据蛋白及标准曲线的样品数制备bca工作液,每管需要加入200μl的工作液,a液与b液的比值为50:1;在样品管及标准曲线管中加入工作液后混合均匀,60℃孵育30min;酶标仪在562nm的波长下测量吸光度,记录相应的蛋白浓度。(8)蛋白电泳westernblotting蛋白变性:1)取20-50μg的蛋白加入八排管中用三蒸水将蛋白样品调整到一样的体积,然后根据体积加入5×的蛋白上样缓冲液;2)混合均匀后pcr仪中99℃变性10min。3)配置聚丙烯酰胺凝胶蛋白上样及电泳:1)将配好的胶插到电泳夹中,固定好,配置1×的sds电泳缓冲液1000ml加入电泳槽中,拔掉梳子,若孔中有碎胶可用注射器冲洗干净;2)将变性的蛋白用10μl的移液枪全部加入胶孔中,并在相应的位置加入蛋白预染marker;3)加样结束后,80v电泳至样品进入分离胶,将电压调至120v,根据预染marker指示带的位置判断电泳结束的时间。转膜:1)按上述实验方法配置转膜液,将转膜液倒至一盘中,把海绵滤纸浸入转膜液中,准备好相应的工具并接取适量的冰块;2)剪取合适大小的pvdf膜,标记后,浸泡入甲醇中;3)取下胶板,用切胶板将胶板撬开,把浓缩胶切除,将胶轻轻的置于滤纸上,按照海绵、滤纸、胶、pvdf膜、滤纸、海绵的顺序依次放置,期间用玻璃棒将气泡赶出,将架子夹紧;4)按照黑对黑的顺序将转膜夹置于转膜槽中,并放入冰盒;5)插入电极,转膜槽放入盆内,将冰块覆盖整个转膜槽,100v转膜1h。封闭:配置适量体积的封闭液,转膜结束后将pvdf膜置于封闭液中,封闭1h。孵育一抗:1)将封闭好的膜在pbst中清洗几次洗掉封闭液;2)将pvdf膜置于一次性手套中,根据marker的位置用圆珠笔进行标记,剪取自己需要的条带,注意区分正反面;3)剪取合适大小的封口膜,放于湿盒中,在封口膜上加入适量的稀释的一抗,将pvdf膜倒置放置于一抗稀释液上,注意不要有气泡产生;4)将湿盒放于4℃冰箱中,孵育过夜。孵育二抗:1)一抗孵育结束后,将膜置于小盒中,加入适量的tbst摇床洗涤3次,每次10min,一抗回收置于4℃冰箱中可重复使用;2)根据一抗的属性配置相应的二抗(鼠抗,兔抗稀释比例为1:10000),二抗用封闭液进行稀释,摇床孵育1h;3)二抗孵育结束后,将膜置于tbst中同样洗涤3次,每次10min。曝光:1)根据pvdf膜的数量配置一定体积的发光液,将发光液中的两种试剂按照等体积的量混合均匀,注意避光;2)将pvdf膜放置于仪器的托盘中,混合后的发光液滴加至膜上,将托盘插入仪器中;3)选择合适的曝光时间进行曝光,保存图片,后期分析使用。(9)实时定量pcr①rna提取定量1)根据试剂盒要求首次使用在相关试剂中加入无水乙醇;2)常规方法收集细胞至1.5ml微量离心管中,管中加入250μlcrl1,吹打混匀;3)将液体转移至dna吸附柱中,12000rpm离心2min;4)得到的液体加入400μlcrl2,混合均匀移至rna吸附柱中,12000rpm离心2min;5)弃收集管中的液体加入500μlrw1,12000rpm离心1min;6)弃收集管中的液体加入500μlrw2,12000rpm离心1min;7)重复步骤(6);8)弃收集管中的液体,12000rpm离心2min;9)将吸附柱转移至新的1.5ml微量离心管中,加入已65℃预热的depc水,室温静置2min后,12000rpm离心2min;10)重复步骤(9);11)使用超微量分光光度计进行rna浓度测量,rna于-80℃冰箱中保存。②逆转录(20μl体系)1)将下述试剂加入八排管中,混匀后短暂离心,于pcr仪中进行逆转录,反应体系如下:37℃,15min;98℃,5min;试剂体积rna1μg5×enzymemix4μl无rnase水补齐至20μl2)反应完成后得到的cdna用无rnase水稀释5倍,-20℃冰箱保存。③实时荧光定量pcr1)引物序列如下2)反应体系如下表,每孔10μl;试剂体积sybrmix5μl引物(f+r)0.4μldepc水3.6μlcdna1μl3)混合均匀后加入96孔反应板或八排管中,用封口膜封住或盖上八排管盖,3000rpm,离心2min,放入定量pcr仪中(样品及内参均至少3个复孔);4)程序结束后进行数据分析处理。(10)阿霉素摄入实验mda-mb-231细胞经瞬时转染靶向rad21的sirnas48h后,常规方法收集细胞,计数铺24孔板,每孔8.5万细胞,培养过夜;每孔使用2μm的阿霉素处理细胞30min,之后pbs清洗3次;使用免疫荧光固定液固定30min,pbs清洗1次;提前使用95%乙醇擦洗载玻片,晾干后滴加dapi染液,用镊子轻轻取出飞片,倒立于吸水纸上吸水,倒扣于dapi染液上,指甲油封片,晾干;显微镜下拍照并统计。实验结果发现:与对照组细胞相比,rad21低表达的mda-mb-231细胞对阿霉素的摄入明显减少。(11)edu掺入法检测细胞增殖1)常规方法收集细胞并计数,按每孔7万细胞将细胞铺于含飞片的24孔板中,含飞片的24孔板提前用pbs润洗,减少飞片表面张力;设置对照组和加药组,培养过夜;2)加药组5-fu处理浓度为10μm,作用48h;对照组加同体积dmso;3)每孔加入100μledu试剂a稀释液(完全培养基:a液=1000:1),培养箱孵育2h;4)弃培养基,每孔加入500μlpbs,洗涤细胞两次,每次5min;5)弃pbs每孔加入500μl细胞固定液,室温孵育30min;6)弃固定液,每孔加入500μl2mg/ml的甘氨酸溶液,摇床孵育5min;7)弃甘氨酸溶液,每孔加入500μlpbs,洗涤细胞两次,每次5min;8)弃pbs每孔加入500μl含0.5%tritonx-100的pbs,孵育10min;9)pbs洗涤细胞两次,每次5min;10)每孔加入20μl的1×apollo染液,避光摇床孵育30min,以下步骤均避光;apollo染液配置比例如下:试剂盒试剂1ml水938μl试剂b50μl试剂c10μl试剂d5μl试剂e9mg11)弃染液,每孔加入500μl渗透液(含0.5%tritonx-100的pbs)洗涤细胞两次,每次10min;12)弃渗透液每孔加入500μl甲醇,洗涤细胞两次每次5min;13)弃甲醇,每孔加入500μlpbs洗涤细胞一次,5min;14)提前用95%乙醇擦洗载玻片,晾干后滴加dapi,用镊子轻轻取出飞片,倒扣于dapi上,晾干;15)指甲油封片,晾干,显微镜下拍照并统计。(12)流式细胞术1)mda-mb-231细胞瞬时转染小干扰rna序列,过夜培养24h;2)24h后铺中皿,每皿35万细胞,过夜培养;设置对照组和加药组,加药组5-fu作用浓度为10μm、20μm,作用48h;对照组加等体积dmso;4)常规方法收细胞,1500rpm,离心5min,弃上清;5)用预冷的pbs洗涤细胞2次,1500rpm,离心5min,弃上清;6)细胞重悬:加入100μl1×bindingbuffer,轻轻吹匀至单细胞悬液7)细胞染色:加入5μlannexinv-pe和5μl7-aadstainingsolution;轻轻混匀,避光、室温孵育10min;加入400μl1×bindingbuffer,轻轻混匀,染色后在1h内用流式细胞仪检测。实验结果表明,经5-fu处理后,rad21低表达mda-mb-231细胞与对照组相比,凋亡比例增加。(13)细胞迁移和侵袭实验1)铺细胞-迁移实验a.常规方法收集细胞,用无血清的培养基洗涤细胞两次,细胞计数,取10万细胞悬液离心,后加入200μl无血清培养基重悬,加入小室中;b.下室加入700μl含10%血清的培养基,培养箱中培养20h;2)铺细胞-侵袭实验基质胶保存于-20℃冰箱为固体状态,4℃时为液态,37℃为凝胶状,铺胶时提前将胶从-20℃拿出置于4℃过夜融化。a.侵袭实验需要提前铺胶,基质胶与无血清培养基的比例为1:20,小室放于24孔板中,每小室加入50μl的混合液,应避免气泡的产生(可将微量移液器调至51μl,吸头内液体不完全排尽),在37℃培养箱中凝胶,大约需6h;b.常规方法收集细胞,用无血清的培养基洗涤细胞两次,细胞计数,取10万细胞悬液离心,后加入200μl无血清培养基重悬,加入到含凝胶的小室中;c.下室加入700μl含30%血清的培养基,37℃培养箱培养36h;3)将小室连同24孔板取出,pbs清洗小室两次,每次5min;4)加入甲醇固定细胞30min,加入甲醇前可用棉棒将小室的内侧轻轻擦拭;5)将小室置于结晶紫染液中,室温染色30min或者4℃过夜;6)pbs洗涤小室两次,5min/次,用棉棒擦拭小室内侧残余染料,勿触及底部;7)清洗干净后,晾干,倒置显微镜下观察,拍照统计。结论:(1)rad21在中高表达并与患者不良预后相关。本发明实施例利用乳腺癌tcga数据库分析发现rad21在浸润性乳腺癌患者中的基因扩增和mrna表达上调比例较高(37%),对rad21与患者临床预后关系的分析显示rad21高表达的乳腺癌患者的预后较差;对乳腺癌患者肿瘤组织的免疫组化分析结果提示,rad21在癌组织中表达明显高于癌旁组织;与正常的乳腺细胞系mcf-10a相比,rad21在乳腺癌细胞中表达较高,尤其是在三阴性乳腺癌细胞系中表达最高。(2)通过细胞生长曲线测定(cck-8)、平板克隆实验、transwell实验和上皮间质转化emt标志物分析等实验,在三阴性乳腺癌细胞系mda-mb-231、bt549中敲低rad21基因表达能够明显抑制乳腺癌细胞增殖、迁移和侵袭能力;过表达rad21后促进了乳腺癌细胞mda-mb-231的迁移和侵袭能力,但并未影响细胞的增殖能力。移植瘤实验结果进一步证实,rad21低表达的乳腺癌细胞移植瘤体积明显小于对照组。(3)利用细胞生长曲线测定(cck-8)、平板克隆实验和蛋白电泳等方法探究经不同浓度的阿霉素(多柔比星)作用,rad21基因低表达、高表达的乳腺癌细胞系的细胞增殖和细胞凋亡的变化。经不同浓度阿霉素作用48小时后,rad21低表达的三阴性乳腺癌细胞mda-mb-231的细胞存活率较对照组增高,细胞凋亡减少;而rad21高表达的mda-mb-231细胞的存活率较对照组降低。利用荧光显微镜检测2μm阿霉素作用不同时间点的自发光,可以反映乳腺癌细胞的药物摄入水平。rad21低表达的mda-mb-231细胞的阿霉素自发光强度明显低于对照细胞,表明rad21低表达降低了细胞对阿霉素的摄入能力。进一步的研究发现rad21负调控nfe2l2基因表达,nfe2l2基因编码的nrf2蛋白作为转录因子可以激活其下游靶基因abcc3(多药耐药相关蛋白3)表达上调,而abcc3属于abc转运蛋白超家族,其高表达是导致化疗耐药的重要因素之一。这提示rad21可能通过负调控nrf2/abcc3进而影响乳腺癌细胞对阿霉素的摄入、caspase3的活化,从而促进乳腺癌细胞对阿霉素的敏感性。(4)利用细胞生长曲线测定(cck-8)、平板克隆实验、edu掺入实验和蛋白电泳等方法探究经不同浓度的5氟尿嘧啶作用48小时后,rad21低表达的三阴性乳腺癌细胞mda-mb-231的细胞存活率、平板克隆形成能力、细胞增殖能力均较对照组降低,凋亡细胞比例增高。进一步研究发现,rad21正调控abhd5的表达,而已有研究表明abhd5可以通过促进自噬性尿嘧啶的产生,引起细胞产生5-fu化疗耐药。这提示rad21可能通过促进abhd5的表达、抑制caspase3的活化来增强乳腺癌细胞对5氟尿嘧啶的抗性。以上结果表明,rad21在乳腺癌组织和乳腺癌细胞系中高表达并与患者不良预后相关,rad21促进三阴乳腺癌细胞的迁移和侵袭能力,rad21参与调控三阴乳腺癌对新辅助化疗药物阿霉素、5氟尿嘧啶的敏感性,是一个潜在的治疗靶点或治疗方案选择的预测指标。以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1