一种提高重组蛋白表达量的方法与流程
1.本发明涉及分子生物学领域,具体涉及一种提高重组蛋白表达量的方法。
背景技术:
2.重组蛋白工业生产的常用哺乳动物作为宿主细胞,中国仓鼠卵巢(cho)细胞是最常用的宿主细胞。尽管cho细胞已成功地用作制造宿主细胞系统超过30年,但这些细胞系在生长速度和重组蛋白生产能力方面仍然受到一定限制。改善宿主细胞的性能,提高宿主细胞的重组蛋白表达量,一直都是重组蛋白生产领域关注的重点。通过生物分子学方法改造细胞系是常用的提高宿主细胞重组蛋白表达量的方法,现阶段应用于cho细胞的细胞系改造方法包括:敲除、过表达特定基因以及使用非编码rna等。这些特定基因涉及蛋白合成、细胞代谢、分泌以及细胞周期等各个细胞通路。
3.目前,亟待提供一种提高重组蛋白表达量的方法。
技术实现要素:
4.本发明的目的在于克服现有技术的缺陷,利用snare家族蛋白改造用于表达重组蛋白的细胞,改善其性能。
5.第一方面,本发明提供一种提高重组蛋白表达量的方法,所述方法包括如下步骤:将编码snare家族蛋白的基因转入用于表达重组蛋白的细胞中,进行瞬时或稳定表达;所述重组蛋白不为所述snare家族蛋白。
6.本发明提供的方法通过在宿主细胞中过表达snare家族蛋白,从而提升重组蛋白产量。
7.在一些实施方式中,所述snare家族蛋白包括sec22b蛋白(sec22 homolog b,vesicle trafficking protein),bet1蛋白(bet1 golgi vesicular membrane trafficking protein)和/或stx5蛋白(syntaxin 5)。
8.在一些实施方式中,所述方法包括如下步骤:将具有编码sec22b蛋白的基因的载体转入用于表达重组蛋白的细胞中。
9.在一些实施方式中,所述方法包括如下步骤:将具有编码bet1蛋白的基因的载体转入用于表达重组蛋白的细胞中。
10.在一些实施方式中,所述方法包括如下步骤:将具有编码stx5蛋白的基因的载体转入用于表达重组蛋白的细胞中。
11.在一些实施方式中,所述方法包括如下步骤:将具有编码sec22b蛋白和编码bet1蛋白的基因的载体转入用于表达重组蛋白的细胞中。
12.在一些实施方式中,所述方法包括如下步骤:将具有编码sec22b蛋白和编码stx5蛋白的基因的载体转入用于表达重组蛋白的细胞中。
13.在一些实施方式中,所述方法包括如下步骤:将具有编码bet1蛋白和编码stx5蛋白的基因的载体转入用于表达重组蛋白的细胞中。
14.在一些实施方式中,所述方法包括如下步骤:将具有编码bet1蛋白和编码stx5蛋白的基因的载体转入用于表达重组蛋白的细胞中。
15.在一些实施方式中,所述方法包括如下步骤:将具有编码sec22b蛋白、编码bet1蛋白和编码stx5蛋白的基因的载体转入用于表达重组蛋白的细胞中。
16.在一些实施方式中,所述基因经过了密码子优化。
17.在一些实施方式中,所述载体中还插入了蛋白标签,如flag标签、halo标签、snap标签、his-tag标签等。
18.在一些实施方式中,所述载体为真核细胞表达载体。作为本发明的优选方案,所述载体为pcdna3.1载体,如pcdna3.1 hygro(+)载体。
19.在一些实施方式中,所述细胞为哺乳动物细胞,可以选自cho细胞(中国仓鼠卵巢细胞)、hek293细胞、vero细胞等。
20.在一些实施方式中,所述细胞为cho细胞,具体可以选用cho-k1、cho-s、cho-dxb11、cho-dg44等细胞系。
21.在一些实施方式中,所述用于表达重组蛋白的细胞是能够稳定表达重组蛋白的单克隆细胞。
22.在一些实施方式中,所述用于表达重组蛋白的细胞是外源转入了重组蛋白表达载体的细胞,所述重组蛋白表达载体可以先于编码sec22b蛋白、编码bet1蛋白和/或编码stx5蛋白的基因或载体转入细胞,也可以与编码sec22b蛋白、编码bet1蛋白和/或编码stx5蛋白的基因或载体共同转入。
23.作为本发明的一种具体实施方式,所述方法包括如下步骤:合成cho细胞的编码sec22b蛋白、编码bet1蛋白和/或编码stx5蛋白的基因,优选合成如seq id no:1所示、如seq id no:2所示和/或如seq id no:3所示的基因序列,然后分别构建到pcdna3.1载体中,将所得载体转染到能够表达重组蛋白的单克隆cho细胞中。
24.作为本发明的一种具体实施方式,所述方法包括如下步骤:合成cho细胞的编码sec22b蛋白、编码bet1蛋白和/或编码stx5蛋白的基因,优选合成如seq id no:1所示、如seq id no:2所示和/或如seq id no:3所示的基因序列,然后分别构建到pcdna3.1载体中,将所得载体与重组蛋白的表达载体共同转染到cho细胞中。
25.在一些实施方式中,所述重组蛋白选自单克隆抗体(例如:曲妥珠单抗)和融合蛋白。
26.在一些实施方式中,所述融合蛋白为fc融合蛋白,即利用基因工程等技术将某种具有生物活性的功能蛋白分子与免疫球蛋白(igg、iga等)的fc片段融合而产生的蛋白,如tnfr-fc融合蛋白等。
27.本发明行瞬时表达的方法具体为:采用本领域常用的转染方法(例如采用聚醚酰亚胺(pei)试剂),将外源的基因或插入了所述外源基因的载体转染到宿主细胞。为了提高转染的效率和细胞的存活率,可以在转染时采用特定的转染培养基。
28.本发明进行稳定表达的方法具体为:将外源的基因序列插入具有某种抗性的载体上,采用本领域常用的转染方法(例如采用聚醚酰亚胺(pei)试剂),将该载体转染到宿主细胞并整合到宿主染色体中,然后用所述载体中所含的抗性筛选标志物如新霉素(neomycin)、潮霉素(hygromycin)、嘌呤霉素(puromycin)等进行筛选,直至细胞活率恢复
至90%以上,得到稳定表达外源基因的细胞。为了提高转染的效率和细胞的存活率,可以在转染时采用特定的转染培养基。
29.第二方面,本发明提供一种高表达重组蛋白的细胞,所述细胞能够瞬时或稳定过表达snare家族蛋白,所述重组蛋白不为所述snare家族蛋白。
30.本发明提供的细胞能够过表达snare家族蛋白,可以显著提高重组蛋白的表达量。
31.在一些实施方式中,所述snare家族蛋白包括sec22b蛋白、bet1蛋白和/或stx5蛋白。
32.在一些实施方式中,所述细胞中外源转入了编码snare家族蛋白的基因。具体而言,所述编码snare家族蛋白的基因包括编码sec22b蛋白的基因、编码bet1蛋白的基因和/或编码stx5蛋白的基因。
33.在一些实施方式中,所述细胞中外源转入了编码sec22b蛋白的基因或插入了上述基因的载体。
34.在一些实施方式中,所述细胞中外源转入了编码bet1蛋白的基因或插入了上述基因的载体。
35.在一些实施方式中,所述细胞中外源转入了编码stx5蛋白的基因或插入了上述基因的载体。
36.在一些实施方式中,所述细胞中外源转入了编码sec22b蛋白和编码bet1蛋白的基因或插入了上述基因的载体。
37.在一些实施方式中,所述细胞中外源转入了编码sec22b蛋白和编码stx5蛋白的基因或插入了上述基因的载体。
38.在一些实施方式中,所述细胞中外源转入了编码bet1蛋白和编码stx5蛋白的基因或插入了上述基因的载体。
39.在一些实施方式中,所述细胞中外源转入了编码bet1蛋白和编码stx5蛋白的基因或插入了上述基因的载体。
40.在一些实施方式中,所述细胞中外源转入了编码sec22b蛋白、编码bet1蛋白和编码stx5蛋白的基因或插入了上述基因的载体。
41.在一些实施方式中,所述基因进行了密码子优化。
42.在一些实施方式中,所述载体中还具有蛋白标签,如flag标签、halo标签、snap标签、his-tag标签等。
43.在一些实施方式中,所述载体为真核细胞表达载体。作为本发明的优选方案,所述载体为pcdna3.1载体,如pcdna3.1 hygro(+)载体。
44.在一些实施方式中,所述细胞为哺乳动物细胞,可以选自cho细胞、hek293细胞、vero细胞等。
45.在一些实施方式中,所述细胞为cho细胞,具体可以选用cho-k1、cho-s、cho-dxb11、cho-dg44等细胞系。
46.在一些实施方式中,所述细胞是能够稳定表达重组蛋白的单克隆细胞。
47.在一些实施方式中,所述细胞是外源转入了重组蛋白表达载体的细胞,所述重组蛋白表达载体可以先于编码sec22b蛋白、编码bet1蛋白和/或编码stx5蛋白的基因或载体转入细胞,也可以与编码sec22b蛋白、编码bet1蛋白和/或编码stx5蛋白的基因或载体共同
转入。
48.作为本发明的一种具体实施方式,所述细胞为表达重组蛋白的单克隆cho细胞,其中外源转入了插入cho细胞的编码sec22b蛋白的基因、优选如seq id no:1所示的基因的pcdna3.1载体,外源转入了插入cho细胞的编码bet1蛋白的基因、优选如seq id no:2所示的基因的pcdna3.1载体和/或外源转入了插入cho细胞的编码stx5蛋白的基因、优选如seq id no:3所示的基因的pcdna3.1载体。
49.作为本发明的一种具体实施方式,所述细胞为cho细胞,其中外源转入了重组蛋白的表达载体,还外源转入了插入cho细胞的编码sec22b蛋白的基因、优选如seq id no:1所示的基因的pcdna3.1载体,外源转入了插入cho细胞的编码bet1蛋白的基因、优选如seq id no:2所示的基因的pcdna3.1载体和/或外源转入了插入cho细胞的编码stx5蛋白的基因、优选如seq id no:3所示的基因的pcdna3.1载体。
50.在一些实施方式中,所述重组蛋白选自单克隆抗体(例如:曲妥珠单抗)和融合蛋白。所述融合蛋白优选为fc融合蛋白,如tnfr-fc融合蛋白等。
附图说明
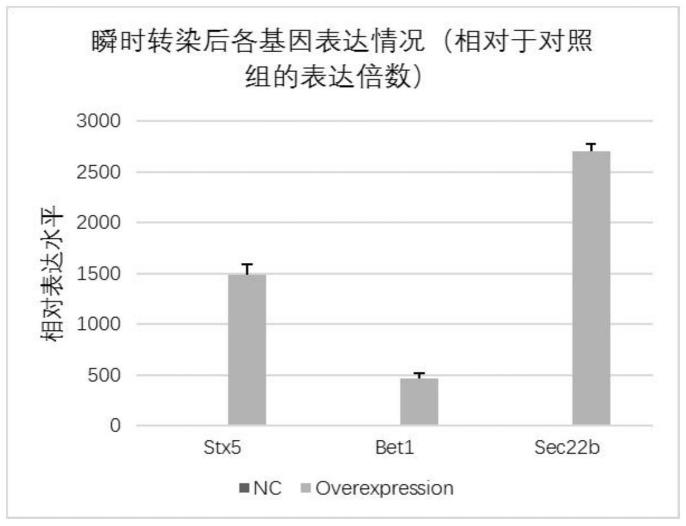
51.图1为瞬时转染72h后snare家族蛋白相对于对照组的表达水平;
52.图2为瞬时转染snare家族蛋白后herceptin单克隆的活细胞密度;
53.图3为瞬时转染snare家族蛋白后herceptin单克隆的细胞活率;
54.图4为瞬时转染snare家族蛋白后herceptin单克隆的抗体产量;
55.图5为瞬时转染snare家族蛋白后tnfr-fc单克隆的活细胞密度;
56.图6为瞬时转染snare家族蛋白后tnfr-fc单克隆的细胞活率;
57.图7为瞬时转染snare家族蛋白后tnfr-fc单克隆的蛋白产量;
58.图8为在herceptin单克隆中表达snare家族蛋白的细胞池中各基因相对于对照组的表达情况;
59.图9为在herceptin单克隆中稳定表达snare家族蛋白后的活细胞密度;
60.图10为在herceptin单克隆中稳定表达snare家族蛋白后的细胞活率;
61.图11为在herceptin单克隆中稳定表达snare家族蛋白后的抗体产量。
具体实施方式
62.以下实施例用于说明本发明,但不用来限制本发明的范围。
63.实施例1:质粒构建
64.将cho细胞(中国仓鼠卵巢细胞)的sec22b基因序列进行序列合成,即合成如seq id no:1所示的基因序列,构建到pcdna3.1hygro(+)载体中,得到pcdna-sec22b载体。
65.所述seq id no:1具体为:
66.atggtgctgctgacaatgattgcccgcgtggccgacgggcttccgctggccgcttcgatgcaggaggacgaacagtcaggccgagaccttcagcagtatcagagtcaggctaaacaactctttcgaaaactgaatgaacagtcccctaccagatgtaccttgggagcaggagccatgacttttcactacattattgagcagggggtgtgttacttagtcttgtgtgaagctgccttccctaagaagttggcctttgcctacctggaagacctgcactcggaatttgatgaacagcatgggaagaaggtgcctactgtgtctaggccctattccttcattgagtttgataccttcattcagaaaaccaagaaactcta
cattgatagtcgtgctcggagaaatctaggctccatcaacactgaattgcaagatgtgcagaggatcatggtggccaatattgaagaagtcttacagcggggggaagcactctcagcattggactcaaaggctaacaatttgtccagtctgtctaagaaataccgccaggatgcgaagtacctgaacatgcgttccacttacgccaaacttgcagcagtagctgtatttttcatcatgttgatagtgtatgtgcggttttggtggctgtga
67.将cho细胞(中国仓鼠卵巢细胞)的bet1基因序列的编码区进行序列合成,即合成如seq id no:2所示的基因序列,构建到pcdna3.1 hygro(+)载体中,得到pcdna-bet1载体。
68.所述seq id no:2具体为:
69.atgaggcgtgcaggcctgggtgaaggaggacctcctggcaactatgggaactatggctatgctggtagtggctataatgcctgtgaagaagaaaacgacagactcactgaaagtctgagaagcaaagtgactgccatcaaatctctttccattgaaataggccatgaagttaaaaatcaaaacaaactactagctgaaatggattcacagtttgattctacaactggatttctaggtaaaaccatgggaagactgaagattttgtccagaggaagccaaacaaaattgctatgctatatgatgttgttttcattgtttgtcttttttgtcatttactggattattaaactgaggtga
70.将cho细胞(中国仓鼠卵巢细胞)的stx5基因序列的编码区进行序列合成,即合成如seq id no:3所示的基因序列,构建到pcdna3.1 hygro(+)载体中,得到pcdna-stx5载体。
71.所述seq id no:3具体为:
72.atgatcccgcggaaacgctacggatctaagaacacagatcagggtgtctacctgggtctctcaaagacacaggttctgtcccctgcaactgctgtcagtagcagcagcgacatcactcctttgcccaccccggtggccctggtcccttcccctcccgacaccatgtcctgccgggatcggacccaggagttcctgtctgcctgtaagtcgctgcagagccgtcagaatggaatccaaacaaataaaccagctctacgggctgccagacaacgcagtgaatttacccttatggccaagcgcattggaaaagatctcagcaatacatttgccaagctggagaagctaacaatcttggcaaagcgcaagtccctctttgatgataaagcagtagaaattgaggagctaacatacatcatcaaacaggacatcaatagcctcaacaaacaaattgctcaacttcaagattttgtgagggccaagggcagccagagtggccggcatctgcagacacattccaacaccattgtagtttcattgcagtcaaaactggcttccatgtccaatgacttcaaatcagttttagaagtgaggactgagaacctgaaacaacagaggaaccgtcgggaacagttctcccggacaccagtgtcggccctgccccttgcccccaaccaccttgggggaggacccatagttttgggagcagagtcccgagcctccagggatgtggccatcgacatgatggattctagaacaagccagcagcttcagctcattgacgagcaggattcctacatccagagccgggcagataccatgcagaacatcgagtctacaatcgttgagctgggctccatttttcagcagttggcacacatggtgaaagaacaggaggaaactattcagaggattgatgagaatgtgcttggagcccagctggatgttgaggccgcccattcagagatcctcaagtacttccagtcagtcacctccaatcggtggctcatggtcaaaatcttcctcatcctcattgtcttcttcatcatctttgtggtcttccttgcctga
73.所述pcdna3.1 hygro(+)载体具有如seq id no:4所示的序列。
74.实施例2:瞬时转染
75.1、实验材料:
76.表达herceptin单抗的cho-k1单克隆,培养基:ex-cell advanced cho fed-batchmedium(sigma);
77.表达tnfr-fc融合蛋白的cho-k1单克隆,培养基balancd cho growtha(irvine),添加4mm谷氨酰胺;
78.实验前两种克隆均已复苏后传代一周以上,接种密度0.3-0.5
×
106个/ml,每3天传代一次,于180rpm,5%co2细胞培养摇床中培养。
79.24深孔板及三明治硅胶盖(htslabs)
80.转染培养基:blancd transfectory cho(irvine)
81.2、步骤:
82.转染前一天将单克隆细胞传代至1.0
×
106个/ml,转染当天计数,用转染培养基blancd transfectory cho调整密度至2.0
×
106个/ml,分装到24深孔板中,每孔2.2ml。分别在细胞中加入实施例1构建的pcdna-sec22b,pcdna-bet1,pcdna-stx5质粒各4μg/孔,pcdna3.1质粒4μg/孔,pei(聚醚酰亚胺)12μl/孔(1mg/ml),每种质粒3个复孔。转染后,分别在24h,48h,72h,96h计数及留样用于滴度检测。72h的细胞样品进行rna提取,逆转录成cdna,再分别用sec22b,stx5,bet1的引物进行荧光定量pcr检测。
83.3、herceptin克隆中的瞬时转染结果如图1至图4所示。
84.如图1所示,瞬时转染stx5,bet1,sec22b 72h后的细胞中,基因表达水平分别为对照组的1484,464和2703倍,说明瞬时转染各基因的质粒后目的基因可成功在宿主细胞中过表达,且表达量较高,其中,sec22b的表达量相对于本底提升的最多,bet1提高倍数较低是因为bet1本底表达水平高于其他两个基因(从ct值中看,同一模板中sec22b、bet1和stx5的ct值分别约为26、22和24)。
85.如图2所示,瞬时转染stx5,bet1,sec22b后,herceptin单克隆的活细胞密度较对照组pcdna3.1均有提升,在96h分别提升了77%,151%,158%。
86.如图3所示,瞬时表达stx5,bet1,sec22b后,相比对照组pcdna3.1,活率也均有10%左右的提升。
87.如图4所示,瞬时转染stx5,bet1,sec22b后,herceptin单克隆的产量在96h分别提升了65%,117%和150%。
88.由以上结果可知,瞬时转染stx5,bet1,sec22b均对herceptin单克隆的细胞生长有促进作用,并且活率提升,抗体产量也有提升。
89.4、tnfr-fc克隆中的瞬时转染结果如图5至图7所示。
90.如图5所示,瞬时转染stx5,bet1,sec22b后,tnfr-fc单克隆的活细胞密度较对照组pcdna3.1均有提升,在96h分别提升了13%,10%和28%。
91.如图6所示,瞬时转染stx5,bet1,sec22b后,tnfr-fc单克隆的活率略有提升,提升了2-7个百分点。
92.如图7所示,瞬时转染stx5,bet1,sec22b后,tnfr-fc单克隆的蛋白产量均有提升,分别提升了22%,35%和32%。
93.由以上结果可知,瞬时转染stx5,bet1,sec22b均对tnfr-fc单克隆的细胞生长有促进作用,抗体产量也有提升。
94.实施例3:稳定表达
95.本实施例检测稳定表达stx5,bet1,sec22b对herceptin单克隆的影响。
96.1、实验材料:
97.表达herceptin单抗的cho-k1单克隆,培养基:ex-cell advanced cho fed-batch medium(sigma);转染培养基:blancd transfectory cho(irvine)。实验前单克隆细胞已复苏后传代一周以上,接种密度0.3-0.5
×
106个/ml,每3天传代一次,于180rpm,5%co2细胞培养摇床中培养。
98.2、实验方法:
99.转染前一天将herceptin单克隆细胞传代至1.0
×
106个/ml,转染当天计数,用转染培养基blancd transfectory cho调整密度至2.0
×
106个/ml,在摇管中进行瞬时转染pcdna-sec22b,pcdna-bet1,pcdna-stx5,pcdna3.1和pcdna-egfp质粒,按照质粒9μg,pei:27μl(1mg/ml),进行转染。
100.转染48h后通过离心换液(200g,5分钟)的方式将细胞密度调整至0.5
×
106个/ml,培养基:ex-cell advanced cho fed-batch medium,并加入筛选试剂hygromycin(潮霉素),终浓度:1500μg/ml,每3-4天计数,通过离心换液以0.5
×
106个/ml传代,直至细胞活率恢复至90%以上。(注:筛选过程中,pcdna3.1空载的细胞未能在1500μg/ml恢复活率,全部死亡)
101.将sec22b,bet1,stx5,egfp筛选后的细胞池与未处理的herceptin单克隆一起以0.5
×
106个/ml的密度接种在无抗生素的培养基中进行补料批培养,第三天开始加入补料cell boost 7a liquid feed(hyclone)3%,cell boost 7b liquid feed(hyclone)0.3%,并检测葡萄糖浓度,低于4g/l则补充到8g/l。培养过程中计数和取样进行抗体产量检测(fortebio octet)。并取第11天的细胞样品提取rna,逆转录成cdna,再分别用sec22b,stx5,bet1的引物进行荧光定量pcr检测。
102.3、结果:
103.如图8所示,herceptin单克隆稳定表达stx5,bet1,sec22b的细胞池中,stx5,bet1,sec22b的表达量分别为未处理组(nc)的7.8,1.1,和3.5倍,细胞池中目的基因表达有提升。
104.如图9和图10所示,与未处理组(nc)的herceptin单克隆相比,herceptin单克隆稳定表达stx5,bet1,sec22b后活细胞密度略有提升,活率基本无变化。
105.如图11所示,与未处理组(nc)相比,herceptin单克隆稳定表达stx5,bet1,sec22b后抗体产量分别提升了10%,26%和44%。
106.由以上结果可知,稳定表达stx5,bet1,sec22b对herceptin单克隆的抗体产量有提升作用。
107.虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1