灰霉病胁迫条件下的韭菜内参基因及内参基因的引物和应用
1.本发明属于基因工程育种技术领域,特别是涉及灰霉病胁迫条件下的韭菜内参基因及内参基因的引物和应用。
背景技术:
2.韭菜是百合科葱属多年生宿根草本植物,食药同源,含有丰富的营养物质如胡萝卜素、蛋白质、多种维生素,钙、磷、铁等20多种微量元素,原产我国,在全国各地均有栽培。韭菜栽培中发病率高、分布广且较难解决的病害之一是由葡萄孢属真菌引起的灰霉病,该病原菌是一种兼性寄生菌,产生的分生孢子随风、水以及农事操作等进行传播,植株被侵染后易腐烂。
3.培育优质高抗灰霉病的种质资源是提高韭菜抗灰霉病害的主要途径,韭菜中存在高抗灰霉病的种质资源,但是韭菜具有特异的无融合生殖特性,杂交后代大多数与母本性状一致,通过传统杂交育种方法培育出优良高抗灰霉病的新品种比较困难。
技术实现要素:
4.为了解决上述问题,本发明提供了灰霉病胁迫条件下的韭菜内参基因及内参基因的引物和应用。本发明提供的内参基因的应用中,ubc1和ubc2基因具有极高的表达稳定性,为韭菜育种中的筛选抗灰霉病韭菜关键候选基因的表达奠定基础,还可以提高韭菜的商品性和食用性。
5.为了实现上述目的,本发明提供了如下技术方案:
6.本发明提供了灰霉病胁迫条件下的韭菜内参基因,所述内参基因包括ubc1和ubc2基因;所述ubc1的核苷酸序列如seq id no:1所示,ubc2的核苷酸序列如seq id no:2所示。
7.本发明还提供了一组韭菜内参基因ubc1和ubc2的扩增引物,所述扩增引物以上述的内参基因中ubc1和ubc2基因序列为基础,按照实时荧光定量pcr引物设计的原则,设计得到ubc1和ubc2的扩增引物。
8.优选的,所述ubc1的扩增引物的核苷酸序列如seq id no:3和seq id no:4所示;所述ubc2的扩增引物的核苷酸序列如seq id no:5和seq id no:6所示。
9.本发明还提供了上述内参基因或上述扩增引物在荧光定量pcr检测中的应用。
10.本发明还提供了上述内参基因或上述扩增引物在韭菜基因定量检测中的应用。
11.本发明还提供了上述内参基因或上述扩增引物在筛选韭菜中抗灰霉病的相关基因中的应用。
12.本发明还提供了上述内参基因或上述扩增引物在筛选葱鳞葡萄孢菌引起的灰霉病抗性韭菜品种中的应用。
13.本发明提供了灰霉病胁迫条件下的韭菜的内参基因ubc1和ubc2,所述ubc1的核苷酸序列如seq id no:1所示,ubc2的核苷酸序列如seq id no:2所示。本发明提供的内参基因中,ubc1和ubc2基因具有极高的表达稳定性,利用本发明提供的内参基因能够筛选现有
韭菜中的高抗灰霉病优异种质资源,开发利用对灰霉病菌有诱导抗性的关键调控因子,从源头预防灰霉病菌侵入宿主细胞内部,还能够通过生物诱导防治的手段阻止灰霉菌侵入韭菜细胞,减少灰霉病相关农药的使用,增强韭菜的食用性和商品性。
附图说明
14.图1为ef
‑
1α基因的熔解曲线;
15.图2为gapdh3基因的熔解曲线;
16.图3为gapdh4基因的熔解曲线;
17.图4为tub基因的熔解曲线;
18.图5为ubc1基因的熔解曲线;
19.图6为ubc2基因的熔解曲线;
20.图7为ubq1基因的熔解曲线;
21.图8为ubq2基因的熔解曲线;
22.图9为候选内参基因在葱鳞葡萄孢菌侵染韭菜不同时间的ct值分析;
23.图10为genorm软件分析结果。
具体实施方式
24.本发明提供了灰霉病胁迫条件下的韭菜内参基因,所述内参基因包括ubc1和ubc2基因,所述ubc1的核苷酸序列如seq id no:1所示,ubc2的核苷酸序列如seq id no:2所示。
25.本发明提供的内参基因ubc1和ubc2基因具有极高的表达稳定性,当韭菜感染灰霉病时,ubc1和ubc2基因不会受外源性或内源性因素的影响仍能保持稳定表达,为灰霉病菌胁迫条件下,韭菜基因的表达及分析提供了稳定的内参基因作为参考。ubc1和ubc2基因是在灰霉病菌
‑
葱鳞葡萄胞菌胁迫和正常条件下韭菜叶片中稳定表达的内参基因,可以通过荧光定量pcr技术采用相对定量的方法(2
-
△△
ct
法),测定韭菜抗灰霉病相关候选基因的表达量,根据候选基因在胁迫和正常条件下表达量的变化,进而筛选出韭菜中抗灰霉病(葱鳞葡萄孢菌引起的灰霉病)的相关基因。目标基因表达水平的相对定量是通过比较ct(cycle threshold)值的方法来进行分析,每个样品中目的基因的相对表达量为2
–
δδct
。此处δδct=(ct
目的基因
‑
ct
内参基因
)
time,x
‑
(ct
目的基因
‑
ct
内参基因
)
time,0
。
26.本发明还提供了一组韭菜内参基因ubc1和ubc2的扩增引物,所述扩增引物以上述的应用中的ubc1和ubc2基因序列为基础,按照实时荧光定量pcr引物设计的原则,设计得到ubc1和ubc2的扩增引物。在本发明中,所述ubc1的扩增引物的核苷酸序列优选如seq id no:3和seq id no:4所示;所述ubc2的扩增引物的核苷酸序列优选如seq id no:5和seq id no:6所示。本发明提供的扩增引物使以ubc1和ubc2基因为基础设计得到的,能够稳定扩增得到目标序列。
27.本发明还提供了上述内参基因或上述扩增引物在荧光定量pcr检测中的应用。
28.本发明还提供了上述内参基因或上述扩增引物在韭菜基因定量检测中的应用。
29.本发明还提供了上述内参基因或上述扩增引物在筛选韭菜中抗灰霉病的相关基因中的应用。
30.本发明还提供了上述内参基因或上述扩增引物在筛选葱鳞葡萄孢菌引起的灰霉
病抗性韭菜品种中的应用。ubc1和ubc2基因或者上述的扩增序列可以通过韭菜高抗葱鳞葡萄胞菌的标记基因(标记基因的表达量和葱鳞葡萄胞菌引起的灰霉病抗性成正比),根据标记基因的表达量的变化,筛选出高抗葱鳞葡萄胞菌引起的灰霉病韭菜品种。
31.为了进一步说明本发明,下面结合附图和实施例对本发明提供的一组韭菜内参基因及内参基因的引物和应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
32.实施例
33.1、实验准备
34.(1)实验材料准备
35.1)葱鳞葡萄孢菌的培养
36.配制新鲜的pda培养基,称取去皮马铃薯200g,蔗糖20g,琼脂粉20g,纯水1000ml。于高压灭菌锅中121℃灭菌20min,冷却后,在超净工作台中倒平板。用接种环挑取纯化的葱鳞葡萄孢菌菌丝至新pda培养基上进行划线,在20℃培养箱中培养3d待用。
37.2)韭菜叶片的接菌和培养
38.取实验田中取长势旺盛,健康无病害的抗灰霉病韭菜叶片,在超净工作台中用灭菌的ddh2o清洗2~3次,灭菌滤纸吸干多余的水分后,用剪刀剪成5cm左右长的韭菜叶段,用解剖针刺破韭菜叶片中间部位的表皮,形成伤口。
39.实验组:取直径为5mm的步骤1)提供的葱鳞葡萄孢菌菌饼,倒置接种于叶片伤口处;
40.对照组:韭菜叶片的伤口处接种的是直径为5mm的20℃培养3天的无菌pda培养基。
41.对照组和实验组的韭菜叶片分别处理20段,放置于铺有无菌水浸润的无菌滤纸的培养皿中,用无菌保鲜膜覆盖培养皿上方,于温度20℃,湿度95%,12h光照/12h黑暗的恒温箱中培养0h,24h,48h和72h后取样。实验组和对照组在各培养阶段取3个叶片,0h的对照组的样品记为ck0
‑
1,ck0
‑
2,ck0
‑
3;实验组24h的样品记为t24
‑
1,t24
‑
2,t24
‑
3,相应的对照组的样品记为ck24
‑
1,ck24
‑
2,ck24
‑
3;实验组48h的样品记为t48
‑
1,t48
‑
2,t48
‑
3,相应的对照组的样品记为ck48
‑
1,ck48
‑
2,ck48
‑
3;实验组72h的样品记为t72
‑
1,t72
‑
2,t72
‑
3,相应的对照组的样品记为ck72
‑
1,ck72
‑
2,ck72
‑
3;样品液氮速冻后
‑
80℃超低温冰箱保存备用。
42.(2)韭菜叶片总rna的提取和反转录
43.韭菜叶片样品总rna的提取采用的是天根生化科技(北京)有限公司的rnasimple总rna提取试剂盒(dp419),操作步骤按照试剂盒的标准步骤进行。韭菜rna样品经琼脂糖凝胶电泳检测合格后,用takara公司的primescripttm第一链cdna合成试剂盒(6110a)合成cdna,操作步骤参考说明书,将步骤(1)中不同组别合成的cdna(ck0
‑
1,ck0
‑
2,ck0
‑
3,t24
‑
1,t24
‑
2,t24
‑
3,ck24
‑
1,ck24
‑
2,ck24
‑
3,t48
‑
1,t48
‑
2,t48
‑
3,ck48
‑
2,ck48
‑
3,t72
‑
1,t72
‑
2,t72
‑
3,ck72
‑
1,ck72
‑
2和ck72
‑
3)置于
‑
20℃冰箱保存备用。
44.(3)候选内参基因的引物设计
45.参考植物常用内参基因,根据葱鳞葡萄孢菌诱导不同时间的韭菜叶片转录组测序注释结果和全长转录组测序序列信息,筛选韭菜β
‑
微管蛋白(tubulin,tub),泛素延伸蛋白(ubiquitin,ubq),多聚泛素酶基因(ubiquitin
‑
conjugatingenzyme,ubc),葡萄糖
‑3‑
磷酸脱氢酶(glyceraldehyde
‑3‑
phosphatedehy
‑
droge
‑
nase,gapdh)和转录延伸因子
(transcriptionelongationfactors,ef
‑1ɑ
)的同源序列。
46.其中gapdh3的核苷酸序列如序列表中seq id no:7所示,
47.gapdh4的核苷酸序列如序列表中seq id no:8所示;
48.其中ubq1的核苷酸序列如序列表中seq id no:9所示,
49.ubq2的核苷酸序列如序列表中seq id no:10所示;
50.其中tub的核苷酸序列如序列表中seq id no:11所示,
51.ef
‑
1α的核苷酸序列如序列表中seq id no:12所示。
52.设计相应的引物序列,引物序列信息见表1。
53.表1韭菜候选内参基因引物序列信息
[0054][0055][0056]
(4)内参基因的初步检测
[0057]
取步骤(2)提供的经过反转录获得的21份初始浓度的cdna(ck0
‑
1,ck0
‑
2,ck0
‑
3,t24
‑
1,t24
‑
2,t24
‑
3,ck24
‑
1,ck24
‑
2,ck24
‑
3,t48
‑
1,t48
‑
2,t48
‑
3,ck48
‑
2,ck48
‑
3,t72
‑
1,t72
‑
2,t72
‑
3,ck72
‑
1,ck72
‑
2和ck72
‑
3)混合得到样品m1,将m1的cdna稀释20倍,以m1经过稀释的cdna为模板,使用表1提供的引物,进行荧光定量pcr扩增。
[0058]
荧光定量pcr试剂盒采用的是赛默飞公司的selectmastermix(ref:4472908),20μl反应体系为:mastermix10μl,上下游引物(1pmol)各2μl,1μl cdna模板,5μlddh2o。荧光定量pcr扩增程序为:95℃预变性5min,95℃变性15s,60℃延伸30s,反应40个
循环,60℃采集荧光信号。熔解曲线程序:95℃,15s;65℃,1min;95℃,20s,隔20s步进0.2℃;30℃,1min。每个样品重复三次,根据熔解曲线导出待测定样品的循环阈值(cycle threshold,ct),判断每对引物的特异性,熔解曲线为单峰时可用于后续实验。反应在美国abi荧光定量pcr仪viia
tm 7型号的实时荧光定量pcr系统(applied biosystems)上进行,数据分析采用quant studio
tm
real
‑
time pcr软件。
[0059]
(5)标准曲线构建及引物扩增效率分析
[0060]
取步骤(4)得到的m1的cdna进行稀释,依次稀释5倍得到m1稀释5倍,25倍,125倍和625倍的cdna样品;以经过梯度稀释的m1的cdna为模板进行荧光定量pcr,引物为表1中提供的引物。利用excel软件分析cdna模板质量浓度(对数值)和ct值的线性关系,获得相关系数(r2)和斜率(s),利用公式e=(5
‑
1/s
‑
1)
×
100%计算引物的扩增效率。
[0061]
(6)内参基因表达稳定性分析
[0062]
实验组的韭菜叶片和相应时间点的对照组的韭菜叶片的cdna分别稀释20倍,利用筛选出的熔解曲线为单峰的候选内参基因引物对进行荧光定量pcr扩增,反应体系的配制和扩增程序同上。扩增结果利用genorm、normfinder和bestkeeper软件分析候选内参基因的表达稳定性。genorm根据表达稳定度(m值)大小对候选内参基因进行排序,m值越小表示基因表达越稳定;根据标准化因子的配对差异分析(v
n/n+1
)判定最佳的内参基因数组,v
n/n+1
<0.15代表该条件下内参基因最佳数目为n个。normfinder软件可以根据内参基因的表达稳定性筛选出最优内参基因;bestkeeper软件根据不同候选内参基因在不同条件下的ct值,通过比较每个基因之间产生配对的相关系数(r)、标准偏差(sd)、变异系数(cv)以及p值的大小,判定内参基因的稳定性。当sd>1或者p>0.05时,判定该基因不适合作为内参基因;相关系数越大,标准偏差和变异系数越小,内参基因稳定性越好。
[0063]
2、试验及结论
[0064]
(1)引物特异性和扩增效率
[0065]
将实施例的步骤(2)得到的21份初始浓度的cdna(ck0
‑
1,ck0
‑
2,ck0
‑
3,t24
‑
1,t24
‑
2,t24
‑
3,ck24
‑
1,ck24
‑
2,ck24
‑
3,t48
‑
1,t48
‑
2,t48
‑
3,ck48
‑
2,ck48
‑
3,t72
‑
1,t72
‑
2,t72
‑
3,ck72
‑
1,ck72
‑
2和ck72
‑
3)混合得到样品m1,将m1的cdna稀释20倍,利用表1中的8个候选内参基因分别以稀释的混合cdna为模板进行荧光定量pcr扩增验证引物的特异性,结果见图1~图8,其中图1为ef
‑
1α基因的熔解曲线,图2为gapdh3基因的熔解曲线,图3为gapdh4基因的熔解曲线,图4为tub基因的熔解曲线,图5为ubc1基因的熔解曲线,图6为ubc2基因的熔解曲线,图7为ubq1基因的熔解曲线,图8为ubq2基因的熔解曲线。结果显示8对引物的熔解曲线均为单峰,表明表1中提供的引物具有特异性。
[0066]
将上述稀释20倍的混合cdna按照5的倍数进行稀释,分别得到稀释5倍,25倍,125倍和625倍的cdna样品,以得到的梯度稀释的1倍、5倍、25倍、125倍和625倍的cdna样品为模板,利用表1提供的引物进行荧光定量pcr扩增,扩增效率见表2。
[0067]
表2韭菜候选内参基因荧光定量pcr扩增效率分析
[0068]
[0069][0070]
由表2可知,本发明提供的扩增引物的扩增效率为101.12%~113.00%,r2为0.9912
‑
0.9971,结果表明cdna的质量浓度和ct值之间存在明确的线性关系,引物扩增效率符合荧光定量要求。
[0071]
(2)内参基因的表达水平分析
[0072]
将实验组的韭菜叶片0h,24h,48h和72h及相应时间的对照组的韭菜叶片的cdna分别稀释20倍后进行荧光定量pcr扩增,结果见图9和表3。图9为候选内参基因在葱鳞葡萄孢菌侵染韭菜不同时间的ct值分析,其中方框内的横线表示平均值。
[0073]
表3候选内参基因在葱鳞葡萄孢菌侵染韭菜不同时间的ct值
[0074][0075][0076]
由图9和表3可知,候选内参基因的ct值为24.07~31.99,不同候选内参基因的ct值存在差异,其中ubc2、ubq2和gapdh4的平均ct值较小,为25左右;ubq1的平均ct值最大,为
31.498;gapdh3的平均ct值为26.95;ef
‑
1α、tub和ubc1的平均ct值为28左右。不同候选内参基因ct值存在差异,说明候选内参基因的表达水平不同,其中ubc2、ubq2和gapdh4的表达水平最高。
[0077]
(3)内参基因表达稳定性分析
[0078]
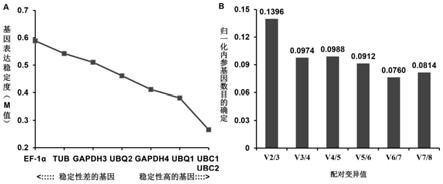
1)genorm软件计算基因的表达稳定性(m值),一般情况下,m值小于1.5的基因被认为是表达相对稳定的基因,m值越小,基因表达越稳定。对实施例提供的8个候选内参基因进行测定,测定结果如图10和表10、表11所示。其中图10中的a为候选内参基因表达稳定性分析,图10中的b是归一化内参基因数目的确定。
[0079]
表10基因表达稳定度(m值)
[0080][0081]
表11是归一化内参基因的配对差异分析
[0082][0083]
由图10中的a和表10可以看出,在葱鳞葡萄孢菌侵染韭菜的不同时间段内,8个候选内参基因的m值均小于1.5,ubc1和ubc2基因的表达最稳定,其后的稳定性是ubq1>gapdh4>ubq2>gapdh3>tub>ef
‑
1α。
[0084]
由图10中的b和表11可知,根据(vn/n+1)判定最佳的内参基因数目,由图10中的b可知,在葱鳞葡萄孢菌侵染韭菜的不同时间段内,vn/n+1均小于0.15,表明韭菜中表达最稳定的内参基因数目有2个。
[0085]
2)normfinder软件通过比较样本的组内和组间变异来评估基因的稳定值,该软件分析结果如表12所示。
[0086]
表12normfinder软件分析葱鳞葡萄孢菌诱导下韭菜内参基因的表达稳定性
[0087][0088]
由表12可知,最稳定的基因为ubq1,其次是ubc2和ubc1。
[0089]
3)bestkeeper软件根据不同候选内参基因在不同条件下的ct值,通过比较每个基因之间产生配对的相关系数(r)、标准偏差(sd)、变异系数(cv)以及p值的大小,判定内参基
因的稳定性。当sd>1或者p>0.05时,判定该基因不适合作为内参基因;相关系数越大,标准偏差和变异系数越小,内参基因稳定性越好。
[0090]
表13bestkeeper软件分析候选内参基因的表达稳定性
[0091][0092]
由表13可以看出8个候选内参基因的sd值均小于1,但是gapdh3,ef
‑
1α,ubq2和tub的p值大于0.05,因此这四个基因在本实验条件下不适合作为内参基因,其余的4个基因ubq1,ubc1,ubc2和gapdh4的p<0.05,且这四个基因的相关系数均较大,具有相对较高的稳定性。
[0093]
综合三个软件的分析结果发现,ubq1,ubc1,ubc2和gapdh4四个基因的表达稳定性排名有差异,genorm软件分析表达最稳定性的基因有两个ubc1和ubc2,其次是ubq1和gapdh4,normfinder软件分析表达最稳定的基因为ubq1,其次是ubc2,ubc1,gapdh4。bestkeeper软件分析显示ubq1,ubc1,ubc2和gapdh4均具有较高的稳定性,但是ubq1的ct值相对其他3个基因偏高,gapdh4的标准偏差(sd)和变异系数(cv)相对其他3个基因偏大,因此ubc1和ubc2是在灰霉菌
‑
葱鳞葡萄孢菌侵染条件下韭菜叶片中稳定表达的内参基因。
[0094]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1