一种矿化防龋材料及其制备方法
本公开涉及材料技术领域,更具体地,涉及一种用于口腔牙体的矿化防龋材料及其制备方法。
背景技术:
龋病是人类口腔的常见病和多发病,导致牙体形态缺损和功能障碍,严重危害人类口腔及全身健康。龋病的有效防治具有重要意义。牙本质是高度矿化的牙体硬组织,主要由无机矿物、有机基质和水组成。而在有机基质中,i型胶原纤维占比约90%,剩余10%主要是非胶原蛋白(non-collagenousproteins,ncps)。当龋坏进展到牙本质层时,会引起牙本质的脱矿和i型胶原纤维的暴露。传统的治疗技术主要通过手术器械去除龋坏组织,并使用树脂等修复材料充填龋洞,对健康牙体组织有一定的侵入性。随着微创牙科理念的提出和推广,利用仿生再矿化技术促进脱矿牙本质胶原再矿化,逆转龋坏进程,恢复牙本质结构、形态和功能,成为龋病防治的新方向。
技术实现要素:
针对现有技术中存在的不足,本发明的目的之一在于解决上述现有技术中存在的一个或多个问题。例如,本发明的目的之一在于提供一种能够在口腔微环境中,保护胶原免受mmps侵袭、维持胶原结构完整和稳定的矿化防龋材料及其制备方法
本公开的一方面提供了一种矿化防龋材料,所述矿化防龋材料包括聚酰胺-胺,所述聚酰胺-胺表面的部分官能团上接枝有可特异性结合胶原分子的多肽片段。
根据本公开的实施例,所述聚酰胺-胺表面的官能团中的至多一半官能团上可接枝有所述多肽片段,所述多肽片段可对称性地接枝到所述聚酰胺-胺表面的官能团上,所述聚酰胺-胺表面的官能团上可接枝有4、16或64条所述多肽片段,每个所述多肽片段接枝在一个官能团上。
根据本公开的实施例,所述聚酰胺-胺表面的官能团可以为氨基、羧基、羟基、磷酸基和阿伦磷酸基中的一种或多种。
根据本公开的实施例,所述多肽片段可以包括牙本质基质蛋白-1中的dsesseedr和/或seenrdsdsqdssr序列,骨唾液蛋白中的ngvfkyrpryflykhayfypplkrfpvq序列,以及纤维黏连蛋白中的cqdsetrtfy序列中的一种或多种。
根据本公开的实施例,所述聚酰胺胺内部的疏水空腔可装载有基质金属蛋白酶抑制剂,所述基质金属蛋白酶抑制剂包括氯己定、季铵盐、加拉定和四环素类药物中的一种或多种。
根据本公开的另一方面,提供了一种制备如上所述的矿化防龋材料的方法,所述方法包括:合成可特异性结合胶原分子的多肽片段;合成聚酰胺-胺,并在所述聚酰胺胺表面的部分官能团上接枝所述多肽片段;以及将基质金属蛋白酶抑制剂载入所述聚酰胺胺内部的疏水空腔。
根据本公开的实施例,可采用迈克尔加成法合成表面带128个氨基官能团的聚酰胺-胺,通过点击反应将聚酰胺-胺表面的部分氨基官能团对称性丙烯酰氯酰化,然后利用丁二酸酐对聚酰胺-胺表面的其余氨基基团进行羧基改性;在所述多肽片段末端连接半胱氨酸,然后利用巯基-迈克尔加成反应将所述多肽片段接枝到聚酰胺胺表面的经酰化处理的氨基官能团上,得到表面接枝有多肽片段的聚酰胺胺;采用有机溶剂法、水溶法和共溶法中的任意一种方法,将表面接枝有多肽片段的聚酰胺-胺与基质金属蛋白酶抑制剂混合,通过超声和震荡的方式,制备得到表面接枝有多肽片段且内部疏水空腔中载入有基质金属蛋白酶抑制剂的聚酰胺胺。
根据本公开的实施例,所述方法还可包括:检测所述表面接枝有多肽片段的聚酰胺-胺交联胶原的能力,并通过分析所述检测步骤的结果,筛选和优化所述表面接枝有多肽片段的聚酰胺胺,其中,所述检测步骤具体包括:观察所述表面接枝有多肽片段的聚酰胺-胺与胶原纤维的结合位点,并检测所述表面接枝有多肽片段的聚酰胺胺与胶原分子的结合力;测定不同ph和ca2+浓度下所述表面接枝有多肽片段的聚酰胺胺对胶原原纤维生成时间及胶原分子间结合力的影响;观察交联前后胶原二级结构的变化;检测交联前后胶原水凝胶的机械性能和抗酶解性能的变化。
根据本公开的实施例,所述方法还可包括:检测所述表面接枝有多肽片段且内部疏水空腔中载入有基质金属蛋白酶抑制剂的聚酰胺-胺,并通过分析所述检测步骤的结果,筛选和优化所述表面接枝有多肽片段且内部疏水空腔中载入有基质金属蛋白酶抑制剂的聚酰胺胺,其中,所述检测步骤具体可包括:检测该系统的物理、生物性能;定性检测基质金属蛋白酶抑制剂的载入情况,定量检测基质金属蛋白酶抑制剂的载入量;检测不同缓冲体系、不同ph条件下基质金属蛋白酶抑制剂的缓释效能;评价所述表面接枝有多肽片段且内部疏水空腔中载入有基质金属蛋白酶抑制剂的聚酰胺胺抑制基质金属蛋白酶活性的能力。
与现有技术相比,本公开能够获得在mmps环境中同步稳定胶原结构和诱导胶原仿生再矿化的新型矿化防龋材料。
附图说明
附图示出了发明构思的示例性实施例,并与说明一起用于解释发明构思的原理,附图被包括以提供对发明构思的进一步的理解,并且附图并入该说明书中并组成该说明书的一部分。
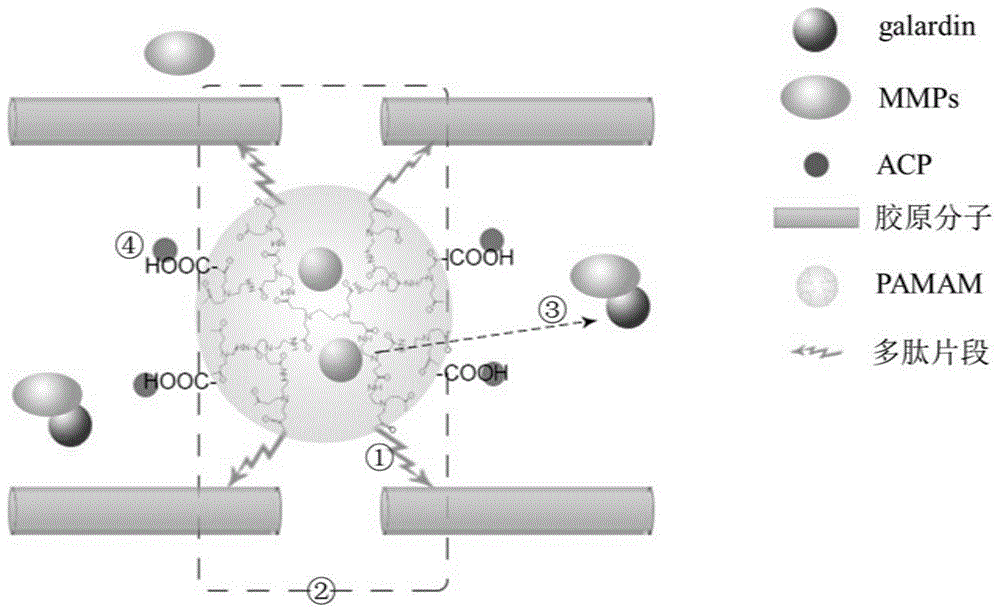
图1示出了根据本公开示例性实施例的矿化防龋材料的示意图。
图2示出了接枝有4条多肽片段的seenrdsdsqdssrc-pamam(sp)的nmr。
图3示出了接枝有4条多肽片段的seenrdsdsqdssrc-pamam(sp)的圆二色谱。
图4示出了接枝有4条多肽片段的seenrdsdsqdssrc-pamam的高效液相色谱(highperformanceliquidchromatography,hplc)图谱。
图5示出了接枝有4条多肽片段的seenrdsdsqdssrc-pamam的羟脯氨酸实验结果。图上的sp代表seenrdsdsqdssrc-pamam。
具体实施方式
申请人以树枝状大分子聚酰胺-胺(polyamidoamine,pamam)为矿化模板,成功诱导了i型胶原和脱矿牙本质胶原纤维内和纤维间的矿物晶体再生。实现了体外环境中的胶原仿生再矿化。但是,仿生再矿化的临床应用尚需进一步考虑人体体内复杂环境带来的影响。其中,口腔内大量存在的基质金属蛋白酶(matrixmetalloproteinases,mmps)对胶原结构完整性的破坏就不利于仿生再矿化的临床开展。在正常生理状态下,mmps处于未激活状态。但在龋病等病理条件下,反复的低ph刺激会激活mmps。此外,进食酸性食物、饮料以及牙本质粘接等也都可能激活mmps。活化的mmps能够酶解暴露的胶原纤维,破坏胶原结构完整性,甚至引起胶原纤维的崩解。而在牙本质的天然结构中,有机胶原基质是无机矿物生长的基础支架,起机械支撑和成核模板等作用,其结构一旦被破坏,仿生再矿化的诱导也将随之失去结构基础。胶原基质结构的完整和稳定,是有效诱导仿生再矿化的前提条件。
在胶原酶存在的人工唾液环境中,如果胶原结构被酶解破坏,则脱矿牙本质的再矿化修复效果显著下降。因此,如何在口腔微环境中,保护胶原免受mmps侵袭、维持胶原结构完整和稳定,成为了仿生再矿化技术临床应用亟待解决的关键问题。但遗憾的是,现有仿生再矿化研究未考虑到口腔内的mmps环境,对于矿化诱导前胶原结构完整性的保护也关注较少。
基于胶原仿生再矿化研究面临的问题,获得能够在mmps环境中同步稳定胶原结构和诱导胶原仿生再矿化的新型矿化防龋材料,对于推动仿生再矿化技术的临床应用具有重大意义。
为了解决人体口腔微环境中胶原支架结构易被酶解破坏、不利于仿生再矿化诱导的关键问题,申请人提出在pamam仿生再矿化研究的基础上,对pamam进行外部官能团和内部空腔的双重修饰,在保留pamam仿生再矿化能力的前提下,赋予其交联胶原纤维和抑制mmps的功能,从而实现在含有mmps的环境中对胶原仿生再矿化的有效诱导。
根据本公开的示例性实施例的矿化防龋材料包括聚酰胺-胺(pamam),聚酰胺-胺表面的官能团上接枝有可特异性结合胶原分子的多肽片段。
其中,pamam树枝状大分子由核心分子、内部空腔、分枝结构和表面官能团组成,具有单分散性、结构明确、生物相容性优异等特点。由于pamam的分子尺寸和结构与多种生物蛋白类似,并且具有类蛋白质自组装作用,能够模拟天然蛋白质的功能,pamam被赋予了“人工蛋白”的美誉。此外,pamam是良好的药物载体,其内部的疏水空腔可以作为难溶性小分子药物的储存库,能够通过静电作用与药物结合,实现药物的装载与缓释,提高药物的溶解性、稳定性并延长药物作用时间。
申请人前期研究发现,氨基为表面官能团的pamam(pamam-nh2)能够稳定并诱导acp沉积于胶原纤维内和纤维间;羧基改性的pamam(pamam-cooh)在人工唾液中能够自组装为纳米球-球链-微带的多级结构,促进胶原纤维内矿物再生;羟基改性的pamam(pamam-oh)能够进入牙本质小管深层,诱导矿物晶体封闭牙本质小管;磷酸基改性的pamam(pamam-po3h2)能够在脱矿牙本质表面诱导具有一定厚度的再矿化层。
首先,申请人利用pamam模拟ncps的有机成核和矿化调控功能,在体外环境中实现了脱矿牙本质和i型胶原的仿生再矿化(图1)。但是同其他矿化材料一样,pamam并不具备稳定胶原结构的能力,且尚未在mmps环境中实现胶原结构的保护和仿生再矿化的诱导。因此,如何在不影响pamam仿生再矿化能力的前提下,赋予其胶原保护功能,成为了重要的科学问题。
pamam大分子的易修饰性为解决上述科学问题提供了可能性。一方面,可以根据不同需求对pamam表面官能团进行相应的改性。例如,通过羧基、羟基、磷酸基改性调节再矿化速率;通过阿伦磷酸基改性增强牙釉质吸附能力;在表面官能团接枝有机多肽片段,获取多肽的功能。另一方面,能够利用pamam分子内部空腔装载和缓释药物,实现pamam与所载药物的多功能复合。例如,利用pamam装载并缓释抗菌药物三氯生,在促进脱矿牙釉质再矿化的同时,抑制致龋菌的生长。因此,本申请通过对pamam外部官能团和内部空腔进行修饰,在分子水平上设计基于pamam分子的、能够同时稳定胶原结构和诱导仿生再矿化的新型矿化防龋材料。于是,寻找可以用于修饰pamam的胶原保护材料成为了解决前述科学问题的突破口。
在胶原基质的天然发育过程中,胶原分子会发生交联反应,形成胶原原纤维,胶原原纤维进一步聚集形成更粗更长的胶原纤维。这种胶原分子相互交联的现象极大增强了胶原基质的结构稳定性。因此,常规稳定胶原结构的方法是利用蛋白交联剂促进胶原纤维交联。例如,用表没食子儿茶素没食子酸(epigallocatechin-3-gallate,egcg)预处理脱矿牙本质胶原,有效增强了脱矿牙本质的机械性能和抗酶解性能。使用原花青素交联牙本质胶原纤维,显著提高了牙本质胶原的结构稳定性。其它研究较多的蛋白交联剂或方法还包括戊二醛、聚羧酸和紫外光照射等。这些蛋白交联剂均能在一定程度上稳定胶原结构,但遗憾的是它们并不适合用于修饰pamam。
除了被人们熟知的矿化诱导和调控功能,牙本质非胶原蛋白(non-collagenousproteins,ncps)还是胶原纤维的非共价交联剂(non-covalentcross-linkers),能够通过与胶原分子的牢固结合,富集于胶原纤维周围,发挥“桥梁”作用,将胶原分子连接在一起,促进胶原分子内和分子间的交联。研究发现,一旦胶原纤维上的ncps被蛋白酶去除,胶原纤维网的结构完整性和稳定性就会随之受到破坏。ncps与胶原分子的强大结合力,是其发挥非共价交联作用的基础,主要得益于ncps中特异性结合胶原的氨基酸序列。例如,牙本质基质蛋白-1(dentinmatrixprotein-1,dmp-1)c末端的两个氨基酸序列dsesseedr和seenrdsdsqdssr被认为是dmp-1结合胶原分子的主要序列。骨唾液蛋白(bonesialoprotein,bsp)中第19-46序列的氨基酸的结构和构象,与其特异性吸附胶原相关。纤维黏连蛋白(fibronectin,fn)是通过其结构中的cqdsetrtfy序列与胶原分子紧密结合的。这些特异性吸附胶原的多肽片段在与胶原纤维结合后,也表现出类似完整ncps的非共价交联作用,具体表现为胶原分子自组装加快,胶原原纤维生成时间缩短,胶原纤维直径增粗,胶原二级结构中的折叠和螺旋增多等。本申请将这些特异性结合胶原的多肽序列修饰在具有类蛋白结构的pamam表面,通过结合前者特异性胶原吸附和后者高密度支化位点的优势,获得能够同步特异性结合多个胶原分子、促进胶原交联的多肽改性pamam(peptide-pamam)。
其中,保留pamam表面半数以上的官能团,以保存其吸引钙磷离子的能力。pamam表面的官能团中的至多一半官能团上接枝有多肽片段,多肽片段对称性地接枝到聚酰胺胺表面的官能团上。
例如,在实施例中,聚酰胺胺表面的官能团上接枝有4、16或64条上述多肽片段,每个多肽片段分别接枝在一个官能团上。
另外,由于mmps是导致胶原结构破坏的重要原因,根据本公开的实施例,应用mmps抑制剂降低mmps的活性,减少mmps对胶原纤维的降解,稳定胶原结构。mmps抑制剂可以包括氯己定(chlorhexidine,chx)、季铵盐、四环素类药物、加拉定(galardin)等。其中,加拉定(galardin)近年来研究较多的一种特异性mmps抑制剂,能够选择性抑制mmp-2、-3、-8和-9。galardin具有很强的mmps抑制能力,在较低浓度就能有效抑制mmps。在牙科领域,将galardin加入粘接剂的处理液中,有效降低了粘接界面胶原纤维的降解。但galardin难溶于水,不利于临床应用。此外,由于galardin与mmps的结合力不强,galardin持续抑制mmps的作用尚不理想。而本申请采用的pamam是难溶性小分子药物的优良载体,能通过对药物的装载与缓释,提高药物的溶解性并延长药物作用时间。因此,通过利用pamam分子内部疏水空腔装载并缓释galardin,可以持续抑制mmps的活性,从而降低mmps对胶原纤维的降解。
也就是说,在实施例中,通过在pamam表面对称性接枝多条非胶原蛋白中特异性结合胶原的peptide片段,并利用pamam内部的疏水空腔装载galardin,构建peptide-pamam-galardin系统。在mmps环境中,该系统可通过peptide特异性结合多个胶原分子,促进胶原交联,同时缓释galardin,持续抑制mmps活性,并利用pamam表面羧基基团吸附钙磷沉积于胶原支架,诱导胶原仿生再矿化。但本公开不限于此,基质金属蛋白酶抑制剂可以包括氯己定、季铵盐、加拉定和四环素类药物中的一种或多种。多肽(peptide)片段可以包括dmp-1中的dsesseedr和/或seenrdsdsqdssr序列,骨唾液蛋白中的ngvfkyrpryflykhayfypplkrfpvq序列,以及纤维黏连蛋白中的cqdsetrtfy序列中的一种或多种。pamam表面的官能团经由氨基、羧基、羟基、磷酸基和阿伦磷酸基中的一种或多种改性。
图1示出了根据本公开示例性实施例的矿化防龋材料的示意图。如图1中所示,①peptide-pamam-galardin系统通过特异性吸附胶原的多肽序列与胶原分子牢固结合,富集于胶原周围;②发挥“桥梁”作用,连接多个胶原分子,促进胶原交联;③缓释galardin,持续抑制mmps活性;④表面羧基基团吸引acp在胶原支架内沉积,实现胶原纤维的仿生再矿化。
根据本公开的另一方面,提供一种制备如上所述的矿化防龋材料的方法,包括:
s1、合成可特异性结合胶原分子的多肽片段。
首先,确定并合成ncps中特异性结合胶原的多肽序列(氨基酸序列),并且检测多肽片段的结构稳定性和结合胶原能力,筛选优化多肽片段。多肽(peptide)片段可以包括dmp-1中的dsesseedr和/或seenrdsdsqdssr序列,骨唾液蛋(bsp)白中的ngvfkyrpryflykhayfypplkrfpvq序列,以及纤维黏连蛋白(fn)中的cqdsetrtfy序列中的一种或多种。固相合成这些多肽片段,并通过体外胶原吸附实验筛选出二级结构稳定、与胶原分子结合能力强的多肽序列。
s2、合成末端为羧基的树枝状聚酰胺-胺(pamam-cooh),并在聚酰胺-胺表面的部分官能团上接枝步骤s1合成的多肽片段。
具体地,合成pamam-cooh,保留pamam表面半数以上的羧基基团,保存其吸引钙磷离子的能力;然后在pamam表面对称性接枝多条特异性结合胶原的多肽片段,合成peptide-pamam,使其能够同步特异性结合多个胶原分子,促进胶原交联。多肽片段的接枝数量可以为4、16、64条,合成peptide-pamam(表面接枝有多肽片段的聚酰胺胺),详细表征其结构,并检测其物理性能和生物相容性。
例如,在实施例中,采用迈克尔加成法或经典发散法合成表面带128个氨基官能团的聚酰胺-胺(pamam-nh2),通过点击反应将聚酰胺-胺表面的部分氨基官能团对称性丙烯酰氯酰化,然后利用丁二酸酐对聚酰胺-胺表面的其余氨基基团进行羧基改性;在多肽片段末端连接半胱氨酸(c)。合成过程如如以下合成路线(1)所示:
然后,利用巯基-迈克尔加成反应(thiol-michaelreaction)将多肽片段接枝到聚酰胺-胺表面的经酰化处理的氨基官能团上,得到表面接枝有多肽片段的聚酰胺-胺。如以下合成路线(2)所示,合成接枝有4条多肽片段的seenrdsdsqdssrc-pamam。
通过羟脯氨酸检测法,初步验证了seenrdsdsqdssrc-pamam稳定胶原结构的能力,图2示出了接枝有4条多肽片段的seenrdsdsqdssrc-pamam(sp)的nmr,图3示出了接枝有4条多肽片段的seenrdsdsqdssrc-pamam(sp)的圆二色谱。图4示出了接枝有4条多肽片段的seenrdsdsqdssrc-pamam的高效液相色谱(highperformanceliquidchromatography,hplc)图谱。图5示出了接枝有4条多肽片段的seenrdsdsqdssrc-pamam的羟脯氨酸实验结果。其中,不同的字母a和b代表差异具有统计学差异(p<0.05)。
从图5中可以看出,sp处理胶原纤维后,mmps降解胶原产生的羟脯氨酸量明显少于对照组。
优选地,还可以检测表面接枝有多肽片段的聚酰胺-胺交联胶原纤维的能力。检测步骤具体可以包括:
a、观察所述表面接枝有多肽片段的聚酰胺-胺与胶原纤维的结合位点,并检测表面接枝有多肽片段的聚酰胺胺与胶原分子的结合力。具体地,分别对peptide-pamam进行荧光染色和磷酸锌量子点标记,然后与i型胶原纤维溶液共培养,利用激光共聚焦显微镜(confocallaserscanningmicroscopy,clsm)和透射电镜(transmissionelectronmicroscopy,tem)观察peptide-pamam与胶原纤维的结合位点;利用qcm-d检测peptide-pamam吸附i型胶原的量;使用afm和sfa测定peptide-pamam与胶原分子的结合力。
b、测定不同ph和ca2+浓度下所述表面接枝有多肽片段的聚酰胺-胺对胶原原纤维生成时间及胶原分子间结合力的影响。具体地,配制含有不同ca2+浓度(0.1mm/1mm/10mm)的i型胶原纤维溶液,调整其ph为4、7、10,将peptide-pamam与上述胶原溶液进行共培养;使用分光光度计检测胶原溶液的浊度变化,测定胶原原纤维的滞留周期和生长周期,计算胶原原纤维的生成时间;使用afm、sfa检测胶原分子间的结合力。
c、观察交联前后胶原二级结构的变化;检测交联前后胶原水凝胶的机械性能和抗酶解性能的变化。具体地,用不同浓度的peptide-pamam溶液处理单层重组i型胶原纤维,利用afm、tem观察交联前后胶原直径的变化;使用圆二色谱(circulardichroismspectra,cd)检测交联前后胶原二级结构的变化;使用流变仪检测交联前后胶原水凝胶的储存模量和损耗模量的变化,评价peptide-pamam增强胶原机械性能的能力;用mmps溶液浸泡交联前后的单层重组胶原水凝胶,分别于5分钟、6小时和3天后,利用羟脯氨酸检测法测定溶液中羟脯氨酸的浓度,评价peptide-pamam增强胶原抗酶解的能力。
通过综合分析上述检测步骤的结果,筛选和优化peptide-pamam。
s3、将基质金属蛋白酶抑制剂载入所述聚酰胺-胺内部的疏水空腔。
采用有机溶剂法、水溶法和共溶法中的任意一种方法,将peptide-pamam与基质金属蛋白酶抑制剂(例如,galardin)混合,通过超声和震荡的方式,制备得到表面接枝有多肽片段且内部疏水空腔中载入有基质金属蛋白酶抑制剂的聚酰胺-胺(peptide-pamam-galardin)。
该方法还可以包括:检测表面接枝有多肽片段且内部疏水空腔中载入有基质金属蛋白酶抑制剂的聚酰胺-胺,并通过分析检测步骤的结果,筛选和优化所述表面接枝有多肽片段且内部疏水空腔中载入有基质金属蛋白酶抑制剂的聚酰胺-胺。其中,检测步骤具体可以包括:检测该系统的物理、生物性能;定性检测基质金属蛋白酶抑制剂的载入情况,定量检测基质金属蛋白酶抑制剂的载入量;检测不同缓冲体系、不同ph条件下galardin的缓释效能;评价表面接枝有多肽片段且内部疏水空腔中载入有基质金属蛋白酶抑制剂的聚酰胺胺抑制基质金属蛋白酶活性的能力。
例如,使用飞行时间质谱、hplc、nmr、ftir等对该系统进行表征;通过细胞毒性实验,检测该系统对口腔黏膜、牙周、牙髓等细胞的毒性;利用nmr、ftir定性检测galardin载入情况;使用hplc定量测定galardin载入量。
配制含有不同钙磷离子浓度的人工唾液,调整其ph为4、7、10,将peptide-pamam-galardin系统放置于透析袋中,利用hplc在连续多个时间点定量检测galardin浓度,绘制药物释放曲线,评价其缓释功效。
配制含有钙、锌离子的mmps激活溶液,将peptide-pamam-galardin系统加入其中,使用mmps活性测定试剂盒在连续多个时间点检测mmps的活性;综合分析前述实验结果,筛选优化peptide-pamam-galardin系统。
3)配制含有不同钙磷离子浓度的人工唾液,调整其ph为4、7、10,将peptide-pamam-galardin系统放置于透析袋中,利用hplc在连续多个时间点定量检测galardin浓度,绘制药物释放曲线,评价其缓释功效。
此外,还可以对peptide-pamam-galardin系统在含有mmps的环境中诱导i型胶原仿生再矿化进行研究,具体可以包括:
(1)配制含有基质金属蛋白酶的人工唾液,并用聚丙烯酸稳定人工唾液中的钙磷离子;在透射电镜(transmissionelectronmicroscopy,tem)镍网上制备单层重组i型胶原模型,用表面接枝有多肽片段且内部疏水空腔中载入有基质金属蛋白酶抑制剂的聚酰胺-胺处理tem镍网后,将tem镍网浸泡入配制好的人工唾液中,放置1、3、7、14、28天;通过羟脯氨酸检测法测定人工唾液中羟脯氨酸的浓度;利用原子力显微镜(atomicforcemicroscopy,afm)、tem观察胶原纤维的直径和结构,利用圆二色谱(circulardichroismspectra,cd)检测胶原纤维的二级结构。
(2)同步骤(1),在tem镍网浸泡入含有mmps的人工唾液1、3、7、14、28天后,使用扫描电镜、tem观察再生矿物晶体的数量、尺寸、结构、形态和排列方式;使用能量分散光谱(energydispersivespectroscopy,eds)和选区电子衍射(selectedareaelectrondiffraction,saed)对再生晶体进行物相分析;使用流变仪检测胶原纤维的储存模量和损耗模量;综合分析上述实验结果,评价表面接枝有多肽片段且内部疏水空腔中载入有基质金属蛋白酶抑制剂的聚酰胺-胺(例如,peptide-pamam-galardin)在含有mmps的环境中保护胶原结构的能力和诱导i型胶原仿生再矿化的功效。
根据本公开,通过研究发现ncps稳定胶原结构的能力主要得益于其对胶原分子的非共价交联作用,这与其特异性结合胶原的多肽序列密切相关。因此,申请人将这些特异性结合胶原的多肽片段对称性接枝到具有类蛋白结构的pamam表面,通过结合前者特异性胶原吸附和后者高密度支化位点的优势,获得可以同步特异性结合多个胶原分子、促进胶原纤维交联的peptide-pamam、其次,pamam是优良的药物载体,其载药对象主要是难溶性小分子;而具有明确mmps抑制作用的galardin恰好是这类药物。因此,利用pamam装载并缓释galardin,可以持续抑制mmps的活性。
本公开创新性提出将ncps中特异性结合胶原的多肽序列修饰到具有类蛋白结构的pamam表面,结合前者特异性胶原吸附和后者高密度支化位点的优势,在保留pamam仿生再矿化能力的前提下,赋予pamam交联胶原分子的功能,是仿生再矿化研究领域的思路创新。
本公开设计并构建具备吸附、交联胶原纤维,抑制mmps活性和诱导钙磷离子在胶原支架内沉积一体化功能的peptide-pamam-galardin系统,从根本上解决现有仿生再矿化材料临床应用所面临的胶原支架结构易被酶解破坏的关键问题,是龋病微创治疗领域的技术和材料创新。
本公开在传统体外人工唾液中加入mmps,模拟人体口腔mmps环境,并在此环境中尝试诱导胶原仿生再矿化,是矿化诱导的实验方法创新。
虽然已经在这里描述了特定示例性实施例和实施方式,但是其它的实施例和修改将通过该描述而明显。因此,发明构思不限于这样的示例性实施例,而是限于所提出的权利要求以及各种明显修改和等同设置的更宽范围。
- 还没有人留言评论。精彩留言会获得点赞!