一种检测EBV中C启动子甲基化水平的试剂盒及方法
一种检测ebv中c启动子甲基化水平的试剂盒及方法
技术领域
1.本发明属于生物技术领域。更具体地,涉及一种检测ebv中c启动子甲基化水平的试剂盒及方法。
背景技术:
2.dna甲基化可以调控特定基因的表达,异常的dna甲基化会导致发育异常、肿瘤等疾病的发生。因此,研究dna甲基化对于深入理解基因表达、个体发育以及疾病的发生、发展机制等具有重要意义。
3.甲基化测序(bisμlfite sequencing pcr,bsp)可以实现高通量单碱基分辨率检测dna甲基化,但dna样本的投入量需要达到μg级别,测序价格在几千到上万元/例,不适合大规模推广应用。甲基化pcr针对特定序列设计特异性引物实现dna甲基化的检测,样本的投入量只需ng级别,而且灵敏度高,价格便宜,只需几十到上百元/例,因而具有广泛的应用前景。甲基化pcr主要包含3个技术,甲基化特异性pcr(msp)、甲基化荧光检测(methylight)和甲基化敏感性高分辨率熔解(ms
‑
hrm)。
4.其中,msp使用一对甲基化特异性引物和一对未甲基化特异性引物来扩增经过亚硫酸氢盐处理过的dna样品,并通过观测dna凝胶电泳的条带强弱来判断甲基化水平,属于一种半定量终点分析技术。msp从非甲基化模板背景中检测甲基化模板的敏感性大大提高,但其引物设计难度大。ms
‑
hrm仅需要设计一对甲基化不敏感的pcr引物,pcr扩增后进行熔解曲线分析,属于一种终点定性分析技术。ms
‑
hrm引物设计难度较小,但是其对荧光pcr仪的要求较高,无法用于实时定量实验。
5.鼻咽癌(nasopharyngeal carcinoma,npc)是起源于鼻咽上皮细胞的恶性肿瘤,目前尚无有效的一级预防措施,临床分期是决定npc治疗效果的最重要因素。一般来说,早期鼻咽癌患者的临床症状常常是不典型的,如咳嗽、鼻塞和涕中带血;但当患者出现显著症状才首次就诊时,70%~80%的患者就已经处于中晚期阶段了。鼻咽癌的发病机制目前尚未完全清楚,但是多种研究资料表明ebv的感染与鼻咽癌的发生、发展关系密切。因此,通过检测eb病毒(epstein
‑
barr virus,ebv)及其相关标志物来主动筛查,实现早发现、早治疗,仍然是鼻咽癌防控最有效的手段。
6.ebv是一种dna双链病毒,主要传播途径为唾液。ebv的感染有潜伏感染和裂解感染两种形式。人群一般多在年幼时感染ebv,并以潜伏感染的形式持续存在于b淋巴细胞内。在一定环境压力下,当机体出现内稳态持续紊乱、免疫力下降时,ebv基因的调控状态发生改变,处于潜伏期的ebv可再被激活,病毒处于裂解状态,表达大量裂解期蛋白和病毒颗粒,导致血液中可检测到相关抗体和病毒颗粒。病毒的大量复制导致鼻咽部病毒拷贝数大量增加,使鼻咽上皮细胞易受到病毒的感染,进而促进上皮细胞的增殖及发生癌变。因此,在体循环和鼻咽部脱落细胞中检测ebv相关标志物可用于鼻咽癌的早期诊断。
7.目前,ebv相关标志物的甲基化pcr检测以定性、半定量居多,尚未有既可定性又可定量的基因甲基化检测方法和产品。中国专利cn 112094908a公开了一种用于鼻咽癌诊断
的多基因甲基化检测试剂盒,其通过检测p16基因异常甲基化水平来诊断鼻咽癌,但该方法的灵敏度不高,也不能定性检测基因的甲基化。
技术实现要素:
8.本发明要解决的技术问题是克服现有上述技术的缺陷和不足,提供一种检测ebv中c启动子甲基化水平的试剂盒及方法。
9.本发明的目的是提供一种检测ebv中c启动子甲基化水平的试剂盒。
10.本发明另一目的是提供一种检测ebv中c启动子甲基化水平的方法。
11.本发明上述目的通过以下技术方案实现:
12.本发明选取ebv中c启动子甲基化水平作为鼻咽癌的早期诊断标志物。具体选取了ebv基因组c启动子的v01555.2:11000
‑
11299序列进行引物设计,并制备了相应的阳性质控品和标准品,所选取的序列如下(seq id no.1)所示:tggaacagtagaaaattgaaccttgttggncgggagaaggaataancgccttatctgggaggagncgancggattatagccaataagagagctcaagancgcagggctncgcaaagtatagtggcccncgtgggaccttagaggtggagcaancgtctaaagtggtaataacaccaggncggggctgggcaaaggggtcctancgggncgggattaattancgccttgcttancgcaagctcagttaattncgcccancgacttgaaaaatgtagcccttaaccaattggncggcccctaagggggggactaaggt
13.其中,ncg表示cpg岛可能发生甲基化修饰的胞嘧啶c的位置,该序列的cg含量高,存在cpg岛,而cpg岛是基因启动子的重要标志之一。
14.在此序列的基础上,本发明提供了下列引物、阳性质控品和质粒标准品。
15.本发明首先提供了一对预扩增引物pref和prer,其序列依次如seq id no.2~seq id no.3所示。
16.本发明还提供了一对甲基化引物mf和mr,其序列依次如seq id no.4~seq id no.5所示。
17.本发明还提供了一对未甲基化引物uf和ur,其序列依次如seq id no.6~seq id no.7所示。
18.本发明还提供了甲基化阳性质控品qc
‑
m和未甲基化阳性质控品qc
‑
u,其为通过人工合成的序列,序列依次如seq id no.8~seq id no.9所示。其中,mcg表示人工合成的甲基化阳性质控品qc
‑
m的cg位点上胞嘧啶c带有一个甲基(
‑
ch3),未甲基化阳性质控品qc
‑
u所有的胞嘧啶c都不带有甲基(
‑
ch3)。
19.本发明还提供了甲基化定量质粒标准品std
‑
m和未甲基化定量质粒标准品std
‑
u。其中,甲基化定量质粒标准品是在甲基化的seq id no.1所示序列的基础上,经亚硫酸盐转化为相应的序列m
‑
seq,再连接至克隆载体所得,m
‑
seq的序列如seq id no.10所示;未甲基化定量质粒标准品是在未甲基化的seq id no.1所示序列的基础上,经亚硫酸盐转化后相应的序列u
‑
seq,再连接至克隆载体所得,其序列如seq id no.11所示。
20.因此,本发明申请保护上述序列、引物、质控品和质粒标准品在制备鼻咽癌检测试剂/试剂盒中的应用。
21.优选地,所述克隆载体为puc57
‑
amp载体,见实施例1。
22.优选地,甲基化定量质粒标准品std
‑
m和未甲基化定量质粒标准品std
‑
u的使用浓度为2
×
10^1~2
×
10^5copies/μl,见实施例1。
23.本发明还提供了一种ebv中c启动子甲基化水平的检测试剂盒,其包含预扩增引物pref和prer、甲基化引物mf和mr、未甲基化引物uf和ur、甲基化阳性质控品qc
‑
m、未甲基化阳性质控品qc
‑
u、甲基化定量质粒标准品std
‑
m和未甲基化定量质粒标准品std
‑
u。
24.优选地,所述试剂盒还含有pcr和荧光定量pcr反应所需试剂。
25.本发明还申请保护所述试剂盒在制备鼻咽癌检测/诊断产品中的应用。
26.本发明还提供一种检测ebv中c启动子甲基化水平的方法,其包括以下步骤:
27.s1.提取待测生物样本中的基因组dna;
28.s2.对步骤s1所得基因组dna中的ebv dna浓度进行定量,并进行亚硫酸氢盐转化;
29.s3.使用预扩增引物pref和prer对转化后的ebv dna进行预扩增,并使用预扩增引物pref和prer对预扩增产物进行内参定性实验;
30.s4.使用甲基化引物mf和mr对预扩增产物进行甲基化定量,使用未甲基化引物uf和ur对预扩增产物进行未甲基化定量;
31.s5.计算甲基化率,甲基化率计算公式为甲基化拷贝数/(甲基化拷贝数+未甲基化拷贝数)
×
100%。
32.步骤s3中进行预扩增的目的在于提高模板浓度以及提高pcr的灵敏度,但预扩增在扩大浓度的同时,不能破坏甲基化和未甲基化的平衡,因此,需要特殊设计引物,而本发明所述预扩增引物可以实现上述目的。
33.优选地,所述生物样本包括活组织检查样品、细胞培养物、全血、血浆、血清、唾液、鼻咽脱落细胞、脑髓液、尿液、粪便、腹膜液和分泌液。
34.优选地,步骤s2中,进行亚硫酸氢盐转化时,ebv dna的投入量至少为50个拷贝,见实施例4。
35.优选地,步骤s2中,进行亚硫酸氢盐转化时,需设立甲基化阳性对照和未甲基化阳性对照;所述甲基化阳性对照为甲基化阳性质控品qc
‑
m,未甲基化阳性对照为未甲基化阳性质控品qc
‑
u,见实施例3。
36.优选地,步骤s3中,进行预扩增时,需设立pcr阳性对照,所述阳性对照为甲基化定量质粒标准品std
‑
m和未甲基化定量质粒标准品std
‑
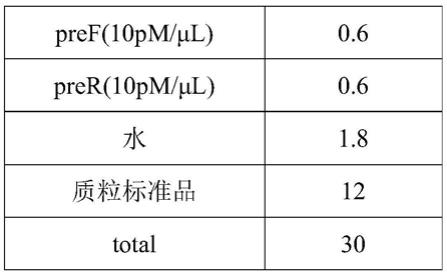
u的混合物;进行内参定性实验时,需分别设立std
‑
m和std
‑
u阳性对照,见实施例3。
37.优选地,步骤s4中,进行甲基化定量时,需设立5个梯度的std
‑
m;进行未甲基化定量时,也需设立5个梯度的std
‑
u,浓度梯度为2
×
10^1~2
×
10^5copies/μl,见实施例3。
38.优选地,上述pcr反应均需设立阴性对照,所述阴性对照为无菌水,见实施例2~3。
39.本发明还申请保护所述方法在制备鼻咽癌检测/诊断产品中的应用。
40.本发明具有以下有益效果:
41.本发明以ebv中c启动子的甲基化水平作为鼻咽癌的早期诊断标志物,并在ebv基因组c启动子的v01555.2:11000
‑
11299序列的基础上,提供了一种用于检测ebv中c启动子甲基化水平的试剂盒和方法。本发明结合msp和ms
‑
hrm技术,开发了一种能进行实时荧光定量和定性检测的甲基化pcr(qmsp
‑
hrm)方法,用染料法代替凝胶电泳来改进pcr产物的显示方式,并引入甲基化定量阳性对照质粒及未甲基化定量阳性对照质粒,以此克服了msp只能半定量而无法实时定量的局限。此外,该方法加入了ms
‑
hrm,可与定量结果互相验证,提高了检测结果的可信度,相较于bsp而言,qmsp
‑
hrm方法具有操作简单,成本低,样本投入量
小,检测灵敏度高的特点,该方法既可以定量定性检测ebv c启动子的甲基化,也可定量定性其他基因的甲基化。
附图说明
42.图1为选取的ebv基因组c启动子序列在methprimercpg岛预测工具中的cpg岛预测图。
43.图2为内参定性实验中甲基化标准品std
‑
m和未甲基化标准品std
‑
u的扩增曲线、熔解峰图;其中a为甲基化标准品std
‑
m和未甲基化标准品std
‑
u的预扩增引物的扩增曲线;b为甲基化标准品std
‑
m和未甲基化标准品std
‑
u的熔解峰图。
44.图3为内参定性实验中,质粒标准品的扩增曲线、预扩增产物熔解峰和熔解曲线分析图;其中a为甲基化标准品std
‑
m的扩增曲线;b为预扩增产物的熔解峰;c为熔解曲线分析脚本github/pyhrm的分析图。
45.图4为本发明的技术方案流程图。
46.图5为内参定性实验中,阳性对照和标本预扩增产物的扩增曲线、熔解峰、熔解曲线分析图;其中a为阳性对照和标本预扩增产物的扩增曲线;b为标本预扩增产物的熔解峰;c为熔解曲线经开源的脚本(github/pyhrm)定性分析。
47.图6为甲基化定量实验中,甲基化标准品std
‑
m的扩增曲线、标准曲线和熔解峰图;其中a为甲基化定量标准品的扩增曲线;b为甲基化定量标准品的标准曲线;c为甲基化定量标准品的熔解峰。
48.图7为未甲基化定量实验中,未甲基化标准品std
‑
u的扩增曲线、标准曲线和熔解峰图;其中a为未甲基化定量标准品的扩增曲线;b为未甲基化定量标准品的标准曲线;c为未甲基化定量标准品的熔解峰。
49.图8为甲基化探针捕获测序技术的测序比对结果。
具体实施方式
50.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
51.除非特别说明,以下实施例所用试剂和材料均为市购。
52.实施例1检测相关引物、质控品及定量标准品的制备
53.本发明以ebv中c启动子的甲基化水平作为鼻咽癌的早期诊断标志物,选取了ebv基因组c启动子的v01555.2:11000
‑
11299序列进行引物设计,并制备了相应的阳性质控品和标准品,c启动子的v01555.2:11000
‑
11299序列如下(seq id no.1)所示:
54.tggaacagtagaaaattgaaccttgttggncgggagaaggaataancgccttatctgggaggagncgancggattatagccaataagagagctcaagancgcagggctncgcaaagtatagtggcccncgtgggaccttagaggtggagcaancgtctaaagtggtaataacaccaggncggggctgggcaaaggggtcctancgggncgggattaattancgccttgcttancgcaagctcagttaattncgcccancgacttgaaaaatgtagcccttaaccaattggncggcccctaagggggggactaaggt
55.序列中的ncg表示cpg岛可能发生甲基化修饰的胞嘧啶c的位置。选取的ebv基因组
c启动子序列在methprimercpg岛预测工具中的cpg岛预测图如图1所示,由图可知,该序列的cg含量高,存在cpg岛,而cpg岛是基因启动子的重要标志之一。
56.在此序列的基础上,设计并合成引物、质控品和质粒标准品所需序列,所需序列交由生工生物工程(上海)股份有限公司进行合成。
57.预扩增引物pref和prer的序列如下(seq id no.2~3)所示:
58.pref:tggaatagtagaaaattgaatt
59.prer:ttactccacctctaaaa
60.甲基化引物mf和mr的序列如下(seq id no.4~5)所示:
61.mf:gttttatttgggaggagcgac
62.mr:ctccacctctaaaatcccacg
63.未甲基化引物uf和ur的序列如下(seq id no.6~7)所示:
64.uf:tgttttatttgggaggagtgat
65.ur:actccacctctaaaatcccaca
66.本发明通过人工合成的方式获得甲基化阳性质控品qc
‑
m和未甲基化阳性质控品qc
‑
u。
67.甲基化阳性质控品qc
‑
m的序列如下(seq id no.8)所示:ctttggaacagtagaaaattgaaccttgttggmcgggagaaggaataamcgccttatctgggaggagmcgamcggattatagccaataagagagctcaagamcgcagggctmcgcaaagtatagtggcccmcgtgggaccttagaggtggagcaac
68.未甲基化阳性质控品qc
‑
u的序列如下(seq id no.9)所示:ctttggaacagtagaaaattgaaccttgttggcgggagaaggaataacgccttatctgggaggagcgacggattatagccaataagagagctcaagacgcagggctcgcaaagtatagtggccccgtgggaccttagaggtggagcaac
69.其中,mcg表示人工合成的甲基化阳性质控品qc
‑
m的cg位点上胞嘧啶c带有一个甲基(
‑
ch3),未甲基化阳性质控品qc
‑
u所有的胞嘧啶c都不带有甲基(
‑
ch3)。
70.甲基化定量质粒标准品std
‑
m和未甲基化定量质粒标准品std
‑
u的制备过程如下:
71.首先,在甲基化的c启动子的v01555.2:11000
‑
11299序列的基础上,经亚硫酸盐转化为相应的序列m
‑
seq,其序列如下(seq id no.10)所示:tggaatagtagaaaattgaattttgttggcgggagaaggaataacgttttatttgggaggagcgacggattatagttaataagagagtttaagacgtagggttcgtaaagtatagtggtttcgtgggattttagaggtggagtaacgtttaaagtggtaataatattaggcggggttgggtaaaggggttttacgggcgggattaattacgttttgtttacgtaagtttagttaattcgtttacgatttgaaaaatgtagtttttaattaattggcggtttttaagggggggattaaggt
72.在未甲基化的c启动子的v01555.2:11000
‑
11299序列的基础上,经亚硫酸盐转化后相应的序列u
‑
seq,其序列如下(seq id no.11)所示:tggaatagtagaaaattgaattttgttggtgggagaaggaataatgttttatttgggaggagtgatggattatagttaataagagagtttaagatgtagggtttgtaaagtatagtggttttgtgggattttagaggtggagtaatgtttaaagtggtaataatattaggtggggttgggtaaaggggttttatgggtgggattaattatgttttgtttatgtaagtttagttaatttgtttatgatttgaaaaatgtagtttttaattaattggtggtttttaagggggggattaaggt
73.将上述m
‑
seq和u
‑
seq两种序列分别克隆至puc57
‑
amp载体,并转染到大肠杆菌。挑菌进行sanger测序,经鉴定序列无误后进行摇菌培养并分别抽提质粒,所得质粒即为质粒标准品std
‑
m和std
‑
u。
74.使用thermo公司的nanodrop 2000紫外分光光度计分别对质粒标准品std
‑
m和std
‑
u的浓度进行测定,此时的单位为ng/μl,通过dna浓度换算公式将其换算为copies/μl。
75.质粒标准品std
‑
m和std
‑
u分别以10倍梯度稀释后,制作成甲基化和未甲基化定量标准品,浓度梯度依次为2
×
10^1,2
×
10^2,2
×
10^3,2
×
10^4,2
×
10^5copies/μl。在预扩增引物pref和prer的扩增下,甲基化标准品std
‑
m和未甲基化标准品std
‑
u的扩增曲线、熔解峰如图2所示,未出现非特异扩增,表明所制备的质粒标准品可用于ebv中c启动子甲基化水平的定量检测。
76.实施例2预扩增引物的效果检测
77.为验证所设计的预扩增引物pref和prer是否能达到扩大浓度的效果,以及是否存在pcr扩增偏好,是否会破坏甲基化和未甲基化的拷贝数平衡,进行了如下预实验:
78.首先使用预扩增引物pref和prer对已知拷贝数的质粒标准品进行预扩增,其中m1
‑
m3为质粒标准品std
‑
m,u1
‑
u3为质粒标准品std
‑
u,其余样本为质粒标准品std
‑
m和std
‑
u的混合物,拷贝数为500copies,再对预扩增产物进行内参定性分析。
79.预扩增所使用的试剂为全式金生物公司的2x pcr supermix(as401),反应体系如下所示:
[0080][0081][0082]
在普通pcr仪上,设置预扩增pcr程序,如下所示:
[0083][0084]
进行预扩增pcr实验时,同时设立一个pcr阴性对照(无菌水)。
[0085]
预扩增结束后,使用预扩增引物对预扩增产物进行内参定性实验,使用的试剂为天根生化科技有限公司的荧光pcr premix(fp210),反应体系如下所示:
[0086]
内参定性体系体积μlpremix10pref(10pm/μl)0.6prer(10pm/μl)0.6水3.8预扩增产物5total20
[0087]
在bio
‑
rad cfx96荧光pcr仪上,设置pcr反应程序,如下所示:
[0088][0089][0090]
内参定性结果如图3所示,图a为甲基化标准品std
‑
m的扩增曲线,表明pcr稳定扩增,浓度符合梯度稀释规律。b为预扩增产物的熔解峰,样品m1~m3、99%m的熔解曲线为76.2
±
0.2℃的单峰,u1~u3、1%m的熔解曲线为74
±
0.2℃的单峰,其余样本在74
±
0.2℃/76.2
±
0.2℃上有双峰,表明熔解峰单一稳定。图c为熔解曲线分析脚本github/pyhrm的分析图,从上到下,分别是100%甲基化(std
‑
m)到100%未甲基化(std
‑
u),结果表明熔解曲线对称平滑,该对引物无扩增偏好或者偏好极小。
[0091]
预扩增引物pref和prer的测试结果如表1所示。预扩增引物能有效扩增甲基化和未甲基化模板,pcr平均扩增效率接近,证明该对引物无扩增偏好或者偏好极小,对甲基化和未甲基化的拷贝数平衡不会造成影响。
[0092]
表1预扩增引物测试结果
[0093][0094][0095]
在上述预扩增引物pref和prer、甲基化引物mf和mr、未甲基化引物uf和ur、甲基化阳性质控品qc
‑
m、未甲基化阳性质控品qc
‑
u、甲基化定量质粒标准品std
‑
m和未甲基化定量质粒标准品std
‑
u,以及实验结果的基础上,本发明还提供了一种检测ebv中c启动子甲基化水平的方法,技术方案流程图如图4所示。
[0096]
实施例3
[0097]
本发明从中山大学肿瘤医院鼻咽科招募了4例中晚期鼻咽癌患者,从四会鼻咽癌早筛研究队列中招募了8例ebv阳性对照和4例鼻咽癌早期患者,采集鼻咽脱落细胞,检测ebv中c启动子甲基化水平。参加本研究的个体已获得本次研究的知情同意书。
[0098]
使用qiagen公司的qiaamp dna blood mini kit(51106)从鼻咽脱落细胞中提取总dna,实验流程完全按照试剂盒说明书进行,最终dna溶解于100μl的te溶液。
[0099]
取5μl dna溶液,使用tib molbiol公司的kit for the detection of epstein
‑
barr virus(40
‑
0186
‑
32)对ebv的dna浓度进行定量,实验流程完全按照试剂盒说明书进行,得到标本的ebv dna浓度,浓度为2
×
10^0~2
×
10^5copies/μl。
[0100]
使用zymo research公司的ez dna methylation
‑
gold
tm kit(d5005)对dna进行亚硫酸氢盐转化。总dna投入量小于2ug,ebv dna投入量至少为50拷贝,实验流程完全按照试剂盒说明书进行,最终转化后的dna溶解于14μl te溶液。
[0101]
在使用ez dna methylation
‑
gold
tm kit进行亚硫酸氢盐转化实验时,同时设立一个阴性对照(无菌水),一个甲基化阳性对照(qc
‑
m,5ng),一个未甲基化阳性对照(qc
‑
u,5ng),与标本dna一同处理。使用预扩增引物对转化后的ebv dna进行预扩增,所使用的2x pcr supermix(as401)购自全式金生物公司,反应体系如下:
[0102]
预扩增pcr体系体积μl2
×
pcr supermix15pref(10pm/μl)0.6prer(10pm/μl)0.6水1.8经亚硫酸氢盐修饰后dna12total30
[0103]
在普通pcr仪上,设置预扩增pcr程序,如下:
[0104][0105]
进行预扩增pcr实验时,设立一个pcr阴性对照(无菌水),一个pcr阳性对照(分别加入10copies的std
‑
m和std
‑
u)。
[0106]
使用预扩增引物对预扩增产物进行内参定性实验,所使用试剂为荧光pcr premix(fp210),购自天根生化科技有限公司,反应体系如下:
[0107][0108][0109]
在bio
‑
rad cfx96荧光pcr仪上,设置内参定性pcr程序,如下:
[0110][0111]
进行内参定性实验时,同时设立4个pcr阴性对照(无菌水),2个pcr阳性对照,分别是std
‑
m和std
‑
u,各5μl。
[0112]
在biorad分析软件(cfx manager version:3.1)上分析实验结果,结果如图5所示。其中图a为阳性对照和标本预扩增产物的扩增曲线,标本预扩增产物出现与阳性对照一致的扩增曲线,阴性对照无扩增,表明所检测标本存在甲基化。图b为标本预扩增产物的熔解峰,甲基化标准品std
‑
m的熔解峰在76.2
±
0.2℃,未甲基化标准品std
‑
u的熔解峰在74
±
0.2℃。图c为熔解曲线经开源的脚本github/pyhrm定性分析,高甲基化的熔解曲线靠近100%m+,低甲基化的熔解曲线靠近100%u+,16例病例中1例对照呈高甲基化,与npc一同处于靠近100%m+位置,其余对照与npc有较明显区分。
[0113]
使用甲基化引物对预扩增产物进行甲基化定量,所使用的试剂为购自天根公司的荧光pcr premix(fp210),反应体系如下:
[0114]
甲基化定量体系体积μlpremix10mf(10pm/μl)0.6mr(10pm/μl)0.6水3.8预扩增产物5total20
[0115]
甲基化定量pcr程序如下:
[0116][0117]
进行甲基化定量实验时,同时设立4个pcr阴性对照(无菌水),5个梯度的甲基化定量标准品std
‑
m,浓度梯度分别为2
×
10^1,2
×
10^2,2
×
10^3,2
×
10^4,2
×
10^5copies/μl,各5μl。
[0118]
在biorad分析软件(cfx manager version:3.1)上分析实验结果,结果如图6所示。其中图a为甲基化定量标准品的扩增曲线,甲基化定量标准品和标本预扩增产物有明显的s型扩增曲线,阴性对照无扩增;在软件上输入甲基化定量标准品的浓度,即可获得标准曲线和预扩增产物浓度,图b为甲基化定量标准品的标准曲线,单位为copies/μl,由此可计算标本的甲基化拷贝数。图c为甲基化定量标准品的熔解峰,甲基化标准品std
‑
m的熔解峰在74.6
±
0.2℃。
[0119]
使用未甲基化引物对对预扩增产物进行未甲基化定量,所使用的试剂为购自天根公司的荧光pcr premix(fp210),反应体系如下:
[0120]
未甲基化定量体系体积μlpremix10uf(10pm/μl)0.6ur(10pm/μl)0.6水3.8预扩增产物5total20
[0121]
未甲基化定量pcr程序如下:
[0122][0123]
进行未甲基化定量实验时,同时设立4个pcr阴性对照(无菌水),5个梯度的未甲基化的定量标准品std
‑
m,浓度梯度分别为2
×
10^1,2
×
10^2,2
×
10^3,2
×
10^4,2
×
10^5copies/μl,各5μl。
[0124]
在biorad分析软件(cfx manager version:3.1)上分析实验结果,结果如图7所示。其中图a为未甲基化定量标准品的扩增曲线,未甲基化定量标准品和预扩增产物有明显的s型扩增曲线,且阴性对照无扩增。图b为未甲基化定量标准品的标准曲线,由此可计算标本的未甲基化拷贝数。图c为未甲基化定量标准品的熔解峰,未甲基化标准品std
‑
u的熔解峰在72.6
±
0.2℃。
[0125]
计算ebv c启动子的甲基化率(percent methylation,%m)。计算公式为:%m=甲基化拷贝数/(甲基化拷贝数+未甲基化拷贝数)
×
100%,即%m=(mcopies/μl)/(m copies/μl+u copies/μl)
×
100%。
[0126]
本次研究的总样本量为16例,鼻咽癌ebv c启动子甲基化定量和定性的汇总结果如表2所示。其中qmsp定量结果和ms
‑
hrm定性的结果高度一致,以甲基化率%m=64%为诊断截断值,诊断的灵敏度达到100%,特异度为87.5%,阳性预测值为88.9%。
[0127]
表2 ebv c启动子甲基化定量和定性的汇总结果
[0128]
[0129][0130]
实施例4
[0131]
为测试本方案qmsp的最高灵敏度,参照实施例3的实验过程,额外补充了灵敏度实验,结果如表3所示。qmsp%m的值表示:目标序列甲基化的数量占所有目标序列(甲基化和未甲基化的数量)的比值。检测结果的意义:0%表示只检测出未甲基化一种序列;100%表示只检测甲基化一种序列;检测失败表示既没有检测出甲基化序列,也没有检测出未甲基化序列。结果显示,ebv dna投入量在30copies左右,将导致检测失败。因此,本方案ebv dna的投入量至少为50copies。
[0132]
表3灵敏度实验
[0133][0134]
实施例5
[0135]
此外,本发明还通过甲基化探针捕获测序技术检测了4例鼻咽癌患者中ebv c启动子的甲基化率,甲基化探针捕获测序委托杭州联川生物公司进行,以验证qmsp
‑
hrm技术的准确性,测序分析结果如图8所示,测序结果如表4所示:
[0136]
表4鼻咽癌患者中ebv c启动子甲基化率的甲基化探针捕获测序结果
[0137][0138][0139]
甲基化测序结果发现,npc在ebv c启动子区呈高度甲基化,与qmsp
‑
hrm结果一致,
表明本发明对鼻咽癌诊断具有潜在应用价值。
[0140]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1