一种抗CIB单链抗体及其筛选方法和应用
一种抗cib单链抗体及其筛选方法和应用
技术领域
1.本发明属于生物工程技术领域,具体涉及一种抗cib单链抗体及其筛选方 法和应用。
背景技术:
2.目前,检测西布特罗残留的方法主要集中于液相色谱
‑
质谱联用 (liquidchromatography
‑
massspectrometry,lc
‑
ms)、气相色谱
‑
质谱联用 (gaschromatography
‑
massspectrometry,gc
‑
ms)、毛细管电泳 (capillaryelectrophoresis,ce)等方法。以上方法均为仪器确证法,检测的精度 和准确度十分可靠,但由于以上方法均存在仪器贵、操作繁锁、需专业人员等 问题,难以满足日常化快速检测的要求。基于抗原抗体特异性识别反应的免疫 化学筛选法则可以满足日常化快速检测的要求,该方法的核心是必须获得稳定、 特异、灵敏的抗体。目前关于西布特罗抗体鲜有报道,因此开发cib抗体对构 建和完善我国药物残留检测体系具有重要意义。
3.
技术实现要素:
4.针对现有技术中的上述不足,本发明提供一种抗cib单链抗体及其筛选方 法和应用,开发得到的抗cib单链抗体具有优异的特异性和灵敏度,能够用于 cib的免疫学检测的构建。
5.为实现上述目的,本发明解决其技术问题所采用的技术方案是:
6.一种抗cib单链抗体,该单链抗体的氨基酸序列如seq id no.1所示。
7.进一步地,单链抗体的轻链可变区和重链可变区通过连接多肽连接。
8.进一步地,连接多肽的基因为编码3组重复gly4ser的核苷酸序列。
9.一种编码上述抗cib单链抗体的基因,该基因的核苷酸序列如seq id no.2 所示。
10.一种表达载体,包括上述核苷酸。
11.一种cib抑制剂,包括上述抗cib单链抗体。
12.一种噬菌体,该噬菌体可表达上述基因。
13.上述抗cib单链抗体在cib免疫学检测中的应用。
14.一种用于进行cib免疫学检测的试剂盒,包括上述抗cib单链抗体。
15.一种筛选上述抗cib单链抗体的方法,包括以下步骤:
16.(1)构建cib完全抗原;
17.(2)提取经cib完全抗原免疫后的样本rna,然后pcr扩增分别得到轻 链可变区基因和重链可变区基因,再用连接片段连接;
18.(3)将步骤(2)所得基因克隆至载体中,然后转化至大肠杆菌内,经噬 菌体拯救后获得cib噬菌体单链抗体库,然后通过制备得到的完全抗原筛选得 到该抗cib单链抗体。
19.进一步地,步骤(3)筛选过程中使用含有过量载体蛋白的tbs作为cib 噬菌体单链
抗体库的稀释液。
20.进一步地,步骤(3)中所用载体为噬菌粒载体pcantab5e,其在单链抗 体与piii蛋白之间存在琥珀型止子tag。
21.本发明的有益效果:
22.1、本发明利用抗体基因工程技术和噬菌体展示技术构建cib鼠源免疫噬菌 体单链抗体库,从中筛选出cib的scfv,为后期建立cib的免疫学快速检测方 法提供理论依据和物质基础。
23.2、转化效率对抗体库库容有着重要的影响。目前,化学转化法和电穿孔转 化法是常用的两种方法。但是前者的转化效率通常较低,故常采用后一种转化 法保证转化效率。因此,本发明采用电穿孔法将重组载体转化至大肠杆菌tg1。 同时,为了保证感受态的高活性,在本发明中转化前提前制备感受态并保证制 备完成后能够立即用于转化,最大程度的保证转化的高效率。
24.3、本发明在后续的筛选过程中用含有过量载体蛋白的tbs作为抗体库的稀 释液,目的是减少与载体蛋白的特异性识别与吸附及对筛选的干扰。
附图说明
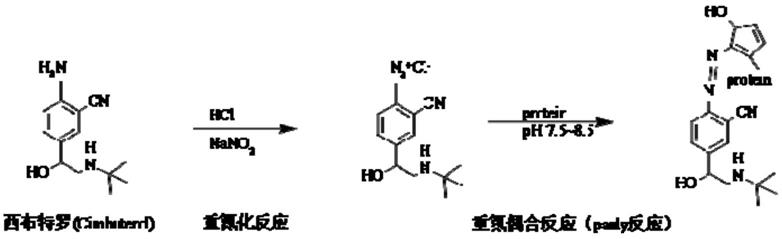
25.图1为cib
‑
bsa10%sds
‑
page电泳鉴定图;其中,m,蛋白质分子量标 准品(11
‑
180kda);1,bsa载体蛋白;2,cib
‑
bsa偶联产物;
26.图2为cib
‑
ova 10%sds
‑
page电泳鉴定图;其中,m:蛋白质分子量标 准品(11
‑
180kda);1,ova载体蛋白;2,cib
‑
ova偶联产物;
27.图3为cib完全抗原紫外扫描鉴定图;其中,a:cib
‑
bsa偶联产物紫外 扫描;b:cib
‑
ova偶联产物紫外扫描;
28.图4为完全抗原免疫效果评价;其中,a:效价测定;b:2号小鼠竞争抑 制曲线;
29.图5为小鼠脾脏rna提取电泳图;
30.图6为vh、vl和scfv基因扩增图;其中,a:m,dl2000 dna marker; 1,vh基因扩增产物;2,vl基因扩增产物;b:m,dl2000;1,scfv基因 扩增产物;
31.图7为pcantab
‑
5e载体双酶切鉴定图;其中,m:dl5000 dna marker; 1:pcantab
‑
5e载体双酶切;2:pcantab
‑
5e载体;
32.图8为转化菌液过夜培养;
33.图9为菌液pcr鉴定结果;其中,m,dl2000 marker;1
‑
22,挑取菌落pcr 扩增结果;
34.图10为第四轮淘选菌落pcr结果;其中,m,dl2000 dnamarker;1
‑
11, 挑选的单菌落pcr扩增;
35.图11为阳性噬菌体克隆elsia测定结果;
36.图12为高亲和力重组噬菌粒双酶切结果;其中,m,dl2000 plus marker; 1,重组载体;
37.图13为cib
‑
scfv的免疫印迹分析结果;其中,m,蛋白分子质量标记;1, pcantab5e空载体诱导表达;2,cib
‑
scfv
‑
pcantab5e诱导表达;
38.图14为单链抗体诱导表达sds
‑
page电泳检测结果;其中,m,蛋白分子 质量标准;1,iptg 0.1mmol/l、30℃、6h;2,iptg 0.25mmol/l、30℃,6h; 3,iptg 0.5mmol/l、30℃、6h;
4,iptg 0.1mmol/l、30℃,10h;5,iptg
ꢀꢀ
0.25mmol/l、30℃,10h;6,iptg 0.5mmol/l、30℃,10h;7,pcantab5e 空载体诱导表达;8,cib
‑
scfv
‑
pcantab5e未加iptg诱导;
39.图15为5
‑
cib
‑
scfv竞争抑制曲线。
具体实施方式
40.下面对本发明的具体实施方式进行描述,以便于本技术领域的技术人员理 解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的 普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精 神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保 护之列。
41.实施例1cib完全抗原的制备与鉴定
42.1、cib完全抗原的制备
43.(1)cib的重氮化
44.使用百万分位分析天平准确称量cib,溶于0.1mol/l预冷的盐酸中。在冰 水浴、低速缓慢搅拌的条件下,缓慢的加入10mg/ml预冷的亚硝酸钠溶液(摩 尔比1:1.2);使用淀粉
‑
ki试纸检验亚硝酸钠溶液是否过量,标准是:试纸颜色 变为灰紫色。避光,低温(0~5℃),搅拌1~2h。
45.(2)与载体蛋白偶联
46.分别精确称取bsa和ova(cib与载体蛋白摩尔比30:1)溶于0.1mol/l, ph=8.6的硼酸钠溶液中,在冰浴条件下,搅拌2h。将步骤(1)中cib的重氮 盐溶液等分为两份,缓慢的加入bsa/ova溶液中。使用稀naoh溶液调节ph 值,使其ph值始终维持在7.5至8.5范围内,低温、搅拌,过夜反应。
[0047][0048]
(3)透析:次日,反应结束后,收集亮黄色的反应产物,用pbs在4℃下 透析3d,并换液。
[0049]
(4)浓度测定及保存
[0050]
使用索莱宝bradford蛋白浓度测定试剂盒测定偶联产物的浓度,并调整浓 度至1mg/ml后,0.5ml/管分装至1.5mlep管中,保存至
‑
80℃冰箱。
[0051]
2、cib完全抗原的鉴定
[0052]
(1)sds
‑
page电泳
[0053]
根据浓度测定的结果,调整上样量,bsa、cib
‑
bsa为2μg,ova、cib
‑
ova 为6μg,点样体积为20μl。浓缩胶浓度为5%,分离胶浓度为10%。电泳时,全 程电压为120v,结束后考马斯亮蓝染色2h,脱色液脱色4h,每隔1h更换新的 脱色液;其结果见图1和图2。
[0054]
为鉴定完全抗原是否偶联成功,首先采用sds
‑
page电泳对偶联产物进行 鉴定。蛋
白质在sds
‑
page电泳中的迁移速率只与其分子量的大小有关,当电 泳结束时不同分子量大小的蛋白质会被截留在不同的位置。如图1和图2所示, 可观察到偶联产物cib
‑
bsa、cib
‑
ova的迁移速率均小于原有载体蛋白,说明 偶联产物的分子量均有所增大。从电泳结果,可证明cib与载体蛋白偶联成功。
[0055]
(2)紫外扫描
[0056]
先用pbs精准配制bsa、ova标准溶液,并调整cib
‑
bsa、cib
‑
ova的 浓度。然后用紫外分光光度计,采用光谱扫描模式获得上述各溶液在200
‑
500nm 范围内的光谱图。
[0057]
载体蛋白一般在紫外区有最大吸收峰(280nm左右),而偶联上新的化合物 后会引入新的基团形成新的物质,新物质最大吸收峰对应的波长会发生红移或 蓝移的现象,可以利用该现象鉴定完全抗原是否偶联成功。从图3中可以观察 到,偶联产物的最大吸收峰波长与载体蛋白最大吸收峰波长均发生了红移,可 以证明cib与载体蛋白偶联成功。
[0058]
实施例2免疫效果评价
[0059]
以制备的完全抗原cib
‑
bsa作为免疫原共免疫3只小鼠,在四免之后第10 天断尾采血,通过间接elisa对小鼠血清中抗体的效价进行测定,基本步骤如 下:
[0060]
(1)包被:分别用检测原cib
‑
ova和载体蛋白bsa、ova包被酶标板, 包被浓度为2μg/ml,50μl/孔,放于冰箱4℃过夜包被。次日,洗板,重复5次, 每次静置3min。
[0061]
(2)封闭:每孔加200μl封闭液(5g脱脂奶粉溶于100ml的pbst),37℃、 封闭2h,重复洗板5次,每次静置3min。
[0062]
(3)孵育一抗:每只小鼠断尾采血,加入pbs中,3000r/min离心5min, 取上清。此为1:100倍稀释的血清,在酶标孔里按1:200、1:400、1:800、1:1600、 1:3200、1:6400、1:12800、1:25600进行倍比稀释,每孔反应体积为50μl、37℃、 孵育60min;重复洗板5次,每次3min,同时未免疫小鼠血清做阴性对照。
[0063]
(4)孵育二抗:用封闭液按照工作浓度1:5000倍稀释hrp标记的羊抗鼠 igg,50μl/孔,37℃、孵育25min;重复洗板5次,每次静置3min。
[0064]
(5)显色:加tmb显色液50μl/孔,37℃、避光10min后加入终止液,50μl/ 孔。
[0065]
(6)读数:用空白对照调零,酶标仪检测od
450
值。
[0066]
如图4所示,3只小鼠均产生抗体,其中1、2号小鼠多抗血清在稀释度达 到1:3200后od
450
值仍大于1.0,每只小鼠的效价(p/n>2.1)均可达1:10000以 上。
[0067]
在检测效价的同时,分别包被载体蛋白bsa、ova检测小鼠多抗血清对载 体蛋白的反应性。如表1所示小鼠多抗血清与免疫原载体蛋白bsa有交叉反应 外,与包被原载体蛋白ova几乎无交叉反应。这一结果是符合预期的,因为载 体蛋白bsa的分子量远远大于半抗原cib的分子量,且bsa自身也存在一定 的抗原决定簇,能够被机体免疫系统识别从而诱导免疫应答反应。虽然,小鼠 多抗血清中存在bsa的抗体,但我们采用的检测原载体蛋白与免疫原载体蛋白 不同,可有效避免载体交叉反应对抗体检测的影响。
[0068]
表1小鼠多抗血清与载体蛋白的交叉反应性
[0069][0070]
再采用间接竞争elisa测定小鼠血液中抗体的半数抑制浓度(ic
50
),基本 步骤同效价测定,只是在加入一抗的同时,加入梯度稀释的西布特罗标准液。
[0071]
数据处理:在origin9.0软件中以cib浓度为横坐标,记未添加cib标准液(0ng/ml)对照孔的od
450
值为b0,添加cib标准液孔的od
450
值为b,以b/b0 为纵坐标绘图,采用logistics四参数方程拟合曲线,计算ic
50
。
[0072]
测定效价后,根据小鼠血清的效价采用间接竞争elisa对多抗血清的灵敏 度进行测定。多抗稀释倍数为吸光值接近1.0时的稀释倍数,cib进行系列梯度 稀释(3.9
‑
1000ng/ml),使用origin9.0软件中的四参数拟合函数对数据进行拟合, 以标准品浓度为横坐标,以吸光值b/b0(b:加竞争物孔的吸光值;b0:不加 竞争物孔的吸光值)作为纵坐标绘制竞争抑制曲线。3只小鼠中2号小鼠的ic
50
最低,计算得出2号小鼠半数抑制浓度ic
50
为62.107ng/ml,1号小鼠ic
50
为 443.084ng/ml,3号小鼠ic
50
>1μg/ml。其中2号小鼠的竞争抑制曲线如图4b。
[0073]
实施例3cib噬菌体单链抗体库的构建
[0074]
1、小鼠脾脏rna的提取
[0075]
根据免疫效果的鉴定,对2号小鼠进行第五次免疫。采用腹腔注射的方法, 注射50μg人工完全抗原cib
‑
bsa,此为超免程序不加任何佐剂。5天之后眼眶 取血分离血清是为阳性血清,并断颈处死摘除脾脏。依据宝生物公司的总rna 提取试剂盒的操作规程,进行rna的提取。然后立即用1.2%的琼脂糖凝胶电 泳鉴定。
[0076]
检测结果如图5所示,可检测到28s、16srna,条带清晰,而5srna存 在部分降解。随后,利用rt
‑
pcr将鉴定后的rna反转录获得cdna,随后vh、 vl的pcr扩增均以此cdna为扩增模板。
[0077]
2、反转录合成cdna
[0078]
rna提取结束后立即进行反转录,按照表2中逆转录的反应体系混合各组 分,低温操作,动作要迅速。反应条件如下:37℃、15min,85℃、5s。反应结 束后测定cdna浓度,于
‑
20
℃中保存。
[0079]
表2逆转录反应体系
[0080][0081]
3、抗体可变区vh、vl的扩增
[0082]
抗体的vh和vl分别由4个相对保守的框架区(fr)和3个抗体互补决 定区(cdr)组成。fr区的碱基组成和排列顺序相对较保守;cdr区是抗体识 别抗原,与抗原特异性结合的关键区域,该区域的保守度低,碱基的组成和排 列顺序多变,抗体的丰富度来源于此区域。本技术扩增vh和vl基因的引物设 计充分考虑了抗体基因的这一特性,设计pcr引物均从框架区开始扩增,保证 了可变区基因的结构完整性,同时在引物中引入了简并碱基保证克隆基因的多 样性。引物由上海生工合成,具体序列设计如表3所示。以步骤2中反转录获 得的cdna产物为模板,扩增vh、vl基因。
[0083]
反应程序如下:98℃30s;98℃1min,56℃30s,72℃1min,35个循环; 72℃10min。反应体系见表4。
[0084]
表3扩增单链抗体引物
[0085]
[0086][0087]
其中,斜体部分为载体pcantab
‑
5e酶切位点附近的同源序列,可在目的 基因两端扩增出与载体的同源的序列;划横线部分为酶切位点;r=a/g;y=c/t; m=a/c;k=g/t;s=c/g;w=a/t;h=a/c/t;b=c/g/t;v=a/c/g;d=a/g/t。
[0088]
表4 vh、vl基因pcr反应体系
[0089][0090]
4、目的基因的回收及纯化:采用琼脂糖凝胶电泳回收的方法对扩增的重链 和轻链基因进行纯化,琼脂凝胶的浓度为1.2%。
[0091]
5、scfv基因序列拼接及扩增
[0092]
以上述步骤扩增并纯化获得的vh、vl为模板,采用soe
‑
pcr技术将vh、 vl、linker按照vh
‑
l
‑
vl的形式进行拼接组装,用1%的琼脂糖凝胶电泳对pcr 产物进行鉴定。pcr反应条件如下:94℃50s,56℃50s,7个循环;72℃10min; 反应体系如表5。
[0093]
如图6a所示,经琼脂糖凝胶电泳检测vh、vl的条带大小分别约为350bp、 320bp,与预期相符。将vh、vl和和linker接头片段利用soe
‑
pcr技术拼接 成scfv基因后,用1%核酸琼脂糖凝胶电泳鉴定,结果如图6b所示,存在一特 异性条带大小约为750bp,与scfc片段预期大小相符合。
[0094]
表5 scfv基因pcr反应体系(step1)
[0095][0096]
将第一轮pcr反应产物均分为5份,并补加扩增scfv基因的上下游引物 vhbacksfi1和vlfornot1mix接着进行第二轮的pcr扩增。反应条件如下: 95℃1min;94℃50s,56℃50s,72℃50s,35个循环;72℃10min,4℃保存, pcr反应体系如表6。
[0097]
表6 scfv基因pcr反应体系(step2)
[0098][0099]
6、单链抗体库的构建及鉴定
[0100]
(1)scfv基因与pcantab5e载体连接
[0101]
s1.使用琼脂糖凝胶电泳回收纯化scfv基因。
[0102]
s2.用notⅰ和sfiⅰ内切酶双酶切pcantab5e载体,由于两种酶的酶切反 应温度相
差较大,故分2步进行,反应体系如表7所示,酶切完成后使用琼脂 糖凝胶电泳回收纯化pcantab5e基因(如图7所示,表明载体线性化成功,)。
[0103]
s3.将scfv片段与pcantab5e载体用同源重组酶进行连接,其反应体系 如表5,利用同源重组酶进行连接转化。把转化后的菌液进行涂布平板,37℃恒 温箱倒置过夜培养(如图8)。
[0104]
表7 pcantab5e载体酶切体系
[0105][0106]
(2)感受态细胞的制备
[0107]
s1.将冻存的tg1菌液划线于2
×
yt平板,次日挑取生长状况良好的菌落接 种于10ml的2
×
yt液体培养基中,37℃、200rpm过夜培养。
[0108]
s2.次日,1:100接种于2
×
yt液体培养基中,37℃、200rpm培养至对数生 长期(od
600
=0.4)。
[0109]
s3.停止培养,分装于50ml离心管中,冰浴40min后,4℃、4500rpm离心 20min。
[0110]
s4.留沉淀,用10ml预冷的10%甘油重悬,4℃、4000rpm离心25min。
[0111]
s5.重复步骤(4)2次,分别用5ml、2ml预冷的10%甘油重悬,离心。
[0112]
s6.最后,用10%预冷甘油重悬沉淀即为感受态,置于碎冰中立即使用效果 最佳。
[0113]
(3)连接产物电转化
[0114]
s1.在新鲜制备的tg1感受态,加入10μl连接产物用移液枪轻柔的混匀, 连接体系如表8所示。
[0115]
s2.然后加到预冷的无菌电转杯中,立即进行电击。
[0116]
s3.在电击后的电击杯中加入900μl到37℃预热的sob液体培养基,37℃, 200r/min培养1h,复苏载体的抗性以供在抗性平板上,选择和生长。
[0117]
s4.5000r/min,离心3min,弃上清,加入新鲜的2
×
yt液体培养基。
[0118]
s5.吸取100μl菌液涂在2
×
yt
‑
a平板上,同时取未经转化的tg1感受态做 阴性对照。
[0119]
s6.将平板在37℃恒温培养箱中倒置过夜培养,第二天计数菌落,估算转化 效率。
[0120]
s7.将所有的连接产物按上述步骤转入tg1感受态细胞,培养过夜的平板封 口后低温保存。
[0121]
表8 scfv与载体pcantab5e连接反应体系
[0122][0123][0124]
(4)重组质粒转化效果鉴定
‑
菌液pcr鉴定
[0125]
为了鉴定转化效果,从转化的平板上随机挑22个单菌落,进行菌液pcr 鉴定,结果如图9所示。反应体系如9,反应程序与扩增scfv基因程序相同。 pcantab5e
‑
s1,pcantab5e
‑
s6引物序列如表10所示。
[0126]
如图9所示,22个克隆中,有21个克隆能扩增出约750bp大小的条带,其 插入率为95.45%。
[0127]
为了进一步验证插入序列的正确性及序列的多样性,将以上菌液pcr检测 为阳性的菌液(20个)送生工测序。测序结果经dnaman软件分析,其中17 个插入序列是完全正确且序列均不相同。因此,抗体库中插入序列正确率为 77.27%(17/22),库容1.5
×
105。
[0128]
表9菌液pcr鉴定
[0129][0130]
表10 dna测序引物
[0131][0132]
(5)单链抗体初级库的菌株保存
[0133]
用2
×
yt
‑
a养基洗脱转化平板上的菌落,吹打混匀后一部分加50%甘油保 存,甘油的终浓度为15%,然后放于
‑
80℃保存,另一部分用于构建cib噬菌体 抗体库。
[0134]
(6)辅助噬菌体m13k07的制备
[0135]
s1.从培养tg1的平板上挑1个生长状况良好的单菌落接种到5ml的2
×
yt 液体培
养基中,在37℃,180r/min条件下过夜培养,次日将过夜培养的tg1菌 液1:100加入到200ml2
×
yt液体培养基中,继续培养到对数期(od
600
为0.5)。
[0136]
s2.从保存的辅助噬菌体m13k07中取10μl加入到上述菌液中,在37℃, 100r/min振荡1h之后,按照1:1000的比例补加卡那青霉素(kan),然后在37℃, 200r/min条件下过夜培养。
[0137]
s3.次日,将过夜培养的菌液在4℃,8000r/min,离心15min,收集上清分 装至50ml的离心管,加入1/5体积的peg/nacl,充分混匀后,在冰上静置4h。
[0138]
s4.在4℃,10000r/min条件下离心30min,然后弃掉上清;用1ml的pbs 重悬沉淀,4℃,13000r/min离心5min,收集上清加入1/5体积的peg/nacl, 充分混匀后,在冰上静置1h。
[0139]
s5.4℃,11000r/min离心15min,弃掉上清,此沉淀即为噬菌体,用200μl 的pbs重悬后,放4℃保存备用。
[0140]
(7)cib噬菌体单链抗体库的构建
[0141]
s1.将含有转化后阳性菌落的菌液接种于10ml2
×
yt
‑
a液体培养基中,在 37℃,200r/min培养至对数期,停止培养,冰水浴10
‑
15min增强感染效果;加 入4
×
10
10
pfu的辅助噬菌体m13k07。
[0142]
s2.37℃,180r/min继续培养1h后,4℃,7000r/min离心10min沉淀细菌, 小心移除上清,沉淀用20ml2
×
yt
‑
ak液体培养基重悬,继续培养12h以上。 次日,在4℃,8000r/min,离心15min,小心吸取上清。用1/5体积的peg/nacl 沉淀重组噬菌体,方法同辅助噬菌体的制备。将得到的cib噬菌体单链抗体库 在4℃冰箱保存,用于下一步免疫亲和筛选和富集。
[0143]
实施例4cib单链抗体的筛选及鉴定
[0144]
1、噬菌体抗体库的生物淘选与富集
[0145]
在实施例3构建得到的噬菌体抗体库的基础上,以cib
‑
bsa、cib
‑
ova为 包被抗原,采用固相筛选法对cib噬菌体库进行四轮“吸附
‑
洗脱
‑
扩增”淘选富 集。具体过程如下:
[0146]
(1)包被:用elisa包被液将cib
‑
bsa稀释到50μg/ml并包被至酶标板, 100μl/孔,4℃包被过夜。洗板,5次,5min/次
[0147]
(2)封闭:加入封闭液200μl/孔,37℃孵育2h;用tbst溶液洗三次,5min/ 次。
[0148]
(3)加抗体库:先每孔加50μltbs,然后每孔加50μl噬菌体单链抗体库, 37℃孵育1h。用0.1%tbst洗10次,3min/次。
[0149]
(4)洗脱与中和:每孔加200μl洗脱液(ph2.2),恒温摇床振荡10min, 立即加入中和液(ph9.1),10μl/孔,来中和洗脱下来的噬菌体溶液,即为第1 轮的筛选洗脱液。
[0150]
(5)滴度测定:取1μl洗脱液进行滴度测定;第二天计算平板上的菌落数, 根据稀释倍数计算回收的噬菌体。
[0151]
(6)扩增:取100μl酸洗脱并中和的洗脱产物加到5ml2
×
yt
‑
a培养基中, 培养至对数期(od
600
为0.4),冰浴30min,加入2
×
10
10
cfu辅助噬菌体m13k07, 室温静置30min后再37℃,180r/min恒温培养1h。8000r/min离心10min,弃上 清。50ml的2
×
yt
‑
ak培养基重悬沉淀,37℃,200r/min过夜培养。
[0152]
(7)peg/nacl沉淀:采用peg/nacl法沉淀扩增后的噬菌体,方法同辅助 噬菌体制备。此为第一轮淘选富集后的次级噬菌体库,测定滴度后进入下一轮 的淘选富集过程。筛选过程中为了给予一定的筛选压力,每轮淘选的条件均不 同,具体条件设置如表11所示。
[0153]
表11每轮淘选不同的淘选条件
[0154][0155]
经过4轮的“吸附
‑
洗脱
‑
扩增”过程,如表12所示,噬菌体的回收率逐轮 得到提升,第4轮淘选相较第1轮淘选噬菌体回收率提高了约140倍,说明特 异性噬菌体得到了有效的富集,为筛选到特异性抗cib单链抗体奠定了基础。
[0156]
表12每轮淘选效率
[0157][0158]
2、淘选菌落的pcr鉴定
[0159]
为检验淘选后的的噬菌体载体是否仍旧含有scfv片段,在第4轮淘选后随 机挑取单菌落进行菌液pcr鉴定,检测结果如图10所示,具体过程如下:
[0160]
(1)将第四轮筛洗脱产物复侵大肠杆菌tg1,涂布2
×
yt
‑
a平板,37℃, 过夜培养,第二天随机挑选生长状况良好的菌落于1ml 2
×
yt
‑
a培养基中并编 号,37℃,200r/min恒温摇床中培养2h。
[0161]
(2)取上述培养液5μl作为菌液pcr模板,其余分两份加50%甘油后
‑
20℃ 保存,一份送测,一份留作菌种进行后序实验。
[0162]
(3)菌液pcr模板与测序引物s1、s6相同,具体反应体系如表13,反应 程序为:98℃5min;98℃1min,56℃1min,72℃1min,25个循环;72℃10min。
[0163]
表13菌液pcr反应体系
[0164][0165]
如图10所示,随机挑取的的11个单菌落进行菌液pcr,均可扩增出大小 约750bp的片段,表明经过淘选富集后的噬菌粒载体仍保留有scfv片段。
[0166]
3、阳性噬菌体的phage
‑
elisa
[0167]
在上述鉴定的基础上逐批次的挑取第四轮筛选后涂板培养的单菌落制备噬 菌体并进行phage
‑
elsia对4轮淘选后的噬菌体进行特异性筛选。在多轮 phage
‑
elisa实验后共筛选出10个p/n(p:cib
‑
scfv噬菌体,n:辅助噬菌体) 大于2.1,od
450
>0.5的阳性噬菌体。结果如图11所示,其中编号为5,6,7,8 的阳性噬菌体反应较强(p/n>3.0);具体过程如下:
[0168]
(1)包被:分别用cib
‑
ova、bsa、ova包被酶标板,包被的浓度均为 10μg/ml,50μl/孔,放于冰箱4℃过夜包被。次日,洗板5次,3min/次。
[0169]
(2)封闭:每孔加200μl的封闭液,37℃,孵育封闭2h,洗板5次,3min/ 次。
[0170]
(3)加一抗:用封闭液稀释制备的噬菌体至1
×
108cfu/ml,50μl/孔、37℃ 恒温孵育1h,洗板五次,3min/次。
[0171]
(4)加酶标二抗:用封闭液按照工作浓度为0.4μg/ml稀释anti
‑
m13 antibody
‑
hrp,50μl/孔,37℃孵育30min;洗板五次,3min/次。
[0172]
(5)显色:每孔中加tmb单组分显色液50μl,室温避光显色10min,然 后加终止液2mol/l h2so4溶液,50μl/孔。
[0173]
(6)读数:酶标仪检测od
450
值。
[0174]
此外,为鉴定阳性噬菌体单链抗体的灵敏度,采用竞争抑制elisa测定cib 标准品浓度为200ng/ml的抑制率。如表14所示,在cib标准品浓度为200ng/ml 时均可产生抑制,其中编号为5的噬菌体抑制率在60.84%,其抑制率最好,后 续实验均以所筛选到的5号cib
‑
scfv噬菌体开展。
[0175]
表14 cib
‑
scfv阳性噬菌体抑制elisa测定结果
[0176][0177]
4、cib
‑
scfv阳性噬菌体的双酶切鉴定
[0178]
根据步骤3中筛选出的强阳性且有抑制的噬菌体,将步骤2中保藏的菌液1: 100接种于5ml 2
×
yt
‑
a培养基中并编号,37℃,180r/min过夜恒温震荡培养。 第二天,抽提重组质粒用notⅰ和sfiⅰ内切酶进行双酶切,反应组分及程序具 体参考实施例3步骤6中的酶切反应。
[0179]
结果如图12所示,在noti和sfii快切酶的作用下,核酸琼脂糖凝胶电泳显 示重组噬菌粒载体被切割为两个片段,其中750bp大小的片段,符合scfv片段 的大小。
[0180]
5、cib
‑
scfv阳性噬菌体的基因序列分析
[0181]
将保藏的菌液扩大培养,然后将5号阳性菌液送上海生工测序后,经 dnaman比对分析,该单链抗体的核苷酸序列大小为738bp(seq id no.2), 其编码的氨基酸序列如seq id no.1所示;其中vh片段大小为366bp,编码 122个氨基酸,vl片段大小为327bp,编码109个氨基酸,link片段大小为45bp, 编码15个氨基酸。经ncbi blast比对分析,vh序列与鼠源抗体序列同源性 达92%(sequence id:jf690472.1),vl与鼠源抗体序列达94%(sequence id: ab435431.1)。
[0182]
通过进一步采用ig blast比对分析,vh和vl存在明显的3个cdr区, 4个fr区,氨基酸序列的cdr区、fr区分区。linker前边的氨基酸序列为vh 氨基酸序列、后边为vl氨基酸序列。从ig blast比对分析结果可以发现在 vh、vl的氨基酸序列中均存在半胱氨酸,符合抗体的结构特征,可以起到维 持抗体稳定性的作用。
[0183]
6、可溶性cib单链抗体免疫印迹分析
[0184]
为了确定是否有可溶性cib
‑
scfv重组蛋白的表达,将5号强阳性噬菌体侵 染琥珀终止子非抑制型菌株hb2151进行诱导表达并采用免疫印迹的方法进行 分析,具体过程为:
[0185]
(1)电泳:电泳样品为30℃、iptg浓度为0.1mmol/l、诱导时间为8h时 cib
‑
scfv
‑
pcantab5e和pcantab5e空载诱导表达的周质腔提取物上清。
[0186]
(2)转印:电泳完毕后立即进行湿法转印,转印膜为pvdf,转印前pvdf 膜用甲醇处理30
‑
60s,转印条件为恒流300ma,90min。
[0187]
(3)封闭:5%的脱脂奶粉,37℃、封闭2h,放置于脱色摇床上用1%吐温 20pbs洗5次,每次5min。
[0188]
(4)一抗:一抗为1:3000倍的anti
‑
e
‑
tag(hrp),于37℃恒温箱中孵育 2h,pbst洗膜5次,放置于脱色摇床上,每次5min。
[0189]
(5)显影:在pvdf膜上适量滴加dab显色液室温避光显色。
[0190]
结果如图13所示,cib
‑
scfv
‑
pcantab5e载体诱导表达的周质腔提取物中 有一大小约为28kda的蛋白,而pcantab5e空载在大肠杆菌hb2151中无任 何携带e
‑
tag标签的重组蛋白表达。可以证实,cib
‑
scfv
‑
pcantab5e载体在 hb2151中诱导表达了可溶性cib
‑
scfv重组蛋白。
[0191]
7、cib单链抗体的可溶性表达
[0192]
为了探讨不同条件下可溶性cib
‑
scfv的表达情况,设置了不同时间、不同 iptg浓度诱导cib
‑
scfv表达,并采用sds
‑
page电泳进行检测;具体过程为:
[0193]
取10μl扩增后的cib阳性噬菌体加入到100μl含有对数期大肠杆菌 hb2151的培养基中,恒温箱中静置培养30min后,恒温摇床180rpm培养15min 后,将所有菌液涂布2
×
yt
‑
a平板,37℃过夜培养。
[0194]
次日,挑选平板上的单菌落,接种于10ml2
×
yt
‑
a液体培养基中,37℃, 200rpm培养过夜。第三天,取过夜培养物1:100接种于250ml2
×
yt
‑
a培养基中, 30℃,250rpm震荡培养至对数期后加入iptg诱导表达。iptg终浓度为 0.1mmol/l,培养温度为30℃,诱导时间为8h。停止诱导之后收集菌液,10000rpm 离心20min,收集菌体,用2ml预冷的tbs充分重悬,
‑
20℃放置20min,室温 放置20min,10000rpm离心20min,菌体先后用高渗缓冲溶液与低渗缓冲溶液 处理提取周质腔内可溶性蛋白。
[0195]
在确定有可溶性cib单链抗体表达后,设置iptg浓度0.1、0.25、0.5mmol/l、 诱导时间8、12h诱导可溶性表达,并采用sds
‑
page检测进行分析不同条件下 的表达情况。
[0196]
如图14所示,在30℃,不同iptg浓度(0.1、0.25、0.5mmol/l)、不同诱 导时间(8、12h)的条件下均有可溶性cib
‑
scfv表达,在iptg的浓度为 0.1mmol/l,30℃、诱导12h时(泳道4),表达效果最佳。
[0197]
8、cib单链抗体的灵敏度与特异性分析
[0198]
(1)首先采用间接elisa实验测定可溶性单链抗体的效价,选定合适的工 作浓度,具体为p/n>2.1,od
450
值在1.0~1.2之间。设阴性对照为 pcantab
‑
5e/hb2151。
[0199]
(2)根据上述步骤选定的工作效价,采用间接竞争elsia测定亲和力和特 异性,具体步骤同实施例2,其中的游离竞争物分别为β
‑
受体激动剂中的cib、 cl、cim、rac、zil;其中西布特罗的浓度梯度为1000、500、250、100、50、 10、5、1、0mg/ml,其他竞争物浓度梯度为2000、1000、500、100、50、10、 0ng/ml。
[0200]
(3)数据处理:在origin9.0软件中以cib浓度为横坐标,记未添加cib 标准液(0ng/ml)对照孔的od
450
值为b0,添加cib标准液孔的od
450
值为b, 以b/b0为纵坐标绘图,采用四参数方程拟合曲线,计算ic
50
。
[0201]
为了测定可溶性表达cib
‑
scfv的灵敏性,首先采用间接elisa实验对所筛 选的cib
‑
scfv效价进行分析。如表14所示,间接elisa检测结果表明所获得 的cib
‑
scfv效价可达1:160(p/n>2.1)。
[0202]
为进一步鉴定所筛选cib
‑
scfv亲和力,以稀释倍数1:40作为间接竞争elisa实验中可溶性scfv的工作效价。如图15为cib
‑
scfv的竞争抑制曲线, 经origin9.0计算其ic
50
=164.197ng/ml,ic
80
=965.67ng/ml。以上结果表明所获 得的cib
‑
scfv具有良好的灵敏度和亲和力。
[0203]
为进一步鉴定筛选该cib
‑
scfv的特异性,分别测定了其与6种β
‑
受体激动 剂cl、sal、cim、zil、rac、tbl的交叉反应性。结果如表15所示,在选 取与盐酸克伦特罗有交叉反应,且交叉反应率达26.12%。除与cl存在一定的 交叉反应外(26.12%),与其他所检测的β
‑
受体激动剂类小分子sal、cim、 rac、tbl、zil交叉反应率均小于0.1%。
[0204]
表15 5
‑
cib
‑
scfv与其β
‑
受体激动剂交叉反应率
[0205][0206]
综上,本发明成功筛选出1株与完全抗原cib
‑
ova具有较高反应性的强阳 性噬菌体,并且该噬菌体与载体蛋白的交叉反应性最低。经测序结果显示,该 单链抗体基因全长大小为738bp,vh大小为366bp、vl大小为327bp,与预期 相符。将cib
‑
scfv强阳性噬菌体侵染表达菌株hb2151后诱导表达,成功获得 了可溶性表达的scfv重组蛋白,经鉴定其与cib有良好的结合活性, ic
20
=9.938ng/ml,ic
50
=164.197ng/ml,ic
80
=965.67ng/ml。特异性鉴定结果显示, 其只与盐酸克伦特罗存在26.12%的交叉反应;该单链抗体可为建立cib的免疫 学快速检测方法提供理论依据和物质基础。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1