一种咔啉衍生物及其制备方法和在制备抗肿瘤药物中应用
1.本发明涉及一种新型的咔啉衍生物,包括具有抗肿瘤活性的3s-1,2,3,4-四氢-β-咔啉-3-甲基-氨基酸和(9h-吡啶并[3,4-b]吲哚-3-基)甲基-氨基酸,本发明还涉及上述化合物的制备方法以及它们在抗肿瘤细胞增殖和肿瘤生长以及在dna嵌插方面中的应用。本发明属于生物医药领域。
背景技术:
[0002]
肿瘤是严重影响居民健康的危险因素,近十年来全球范围内癌症负担呈持续增长态势,在我国肿瘤死亡占全部死因的1/4,位居死亡第一位。我国癌症发病近十年来呈上升态势,每年增加约4%。中国的癌症发病率略高于世界平均水平,位居全球癌症发病的第74位。在我国近20年来癌症呈现年轻化及发病率和死亡率“三线”走高的趋势,平均全国每分钟有6人被诊断为癌症。因此,开发新的高效、低毒的抗肿瘤以及抗癌药物有着十分重大的意义。
[0003]
β-咔啉类化合物是一大类具有不同程度芳香性的天然存在或人工合成的吲哚类生物碱,广泛分布于自然界,包括多种植物、各类海洋生物和人的组织和体液当中。该类化合物有多种生物学活性,其中抗肿瘤活性明显。β-咔啉可以以非共价键结合dna,它们是能够插入双链dna碱基对之间的扁平芳香胺,往往具有大的环状平面结构。结构简单的小分子β-咔啉可以插入到原核和真核dna中,导致复制保真度的损失和修复过程受损。小分子β-咔啉也已经表现出抑制dna转录体外和诱导dna链断裂的作用。
[0004]
发明人假设,在β-咔啉为基础的前提下,引入氨基酸,或将β-咔啉氧化后引入氨基酸,使其具有芳香平面结构,能够与dna结合从而具有抗肿瘤的生物活性。根据这个假设,发明人提出了本发明。
技术实现要素:
[0005]
本发明的目的之一是提供一种新型咔啉衍生物,即具有抗肿瘤活性的3s-1,2,3,4-四氢-β-咔啉-3-甲基-氨基酸和(9h-吡啶并[3,4-b]吲哚-3-基)甲基-氨基酸。
[0006]
本发明的目的之二是提供上述化合物的制备方法。
[0007]
本发明的目的之三是提供上述化合物在抗肿瘤方面的应用。
[0008]
为了达到上述目的,本发明采用了以下技术手段:
[0009]
首先,本发明提出了一种具有通式i结构的3s-1,2,3,4-四氢-β-咔啉-3-甲基-氨基酸,通式i中的aa为ser(bzl)或trp,对应的化合物分别命名为202-s(bzl)和202-w;
[0010][0011]
其次,本发明还提出了一种具有通式ii结构的(9h-吡啶并[3,4-β]吲哚-3-基)甲
基-氨基酸,通式ii中的aa为asp、glu或tyr,对应的化合物分别命名为198-d、198-e和198-y;
[0012][0013]
进一步的,本发明提出了所述的具有通式i结构的3s-1,2,3,4-四氢-β-咔啉-3-甲基-氨基酸的制备方法,该方法包括以下步骤:
[0014]
(1)在1m h2so4催化下l-trp和甲醛发生pictet-spengler缩合,制得3s-1,2,3,4-四氢-β-咔啉-3-羧酸;
[0015]
(2)以甲醇为溶剂,二氯亚砜催化下将3s-1,2,3,4-四氢-β-咔啉-3-羧酸三位上的羧基引入甲酯保护,得到3s-1,2,3,4-四氢-β-咔啉-3-羧酸甲酯;
[0016]
(3)以无水四氢呋喃为溶剂,四氢铝锂条件下将3s-1,2,3,4-四氢-β-咔啉-3-羧酸甲酯三位的甲酯还原为醇羟基,得到3s-1,2,3,4-四氢-β-咔啉-3-伯醇,命名为化合物202;
[0017]
(4)以四氢呋喃为溶剂,nmm,(boc)2o条件下对3s-1,2,3,4-四氢-β-咔啉-3-伯醇二位的nh引入boc保护,得到boc-3s-1,2,3,4-四氢-β-咔啉-3-伯醇;
[0018]
(5)以无水四氢呋喃为溶剂,dcc,dmap条件下,boc-3s-1,2,3,4-四氢-β-咔啉-3-伯醇与boc-ser(bzl)-oh发生分子间缩合,得到boc-3s-1,2,3,4-四氢-β-咔啉-3-甲基-boc-s-bzl;
[0019]
(6)将boc-3s-1,2,3,4-四氢-β-咔啉-3-甲基-boc-s-bzl在4n ea/hcl条件下脱去boc保护,得到目标化合物202-s(bzl);
[0020]
(7)以无水四氢呋喃为溶剂,dcc,dmap条件下,boc-3s-1,2,3,4-四氢-β-咔啉-3-伯醇与boc-trp-oh发生分子间缩合,得到boc-3s-1,2,3,4-四氢-β-咔啉-3-甲基-boc-w;
[0021]
(8)将boc-3s-1,2,3,4-四氢-β-咔啉-3-甲基-boc-w在4n ea/hcl条件下脱去boc保护,得到目标化合物202-w。
[0022]
进一步的,本发明还提出了所述的具有通式ii结构的(9h-吡啶并[3,4-β]吲哚-3-基)甲基-氨基酸的制备方法,该方法包括以下步骤:
[0023]
(1)以丙酮为溶剂,高锰酸钾条件下将3s-1,2,3,4-四氢-β-咔啉-3-羧酸甲酯氧化,得到9h-吡啶并[3,4-b]吲哚-3-羧酸甲酯;
[0024]
(2)以无水四氢呋喃为溶剂,四氢铝锂条件下将9h-吡啶并[3,4-b]吲哚-3-羧酸甲酯三位的甲酯还原为醇羟基,得到(9h-吡啶并[3,4-b]吲哚-3-基)甲醇,命名为化合物198;
[0025]
(3)以无水四氢呋喃为溶剂,dcc,dmap条件下,(9h-吡啶并[3,4-b]吲哚-3-基)甲醇与boc-asp(obzl)-oh发生分子间缩合,得到(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-d-obzl;
[0026]
(4)将得到的(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-d-obzl产物溶于甲醇,在pd/c,h2条件下脱去obzl保护,得到(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-d-oh;
[0027]
(5)将(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-d-oh在4n ea/hcl条件下脱去boc保护,得到目标化合物198-d;
[0028]
(6)以无水四氢呋喃为溶剂,dcc,dmap条件下,(9h-吡啶并[3,4-b]吲哚-3-基)甲
醇与boc-glu(obzl)-oh发生分子间缩合,得到(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-e-obzl;
[0029]
(7)将得到的(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-e-obzl产物溶于甲醇,在pd/c,h2条件下脱去obzl保护,得到(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-e-oh;
[0030]
(8)将(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-e-oh在4n ea/hcl条件下脱去boc保护,得到目标化合物198-e;
[0031]
(9)以无水四氢呋喃为溶剂,dcc,dmap条件下,(9h-吡啶并[3,4-b]吲哚-3-基)甲醇与boc-tyr-oh发生分子间缩合,得到(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-y-oh;
[0032]
(10)将(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-y-oh在4n ea/hcl条件下脱去boc保护,得到目标化合物198-y。
[0033]
再进一步的,本发明提出了所述的具有通式i结构的3s-1,2,3,4-四氢-β-咔啉-3-甲基-氨基酸在制备抗肿瘤药物中的应用。
[0034]
其中,优选的,所述的应用包括以下三部分:
[0035]
(1)所述的具有通式i结构的3s-1,2,3,4-四氢-β-咔啉-3-甲基-氨基酸在制备抗肿瘤细胞增殖药物中的应用;
[0036]
(2)所述的具有通式i结构的3s-1,2,3,4-四氢-β-咔啉-3-甲基-氨基酸在制备抗肿瘤生长药物中的应用;
[0037]
(3)所述的具有通式i结构的3s-1,2,3,4-四氢-β-咔啉-3-甲基-氨基酸在制备dna嵌插药物中的应用。
[0038]
再进一步的,本发明还提出了所述的具有通式ii结构的(9h-吡啶并[3,4-β]吲哚-3-基)甲基-氨基酸在制备抗肿瘤药物中的应用。
[0039]
其中,优选的,所述的应用包括以下三部分:
[0040]
(1)所述的具有通式ii结构的(9h-吡啶并[3,4-β]吲哚-3-基)甲基-氨基酸在制备抗肿瘤细胞增殖药物中的应用;
[0041]
(2)所述的具有通式ii结构的(9h-吡啶并[3,4-β]吲哚-3-基)甲基-氨基酸在制备抗肿瘤生长药物中的应用;
[0042]
(3)所述的具有通式ii结构的(9h-吡啶并[3,4-β]吲哚-3-基)甲基-氨基酸在制备dna嵌插药物中的应用。
附图说明
[0043]
图1为202-s(bzl)的合成路线。
[0044]
图2为202-w的合成路线。
[0045]
图3为198-d的合成路线。
[0046]
图4为198-e的合成路线。
[0047]
图5为198-y的合成路线。
具体实施方式
[0048]
为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
[0049]
实施例1制备3s-1,2,3,4-四氢-β-咔啉-3-羧酸
[0050]
在冰浴下向400ml水中缓慢加入0.2ml浓硫酸,向得到的稀硫酸溶液中加入5.00g(24.5mmol)l-色氨酸,使其完全溶解后缓慢加入10ml浓度为37-40%的甲醛溶液。反应混合物室温搅拌4-5小时,后用浓氨水调ph至7过滤并用甲醇洗,得到5.15g(产率99%)滤饼即为3s-1,2,3,4-四氢-β-咔啉-3-羧酸。
[0051]
esi/ms:217[m+h]
+
;1h nmr(300mhz,dmso-d6)δ10.95(s,1h),δ7.47(q,j=8.5hz,2h),7.07(m,2h),5.42(s,1h),4.42(d,j=15.8hz,1h),4.25(m,1h),3.63(m,1h),3.14(m,1h),2.85(m,1h).
13
c nmr(75mhz,dmso-d6)δ169.58,136.31,136.19,129.03,121.40,119.35,117.69,111.09,109.79,56.47,22.85.
[0052]
实施例2制备3s-1,2,3,4-四氢-β-咔啉-3-羧酸甲酯
[0053]
在冰浴下向40ml甲醇中加入3ml socl2,并通过恒压漏斗滴入瓶中,在漏斗上方架上干燥管,活化。活化完成后,撤下恒压漏斗,称取3.00g(15mmol)3s-1,2,3,4-四氢-β-咔啉-3-羧酸加入瓶中,加干燥管。撤去冰浴,常温搅拌下反应48小时,tlc(二氯甲烷:甲醇20:1)监测反应完成。后用水泵抽干甲醇,并依次用乙酸乙酯,石油醚抽干。用乙酸乙酯复溶,加入适量饱和碳酸氢钠溶液冰浴下搅拌除盐,后置于分液漏斗中静置分层,依次用依次用饱和nahco3,饱和nacl洗涤,酯层用无水na2so4干燥后过滤旋干。用二氯甲烷,甲醇体系进行硅胶柱层析纯化,得到白色固体化合物1.7g,即为目标化合物,产率54%。
[0054]
esi/ms:231.1[m+h]
+
;1h nmr(300mhz,dmso-d6)δ10.73(s,1h),7.37(m,1h),7.28(m,1h),6.99(m,2h),3.97(m,2h),3.74(dd,j=8.8,4.8hz,1h),3.68(s,3h),2.95(m,1h),2.75(m,2h).
13
c nmr(75mhz,dmso-d6)δ173.55,135.67,133.38,126.85,120.35,118.20,117.12,110.77,105.42,55.13,51.54,41.33,24.91.
[0055]
实施例3制备3s-1,2,3,4-四氢-β-咔啉-3-伯醇(202)
[0056]
在冰浴条件下,将0.7g(17mmol)lialh4缓慢加入无水thf中,称取1.0g(4.3mmol)3s-1,2,3,4-四氢-β-咔啉-3-羧酸甲酯在冰浴下缓慢加入该反应液中,茄瓶上加干燥管,冰浴搅拌5h。薄层层析(二氯甲烷:甲醇=10:1)监测反应结束后进行淬灭反应:依次逐滴加入h2o、4n naoh溶液、h2o,加入水时溶液中有气体产生。加毕继续搅拌40分钟。减压过滤除去滤渣,旋干滤液得黄色固体。经硅胶柱层析纯化(二氯甲烷甲醇体系)得0.63g白色固体,即为3s-1,2,3,4-四氢-β-咔啉-3-伯醇(202),产率72%。
[0057]
m.p.:175.7-179.4℃;-67.88;esi/ms:203[m+h]
+
;1h nmr(300mhz,dmso-d6)δ10.66(s,1h),7.34(m,1h),7.26(m,1h),6.96(m,2h),4.70(s,1h),3.92(s,2h),3.51(m,2h),2.88(m,1h),2.63(dd,j=14.9,4.1hz,1h),2.29(m 1h).
13
c nmr(75mhz,dmso-d6)δ135.75,133.97,127.12,120.07,118.03,117.02,110.70,106.58,65.01,55.41,42.31,24.41.
[0058]
实施例4制备boc-3s-1,2,3,4-四氢-β-咔啉-3-伯醇
[0059]
取1g(4.95mmol)3s-1,2,3,4-四氢-β-咔啉-3-伯醇,溶于无水thf,加入1.4g(6.44mmol)(boc)2o,调ph至9,茄瓶上置单通室温下反应,开始2小时频繁减压抽气,后监测ph使其维持在9。经tlc(二氯甲烷:甲醇30:1)监测反应完全后,旋干反应液,乙酸乙酯复溶,依次用5%khso4,饱和nacl洗,酯层用无水na2so4干燥,过滤旋干。经硅胶柱层析纯化(二氯甲烷甲醇体系)得1.34g白色固体,即为目标化合物,产率90%。
[0060]
esi/ms:303[m+h]
+
;1h nmr(300mhz,dmso)δ10.81(s,1h),7.38(d,j=7.7hz,1h),7.29(d,j=7.7hz,1h),6.99(m,2h),4.82(m,2h),4.61(s,1h),4.53(s,1h),4.16(m,1h),3.34(m,1h),2.76(s,2h),1.45(s,9h).
13
c nmr(75mhz,dmso)δ155.04,154.35,136.02,129.99,126.84,120.64,118.26,117.43,110.86,104.45,78.95,59.89,51.82,50.29,37.86,28.04,26.27,22.46,21.02,20.62.
[0061]
实施例5制备boc-3s-1,2,3,4-四氢-β-咔啉-3-甲基-boc-s(bzl)
[0062]
取0.70g(2.39mmol)boc-ser(bzl)-oh溶于无水thf,加入0.49g(2.38mmol)dcc,24mg(0.20mmol)dmap,冰浴下活化40min,待dcu析出,反应液呈白色混悬液后加入0.60g(1.99mmol)boc-3s-1,2,3,4-四氢-β-咔啉-3-伯醇,撤去冰浴室温反应过夜,经tlc(二氯甲烷:甲醇30:1)监测反应完全后终止反应。反应液过滤旋干,用适量乙酸乙酯复溶,依次用饱和nahco3,饱和nacl,5%khso4,饱和nacl,饱和nahco3,饱和nacl各洗三遍,分液除去水层。酯层经无水na2so4干燥2h后过滤旋干。经硅胶柱层析纯化(石油醚乙酸乙酯体系)得0.30g,产率26%的白色固体,即为目标化合物。
[0063]1h nmr(300mhz,dmso-d6)δ10.88(s,1h),7.33(m,7h),7.18(m,1h),7.05(m,1h),6.97(d,j=7.6hz,1h),4.86(s,2h),4.46(m,2h),4.26(s,1h),4.08(m,3h),3.63(m,2h),2.80(m,2h),1.76(m,2h),1.42(s,s,18h).
[0064]
实施例6制备202-s(bzl)
[0065]
取0.30g(0.52mmol)boc-3s-1,2,3,4-四氢-β-咔啉-3-甲基-boc-s(bzl)用8ml 4n ea/hcl溶解,茄瓶上方加干燥管,在冰浴下反应至原料点消失。用水泵将反应液抽干,后依次用乙酸乙酯,乙醚各复溶三次,分别抽干后得到白色固体产物0.18g,即为目标化合物,产率77%,合成路线如图1所示。
[0066]
m.p.:133.4-135.3℃;+10.13(c=0.10,ch3oh);esi/ms:380[m+h]
+
;1h nmr(300mhz,dmso-d6)δ8.97(s,1h),7.36(m,9h),7.12(m,1h),7.01(m,1h),4.63(m,4h),4.38(m,2h),4.03(m,1h),3.88(mm,2h),2.97(m,2h),1.15(m,1h).1h nmr(500mhz,dmso-d6)δ10.27(s,1h),8.78(s,1h),8.72(s,1h),7.31(m,5h),7.09(ddd,j=8.2,6.9,1.2hz,1h),6.99(dd,j=8.3,6.6hz,1h),4.71(m,1h),4.58(m,2h),4.49(m,1h),4.41(d,j=16.5hz,1h),4.31(d,j=15.3hz,1h),4.01(m,1h),3.87(m,1h),3.85(s,1h),3.14(s,1h),2.95(m,2h).
13
cnmr(126mhz,dmso-d6)δ166.80,137.36,136.19,128.18,127.56,126.08,125.77,121.51,118.84,117.64,117.59,111.31,104.69,72.39,67.06,64.24,52.64,47.38,40.03,24.34.
[0067]
实施例7制备boc-3s-1,2,3,4-四氢-β-咔啉-3-甲基-boc-w
[0068]
取0.60g(1.98mmol)boc-trp-oh溶于二氯甲烷,加入0.41g(1.98mmol)dcc,20mg(0.16mmol)dmap,冰浴下活化20min,待dcu析出,反应液呈白色混悬液后加入0.50g(1.65mmol)boc-3s-1,2,3,4-四氢-β-咔啉-3-伯醇,撤去冰浴室温反应过夜,经tlc(二氯甲烷:甲醇30:1)监测反应完全后终止反应。反应液过滤旋干,用适量乙酸乙酯复溶,依次用饱和nahco3,饱和nacl,5%khso4,饱和nacl,饱和nahco3,饱和nacl各洗三遍,分液除去水层。酯层经无水na2so4干燥2h后过滤旋干。经硅胶柱层析纯化(石油醚乙酸乙酯体系)得0.31g,产率32%的白色固体,即为目标化合物。
[0069]1h nmr(300mhz,dmso-d6)δ10.86(s,1h),7.50(d,j=7.7hz,1h),7.34(m,3h),7.06
(m,6h),4.88(d,j=18.8hz,2h),4.19(s,3h),4.08(m,1h),3.12(m,1h),2.97(m,1h),2.75(d,j=13.8hz,1h),1.99(s,1h),1.42(s,9h),1.33(m,7h).
[0070]
实施例8制备202-w
[0071]
取0.31g(0.53mmol)boc-3s-1,2,3,4-四氢-β-咔啉-3-甲基-boc-w用6ml4n ea/hcl溶解,茄瓶上方加干燥管,在冰浴下反应至原料点消失。用水泵将反应液抽干,后依次用乙酸乙酯,乙醚各复溶三次,分别抽干。用反相c
18
柱进行纯化(甲醇,水体系),纯化后旋干甲醇,将剩余的水冻干后得到白色固体产物0.21g,即为目标化合物,产率93%,合成路线如图2所示。
[0072]
m.p.:234.9-236.8℃;+23.27(c=0.10,ch3oh);esi/ms:389[m+h]
+
;1h nmr(500mhz,dmso-d6)δ11.11(m,2h),10.42(s,1h),10.15(s,1h),8.88(s,3h),7.59(d,j=7.8hz,1h),7.40(d,j=7.8hz,1h),7.36(d,j=8.1hz,2h),7.31(dd,j=6.9,2.5hz,1h),7.04(m,4h),4.64(m,1h),4.34(m,3h),4.26(d,j=6.8hz,1h),3.39(m,2h),3.15(s,1h),2.86(m,2h).
13
cnmr(126mhz,dmso-d6)δ136.22,136.18,126.81,126.01,125.77,125.00,121.53,121.06,118.86,118.55,118.05,117.68,111.49,111.30,106.50,104.73,63.99,53.23,52.09,40.00,26.15,25.93.
[0073]
实施例9制备9h-吡啶并[3,4-b]吲哚-3-羧酸甲酯
[0074]
在冰浴条件下,将1.00g(4.63mmol)3s-1,2,3,4-四氢-β-咔啉-3-羧酸甲酯加入至50ml丙酮中搅拌,并缓慢分批加入1.55g(9.81mmol)kmno4粉末在室温下反应过夜。经tlc监测,约12小时后原料点完全消失,此时反应液呈深棕色。加入50ml乙醇在冰浴下反应30分钟后消耗掉未反应的kmno4,过滤除去滤渣,得到橙红色澄清透明液体,旋干后经二氯甲烷,甲醇体系进行硅胶柱层析纯化,得到该白色固体化合物0.42g,即为目标化合物,产率43%。
[0075]
实施例10制备(9h-吡啶并[3,4-b]吲哚-3-基)甲醇(198)
[0076]
将0.51g(13.42mmol)allih4置于干燥三天以上的茄瓶中,在冰浴下用干燥三周以上的无水thf分批溶解形成a液;冰浴下将0.77g(3.55mmol)9h-吡啶并[3,4-b]吲哚-3-羧酸甲酯溶于适量的无水thf形成b液。将a液缓慢加入至b液,形成草绿色溶液,该反应产生大量的氢气,应在通风橱中进行。反应5h后经tlc(二氯甲烷:甲醇10:1)监测原料点完全消失。依次在冰浴下缓慢滴加0.5ml水,1.5ml 2n naoh,1ml水淬灭反应,反应30min后反应液由草绿色变为黄色,减压过滤,滤液旋干,并用二氯甲烷,甲醇体系进行硅胶柱层析纯化。最终得到白色粉末状固体0.46g,产率68%,该白色固体即为(9h-吡啶并[3,4-b]吲哚-3-基)甲醇(198)。
[0077]
m.p.:221.9-226.2℃;1h nmr(300mhz,dmso-d6)δ11.50(s,1h),8.83
–
8.76(m,1h),8.24(d,j=7.9hz,1h),8.14(s,1h),7.63
–
7.47(m,2h),7.29
–
7.17(m,1h),5.35(t,j=5.8hz,1h),4.73(d,j=5.6hz,2h).
[0078]
实施例11制备(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-d(obzl)
[0079]
取0.97g(3.00mmol)boc-asp(obzl)-oh溶于无水thf,加入0.62g(3.00mmol)dcc,30mg(0.25mmol)dmap,冰浴下活化40min,待dcu析出,反应液呈白色混悬液后加入0.50g(2.50mmol)(9h-吡啶并[3,4-b]吲哚-3-基)甲醇,撤去冰浴室温反应过夜,经tlc(二氯甲烷:甲醇30:1)监测反应完全后终止反应。反应液过滤旋干,用适量乙酸乙酯复溶,依次用饱和nahco3,饱和nacl,5%khso4,饱和nacl,饱和nahco3,饱和nacl各洗三遍,分液除去水层。
酯层经无水na2so4干燥2h后过滤旋干。经硅胶柱层析纯化(二氯甲烷甲醇体系)得0.98g,即为目标化合物,产率为78%的白色固体。
[0080]1h nmr(300mhz,dmso-d6)δ11.67(s,1h),8.86(s,1h),8.18(m,2h),7.58(m,2h),7.47(d,j=8.4hz,1h),7.32(s,5h),7.25(t,j=7.3hz,1h),5.31(s,2h),5.08(s,2h),4.53(m,1h),2.94(m,1h),2.79(m,1h),1.35(s,9h).
[0081]
实施例12制备(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-d-oh
[0082]
取0.50g(0.99mmol)(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-d(obzl)溶于适量甲醇,由于其溶解度不好,加入少量二氯甲烷助溶,后迅速加入0.10g pd/c,茄瓶上方加三通,将瓶中空气与氢气袋中的氢气进行置换,并于室温下反应6h,经tlc(二氯甲烷:甲醇20:1)监测原料点消失,终止反应,反应液过滤旋干,过滤出的废弃pd/c置于水中保存。旋干后得淡黄色固体0.40g,即为目标化合物,产率93%。
[0083]
实施例13制备198-d
[0084]
取0.40g(0.97mmol)(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-d用5ml4n ea/hcl在冰浴下溶解,茄瓶上方加干燥管,在冰浴下反应7h后经tlc监测(乙酸乙酯:水:冰醋酸3:1:1)原料点消失。用水泵将反应液抽干,后依次用10ml乙酸乙酯,乙醚复溶三次,分别抽干。用反相c
18
柱进行纯化(甲醇,超纯水体系),纯化后旋干甲醇,将剩余的水冻干后得到白色固体产物0.20g,即为目标化合物,产率69%。合成路线如图3所示。
[0085]
m.p.:199.8-201.7℃;+6.36(c=0.10,ch3oh);esi/ms:314[m+h]
+
;1h nmr(500mhz,dmso-d6)δ12.76(s,1h),9.04(s,1h),8.75(s,1h),8.63(s,1h),8.56(s,1h),8.37(d,j=8.0hz,1h),7.73(m,2h),7.36(ddd,j=8.0,6.3,1.7hz,1h),4.09(t,j=5.4hz,1h),3.13(s,1h),2.89(d,j=5.4hz,2h),2.81(s,3h).
13
c nmr(126mhz,dmso-d6)δ170.80,169.74,144.01,143.37,139.48,134.02,133.35,125.36,124.98,123.30,123.23,120.88,117.03,59.58,48.40,34.16.
[0086]
实施例14制备(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-e(obzl)
[0087]
取1.01g(3.36mmol)boc-glu(obzl)-oh溶于无水thf,加入0.62g(3.00mmol)dcc,30mg(0.25mmol)dmap,冰浴下活化40min,待dcu析出,反应液呈白色混悬液后加入0.50g(2.50mmol)(9h-吡啶并[3,4-b]吲哚-3-基)甲醇,撤去冰浴室温反应过夜,经tlc(二氯甲烷:甲醇20:1)监测反应完全后终止反应。反应液过滤旋干,用适量乙酸乙酯复溶,依次用饱和nahco3,饱和nacl,5%khso4,饱和nacl,饱和nahco3,饱和nacl各洗三遍,分液除去水层。酯层经无水na2so4干燥2h后过滤旋干。经硅胶柱层析纯化(二氯甲烷甲醇体系)得0.95g,产率为74%的白色固体,即为目标化合物。
[0088]1h nmr(300mhz,dmso-d6)δ11.67(s,1h),8.86(s,1h),8.20(m,2h),7.58(m,2h),7.40(d,j=7.8hz,1h),7.32(s,5h),7.25(t,j=7.3hz,1h),5.33(d,j=3.1hz,2h),5.07(s,2h),4.14(m,1h),2.04(m,1h),1.89(s,1h),1.36(s,9h).
[0089]
实施例15制备(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-e-oh
[0090]
取0.94g(1.82mmol)(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-e(obzl)溶于适量甲醇,由于其溶解度不好,加入少量二氯甲烷助溶,后迅速加入0.14g pd/c,茄瓶上方加三通,将瓶中空气与氢气袋中的氢气进行置换,并于室温下反应6h,经tlc(二氯甲烷:甲醇30:1)监测原料点消失,终止反应,反应液过滤旋干,过滤出的废弃pd/c置于水中保存。旋干后
得淡黄色固体0.77g,即为目标化合物,产率97%。
[0091]
实施例16制备198-e
[0092]
取0.50g(1.17mmol)(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-e-oh用7ml4n ea/hcl在冰浴下溶解,茄瓶上方加干燥管,在冰浴下反应7h后经tlc监测(乙酸乙酯:水:冰醋酸3:1:1)原料点消失。用水泵将反应液抽干,后依次用10ml乙酸乙酯,乙醚复溶三次,分别抽干。得黄色粉末。用反相c
18
柱进行纯化(甲醇,超纯水体系),纯化后旋干甲醇,将剩余的水冻干后得到白色固体产物0.22g,即为目标化合物,产率58%。合成路线如图4所示。
[0093]
m.p.:187.9-189.7℃;+13.33(c=0.10,ch3oh);esi/ms:317[m+h]
+
;1h nmr(500mhz,dmso-d6)δ12.75(s,1h),9.04(s,1h),8.56(s,1h),8.53(m,3h),8.37(d,j=8.0hz,1h),7.74(m,2h),7.37(m,1h),3.88(t,j=6.7hz,1h),2.81(s,2h),2.46(m,1h),2.36(ddd,j=17.1,8.9,6.6hz,1h),2.02(m,2h).
13
c nmr(126mhz,dmso-d6)δ173.10,170.44,144.04,139.45,134.07,133.77,133.36,125.20,124.93,123.33,123.23,121.02,117.05,59.48,51.14,29.27,25.22.
[0094]
实施例17制备(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-y-oh
[0095]
取0.89g(3.17mmol)boc-tyr-oh溶于无水thf,加入0.65g(3.17mmol)dcc,38mg(0.31mmol)dmap,冰浴下活化40min,待dcu析出,反应液呈白色混悬液后加入0.52g(2.53mmol)(9h-吡啶并[3,4-b]吲哚-3-基)甲醇,撤去冰浴室温反应过夜,经tlc(二氯甲烷:甲醇30:1)监测反应完全后终止反应。反应液过滤旋干,用适量乙酸乙酯复溶,依次用饱和nahco3,饱和nacl,5%khso4,饱和nacl,饱和nahco3,饱和nacl各洗三遍,分液除去水层。酯层经无水na2so4干燥2h后过滤旋干。经硅胶柱层析纯化(二氯甲烷甲醇体系)得0.35g,产率为29%的白色固体,即为目标化合物。
[0096]1h nmr(300mhz,dmso-d6)δ11.66(s,1h),9.23(s,1h),8.87(s,1h),8.23(d,j=7.9hz,1h),8.10(s,1h),7.58(m,2h),7.27(m,2h),7.05(d,j=8.0hz,2h),6.67(d,j=8.0hz,2h),5.75(s,1h),5.31(m,2h),4.20(m,1h),2.96(m,1h),2.82(m,1h),1.32(s,9h).
[0097]
实施例18制备198-y
[0098]
取0.50g(1.08mmol)(9h-吡啶并[3,4-b]吲哚-3-基)甲基-boc-y-oh用7ml4n ea/hcl在冰浴下溶解,茄瓶上方加干燥管,在冰浴下反应7h后经tlc监测(乙酸乙酯:水:冰醋酸3:1:1)原料点消失。用水泵将反应液抽干,后依次用10ml乙酸乙酯,乙醚复溶三次,分别抽干。用反相c
18
柱进行纯化(甲醇,超纯水体系),纯化后旋干甲醇,将剩余的水冻干后得到白色固体产物0.30g,即为目标化合物,产率77%。合成路线如图5所示。
[0099]
m.p.:177.2-178.6℃;+35.41(c=0.10,ch3oh);esi/ms:362[m+h]
+
;1h nmr(500mhz,dmso-d6)δ12.94(s,1h),9.21(s,1h),8.78(s,1h),8.50(d,j=8.0hz,1h),7.80(d,j=8.3hz,1h),7.75(t,j=7.6hz,1h),7.41(t,j=7.6hz,1h),7.04(m,2h),6.63(m,2h),5.66(d,j=13.5hz,1h),5.58(d,j=13.5hz,1h),4.29(s,1h),3.17(d,j=14.1hz,1h),3.14(s,1h),3.09(dd,j=14.1,7.4hz,1h).
13
c nmr(126mhz,dmso-d6)δ168.33,156.57,143.75,135.98,134.19,132.86,131.51,130.36,126.69,124.31,123.38,121.25,119.34,116.89,112.97,63.04,53.64,34.92.
[0100]
实施例19抗肿瘤细胞增殖作用评价
[0101]
实验材料
[0102]
盐酸阿霉素(cas:25316-40-9,百灵威科技有限公司)、202、202-s(bzl)、202-w、198、198-d、198-e和198-y、生理盐水(石家庄四药有限公司)、mtt(江苏凯基生物有限公司)、pbs、rpmi-1640培养基、dmem培养基(江苏凯基生物有限公司)、胰蛋白酶-edta消化液、胎牛血清、dmso(hyclone)、青霉素(石药集团中诺药业(石家庄)有限公司)、链霉素(石药集团中诺药业(石家庄)有限公司)。
[0103]
实验仪器
[0104]
酶标仪(molecular devices spectramax)、显微镜(蔡司)、0.22μm滤膜(millex)、高压蒸汽灭菌锅(tomy sx-700)、细胞孵育箱(inc153,memmer)、离心机(eppendorf)、超净台(thermo msc-advantage)、孵箱(thermo heracell 150i)、96孔细胞培养板,25cm2培养瓶(costar)。
[0105]
细胞株
[0106]
a549(人肺腺癌细胞)、95d(人高转移性肺癌细胞)、mcf-7(人乳腺癌细胞)、hepg2(人肝癌细胞)、hct116(人结肠癌细胞)、s180(小鼠肉瘤细胞)(江苏凯基公司)。
[0107]
分组及给药剂量
[0108]
本发明的化合物202、202-s(bzl)、202-w、198、198-d、198-e和198-y浓度依次为100.00μm、50.00μm、25.00μm、12.50μm、6.25μm、3.13μm;阳性对照:阿霉素(dox),用含0.5%dmso的pbs缓冲液配制成目标浓度(5.00μm、2.50μm、1.25μm、0.63μm、0.31μm、0.16μm);空白对照:含0.5%dmso的pbs缓冲液。
[0109]
实验操作
[0110]
(1)贴壁细胞的培养
[0111]
a549,95d,mcf-7,hepg2和hct116均为贴壁细胞。
[0112]
分别将生长状态良好、处于对数生长期的a549,95d,mcf-7,hepg2和hct116细胞以5000个/孔的密度接种于96孔板,于37℃,5%co2孵箱中培养8小时,待细胞贴壁后按预设的浓度(梯度)依次加入25μl受试化合物及dox,空白对照组加入等体积的含0.5%dmso的pbs缓冲液,继续在孵箱中培养48小时,后每孔加25μl mtt溶液,置于37℃孵育4小时,移液枪吸取上清后每孔加入150μl的dmso(二甲基亚砜),振荡约15min摇匀。立即于酶标仪上检测od(吸光度)值,波长490nm。
[0113]
(2)悬浮细胞的培养
[0114]
s180为悬浮细胞。
[0115]
将生长状态良好、处于对数生长期的s180细胞以5000个/孔的密度接种于96孔板,按预设的浓度(梯度)依次加入25μl受试化合物及dox,空白对照组加入等体积的含0.5%dmso的pbs缓冲液。在孵箱中培养48小时后每孔加25μl mtt溶液,置于37℃孵育4小时,3000rpm、5min离心,用移液枪小心吸取上清液,每孔加入150μl的dmso振荡约15min摇匀。立即于酶标仪上检测od值,波长490nm。
[0116]
(3)统计方法
[0117]
按下式计算出受试样品不同浓度下对肿瘤细胞的抑制率:
[0118]
生长抑制率=[(空白组平均od值-样品组平均od值)/空白组平均od值]
×
100%。实验重复6次,在origin软件上以抑制率对受试化合物浓度作生长曲线图,计算得出受试化
合物的ic
50
(半数有效抑制浓度)值。
[0119]
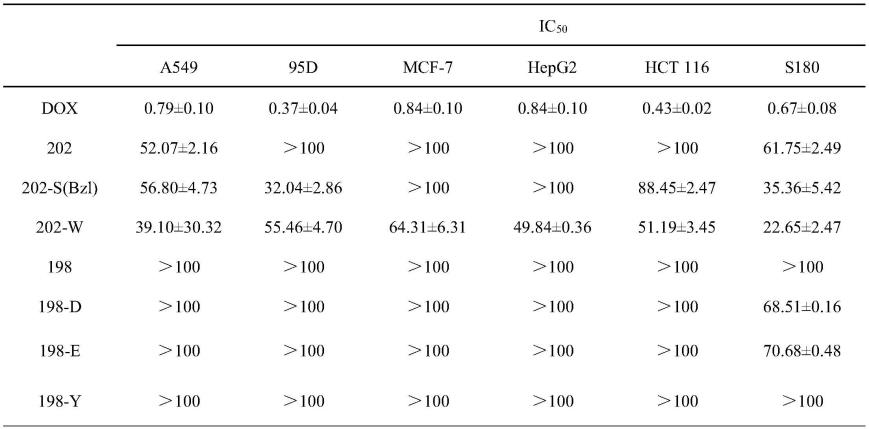
实验结果
[0120]
结果见表1。可以看出,不同受试化合物在不同受试细胞株中均表现出不同的活性,202-w和202-s(bzl)在体外表现出了良好的抗肿瘤细胞增殖活性;198-d,198-e和198-y则在六株受试肿瘤细胞中均表现出大于100μm的ic
50
,体外抗肿瘤细胞增殖活性稍差。
[0121]
选取具有较好的体外抗细胞增殖活性的2个目标化合物202-w和202-s(bzl)在1μmol/kg剂量下进行小鼠体内抗肿瘤活性的评价;对于在体外抗细胞增殖实验中ic
50
大于100的198系列三个目标化合物198-d,198-e和198-y在5μmol/kg剂量下进行小鼠体内抗肿瘤活性的评价。
[0122]
表1 体外抗肿瘤活性(ic
50
,μm)
[0123][0124]
注:n=6。
[0125]
实施例20抗肿瘤作用评价
[0126]
实验材料
[0127]
盐酸阿霉素(cas:25316-40-9,百灵威科技有限公司)、生理盐水(石家庄四药有限公司)、202、202-s(bzl)、202-w、198、198-d、198-e和198-y。
[0128]
实验动物
[0129]
icr品系小鼠,雄性,20
±
2g,购自北京维通利华实验动物技术有限公司。
[0130]
瘤源为小鼠s180肉瘤,购自北京大学医学部动物实验中心,自行传代维持。
[0131]
小鼠分组及给药剂量
[0132]
本发明的化合物202、202-s(bzl)和202-w剂量为1μmol/kg,阳性对照盐酸阿霉素剂量为2μmol/kg,阴性对照为生理盐水;或本发明的化合物198、198-d、198-e和198-y剂量为5μmol/kg,阳性对照盐酸阿霉素剂量为2μmol/kg,阴性对照为生理盐水给药剂量为0.2ml/20g,连续给药10天,共给药10次。
[0133]
实验操作
[0134]
无菌条件下抽取s180腹水瘤瘤液接种,用生理盐水稀释成(1:2)的细胞液充分混合,将肿瘤细胞悬液用当天配制的0.2%台盼蓝染色,混匀后按白细胞计数方法进行计数,染蓝色者为死细胞,未染色者为活细胞,并按以下公式计算细胞浓度和存活率:
[0135]
细胞浓度=4大方格内活细胞数/4
×
104×
稀释倍数=细胞数/ml
[0136]
细胞存活率=活细胞数/(活细胞数+死细胞数)
×
100%
[0137]
将存活率大于90%的细胞悬液用匀浆法制备成2.0
×
107个/ml,于小鼠腋下皮下接种,0.2ml/只,制造s180肿瘤小鼠。肿瘤接种3天后,受试化合物组小鼠按照0.1ml/10g每日口服给定剂量的受试化合物或生理盐水,或者腹腔注射给定剂量的阿霉素,剂量如上所述,连续给药10天,共给药10次。第11天时乙醚麻醉后眼球取血,颈椎脱臼处死小鼠,然后钝性剥离肿瘤,并取小鼠各脏器称重,肿瘤及脏器重量以平均值
±
sd g表示。实验数据采用t检验和方差分析统计。
[0138]
实验结果
[0139]
202、202-s(bzl)和202-w的实验结果见表2。从结果中可以看出,在1μmol/kg/day剂量下,受试化合物均表现出良好的体内抗肿瘤活性,与ns相比,p<0.01。获得了意想不到的技术效果。
[0140]
表2 202、202-s(bzl)和202-w对肿瘤生长的影响
[0141][0142]
注:n=6。a:与ns相比,p<0.01。
[0143]
198、198-d、198-e和198-y的实验结果见表3。从结果中可以看出,在5μmol/kg/day剂量下,受试化合物均表现出良好的体内抗肿瘤活性,与ns相比,p<0.05。获得了意想不到的技术效果。
[0144]
表3 198、198-d、198-e和198-y对肿瘤生长的影响
[0145][0146]
注:n=6。a:与ns相比,p<0.05。
[0147]
实施例21dna嵌插作用评价
[0148]
实验操作
[0149]
将202、202-s(bzl)、202-w、198、198-d、198-e和198-y全部与dna进行了分子对接,并分析其结合能。
[0150]
实验结果
[0151]
实验结果见表4。从结果中看出,202、202-s(bzl)、202-w、198、198-d、198-e和198-y
[0152]
所有受试化合物均可与dna分子发生结合,化合物是通过dna分子嵌插的机制发挥的抗肿瘤活性,获得了意想不到的技术效果。
[0153]
表4 化合物与dna分子的结合能
[0154]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1