一种基于化学修饰mRNA编码蛋白因子诱导和/或增强软骨损伤修复的方法与流程
一种基于化学修饰mrna编码蛋白因子诱导和/或增强软骨损伤修复的方法
技术领域
1.本发明涉及骨关节炎技术领域,具体涉及一种基于化学修饰mrna编码蛋白因子诱导和/或增强软骨损伤修复的方法。
背景技术:
2.骨关节炎(osteoarthritis,oa)是一种以关节软骨的变性、破坏及骨质增生为特征的慢性关节病。骨关节炎中关节软骨的退化是由创伤性、退化性骨关节炎和类风湿骨引起的关节炎,是严重的医学问题,是我国第四大致残疾病和欧美第三大致残疾病。
3.目前,骨关节炎绝大部分的治疗方式是给予药物以控制疼痛并维持肿胀下降。但软骨继续被破坏,无法改变疾病进程,最终必须进行关节置换,这是临床治疗骨关节炎的痛点。
4.据研究报道,在关节表面受损后不久,与受损表面相邻的软骨细胞显示出少量的有丝分裂,并伴随着糖胺聚糖和胶原蛋白合成的增加,但软骨基质并没有明显增加,无法自我有效地修复缺损,这也是软骨先天的缺陷。所以,诱导和/或增强软骨损伤修复是骨关节炎病因治疗的关键。成熟的软骨细胞修复能力非常有限,且会失去终末分化功能,所以,具备分化的软骨细胞的人骨髓间充质干细胞(hmsc)进行软骨修复成为主要的治疗候选项。
5.转化生长因子
‑
β(transforming growth factor beta,简称tgf
‑
β)是一种多功能蛋白质,可以影响多种细胞的生长、分化、细胞凋亡及免疫调节等功能。研究人员发现tgf
‑
β家族通过腺病毒和逆转录病毒等病毒载体转染hmsc已显示出持续诱导软骨生成,同时避免了其因终末分化而丧失功能。但是,将腺病毒和逆转录病毒用于临床基因治疗会存在重大安全隐患,例如诱发严重过敏反应和恶性肿瘤。
6.因此,急需研究一种安全有效的用于临床基因治疗的方法,达到诱导和/或增强软骨损伤修复的目的。
技术实现要素:
7.本发明的目的在于针对现有技术中的不足,而提供一种基于化学修饰mrna编码蛋白因子诱导和/或增强软骨损伤修复的方法。
8.本发明的目的通过以下技术方案实现:
9.本发明提供一种基于化学修饰mrna编码蛋白因子诱导和/或增强软骨损伤修复的方法,包括以下步骤:
10.步骤一、以特异的dna模板合成编码tgf
‑
β家族中的至少一个蛋白因子的mrna;
11.步骤二、体外化学修饰该编码tgf
‑
β家族mrna;
12.步骤三、导入该编码tgf
‑
β家族的化学修饰mrna,并通过机体本身细胞或者转染人骨髓间充质干细胞以产生单个或者多个编码tgf
‑
β家族的蛋白因子。
13.上述技术方案中,步骤一中,所述dna模板含有特异的5’和3’非翻译区dna序列、信
号肽序列以及至少编码一个tgf
‑
β家族蛋白因子的mrna序列。
14.上述技术方案中,所述5’非翻译区序列如seq id no:1所示,所述3’非翻译区序列如seq id no:2所示,所述至少编码一个tgf
‑
β家族蛋白因子的mrna序列如seq id no:3所示。
15.上述技术方案中,所述tgf
‑
β家族包括tgf
‑
β1、tgf
‑
β2、tgf
‑
β3、bmp
‑
2、bmp
‑
6、bmp
‑
7、bmp
‑
10和fgf
‑
18蛋白因子。
16.上述技术方案中,步骤三中,采用局部注射的方式导入该编码tgf
‑
β家族的化学修饰mrna。
17.本发明的有益效果:
18.本发明的一种基于化学修饰mrna编码蛋白因子诱导和/或增强软骨损伤修复的方法,是通过化学修饰mrna表达tgf
‑
β家族中的至少一个蛋白因子,利用关节腔等局部注射方法导入该编码tgf
‑
β家族的化学修饰mrna,并通过机体本身细胞或者转染人骨髓间充质干细胞(hmsc)产生单个或者多个在软骨组织工程中的细胞分化、胶原合成和基质沉积中起关键作用的编码tgf
‑
β的蛋白因子,进而使该编码蛋白因子达到诱导和/或增强软骨损伤修复的目的。本发明通过实验证实了编码tgf
‑
β化学修饰mrna可以在293t细胞表达目标蛋白质,该编码tgf
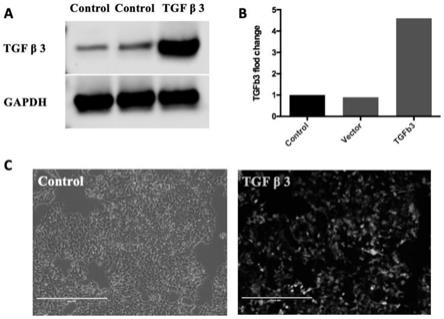
‑
β化学修饰mrna可以转染并促进人骨髓间充质干细胞3d培养增大,该编码tgf
‑
β化学修饰mrna可以成功诱导人msc细胞成软骨分化,更重要的是,从大体观测来看,各处理组的软骨缺损处修复效果相对于无填充组明显改善,其中hmsc和(编码tgf
‑
β3化学修饰mrna+hmsc)两组的修复效果比只用tgf
‑
β3处理的更好,可以证实编码tgf
‑
β化学修饰mrna具有诱导和/或增强软骨损伤修复的效果。故,本发明为治疗骨关节炎提供了一种安全有效的用于临床基因治疗的方法,在骨关节炎的治疗作用上具有重大意义,其具有广阔的应用前景。
附图说明
19.图1为本发明实施例的编码tgf
‑
β3化学修饰mrna在293t细胞表达的效果图。
20.图2为本发明实施例的编码tgf
‑
β3化学修饰mrna可以促进人骨髓间充质干细胞3d培养环境下生长的效果图。
21.图3为本发明实施例的编码tgf
‑
β3化学修饰mrna可以成功诱导人msc细胞成软骨分化的效果图。
22.图4为本发明实施例的大鼠软骨缺损后编码tgf
‑
β3化学修饰mrna+hmsc组修复大体解剖结果示意图。
具体实施方式
23.下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
24.本实施例的一种基于化学修饰mrna编码蛋白因子诱导和/或增强软骨损伤修复的方法,包括以下步骤:
25.步骤一、特异的dna模版的合成
26.1、编码tgf
‑
β家族蛋白因子的双链dna:
27.编码tgf
‑
β家族蛋白因子的双链dna:gblock,直接订购于美国idt公司,该dna序列(995bp)信息如下:
28.(1)t7启动子:taatacgactcactataggg。
29.(2)5’非翻译区序列:
30.aaataagagagaaaagaagagtaagaagaaatataagagccacc。
31.(3)tgf
‑
β3开放阅读框序列:
32.atgctgtccacttgcaccaccttggacttcggccacatcaagaagaagagggtggaagccattaggggacagatcttgagcaagctcaggctcaccagcccccctgagccaacggtgatgacccacgtcccctatcaggtcctggccctttacaacagcacccgggagctgctggaggagatgcatggggagagggaggaaggctgcacccaggaaaacaccgagtcggaatactatgccaaagaaatccataaattcgacatgatccaggggctggcggagcacaacgaactggctgtctgccctaaaggaattacctccaaggttttccgcttcaatgtgtcctcagtggagaaaaatagaaccaacctattccgagcagaattccgggtcttgcgggtgcccaaccccagctctaagcggaatgagcagaggatcgagctcttccagatccttcggccagatgagcacattgccaaacagcgctatatcggtggcaagaatctgcccacacggggcactgccgagtggctgtcctttgatgtcactgacactgtgcgtgagtggctgttgagaagagagtccaacttaggtctagaaatcagcattcactgtccatgtcacacctttcagcccaatggagatatcctggaaaacattcacgaggtgatggaaatcaaattcaaaggcgtggacaatgaggatgaccatggccgtggagatctggggcgcctcaagaagcagaaggatcaccacaaccctcatctaatcctcatgatgattcccccacaccggctcgacaacccgggccaggggggtcagaggaagaagcggtag。
33.(4)3’非翻译区序列:
34.gctgccttctgcggggcttgccttctggccatgcccttcttctctcccttgcacctgtacctcttggtctttgaataaagcctgagtaggaagt。
35.2、通过pcr添加mrna的poly
‑
(a)尾巴dna模版:
36.按照表1制备pcr预混液(总体积为200ul,八个反应各25ul)
37.表1.pcr预混液的组成
38.组分用量终浓度kapa prc mix(2x)100ul1x加尾引物
‑
f1 10um6ul0.3um加尾引物
‑
t120 10um6ul0.3um水80ul gblock dna 10ug/ul8ul40
‑
400pg/ul
39.加尾引物
‑
f1:5
′‑
ttggaccctcgtacagaagctaatacg
‑3′
。
40.加尾
‑
f2
‑
t120:
[0041]5‑
ttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttttcttcctactcaggctttatt caaagacca
‑
3。
[0042]
3、使用表2的条件展开pcr:
[0043]
表2.pcr条件
[0044]
循环次数变性退火扩展195℃,2
–
3min
ꢀꢀ2‑
3198℃,20s60℃,15s72℃,60s3272℃,3min
ꢀꢀ
[0045]
4、通过凝胶电泳检查pcr产物的质量。
[0046]
5、切胶回收pcr产物(qiaquick pcr purification kit,qiagen,cat.no.28106):将尾模板的最终浓度调整为100ng/ul,作为体外转录合成mrna模版。
[0047]
步骤二、体外转录合成mrna
[0048]
1、按照表3组装mrna帽结构和核苷酸混合物:
[0049]
帽子结构3
′‑
o
‑
me
‑
m7g(5
′
)ppp(5
′
)g rna cap analog(new england biolabs,cat.no.s1411s),
‑
methylcytidine
‑5′‑
triphosphate(me
‑
ctp;trilink,cat.no.n1014),pseudouridine
‑5’‑
triphosphate(pseudo
‑
utp;trilink,cat.no.n1019),其他组分均来自megascript t7试剂盒(ambion,cat.no.am1334)。
[0050]
表3.mrna帽结构
[0051][0052]
2、按照表4组装mrna体外转录体系:
[0053]
表3.mrna体外转录体系
[0054][0055]
3、将反应置于pcr仪器在37℃孵育3~6h。
[0056]
4、向每个样品中添加2ul turbo dnase(来自megascript t7试剂盒,ambion,cat.no.am1334)。
[0057]
5、轻轻混合并在37℃下孵育15min。
[0058]
6、使用megaclear试剂盒(ambion,cat.no.am1908),纯化经过dnase处理的反应;用总共100ul的洗脱缓冲液洗脱修饰的mrna(50ul的洗脱缓冲液洗脱两次)。
[0059]
7、使用磷酸酶(antarctic phosphatase(new england biolabs,cat.no.m0289s)处理纯化的修饰mrna。
[0060]
8、向每个样品(~100ul)中,添加11ul 10
×
磷酸酶缓冲液,然后添加2ul磷酸酶;轻轻混合样品并在37℃下孵育0.5~1h。
[0061]
9、洗脱后,在nanodrop分光光度计中测量修饰的mrna的浓度。预期的总产量应为~50ug(30~70ug范围;一次40ul ivt反应的100ul洗脱体积为300~700ng ul)。通过添加洗脱缓冲液或te缓冲液(ph 7.0),将浓度调节至100ng/ul。
[0062]
步骤三、编码tgf
‑
β3化学修饰mrna转染人骨髓间充质干细胞
[0063]
1、大鼠骨关节缺损模型
[0064]
采用3个月龄的无胸腺大鼠,使用腹膜内注射戊巴比妥麻醉,取仰卧位,显露膝关节,取髌骨上中线切口,牵开皮肤,进行内侧关节切开术切口,使髌骨向外侧移位,暴露膝关节股骨滑车,并在股骨滑车中线用钻孔器造成无法自愈的1.5x1.5 mm缺损。
[0065]
2、体外转染编码tgf
‑
β3化学修饰mrna
[0066]
原代人骨髓间充质干细胞,数量25万,在每分钟2500转的条件下,在0.5ml标准软骨形成培养基中离心5分钟,编码tgf
‑
β3化学修饰mrna,以pei转染,隐性对照组为编码gfp化学修饰mrna(gfp组),阳性对照组为tgf
‑
β3蛋白因子。培养14天后进行组织学形态和定量分析(h&e、safranin
‑
o、alcian blue、aggrecan,collagen ii染色)。
[0067]
3、将人骨髓间充质干细胞填充至大鼠骨关节缺损模型
[0068]
在上述人骨髓间充质干细胞微球体外3d培养14天后,填充于大鼠骨关节缺损处,在填充后行形态学,ct观测,分为3组,即:无填充对照组,编码tgf
‑
β3化学修饰mrna组(简称tgf
‑
β3组),编码tgf
‑
β3化学修饰mrna+人骨髓间充质干细胞微球组(简称编码tgf
‑
β3化学修饰mrna+hmsc组)。
[0069]
实验结果及分析:
[0070]
1、如图1所示,定量pcr,蛋白免疫印记和免疫荧光都证实了编码tgf
‑
β3化学修饰mrna可以在293t细胞表达目标蛋白质。
[0071]
图1中:
[0072]
a:编码tgf
‑
β3化学修饰mrna转染293t细胞后,收集细胞蛋白,进行蛋白免疫印记检测,提示编码tgf
‑
β3化学修饰mrna可以翻译为tgf
‑
β3,对照组为编码tgf
‑
β3的dna质粒载体;
[0073]
b:荧光定量pcr显示,编码tgf
‑
β3化学修饰mrna翻译的效率为对照组的5倍;
[0074]
c:细胞免疫荧光染色提示蛋白免疫印记检测定量显示,编码tgf
‑
β3化学修饰mrna在293t细胞表达,对照组为光学显微镜视野。
[0075]
2、如图2所示,编码tgf
‑
β3化学修饰mrna能成功转染至体外3d培养的人骨髓间充质干细胞(hmsc)微球内,并且cmrna
‑
tgf
‑
β3和tgf
‑
β3蛋白都能使bmscs微球的大小显著增大。
[0076]
图2中:
[0077]
a:编码绿色荧光蛋白即编码gfp化学修饰mrna可转染3d培养人骨髓间充质干细胞,图中cmrna(
‑
):未转染化学修饰mrna,bf:光学显微镜视野;cmrna(+):转染化学修饰mrna;
[0078]
b:定量gfp荧光分析提示,转染gfp组绿色荧光明显高于未转染组;
[0079]
c:编码tgf
‑
β3化学修饰mrna可以转染并促进人骨髓间充质干细胞3d培养增大,并同未转染组相比,增大效果更明显,cmrna(
‑
):未转染化学修饰rna,cmrna(+):转染化学修饰mrna,tgfb3蛋白因子处理为阳性对照;
[0080]
d:定量分析提示,编码tgf
‑
β3化学修饰mrna相比未处理组,可以显著促进人骨髓间充质干细胞的3d培养生长,同tgf
‑
β3蛋白因子处理的效果类似。
[0081]
3、如图3所示,he染色、免疫组化和sgag含量结果显示,编码tgf
‑
β3化学修饰mrna可以成功诱导人msc细胞成软骨分化,但编码tgf
‑
β3化学修饰mrna处理组软骨微球中sgag的含量相对于空白对照组和正对照处理组的显著增高。
[0082]
图3中:
[0083]
a:he染色、成软骨免疫组化结果显示,编码tgf
‑
β3化学修饰mrna可以成功诱导人msc细胞成软骨分化,cmrna(
‑
):未转染化学修饰rna,cmrna(+):转染化学修饰mrna,tgf
‑
β3蛋白因子处理为阳性对照;
[0084]
b:成软骨特异性指标sgag含量检测提示,编码tgf
‑
β3化学修饰mrna诱导人msc细胞的能力显著性高于未转染化学修饰rna组和tgf
‑
β3蛋白因子处理组。
[0085]
4、如图4所示,大体观测提示,各处理组的软骨缺损处修复效果相对于无填充组明显改善,但其中hmsc和编码tgf
‑
β3化学修饰mrna+hmsc两组的修复效果比只用tgf
‑
β3处理的更好,可以证实编码tgf
‑
β3化学修饰mrna具有诱导和/或增强软骨损伤修复的效果。
[0086]
图4中从上至下:
[0087]
第一组:大鼠软骨缺损后修复2周(2w),无处理组(control)软骨缺损无变化,胶原(collagen)+编码tgf
‑
β3化学修饰mrna组,胶原(collagen)+大鼠骨髓间充质干细胞(bmscs)组,胶原(collagen)+编码tgf
‑
β3化学修饰mrna+大鼠骨髓间充质干细胞(bmscs)组,均出现缺损缩小修复,但以胶原(collagen)+编码tgf
‑
β3化学修饰mrna+大鼠骨髓间充
质干细胞(bmscs)组为最佳;
[0088]
第二组:软骨缺损后修复4周(4w),无处理组(control)软骨缺损无变化,胶原(collagen)+编码tgf
‑
β3化学修饰mrna组,胶原(collagen)+大鼠骨髓间充质干细胞(bmscs)组,胶原(collagen)+编码tgf
‑
β3化学修饰mrna+大鼠骨髓间充质干细胞(bmscs)组,均出现缺损缩小修复,但以胶原(collagen)+编码tgf
‑
β3化学修饰mrna+大鼠骨髓间充质干细胞(bmscs)组为最佳;
[0089]
第三组:软骨缺损后修复6周(6w),无处理组(control)软骨缺损无变化,胶原(collagen)+编码tgf
‑
β3化学修饰mrna组,胶原(collagen)+大鼠骨髓间充质干细胞(bmscs)组,胶原(collagen)+编码tgf
‑
β3化学修饰mrna+大鼠骨髓间充质干细胞(bmscs)组,均出现缺损缩小修复,但以胶原(collagen)+编码tgf
‑
β3化学修饰mrna+大鼠骨髓间充质干细胞(bmscs)组为最佳。单纯胶原(collagen)处理缺损亦无明显变化。
[0090]
以上所举实施例为本发明的较佳实施方式,仅用来方便说明本发明,并非对本发明作任何形式上的限制,任何所属技术领域中具有通常知识者,若在不脱离本发明所提技术特征的范围内,利用本发明所揭示技术内容所作出局部更动或修饰的等效实施例,并且未脱离本发明的技术特征内容,均仍属于本发明技术特征的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1