一株防治水稻纹枯病的生防菌株苏云金芽孢杆菌FJ2B-25
一株防治水稻纹枯病的生防菌株苏云金芽孢杆菌fj2b
‑
25
技术领域
1.本发明属于植物病害生物防治技术领域,具体涉及一株防治水稻纹枯病的生防菌株苏云金芽孢杆菌fj2b
‑
25。
背景技术:
2.水稻是世界上种植面积最大的作物,同时也是我国第一大农作物和最主要的粮食作物。但是水稻病虫害的发生导致产量和品质的下降,其中一种重要的病害是水稻纹枯病。该病害在全球都有分布,具有很强的致病性,流行频率也非常高,因此给全球的水稻生产造成了严重危害。水稻纹枯病由立枯丝核菌(rhizoctonia solani)引起,该菌的有性阶段为担子菌门的瓜亡革菌(thanatephorus cucumeris donk)。立枯丝核菌(rhizoctonia solani)不产生无性孢子,以菌丝或菌核的形式存在并作为下一次侵染的初侵染源。特别重要的是其产生的菌核可以在土壤中越冬并长期存活,从而导致其成为一种顽固的土壤习居菌。水稻对纹枯病的抗性属于水平抗病性,因此难以找到可用于生产的抗性很强的品种。目前防治水稻纹枯病的有效手段仍然是利用化学农药杀灭该病原菌。尽管化学防治有效,但是其也有很多负面影响,例如:对人畜产生毒副作用、污染土壤环境、致病原菌产生抗性、以及产生农药残留等一系列问题。这些负面影响将成为有效推行绿色环保种植方式以及农业可持续发展的障碍。因此,制订一套安全有效且绿色环保的水稻纹枯病防治措施成为当务之急。前人研究发现利用有益微生物防治纹枯病病原菌是代替化学农药的一种安全有效的途径。目前已经发现了一些对水稻纹枯病有防治效果的真菌、细菌和放线菌,然而这些菌在使用中都有一定的局限性。此外,利用微生物组控制病害也是目前研究的热点之一,而人为制备微生物组则需要更多的微生物资源。因此筛选更多的生防菌来用于水稻纹枯病的微生物防治显的尤为重要。
技术实现要素:
3.本发明的目的在于针对化学防治水稻纹枯病产生危害和微生物源农药不足等问题,提供一株从水稻田土壤中分离筛选出的防治水稻纹枯病的生防菌株苏云金芽孢杆菌fj2b
‑
25。
4.为实现上述目的,本发明采用如下技术方案:一株防治水稻纹枯病的生防菌株苏云金芽孢杆菌fj2b
‑
25,所述苏云金芽孢杆菌fj2b
‑
25,其分类命名为苏云金芽孢杆菌(bacillus thuringensis),已保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所;保藏日期为2021年3月15日,保藏号为cgmcc no.22014。
5.一株防治水稻纹枯病的生防菌剂,所述生防菌剂包含生防菌株苏云金芽孢杆菌fj2b
‑
25或生防菌株苏云金芽孢杆菌fj2b
‑
25的无菌体发酵液。
6.上述生防菌株苏云金芽孢杆菌fj2b
‑
25的无菌体发酵液的制备方法,包括以下步骤:
(1)将生防菌苏云金芽孢杆菌fj2b
‑
25接种到无菌的lb液体培养基中37 ℃,180 r/min活化振荡培养12 h,获得活化菌液;(2)取1 μl步骤(1)的活化菌液转接到50 ml lb液体培养基中,37 ℃ ,180 r/min 振荡培养24 h;(3)收集步骤(2)培养所得菌液,8,000 r/min离心10 min,0.22 μm无菌滤膜过滤上清液除去菌体,获得无菌体发酵液。
7.上述lb液体培养基组分为:1% tryptone、0.5% yeast extract 、0.5% nacl,余量为蒸馏水。
8.上述一株防治水稻纹枯病的生防菌株苏云金芽孢杆菌fj2b
‑
25在抑制立枯丝核菌(rhizoctonia solani)中的应用。
9.上述一株防治水稻纹枯病的生防菌剂在水稻纹枯病防治中的应用。
10.本发明的有益效果:本发明筛选出的防治水稻纹枯病的生防菌株fj2b
‑
25及其无菌发酵液对水稻纹枯病病原菌立枯丝核菌(rhizoctonia solani)具有显著的抑制作用。该菌株分离筛选自水稻根际土壤,与土壤生态和谐相容,作为生物制剂,没有化学农药使用带来的一系列毒副作用、药物残留等问题;在有效防治水稻纹枯病的同时,能显著减少农业污染,改善土壤环境。该菌株的培养条件简单,易于保存,易于工业化生产,使其成为一种理想的生防菌剂。
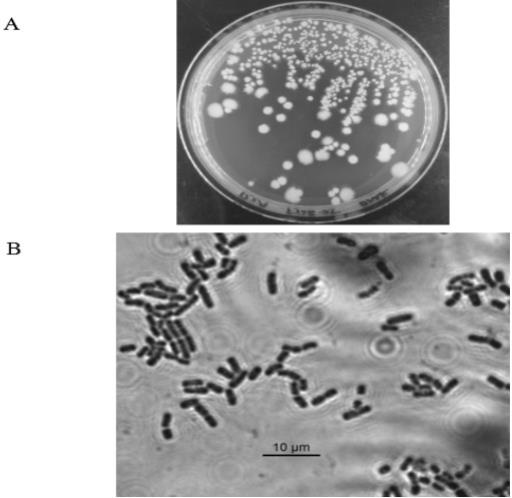
11.附图说明:图1 细菌菌株fj2b
‑
25的菌落形态及其革兰氏染色。a:为细菌菌株fj2b
‑
25的菌落形态图;b:为细菌菌株 fj2b
‑
25的革兰氏染色图。
12.图2 细菌菌株fj2b
‑
25的16s rdna序列系统发育树。
13.图3 细菌菌株fj2b
‑
25与水稻纹枯病病原菌立枯丝核菌(rhizoctonia solani)gd
‑
118的对峙培养。a:细菌菌株与水稻纹枯病病原菌立枯丝核菌(rhizoctonia solani)gd
‑
118对峙培养的菌落形态图;b:细菌菌株与水稻纹枯病病原菌立枯丝核菌(rhizoctonia solani)gd
‑
118对峙培养时抑菌带宽的柱形图。
14.图4 细菌菌株fj2b
‑
25的无菌发酵液对水稻纹枯病病原菌立枯丝核菌(rhizoctonia solani)gd
‑
118生长的抑制作用。a:水稻纹枯病病原菌立枯丝核菌(rhizoctonia solani)gd
‑
118在含细菌菌株fj2b
‑
25无菌发酵液和无菌水作为对照的pda培养基的菌落形态;b:水稻纹枯病病原菌立枯丝核菌(rhizoctonia solani)gd
‑
118在含细菌菌株fj2b
‑
25无菌发酵液和无菌水作为对照的pda培养基的菌落直径的统计分析。
15.图5 fj2b
‑
25菌株无菌发酵液对立枯丝核菌(rhizoctonia solani)菌核萌发和菌丝生长的影响。a:fj2b
‑
25菌株无菌发酵液和无菌水处理后立枯丝核菌(rhizoctonia solani)菌核萌发的形态图;b:fj2b
‑
25菌株无菌体发酵液和无菌水处理后立枯丝核菌(rhizoctonia solani)菌核萌发菌丝指数的统计。
具体实施方式
16.下面结合具体实施例对本发明做进一步描述,在此发明的示意性实施例以及说明用来解释本发明,但并不作为对本发明的限定。
17.实施例1 菌株的分离与鉴定
培养基培养2 d 的水稻纹枯病病原菌取 5 mm直径的菌饼,接种于新的 pda 培养基一端直径三分之一的地方,同时取10 μl活化后均匀的fj2b
‑
25菌液接种在同一pda平板的另一端直径三分之一的地方,以加10 μl灭菌水作为对照,两者与中心点对称。待菌液干燥后,密封放于29 ℃恒温培养箱,每隔两小时观察菌丝生长情况,并测抑菌圈直径大小。如图3 显示:与对照组相比,菌株fj2b
‑
25对立枯丝核菌(rhizoctonia solani)的平均抑菌带宽为7.61 mm,有明显的抑菌带,对照组与处理组数据间具有显著性差异,表明菌株fj2b
‑
25的抑制效果显著。实施例 3:本发明分离的菌株发酵物无菌体滤液对立枯丝核菌(rhizoctonia solani)生长和菌核萌发的影响首先将fj2b
‑
25菌株接种于装有3 ml lb液体培养基(1% tryptone、0.5% yeast extract、0.5% nacl,余量为蒸馏水)的试管中;然后37 ℃,180 r/min摇床培养12 h;接下来取1 ml菌液接种到装有50 ml lb液体培养基的摇瓶中,37 ℃,180 r/min摇床培养24 h;随后装到50 ml无菌离心管中,4 ℃,8,000 r/min离心10 min去除菌体,用0.22 μm无菌滤膜过滤上清液除去菌体,分装于无菌管中,获得fj2b
‑
25菌株的无菌体发酵液。
22.取 1 ml fj2b
‑
25菌株无菌体发酵液加入到9 ml灭菌后冷却至45 ℃还未冷凝的pda固体培养基中,混匀,倒板;在平板中央接种5 mm直径的水稻纹枯病病原菌立枯丝核菌(rhizoctonia solani)gd
‑
118菌饼,同时取1 ml无菌水加入到9 ml灭菌后冷却至45 ℃还未冷凝的的pda培养基中混匀后倒板,作为对照。29 ℃恒温培养,每隔四小时测一次菌丝生长直径。每个处理包括三次重复,整个实验重复三次。结果显示:对照组和经过fj2b
‑
25菌株无菌体滤液处理后立枯丝核菌(rhizoctonia solani)的生长直径分别为55.7 mm和40.7 mm,对照组与处理组数据间具有显著性差异。根据抑菌率公式:抑菌率(%)得出fj2b
‑
25菌株的抑菌率为29.59%,菌株fj2b
‑
25对水稻纹枯病病原菌立枯丝核菌(rhizoctonia solani)菌丝的生长有明显的抑制效果(图4)。
23.分析细菌菌株fj2b
‑
25的发酵物无菌体滤液对菌核萌发的抑制作用:在pda培养基上培养水稻纹枯病病原菌立枯丝核菌(rhizoctonia solani)gd
‑
118,长出菌核后,用镊子挑选大小基本相同,无任何污染的菌核,然后将其放在无菌水中清洗干净,去掉生长的菌丝,再用无菌滤纸擦净,室温晾干。取fj2b
‑
25菌株无菌体发酵液在超净台上倒于无菌培养皿中,将预处理好的菌核浸泡在fj2b
‑
25菌株无菌体发酵液中以及对照组的无菌水中,室温浸泡30 min。然后取出菌核,放在滤纸晾干;接下来将其接种在pda平板上,每板均匀接种四个菌核,最后放于29 ℃培养,每隔半小时取出,放于显微镜下观察菌核上菌丝生长情况,统计萌发菌丝级数。萌发菌丝分级标准:0级,菌丝萌发数为1根;1级菌丝萌发数为1~20根;2级,萌发菌丝数为21~50根;3级,萌发菌丝数为51~80根;4级,萌发菌丝数为81~140根;5级,萌发菌丝数为141根以上。每个处理包括三次重复,整个实验重复三次。根据萌发菌丝指数公式计算菌丝萌发指数:萌发菌丝指数=∑(各级萌发菌丝级数
×
各级代表值)/(调查总数
×
最高级代表值)
×
100。结果如图5显示:对照组和经过fj2b
‑
25菌株的无菌体发酵液处理的立枯丝核菌(rhizoctonia solani)gd
‑
118菌核萌发菌丝指数分别为71.67%和33.33%,对照组与处理组数据间具有显著性差异。由此可见与对照组相比,经过菌
株fj2b
‑
25菌株的无菌体发酵液处理导致立枯丝核菌(rhizoctonia solani)的菌核萌发菌丝指数显著降低。同时菌株fj2b
‑
25的无菌体发酵液对立枯丝核菌(rhizoctonia solani)gd
‑
118菌核菌丝的生长有显著的抑菌效果。综上所述,fj2b
‑
25菌株的无菌体发酵液能抑制立枯丝核菌(rhizoctonia solani)菌核的萌发和生长。
24.以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1