一种Piezo1基因敲除的肾小球旁细胞系及其构建方法
一种piezo1基因敲除的肾小球旁细胞系及其构建方法
技术领域
1.本发明属于生物技术领域,具体涉及一种piezo1基因敲除的肾小球旁细胞系及其构建方法。
背景技术:
2.高血压病是最常见的心血管疾病诱因,其发病率和死亡率在全球范围内呈上升的趋势。肾素(renin)是由肾小球旁器(juxtaglomerular apparatus)分泌的一种天冬氨酸蛋白酶,主要生理作用是将肾素原分解为血管紧张素ⅰ,renin是肾素
‑
血管紧张素(raas)轴中的关键限速酶。既往的大量研究证实raas系统过度激活与高血压的发生有密切的关系,因此renin的合成与分泌对机体血压调控有重要作用,是重要的抗高血压药物靶点。
3.研究表明球旁细胞合成及分泌renin的过程是通过入球小动脉血流压力调控。血压下降触发肾素的分泌,进一步导致血管紧张素ⅱ引起的血压升高,反之,血压升高会抑制肾素的分泌。传入小动脉血压与肾素分泌之间的反向关系构成一个负反馈,调控机体血压的稳定。然而到目前为止,肾小球旁细胞如何感受血流压力以及其具体的作用机制依然不清楚。piezo1作为一种新型的机械敏感性离子通道蛋白,在细胞感受机械应力过程中发挥重要作用。研究piezo1在球旁细胞中的表达及调控renin合成作用及相关机制进行研究,对调控球旁细胞renin合成有重要的意义,为高血压疾病治疗及抗高血压药物开发提供新的策略。为达到此目的,首先考虑是建立一株稳定干扰piezo1表达的细胞株,这样才能更好的对其下游表达及功能进行研究。目前用于体外实验针对piezo1功能的方法,例如干预其基因表达,多采用小干扰rna(small interfering rna,sirna)、短发夹rna(short hairpin rna,shrna),或者采用piezo1抑制剂的方法。
4.sirna是一种长度约20~25个核苷酸的双链rna,其干扰靶基因表达需要dicer酶和rna诱导的沉默复合体(rna
‑
induced silencing complex,risc)等参与。shrna包括两个短反向重复序列,将其克隆到shrna表达载体中,通过与mirna的加工相同的rnai机制,shrna被加工成sirna。使用细菌或病毒载体,shrna可以被导入靶细胞的细胞核内,shrna通过细胞内一系列加工形成在两个3’末端带有两个游离碱基的20
‑
25nt的双链sirna。这一有活性的sirna随后被整合到risc上,从而发挥干扰作用。但sirna以及shrna干扰技术对基因表达的调控是在转录层面实现,其主要缺点是干扰效率低,干扰持续时间有限,干扰效果不稳定等。
5.此外,piezo1的抑制剂也是干扰其功能的途径之一。目前常用的piezo1抑制剂有dooku1,钌红(ruthenium red,rr),gsmtx4,gd
3+
等。其中dooku1是目前发现的唯一具有选择性的piezo通道抑制剂,除此之外其余抑制剂都会对除piezo外的其他离子通道产生影响。如rr同时对trpv和piezo通道有抑制作用,gsmtx4对piezo和trpc类型的离子通道同时有抑制作用,而gd
3+
则是一种非选择性的钙离子通道抑制剂。因此,使用抑制剂进行piezo1的干扰实验显然具有不可避免的缺陷,从而限制了其使用。
技术实现要素:
6.本发明第一方面的目的,在于提供一种sgrna。
7.本发明第二方面的目的,在于提供编码本发明第一方面的sgrna的核酸分子。
8.本发明第三方面的目的,在于提供包含本发明第二方面的核酸分子的表达盒、重组载体或转基因细胞系。
9.本发明第四方面的目的,在于提供一种crispr/cas9系统。
10.本发明第五方面的目的,在于提供本发明第一方面的sgrna的应用。
11.本发明第六方面的目的,在于提供本发明第二方面的核酸分子的应用。
12.本发明第七方面的目的,在于提供本发明第三方面的表达盒、重组载体或转基因细胞系的应用。
13.本发明第八方面的目的,在于提供本发明第四方面的crispr/cas9系统的应用。
14.本发明第九方面的目的,在于提供一种piezo1基因敲除的细胞系的构建方法。
15.本发明第十方面的目的,在于提供一种piezo1基因敲除的细胞系。
16.本发明第十一方面的目的,在于提供本发明第十方面的细胞系在药物筛选中的应用。
17.本发明第十二方面的目的,在于提供本发明第十方面的细胞系在制备药物筛选试剂盒中的应用。
18.为了实现上述目的,本发明所采取的技术方案是:
19.本发明的第一个方面,提供一种sgrna,所述sgrna的靶序列为小鼠第8号染色体第122502249~122502271个碱基。
20.优选地,所述sgrna的序列为:5
’‑
tagatgctgccccagccgtg
‑3’
。
21.本发明的第二个方面,提供编码本发明第一方面的sgrna的核酸分子。
22.本发明的第三个方面,提供包含本发明第二方面的核酸分子的表达盒、重组载体或转基因细胞。
23.所述表达盒,是指能够在宿主细胞中表达所述sgrna的dna,该dna不但可包括启动所述sgrna的编码基因转录的启动子,还可包括终止编码基因转录的终止子。
24.优选地,所述表达盒还可包括增强子序列。
25.优选地,所述转基因细胞不包括繁殖材料。
26.本发明的第四个方面,提供一种crispr/cas9系统,包含本发明第一方面的sgrna。
27.优选地,所述crispr/cas9系统还包含cas9。
28.本发明的第五个方面,提供第一方面的sgrna在(1)~(6)中任一项中的应用;
29.(1)特异性识别piezo1基因;
30.(2)敲除piezo1基因;
31.(3)构建piezo1基因敲除的细胞系;
32.(4)制备用于构建piezo1基因敲除的细胞系的产品;
33.(5)构建piezo1基因敲除的动物模型;
34.(6)制备用于构建piezo1基因敲除的动物模型的产品。
35.优选地,所述应用为非疾病诊断和治疗目的的应用。
36.优选地,所述细胞系不包括繁殖材料。
37.本发明的第六个方面,提供第二方面的核酸分子在(1)~(6)中任一项中的应用;
38.(1)特异性识别piezo1基因;
39.(2)敲除piezo1基因;
40.(3)构建piezo1基因敲除的细胞系;
41.(4)制备用于构建piezo1基因敲除的细胞系的产品;
42.(5)构建piezo1基因敲除的动物模型;
43.(6)制备用于构建piezo1基因敲除的动物模型的产品。
44.优选地,所述应用为非疾病诊断和治疗目的的应用。
45.优选地,所述细胞系不包括繁殖材料。
46.本发明的第七个方面,提供第三方面的表达盒、重组载体或转基因细胞在(1)~(6)中任一项中的应用;
47.(1)特异性识别piezo1基因;
48.(2)敲除piezo1基因;
49.(3)构建piezo1基因敲除的细胞系;
50.(4)制备用于构建piezo1基因敲除的细胞系的产品;
51.(5)构建piezo1基因敲除的动物模型;
52.(6)制备用于构建piezo1基因敲除的动物模型的产品。
53.优选地,所述应用为非疾病诊断和治疗目的的应用。
54.优选地,所述细胞系不包括繁殖材料。
55.本发明的第八个方面,提供第四方面的crispr/cas9系统在(1)~(6)中任一项中的应用;
56.(1)特异性识别piezo1基因;
57.(2)敲除piezo1基因;
58.(3)构建piezo1基因敲除的细胞系;
59.(4)制备用于构建piezo1基因敲除的细胞系的产品;
60.(5)构建piezo1基因敲除的动物模型;
61.(6)制备用于构建piezo1基因敲除的动物模型的产品。
62.优选地,所述应用为非疾病诊断和治疗目的的应用。
63.优选地,所述细胞系不包括繁殖材料。
64.本发明的第九个方面,提供一种piezo1基因敲除的细胞系的构建方法,采用本发明第四方面的crispr/cas9系统敲除所述细胞系的piezo1基因。
65.优选地,所述构建方法为:将本发明第四方面的crispr/cas9系统导入所述细胞系。
66.优选地,所述细胞系不包括繁殖材料,进一步为肾小球旁细胞系。
67.优选地,一种piezo1基因敲除的肾小球旁细胞系的构建方法,包括如下步骤:
68.s1:根据第一方面的sgrna分别合成单链dna oligo,将合成的单链dna oligo变性,退火,形成双链;
69.s2:将s1得到的双链与慢病毒载体连接,得到重组表达载体;
70.s3:将s2得到的重组表达载体、cas载体共转染肾小球旁细胞,得到piezo1基因敲
除的肾小球旁细胞系。
71.优选地,所述构建方法还包括如下步骤:筛选、扩培、鉴定。
72.优选地,步骤s2中所述慢病毒载体为plenti
‑
u6
‑
spgrna v2.0
‑
cmv
‑
egfp
‑
wpre。
73.优选地,所述cas载体为cas9载体;进一步为lenticrisper v2。
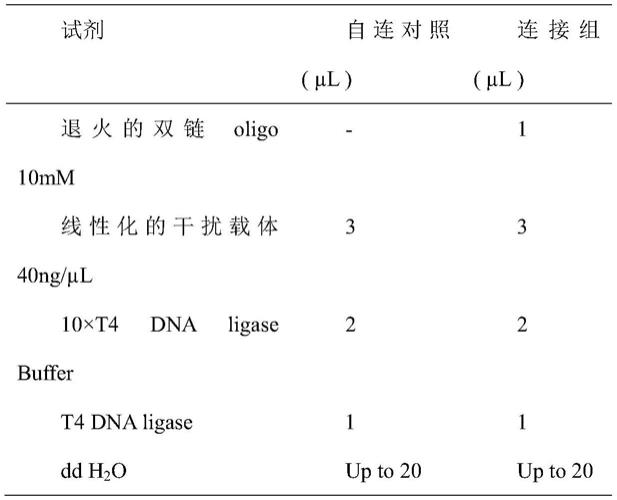
74.优选地,所述共转染的方法包括但不限于电击转染法、脂质体转染法、pei转染法和磷酸钙转染法;进一步为脂质体转染法。
75.优选地,所述肾小球旁细胞的汇合度大于等于50%。
76.优选地,所述肾小球旁细胞为as4.1细胞。
77.本发明的第十个方面,提供一种piezo1基因敲除的细胞系,通过本发明第九方面的构建方法得到。
78.优选地,所述细胞系不包括繁殖材料,进一步为肾小球旁细胞系。
79.本发明的第十一个方面,提供本发明第十方面的细胞系在药物筛选中的应用。
80.优选地,所述药物用于调控血浆肾素释放及机体血压。
81.优选地,所述应用为非疾病诊断和治疗目的的应用。
82.本发明的第十二个方面,提供本发明第十方面的细胞系在制备药物筛选试剂盒中的应用。
83.优选地,所述药物用于调控血浆肾素释放及机体血压。
84.本发明的有益效果是:
85.本发明提供了一种sgrna,该sgrna的靶序列为小鼠第8号染色体第122502249~122502271个碱基;该sgrna可用于特异性识别piezo1基因、敲除piezo1基因、构建piezo1基因敲除的细胞系、制备用于构建piezo1基因敲除的细胞系的产品、构建piezo1基因敲除的动物模型、制备用于构建piezo1基因敲除的动物模型的产品,尤其在构建piezo1基因敲除的细胞系时,相对传统文献报道的shrna干扰方法主要集中在转录层面进行调控的特点,该sgrna可以从基因组层面对靶基因piezo1表达进行调控,显著提高piezo1基因的抑制效率。
86.本发明还提供了一种crispr/cas9系统,包含上述sgrna,该crispr/cas9系统可用于特异性识别piezo1基因、敲除piezo1基因、构建piezo1基因敲除的细胞系、制备用于构建piezo1基因敲除的细胞系的产品、构建piezo1基因敲除的动物模型、制备用于构建piezo1基因敲除的动物模型的产品,尤其在构建piezo1基因敲除的细胞系时,相对传统文献报道的shrna干扰方法主要集中在转录层面进行调控的特点,该crispr/cas9系统可以从基因组层面对靶基因piezo1表达进行调控,显著提高piezo1基因的抑制效率。
87.本发明还提供一种piezo1基因敲除的细胞系的构建方法及细胞系,该构建方法得到细胞系中piezo1基因的抑制效率显著高于传统的通过shrna干扰构建的方法,该构建方法得到细胞系可用于药物筛选。
附图说明
88.图1是实施例1中piezo1敲除肾小球旁细胞系构建技术路线图。
89.图2是plenti
‑
u6
‑
spgrna v2.0
‑
cmv
‑
egfp
‑
wpre表达载体图谱。
90.图3是as4.1
‑
piezo1
wt
及as4.1
‑
piezo1
ko
中piezo1蛋白表达水平的免疫印迹图。
91.图4是as4.1
‑
piezo1
wt
及as4.1
‑
piezo1
ko
中piezo1蛋白表达水平的免疫荧光图。
92.图5是as4.1
‑
piezo1
wt
及as4.1
‑
piezo1
ko
对yoda1引起钙离子变化的结果图:其中,(a)是as4.1
‑
piezo1
wt
及as4.1
‑
piezo1
ko
对yoda1引起钙离子变化的时间依赖曲线图;(b)是as4.1
‑
piezo1
wt
及as4.1
‑
piezo1
ko
对yoda1引起钙离子变化的钙离子峰值差异;****表示p<0.0001。
93.图6是不同构建方法得到的piezo1基因敲除细胞系中piezo1mrna表达量的结果图:****表示p<0.0001;**表示p<0.01;*表示p<0.05。
具体实施方式
94.以下通过具体的实施例对本发明的内容作进一步详细的说明。
95.本实施例中所采用的原料,除特殊说明外,均通过常规手段制备或者通过商业渠道购买。
96.作为基因编辑技术之一的crispr/cas9技术,是从基因组层面对靶基因表达进行调控的新技术。其实验原理及载体描述:crispr/cas9是一种能够对任何物种基因组的特定位点进行精确编辑的技术,使用该技术能够进行细胞水平单基因或多基因敲除;其原理是核酸内切酶cas9蛋白通过导向性rna(guide rna,grna)识别特定基因组位点并对双链dna进行切割。crispr/cas9表达载体可向细胞导入cas9蛋白和sgrna序列表达框,从而实现对目的基因的敲除;本实施例使用的质粒plenti
‑
u6
‑
spgrna v2.0
‑
cmv
‑
egfp
‑
wpre图谱如图2所示。
97.为了采用crisper/cas9技术靶向敲除肾小球旁细胞系as4.1中piezo1基因,本发明合成了特异性sgrna,其碱基序列为5
’‑
tagatgctgccccagccgtg
‑3’
(seq id no.1)所示;进一步的,本发明构建了含有特异性靶向piezo1基因的sgrna表达载体,从而成功构建出基于crisper/cas9技术靶向敲除小鼠piezo1基因的肾小球旁细胞系as4.1
‑
piezo1
ko
。
98.实施例1
99.根据小鼠的piezo1基因设计sgrna 序列,安排引物合成单链oligo;将单链的引物退火成双链oligo序列,连接入bsmb i酶切线性化的表达载体。菌落pcr筛选转化子,筛选的阳性克隆进行测序验证。测序验证正确的克隆,进行高纯度质粒抽提。技术路线图如图1所示,实验步骤如下:
100.1)sgrna设计及合成:在genebank中找到小鼠piezo1基因的序列gene id:234839,该基因有2个转录本:nm_001037298.1,nm_001357349.1,选择公共区域设计潜在靶点;通过在线设计软件(https://zlab.bio/guide
‑
design
‑
resources)及grna设计原则进行设计并对sgrna在基因组中的位置及脱靶效率进行加权筛选,择优选择sgrna序列如下:5
’‑
tagatgctgccccagccgtg
‑3’
(seq id no.1)。
101.2)引物退火形成带粘性末端的双链片段:将合成好的oligo(oligo
‑
f:accgtagatgctgccccagccgtg,seq id no.2;oligo
‑
r:aaaccacggctggggcagcatcta,seq id no.3)用oligo annealing buffer溶解成20μm,互补单链各取30μl混合;然后将oligo混合物在水浴锅中95℃加热5min,然后水浴锅开盖置室温中自然冷却至室温,形成双链oligo片段;取1μl用于后续的连接反应,其余
‑
20℃保存。
102.3)线性化表达载体的制备:用限制性内切酶bsmb i对表达载体进行酶切,酶切反应体系为:质粒(plenti
‑
u6
‑
spgrna v2.0
‑
cmv
‑
egfp
‑
wpre)2μg,10x反应buffer 5μl,限制
性内切酶bsmb i 1μl,去离子水补足50μl,于37℃水浴锅中孵育2h以上。酶切产物进行琼脂糖凝胶电泳检测酶切效果,并把目的载体条带从琼脂糖凝胶电泳后的胶中割下来,用takara minibest agarose gel dna extraction kit ver.3.0做胶回收,具体步骤参考试剂盒说明书。
103.4)干扰片段连接入表达载体:连接反应体系如表1所示,于16℃连接过夜。
104.表1连接反应体系
[0105][0106]
5)感受态细胞的转化。
[0107]
6)菌落pcr鉴定阳性转化子。
[0108]
7)脂质体转染细胞:培养生长状态良好的as4.1肾小球旁细胞,质粒转染前一天铺板,约3
×
105个细胞接种于6孔板,37℃、5%co2环境下继续培养细胞,待细胞汇合度达50%进行转染;转染当天,使用lipo3000配制转染复合物,分别加入1ug plenti
‑
u6
‑
piezo1
‑
spgrnav2.0
‑
cmv
‑
egfp
‑
wpre及lenticrisper v2表达质粒进行转染实验;12h后观察细胞状态,无明显细胞毒性,继续培养细胞至24h,随后更换新鲜的完全培养基;转染后4天使用5ug/mlpuromycin筛选,筛选持续4天;荧光显微镜下观察gfp表达情况,荧光率达80%以上,收集细胞使用流式细胞仪进行分选,将单克隆接种到96孔板进行培养,每2天换液。
[0109]
8)验证:扩培单克隆,然后收集单克隆细胞,抽提细胞总蛋白,检测piezo1蛋白表达水平(anti
‑
piezo1 antibody,alomone lab,#apc
‑
087),内参基因选择gapdh(anti
‑
gapdh antibody,cst,#hrp
‑
60004),同时,以相同方法检测野生型as4.1细胞系(as4.1
‑
piezo1
wt
)中piezo1蛋白表达水平,结果显示敲除细胞系piezo1蛋白表达缺失(结果参见图3)。即获得piezo1基因敲除的细胞系(as4.1
‑
piezo1
ko
)。
[0110]
实施例2
[0111]
免疫荧光检测实施例1所得piezo1基因敲除的细胞系as4.1
‑
piezo1
ko
中piezo1表达,步骤如下:
[0112]
1)24孔板提前放入12mm圆形盖玻片,接种约5
×
104个细胞,培养至汇合度50%,加4%多聚甲醛(pfa)300ul/孔,室温固定10分钟。
[0113]
2)1ml/孔pbs洗去残留pfa,重复2次;加入0.1%triton x
‑
100 300ul/孔,室温10分钟,对细胞进行通透处理。
[0114]
3)1ml/孔pbs洗去残留triton x
‑
100,重复2次;加入5%bsa 300ul/孔,室温封闭1小时。
[0115]
4)吸去孔内液体,加入5%bsa 300ul配制的一抗稀释液(anti
‑
piezo1,alomonelab,1:100),室温孵育2小时。
[0116]
5)加入1ml/孔pbst(0.1%吐温20,pbs)洗去残留一抗,重复3次;加入5%bsa 300ul配制的二抗稀释液(山羊抗兔alexa
‑
488,invitrogen,1:100),室温孵育1小时。
[0117]
6)加入1ml/孔pbst(0.1%吐温20,pbs)洗去残留二抗,重复3次;加入一滴封片剂(invitrogen),室温避光放置1小时。
[0118]
7)共聚焦显微镜成像,以相同方法检测野生型as4.1细胞系(as4.1
‑
piezo1
wt
,即未敲除piezo1基因的as4.1细胞)中piezo1表达,收集结果,如图4所示:敲除细胞系piezo1蛋白表达缺失,即piezo1基因敲除的细胞系(as4.1
‑
piezo1
ko
)构建成功。
[0119]
实施例3
[0120]
钙离子荧光探针(fluo
‑
4 am)试剂检测实施例1所得piezo1基因敲除细胞系as4.1
‑
piezo1
ko
对激动剂yoda1引起的钙离子透过性变化。步骤如下:
[0121]
1)as4.1
‑
piezo1
wt
,as4.1
‑
piezo1
ko
肾小球旁细胞分别接种于96孔板,每种细胞4各孔,每孔接种1.5
×
104个细胞,置于5%co2培养箱培养过夜。
[0122]
2)按照fluo4
‑
am试剂说明书配制指示剂工作液,以及piezo1激动剂yoda1(20um)溶液。
[0123]
3)待96孔板内细胞汇合度>90%,吸去孔内液体,pbs清洗1次,加入fluo4
‑
am工作液100ul/孔,放入37℃孵育30min,随后放入室温孵育30min。
[0124]
4)吸去孔内液体,选择酶标仪484nm/525nm波长检测各孔细胞内钙离子基线值,随后迅速加入激动剂yoda1溶液,相同波长记录细胞内钙离子水平变化。结果如图5所示,piezo1敲除肾小球旁细胞对其激动剂yoda1引起的细胞内钙离子升高有显著的抑制。
[0125]
对比例1
[0126]
荧光定量pcr(qpcr)对比piezo1敲除细胞系as4.1
‑
piezo1
ko
中与as4.1
‑
shpiezo1干扰细胞系中的piezo1 mrna表达水平差异。as4.1
‑
shpiezo1细胞系构建方法参考已发表文献nat commun.2017;8:1797。其中干扰序列为:5
’‑3’
:tcggcgcttgctagaacttca(seq id no.4)。
[0127]
1)as4.1
‑
piezo1
wt
,as4.1
‑
piezo1
ko
与as4.1
‑
shpiezo1细胞分别接种于六孔板,每孔接种5
×
105个细胞,置于5%co2培养箱培养过夜。
[0128]
2)第二天,trizol
‑
乙醇沉淀提取三种对比细胞的总rna,并使用500ng进行反转录,得到cdna。
[0129]
3)sybr green master mix配制qpcr反应溶液,使用piezo1特异性引物检测三种细胞中piezo1的表达水平,gapdh表达水平作为相对变化的对照。两种基因的引物序列分别为:piezo1:正向引物(5
’‑3’
):gtcatggactgggtgtggac(seq id no.5),反向引物(5
’‑3’
):tgggctgggggtatttcttc(seq id no.6);gapdh:正向引物(5
’‑3’
):ggagagtgtttcctcgtccc(seq id no.7),反向引物(5
’‑3’
):actgtgccgttgaatttgcc(seq id no.8)。
[0130]
4)根据公式:相对表达水平=2^(
‑
(piezo1 cq值
‑
gapdh cq值))计算得出三种细胞中piezo1基因的相对表达水平,结果如图6所示:piezo1敲除细胞系as4.1
‑
piezo1
ko
中mrna的表达量显著低于as4.1
‑
shpiezo1干扰细胞系,表明实施例1提供的构建方法对piezo1基因的抑制效率显著高于shrna干扰构建的方法。
[0131]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1