德度司他的共晶或盐及其制备方法和用途与流程
1.本发明涉及医药化工技术领域,具体涉及德度司他的共晶或盐及其制备方法和用途。
背景技术:
2.wo2014102818 a1首次公开了一种新型的喹诺酮衍生物,并具体地公开了德度司他(desidustat),其结构式如下所示
[0003][0004]
德度司他是一种缺氧诱导因子(hif)脯氨酰羟化酶抑制剂,其通过抑制缺氧诱导因子脯氨酰羟化酶来激活hif,使各种基因(包括epo/血管内皮生长因子(vegf)、肾上腺髓质素等)的表达增强,从而治疗贫血和类似病症。
[0005]
us20190359574 a1公开了一种德度司他无水晶型,其x
‑
射线粉末衍射图谱如图1所示。然而,这种无水晶型的溶解性和耐湿性不太令人满意。因此,本发明人对德度司他的晶型进行了相关研究,开发了溶解性好、引湿性低的德度司他的共晶或盐。
技术实现要素:
[0006]
本发明的目的是克服现有技术的缺点,提供德度司他的共晶或盐,其溶解性好、引湿性低且稳定性好,可用于药物制剂。
[0007]
本发明的另一目的是提供德度司他的共晶或盐的制备方法。
[0008]
为了实现以上目的,本发明提供如下技术方案。
[0009]
本发明还提供德度司他的共晶,其为德度司他与异烟肼、异烟碱、尿素或烟酰胺的共晶。
[0010]
优选地,所述德度司他与异烟肼的共晶在x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:8.66
°
,10.49
°
,11.71
°
,12.33
°
,14.20
°
,15.66
°
,16.13
°
,19.29
°
和19.55
°
,存在
±
0.2
°
的误差容限;
[0011]
或者,具有下列以角度2θ表示的特征峰:8.66
°
,9.70
°
,10.49
°
,11.00
°
,11.71
°
,12.33
°
,14.20
°
,15.66
°
,16.13
°
,17.48
°
,19.29
°
,19.55
°
和23.57
°
,存在
±
0.2
°
的误差容限;
[0012]
或者,具有下列以角度2θ表示的特征峰:3.94
°
,4.36
°
,7.02
°
,8.66
°
,9.70
°
,10.49
°
,11.00
°
,11.71
°
,12.33
°
,14.20
°
,15.66
°
,16.13
°
,16.69
°
,17.48
°
,18.02
°
,19.29
°
,19.55
°
,20.82
°
,21.85
°
,23.57
°
,24.63
°
,25.34
°
,25.91
°
,26.41
°
,26.75
°
,28.37
°
,30.79
°
,
31.68
°
,33.88
°
,存在
±
0.2
°
的误差容限。
[0013]
优选地,德度司他与尿素的共晶在x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:6.92
°
,7.29
°
,9.36
°
,13.85
°
,18.82
°
,22.74
°
,22.84
°
,25.06
°
和25.57
°
,存在
±
0.2
°
的误差容限;
[0014]
或者,具有下列以角度2θ表示的特征峰:6.92
°
,7.29
°
,9.36
°
,11.75
°
,13.85
°
,18.82
°
,22.74
°
,22.84
°
,24.80
°
,25.06
°
,25.57
°
,26.34
°
,27.75
°
和31.45
°
,存在
±
0.2
°
的误差容限;
[0015]
或者,具有下列以角度2θ表示的特征峰:6.92
°
,7.29
°
,9.36
°
,11.75
°
,12.43
°
,13.85
°
,15.78
°
,18.82
°
,19.25
°
,20.31
°
,20.86
°
,21.22
°
,22.02
°
,22.74
°
,22.84
°
,23.04
°
,24.27
°
,24.80
°
,25.06
°
,25.57
°
,26.34
°
,27.75
°
,31.45
°
,37.22
°
和37.62
°
,存在
±
0.2
°
的误差容限。
[0016]
优选地,德度司他与异烟碱的共晶在x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:8.65
°
,9.24
°
,15.66
°
,15.78
°
,16.36
°
,18.54
°
和18.66
°
,存在
±
0.2
°
的误差容限;
[0017]
或者,具有下列以角度2θ表示的特征峰:8.65
°
,9.24
°
,11.62
°
,15.66
°
,15.78
°
,16.36
°
,18.54
°
,18.66
°
,20.78
°
,21.61
°
,23.93
°
,存在
±
0.2
°
的误差容限;
[0018]
或者,具有下列以角度2θ表示的特征峰:5.82
°
,6.24
°
,8.65
°
,9.24
°
,10.24
°
,11.19
°
,11.62
°
,14.00
°
,15.66
°
,15.78
°
,16.36
°
,18.54
°
,18.66
°
,20.78
°
,21.61
°
,22.89
°
,23.93
°
,25.18
°
,26.19
°
,27.00
°
,28.12
°
,31.01
°
,33.10
°
,39.00
°
和39.55
°
,存在
±
0.2
°
的误差容限。
[0019]
优选地,德度司他与烟酰胺的共晶在x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:8.35
°
,9.31
°
,14.27
°
,14.64
°
,15.79
°
,18.74
°
和21.52
°
,存在
±
0.2
°
的误差容限;
[0020]
或者,具有下列以角度2θ表示的特征峰:5.27
°
,8.35
°
,9.31
°
,14.27
°
,14.64
°
,15.79
°
,18.15
°
,18.74
°
和21.52
°
,存在
±
0.2
°
的误差容限;
[0021]
或者,具有下列以角度2θ表示的特征峰:5.27
°
,7.10
°
,8.35
°
,9.31
°
,10.56
°
,12.05
°
,14.27
°
,14.64
°
,15.79
°
,16.68
°
,18.15
°
,18.74
°
,21.52
°
,22.86
°
,23.20
°
,28.67
°
和29.57
°
,存在
±
0.2
°
的误差容限。
[0022]
优选地,所述德度司他与异烟肼的共晶的差式扫描量热谱图在175
‑
195℃处具有吸热峰。
[0023]
优选地,所述德度司他与尿素的共晶的差式扫描量热谱图在170
‑
195℃和210
‑
230℃处具有吸热峰。
[0024]
优选地,所述德度司他与异烟碱的共晶的差式扫描量热谱图在150
‑
180℃处具有吸热峰。
[0025]
优选地,所述德度司他与烟酰胺的共晶的差式扫描量热谱图在165
‑
185℃处具有吸热峰。
[0026]
优选地,所述德度司他与异烟肼的共晶在30
‑
100℃的温度范围内无明显失重;或者所述德度司他与异烟肼的共晶在110℃
‑
220℃的温度范围内有2.0%
‑
5.0%失重;在一些实施方式中,所述德度司他与异烟肼的共晶在110℃
‑
220℃的温度范围内失重3.5%。
[0027]
优选地,所述德度司他与尿素的共晶在30
‑
100℃的温度范围内无明显失重;或者所述德度司他与尿素的共晶在110℃
‑
220℃的温度范围内有12.0%
‑
18.0%失重;在一些实施方式中,所述德度司他与尿素的共晶在110℃
‑
220℃的温度范围失重15.2%。
[0028]
优选地,所述德度司他与异烟碱的共晶在30
‑
100℃的温度范围内有6.5%
‑
7.5%失重,所述德度司他与异烟碱的共晶在110℃
‑
220℃的温度范围内有10.0%
‑
15.0%失重;在一些实施方式中,所述德度司他与异烟碱的共晶在30
‑
100℃的温度范围内失重7.1%,在110℃
‑
220℃的温度范围内失重12.5%。
[0029]
优选地,所述德度司他与烟酰胺的共晶在30
‑
100℃的温度范围内无明显失重;或者所述德度司他与烟酰胺的共晶在150℃
‑
250℃的温度范围内有25.0%
‑
35.0%失重;在一些实施方式中,所述德度司他与烟酰胺的共晶在150℃
‑
250℃的温度范围内失重29.3%。
[0030]
优选地,在所述德度司他与异烟肼的共晶中,德度司他与异烟肼以2:1摩尔比存在。
[0031]
优选地,在所述德度司他与尿素的共晶中,德度司他与尿素以1:1摩尔比存在。
[0032]
优选地,在所述德度司他与异烟碱的共晶中,德度司他与异烟碱以1:1摩尔比存在。
[0033]
优选地,在所述德度司他与烟酰胺的共晶中,德度司他与烟酰胺以1:1摩尔比存在。
[0034]
本发明还提供上述德度司他与异烟肼的共晶的制备方法,包括将德度司他和异烟肼置于甲醇中搅拌,分离、干燥后得到德度司他与异烟肼的共晶。
[0035]
优选地,在该制备方法中,德度司他和异烟肼的摩尔比为2:1。优选地,德度司他的质量与溶剂的体积的比例为10
‑
50mg/ml。将德度司他和异烟肼置于甲醇中搅拌一段时间后可得到悬浮液。优选地,搅拌温度为25℃
‑
40℃,搅拌时间为24
‑
48h。优选地,通过过滤或离心进行分离。本发明对于德度司他的固体形式没有特别限制。
[0036]
本发明还提供上述德度司他与尿素的共晶的制备方法,包括将德度司他和尿素置于丙酮或乙酸乙酯中搅拌,分离、干燥后得到德度司他与尿素的共晶。
[0037]
优选地,在该制备方法中,德度司他和尿素的摩尔比为1:1。优选地,德度司他的质量与溶剂的体积的比例为10
‑
50mg/ml。将德度司他和尿素置于丙酮或乙酸乙酯中搅拌一段时间后可得到悬浮液。优选地,搅拌温度为25℃
‑
40℃,搅拌时间为24
‑
48h。优选地,通过过滤或离心进行分离。本发明对于德度司他的固体形式没有特别限制。
[0038]
本发明还提供上述德度司他与异烟碱的共晶的制备方法,包括将德度司他和异烟碱置于丙酮或乙酸乙酯中搅拌,分离、干燥后得到德度司他与异烟碱的共晶。
[0039]
优选地,在该制备方法中,德度司他和异烟碱的摩尔比为1:1。优选地,德度司他的质量与溶剂的体积的比例为10
‑
50mg/ml。将德度司他和异烟碱置于丙酮或乙酸乙酯中搅拌一段时间后可得到悬浮液。优选地,搅拌温度为25℃
‑
40℃,搅拌时间为24
‑
48h。优选地,通过过滤或离心进行分离。本发明对于德度司他的固体形式没有特别限制。
[0040]
本发明还提供上述德度司他与烟酰胺的共晶的制备方法,包括将德度司他和烟酰胺置于丙酮或乙酸乙酯中搅拌,分离、干燥后得到德度司他与烟酰胺的共晶。
[0041]
优选地,在该制备方法中,德度司他和烟酰胺的摩尔比为1:1。优选地,德度司他的质量与溶剂的体积的比例为10
‑
50mg/ml。将德度司他和烟酰胺置于丙酮或乙酸乙酯中搅拌
一段时间后可得到悬浮液。优选地,搅拌温度为25℃
‑
40℃,搅拌时间为24
‑
48h。优选地,通过过滤或离心进行分离。本发明对于德度司他的固体形式没有特别限制。
[0042]
本发明还提供一种药物组合物,其包含上述德度司他的共晶,以及药学上可接受的载体。
[0043]
本发明还提供德度司他的盐,其为德度司他哌嗪盐。
[0044]
优选地,所述德度司他哌嗪盐为德度司他哌嗪盐型ⅰ,其x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:7.21
°
,7.46
°
,9.09
°
,13.68
°
,17.84
°
和18.30
°
,存在
±
0.2
°
的误差容限;
[0045]
或者,具有下列以角度2θ表示的特征峰:7.21
°
,7.46
°
,8.07
°
,9.09
°
,13.68
°
,17.84
°
,18.30
°
,24.52
°
和27.66
°
,存在
±
0.2
°
的误差容限;
[0046]
或者,具有下列以角度2θ表示的特征峰:7.21
°
,7.46
°
,8.07
°
,9.09
°
,10.783
°
,11.51
°
,12.89
°
,13.68
°
,14.65
°
,15.43
°
,17.84
°
,18.30
°
,19.36
°
,19.67
°
,20.24
°
,20.76
°
,21.65
°
,22.97
°
,23.21
°
,23.48
°
,24.52
°
,25.65
°
,25.95
°
,27.66
°
和32.40
°
,存在
±
0.2
°
的误差容限。
[0047]
优选地,所述德度司他哌嗪盐为德度司他哌嗪盐型ii,其x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:9.66
°
,9.89
°
,10.40
°
,15.65
°
,17.94
°
和26.28
°
,存在
±
0.2
°
的误差容限;
[0048]
或者,具有下列以角度2θ表示的特征峰:9.66
°
,9.89
°
,10.40
°
,15.65
°
,17.94
°
,23.22
°
,26.28
°
和27.36
°
,存在
±
0.2
°
的误差容限;
[0049]
或者,具有下列以角度2θ表示的特征峰:9.66
°
,9.89
°
,10.40
°
,15.65
°
,16.58
°
,17.27
°
,17.94
°
,22.35
°
,23.22
°
,25.71
°
,26.28
°
,27.36
°
,31.67
°
和37.14
°
,存在
±
0.2
°
的误差容限。
[0050]
优选地,所述德度司他哌嗪盐为德度司他哌嗪盐型iii,其x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:8.05
°
,8.39
°
和24.32
°
,存在
±
0.2
°
的误差容限;
[0051]
或者,具有下列以角度2θ表示的特征峰:8.05
°
,8.39
°
,9.43
°
和24.32
°
,存在
±
0.2
°
的误差容限;
[0052]
或者,具有下列以角度2θ表示的特征峰:8.05
°
,8.39
°
,9.43
°
,16.31
°
,16.91
°
,17.85
°
,20.38
°
,24.32
°
和33.55
°
,存在
±
0.2
°
的误差容限。
[0053]
优选地,所述德度司他哌嗪盐为德度司他哌嗪盐型iv,其x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:7.65
°
,9.11
°
,14.71
°
,18.33
°
,20.27
°
,24.53
°
和27.68
°
,存在
±
0.2
°
的误差容限;
[0054]
或者,具有下列以角度2θ表示的特征峰:7.65
°
,8.09
°
,9.11
°
,13.71
°
,14.71
°
,17.80
°
,18.33
°
,20.27
°
,23.02
°
,23.27
°
,24.53
°
和27.68
°
,存在
±
0.2
°
的误差容限;
[0055]
或者,具有下列以角度2θ表示的特征峰:6.43
°
,7.65
°
,8.09
°
,9.11
°
,10.86
°
,12.91
°
,13.71
°
,14.71
°
,15.44
°
,17.80
°
,18.33
°
,19.70
°
,20.27
°
,20.89
°
,21.64
°
,23.02
°
,23.27
°
,24.53
°
,27.68
°
,30.52
°
和32.43
°
,存在
±
0.2
°
的误差容限。
[0056]
优选地,所述德度司他哌嗪盐为德度司他哌嗪盐型v,其x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:9.25
°
,10.93
°
,16.46
°
和20.30
°
,存在
±
0.2
°
的误差容限;
[0057]
或者,具有下列以角度2θ表示的特征峰:8.02
°
,8.34
°
,9.25
°
,10.08
°
,10.93
°
,16.46
°
,18.11
°
,20.30
°
,22.04
°
和22.34
°
,存在
±
0.2
°
的误差容限;
[0058]
或者,具有下列以角度2θ表示的特征峰:5.45
°
,8.02
°
,8.34
°
,9.25
°
,10.08
°
,10.93
°
,16.46
°
,18.11
°
,20.30
°
,22.04
°
,22.34
°
,23.30
°
,27.69
°
和28.09
°
,存在
±
0.2
°
的误差容限。
[0059]
优选地,所述德度司他哌嗪盐型ⅰ的差式扫描量热谱图在75
‑
95℃和210
‑
230℃处具有吸热峰。
[0060]
优选地,所述德度司他哌嗪盐型ii的差式扫描量热谱图在80
‑
100℃和205
‑
225℃处具有吸热峰;
[0061]
优选地,所述德度司他哌嗪盐型iii的差式扫描量热谱图在210
‑
235℃处具有吸热峰。
[0062]
优选地,所述德度司他哌嗪盐型iv的差式扫描量热谱图在218.6
±
2℃处具有吸热峰。
[0063]
优选地,所述德度司他哌嗪盐型
ⅴ
的差式扫描量热谱图在81.7
±
2℃和216.6
±
2℃处具有吸热峰。
[0064]
优选地,所述德度司他哌嗪盐型ii在50℃之前有3.5%
‑
4.0%的失重。
[0065]
优选地,所述德度司他哌嗪盐型iii在30
‑
150℃的温度范围内有2.5%
‑
3.5%的失重。
[0066]
优选地,所述德度司他哌嗪盐型iv在30
‑
50℃的温度范围内有3.56%失重。
[0067]
优选地,在所述德度司他哌嗪盐型ⅰ、ii和iv中,德度司他与哌嗪均以1:1摩尔比存在。
[0068]
优选地,在所述德度司他哌嗪盐型iii和v中,德度司他与哌嗪均以2:1摩尔比存在。
[0069]
本发明还提供上述德度司他哌嗪盐型ⅰ的制备方法,包括将德度司他和哌嗪六水合物置于水中搅拌,分离得到德度司他哌嗪盐型ⅰ。
[0070]
优选地,在该制备方法中,德度司他和哌嗪六水合物的摩尔比为1:1。优选地,德度司他的质量与溶剂的体积的比例为10
‑
50mg/ml。将德度司他和哌嗪六水合物置于水中搅拌一段时间后可得到悬浮液。优选地,搅拌温度为25℃
‑
40℃,搅拌时间为24
‑
48h。优选地,通过过滤或离心进行分离。本发明对于德度司他的固体形式没有特别限制。
[0071]
本发明还提供上述德度司他哌嗪盐型ii的制备方法,包括将德度司他和哌嗪六水合物置于甲醇中搅拌,分离、干燥后得到德度司他哌嗪盐型ii。
[0072]
优选地,在该制备方法中,德度司他和哌嗪六水合物的摩尔比为1:1。优选地,德度司他的质量与溶剂的体积的比例为10
‑
50mg/ml。将德度司他和哌嗪六水合物置于甲醇中搅拌一段时间后可得到悬浮液。优选地,搅拌温度为25℃
‑
40℃,搅拌时间为24
‑
48h。优选地,通过过滤或离心进行分离。本发明对于德度司他的固体形式没有特别限制。
[0073]
本发明还提供上述德度司他哌嗪盐型iii的制备方法,包括将德度司他和哌嗪六水合物置于丙酮或乙酸乙酯中搅拌,分离、干燥后得到德度司他哌嗪盐型iii。
[0074]
优选地,在该制备方法中,德度司他和哌嗪六水合物的摩尔比为2:1。优选地,德度司他的质量与溶剂的体积的比例为10
‑
50mg/ml。将德度司他和哌嗪六水合物置于丙酮或乙
酸乙酯中搅拌一段时间后可得到悬浮液。优选地,搅拌温度为25℃
‑
40℃,搅拌时间为24
‑
48h。优选地,通过过滤或离心进行分离。本发明对于德度司他的固体形式没有特别限制。
[0075]
本发明还提供上述德度司他哌嗪盐型iv的制备方法,包括将上述德度司他哌嗪盐型ⅰ进行干燥。
[0076]
在该制备方法中,可在烘箱中进行干燥。优选地,干燥温度为45℃
‑
60℃,干燥时间为12
‑
24h。
[0077]
本发明还提供上述德度司他哌嗪盐型v的制备方法,包括将上述德度司他哌嗪盐型iii在高湿条件下放置。
[0078]
在该制备方法中,高湿条件为相对湿度(rh)大于或等于85%,放置温度为20℃
‑
30℃,放置时间为5
‑
15天。
[0079]
本发明还提供一种药物组合物,其包含上述德度司他的盐,以及药学上可接受的载体。
[0080]
本发明还提供所述盐、所述共晶或所述药物组合物在制备用于治疗贫血或类似病症的药物中的用途。
[0081]
本发明所取得的有益效果是:
[0082]
本发明提供德度司他的共晶或盐,其稳定性好,有利于药品的长期储存。另外,其吸湿性低,溶解性好,有利于用作药物成分,具有极高的药物开发价值。
[0083]
本发明的德度司他的共晶和盐的制备方法简单,重复性好,适合工业化生产。
[0084]
定义和一般术语
[0085]
除非另有说明,本发明使用的所有技术和科学术语与本发明所属领域的普通技术人员所通常理解的具有相同含义。本发明涉及的所有专利和公开出版物通过引用方式整体并入本发明。尽管在本发明的实践或者测试中可以使用与本发明所述相似或者相同的任何方法和物质,但是本发明中描述的是优选的方法、设备和物质。
[0086]
晶型可以通过多种技术手段进行鉴别,例如x射线粉末衍射(xrpd)、红外吸收光谱法(ir)、熔点法、差示扫描量热法(dsc)、热重分析法(tga)、核磁共振法、拉曼光谱、x射线单晶衍射、溶解量热法、扫描电子显微镜(sem)、定量分析、溶解度和溶解速度等等。
[0087]
x射线粉末衍射(xrpd)可检测晶型的变化、结晶度、晶构状态等信息,是鉴别晶型的常用手段。xrpd图谱的峰位置主要取决于晶型的结构,对实验细节相对不敏感,而其相对峰高取决于与样品制备和仪器几何形状有关的许多因素。因此,在一些实施方案中,本发明的晶型的特征在于具有某些峰位置的xrpd图,其基本上如本发明附图中提供的xrpd图所示。同时,xrpd图谱的2θ的量度可以有实验误差,不同仪器以及不同样品之间,xrpd图谱的2θ的量度可能会略有差别,因此所述2θ的数值不能视为绝对的。根据本试验所用仪器状况,衍射峰存在
±
0.2
°
的误差容限。
[0088]
差示扫描量热(dsc)是在程序控制下,通过不断加热或降温,测量样品与惰性参比物(常用α
‑
al2o3)之间的能量差随温度变化的一种技术。dsc曲线的吸热峰高取决于与样品制备和仪器几何形状有关的许多因素,而峰位置对实验细节相对不敏感。因此,在一些实施方案中,本发明所述晶型的特征在于具有特征峰位置的dsc图,其基本上如本发明附图中提供的dsc图所示。同时,dsc图谱可以有实验误差,不同仪器以及不同样品之间,dsc图谱的峰位置和峰值可能会略有差别,因此所述dsc吸热峰的峰位置或峰值的数值不能视为绝对的。
根据本试验所用仪器状况,吸热峰存在
±
3℃的误差容限。
[0089]
热重分析(tga)是在程序控制下,测定物质的质量随温度变化的一种技术,适用于检查晶体中溶剂的丧失或样品升华、分解的过程,可推测晶体中含结晶水或结晶溶剂的情况。tga曲线显示的质量变化取决于样品制备和仪器等许多因素;不同仪器以及不同样品之间,tga检测的质量变化略有差别。根据本试验所用的仪器状况,质量变化存在
±
0.1%的误差容限。
[0090]
在本发明的上下文中,x
‑
射线粉末衍射图中的2θ值均以度(
°
)为单位。
[0091]
术语“基本上如图所示”是指x
‑
射线粉末衍射图或dsc图或拉曼光谱图或红外光谱图中至少50%,或至少60%,或至少70%,或至少80%,或至少90%,或至少95%,或至少99%的峰显示在其图中。
[0092]
当提及谱图或/和出现在图中的数据时,“峰”指本领域技术人员能够识别的不会归属于背景噪音的一个特征。
[0093]
本发明涉及所述德度司他的共晶和盐,它们以基本上纯净的结晶形态存在。
[0094]“基本上纯净的”是指一种晶型基本上不含另外一种或多种晶型,即晶型的纯度至少80%,或至少85%,或至少90%,或至少93%,或至少95%,或至少98%,或至少99%,或至少99.5%,或至少99.6%,或至少99.7%,或至少99.8%,或至少99.9%,或晶型中含有其它晶型,所述其它晶型在晶型的总体积或总重量中的百分比少于20%,或少于10%,或少于5%,或少于3%,或少于1%,或少于0.5%,或少于0.1%,或少于0.01%。
[0095]“基本上不含”是指一种或多种其它晶型在晶型的总体积或总重量中的百分比少于20%,或少于10%,或少于5%,或少于4%,或少于3%,或少于2%,或少于1%,或少于0.5%,或少于0.1%,或少于0.01%。
[0096]
xrpd图中的“相对强度”(或“相对峰高”)是指x
‑
射线粉末衍射图(xrpd)的所有衍射峰中第一强峰的强度为100%时,其它峰的强度与第一强峰的强度的比值。
[0097]
在本发明的上下文中,当使用或者无论是否使用“大约”或“约”等字眼时,表示在给定的值或范围的10%以内,适当地在5%以内,特别是在1%以内。或者,对于本领域普通技术人员而言,术语“大约”或“约”表示在平均值的可接受的标准误差范围内。每当公开一个具有n值的数字时,任何具有n+/
‑
1%,n+/
‑
2%,n+/
‑
3%,n+/
‑
5%,n+/
‑
7%,n+/
‑
8%或n+/
‑
10%值以内的数字会被明确地公开,其中“+/
‑”
是指加或减。
[0098]
本发明中“室温”指的是温度由大约10℃到大约40℃。在一些实施例中,“室温”指的是温度由大约20℃到大约30℃;在另外一些实施例中,“室温”指的是20℃,22.5℃,25℃,27.5℃等等。
附图说明
[0099]
图1为实施例1制得的德度司他与异烟肼的共晶的x
‑
射线粉末衍射(xrpd)图谱。
[0100]
图2为实施例1制得的德度司他与异烟肼的共晶的差式扫描量热(dsc)图谱。
[0101]
图3为实施例1制得的德度司他与异烟肼的共晶的热重分析(tga)图谱。
[0102]
图4为实施例2制得的德度司他与异烟碱的共晶的x
‑
射线粉末衍射图谱。
[0103]
图5为实施例2制得的德度司他与异烟碱的共晶的差式扫描量热图谱。
[0104]
图6为实施例2制得的德度司他与异烟碱的共晶的热重分析图谱。
[0105]
图7为实施例4制得的德度司他与尿素的共晶的x
‑
射线粉末衍射图谱。
[0106]
图8为实施例4制得的德度司他与尿素的共晶的差式扫描量热图谱。
[0107]
图9为实施例4制得的德度司他与尿素的共晶的热重分析图谱。
[0108]
图10为实施例6制得的德度司他与烟酰胺的共晶的x
‑
射线粉末衍射图谱。
[0109]
图11为实施例6制得的德度司他与烟酰胺的差式扫描量热图谱。
[0110]
图12为实施例6制得的德度司他与烟酰胺的热重分析图谱。
[0111]
图13为实施例8制得的德度司他哌嗪盐型ⅰ的x
‑
射线粉末衍射图谱。
[0112]
图14为实施例8制得的德度司他哌嗪盐型ⅰ的差式扫描量热图谱。
[0113]
图15为实施例9制得的德度司他哌嗪盐型ii的x
‑
射线粉末衍射图谱。
[0114]
图16为实施例9制得的德度司他哌嗪盐型ii的差式扫描量热图谱。
[0115]
图17为实施例9制得的德度司他哌嗪盐型ii的热重分析图谱。
[0116]
图18为实施例10制得的德度司他哌嗪盐型iii的x
‑
射线粉末衍射图谱。
[0117]
图19为实施例10制得的德度司他哌嗪盐型iii的差式扫描量热图谱。
[0118]
图20为实施例10制得的德度司他哌嗪盐型iii的热重分析图谱。
[0119]
图21为实施例11制得的德度司他哌嗪盐型iv的x
‑
射线粉末衍射图谱。
[0120]
图22为实施例11制得的德度司他哌嗪盐型iv的差式扫描量热图谱。
[0121]
图23为实施例11制得的德度司他哌嗪盐型iv的热重分析图谱。
[0122]
图24为实施例12制得的德度司他哌嗪盐型v的x
‑
射线粉末衍射图谱。
[0123]
图25为实施例12制得的德度司他哌嗪盐型v的差式扫描量热图谱。
[0124]
图26为实施例9制得的德度司他哌嗪盐型ii的15天影响因素实验结果(从下到上依次为:0天、高湿5天、高温5天,光照5天、高湿10天、高温10天,光照10天、高湿15天、高温15天,光照15天)。
[0125]
图27为实施例10制得的德度司他哌嗪盐型iii的15天影响因素实验结果(从下到上依次为:0天、高湿5天、高温5天,光照5天、高湿10天、高温10天,光照10天、高湿15天、高温15天,光照15天)。
[0126]
图28为实施例1制得的德度司他与异烟肼的共晶的15天影响因素实验结果(从下到上依次为:0天、高湿5天、高温5天,光照5天、高湿10天、高温10天,光照10天、高湿15天、高温15天,光照15天)。
[0127]
图29为实施例2制得的德度司他与异烟碱的共晶的15天影响因素实验结果(从下到上依次为:0天、高湿5天、高温5天,光照5天、高湿10天、高温10天,光照10天、高湿15天、高温15天,光照15天)。
[0128]
图30为实施例4制得的德度司他与尿素的共晶的15天影响因素实验结果(从下到上依次为:0天、高湿5天、高温5天,光照5天、高湿10天、高温10天,光照10天、高湿15天、高温15天,光照15天)。
[0129]
图31为实施例6制得的德度司他与烟酰胺的共晶的15天影响因素实验结果(从下到上依次为:0天、高湿5天、高温5天,光照5天、高湿10天、高温10天,光照10天、高湿15天、高温15天,光照15天)。
[0130]
图32为德度司他无水晶型(us20190359574 a1中的式(i
‑
a)的化合物晶型,其x
‑
射线粉末衍射图谱如该专利申请的图1所示)的动态蒸汽吸附(dvs)图。
[0131]
图33为实施例1制得的德度司他与异烟肼的共晶的动态蒸汽吸附图。
[0132]
图34为实施例2制得的德度司他与异烟碱的共晶的动态蒸汽吸附图。
[0133]
图35为实施例4制得的德度司他与尿素的共晶的动态蒸汽吸附图。
[0134]
图36为实施例6制得的德度司他与烟酰胺的共晶的动态蒸汽吸附图。
具体实施方式
[0135]
为了使本发明所述的内容更加便于理解,下面结合具体实施例对本发明所述的技术方案做进一步说明,但本发明不仅限于此。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。除非另有说明,实施例中使用的原料和试剂均为市售商品。本文未记载的试剂、仪器或操作步骤均是本领域普通技术人员可常规确定的内容。
[0136]
仪器参数
[0137]
除非参数中另行规定,以下所有分析都在室温下进行。
[0138]
x
‑
射线粉末衍射(xrpd)
[0139]
在装配有自动化3*15零背景样品架的透射反射样品台的荷兰panalytical empyrean x
‑
射线衍射仪上收集x
‑
射线粉末衍射(xrpd)图案。所用辐射源为(cu,kα,1.540598;1.544426;kα2/kα1强度比例:0.50),其中电压设定在45kv,电流设定在40ma.x
‑
射线的束发散度,即样品上x
‑
射线约束的有效尺寸,为10mm采用θ
‑
θ连续扫描模式,得到3
°
~40
°
的有效2θ范围。取适量样品在环境条件(约18℃~32℃)下于零背景样品架圆形凹槽处,用洁净的载玻片轻压,得到一个平整的平面,并将零背景样品架固定。将样品以0.0167
°
的扫描步长在3~40
°
2θ
±
0.2
°
范围内产生传统的xrpd图案。用于数据收集的软件为data collector,数据用data viewer和highscore plus分析和展示。在x
‑
射线粉末衍射图中,纵坐标为用计数(counts)表示的衍射强度,横坐标为用度(
°
)表示的衍射角2θ。
[0140]
差示扫描量热法(dsc)
[0141]
使用ta instruments差示扫描量热计q2000进行差示扫描量热法(dsc)。将样品(约1mg~3mg)放入铝盘中并精确记录重量。该盘用盖子覆盖,然后压接,并将样品转移至仪器中进行测量。将样品池在30℃下平衡并在氮气吹扫下以50℃/min的速率加热至300℃的最终温度。在dsc图中,横坐标表示温度(temperature,℃),纵坐标表示单位质量的物质放出的热流量(heat flow,w/g)。
[0142]
热重分析法(tga)
[0143]
使用ta instruments热重分析仪q500进行热重分析,将适量样品放置在铂样品盘中,在氮气氛下,以60℃/分钟速率升温,温度范围为30至300℃。在tga图中,横坐标表示温度(temperature,℃),纵坐标表示质量百分数(weight,%)。
[0144]
动态蒸汽吸附(dvs)分析法
[0145]
dvs测试等温吸附平衡曲线,仪器:dvs
‑
intrinsic,25.0℃条件下随着相对湿度(0%
‑
95.0%
‑
0%)的变化,从0%相对湿度开始,以10%的相对湿度阶梯变化到达95%相对湿度,然后再以10%的相对湿度阶梯变化到达0%相对湿度。处于某一特定相对湿度条件下单位时间样品重量变化dm/dt的绝对值小于0.1%时认为达到平衡,则进入下一个相对湿度。检测产品在(0%
‑
95.0%
‑
0%)相对湿度循环条件下的引湿性变化情况。
[0146]
实施例1:德度司他与异烟肼的共晶的制备
[0147]
将20mg德度司他与8.3mg异烟肼加入5ml ep管中,再加入1ml甲醇,25℃混悬打浆24h。过滤,干燥得到类白色固体产品,经检测为德度司他与异烟肼的共晶。
[0148]
本实施例中,德度司他与异烟肼的共晶在cu
‑
kα射线的x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:3.94
°
,4.36
°
,7.02
°
,8.66
°
,9.70
°
,10.49
°
,11.00
°
,11.71
°
,12.33
°
,14.20
°
,15.66
°
,16.13
°
,16.69
°
,17.48
°
,18.02
°
,19.29
°
,19.55
°
,20.82
°
,21.85
°
,23.57
°
,24.63
°
,25.34
°
,25.91
°
,26.41
°
,26.75
°
,28.37
°
,30.79
°
,31.68
°
,33.88
°
,存在
±
0.2
°
的误差容限,如图1所示。
[0149]
本实施例中,在德度司他与异烟肼的共晶的dsc谱图(如图2所示)中,在186
±
2℃处具有吸热峰。在德度司他与异烟肼的共晶的tga谱图(如图3所示)中,在30
‑
100℃的温度范围内无明显失重,可认为德度司他与异烟肼的共晶为无水物。
[0150]
在本说明书中,无明显失重是指失重不超过0.1%。
[0151]
实施例2:德度司他与异烟碱的共晶的制备
[0152]
将20mg德度司他与7.4mg异烟碱加入5ml ep管中,再加入1ml丙酮,25℃混悬打浆24h。过滤,干燥得到类白色固体产品,经检测为德度司他与异烟碱的共晶。
[0153]
本实施例中,德度司他与异烟碱的共晶在cu
‑
kα射线的x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:5.82
°
,6.24
°
,8.65
°
,9.24
°
,10.24
°
,11.19
°
,11.62
°
,14.00
°
,15.66
°
,15.78
°
,16.36
°
,18.54
°
,18.66
°
,20.78
°
,21.61
°
,22.89
°
,23.93
°
,25.18
°
,26.19
°
,27.00
°
,28.12
°
,31.01
°
,33.10
°
,39.00
°
和39.55
°
,存在
±
0.2
°
的误差容限,如图4所示。
[0154]
本实施例中,在德度司他与异烟碱的共晶的dsc谱图(如图5所示)中,在162
±
2℃和167
±
2℃处具有吸热峰。在德度司他与异烟碱的共晶的tga谱图(如图6所示)中,在30
‑
100℃的温度范围内有7.13%失重,可认为德度司他与异烟碱的共晶为水合物。
[0155]
实施例3:德度司他与异烟碱的共晶的制备
[0156]
将20mg德度司他与7.4mg异烟碱加入5ml ep管中,再加入1ml乙酸乙酯,25℃混悬打浆24h。过滤,干燥得到类白色固体产品,经检测为德度司他与异烟碱的共晶。其xrpd图谱与图4基本一致。
[0157]
实施例4:德度司他与尿素的共晶的制备
[0158]
将20mg德度司他与3.6mg尿素加入5ml ep管中,再加入1ml丙酮,25℃混悬打浆24h。过滤,干燥得到类白色固体产品,经检测为德度司他与尿素的共晶。
[0159]
本实施例中,德度司他与尿素的共晶在cu
‑
kα射线的x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:6.92
°
,7.29
°
,9.36
°
,11.75
°
,12.43
°
,13.85
°
,15.78
°
,18.82
°
,19.25
°
,20.31
°
,20.86
°
,21.22
°
,22.02
°
,22.74
°
,22.84
°
,23.04
°
,24.27
°
,24.80
°
,25.06
°
,25.57
°
,26.34
°
,27.75
°
,31.45
°
,37.22
°
和37.62
°
,存在
±
0.2
°
的误差容限,如图7所示。
[0160]
本实施例中,在德度司他与尿素的共晶的dsc谱图(如图8所示)中,在182
±
2℃和217
±
2℃处具有吸热峰。在德度司他与尿素的共晶的tga谱图(如图9所示)中,在30
‑
100℃的温度范围内无明显失重,可认为德度司他与尿素的共晶为无水物。
[0161]
实施例5:德度司他与尿素的共晶的制备
[0162]
将20mg德度司他与3.6mg尿素加入5ml ep管中,再加入1ml乙酸乙酯,25℃混悬打浆24h。过滤,干燥得到类白色固体产品,经检测为德度司他与尿素的共晶。其xrpd图谱与图7基本一致。
[0163]
实施例6:德度司他与烟酰胺的共晶的制备
[0164]
将20mg德度司他与7.3mg烟酰胺加入5ml ep管中,再加入1ml丙酮,25℃混悬打浆24h。过滤,干燥得到类白色固体产品,经检测为德度司他与烟酰胺的共晶。
[0165]
本实施例中,德度司他与烟酰胺的共晶在cu
‑
kα射线的x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:5.27
°
,7.10
°
,8.35
°
,9.31
°
,10.56
°
,12.05
°
,14.27
°
,14.64
°
,15.79
°
,16.68
°
,18.15
°
,18.74
°
,21.52
°
,22.86
°
,23.20
°
,28.67
°
和29.57
°
,存在
±
0.2
°
的误差容限,如图10所示。
[0166]
本实施例中,在德度司他与烟酰胺的共晶的dsc谱图(如图11所示)中,在175
±
2℃处具有吸热峰。在德度司他与烟酰胺的共晶的tga谱图(如图12所示)中,在30
‑
100℃的温度范围内无明显失重,可认为德度司他与烟酰胺的共晶为无水物。
[0167]
实施例7:德度司他与烟酰胺的共晶的制备
[0168]
将20mg德度司他与7.3mg烟酰胺加入5ml ep管中,再加入1ml乙酸乙酯,25℃混悬打浆24h。过滤,干燥得到类白色固体产品,经检测为德度司他与烟酰胺的共晶。其xrpd图谱与图10基本一致。
[0169]
实施例8:德度司他哌嗪盐型ⅰ的制备
[0170]
将20mg德度司他与11.7mg哌嗪六水合物加入5ml离心管(ep管)中,再加入1ml水,25℃混悬打浆24h。过滤,干燥得到类白色固体产品,经检测为德度司他哌嗪盐型ⅰ。
[0171]
本实施例中,德度司他哌嗪盐型ⅰ在cu
‑
kα射线的x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:7.21
°
,7.46
°
,8.07
°
,9.09
°
,10.783
°
,11.51
°
,12.89
°
,13.68
°
,14.65
°
,15.43
°
,17.84
°
,18.30
°
,19.36
°
,19.67
°
,20.24
°
,20.76
°
,21.65
°
,22.97
°
,23.21
°
,23.48
°
,24.52
°
,25.65
°
,25.95
°
,27.66
°
和32.40
°
,存在
±
0.2
°
的误差容限,如图13所示。
[0172]
本实施例中,德度司他哌嗪盐型ⅰ的dsc谱图(如图14所示)在85
±
2℃和218
±
2℃处具有吸热峰。
[0173]
实施例9:德度司他哌嗪盐型ii的制备
[0174]
将20mg德度司他与11.7mg哌嗪六水合物加入5ml ep管中,再加入1ml甲醇,25℃混悬打浆24h。过滤,干燥得到类白色固体产品,经检测为德度司他哌嗪盐型ii。
[0175]
本实施例中,德度司他哌嗪盐型ii在cu
‑
kα射线的x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:9.66
°
,9.89
°
,10.40
°
,15.65
°
,16.58
°
,17.27
°
,17.94
°
,22.35
°
,23.22
°
,25.71
°
,26.28
°
,27.36
°
,31.67
°
和37.14
°
,存在
±
0.2
°
的误差容限,如图15所示。
[0176]
本实施例中,德度司他哌嗪盐型ii的dsc谱图(如图16所示)在93
±
2℃和216
±
2℃处具有吸热峰。在德度司他哌嗪盐型ii的tga谱图(如图17所示)中,在50℃之前有3.82%的失重,可认为德度司他哌嗪盐型ii为水合物。
[0177]
实施例10:德度司他哌嗪盐型iii的制备
[0178]
将20mg德度司他与11.7mg哌嗪六水合物加入5ml ep管中,再加入1ml丙酮,25℃混悬打浆24h。过滤,干燥得到类白色固体产品,经检测为德度司他哌嗪盐型iii。
[0179]
本实施例中,德度司他哌嗪盐型iii在cu
‑
kα射线的x
‑
射线粉末衍射图谱中,具有
下列以角度2θ表示的特征峰:8.05
°
,8.39
°
,9.43
°
,16.31
°
,16.91
°
,17.85
°
,20.38
°
,24.32
°
和33.55
°
存在
±
0.2
°
的误差容限,如图18所示。
[0180]
本实施例中,德度司他哌嗪盐型iii的dsc谱图(如图19所示)在223
±
2℃处具有吸热峰。在德度司他哌嗪盐型iii的tga谱图(如图20所示)中,在30
‑
150℃的温度范围内有3.05%的失重,可认为德度司他哌嗪盐型iii为水合物。
[0181]
实施例11:德度司他哌嗪盐型ⅳ的制备
[0182]
将20.0mg德度司他哌嗪盐型ⅰ置于50℃烘箱中12h。得到白色固体产品,经检测为德度司他哌嗪盐型ⅳ。
[0183]
本实施例中,德度司他哌嗪盐型ⅳ在cu
‑
kα射线的x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:6.43
°
,7.65
°
,8.09
°
,9.11
°
,10.86
°
,12.91
°
,13.71
°
,14.71
°
,15.44
°
,17.80
°
,18.33
°
,19.70
°
,20.27
°
,20.89
°
,21.64
°
,23.02
°
,23.27
°
,24.53
°
,27.68
°
,30.52
°
和32.43
°
,存在
±
0.2
°
的误差容限,如图21所示。
[0184]
本实施例中,德度司他哌嗪盐型ⅳ的dsc谱图(如图22所示)在218.6
±
2℃处具有吸热峰。德度司他哌嗪盐型ⅳ的tga谱图(如图23所示),在30
‑
50℃的温度范围内有3.56%失重,可认为德度司他哌嗪盐型ⅳ为水合物。
[0185]
实施例12:德度司他哌嗪盐型
ⅴ
的制备
[0186]
将20.0mg德度司他哌嗪盐型ⅲ置于高湿(rh=92.5%)条件下5天。得到白色固体产品,经检测为德度司他哌嗪盐型
ⅴ
。
[0187]
本实施例中,德度司他哌嗪盐型
ⅴ
在cu
‑
kα射线的x
‑
射线粉末衍射图谱中,具有下列以角度2θ表示的特征峰:5.45
°
,8.02
°
,8.34
°
,9.25
°
,10.08
°
,10.93
°
,16.46
°
,18.11
°
,20.30
°
,22.04
°
,22.34
°
,23.30
°
,27.69
°
和28.09
°
,存在
±
0.2
°
的误差容限,如图24所示。
[0188]
本实施例中,德度司他哌嗪盐型
ⅴ
的dsc谱图(如图25所示)在81.7
±
2℃和216.6
±
2℃处具有吸热峰。
[0189]
实施例13:盐型/共晶的稳定性实验
[0190]
根据药物制剂稳定性试验指导原则,对德度司他的盐型/共晶进行影响因素实验,包括高温试验、高湿试验和强光照射试验,考察影响其晶型的稳定性条件,结果如下表1
‑
6所示,xrpd对比图如图26
‑
31所示。
[0191]
高温试验:取德度司他的盐型/共晶样品适量,平铺于称量瓶中,在60℃
±
5℃、rh 75
±
5%恒温恒湿箱中放置,然后分别于5、10和15天取上述样品,采用x
‑
射线粉末衍射测试其晶型情况。
[0192]
高湿试验:取德度司他的盐型/共晶样品适量,平铺于称量瓶中,在25℃、rh 92.5
±
5%恒温恒湿箱中放置,然后分别于5、10和15天取上述样品,采用x
‑
射线粉末衍射测试其晶型情况。
[0193]
光照试验:取德度司他的盐型/共晶样品适量,平铺于称量瓶中,在可见光(vis)4500lux
±
500lux、紫外光(uv)1.7w*h/m2的恒温恒湿箱(25℃、rh 60%
±
5%)条件下放置,然后分别于5、10和15天取上述样品,采用x
‑
射线粉末衍射测试其晶型情况。
[0194]
表1:德度司他哌嗪盐型ⅱ的稳定性试验条件
[0195]
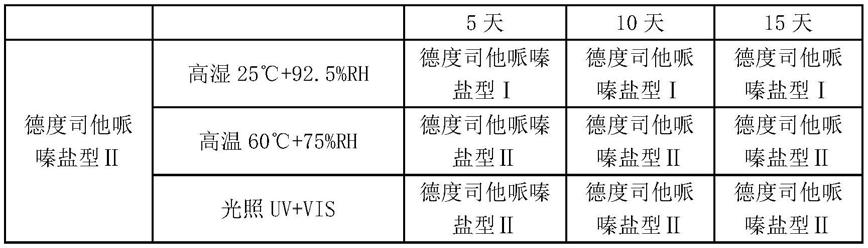
[0196][0197]
表2:德度司他哌嗪盐型ⅲ的稳定性试验条件
[0198][0199]
表3:德度司他与异烟肼的共晶的稳定性试验条件
[0200][0201]
表4:德度司他与异烟碱的共晶的稳定性试验条件
[0202]
[0203][0204]
表5:德度司他与尿素的共晶的稳定性试验条件
[0205][0206]
表6:德度司他与烟酰胺的共晶的稳定性试验条件
[0207][0208]
结论:德度司他哌嗪盐型ⅱ在高湿条件下5天会发生转晶,转变为德度司他哌嗪盐型ⅰ;德度司他哌嗪盐型ⅲ在高湿条件下5天会发生转晶,转变为德度司他哌嗪盐型
ⅴ
。盐型ⅱ和盐型ⅲ在高温和光照条件下放置15天后均能保持稳定,晶型未发生改变,具有良好的稳定性。德度司他与异烟肼的共晶、德度司他与异烟碱的共晶、德度司他与尿素的共晶和德度司他与烟酰胺的共晶在高温、高湿和光照三个影响因素试验条件下放置15天后晶型未发生改变,具有良好的稳定性。
[0209]
实施例14
[0210]
dvs测试等温吸附平衡曲线的测试方法如下,25.0℃条件下相对湿度发生(0%
‑
95.0%
‑
0%)变化,从0%相对湿度开始,以10%的相对湿度阶梯变化到达95%相对湿度,然后再以10%的相对湿度阶梯变化到达0%相对湿度。当处于某一特定相对湿度条件下单位时间样品重量变化dm/dt的绝对值小于0.1%时,认为吸附达到平衡,则进入下一个相对湿度。检测德度司他的共晶产品在(0%
‑
95.0%
‑
0%)相对湿度循环条件下的引湿性变化情况。
[0211]
德度司他无水晶型(us20190359574 a1中的式(i
‑
a)的化合物晶型,其x
‑
射线粉末衍射图谱如该专利申请的图1所示)、德度司他与异烟肼的共晶、德度司他与异烟碱的共晶、德度司他与尿素的共晶以及德度司他与烟酰胺的共晶的dvs结果如图32、图33、图34、图35和图36所示。德度司他无水晶型在dvs曲线湿度大于80%后引湿性急剧上升,湿度为95%时引湿增重达到最大,约为2.72%。德度司他与异烟肼的共晶在dvs曲线湿度大于50%后引湿性缓慢上升,湿度为95%时,引湿增重仅为约为0.34%,这说明德度司他与异烟肼的共晶具有较低的引湿性。德度司他与异烟碱的共晶在dvs曲线湿度大于70%后引湿性急剧上升,湿度为95%时,引湿增重达到最大,约为0.61%,这说明德度司他与异烟碱的共晶具有较低的引湿性。德度司他与尿素的共晶在dvs曲线湿度大于80%后引湿性急剧上升,湿度为95%时,引湿增重达到最大,约为2.45%。德度司他与烟酰胺的共晶在dvs曲线湿度大于80%后引湿性急剧上升,湿度为95%时,引湿增重达到最大,约为1.68%。
[0212]
实施例15
[0213]
溶解度的测试方法如下。
[0214]
在250ml圆底烧瓶中加入一定质量的溶质(即测试样品),在温度为37.0℃的油浴锅中,磁力搅拌设置为200rpm,然后利用50ml量筒加入37.0℃的不同溶出介质,先用50ml的量筒每次加入20ml,加入后停留半小时,若未溶清,再持续加入特定溶出介质,直至完全溶清。最后统计溶解固体所需要的总共介质的量,并计算相应的溶解度。各样品结果参见表7。
[0215]
ph 4.5溶出介质制备:将29.9g三水合乙酸钠或18.0g无水乙酸钠,与18.5ml浓冰醋酸以及9.9815l纯化水配制为10l体积,即得;
[0216]
表7:各样品在37.0℃的ph=4.5溶出介质中的溶解度情况
[0217][0218][0219]
根据上述结果可知:在37.0℃ph=4.5的溶出介质中,德度司他与异烟肼的共晶、德度司他与异烟碱的共晶、德度司他与尿素的共晶以及德度司他与烟酰胺的共晶相对于德度司他无水晶型具有更好的溶解性。综合多个因素来看,德度司他与异烟肼的共晶稳定性好、溶解性好、引湿性弱,相对最优,有利于药物制剂的制备。德度司他与异烟碱的共晶、德
度司他与尿素的共晶以及德度司他与烟酰胺的共晶,也相对较为稳定并具有一定的溶解性和引湿性优势,可以用于药物制剂的制备。
[0220]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1