一种融合蛋白及其应用的制作方法
1.本发明涉及生物医药领域,具体涉及一种融合蛋白及其应用。
背景技术:
2.丙型病毒性肝炎,简称为丙型肝炎、丙肝,是一种由丙型肝炎病毒(hcv)感染引起的病毒性肝炎,主要经输血、针刺、吸毒等传播,据世界卫生组织统计,全球hcv的感染率约为3%,估计约1.8亿人感染了hcv,每年新发丙型肝炎病例约3.5万例。丙型肝炎呈全球性流行,可导致肝脏慢性炎症坏死和纤维化,部分患者可发展为肝硬化甚至肝癌。未来20年内与hcv感染相关的死亡率(肝衰竭及肝细胞癌导致的死亡)将继续增加,对患者的健康和生命危害极大,已成为严重的社会和公共卫生问题。宿主在hcv感染的不同阶段和不同生理条件下,产生的hcv抗体存在差异,可能仅产生某一种抗原的抗体或多种抗原的抗体。因此,抗hcv的检测试剂中因包含多种抗原,可提高检出率。此外,hcv重组抗原作为hcv抗体诊断试剂的主要组成成分,对hcv抗体检测试剂盒的质量、成本都起决定性作用。
技术实现要素:
3.本发明解决的技术问题是如何检测丙肝。
4.本发明提供如下任一所述产品:
5.(b1)一种融合蛋白,由丙型肝炎病毒核心蛋白和丙型肝炎病毒非结构蛋白ns3融合组成;
6.(b2)编码所述融合蛋白的核酸分子;
7.(b3)含有(b2)所述核酸分子的表达盒;
8.(b4)含有(b2)所述核酸分子的重组载体、或含有(b3)所述表达盒的重组载体;
9.(b5)含有(b2)所述核酸分子的重组微生物、或含有(b3)所述表达盒的重组微生物、或含有b4)所述重组载体的重组微生物。
10.可选的,丙型肝炎病毒核心蛋白和丙型肝炎病毒非结构蛋白ns3通过连接肽连接。
11.可选的,所述融合蛋白的氨基酸序列为从n末端至c末端依次由所述丙型肝炎病毒核心蛋白氨基酸序列、连接肽氨基酸序列、丙型肝炎病毒非结构蛋白ns3氨基酸序列组成;
12.或,
13.所述融合蛋白的氨基酸序列为从n末端至c末端依次由标签蛋白的氨基酸序列、甲硫氨酸、所述丙型肝炎病毒核心蛋白氨基酸序列、连接肽氨基酸序列、丙型肝炎病毒非结构蛋白ns3氨基酸序列组成。
14.可选的,所述丙型肝炎病毒核心蛋白氨基酸序列为seq id.no.2第2
‑
172位;其编码dna分子的核苷酸序列为seq id no.1(5
’‑3’
)第4
‑
516位;
15.丙型肝炎病毒非结构蛋白ns3氨基酸序列为seq id.no.2第182
‑
555位;其编码dna分子的核苷酸序列为seq id no.1(5
’‑3’
)第544
‑
1665位;
16.连接肽氨基酸序列为seq id.no.2第173
‑
181位;其编码dna分子的核苷酸序列为
seq id no.1(5
’‑3’
)第517
‑
543位;
17.标签蛋白为mbp标签。
18.融合蛋白在检测丙肝中的应用;可选的,待测样本为血清。
19.本发明技术方案,具有如下优点:
20.1、本技术制备得到一种抗原,可以与丙肝患者血清中的抗体结合。
21.本技术用pmal
‑
c2载体表达hcv core/ns3重组融合蛋白,该载体带mbp标签,mbp标签融合表达在目的蛋白的n端,在mbp标签后面通过pcr连上了tev酶切位点,便于在表达后切除mbp标签。构建成功后,表达纯化有目蛋白的表达。表达后尝试切掉mbp标签,但是切掉标签后蛋白不稳定,容易沉淀,mbp标签的存在增加了蛋白的溶解性。于是用带标签的蛋白进行了胶体金标记和检测,发现mbp标签的存在没有影响检测试剂的灵敏度和特异性。通常本领域技术人员会将mbp标签切除,本发明意外的发现,不切除的情况下,蛋白更稳定,且没有影响检测试剂的灵敏度和特异性。
22.注:mbp(麦芽糖结合蛋白)标签蛋白大小为40kda,由大肠杆菌k12的male基因编码。
23.2、本发明提供一种特异性检测丙肝的试剂盒,其中的融合蛋白作为抗原,能够灵敏、特异的检测丙肝。
附图说明
24.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
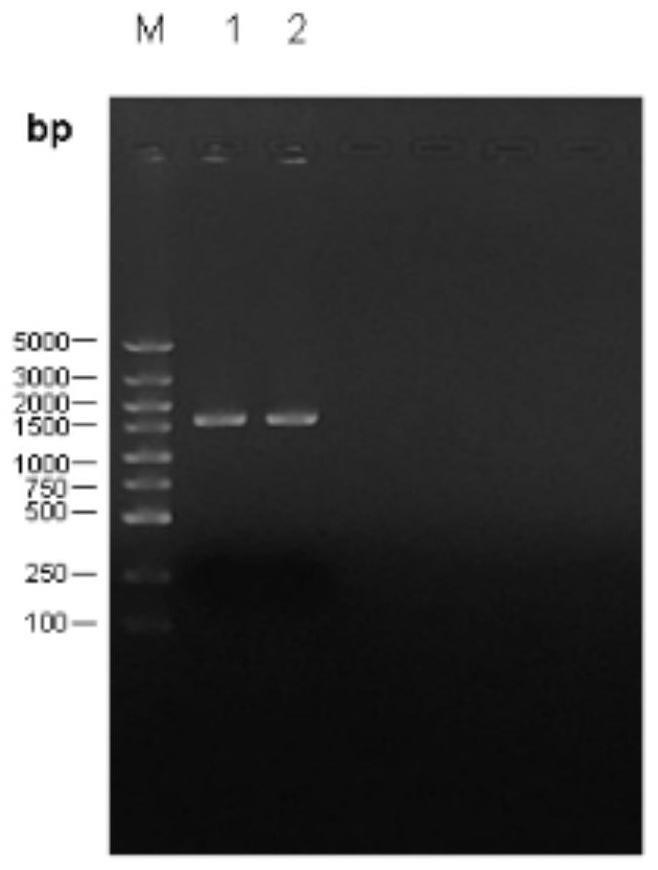
25.图1为实施例1中的琼脂糖凝胶电泳结果;图中标记m的是marker,标记1和2的是扩增的hcv core/ns3基因;
26.图2为实施例1中的sds
‑
page检测蛋白结果;标号1
‑
5为五个平行样;
27.图3为实施例3中的部分阴性标本检测结果;
28.图4实施例3中的部分阳性标本检测结果;
29.图5是本发明实施例2丙型肝炎病毒(hcv)抗体检测胶体金试纸条的示意图;
[0030]1‑
基片,2
‑
上样垫,3
‑
胶体金吸附垫,4
‑
承载膜,5
‑
吸水垫,6
‑
保护膜,t
‑
检测线t,c
‑
质控线c。
具体实施方式
[0031]
实施例1 hcv core/ns3融合蛋白的获得
[0032]
1.1生物公司合成核苷酸序列如seq id no.2的hcv core/ns3基因序列,其中第1
‑
172位为hcv core基因序列,第183
‑
555位为ns3基因序列,第173位
‑
182为linker的基因序列。hcv core/ns3基因编码的蛋白的氨基酸序列如seq id no.1所示。
[0033]
1.2用引物序列:上游引物ccggaattcatgagcaccaatccgaaa(seq id no.3)和下游引物:cccaagcttttagcattcctccatttcatc(seq id no.4)扩增seq id no.1,加入酶切位点ecor i/hind iii,pcr体系如下:
[0034]
模板1ul、5’端引物1ul、3’端引物1ul、dntp 4ul、mg
2+
buffer 5ul、mg
2+ 4ul、taq 1ul,水补充到50ul。
[0035]
pcr扩增程序为:
[0036][0037]
1.3琼脂糖凝胶电泳回收pcr产物。琼脂糖凝胶电泳结果见图1。
[0038]
1.4酶切
[0039]
酶切1.3获得的pcr产物和pmal
‑
c2载体,酶切体系如下:
[0040][0041]
1.5纯化
[0042]
酶切产物以0.8%琼脂糖电压,恒压220v,电泳15min后在紫外灯下用干净刀片快速割下含目的dna的琼脂糖块,加入1.5ml离心管中,用电子天平称量切下胶块的重量,进行纯化。
[0043]
纯化(omega:plasmid mini kitⅰ)步骤如下:
[0044]
(1)按1mg=1ul计算,向胶块中加入相应量的bufferⅰ,混合后,置56℃水浴锅中,使琼脂糖块完全融化;
[0045]
(2)将溶液转移到spin column中,10000rpm离心1min,弃滤液;
[0046]
(3)加入300ul的binding buffer,10000rpm离心1min;
[0047]
(4)加入700ul的spw buffer,10000rpm离心1min;
[0048]
(5)重复步骤4一次,12000rpm离心2min;
[0049]
(6)加入65℃预热的elution buffer 50ul,静止2min,12000rpm离心2min。
[0050]
1.6连接及转化
[0051]
将酶切后的hcvns3基因与pmal
‑
c2骨架载体连接,连接体系如下:
[0052][0053]
转化大肠杆菌:
①
将连接产物加入大肠杆菌dh5a感受态中,混匀,冰浴30min。
②
42℃水浴热激转化90s,立即放回冰上,放置3min。
③
向离心管中加入600ul的lb培养基,37c170rpm振荡培养1h。
[0054]
④
3000rpm离心10min,吸取上清仅留约100ul,吹打混匀后,涂于固体的含有amp抗性的lb平板上,于37℃培养箱中,先正置30min,待菌液吸收后倒置培养过夜。
[0055]
挑单克隆培养及质粒抽提,提取的质粒送公司测序,结果正确。
[0056]
1.7原核表达
[0057]
①
取50ul的大肠杆菌bl21感受态,冰浴,加2ul质粒,冰浴30min;
[0058]
②
于42℃热激90s,再冰浴3min,加入600ul的lb液体培养基,37℃180rpm振荡培养1h。
[0059]
③
10000rpm离心1min,吸取上清,留约100ul,混匀涂amp抗性的lb平板上,37℃培养箱,先正置30min,倒置培养过夜。
[0060]
1.8表达及菌体处理
[0061]
①
从1.7的amp抗性板上挑取菌落,转至含amp抗性的液体培养基中,37℃、180rpm振荡过夜培养。
[0062]
②
将过夜培养的菌液重新转入含有amp抗性的液体培养基中,37℃、220rpm振荡培养4h,od
600
=0.8时,将温度降至16℃,180rpm振荡培养1h,加入iptg(按终浓度1mm),过夜培养。
[0063]
③
8000rpm离心10min,收集菌体,加入50ml pbs/l重悬,将高压破碎仪压力调至800bar,破碎3次,12000rpm离心40min,取上清,得菌体破碎后的上清。
[0064]
1.9 mbp柱纯化
[0065]
(1)滴出mbp柱中的保存液,加10ml水清洗mbp柱,重复2次;
[0066]
(2)加10mlmbp平衡液平衡柱子,重复两次;
[0067]
(3)将1.8中菌体破碎后的上清加入mbp柱中;
[0068]
(4)用10ml平衡液满柱清洗杂蛋白两次;
[0069]
(5)用4ml的洗脱液洗脱蛋白,收集。
[0070]
1.10 sds
‑
page检测蛋白
[0071]
取24ul纯化的蛋白(即hcv core/ns3融合蛋白)于1.5ml离心管中,按比例加入6ul的5*sds上样缓冲液,混匀后沸水煮10min。将处理好的样品取10ul上样。将电泳装置和电源
相接,120v,120min。
[0072]
从电泳装置上卸下凝胶,置于考马斯亮蓝染色液中,微波炉中加热3min,转移至脱色液中,微波炉加热直至背景清晰,观察并记录结果,见图2。
[0073]
1.11二次纯化蛋白
[0074]
使用ge公司的dextrin sepharose high performance(lot:10288766)试剂盒按照说明书进行纯化。即得纯化后的hcv core/ns3融合蛋白。
[0075]
实施例2胶体金试纸条制备
[0076]
一种胶体金试纸条,如图5所示,在基片1上依次重叠搭接有上样垫2、胶体金吸附垫3、承载膜4和吸水垫5;
[0077]
所述胶体金吸附垫3上包被胶体金标记的hcv core/ns3融合蛋白和胶体金标记的兔igg。
[0078]
所述承载膜4上设置有相间隔的检测线t和质控线c,检测线设置在靠近胶体金吸附垫3的一侧,质控线c设置在靠近吸水垫5的一侧;所述检测线t包被hcv core/ns3融合蛋白,所述质控线c包被羊兔igg。检测线t和质控线c的之间的间距为4
‑
6mm,在本实施例中选择间距为4mm。
[0079]
进一步的,上样垫2和吸水垫5上均设置有保护膜6。
[0080]
胶体金试纸条的制备方法:
[0081]
1.承载膜的制备:
[0082]
(1)选择3μm~10μm孔径的硝酸纤维素膜,根据需要将膜分切成宽度为2.0cm,长度为30.5cm的规格,备用。
[0083]
(2)用0.1m、ph 8.0的tris
‑
hcl缓冲液配制供检测线包被使用的融合蛋白,融合蛋白浓度为0.3
‑
2mg/ml,本实施例中为1mg/ml;用质量百分含量0.85%的氯化钠缓冲液配制供质控线包被使用的羊抗兔igg,使抗体浓度为0.5
‑
3mg/ml,本实施例中为2mg/ml。
[0084]
(3)选择硝酸纤维素膜的抗体包被面并作标记,将需包被的检测线和质控线的抗体(抗原)溶液平行均匀的包被在膜片上,且检测线与质控线的间距为:4.0mm,硝酸纤维素膜在2℃~30℃的恒温条件下干燥备用。
[0085]
(4)配制封闭处理浸泡液,向配液罐加入实际生产量的纯化水;分别称量缓冲液、糖份、封闭蛋白和防腐剂,将以上组分直接加入到配液罐中搅拌,直至完全溶解,加纯化水定容至所需体积,充分搅拌均匀,搅拌时间不少于10分钟,备用;其中配制的封闭处理浸泡液中含有0.1mol缓冲液、质量百分含量为0.5%的糖份、质量百分含量为1%的封闭蛋白、质量百分含量为0.05%的防腐剂,其中,缓冲液为磷酸盐缓冲液,糖份为蔗糖,防腐剂为硫柳汞,封闭蛋白为牛血清蛋白。
[0086]
(5)将包被了检测线和质控线的膜放于处理槽中,加入配好的上述(4)的封闭处理浸泡液,确保每条膜完全浸没在上述(4)的封闭处理浸泡液中30分钟,并保证膜不移动、不重叠,30分钟后将膜从处理槽中取出,将上述(4)的封闭处理浸泡液倒掉;用镊子将膜放在纱布上晾稍干,得到承载膜。
[0087]
(6)贴板干燥:撕去胶板双面胶上切割线中间的白纸,用镊子将封闭处理后的承载膜正好放在胶板中央空白位置,且胶板右边与膜右边平齐,避免在生产过程中的误差,确保显色位置相对准确,贴板时全部顶质控线一头贴,膜贴在胶板上后,隔着双面胶纸抹平膜
面,避免有气泡,控制室内的温度18~28℃、相对湿度≤40%,并保证干燥间空气能循环流通且除湿机风不会直接吹到膜面上。干燥时间≥4小时,后备用。
[0088]
2.胶体金吸附垫的制备
[0089]
(1)胶体金复溶液的配制:向配液罐加入实际生产量的纯化水;用电子分析天平称量海藻糖、牛血清白蛋白、柠檬酸三钠、聚乙二醇和nan3,直接加入到配液罐中搅拌,搅拌直至完全溶解,加纯化水定容至所需体积,充分搅拌均匀,搅拌时间大于30分钟,得到的胶体金复溶液中含有质量百分含量5%的海藻糖、质量百分含量2%的牛血清白蛋白、质量百分含量0.5%的柠檬酸三钠、质量百分含量0.05%的聚乙二醇、质量百分含量0.05%的nan3。
[0090]
(2)用量筒量取需要标记量的胶体金,按ph7.0
‑
7.3进行调节,即按体积百分含量为0.50%加入0.2mol/l的碳酸钾溶液,于磁力搅拌器上搅拌15分钟后,取融合蛋白,用双蒸水将融合蛋白进行稀释,并按10ug/ml标记胶体金(即向融合蛋白稀释液中加入胶体金后,融合蛋白的终浓度为10ug/ml),将融合蛋白加入胶体金中,于磁力搅拌器上搅拌30分钟,加入体积百分含量0.5
‰
的稳定剂聚乙二醇,搅拌30分钟后离心,收集沉淀,用胶体金复溶液按体积百分含量3%复溶,于磁力搅拌器上搅拌至混合均匀,得到体积百分含量3%的胶体金-融合蛋白结合物复溶液,备用。
[0091]
(3)用量筒量取需要标记量的胶体金,按ph7.0
‑
7.3进行调节,即按体积百分含量为0.50%加入0.2mol/l的碳酸钾溶液,于磁力搅拌器上搅拌15分钟后,取兔igg,用双蒸水将兔igg进行稀释,并按20ug/ml标记胶体金,将兔igg加入胶体金中,于磁力搅拌器上搅拌30分钟,加入体积百分含量0.5
‰
的稳定剂聚乙二醇,搅拌30分钟后离心,收集沉淀,用胶体金复溶液按体积百分含量3%复溶,于磁力搅拌器上搅拌至混合均匀,得到体积百分含量3%的胶体金-兔igg结合物复溶液,备用。
[0092]
(4)取上述(2)和(3)中体积百分含量3%的胶体金-融合蛋白结合物复溶液和胶体金-兔igg抗体结合物复溶液,用胶体金复溶液按体积百分含量50%进行复溶,于磁力搅拌器上混合均匀,按照50μl/cm2浇制在准备好的胶体金吸附垫上,置于干燥室晾干≥4个小时,干燥室控制温度18
‑
28℃,相对湿度≤40%,保证空气畅通且气流不能直接吹于胶体金吸附垫上,将干燥好的胶体金吸附垫放入到装有干燥剂的铝箔袋中,密封保存,做好标记胶体金吸附垫,备用。
[0093]
注:胶体金为浇制,是因为浇制的胶体金可以自由的裁切宽度,从而方便调节产品的深浅显色。
[0094]
3.组装及裁切:
[0095]
(1)取已粘贴承载膜的透明基片半成品,将试纸条胶体金吸附垫按0.5cm宽度裁切成0.5cm
×
30cm的条状后粘贴在靠近检测线一侧的透明基片上,并保持与承载膜呈搭接约1mm,将试纸条吸水垫复合在靠近质控线一侧的透明基片上并与承载膜搭接约1mm,将试纸条上样垫复合在试纸条胶体金吸附垫远离承载膜的一端并与其搭接约1mm,做好标记,备用;
[0096]
(2)将已组装备用的基片,切割成条状试纸备用。
[0097]
实施例3用胶体金试纸条检测丙肝
[0098]
取阴性标本1000份(来自河南省疾病预防控制中心、中国人民解放军第三0二医院和苏北人民医院),采用实施例2所制备的胶体金试纸检测,结果显示阴性符合率大于95%,
图3为部分阴性标本检测结果。
[0099]
取阳性标本100份(来自河南省疾病预防控制中心、中国人民解放军第三0二医院和苏北人民医院),采用实施例2所制备的胶体金试纸检测。阳性检出率大于96%,图4为部分阳性标本检测结果。
[0100]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1