一种基于亚甲基氮杂环丙烷合成羟基丙酮酯类化合物的方法
biomolecular chemistry, 2016, 1
‑
4. );以及张培成等报道的使用碘化钾作为催化剂,1,2
‑
二溴乙烷介导的合成方法(chinese chemical letters, 2019, 59: 5331
‑
5337. )。
6.上述方法以酮为原料,需要采用含碘化合物作为催化剂,还需要加入氧化剂或卤代试剂,增加副反应,并会造成环境污染,且反应温度通常较高。
技术实现要素:
7.针对现有技术存在的不足,本发明提供一种羟基丙酮酯类化合物的合成方法,实现以下发明目的:避免使用到剧毒金属催化剂、强氧化剂、卤代试剂;降低反应温度;提高反应收率。
8.本发明采用的技术方案为:一种基于亚甲基氮杂环丙烷合成羟基丙酮酯类化合物的方法,以n
‑
取代亚甲基氮杂环丙烷、羧酸、水为原料合成羟基丙酮酯类化合物。
9.以下是对上述技术方案的进一步改进:所述n
‑
取代亚甲基氮杂环丙烷为n
‑
苄基
‑2‑
亚甲基氮杂环丙烷、1
‑
(2,2
‑
二甲氧基乙基)
‑2‑
亚甲基氮杂环丙烷、n
‑
异丙基
‑2‑
亚甲基氮杂环丙烷中的一种。
10.所述羧酸为3
‑
苯基丙炔酸、3
‑
萘基丙炔酸、对甲基苯丙炔酸、对氟苯丙炔酸、丁炔酸、肉桂酸、2
‑
呋喃丙烯酸中的一种。
11.所述 n
‑
取代亚甲基氮杂环丙烷与羧酸的摩尔比为(1.25
‑
10):1;n
‑
取代亚甲基氮杂环丙烷与水的摩尔比为1:(0.6
‑
10)。
12.所述方法为加入n
‑
取代亚甲基氮杂环丙烷、羧酸、水和溶剂,于室温条件下反应24
‑
48小时,反应结束后,去除溶剂,纯化得到产物;所述纯化方法为将去除溶剂后的残余物进行硅胶柱层析,以石油醚:乙酸乙酯=10:1(体积比)的洗脱剂冲洗柱子,得到产物。
13.所述溶剂为乙醇、四氢呋喃、乙腈、二氯甲烷中的一种。
14.所述n
‑
取代亚甲基氮杂环丙烷与溶剂的摩尔体积比为1 mmol:(0
‑
3)ml。
15.所述羟基丙酮酯类化合物为2
‑
氧丙基
‑3‑
苯基丙炔酸酯、2
‑
氧丙基
‑3‑
萘基丙炔酸酯、2
‑
氧丙基
‑3‑
对甲基苯基丙炔酸酯、2
‑
氧丙基
‑3‑
对氟苯基丙炔酸酯、丁炔酸2
‑
氧丙酯、2
‑
氧丙基
‑3‑
苯丙烯酸酯、2
‑
氧丙基
‑3‑
呋喃丙烯酸酯。
16.上述技术方案基础上,根据原料的水溶性不同,可以分为加入溶剂或不加入溶剂两种情形。
17.当加入溶剂时:n
‑
取代亚甲基氮杂环丙烷与水的摩尔比为1:(0.6
‑
1);n
‑
取代亚甲基氮杂环丙烷与溶剂的摩尔体积比为1 mmol:(1
‑
3)ml。
18.当不加入溶剂时:通过加入过量的水,一部分水参加反应,一部分水作为溶剂,需要限定n
‑
取代亚甲基氮杂环丙烷为n
‑
苄基
‑2‑
亚甲基氮杂环丙烷,n
‑
取代亚甲基氮杂环丙烷与水的摩尔比为1:10。
19.上述方案可以实现产物的收率为70
‑
95%。
20.进一步优选的方案如下:
所述n
‑
取代亚甲基氮杂环丙烷为n
‑
苄基
‑2‑
亚甲基氮杂环丙烷、n
‑
异丙基
‑2‑
亚甲基氮杂环丙烷中的一种。
21.所述羧酸为肉桂酸、2
‑
呋喃丙烯酸中的一种。
22.所述 n
‑
取代亚甲基氮杂环丙烷与羧酸的摩尔比为1.25:1;n
‑
取代亚甲基氮杂环丙烷与水的摩尔比为1:(0.8
‑
1)。
23.所述方法为加入n
‑
取代亚甲基氮杂环丙烷、羧酸、水和溶剂,于室温条件下反应48小时,反应结束后,去除溶剂,纯化得到产物;所述纯化方法为将去除溶剂后的残余物进行硅胶柱层析,以石油醚:乙酸乙酯=10:1(体积比)的洗脱剂冲洗柱子,得到产物。
24.所述溶剂为二氯甲烷。
25.所述n
‑
取代亚甲基氮杂环丙烷与溶剂的摩尔体积比为1 mmol: 3ml。
26.所述产物为2
‑
氧丙基
‑3‑
苯丙烯酸酯、2
‑
氧丙基
‑3‑
呋喃丙烯酸酯。
27.上述优选的技术方案可以实现产物的收率为90
‑
95%。
28.n
‑
取代亚甲基氮杂环丙烷是一种化学性质丰富,但是相对稳定存在的三元环状化合物,本发明采用n
‑
取代亚甲基氮杂环丙烷,羧酸和水在室温环境下,发生开环水解反应,得到羟基丙酮酯类化合物。
29.本发明取得的有益效果如下:本发明所述羟基丙酮酯类化合物的合成方法,以n
‑
取代亚甲基氮杂环丙烷为原料,避免使用到剧毒金属催化剂、强氧化剂、卤代试剂,在室温下即可反应,制备的羟基丙酮酯类化合物,收率为70
‑
95%。
附图说明
30.图1为实施例1制备的3a的1h nmr图;图2为实施例1制备的3a的13c nmr图;图3为实施例2制备的3b的1h nmr图;图4为实施例2制备的3b的13c nmr图;图5为实施例3制备的3c的1h nmr图;图6为实施例3制备的3c的13c nmr图;图7为实施例4制备的3d的1h nmr图;图8为实施例4制备的3d的13c nmr图;图9为实施例5制备的3e的1h nmr图;图10为实施例5制备的3e的13c nmr图;图11为实施例6制备的3f的1h nmr图;图12为实施例6制备的3f的13c nmr图;图13为实施例7制备的3g的1h nmr图;图14为实施例7制备的3g的13c nmr图。
具体实施方式
31.实施例1
于10ml反应管中进行反应,加入0.6mmol 的n
‑
苄基
‑2‑
亚甲基氮杂环丙烷(1a),0.4mmol的3
‑
苯基丙炔酸(2a),0.6mmol 的水,加入0.6ml乙醇,于25℃下反应24h。反应结束后用旋转蒸发仪抽干溶剂,残余物进行硅胶柱层析,以石油醚:乙酸乙酯=10:1(体积比)的洗脱剂冲洗柱子,得到产物2
‑
氧丙基
‑3‑
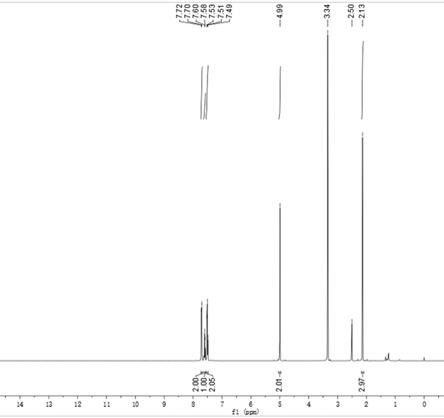
苯基丙炔酸酯(3a),分离收率为85%。产物的状态为白色固体。
[0032]1h nmr (300 mhz, dmso
‑
d6) δ= 7.77 (d, j = 16.0 hz, 1h), 7.57
ꢀ–ꢀ
7.50 (m, 2h), 7.44
ꢀ–ꢀ
7.31 (m, 3h), 4.99 (s, 2h), 2.13 (s, 3h); 13
c nmr (300 mhz, dmso
‑
d6) δ = 200.37, 165.38; hrms calcd for c
12
h
10
o
3 [m+h]
+ 202.0630; found 202.0627。
[0033]
实施例2于10ml反应管中进行反应,加入0.6mmol 的1
‑
(2,2
‑
二甲氧基乙基)
‑2‑
亚甲基氮杂环丙烷(1b), 0.3mmol的3
‑
萘基丙炔酸(2b), 0.4mmol 的水,加入1ml四氢呋喃,于25℃下反应48h。反应结束后用旋转蒸发仪抽干溶剂,残余物进行硅胶柱层析,以石油醚:乙酸乙酯=10:1(体积比)的洗脱剂冲洗柱子,得到产物2
‑
氧丙基
‑3‑
萘基丙炔酸酯(3b),分离收率为75%,产物状态为无色油状物。
[0034] 1
h nmr (400 mhz, dmso
‑
d6) δ = 8.43 (s, 1h), 8.02 (t, j = 8.8 hz, 3h), 7.71
ꢀ–ꢀ
7.61 (m, 3h), 5.02 (s, 2h), 2.15 (s, 3h); 13
c nmr (101 mhz, dmso
‑
d6) δ = 201.20, 152.80, 134.88, 134.08, 132.72, 129.30, 128.96, 128.72, 128.38, 128.35, 127.82, 115.87, 87.73, 80.66, 70.07, 26.30; hrms calcd for c
16
h
12
o
3 [m+na]
+ 275.0786; found 275.0672。
[0035]
实施例3于10ml反应管中进行反应,加入1 mmol 的n
‑
苄基
‑2‑
亚甲基氮杂环丙烷(1a), 0.1mmol的对甲基苯丙炔酸(2c),1 mmol 的水,加入3ml乙腈,于25℃下反应48h。反应结束后用旋转蒸发仪抽干溶剂,残余物进行硅胶柱层析,以石油醚:乙酸乙酯=10:1(体积比)的洗脱剂冲洗柱子,得到产物2
‑
氧丙基
‑3‑
对甲基苯基丙炔酸酯(3c),分离收率为80%。产物状态为无色油状物。
[0036]1h nmr (400 mhz, cdcl3) δ = 7.51 (d, j = 7.9 hz, 2h), 7.20 (d, j = 7.9 hz, 2h), 4.78 (s, 2h), 2.39 (s, 3h), 2.22 (s, 3h); 13
c nmr (101 mhz, cdcl3) δ = 200.70, 153.25, 141.72, 133.18, 129.44, 116.16, 88.77, 79.49, 77.35, 77.03, 76.71, 69.11, 26.15, 21.78; hrms calcd for c
13
h
12
o
3 [m+na]
+ 239.0786; found 239.0669。
[0037]
实施例4于10ml反应管中进行反应,加入0.6 mmol 的n
‑
苄基
‑2‑
亚甲基氮杂环丙烷(1a), 0.4mmol的对氟苯丙炔酸(2d),6mmol水,于25℃下反应24h。反应结束后用旋转蒸发仪抽干溶剂,残余物进行硅胶柱层析,以石油醚:乙酸乙酯=10:1(体积比)的洗脱剂冲洗柱子,得到产物2
‑
氧丙基
‑3‑
对氟苯基丙炔酸酯(3d),分离收率为75%。产物为无色油状物。
[0038]1h nmr (400 mhz, cdcl3) δ = 7.62 (dd, j = 7.8, 5.6 hz, 2h), 7.09 (t, j = 8.4 hz, 2h), 4.80 (s, 2h), 2.22 (s, 3h); 13
c nmr (101 mhz, cdcl3) δ = 200.38, 165.37, 162.85, 153.00, 135.51, 135.42, 116.35, 116.13, 87.06, 79.72, 69.15, 26.11; hrms calcd for c
12
h9fo
3 [m+h]
+ 221.0536; found 221.0681。
[0039]
实施例5于10ml反应管中进行反应,加入1.0 mmol 的n
‑
苄基
‑2‑
亚甲基氮杂环丙烷(1a), 0.5mmol的丁炔酸(2e),0.6mmol 的水,加入2ml四氢呋喃,于25℃下反应24h。反应结束后用旋转蒸发仪抽干溶剂,残余物进行硅胶柱层析,以石油醚:乙酸乙酯=10:1(体积比)的洗脱剂冲洗柱子,得到产物丁炔酸2
‑
氧丙酯(3e),分离收率为70%。产物状态为黄色油状物。
[0040]1h nmr (400 mhz, cdcl3) δ = 4.71 (s, 2h), 2.19 (s, 3h), 2.03 (s, 3h); 13
c nmr (101 mhz, cdcl3) δ = 200.60, 152.72, 87.62, 71.61, 68.95, 26.07, 3.91; hrms calcd for c7h8o
3 [m+na]
+ 163.0473; found 163.0272。
[0041]
实施例6于10ml反应管中进行反应,加入1.0 mmol 的n
‑
异丙基
‑2‑
亚甲基氮杂环丙烷(1c), 0.8mmol的肉桂酸(2f),1.0 mmol 的水,加入3ml二氯甲烷,于25℃下反应48h。反应结束后用旋转蒸发仪抽干溶剂,残余物进行硅胶柱层析,以石油醚:乙酸乙酯=10:1(体积比)的洗脱剂冲洗柱子,得到产物2
‑
氧丙基
‑3‑
苯丙烯酸酯(3f),分离收率为95%。产物状态
为黄色油状物。
[0042]1h nmr (400 mhz, cdcl3) δ = 7.80 (d, 1h), 7.54 (m, 2h),7.40 (m, 3h), 6.52 (d, 1h), 4.78 (s, 2h), 2.21 (s, 3h); 13
c nmr (101 mhz, cdcl3) δ = 201.90, 166.11, 146.30, 134.15, 130.64, 128.96, 128.27, 117.79, 68.42, 26.18; hrms calcd for c7h8o3 [m+na]+ 163.0473; found 163.0272。
[0043]
实施例7于10ml反应管中进行反应,加入1.0 mmol 的n
‑
苄基
‑2‑
亚甲基氮杂环丙烷(1a),0.8mmol的2
‑
呋喃丙烯酸(2g), 0.8 mmol 的水,加入3ml二氯甲烷,于25℃下反应48h。反应结束后用旋转蒸发仪抽干溶剂,残余物进行硅胶柱层析,以石油醚:乙酸乙酯=10:1(体积比)的洗脱剂冲洗柱子,得到产物2
‑
氧丙基
‑3‑
呋喃丙烯酸酯(3g),分离收率为90%。产物状态为黄色油状物。
[0044]1h nmr (400 mhz, cdcl3) 1h nmr (cdcl3, δ): 7.48 (d, 1h), 7.47
–
7.48 (m, 1h), 6.63 (d, 1h), 6.46 (dd, 1h), 6.37 (d, 1h), 4.73 (s, 2h), 2.17 (s, 3h); 13
c nmr (101 mhz, cdcl3) δ = 202.1, 166.2, 150.8, 145.2, 132.4, 115.6, 114.4, 112.5, 68.4, 26.2; hrms calcd for c
10
h
10
o
4 [m+h]
+ 195.0579; found 195.0572。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1