靶向间皮素的纳米抗体、嵌合抗原受体及其应用的制作方法
1.本技术涉及生物医药领域,具体涉及一种靶向间皮素的纳米抗体、嵌合抗原受体及其应用。
背景技术:
2.间皮素(mesothelin,meso)是一种细胞表面糖蛋白,在正常组织中很少表达,但是在间皮瘤、肺癌、胰腺癌、乳腺癌、卵巢癌等肿瘤中均有高表达,因此间皮素有可能成为癌症治疗的重要靶点。
3.目前针对间皮素为靶点的抗癌药物多是以抗体类药物为主,少数有报道car-t(嵌合抗原受体t细胞)疗法。然而,靶向meso的抗体类药物的临床治疗效果有限,靶向meso的car-t所用的单链抗体(即,scfv)基本上都是含有重链可变区和轻链可变区的小鼠来源抗体,对嵌合抗原受体的表达和稳定不利,同时在体内易引起免疫原性,治疗效果不佳。
技术实现要素:
4.为解决上述技术问题,本技术提供了一种含靶向间皮素的纳米抗体的嵌合抗原受体及car-t细胞,该纳米抗体作为间皮素识别点,其不含轻链可变区,易在car-t细胞表面稳定表达,且使car-t细胞具有较小的免疫原性,提高治疗效果和安全性。
5.具体地,第一方面,本技术提供了一种靶向间皮素的纳米抗体,所述靶向间皮素的纳米抗体包括如seq id no:1所示的氨基酸序列。
6.可选地,所述靶向间皮素的纳米抗体的编码基因包括如seq id no:2所示的核苷酸序列。该纳米抗体的编码基因应该考虑简并碱基,即如seq id no:1所示的氨基酸序列的编码基因也可以包括与seq id no:2具有碱基简并性质的核苷酸序列,这些核苷酸序列对应的氨基酸序列仍然为seq id no:1。
7.本技术第一方面提供的靶向间皮素的纳米抗体(简称为vhh)较小,该纳米抗体不含轻链可变区,不会像人工改造的单链抗体片段那样容易相互粘连甚至聚集成块,因此,其结构稳定性高,且其与间皮素的结合活性较高,对人的免疫原性较弱。
8.该纳米抗体可应用到过表达间皮素的阳性肿瘤的诊断、治疗领域等。具体地,该纳米抗体可以以本技术下文所述的嵌合抗原受体形式使用;还可以用作抗体类治疗/检测药物,如单独使用或者包被在脂质体等递送系统中,也可以多价抗体、融合型纳米抗体(如与牛血清白蛋白、igg-fc、阿霉素等结合形成新的融合分子)等形式使用。
9.第二方面,本技术提供了一种靶向间皮素的嵌合抗原受体(简写为“car-meso”),包括顺次连接的靶向间皮素的纳米抗体、胞外铰链区、跨膜区和胞内信号区,其中,所述靶向间皮素的纳米抗体如本技术第一方面所述。
10.上述“顺次连接”可以理解为:所述靶向间皮素的纳米抗体的氨基酸序列的羧基端与所述胞外铰链区的氨基酸序列的氨基端相连,胞外铰链区的氨基酸序列的羧基端与所述跨膜区的氨基酸序列的氨基端相连,所述跨膜区的氨基酸序列的羧基端与所述胞内信号区
no:6与seq id no:4相比,多了信号肽的苷酸序列。
18.其中,信号肽的编码基因可较好地指导嵌合抗原受体car-meso表达到细胞表面,但在car-meso表达到t细胞表面时,信号肽在蛋白翻译成熟过程中被信号肽酶切割。因此,在翻译成的car-meso的氨基酸序列(seq id no:3)中并未带有信号肽的氨基酸序列。
19.可选地,所述信号肽的氨基酸序列包括如seq id no:15所示的氨基酸序列。考虑到编码基因的碱基简并性质,所述信号肽的编码基因不限于包括如seq id no:16所示的核苷酸序列。
20.本技术第二方面提供的靶向间皮素的嵌合抗原受体car-meso可以专一性地靶向表达间皮素抗原的肿瘤细胞,在其与间皮素抗原结合后,可以使t细胞的胞内信号区被激活,促进t细胞在患者体内的扩增,并高效且特异性地杀伤肿瘤细胞,而对正常细胞几乎不会造成损伤,从而实现较好的肿瘤治疗效果。
21.第三方面,本技术提供了一种靶向间皮素的嵌合抗原受体t细胞,其表面表达如第二方面所述的靶向间皮素的嵌合抗原受体car-meso。
22.该靶向间皮素的嵌合抗原受体t细胞可以专一性地靶向表达间皮素的肿瘤细胞,在car-meso与肿瘤上的meso结合后,该car-t细胞的胞内信号区被激活,促进其在患者体内的扩增,长效持久地发挥高效且特异性杀伤肿瘤细胞的能力,而对正常细胞几乎不会造成损伤。
23.第四方面,本技术提供了一种重组载体,该重组载体包括如第二方面所述的靶向间皮素的嵌合抗原受体car-meso的编码基因。
24.如上所述,该重组载体携带的编码基因包括从5’端到3’端顺次连接的信号肽的编码基因、靶向间皮素的纳米抗体的编码基因、胞外铰链区的编码基因、跨膜区的编码基因、胞内信号区的编码基因。可选地,该重组载体携带有如seq id no:5所示的氨基酸序列所对应的核苷酸序列。进一步可选地,该car-meso的编码基因包括seq id no:6所示的核苷酸序列。
25.可选地,所述重组载体中的载体为病毒载体和非病毒载体中的至少一种。其中,非病毒载体包括质粒载体和噬菌体载体。具体地,所述质粒载体可以但不限于为真核质粒载体、原核质粒载体、微环dna、转座子等。其中,所述病毒载体包括慢病毒载体、腺病毒载体或逆转录病毒载体。优选为慢病毒载体,例如pcdh质粒、pwpxld载体、plex-mcs载体、psico载体和pcgpv载体中的至少一个,但不限于此。
26.本技术第四方面提供的重组载体安全高效,可以稳定高效地将car-meso的编码基因导入宿主细胞中或复制,并可以用于制备靶向间皮素的嵌合抗原受体t细胞,使所述t细胞持续、稳定地发挥靶向、杀伤效力。
27.第五方面,本技术提供了一种靶向间皮素的嵌合抗原受体t细胞的制备方法,包括:
28.(1)提供靶向间皮素的嵌合抗原受体的编码基因,包括从5’端到3’端顺次连接的信号肽的编码基因、靶向间皮素的纳米抗体的编码基因、胞外铰链区的编码基因、跨膜区的编码基因、胞内信号区的编码基因,其中,所述靶向间皮素的纳米抗体的编码基因包括如seq id no:1所示的氨基酸序列所对应的核苷酸序列;
29.(2)将所述靶向间皮素的嵌合抗原受体的编码基因插入到基因传递载体中,得到
重组基因传递载体;
30.(3)将所述重组基因传递载体进行包装并转染宿主细胞,得到重组慢病毒;
31.(4)将所述重组慢病毒转染cd3阳性t淋巴细胞,获得靶向间皮素的嵌合抗原受体t细胞。
32.步骤(2)中,所述基因传递载体可以为质粒载体,例如为pcdh质粒。该pcdh质粒可接上延伸因子1α(ef1α),以作为car-meso编码基因转录的启动子。可以理解的,car-meso的编码基因应位于pcdh载体的ef1α之后。car-meso的编码基因插入到基因传递载体中时,其5’端可加入起始密码子(如atg)与ef1α相连,3’端可加入终止密码子(如taa)。
33.可选地,步骤(3)中,将所述重组基因传递载体进行包装并转染宿主细胞,得到重组慢病毒,包括:将所述重组基因传递载体与包膜质粒和包装质粒共同转染宿主细胞,得到所述重组慢病毒。其中,宿主细胞用于组装重组慢病毒,使其具有感染性。可选地,所述宿主细胞可以包括hek293t细胞、293细胞、293t细胞、293ft细胞、sw480细胞、u87mg细胞、hos细胞、cos1细胞或cos7细胞等,但不限于此。进一步可选地,所述宿主细胞为hek293t细胞。
34.所述重组慢病毒的包装可采用三质粒系统或四质粒系统,包膜质粒、包装质粒为本领域常用的物质。可以理解的,包膜质粒、包装质粒与上述基因传递载体的质粒不同。可选地,所述包装质粒为pmdlg/prre和prsv-rev。所述包膜质粒可以编码水疱性口炎病毒糖蛋白(vsv-g)衣壳,该vsv-g衣壳可协助重组慢病毒向细胞膜粘附,并保持重组慢病毒的感染性。可选地,所述包膜质粒可以为pmd2g。可选地,所述包装质粒为pmdlg/prre和prsv-rev。
35.可选地,步骤(4)中,所述cd3阳性t淋巴细胞是从人源外周血单个核细胞(pbmc)中分离获得。优选地,该pbmc可以来自于癌症患者,这样制得的car-t细胞在回输给患者时可具有较低的免疫反应。其中,所述人源外周血单个核细胞来源于自体静脉血、自体骨髓、脐带血和胎盘血等。进一步可选地,来源于癌症患者手术一个月后、放化疗一个月后采集的新鲜外周血或骨髓。
36.具体地,所述cd3阳性t淋巴细胞的获得过程如下:向外周血单个核细胞中按一定比例加入cd3/cd28免疫磁珠,孵育一段时间后,放入磁铁进行筛选,得到免疫磁珠包被的cd3阳性t淋巴细胞,去除磁珠后,获得cd3阳性t淋巴细胞。
37.第六方面,本技术提供了如第一方面所述的靶向间皮素的纳米抗体、如第二方面所述的靶向间皮素的嵌合抗原受体、如第三方面所述的或如第五方面所述的制备方法制得的靶向间皮素的嵌合抗原受体t细胞、如第四方面所述的重组载体在制备诊断和/或治疗过表达间皮素的恶性肿瘤的药物中的应用。
38.在本技术一实施方式中,诊断和/或治疗恶性肿瘤的药物包括靶向间皮素的嵌合抗原受体t细胞。该t细胞可以通过静脉注射、皮下注射、肿瘤原位注射等方式输入患者,且能达到良好的治疗效果。
39.其中,所述恶性肿瘤为过表达间皮素的肿瘤,如间皮瘤、肺癌、胰腺癌、胸腺癌、食道癌、胃癌、胆管癌、子宫内膜癌,乳腺癌、卵巢癌等。
附图说明
40.图1为本技术实施例提供的带car-meso编码基因的重组慢病毒感染t细胞后表达
嵌合抗原受体car-meso的阳性率流式检测结果图。
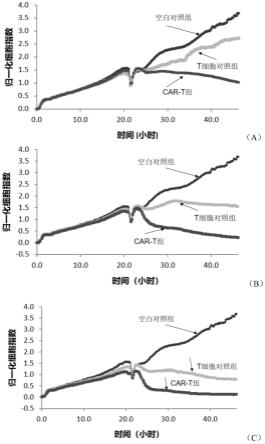
41.图2为本技术实施例提供的靶向间皮素的car-t细胞在体外以不同e:t比杀伤mda-231癌细胞46h后的效果图;其中,(a)中e:t=2.5,(b)中e:t=7,(c)中e:t=20。
具体实施方式
42.以下所述是本技术的示例性实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本技术的保护范围。
43.实施例1
44.靶向间皮素的car-t细胞的制备,具体包括以下步骤:
45.(1)制备靶向间皮素的嵌合抗原受体car-meso的基因序列
46.分别制备信号肽、靶向间皮素的纳米抗体、cd8α铰链区、cd8跨膜区、4-1bb信号区和cd3ζ信号区的编码基因,通过pcr的方法将上述信号肽、靶向间皮素的纳米抗体、cd8α铰链区、cd8跨膜区、4-1bb信号区和cd3ζ信号区的编码基因依次从5’端到3’端连接到一起,得到car-meso的编码基因,该car-meso的编码基因如seq id no:6所示。
47.(2)构建含car-meso编码基因的pcdh重组质粒
48.将上述car-meso的编码基因插入到pcdh载体中,且位于该载体的延伸因子1α(ef1α)之后。car-meso的编码基因插入到pcdh载体时,car-meso的编码基因的5’端可加入起始密码子(如atg),3’端可加入终止密码子(如taa)。然后转入大肠杆菌感受态细胞dh5α,进行阳性克隆pcr鉴定和测序鉴定。经过pcr产物凝胶电泳检测和测序鉴定符合目的片段大小和序列,成功构建pcdh重组质粒-即,重组表达质粒。
49.(3)重组慢病毒构建
50.将上述获得的含car-meso的pcdh重组质粒与包膜质粒pmd2g、包装质粒(pmdlg/prre和prsv-rev)三者通过脂质体转染试剂lipofectamine3000共转染培养好的hek293t细胞,48小时后离心收获重组慢病毒。
51.(4)靶向间皮素的car-t细胞的制备
52.a)pbmc(外周血单个核细胞)的分离
53.pbmc来源于自体静脉血、自体骨髓、脐带血和胎盘血等。最好是来源于癌症患者手术一个月后、放化疗一个月后采集的新鲜外周血或骨髓。
54.抽取病人血液,送样至血液分离室;采集外周血单个核细胞,ficoll离心分离后取中间层细胞;经pbs洗涤后,得到pbmc。
55.b)免疫磁珠法分离抗原特异性t淋巴细胞
56.取上述pbmc,加入不含血清的基础培养基,配成细胞悬液;按磁珠与细胞的比例为1:1,加入cd3/cd28免疫磁珠,室温孵1-2h;采用磁铁对孵育好磁珠的细胞进行筛选;pbs洗涤,去除免疫磁珠后,得到cd3阳性t淋巴细胞。
57.c)病毒转染法制备抗原特异性t淋巴细胞
58.采用上述步骤(3)中的重组慢病毒对b)中经免疫磁珠分离法得到的cd3阳性t淋巴细胞进行共培养,培养的第3天,进行细胞计数和换液,调整细胞浓度为1
×
106个/ml,接种,培养;培养的第5天,观察细胞状态,如果细胞密度增大,则稀释细胞浓度为1
×
106个/ml,检
测细胞活性,继续培养。扩增培养到第9-11天,收集细胞,同时经过流式细胞仪检测靶向间皮素的嵌合抗原受体car-meso的表达,结果如图1所示。
59.经检测,经上述重组慢病毒感染的t细胞中,car-meso的阳性率约为50.47%。这表明成功制得得到靶向间皮素的car-t细胞,并保存在回输专用的细胞冻存液中,以供患者回输用。
60.为了评估本技术所描述的上述方法制备的靶向间皮素的car-t细胞在杀伤肿瘤细胞方面的效果,进行如下效果实施例。
61.体外杀伤效果评价:
62.采用实时细胞分析仪(xcelligence rtca sp)进行肿瘤细胞杀伤实验。首先在该仪器配套的e-plate 96孔板中加入5000个过表达间皮素的靶细胞(具体为人乳腺癌细胞mda-231)的完全培养基进行培养,培养24小时后,按照不同效靶比(e:t)分别加入相应数量的meso car-t细胞(car-t组)作为效应细胞,并以单纯的培养基作为空白对照,以只经磁珠刺激未加病毒感染的t细胞(简写为utd细胞,即,实施例1步骤(4)的(b)中cd3阳性t淋巴细胞)作为t细胞对照组,随后共培养一段时间(≥24小时)。使用实时细胞分析仪的细胞指数(cell index,ci)值对细胞杀伤效果进行分析,结果如图2所示。
63.图2为本技术实施例提供的靶向间皮素的car-t细胞在体外以不同e:t比杀伤mda-231癌细胞46h后的效果图。其中,(a)中e:t=2.5,(b)中e:t=7,(c)中e:t=20。
64.从图2可以明显看出,本技术提供的靶向间皮素的car-t细胞对过表达间皮素的癌细胞具有非常强的杀伤能力,且杀伤能力远远高于阴性对照组和空白对照组,这表明本技术提供的靶向间皮素的car-t细胞在制备治疗过表达间皮素的恶性肿瘤的药物中具有非常可观的应用前景。
65.以上实施例仅表达了本技术的示例性实施方式,其描述较为具体和详细,但并不能因此而理解为对本技术专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本技术构思的前提下,还可以做出若干变形和改进,这些都属于本技术的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1