一种幽门螺杆菌CD4
一种幽门螺杆菌cd4
+
t细胞耐受多肽融合抗原及其应用
技术领域
1.本发明涉及一种幽门螺杆菌cd4
+
t细胞耐受多肽融合抗原及其制备的多克隆抗体牛乳。
背景技术:
2.幽门螺杆菌(helicobacter pylori,hp)是一种伴随人类进化的革兰阴性细菌。目前对于hp的治疗主要是用一种质子泵结合二种或三种抗生素的联合疗法。对抗菌药物耐药的增加、复发感染和高治疗费用等原因限制了对hp的治疗。防治hp感染仍缺乏理想对策。
3.幽门螺杆菌感染可引起全身和局部胃粘膜的免疫反应。通常先是招募中性粒细胞进入胃粘膜幽门螺杆菌感染部位,如果中性粒细胞不能及时清除幽门螺杆菌,胃粘膜中的树突状细胞将被激活,然后招募b细胞至胃粘膜幽门螺杆菌感染部位,如果b细胞反应还不足以清除幽门螺杆菌,将会招募cd4
+
t和cd8
+
t细胞至胃组织感染部位。活化的cd4
+
t分泌ifn-γ和il-2将分别活化巨噬细胞和cd8
+
t细胞,活化的巨噬细胞和cd8
+
t细胞可以有效清除粘膜下的微小菌落、生物被膜以及在躲在细胞间隙静止的球形幽门螺杆菌和细胞内的细菌;同时活化的cd4
+
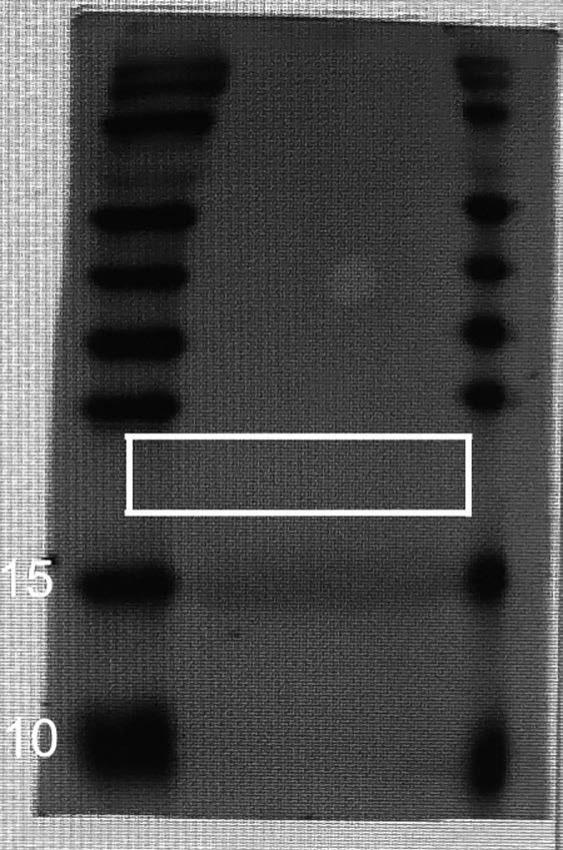
t也可以增强和扩大b细胞的免疫反应来清除幽门螺杆菌。
4.研究中发现,hp能够长期寄生于胃内不易被机体免疫系统清除的原因是人类对其表现出“先天耐受性”。也就是hp感染存在母胎垂直传播和中枢免疫耐受,即母亲怀孕合并hp感染,hp抗原物质经血液-胎盘传播给胚胎,导致子代在发育中形成对hp的中枢免疫耐受,由此导致人群中不断有新生代成为hp的易感个体。原因有以下几点:(1)hp能够释放含有生物活性物质的外膜囊泡(outer membrane vesicle,omv),大小介于20-400nm之间,可经血液循环远距离传播并能跨血-胎盘屏障传递。
5.(2)孕期合并感染hp者占孕妇人数的25-62%,平均46%。
6.(3)孕期感染hp对胎盘有损伤作用,母体感染hp可以引起胎儿发育不足、畸形,甚至死胎流产。andreas kyburz等报道,围产期暴露hp,可以影响子代调节性t细胞的发育,能够降低子代呼吸道过敏性疾病的发生率。
7.(4)我们从hp培养液中提取到hp的omv,经荧光探针标记后注射到孕鼠体内,利用动物整体成像技术观察发现,被标记的omv在胎鼠体内显影成像,证实hp的omv能够通过胎盘屏障,说明孕期母体内hp产生的omv,通过血液并能跨胎盘屏障传递至胚胎体内。
8.因此,omv内容物可以介导子代cd4
+
t细胞发生选择性凋亡,不能有效刺激b细胞和cd8
+
t细胞和巨噬细胞的免疫反应,从而导致子代对幽门螺杆菌表现先天性耐受而不容易清除。
技术实现要素:
9.本发明的目的是提供一种能有效打破免疫耐受、治疗幽门螺杆菌感染的幽门螺杆菌cd4
+
t细胞耐受多肽融合抗原及其制备的多克隆抗体牛乳。
10.本发明采用如下技术方案:
一种幽门螺杆菌cd4
+
t细胞耐受多肽融合抗原,其包括如seq id no.1所示氨基酸序列。
11.具体为:dprvpssyvtqcggnangqkstssttifnnepgyrgpgpgehmdmlmvchhldksikedvqfadsrgpgpgnlvvntgkvkqtfnmgmrflkklyfpsyaqflnlaphfvikkkrayrpfqwggpgpginvssqtflkgmsnassrtvldsaaqkk。
12.一种编码上述幽门螺杆菌cd4
+
t细胞耐受多肽融合抗原的核酸分子。
13.一种包含上述核酸分子的载体。
14.一种利用上述幽门螺杆菌cd4
+
t细胞耐受多肽融合抗原制备的多克隆抗体。
15.上述多克隆抗体,用于对有幽门螺杆菌天然免疫耐受存在的感染者的治疗。
16.一种利用上述幽门螺杆菌cd4
+
t细胞耐受多肽融合抗原制备的疫苗。
17.上述疫苗,用于对有幽门螺杆菌天然免疫耐受存在的人群预防幽门螺杆菌感染。
18.上述幽门螺杆菌cd4
+
t细胞耐受多肽融合抗原或疫苗,用于刺激宿主奶牛的免疫应答反应。
19.上述幽门螺杆菌cd4
+
t细胞耐受多肽融合抗原或疫苗,用于生产多克隆抗体牛乳。
20.本发明的有益效果在于:本发明通过制备出幽门螺杆菌cd4
+
t细胞耐受多肽融合抗原,可以通过开发的被动免疫产品,提高机体对幽门螺杆菌的清除能力,用于预防和治疗幽门螺杆菌感染。
附图说明
21.图1为从dc细胞洗脱下来的多肽质谱鉴定图。
22.图2为wb鉴定融合多肽的表达。
23.图3为融合多肽的质谱鉴定图。
具体实施方式
24.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
25.(一)hp的培养将ss1 hp种在含糊精的脑浸心肉汤中(5mg/l trimethoprim、5mg/l polymixin-b、5mg/l amphoteracin-b、10mg/l vancomucin),置三气培养箱(10% co2、85% n2、5% o2),温度37℃下,120转/分,振荡培养3~10天。
26.(二)粗提hp的omv将培养至对数生长期的hp菌液10000
×
g离心10min,收集上清,用0.22μm的滤菌器过滤,用截留相对分子质量约100kd的超滤离心管浓缩至原体积的1/6,收集液体,39000
×
g离心60 min,弃去上清,将沉淀重悬于180μl,50mmol/l的hepse缓冲液(4-羟乙基哌嗪乙磺酸,n-(2-羟乙基)哌嗪-n-2-乙烷磺酸,ph6.8)中,为粗提取的omv。
27.(三)阻尼柱纯化omv3.1柱平衡
(1)将exosupur柱从4℃冰箱取出,在固定分离组件上垂直固定。
28.(2)将废液收集管(普通离心管或者烧杯均可)放置于排阻柱下方,取下柱子顶盖和底盖(注意:先去顶盖再取底盖),弃去柱子上的封柱液(可以直接倒掉或者用移液器吸去),并从顶部加入不少于20ml的pbs冲洗柱子。冲洗过程中,顶部筛板必须保持湿润,避免柱子变干,冲洗完成后,盖上底盖,加入1ml pbs备用。
29.3.2 样品上样(1)取下柱子底盖,用移液器吸去上筛板上面的pbs,加入不超过1ml的粗提omv样品,等样品全部进入筛板后,再添加洗脱液(pbs)进行洗脱,防止样品被稀释影响实验结果。
30.(2)待样品全部进入筛板,底部出口无液体流出后,开始加洗脱液(建议每次添加500μl洗脱液,待上一个500μl洗脱液全部进入排阻柱内后,再添加下一个500μl洗脱液),用收集管(1.5ml离心管)收集流出液,从第一滴流出液开始计算,每500μl流出液记为1个馏分,该型号柱子,前3个馏分分为不含omv组分的空隙体积,不用收集。
31.3.3 omv收集空隙体积之后直接加入2.5ml pbs洗脱,并开始收集omv到1.5ml的ep管中,并标记为omv-4、omv-5、omv-6、omv-7。共收集4管。之后再加入1.5ml的pbs,继续收集1管,标记为omv-8。
32.3.4 将收集到ep管中标记好的omv至于冻存盒中,放到-80℃冰箱保存。
33.(四)omv的电镜观察取纯化的omv样品,分别滴加到碳包覆铜网上,滴加2%醋酸双氧铀,室温干燥,并送河北医科大学电镜室进行检测。
34.(五)omv蛋白的定量、鉴定用bca法蛋白浓度定量试剂盒说明书测定omv的总蛋白浓度。蛋白质谱仪鉴定omv内含物。
35.(六)omv注射孕鼠所有动物实验均由河北医科大学动物实验伦理委员会审查通过后进行。实验小鼠(balb/c)由河北医科大学动物实验中心提供。每组性成熟雌性2-3只balb/c小鼠和1-2只雄性balb/c小鼠于前一天下午五点左右合笼,隔日上午九时左右取出雌性balb/c小鼠,随后以见到阴栓形成则确认怀孕,并计算为0d,将其标记并独笼饲养,在12d时观察小鼠腹部确认是否怀孕,淘汰未孕小鼠。分别在孕6、9、12、15天从尾静脉或者腹腔注入balb/c孕鼠,50μl/次/只,以pbs作对照组。
36.(七)小鼠dc培养balb/c小鼠(6-10周龄)处死,手术取出所有股骨和胫骨,注射器针头分别从骨两端插入骨髓腔,反复冲洗出骨髓至培养皿中,收集骨髓悬液,用200目尼龙网滤去小碎片和肌肉组织;滤过液1200rpm 离心5min,弃上清;加入2ml氯化铵红细胞裂解液(1
×
),重悬细胞,室温孵育3-5min。获得的小鼠骨髓细胞计数后调整细胞浓度为2
×
105/ml, 用含10% fbs的rpmi1640完全培养液,铺至100mm 细胞培养皿中,每皿10ml细胞,同时加入重组小gm-csf (200u/ml),37℃,5% co
2 培养箱培养;第3天时,向培养皿中再加入10ml含20ng/ml重组小鼠gm-csf的完全培养液;第6天和第8天分别半量换液,即收集旧培养液,离心后用含20ng/ml 重组小鼠gm-csf 的完全培养液重悬细胞沉淀,然后再将细胞悬液放回原皿;第10
天时可收集细胞,即为bmdc。
37.(八)弱酸洗脱法洗脱mhc结合的抗原肽成熟bmdc(浓度2
×
105个/ml)分别与10、20、40、60μg/ml omv共培养48h,离心后弃上清,加入4ml弱酸提取液(0.131mol/l枸橼酸,0.066mol/l磷酸氢二钠,调节ph至3.3),室温下轻晃5min,离心吸取上清液上质谱鉴定。以pbs作为对照组。按照bradford蛋白浓度测定试剂盒说明书所示方法,测得a
595
,并据标准曲线计算多肽浓度,-80℃保存备用。
38.(九)洗脱多肽质谱鉴定100ul样品(一般处理的起始量为100-200ug左右蛋白质),加入200μl of ua,离心12,000g for 15 min;再加入200μl of ua,离心12,000g for 15 min;去除离心管中液体;加入100μl iaa,600 rpm混匀1min;暗处孵育20min;12,000g for 10 min离心;加入100μl of ua,再离心15min;重复两次;加入100μl abc;离心12,000g for 10 min;重复两次;加入40μl abc with trypsin;混匀,37℃ for 4
ꢀ‑
18 h;转入新的收集管,12,000
×
g for 10 min;加入40μl abc;离心12,000
×
g for 10 min;加入甲酸酸化(abc和甲酸的体积比是100∶1);冷冻干燥;如果收集管中盐残留高,可以考虑脱盐(主要是为了除去abc。一般用spe小柱,但同时也会造成样品损失,上质谱分析一般都有trap column除盐);冷冻干燥;进样前用0.1%fa进行复溶,上样浓度约为1μg左右。
39.质谱仪检测分析色谱仪:thermofisher easy-nlc1200纳升液相;色谱柱:c
18
,75 μm
ꢀ×
150 mm,3μm,100
å
;流速:300 nl/min;流动相a:0.1% formic acid in water;流动相b:0.1% formic acid in acetonitrile;洗脱梯度时间:60min。离子源参数:喷雾电压2.1 kv;毛细管温度=275oc;s-lens60%;分辨率设置:一级60,000@m/z 200;母离子扫描范围:m/z 350-1600;agc设置:一级3e6,二级1e5;最大离子注入时间:一级20ms,二级45ms;母离子分离窗口:1.6da。nce碰撞能量: 27%hcd;动态排除:40s。
40.数据库检索条件proteome discoverer 2.2;蛋白酶:胰蛋白酶;漏切位点:2;母离子质量偏差:20ppm;碎片离子质量偏差:0.02da;动态修饰:oxidation/15.995da(m)、deamidated/0.984da(n、q);固定修饰:carbamidomethyl/57.021da(c);肽段&谱图假阳性率:≤1%。鉴定结果如图1所示。
41.(十)用netmhcii 2.3分析软件分析质谱鉴定的肽段,再人工合成肽段做下游筛选,-20℃保存备用(10mg/条)。
42.(十一)t-dc混合反应筛选耐受肽采用密度梯度离心法分离子鼠外周血单个核细胞(pbmcs),然后使用t细胞分离试剂盒(myltenil biotec)通过负磁激活细胞分选(macs)从pbmcs中分离出cd4
+
t细胞。
43.在混合白细胞反应测定中,将经过1、2、4、8、16μg/ml 人工合成多肽刺激处理的dc和未经处理的dc在含有10%fcs、l-谷氨酰胺、2-巯基乙醇(50μm)和1%双抗(青霉素、链霉素)的完整rpmi 1640培养基中培养。然后将不同浓度不同多肽刺激后的dc(0.5
×
104、0.25
×
104、0.125
×
104)与cd4
+
t细胞(96孔板1
×
105/孔)共培养5天。空白对照组为单独培养的cd4
+
t细胞。用elisa试剂盒检测细胞培养孔上清的il-2和ifn-γ,与空白对照组无统计学意义的孔为子鼠cd4
+
t细胞耐受肽段(p》0.05);与空白对照组有统计学意义的孔为子鼠cd4
+
t细胞非耐受肽段(p《0.05)。
44.(十二)融合多肽的表达12.1融合多肽表达载体的构建(1)根据筛选出来的5个耐受肽的氨基酸序列(如seqidno.2~6所示),人工合成融合基因片段,即seqidno.7所示的核酸序列(两端带有ndei-xhoi酶切位点),对应的氨基酸序列如seqidno.1所示。
45.(2)酶切空骨架载体pet-22b(+)-t7promoter-gene-6xhis,对载体酶切产物进行琼脂糖凝胶电泳,回收目的条带。
46.酶切体系:10xbuffer2μlndei1μlxhoi1μlplasmid2-3μladdddh2oto20μl。
47.(3)合成基因与表达载体的连接得到骨架载体回收产物后,根据同源重组的原理,利用无缝拼接试剂盒将合成基因克隆到pet-22b+载体中,克隆位点:ndei(catatg)-xhoi(ctagag)。
48.(4)转化涂板及菌斑鉴定无缝拼接后产物5-10μl转化至100μldh5a感受态,42℃金属浴,热激1min,冰上迅速预冷2min,在超净工作台中,加入600μl无抗培养基,37℃摇床振荡培养1h,取适量菌液涂布在含有kan抗性的平板上,在恒温培养箱中倒置培养12-16h。菌落pcr后鉴定阳性克隆。
49.(5)阳性克隆摇菌及质粒提取挑选3-4个单菌落摇菌,加入含有kan的培养基摇菌过夜(8mllb液体培养基),然后参照质粒抽提试剂盒进行质粒抽提。
50.制备多肽表达工程菌(1)制备bl21感受态;(2)提取的质粒加入至bl21感受态,42℃水浴热激90秒,迅速放回冰上并静置5分钟;(3)向离心管中加入500μl不含抗生素的无菌培养基,混匀后37℃,200rpm,复苏60分钟;(4)3000rpm瞬时离心收菌,留取100μl左右上清轻轻吹打重悬菌块并涂布到含kan的lb培养基上;(5)待平板正置培养30min后,再将平板倒置放于37℃培养箱过夜培养。
51.(6)获取阳性菌落摇菌,制备甘油菌冻存备用。
52.工程菌增菌(1)取10毫升的lb液体培养基放入15ml的离心管中;(2)将bl21工程菌接种到含有kan的lb液体培养基,盖子不要太严,用胶布固定,放到摇床上,37℃,16-18h;
(3)第二天将其倒入200ml的lb液体培养基中,摇晃过夜;(4)第三天取出,分装到50ml离心管,离心(5000r,10-15min),pbs洗一遍,-80℃保存。
53.裂解bl21工程菌(1)溶菌酶10mg/ml(用pbs溶解,用ripa裂解液稀释成1mg/ml);(2)1ml的溶菌酶加入9ml的ripa裂解液,加入蛋白酶抑制剂,裂解30分钟,每10分钟用枪头混匀一下,然后超声裂解,离心(12000g,10min),保存上清。
54.细菌裂解蛋白定量19μl的pbs+1μl的样品,再加入200μl的工作液(a∶b=1∶50),37℃孵育30分钟,570nm测其吸光度。
55.蛋白纯化仪器纯化融合多肽(1)先将配置好的细菌裂解蛋白用0.22微米的滤器过滤,然后将细菌裂解蛋白的浓度稀释到1mg/ml;(2)连接纯化柱,先用超纯水洗泵,3-5柱体积;(3)用结合缓冲液洗3-5个柱体积;(4)上样10个柱体积,然后用结合缓冲液再洗5-10个柱体积;(5)用洗脱液洗,一旦见到起峰,立即暂停洗脱2分钟,让其充分反应,然后开始收集;(6)收集完成后,将柱子拆卸下来用结合缓冲液冲洗5-10个柱体积,然后用20%的乙醇冲洗;(7)收集好的融合多肽放入-80℃冰箱保存,备用。
56.捕捉his标签(1)将纯化后的融合多肽冻干,然后进行sds-page,将胶样品一分为二(一半用于曝光捕捉his标签,一半用于质谱鉴定);(2)一半转膜;(3)将转膜结束后的pvdf膜放在封闭液中,在摇床上封闭1个小时;(4)用pbst洗去封闭液(3次,每次5-10min),孵育一抗(1∶3000),4℃摇晃孵育过夜;(5)第二天将孵育好的pvdf膜用pbst洗3遍,每次5-10min;(6)孵育二抗(1∶1000),避光孵育1个小时(温和震荡),pbst洗3次,避光;(7)曝光,看是否含有his标签。结果如图2所示。
57.质谱鉴定(1)将另一半胶烤染,放在摇床上染色半小时;(2)脱色,每隔1h换1次脱色液,然后4℃孵育过夜;(3)第二天用手术刀片切下胶上目标条带,切成1mm的小块,置于1.5ml ep管中;(4)每管加入300 ul色液室温脱色,清洗至透明,去除上清;每1-2小时建议更换一次脱色液以加快脱色进程;根据不同情况,脱色一般需要4-8小时;(5)干胶:加入300ul 100%acn thermomixer震荡 5min至胶粒变白,吸去acn,冻干 3min;
(6)每管加入300 ul 10mm dtt/50mm nh4hco3,振荡混匀至胶块泡胀透明,56℃ 1h,随后弃上清;(7)干胶:加入300ul 100%acn thermomixer震荡 5min至胶粒变白,吸去acn,冻干3min;(8)每管加入300 ul 60mm iaa/50mm nh4hco3,避光振荡混匀至胶块泡胀透明,暗处反应30分钟;(9)干胶:加入300ul 100%acn thermomixer震荡 5min至胶粒变白,吸去acn,冻干3min;(10)每管加入50mm碳酸氢铵溶液50-80ul,再加入 1-2ug胰酶(或者将两者混合后再加入样品中,淹没胶条),用玻璃棒将凝胶挤碎,37℃温育6小时以上;(11)每管加入200ul含0.1% fa乙腈震荡5分钟,吸取上清液至干净的ep管中;(12)凝胶中再加入 30ul 0.1%fa震荡 5分钟,再加入 200ul含0.1% fa 乙腈震荡 5分钟,吸取上清,并将两次上清液合并,冻干3小时以上;(13)除盐甲醇活化:200μl甲醇,离心室温1200g,5min,弃流出液buffer b:200μl,2次,4000g,2minbuffer a:200μl,3次,6000g,2min将样品稀释至200μl,加入到除盐小柱中,2000g,5minbuffer a:200μl,3次,6000g,2minbuffer b:180μl,2次离心,2000g,2min;4000g,2min。
58.将两次洗脱液放置新的ep管中,冻干。
59.(14)上质谱结果如图3所示。
60.(十三)多克隆抗体牛乳的制备13.1融合多肽疫苗的制备13.1.1增菌(1)取10毫升的lb液体培养基放入15ml的离心管中;(2)将bl21工程菌接种到含有kan的lb液体培养基,盖子不要太严,用胶布固定,放到摇床上,37℃,16-18h;(3)第二天将其倒入200ml的lb液体培养基中,摇晃过夜;(4)第三天取出,分装到50ml离心管,离心(5000r,10-15min),pbs洗一遍,-80℃保存。
61.13.1.2裂解bl21工程菌(1)溶菌酶10mg/ml(用pbs溶解,用ripa裂解液稀释成1mg/ml);(2)1ml的溶菌酶加入9ml的ripa裂解液,加入蛋白酶抑制剂,裂解30分钟,每10分钟用枪头混匀一下,然后超声裂解,离心(12000g,10min),保存上清。
62.13.1.3细菌裂解蛋白定量19μl的pbs+1μl的样品,再加入200μl的工作液(a∶b=1∶50),37℃孵育30分钟,570nm测其吸光度。
63.13.1.4 蛋白纯化仪器纯化融合多肽(1)先将配置好的细菌裂解蛋白用0.22微米的滤器过滤,然后将细菌裂解蛋白的浓度稀释到1mg/ml;(2)连接纯化柱,先用超纯水洗泵,3-5柱体积;(3)用结合缓冲液洗3-5个柱体积;(4)上样10个柱体积,然后用结合缓冲液再洗5-10个柱体积;(5)用洗脱液洗,一旦见到起峰,立即暂停洗脱2分钟,让其充分反应,然后开始收集;(6)收集完成后,将柱子拆卸下来用结合缓冲液冲洗5-10个柱体积,然后用20%的乙醇冲洗;(7)收集好的融合多肽疫苗放入-80℃冰箱保存,备用。
64.融合多肽免疫奶牛选择体质健康的3-4周岁的孕牛,分别于分娩前63d、42 d、14d及分娩后21d免疫,总计4次;首次用100mg融合多肽与氢氧化铝佐剂配制成4ml,于奶牛颈部两侧肌肉注射;后三次用50mg融合多肽+氢氧化铝佐剂配制成4ml免疫。根据抗体效价检测结果再进一步做加强免疫。
65.检测牛乳抗体效价13.3.1 乳清的制备将牛乳装于50ml离心管,3000r/min,10min;脱脂后,用1mol/l的hcl调整ph值至4.5~4.6,置于40℃水浴箱1 h,使酪蛋白完全析出,再次3000r/min离心10 min,倒出上清液,用1mol/l的 naoh调节ph至6.8~7.0,获得乳清,分装备用。
66.13.3.2间接elisa检测抗体效价先用2.5%戊二醛溶液150
µ
l/孔预处理96孔板1小时,37℃,超纯水洗涤4次,每次甩净拍干;分别用合成的多肽和融合多肽100
µ
l(0.05mg/ml)包被酶标板,37℃至干燥,用pbst(含0.5ml/l tweem 20的pbs缓冲液)洗涤液洗板3次,每次3min,每次甩净拍干;用3%bsa的pbst封闭1小时,洗涤同上;加不同稀释度的乳清,100
µ
l/孔,每样3个复孔,37℃温育1小时;洗涤3次后加入兔抗牛igg-hrp(1∶8000),100
µ
l/孔,37℃温育1小时;洗涤3次后加四甲基联苯胺底物工作液100
µ
l,37℃反应15分钟后每孔加50
µ
l h2so4(2mol/l)终止反应,立即在酶标仪上测450nm 波长的吸光度值,以od
450 0.5的最大稀释倍数为抗体效价。
67.收集和消毒牛乳收集抗体效价达到和稳定在1∶1200以上的牛乳;在62.8-65.6℃,30min或者71.7℃,15s消毒牛乳。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1