仔猪副伤寒弱毒菌发酵培养物、活疫苗及其制备方法与流程
1.本发明涉及生物制品技术领域,具体涉及一种仔猪副伤寒弱毒菌的发酵培养物、活疫苗及其制备方法。
背景技术:
2.仔猪副伤寒(necrotic enteritis)也叫沙门氏菌病,是一种由沙门氏菌引起的传染病,在临床可分慢性和急性两型,慢性型引发坏死性肠炎、顽固下痢,急性型引发败血症,主要发病于出生6个月以内的仔猪,2-4月仔猪尤为多见,而一旦发病整个猪场将面临巨大损失。
3.为预防仔猪副伤寒,需对仔猪副伤寒弱毒菌进行发酵培养得到活菌数多的发酵菌液,并发酵菌液制备相关的药物和疫苗,其中仔猪副伤寒弱毒菌株是将猪霍乱沙门氏菌强毒株c87-1通过化学方法致弱后得到的c500弱毒菌株。
4.大量稳定繁殖生长仔猪副伤寒弱毒菌是制备高质量仔猪副伤寒弱毒活疫苗和药物的关键所在。现有技术中,一般使用牛肉浸液肉汤培养基培养仔猪副伤寒弱毒菌株,配制这种培养基工序多,耗费时间、人物力,需要购置大量牛肉,而市面上牛肉多是饲料喂养的肉牛,生长周期短,制备出的培养基营养成分不充足,常规的培养方法也难以实现仔猪副伤寒弱毒菌高密度培养,使得发酵菌液活菌数少,冻干后产品头份不够或者出现安全性问题,最终影响疫苗产品的质量。
5.因此,十分有必要开发一种有助于仔猪副伤寒弱毒菌高密度繁殖的培养方法。
技术实现要素:
6.本发明的目的在于提供一种仔猪副伤寒弱毒菌的发酵培养物、活疫苗及其制备方法,以解决现有技术中存在的一般使用牛肉浸液肉汤培养基培养仔猪副伤寒弱毒菌株,配制这种培养基工序多,耗费时间、人物力,需要购置大量牛肉,而市面上牛肉多是饲料喂养的肉牛,生长周期短,制备出的培养基营养成分不充足,常规的培养方法也难以实现仔猪副伤寒弱毒菌高密度培养,使得发酵菌液活菌数少,冻干后产品头份不够或者出现安全性问题,最终影响疫苗产品的质量的技术问题。
7.为了实现上述目的,本发明的技术方案是:
8.本发明第一方面提供了一种仔猪副伤寒弱毒菌的发酵培养物的制备方法,包括如下步骤:
9.s11一级种子的培养:将仔猪副伤寒弱毒菌接种于血平板上,在36~37℃下厌氧培养18~22h,得到生长有仔猪副伤寒弱毒菌一级种子的血平板;
10.s12二级种子的培养:从步骤s11得到的生长有仔猪副伤寒弱毒菌一级种子的血平板上,挑选出圆形、细小、半透明、光滑、湿润、圆整的单菌落,将其接种于培养基中,在36~37℃下培养18~22h,得到生长有仔猪副伤寒弱毒菌二级种子的培养液;
11.s13发酵培养:在发酵罐中依次加入培养基和消泡剂,高压高温灭菌后降温,再将
步骤s12制备的培养液接种到发酵罐内,培养即得;
12.其中,所述步骤s12和s13中的培养基包括以下质量浓度组分:酵母浸粉0.018-0.025%,牛肉浸粉0.018-0.025%,蛋白胨0.018-0.025%,葡萄糖0.005-0.01%,氯化钠0.001-0.003%,磷酸氢二钾0.002-0.005%。
13.通过采用上述方案,在发酵培养前经过一级种子培养和二级种子培养,有效提高菌落质量,有助于提高发酵培养的活菌数,工艺简便、质量稳定、生产周期短,培养基含有酵母浸粉、牛肉浸粉、蛋白胨、葡萄糖、氯化钠等商品化生物化学试剂,组成获取方便,营养成分充足,成本低。
14.在上述技术方案的基础上,本发明还可以做如下改进:
15.进一步的,所述步骤s13中的培养具体为:初始时将发酵罐内溶液ph调节为6.7~7.3,持续通入无菌空气,培养时每隔一定时间检测一次ph,当ph值上升至7.8时,添加40%葡萄糖溶液调整ph至7.0~7.3,培养时间为18-22h,培养温度为36~37℃。
16.进一步的,所述持续通入无菌空气具体为:接种后先以3~5l/h的流量通入无菌空气2h,之后增加流量至8~10l/h通入无菌空气3h,之后增加流量至20~25l/h通入无菌空气3h,之后增加流量至50~60l/h通入无菌空气4h,之后增加流量至70~80l/h通入无菌空气4h,之后增加流量至100~120l/h通入无菌空气直至培养结束。
17.通过采用上述方案,持续通入无菌空气,并随着菌落数的增大逐渐增大通气量,满足高密度活菌的需求,从而实现高密度培养。
18.进一步的,所述步骤s13中发酵罐内培养基、消泡剂、培养液的体积比为:100:(0.01~0.02):(1~3)。
19.进一步的,所述步骤s12和s13中的培养基包括以下质量浓度组分:酵母浸粉0.023%,牛肉浸粉0.022%,蛋白胨0.021%,葡萄糖0.01%,氯化钠0.002%,磷酸氢二钾0.003%,且培养基的ph为6.4-7.0。
20.本发明第二方面提供了采用本发明第一方面的制备方法制备仔猪副伤寒弱毒菌的发酵培养物。
21.本发明第三方面提供了本发明第二方面的发酵培养物在制备用于预防由沙门氏菌引起的相关疾病的药物或疫苗中的应用。
22.进一步的,所述相关疾病包括坏死性肠炎、顽固下痢、败血症的任一种或其组合。
23.本发明第四方面提供了采用本发明第二方面的发酵培养物制备的活疫苗。
24.本发明第五方面提供了本发明第四方面的活疫苗的制备方法,包括如下步骤:
25.s21向本发明第二方面的发酵培养物中加入明胶蔗糖冻干保护剂,充分混合,其中发酵培养物与明胶蔗糖冻干保护剂的体积比为7:1,混合后明胶和蔗糖的体积百分比含量分别为1.5%和5%,得到混合液
26.s22将步骤s21得到的混合液分装,依次经过-50℃预冻、-5℃一次升华、解析升华三个阶段干燥,干燥结束依次压塞、放气,完成冻干程序即得。
27.与现有技术相比,本发明的有益效果是:
28.1、本发明仔猪副伤寒弱毒菌在发酵培养前经过一级种子培养和二级种子培养,有效提高菌落质量,有助于提高发酵培养的活菌数,工艺简便、质量稳定、生产周期短,培养基含有酵母浸粉、牛肉浸粉、蛋白胨、葡萄糖、氯化钠等商品化生物化学试剂,组成获取方便,
营养成分充足,成本低;
29.2、本发明通过对发酵培养ph和通气量的实时控制可实现仔猪副伤寒弱毒菌的高密度需氧发酵培养,其活菌数可达到400-450cfu/ml(
×
108),比用国家规定的工艺培养要高出120—170cfu/ml(
×
108),且冻干成活率达70%以上,制品安全性更可靠,具有极好的产业应用价值;
30.3、本发明的发酵培养物经过配苗冻干后的成为弱毒活疫苗,可用于预防由沙门氏菌引起的相关疾病,所述的相关疾病选自仔猪坏死性肠炎、顽固下痢、败血症的任一种或其组合。
具体实施方式
31.下面对本发明技术方案的实施例进行详细的描述。以下实施例仅用于更加清楚地说明本发明的技术方案,因此只作为示例,而不能以此来限制本发明的保护范围。
32.需要注意的是,除非另有说明,本技术使用的技术术语或者科学术语应当为本发明所属领域技术人员所理解的通常意义。
33.实施例一
34.本实施例提供一种仔猪副伤寒弱毒菌的发酵培养物,采用以下步骤制备:
35.s11一级种子的培养:将仔猪副伤寒弱毒菌接种于血平板上,在36℃下厌氧培养22h,得到生长有仔猪副伤寒弱毒菌一级种子的血平板;
36.s12二级种子的培养:从步骤s11得到的生长有仔猪副伤寒弱毒菌一级种子的血平板上,挑选出圆形、细小、半透明、光滑、湿润、圆整的单菌落,将其接种于培养基中,在36℃下培养22h,得到生长有仔猪副伤寒弱毒菌二级种子的培养液;
37.s13发酵培养:按发酵罐的容积加入70%的培养基,之后加入和消泡剂在116℃下高压灭菌40min后降温至36℃,再将步骤s12制备的培养液接种到发酵罐内,培养基、消泡剂、培养液的体积比为100:0.01:3,培养即得,
38.培养初始时将发酵罐内溶液ph调节为7.3,持续通入无菌空气,接种后先以3l/h的流量通入无菌空气2h,之后增加流量至8l/h通入无菌空气3h,之后增加流量至20l/h通入无菌空气3h,之后增加流量至50l/h通入无菌空气4h,之后增加流量至70l/h通入无菌空气4h,之后增加流量至100l/h通入无菌空气直至培养结束;
39.培养时每隔1h检测一次ph,当ph值上升至7.8时,添加40%葡萄糖溶液调整ph至7.3,培养时间为22h,培养温度为36℃。
40.其中,所述步骤s12和s13中的培养基包括以下质量浓度组分:酵母浸粉0.023%,牛肉浸粉0.022%,蛋白胨0.021%,葡萄糖0.01%,氯化钠0.002%,磷酸氢二钾0.003%,且培养基的ph为6.4。
41.实施例二
42.本实施例提供一种仔猪副伤寒弱毒菌的发酵培养物,采用以下步骤制备:
43.s11一级种子的培养:将仔猪副伤寒弱毒菌接种于血平板上,在37℃下厌氧培养18h,得到生长有仔猪副伤寒弱毒菌一级种子的血平板;
44.s12二级种子的培养:从步骤s11得到的生长有仔猪副伤寒弱毒菌一级种子的血平板上,挑选出圆形、细小、半透明、光滑、湿润、圆整的单菌落,将其接种于培养基中,在37℃
下培养18h,得到生长有仔猪副伤寒弱毒菌二级种子的培养液;
45.s13发酵培养:按发酵罐的容积加入70%的培养基,之后加入和消泡剂在116℃下高压灭菌40min后降温至36℃,再将步骤s12制备的培养液接种到发酵罐内,培养基、消泡剂、培养液的体积比为:100:0.02:1,培养即得,
46.培养初始时将发酵罐内溶液ph调节为6.7,持续通入无菌空气,接种后先以5l/h的流量通入无菌空气2h,之后增加流量至10l/h通入无菌空气3h,之后增加流量至25l/h通入无菌空气3h,之后增加流量至60l/h通入无菌空气4h,之后增加流量至80l/h通入无菌空气4h,之后增加流量至120l/h通入无菌空气直至培养结束;
47.培养时每隔1h检测一次ph,当ph值上升至7.8时,添加40%葡萄糖溶液调整ph至7.0,培养时间为18,培养温度为37℃。
48.其中,所述步骤s12和s13中的培养基包括以下质量浓度组分:酵母浸粉0.018%,牛肉浸粉0.018%,蛋白胨0.018%,葡萄糖0.005%,氯化钠0.003%,磷酸氢二钾0.005%,培养基的ph为7.0。
49.实施例三:
50.本实施例提供采用实施例一的仔猪副伤寒弱毒菌的发酵培养物制备的活疫苗,具体制备方法包括如下步骤:
51.s21向实施例1的发酵培养物中加入明胶蔗糖冻干保护剂,充分混合,其中发酵培养物与明胶蔗糖冻干保护剂的体积比为7:1,混合后明胶和蔗糖的体积百分比含量分别为1.5%和5%,得到混合液;
52.s22将步骤s21得到的混合液分装,依次经过-50℃预冻、-5℃一次升华、解析升华三个阶段干燥,干燥结束依次压塞、放气,完成冻干程序即得。
53.实施例四:
54.本实施例提供采用实施例二的仔猪副伤寒弱毒菌的发酵培养物制备的活疫苗,具体制备方法包括如下步骤:
55.s21向实施例1的发酵培养物中加入明胶蔗糖冻干保护剂,充分混合,其中发酵培养物与明胶蔗糖冻干保护剂的体积比为7:1,混合后明胶和蔗糖的体积百分比含量分别为1.5%和5%,得到混合液;
56.s22将步骤s21得到的混合液分装,依次经过-50℃预冻、-5℃一次升华、解析升华三个阶段干燥,干燥结束依次压塞、放气,完成冻干程序即得。
57.效果例:
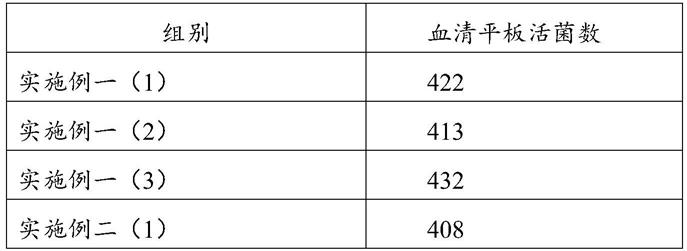
58.对实施例一和实施例二的发酵培养物进行活菌计数,用生理盐水将1ml的发酵培养物作107倍稀释,吸取0.3ml的稀释后的发酵培养物分别滴在3个血清平板上,每个0.1ml,37℃培养20~24h后,观察3个血清平板的活菌数,计算平均活菌,得到以下数据:
[0059][0060][0061]
对上述数据取平均值计算可知,实施例一的活菌数为422cfu/ml(
×
108),实施例二的活菌数为409cfu/ml(
×
108)。因此,本发明实施例的发酵培养物的活菌数可达到400-450cfu/ml(
×
108)。
[0062]
效果例二:
[0063]
对实施例三、四的活疫苗进行评价试验,具体包括以下试验:
[0064]
(1)安全检验和毒力检验
[0065]
用体重1.5-2kg的健康家兔5只,各肌肉注射疫苗1ml实施例2的活疫苗,观察21日,观察是否健活,有无局部或全身异常反应。
[0066]
结果显示:在观察期内,注射实施例三和实施例四的活疫苗的试验兔全部健活,食欲正常,体温正常,接种部位无红肿发热现象。
[0067]
因此,实施例三和实施例四制备的活疫苗安全性较好。
[0068]
(2)免疫原性检验
[0069]
选取20只体重1.5kg的家兔,其中10只肌肉注射1ml实施例三的活疫苗,另10只注射1ml实施例四的活疫苗,一个月后攻击2-4mld(最小致死剂量)强毒菌,观察21日,记录存活数量。
[0070]
结果显示:实施例三的家兔存活9只,实施例四的家兔存活8只。
[0071]
因此,本发明的实施例制备的活疫苗保护力达到80%以上。
[0072]
本发明的说明书中,说明了大量具体细节。然而,能够理解,本发明的实施例可以在没有这些具体细节的情况下实践。在一些实例中,并未详细示出公知的方法、结构和技术,以便不模糊对本说明书的理解。
[0073]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征
进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,其均应涵盖在本发明的权利要求和说明书的范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1