一种嗜热一氧化碳链霉菌及含该菌的增效生物菌剂与应用
1.本发明属于农业微生物领域,涉及生物菌肥技术,尤其是一种嗜热一氧化碳链霉菌及含该菌的增效生物菌剂与应用。
背景技术:
2.生物菌肥是我国设施农业生产中新兴的一类重要肥料,其推广与应用不仅是科学配方施肥的延伸,也是发展生态、有机设施农业的重要组成部分。现有技术中的生物菌肥普遍存在菌种活性不稳定的问题,菌种活性依赖于活体微生物的生物学功效,而外源活体微生物制剂的活性受诸多因素的影响,如土壤微环境、理化性质、土著微生物、根系分泌物以及施用方式等,使得以微生物为主料的生物菌肥不能稳定发挥其生物学功效,进而影响其对农作物的生长促进,故研发一种具有增效作用的生物菌肥具有重要的应用价值。
技术实现要素:
3.本发明的目的在于克服现有技术的不足之处,提供一种嗜热一氧化碳链霉菌及含该菌的增效生物菌剂,利用嗜热一氧化碳链霉菌的生物学功效,并结合微生物增效剂的功能特性,使得微生物具有更强的自主固氮能力、解钾、解微量元素、产铁载体和纤维素酶的能力,预防植物缺钾、钙、铁、镁、硫等元素造成的生理性病害;并能够合成更多的植物促生长信号分子,例如:吲哚乙酸和乙偶姻等挥发性气体组分,促进植物生长,增加植株高度、根重、茎粗、叶片面积等生物量指标;同时,借助嗜热一氧化碳链霉菌分泌乙酸等等小分子有机酸组分消除土壤板结、疏松土壤、中和碱性、降低土壤盐碱病害;通过分泌更多的链霉素等抑菌物质,更有效抑制有害菌的生长、繁殖,净化土壤环境,保护作物根系。
4.本发明解决其技术问题是采取以下技术方案实现的:
5.一株嗜热一氧化碳链霉菌,所述菌株的名称为:fs-1,分类命名为:嗜热一氧化碳链霉菌(streptomyces thermocarboxydus),保藏号为cgmcc no.21628,保藏日期为:2021年1月15日,保藏单位:中国微生物菌种保藏管理委员会普通微生物中心,保藏地址:北京市朝阳区北辰西路1号院3号。
6.一种含嗜热一氧化碳链霉菌的增效菌剂,包括以下质量份数的各组分:嗜热一氧化碳链霉菌fs-1菌粉10-50份、硅藻土5-10份、高岭土5-30份、轻质碳酸钙5-10份、peg80001-10份、腐殖酸1-5份、草木灰1-10份,还包括微生物增效剂1-10份。
7.而且,所述的嗜热一氧化碳链霉菌fs-1菌粉制备工艺包括如下步骤:
8.(1)菌种扩培:将活化的嗜热一氧化碳链霉菌fs-1接到高氏一号培养基中,于28℃、180r/min条件下培养2天,得到嗜热一氧化碳链霉菌fs-1种子液,一氧化碳链霉菌种子液活菌数量特征值为1.0
×
10
9-6.0
×
109cfu/ml;
9.(2)预处理混合料的制备:取各质量份数的如下组分:大米0.01-10份、可溶性淀粉0.01-12份、麦麸0.01-6份、麦芽浸粉0.01-2份、酵母浸粉0.01-1份、蛋白胨0.01-10份、棉籽饼粉0.01-2份、豆粕粉0.01-5份、硫酸镁0.01-0.4份、硫酸铵0.01-1份、磷酸氢二钾0.01-1
份、硝酸钾0.01-1份、氯化钴0.01-0.5份、氯化钠0.01-0.5份,加水调整至含水量为10%-40%,固形物=3:7w/w然后于121℃下灭菌30min,冷却后备用;
10.(3)发酵物制备:取步骤(2)制得的预处理混合料,按质量百分比为10%的接种量接入步骤(1)制备的嗜热一氧化碳链霉菌fs-1种子液,搅拌均匀,在温度为28℃,通风条件下发酵14天,期间定期补充无菌水并翻料,即得到嗜热一氧化碳链霉菌fs-1固态发酵物;
11.(4)菌粉制备:利用流化床干燥器将步骤(3)制得的发酵物低温烘干,超微粉碎至400-2000目,得到高含活菌数的嗜热一氧化碳链霉菌fs-1菌粉,所含活菌数特征值为2亿-200亿/g。
12.而且,所述的微生物增效剂包括有下述质量份数的各组分:植物或微生物细胞壁组分因子0.01-5份、环境胁迫金属离子0.001-0.01份和微生物信号感应分子0.001-0.05份,其余组分为水,所述的植物或微生物细胞壁组分因子包括葡萄糖、果糖、半乳糖、阿拉伯糖、木糖、鼠李糖、岩藻糖、甘露糖、糖醛酸、几丁质、几丁寡糖、葡聚糖、壳聚糖、壳寡糖、n-乙酰葡萄糖胺的一种或几种,所述的环境胁迫金属离子包括硫酸锌、硫酸亚铁、氯化钴、氯化镧中的一种或几种,所述的微生物信号感应分子包括γ-丁酸内酯或n-脂酰高丝氨酸内酯。
13.上述微生物增效剂制备方法包括:室温条件20℃下,将植物或微生物细胞壁组分因子加入质量浓度为0-0.1%的乙酸水溶液中,添加比例g:ml=50-100:850,在20-40khz超声频率条件下超声处理20min,制备无色或略带黄色的混合液a;将环境胁迫金属离子和微生物信号感应分子混合溶解于水中,添加比例mg:ml:ml=30-60mg:1-10ml:100ml,在搅拌状态下加入混合液a,待溶解完全以后,选取1mol/lnaoh调节混合液ph值至5.0-9.0,之后用纯净水将混合溶液定量至1l,过滤去掉不溶物,即得调节剂成品母液,选用喷雾干燥装置,在低温条件下进风口温度150~180℃,出风口温度70~80℃制备调节剂成品粉剂。
14.一种含嗜热一氧化碳链霉菌的增效菌剂的应用:单独施用或者在微生物菌剂、菌肥及生物有机肥类产品及其衍生产品配制或施用时作为辅助制剂使用。单独施用包括:
①
以粉剂状态作为底肥使用,使用方法包括:拌种或者与土壤、化肥、农家肥等混合施用,每亩地推荐使用总量200-800g;
②
以母液稀释水溶液的状态作为追肥使用,使用方法包括:灌根或喷雾,将母液进行5-10倍稀释,每亩地推荐使用总量2.5-9.0l。
15.本发明的优点和积极效果是:
16.1、本发明中的嗜热一氧化碳链霉菌菌株分离自番茄根际区域,是番茄等植物的优势根际微生物之一,在番茄等类别植物根际中具有良好的再定殖能力。因具有耐高温和产纤维素酶等特性,嗜热一氧化碳链霉菌通常被用于高温堆肥,本发明中发现嗜热一氧化碳链霉菌fs-1菌株还具有自主固氮、解钾、产铁载体与乙酸的能力,有助于消除土壤板结、疏松土壤、中和碱性、降低土壤盐碱病害。同时,该菌株能够代谢吲哚乙酸和乙偶姻等挥发性气体组分,使本发明中的嗜热一氧化碳链霉菌fs-1菌株具备促进农作物生长的能力,即增加农作物高度、根重、茎粗、叶片面积等生物量指标,促进农作物根系生长和根系活力,可被新开发为微生物菌剂或微生物菌肥。此外,经测试该菌株各项能力具备优化与再提升的空间。
17.2、本发明中的嗜热一氧化碳链霉菌增效生物菌剂较单独菌株能够合成更多的植物促生长信号分子,例如:吲哚乙酸和乙偶姻等挥发性气体组分,更有效促进植物生长。同时,本发明中的增效生物菌剂较单独菌株能够分泌更多的有机酸,更有效消除土壤板结、疏
松土壤、中和碱性、降低土壤盐碱病害。最后,本发明中的增效生物菌剂可分泌更多的链霉素等抑菌物质,抑制有害菌的生长、繁殖,净化土壤环境,保护作物根系。
18.3、本发明的嗜热一氧化碳链霉菌增效生物菌剂包括但不限于微生物菌剂、菌肥、生物农药、生物肥料、植物促生长剂、抗菌剂、防腐剂、消毒剂或食品保鲜剂,本增效生物菌剂可以单独施用或者在微生物菌剂、菌肥及生物有机肥类产品及其衍生产品配制或施用时作为辅助制剂使用。
19.4、本发明中的微生物增效剂包括但不限于嗜热一氧化碳链霉菌fs-1,以及cyanobacteria,proteobacteria,actinobacteria和planctomycetes类别微生物增效,,能够增加cyanobacteria,proteobacteria,actinobacteria和planctomycetes门微生物在根际中定殖和存活比例,提高以上微生物的相对丰度和占比。
20.5、本发明中的微生物增效剂制备过程中,充分考虑到不同组分在水中的溶解度,以及高温状态下单糖等物质失活或者变色等问题,采用超声波处理、酸溶碱调、离子聚合、低温吹干等两步法制备工艺,最大程度上减少各组分之间的相互干扰,保留各组分的生物学活性。最后与嗜热一氧化碳链霉菌fs-1菌粉混合,产品中各组分含量,特别是增效剂的含量更准确。
21.6、本发明中的微生物增效剂可有效为嗜热一氧化碳链霉菌在植物根际表面定殖并发挥其生态学功效,提供以下帮助:
①
提供定殖窗口期微生物生长所需能量来源,
②
提供微生物植物互作信号分子,启动微生物与植物之间相互识别,并建立互利、共生、互惠关系,提供微生物代谢调控信号分子,
③
调控嗜热一氧化碳链霉菌fs-1中的色氨酸-生长素代谢途径、丙酮酸-乙酸-丁二醇途径、以及转录因子dasr调控的链霉素等抑菌物质合成途径。
附图说明
22.图1为本发明嗜热一氧化碳链霉菌fs-1菌落形态图;
23.图2为本发明嗜热一氧化碳链霉菌fs-1系统发育树图;
24.图3为本发明实施例中嗜热一氧化碳链霉菌对玉米、小麦和番茄生长的影响对比图;
25.图4为本发明实施例中不同浓度嗜热一氧化碳链霉菌fs-1对拟南芥生长的影响结果;
26.图5为本发明中嗜热一氧化碳链霉菌fs-1自主固氮、解钾和产纤维素酶效果;
27.图6为本发明实施例中混合增效菌剂合成植物生长素效果;
28.图7为本发明实施例增效剂处理前后番茄根际微生物属水平菌落丰度图;
29.图8为本发明实施例增效剂处理前后番茄根际微生物kegg代谢流向对比图;
具体实施方式
30.下面通过具体实施例对本发明作进一步详述,以下实施例只是描述性的,不是限定性的,不能以此限定本发明的保护范围。
31.1、本发明首先从番茄根际土壤分离一株嗜热一氧化碳链霉菌,菌株的名称为:fs-1,分类命名为:嗜热一氧化碳链霉菌streptomyces thermocarboxydus,保藏号为cgmcc no.21628,保藏日期为:2021年1月15日,保藏单位:中国微生物菌种保藏管理委员会普通微
生物中心,北京市朝阳区北辰西路1号院3号,具体见附件保藏证明。
32.对嗜热一氧化碳链霉菌株进行鉴定,fs-1菌株16s rna序列信息如下:
33.ttcccggggggggtgcttaccatgcagtcgaacgatgaagcccttcggggtggattagtggcgaacgggtgagtaacacgtgggcaatctgccctgcactctgggacaagccctggaaacggggtctaataccggatactgatcgccttgggcatccttggtgatcgaaagctccggcggtgcaggatgagcccgcggcctatcagcttgttggtgaggtaatggctcaccaaggcgacgacgggtagccggcctgagagggcgaccggccacactgggactgagacacggcccagactcctacgggaggcagcagtggggaatattgcacaatgggcgaaagcctgatgcagcgacgccgcgtgagggatgacggccttcgggttgtaaacctctttcagcagggaagaagcgaaagtgacggtacctgcagaagaagcgccggctaactacgtgccagcagccgcggtaatacgtagggcgcgagcgttgtccggaattattgggcgtaaagagctcgtaggcggcttgtcgcgtcggttgtgaaagcccggggcttaaccccgggtctgcagtcgatacgggcaggctagagttcggtaggggagatcggaattcctggtgtagcggtgaaatgcgcagatatcaggaggaacaccggtggcgaaggcggatctctgggccgatactgacgctgaggagcgaaagcgtggggagcgaacaggattagataccctggtagtccacgccgtaaacggtgggcactaggtgtgggcgacattccacgtcgtccgtgccgcagctaacgcattaagtgccccgcctggggagtacggccgcaaggctaaaactcaaaggaattgacgggggcccgcacaagcggcggagcatgtggcttaattcgacgcaacgcgaagaaccttaccaaggcttgacatacaccggaaacgtccagagatgggcgcccccttgtggtcggtgtacaggtggtgcatggctgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgagcgcaacccttgtcccgtgttgccagcaggcccttgtggtgctggggactcacgggagaccgccggggtcaactcggaggaaggtggggacgacgtcaagtcatcatgccccttatgtcttgggctgcacacgtgctacaatggccggtacaatgagctgcgataccgcgaggtggagcgaatctcaaaaagccggtctcagttcggattggggtctgcaactcgaccccatgaagtcggagtcgctagtaatcgcagatcagcattgctgcggtgaatacgttcccgggccttgtacacaccgcccgtcacgtcacgaaagtcggtaacacccgaagccggtggcccaacccccttgtggggagggagcgtcgaagtgaaccggcctt。
34.该菌株培养特性如下:
35.将菌株在高氏一号培养基、lb培养基、yeme培养基、tsby培养基、淀粉、yms培养基、isp2培养基等液态培养基上分别培养,观察菌体生长状况与产色素情况,除了在高氏一号培养基中产生色素外,其他的培养基未见有色素的产生,在各个培养基中生长良好,但在高氏一号培养基中生长状况最好。菌体颗粒较大,且能产生孢子。
36.如图1所示,在高氏一号培养基上,嗜热一氧化碳链霉菌菌株生长良好,菌落略隆起,质地致密干燥,呈微绒状,不透明,气生菌丝呈现白色或灰白色,基生菌丝为淡黄色,生长局限,产生色素。嗜热一氧化碳链霉菌fs-1系统发育树图如图2所示。
37.2、菌株分离培养后制备嗜热一氧化碳链霉菌fs-1菌粉,制备工艺包括如下步骤:
38.(1)菌种扩培:将活化的嗜热一氧化碳链霉菌fs-1接到高氏一号培养基中,于28℃、180r/min条件下培养2天,得到嗜热一氧化碳链霉菌fs-1种子液,活菌数量特征值为1.0
×
10
9-6.0
×
109cfu/ml;
39.(2)预处理混合料的制备:取大米、可溶性淀粉、麦麸、麦芽浸粉、酵母浸粉、蛋白胨、棉籽饼粉、豆粕粉、硫酸镁、硫酸铵、磷酸氢二钾、硝酸钾、氯化钴、氯化钠混合均匀,各组分质量份数如下:大米0.01-10份、可溶性淀粉0.01-12份、麦麸0.01-6份、麦芽浸粉0.01-2份、酵母浸粉0.01-1份、蛋白胨0.01-10份、棉籽饼粉0.01-2份、豆粕粉0.01-5份、硫酸镁0.01-0.4份、硫酸铵0.01-1份、磷酸氢二钾0.01-1份、硝酸钾0.01-1份、氯化钴0.01-0.5份、氯化钠0.01-0.5份,加水调整至含水量为10%-40%(水:固形物=3:7w/w),然后于121℃下
灭菌30min,冷却后备用;
40.(3)发酵物制备:取步骤(2)制得的预处理混合料,按质量百分比为10%的接种量接入步骤(1)制备的嗜热一氧化碳链霉菌fs-1种子液,搅拌均匀,在温度为28℃,通风条件下发酵14天,期间定期补充无菌水并翻料,即得到嗜热一氧化碳链霉菌fs-1固态发酵物;
41.(4)菌粉制备:利用流化床干燥器将步骤(3)制得的发酵物低温烘干,超微粉碎至400-2000目,得到高含活菌数的嗜热一氧化碳链霉菌fs-1菌粉,所含活菌数特征值为2亿-200亿/g。
42.3、制备一种含嗜热一氧化碳链霉菌的增效菌剂,包括以下质量份数的各组分:嗜热一氧化碳链霉菌fs-1菌粉10-50份、硅藻土5-10份、高岭土5-30份、轻质碳酸钙5-10份、peg80001-10份、腐殖酸1-5份、草木灰1-10份和微生物增效剂0.01-10份。
43.具体的,所述的微生物增效剂包括有下述质量份数的各组分:植物或微生物细胞壁组分因子0.01-5份、环境胁迫金属离子0.001-0.01份和微生物信号感应分子0.001-0.05份,其余组分为水。
44.所述的植物或微生物细胞壁组分因子包括葡萄糖、果糖、半乳糖、阿拉伯糖、木糖、鼠李糖、岩藻糖、甘露糖、糖醛酸、几丁质、几丁寡糖、葡聚糖、壳聚糖、壳寡糖、n-乙酰葡萄糖胺的一种或几种,所述的环境胁迫金属离子包括硫酸锌、硫酸亚铁、氯化钴、氯化镧中的一种或几种,所述的微生物信号感应分子包括γ-丁酸内酯或n-脂酰高丝氨酸内酯。
45.4、一种含嗜热一氧化碳链霉菌的增效菌剂中微生物增效剂制备方法包括:室温条件20℃下,将植物或微生物细胞壁组分因子加入质量浓度为0-0.1%的乙酸水溶液中,添加比例g:ml=50-100:850,在20-40khz超声频率条件下超声处理20min,制备无色或略带黄色的混合液a;将环境胁迫金属离子和微生物信号感应分子混合溶解于水中,添加比例mg:ml:ml=30-60mg:1-10ml:100ml,在搅拌状态下加入混合液a,待溶解完全以后,选取1mol/lnaoh调节混合液ph值至5.0-9.0,之后用纯净水将混合溶液定量至1l,过滤去掉不溶物,即得调节剂成品母液,选用喷雾干燥装置,在低温条件下进风口温度150~180℃,出风口温度70~80℃制备调节剂成品粉剂。
46.本发明实施例个实验方法及实验结果如下:
47.将本发明实施例在盆栽小麦、玉米、番茄中进行生长效果促进试验,生长影响展示见图3:
48.将以上农作物种子放在清水中浸泡24h,然后均匀的点在营养土中,然后在表层覆盖一层薄薄的土,浇水,发芽后5d,开始做不同的处理,ck组加5ml自来水,处理组加5ml嗜热一氧化碳链霉菌菌悬液,每隔2d进行浇灌处理,观察并记录小麦、玉米、番茄的生长情况。
49.株高:每隔2d测定一次株高,以地上部分土面为基准点,测定小麦和玉米的全长。
50.鲜重、干重、根长:培养14d后,随机从处理组和ck组,随机挑选一定数量的小麦、玉米、番茄连根拔起,洗净根部的泥土,用纱布擦干,称量其鲜量,然后测其根长。测量完毕后60℃烘1.2h测定其干重。
51.玉米杆粗和1/2叶宽:小麦和玉米生长14d后,处理组停止浇灌菌剂,生长到30d时候,测定玉米的杆粗和叶片总长1/2处的叶宽。
52.叶绿素含量测定:称取1.0g叶片样品加入研钵中,加少量石英砂和碳酸钙粉及2~3ml 80%丙酮溶液,研成匀浆,再加10ml 80%丙酮溶液继续继续研磨至组织变白。静置3~
5min提取。用滤纸将提取液过滤到50ml棕色容量瓶中,用丙酮溶液冲洗至滤纸和残渣中无绿色。用80%丙酮定容至50ml,摇匀,测定od663、od645,计算公式:ρa=12.72od663-2.59od645;ρb=22.88od645-4.67od663;叶绿素总量ρt=ρa+ρb=20.29od645+8.05od663。
53.试验结果见下表:
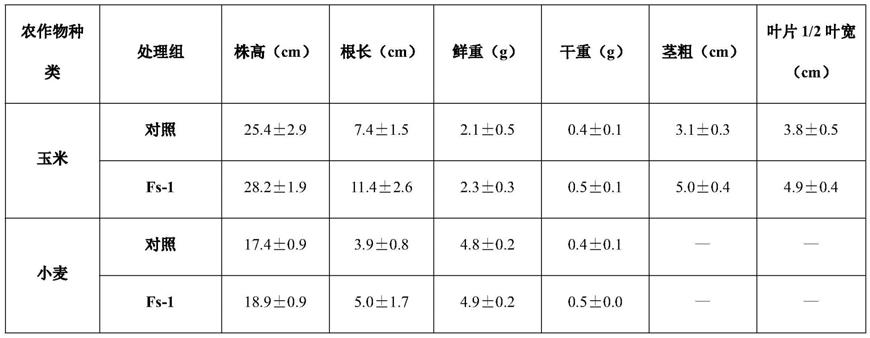
54.表1嗜热一氧化碳链霉菌对玉米和小麦生长的影响结果
[0055][0056]
表2嗜热一氧化碳链霉菌对番茄生长的影响
[0057][0058]
如图3,实验结果表明,嗜热一氧化碳链霉菌fs-1对玉米,小麦和番茄生长均具有促进作用。施用嗜热一氧化碳链霉菌fs-1后,玉米,小麦和番茄植株高度、根重指标均有显著增加,玉米的茎粗与叶片面积等生物量指标也有显著改善。
[0059]
同时,本实施例还做了盆栽促进模式植物生长效果(拟南芥)试验
[0060]
将拟南芥的种子用无菌水冲洗数次,然后用移液枪尽量均匀的点在铺有无菌滤纸的无菌平板上,封上封口膜后放在4℃下春化2d,然后放在22℃的培养箱中萌发,待萌发出芽后,将萌发的拟南芥点进营养土,在培养箱中培养,定期浇水。
[0061]
拟南芥总叶面积、总鲜重。将在培养皿中萌发的拟南芥移栽到营养土中,正常生长15d后,挑选大小一致的拟南芥进行实验,按照全因子实验表,配置不同浓度的菌悬液,每种菌悬液添加1ml,接着共培养7d,每天对拟南芥幼苗进行拍照(控制同一放大倍数,同一手机),然后用imagej软件对叶面积进行测量,同时测量地上部分重量。
[0062]
如图4,实验结果表明,嗜热一氧化碳链霉菌fs-1对拟南芥的叶片生长具有促进作用,且促进能力与施用浓度存在区间单峰曲线关系。低浓度(1%)促进作用最为明显。
[0063]
之后进行了嗜热一氧化碳链霉菌fs-1具有自主固氮能力、解钾、产铁载体和纤维素酶的能力试验,
[0064]
如图5,在阿须贝无氮选择培养基上,嗜热一氧化碳链霉菌fs-1菌株生长良好,在钾长石培养基上可以产生透明圈,证明其具有自主固氮能力和解钾能力。同时,利用630nmcas检测法检测其铁载体活性单位数值为0.253,证明其产铁载体能力较高。利用纤维
素刚果红培养基法培养基检测其产纤维素能力,发现其纤维素酶透明圈(h/c)数值为3.22。
[0065]
嗜热一氧化碳链霉菌fs-1混合增效菌剂效试验效果见图6。
[0066]
吲哚乙酸测定方法:准确称取样品1ml,加入1ml预冰的80%冰甲醇,充分搅拌均匀,4℃,5000r/min离心10min后弃沉淀,得到含有吲哚乙酸的样品提取液。显色剂需现配现用,其配置方法为:0.5mol/l fecl2(需避光保存)0.15ml、浓硫酸3ml、蒸馏水5ml混合。酶标板中加入40ul吲哚乙酸提取液,以与样品提取液等体积的蒸馏水为空白,向吲哚乙酸提取液和空白中分别加入160ul显色液。混合均匀后,遮光恒温显色反应30min,用分光光度计测定样品530ul处的吸光值。样品中吲哚乙酸的含量(ug/g)=(a*v1)/(w*v2)其中,a为参加显色反应的菌丝提取液中吲哚乙酸的浓度,ug/ml。v1为样品中提取液的总体积,ml。w为样品的重量,g。v2为参加显色反应的样品提取液体积,ml。
[0067]
嗜热一氧化碳链霉菌fs-1混合增效菌剂促进合成挥发性气体试验结果如下:
[0068]
挥发性物质成分的gc/ms分析,采用顶空固相微萃取结合气相色谱-质谱联用(gc-ms)收集和分析微生物发酵过程中产生的vocs。挥发性物质的收集:取5ml发酵液样品于20ml顶空进样瓶中,置于45℃、1200rpm的磁力搅拌器上恒温水浴30分钟,插入经过老化处理的75μcar/pdms固相微萃取纤维头,顶空吸附30分钟,使挥发性物质富集于萃取头上后直接进样到气相色谱-质谱联用仪分析。
[0069]
气相色谱条件。色谱柱型号:vf-5ms(30m
×
0.25mm
×
0.25μm);进样口温度:250℃;载气:he,纯度为99.999%;分流比:10:1;流速:1ml/min;程序升温:初始温度40℃,保持3min,以4℃/min升温至150℃,保持1min,再以8℃/min升温至250℃,保持6min。质谱条件:质量分离器:离子阱;离子源:ei;电离能量:70ev;离子阱温度:220℃;传输线温度:280℃;溶剂延迟时间:1.5min;全扫描方式;扫描范围:43-500m/z;检索谱库:nist11。将样品组分质谱图与标准图对照,以2-甲基-3-庚酮(cas:13019-20-0)为内标物确定各组分相对含量。
[0070]
得出结果不同增效剂组合可显著增强嗜热一氧化碳链霉菌fs-1合成3-羟基-2-丁酮、2,3-丁二醇、乙酸乙酯、2,3-丁二酮等物质。其中,3-羟基-2-丁酮、2,3-丁二醇属于植物促生长类的微生物源有机挥发物。增效菌剂组合1中,3-羟基-2-丁酮含量达到0.0538,较对照组0.0005,高出的倍数较多。增效菌剂组合3中,2,3-丁二醇含量达到0.0008,较对照组和其他增效菌剂低于检测限的结果,同样增加显著。
[0071]
表3混合增效菌剂合成具有促进植物生长气体的能力
[0072]
[0073][0074]
微生物增效剂增加链霉素等抑菌物质合成及根际表面益生微生物数量结果,如下:
[0075]
以不同浓度的复配增效剂作为实验受试物,实验设置自然生长组、增效剂实验组(组一至组四);每组均设置有菌对照组和无菌对照组。每个实验组设置6组平行。
[0076]
植物实验操作,将番茄幼苗放入智能型人工气候光照培养箱培养一周,使其适应实验环境。适应期结束后,剔除生长异常番茄幼苗,将剩余番茄幼苗随机分组,每组6颗。无菌组进行无菌处理。土壤混合物在121℃下灭菌20分钟;番茄幼苗用75%乙醇灭菌1分钟,后用无菌蒸馏水冲洗3次,浇灌均采用无菌蒸馏水。有菌组不做任何处理,浇灌采用自来水。
[0077]
土壤菌群样本收集,21天后收集土壤样本,并如下所述分离大田土壤,根际土壤和根内土壤。丢弃盆中最上面的1cm厚度土层土壤,将下面1g的混合土壤铲入灭菌处理的离心管中来收集大田土壤样品;摇动植物根系以除去松散的土壤,直到仅剩距根系表面1毫米以内的土壤为止,收集根系表面土壤作为根际土壤样品;将根系用75%的乙醇漂洗,后将根系置于干净且无菌的250ml锥形管中,其中装有50ml无菌蒸馏水。放置在摇床上,以180rpm摇动根系20分钟3次。收集生成的浑浊溶液,并进行两次离心以形成紧密的沉淀,收集沉淀作为根内土壤样品。将所有大田,根际和根内土壤样品新鲜冷冻,保存在-80℃下备用。
[0078]
结果如图7可知,在门分类水平上,以相对丰度≥0.01%为阈值,将<0.01%的菌门归为others,实验组共得到12个细菌门,从高到低依次为蓝藻菌门(cyanobacteria)、变形菌门(proteobacteria)、放线菌门(actinobacteria)、浮霉菌门(planctomycetes)、酸杆菌门(acidobacteria)、芽单胞菌门(gemmatimonadetes)、拟杆菌门(bacteroidetes)、绿弯菌门(chloroflexi)、parcubacteria门、疣微菌门(verrucomicrobia)、螺旋体菌门(saccharibacteria)、衣原体门(chlamydiae)。在添加增效剂的实验组中变形菌门(proteobacteria)、厚壁菌门(phylum firmicutes)、拟杆菌门(bacteroidetes)、螺旋体菌门(saccharibacteria)的相对丰度占比有所增加,尤其在根际土壤中相对丰度增加量显
著。增效剂组分之一强化了cyanobacteria,proteobacteria,actinobacteria和planctomycetes类别微生物在番茄根际表面的定殖能力和存活比例,提高了以上类别微生物的相对丰度和占比。
[0079]
同时,在根际土壤中,外源增效剂的添加显著提高了嘧啶代谢(pyrimidine metabolism)、肽聚糖生物合成(peptidogycan biosynthesis)、核苷酸切除修复(nucleotide excision repair)、蛋白质修复(protein repair)和链霉素生物合成(streptomycin biosynthesis)的相对丰度(图8)。
[0080]
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1