一种提高生物靛蓝产量的方法与流程
1.本发明涉及一种提高生物靛蓝产量的方法,属于代谢工程技术领域。
背景技术:
2.靛蓝,是天然染料之一,来源于植物。最早,靛蓝主要从蓼蓝植物中提取加工制得,但是植物种植耕地占用量大,培养周期长,也受天气影响较大。随着工业的发展,现在靛蓝常常以苯胺为原料,通过化学合成的方式制备,但是原料的毒性大,反应需要用到强酸、强碱,且反应温度高,对环境及人体的危害性很大。为此,研究者另辟蹊径,以生物合成的方式生产靛蓝,虽然采用无毒无害的微生物,但是现有生物合成的靛蓝,产量、纯度很低,主要因为在生物合成过程的中间产物吲哚酚的限速酶活性较低,导致吲哚酚的转化率较低,中国发明专利cn202110656252.x公开了一种高产靛蓝的工程菌制备靛蓝及其染布的方法,报道了生物合成靛蓝的产量仅达到346.29mg/l,靛蓝产量较低,不能使靛蓝的生物合成实现产业化。为了解决上述存在的问题,本发明提供了一种提高吲哚酚的转化效率而提高生物靛蓝产量的方法。
技术实现要素:
3.针对上述现有技术存在的问题,本发明提供一种提高生物靛蓝产量的方法,以大肠杆菌为宿主,加入变构酶,在生物合成的过程中持续提供辅因子nadph,获得靛蓝生物合成优化菌株,显著提高生物靛蓝的产量,能够为生物靛蓝的工业产业化奠定基础,能广泛应用于用于食品、医药和印染工业。
4.为了实现上述目的,本发明采用如下技术方案:一种提高生物靛蓝产量的方法,包括以下步骤:s1、构建大肠杆菌基因工程菌shg-01s1.1、通过转化法将细胞色素加氧酶导入宿主大肠杆菌中,获得出发宿主菌株shg-00;s1.2、以变构酶基因组为模板,在变构酶基因的上下游各选取20bp碱基作为正向引物和反向引物,通过聚合酶链式反应,获得变构酶基因片段p1;s1.3、以载体pet作为表达载体,将上述s1.2中的变构酶基因片段p1连接到载体pet的多克隆位点,获得重组质粒,标记为phg-01;s1.4、将上述s1.3中的重组质粒phg-01转入上述s1.1的出发宿主菌株shg-00中,获得带有变构酶基因片段的大肠杆菌基因工程菌,标记为shg-01;s2、工程菌shg-01的种子培养液s2.1、将上述s1.4中大肠杆菌基因工程菌shg-01加入到甘油中,使大肠杆菌基因工程菌shg-01的浓度为15~40%,于-80℃进行保藏;s2.2、取上述s2.1中保藏有大肠杆菌基因工程菌shg-01的甘油经摇瓶活化,后接种于5ml lb固体培养基中,使工程菌shg-01的接种量为30%,于30℃、2250rpm 摇床中过夜
培养12-18 小时,获得工程菌shg-01的种子培养液;所述 lb固体培养基的配方为:每升培养基中,加入胰蛋白胨10g,酵母提取物5g,nacl 10g,琼脂20g,其余为水,ph5.5~6.5;s3、扩大培养取上述s2.2中的工程菌shg-01的种子培养液1ml,加入到250ml的lb液体培养基中,于30℃、2250rpm 摇床中进行扩大培养,获得发酵培养液;所述 lb液体培养基的配方为:每升培养基中,加入胰蛋白胨10g,酵母提取物5g,nacl 10g,其余为水,ph5.5~6.5;s4、诱导表达s4.1取上述s3中的发酵培养液,用分光光度计在600nm波长下进行检测od值,当od600值为0.4时,加入异丙基-β-d-硫代半乳糖苷诱导剂,进行诱导表达蛋白酶;s4.2当上述的异丙基-β-d-硫代半乳糖苷浓度为200mm时,将上述s4.1中诱导表达的发酵培养液置于25℃的摇床中培养18h,获得靛蓝高产量的靛蓝培养液;s5、分离提纯测定取5ml上述s4.2的靛蓝培养液,经超声波处理,后于13000 rpm 离心10 min得到粗提物,再将粗提物溶解于甲醇中,于13000 rpm 离心10 min,得到的沉淀物溶解于正己烷中,于13000 rpm 离心10 min,获得纯净的靛蓝沉淀物,再溶于5ml二甲基亚砜中,获得提纯的靛蓝液体,采用分光光度计测定,获得靛蓝产量。
5.其中,所述s1.1中的大肠杆菌为基因表达菌株b21或者菌株b25。
6.其中,所述s1.2中的聚合酶链式反应的条件为:95℃进行解链,55~65℃进行退火,72℃进行延伸。
7.其中,所述s1.3中的重组质粒phg-01的核苷酸序列如seq id no.1所示。
8.其中,所述s1.3中的载体pet为pet28,所述pet28的核苷酸序列如seq id no.2所示。
9.其中,所述s1.2中的变构酶为脱氢酶。
10.其中,所述脱氢酶中的核苷酸序列如seq id no.3~seq id no.9所示。
11.其中,所述s1.1中的细胞色素加氧酶为细胞色素单加氧酶。
12.其中,所述细胞色素单加氧酶的核苷酸序列如seq id no.10~seq id no.13所示。
13.本发明的有益效果:本发明以导有细胞色素加氧酶的大肠杆菌为宿主,加入变构酶,在生物合成的过程中持续提供辅因子nadph,为限速步生物酶反应持续提供能量,获得靛蓝生物合成优化菌株,提高吲哚酚的转化率,进而提高生物靛蓝的产量;本发明在发酵培养液的od600值为0.4开始诱导,在诱导培养温度25℃下培养18h,靛蓝产量超过500mg/l,显著提高生物靛蓝的产量,有利于实现靛蓝的生物合成产业化;本发明能够为生物靛蓝的工业产业化奠定基础,能广泛应用于用于食品、医药和印染工业。
附图说明
14.图1为本发明转化为生物靛蓝技术路线图;图2为本发明靛蓝标准曲线图。
具体实施方式
15.为了对本发明作出更加清楚完整地说明,下面用具体实施例说明本发明,但并不
是对发明的限制。
16.实验前准备:一、 lb固体培养基的配方每升培养基中,加入胰蛋白胨10g,酵母提取物5g,nacl 10g,琼脂20g,其余为水,ph5.5~6.5。
17.二、 lb液体培养基的配方每升培养基中,加入胰蛋白胨10g,酵母提取物5g,nacl 10g,其余为水,ph5.5~6.5。
18.三、靛蓝标准曲线绘制称取靛蓝纯品1mg,加入1ml dmso溶解,得到1mg/ml的标准溶液,将此标准溶液用二甲基亚砜稀释,分别获得终浓度分别为9.9mg/l、50mg/ml、150mg/ml、250mg/ml、350mg/ml、550mg/ml不同梯度的标准溶液,用分光光度计在600nm波长下检测对应浓度标准溶液的吸光度,分别为36、194.4、555.1、942.7、1344.3、2112.6,以靛蓝的浓度为横坐标(x),吸光度为纵坐标(y),拟合靛蓝标准曲线,如图2所示,y = 3.8471x
ꢀ‑ꢀ
7.7519y = 3.9661x
ꢀ‑ꢀ
3.8922,r
2 = 0.9998(r2是线性拟合常数)。
19.实施例1 靛蓝培养液含量测定取5ml靛蓝培养液,经超声波处理,后于13000 rpm 离心10 min得到粗提物,再将粗提物溶解于甲醇中,于13000 rpm 离心10 min,得到的沉淀物溶解于正己烷中,于13000 rpm 离心10 min,获得纯净的靛蓝沉淀物,溶解5ml于二甲基亚砜中,获得提纯的靛蓝液体,然后用分光光度计在600nm波长测定其的吸光度,再根据靛蓝标准曲线计算靛蓝的含量。
20.实施例2一、构建大肠杆菌基因工程菌shg-01(1)通过转化法将seq id no.10 所示的细胞色素单加氧酶导入宿主大肠杆菌菌株b21,获得出发宿主菌株shg-00;(2)以seq id no.3所示的变构酶基因组为模板,该基因组通过基因组提取试剂盒的操作步骤获得,在该变构酶基因的上下游各选取20bp碱基作为正向引物和反向引物,通过以95℃解链、55~65℃退火、72℃延伸的聚合酶链式反应,获得变构酶基因片段p1;(3)以seq id no.2所示的载体pet28作为表达载体,将上述(2)中的变构酶基因片段p1连接到载体pet的多克隆位点,获得seq id no.1所示的重组质粒,标记为phg-01;(4)将上述(3)中的重组质粒phg-01转入上述(1)出发宿主菌株shg-00中,获得带有变构酶基因片段的大肠杆菌基因工程菌,标记为shg-01;二、获取工程菌shg-01种子液培养液(1)将大肠杆菌基因工程菌shg-01加入到甘油中,使大肠杆菌基因工程菌shg-01的浓度为30%后,于-80℃进行保藏;(2)取上述(1)中保藏有大肠杆菌基因工程菌shg-01的甘油经摇瓶活化,后接种于5ml lb固体培养基中,使工程菌shg-01的接种量为1%,于30℃、2250rpm 摇床中过夜培养12-18 小时,获得工程菌shg-01种子培养液;三、工程菌shg-01种子液培养液的扩大培养取的工程菌shg-01的种子培养液1ml,加入到250ml的lb液体培养基中,于30℃、
2250rpm摇床中进行扩大培养,获得发酵培养液;四、诱导表达,并对发酵液开始诱导的od值、诱导培养时间和诱导培养温度进行筛选(1)对发酵培养液开始诱导的od值筛选用分光光度计于600nm波长下检测上述发酵培养液的吸光度,待在600nm波长下进行检测od值分别为0.2、0.6、0.8、1、1.2时,分别使用异丙基-β-d-硫代半乳糖苷诱导工程菌shg-01表达蛋白酶,使异丙基-β-d-硫代半乳糖苷的终浓度为200mm,然后分别将发酵培养液置于30℃的摇床之中培养18h,获取靛蓝培养液,分别取样5ml靛蓝培养液,根据实施例1进行分离提纯测定,得到靛蓝产量,结果表2所示,在诱导培养温度为30℃、诱导培养时间为18h的条件下,选择发酵培养液在600nm波长下进行检测od值为0.4时的靛蓝产量最高,od值小于或大于0.4,靛蓝产量都降低,为此,在诱导培养温度、诱导培养时间一定时,优选发酵培养液在600nm波长下检测od值为0.4时开始诱导表达;表1发酵培养液开始诱导的不同od600值的靛蓝产量变化表od600值0.20.40.60.811.2吸光度(a)1000124811811056882.1616产量(mg/l)253.1315.6298.7267.3223.4156.3(2)对诱导培养时间筛选用分光光度计于600nm波长下检测上述发酵培养液的吸光度,待在600nm波长下进行检测od值为0.4时,使用异丙基-β-d-硫代半乳糖苷诱导工程菌shg-01表达蛋白酶,使异丙基-β-d-硫代半乳糖苷的终浓度为200mm,然后将发酵培养液置于30℃的摇床之中培养36h,获取靛蓝培养液,每3小时取样,每次取样5ml靛蓝培养液,根据实施例1进行分离提纯测定,得到靛蓝产量,结果如表2所示,在开始诱导的od值为0.4、诱导培养温度为30℃时,培养18h后的靛蓝产量最高,继续培养靛蓝产量降低,为此,在开始诱导的od值、诱导培养温度一定时,优选诱导培养时间为18h;表2不同诱导培养时间的靛蓝产量变化表
时间(h)0369121518212427303336吸光度(a)00017.8110.7265.4411.8384343.5294.8272.5249.1225.7产量(mg/l)0005.4728.967.9104.897.887.675.369.763.857.9
(3)对诱导培养时间筛选用分光光度计于600nm波长下检测上述发酵培养液的吸光度,待在600nm波长下进行检测od值为0.4时,使用异丙基-β-d-硫代半乳糖苷诱导工程菌shg-01表达蛋白酶,使异丙基-β-d-硫代半乳糖苷的终浓度为200mm,然后将发酵培养液置于18℃、25℃、30℃、37℃不同的摇床之中分别培养18h,获取靛蓝培养液,分别取样5ml靛蓝培养液,根据实施例1进行分离提纯测定,得到靛蓝产量,结果如表3所示,在开始诱导的od值为0.4、诱导培养时间为18h时,诱导培养温度为25℃时,靛蓝产量最高,温度大于或小于25℃,靛蓝产量降低,为此,在开始诱导的od值、诱导培养时间一定时,优选诱导培养温度为25℃。
21.表3不同诱导培养温度的靛蓝产量变化表温度(℃)18253037吸光度(a)12472042463.3219产量(mg/l)315.3515.8117.856.2
根据实施例2,综上,结合表1至表3,诱导表达时,选择发酵培养液的od600值为0.4,培养温度为25℃,培养时间为18h,靛蓝的产量最高,高达515.8mg/l。
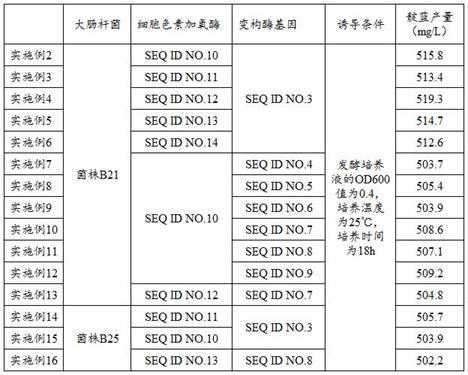
22.实施例3一、构建大肠杆菌基因工程菌shg-01(1)通过转化法将seq id no.11 所示的细胞色素单加氧酶导入宿主大肠杆菌菌株b21,获得出发宿主菌株shg-00;(2)以seq id no.3所示的变构酶基因组为模板,该基因组通过基因组提取试剂盒的操作步骤获得,在该变构酶基因的上下游各选取20bp碱基作为正向引物和反向引物,通过以95℃解链、55~65℃退火、72℃延伸的聚合酶链式反应,获得变构酶基因片段p1;(3)以seq id no.2所示的载体pet28作为表达载体,将上述(2)中的变构酶基因片段p1连接到载体pet的多克隆位点,获得seq id no.1所示的重组质粒,标记为phg-01;(4)将上述(3)中的重组质粒phg-01转入上述(1)出发宿主菌株shg-00中,获得带有变构酶基因片段的大肠杆菌基因工程菌,标记为shg-01;二、获取工程菌shg-01种子液培养液(1)将大肠杆菌基因工程菌shg-01加入到甘油中,使大肠杆菌基因工程菌shg-01的浓度为30%后,于-80℃进行保藏;(2)取上述(1)中保藏有大肠杆菌基因工程菌shg-01的甘油经摇瓶活化,后接种于5ml lb固体培养基中,使工程菌shg-01的接种量为1%,于30℃、2250rpm 摇床中过夜培养12-18 小时,获得工程菌shg-01种子培养液;三、工程菌shg-01种子液培养液的扩大培养取的工程菌shg-01的种子培养液1ml,加入到250ml的lb液体培养基中,于30℃、2250rpm 摇床中进行扩大培养,获得发酵培养液;四、诱导表达用分光光度计于600nm 波长下检测上述(1)发酵培养液的吸光度,待在600nm波长下进行检测od值为0.4时,使用异丙基-β-d-硫代半乳糖苷诱导工程菌shg-01表达蛋白酶,使异丙基-β-d-硫代半乳糖苷的终浓度为200mm,然后将发酵培养液置于25℃的摇床之中培养18h,获得靛蓝培养液。
23.本实施例3与实施例2以发酵培养液的od600值为0.4、培养温度为25℃、培养时间为18h的诱导表达进行比较,不同在于细胞色素单加氧酶的核苷酸序列不同,本实施例3的细胞色素单加氧酶如seq id no.11所示。
24.实施例4本实施例4的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的细胞色素单加氧酶的核苷酸序列不同,实施例4的细胞色素单加氧酶如seq id no.12所示。
25.实施例5本实施例5的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的细胞色素单加氧酶的核苷酸序列不同,实施例5的细胞色素单加氧酶如seq id no.13所示。
26.实施例6
本实施例6的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的细胞色素双加氧酶的核苷酸序列不同,实施例6的细胞色素单加氧酶如seq id no.14所示。
27.实施例7本实施例7的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的变构酶基因的核苷酸序列不同,实施例7的变构酶基因如seq id no.4所示。
28.实施例8本实施例8的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的变构酶基因的核苷酸序列不同,实施例8的变构酶基因如seq id no.5所示。
29.实施例9本实施例9的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的变构酶基因的核苷酸序列不同,实施例9的变构酶基因如seq id no.6所示。
30.实施例10本实施例10的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的变构酶基因的核苷酸序列不同,实施例10的变构酶基因如seq id no.7所示。
31.实施例11本实施例11的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的变构酶基因的核苷酸序列不同,实施例11的变构酶基因如seq id no.8所示。
32.实施例12本实施例12的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的变构酶基因的核苷酸序列不同,实施例12的变构酶基因如seq id no.9所示。
33.实施例13本实施例13的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的细胞色素单加氧酶的核苷酸序列不同、变构酶基因的核苷酸序列不同,实施例13的细胞色素单加氧酶如seq id no.12,变构酶基因如seq id no.7所示。
34.实施例14本实施例14的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的宿主大肠杆菌不同,实施例14的大肠杆菌为菌株b25。
35.实施例15本实施例15的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的宿主大肠杆菌不同、细胞色素单加氧酶的核苷酸序列不同,实施例15的大肠杆菌为菌株b25、细胞色素单加氧酶如seq id no.10所示。
36.实施例16本实施例16的步骤与实施例3步骤相同,不同在于构建大肠杆菌基因工程菌shg-01时采用的宿主大肠杆菌不同、细胞色素单加氧酶的核苷酸序列不同、变构酶基因的核苷酸序列不同,实施例16的大肠杆菌为菌株b25、细胞色素单加氧酶如seq id no.13,变构酶基因如seq id no.8所示。
37.将上述实施例3至实施例16获得的靛蓝培养液,分别取靛蓝培养液5ml,根据实施例1进行分离提纯测定,经超声波处理,后于13000 rpm 离心10 min得到粗提物,再将粗提
物溶解于甲醇中,于13000 rpm 离心10 min,得到的沉淀物溶解于正己烷中,于13000 rpm 离心10 min,获得纯净的靛蓝沉淀物,溶解5ml于二甲基亚砜中,获得提纯的靛蓝液体,然后用分光光度计在600nm波长测定其的吸光度,再根据靛蓝标准曲线计算靛蓝的含量,结果如表4所示。
38.表4 不同宿主大肠杆菌、不同细胞色素加氧酶、不同变构酶基因的靛蓝产量综上所述,本发明在发酵培养液的od600值为0.4开始诱导,在诱导培养温度25℃下培养18h,靛蓝产量超过500mg/l,高达519.3mg/l,显著提高生物靛蓝的产量,有利于实现靛蓝的生物合成产业化,以导有细胞色素加氧酶的大肠杆菌为宿主,加入变构酶,在生物合成的过程中持续提供辅因子nadph,为限速步生物酶反应持续提供能量,获得靛蓝生物合成优化菌株,提高吲哚酚的转化率,进而提高生物靛蓝的产量;而且实施例6使用有细胞色素双加氧酶获得的靛蓝产量小于实施例2至实施例5使用细胞色素单加氧酶获得的靛蓝产量,优选细胞色素单加氧酶表达大肠杆菌菌株。
39.最后应说明的是,以上实施例仅用以说明而非限制本发明的技术方案,尽管参照上述实施例对本发明进行了详细说明,本领域技术人员应当理解,依然可以对本发明进行修改或者等同替换,而不脱离本发明的精神和范围的任何修改或局部替换,其均应涵盖在本发明的权利要求范围中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1