基因疗法
1.本公开涉及包含编码ruvbl1和/或ruvbl2的核酸的转录盒,以及所述载体在用于治疗神经退行性疾病的基因疗法中的用途,所述神经退行性疾病由c9orf72基因的第一内含子中的ggggcc(seq id no:5)六核苷酸重复序列的多态性重复扩增的表达引起;包含所述载体的药物组合物,并且包括治疗神经退行性疾病的用途和方法。
背景技术:
2.肌萎缩性侧索硬化(als)和额颞痴呆(ftd)是无有效治疗方法的成人发作型神经退行性疾病。肌萎缩性侧索硬化(als)是最常见形式的运动神经元疾病(mnd),是一组以运动神经元的变性和丧失为特征的神经系统病症的统称。als的特征是上部和下部运动神经元的选择性变性,导致通常是由于呼吸衰竭和瘫痪的肌肉萎缩和过早死亡。als的中位生存期少于诊断后的3年,但一系列因素可能影响疾病的持续时间。als的发病率为每年每100,000人中大约2例。大约90%的als病例被归类为散发性,其中大约10%显示出遗传组分和家族遗传。ftd是第二种最常见的早发性痴呆,其特征是额叶和颞叶中的神经元细胞的进行性丧失,导致认知功能和人格的改变,使患者无法照顾自己,并且导致疾病发作后2-15年内死亡。每年每100,000人中有大约四个新病例。als和ftd表现出大量的临床、病理和遗传重叠,40-50%的ftd患者出现某种程度的运动功能障碍,并且大约25%的als病例临床诊断患有ftd。因此,als和ftd被提议构成一个具有相关致病机制的疾病谱。als和ftd的神经保护治疗选择极其有限。目前,治疗als的唯一许可药物是抗谷氨酸剂利鲁唑(riluzole),其将als患者的生存期延长仅大约3-6个月。因此,需要对这些相关的神经疾病进行改进的治疗干预。
3.als和ftd的最常见的遗传原因是ggggcc的六核苷酸重复扩增,本文称为g4c2(seq id no:5),位于9号染色体开放阅读框72(c9orf72)基因的第一内含子中,称为c9als/ftd。c9als/ftd表现为常染色体显性遗传和不完全外显率,致病重复序列从30到数千不等。c9orf72重复扩增占家族性als的40%和家族性ftd的25%,尽管这在不同人群之间可能有所不同。c9orf72扩增也是部分散发性als和ftd病例的原因,并在其他神经退行性疾病中有报道,包括原发性侧索硬化、进行性肌萎缩、皮质基底综合征、阿尔茨海默氏病(alzheimer's disease)、帕金森氏病(parkinson’s disease)和路易体痴呆(dementia with lewy body)。存在3种公认的与c9orf72重复扩增相关的致病机制:1)重复扩增的rna毒性2)异常重复相关的非atg(ran)翻译的二肽重复(dpr)蛋白质积累的蛋白质毒性,和3)c9orf72基因的单倍体不足。靶向c9orf72的反义寡核苷酸疗法正在临床试验中,并且旨在减少重复扩增的表达,因此降低rna和dpr毒性,而不影响c9orf72的正常表达。由于缺陷性dna修复导致的dna损伤水平的升高如何被提议作为c9orf72相关rna和dpr蛋白介导的细胞毒性的一种方法1。因此,基因组不稳定性被认为是c9als/ftd的一个促成因素,并且解决这一问题的机制可能被证明是有益的。
4.ruvbl1和ruvbl2(也称为rvb1/rvb2、pontin/reptin和tip49/tip48)是atp酶的
aaa+(与不同细胞活性相关的atp酶)家族的成员。ruvbl1和ruvbl2结构相似,共享aaa+超家族的基序和结构域结构特征
2-4
。通过x射线晶体学和电子显微镜的结构分析指示,ruvbl1和ruvbl2单体寡聚成杂环和同环六聚环,其可以进一步堆叠成双环结构
2-5
。这些寡聚六聚体的组织(无论是异源的还是同源的)都有可能与含ruvbl1/2的复合物的特定功能相关,并且在结构上对于ruvbl1和ruvbl2的内在atp酶活性是重要的,其通过其保守的walker a和b基序水解atp
5,6
。从酵母到哺乳动物,ruvbl1和ruvbl2是高度保守的,并且与细菌ruvb蛋白是旁系同源的,从而指示在基本细胞过程中的作用。事实上,ruvbl1/2是多种细胞内蛋白复合物的组分,并且参与一系列重要的细胞途径,包括转录调节、端粒酶生物发生、有丝分裂装配和核糖核蛋白复合物生物发生(如
7-9
中所述)。
5.本公开涉及包含编码ruvbl1和/或ruvbl2的核酸的转录盒,以及所述载体在基因治疗中用于治疗运动神经元疾病(mnd)(诸如als)和其他神经退行性疾病(诸如ftd)中的用途,所述疾病由c9orf72基因的第一内含子中的ggggcc(seq id no:5)六核苷酸重复序列的多态性重复扩增引起。增加ruvbl1和2蛋白水平的所述基因的表达特异性地靶向ruvbl1和/或ruvbl2水平缺失的神经元细胞,以改善疾病。
技术实现要素:
6.根据本发明的一方面,提供一种分离的核酸分子,包含:转录盒,其包含适于在哺乳动物神经元中表达的启动子,所述转录盒还包含编码选自由以下组成的组的atp酶的核苷酸序列:
7.i)seq id no:1和/或seq id no:2中所示的核苷酸序列;
8.ii)核苷酸序列,其中所述序列由于遗传密码而与(i)中定义的核苷酸序列简并;
9.iii)核酸分子,其互补链在严格杂交条件下与seq id no:1和/或seq id no:2中的序列杂交,其中所述核酸分子编码atp酶;
10.iv)核苷酸序列,其编码包含seq id no:3和/或4中所示的氨基酸序列的多肽;
11.v)核苷酸序列,其编码包含氨基酸序列的多肽,其中所述氨基酸序列通过添加、缺失或取代至少一个如以上iv)中所示的氨基酸残基而被修饰,并且其具有atp酶活性。
12.当两个互补的核酸分子彼此经历一定量的氢键结时,就会发生核酸分子的杂交。杂交的严格性可以根据核酸周围的环境条件、杂交方法的性质以及所用核酸分子的组成和长度而变化。关于获得特定严格程度所需的杂交条件的计算论述于sambrook等人,molecularcloning:a laboratory manual(cold spring harbor laboratory press,cold spring harbor,ny,2001);和tijssen,laboratory techniques in biochemistry and molecular biology—hybridization with nucleic acid probes第i部分,第2章(elsevier,new york,1993)中。tm是核酸分子的给定链的50%与其互补链杂交的温度。以下是一组示例性的杂交条件,但不是限制性的:
13.极高严格性(允许共享至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列杂交)
14.杂交:5x ssc,在65 c下,16小时
15.洗涤两次:2x ssc,在室温(rt)下,每次15分钟
16.洗涤两次:0.5x ssc,在65 c,每次20分钟
17.高严格性(允许共享至少80%、81%、82%、83%、84%、85%、86%、87%、88%或89%同一性的序列杂交)
18.杂交:5x-6x ssc,在65 c-70 c下,16-20小时
19.洗涤两次:2x ssc,在rt下,每次5-20分钟
20.洗涤两次:1x ssc,在55 c-70 c下,每次30分钟
21.低严格性(允许共享至少50%、55%、60%、65%、70%或75%同一性的序列杂交)
22.杂交:6x ssc,在rt至55c下,16-20小时
23.洗涤至少两次:2x-3x ssc,在rt至55c下,每次20-30分钟。
24.在本发明的优选实施方案中,所述表达盒适于在神经元中表达。优选地,所述神经元是运动神经元。
25.在本发明的优选实施方案中,所述核酸分子包含seq id no:1和/或2中所示的核苷酸序列或由其组成。
26.在本发明的优选实施方案中,提供一种编码多肽或其多态性序列变体的核苷酸序列,其包含seq id no:3和/或4中所示的氨基酸序列。
27.如本文所公开的多肽可以通过可以任何组合存在的一个或多个取代、添加、缺失、截短而在氨基酸序列上不同。优选的变体是通过保守氨基酸取代而不同于参考多肽的那些变体。这种取代是用具有相似特征的另一种氨基酸取代给定的氨基酸的那些取代。以下非限制性氨基酸列表被认为是保守替换(相似的):a)丙氨酸、丝氨酸和苏氨酸;b)谷氨酸和天冬氨酸;c)天冬酰胺和谷氨酰胺;d)精氨酸和赖氨酸;e)异亮氨酸、亮氨酸、蛋氨酸和缬氨酸;以及f)苯丙氨酸、酪氨酸和色氨酸。最优选的是保留或增强与其变异的参考多肽相同的生物学功能和活性的变体。
28.在一个实施方案中,多肽与本文所示的大部分或全长氨基酸序列具有至少70%同一性,甚至更优选至少75%同一性,还更优选至少80%、85%、90%、95%同一性,以及至少99%同一性。
29.在本发明的优选实施方案中,所述启动子是组成型启动子。
30.在本发明的替代实施方案中,所述启动子是受调控启动子,例如诱导型或细胞特异性启动子。
31.在本发明的优选实施方案中,所述启动子选自由以下组成的组:鸡β肌动蛋白(cba)启动子、鸡β肌动蛋白杂合启动子(cbh)、cag启动子、ef-1a启动子、神经元和神经胶质特异性启动子,包括突触蛋白1、hb9、camkii、mecp2和gfap启动子序列。
32.在本发明的另优选实施方案中,所述启动子选自由以下组成的组:mep229、mecp2和jet启动子序列。
33.在本发明的优选实施方案中,所述jet启动子核苷酸序列包含如以下中所示的序列或由如以下中所示的序列组成:
34.gggcggagttagggcggagccaatcagcgtgcgccgttccgaaagttgccttttatggctgggcggagaatgggcggtgaacgccgatgattatataaggacgcgccgggtgtggcacagctagttccgtcgcagccgggatttgggtcgcggttcttgtttgt:seq id no 8。
35.jet启动子序列是本领域已知的,并且在美国专利申请us2002/0098547中公开,其全部内容在此通过引用并入。
36.根据本发明的另一方面,提供一种包含根据本发明的转录盒的表达载体。
37.病毒通常被用作递送外源基因的载体。通常采用的载体包括重组修饰的包膜或非包膜dna和rna病毒,例如杆状病毒科、细小病毒科、小核糖核酸病毒科(picornoviridiae)、疱疹病毒科、痘病毒科、腺病毒科、小核糖核酸病毒科(picornnaviridiae)或逆转录病毒科,例如慢病毒。也可以采用嵌合载体,其利用了亲本载体特性中每一种的有利元素(参见例如,feng,等人(1997)nature biotechnology 15:866-870)。这种病毒载体可以是野生型的或可以通过重组dna技术修饰成复制缺陷型、条件复制型或复制胜任型。条件复制型病毒载体用于在特定细胞类型中实现选择性表达,同时避免不利的广谱感染。条件复制型载体的例子描述于pennisi,e.(1996)science 274:342-343;russell和s.j.(1994)eur.j.of cancer 30a(8):1165-1171中。
38.优选的载体来源于腺病毒、腺相关病毒或逆转录病毒基因组。
39.在本发明的优选实施方案中,所述表达载体是基于病毒的表达载体。
40.在本发明的优选实施方案中,所述基于病毒的载体是腺相关病毒[aav]。
[0041]
在一优选的实施方案中,所述基于病毒的载体选自由以下组成的组:
[0042]
aav2、aav3、aav6、aav13;aav1、aav4、aav5、aav6和aav9。
[0043]
在本发明的优选实施方案中,所述基于病毒的载体是aav9。
[0044]
在本发明的替代优选实施方案中,所述基于病毒的载体是慢病毒载体。
[0045]
根据本发明的另一方面,提供一种药物组合物,其包含根据本发明的表达载体和赋形剂或载体。
[0046]
本发明的表达载体组合物以药学上可接受的制剂形式施用。这种制剂可常规地含有药学上可接受浓度的盐、缓冲剂、防腐剂、相容的载体和辅助治疗剂。本发明的表达载体组合物可以通过任何常规途径施用,包括注射或随时间逐渐输注。
[0047]
本发明的表达载体组合物以有效量施用。“有效量”是单独或与其他剂量一起产生所需反应的表达载体的量。在治疗疾病的情况下,所需反应是抑制疾病的发展。这可能仅涉及暂时减缓疾病的发展,但更优选地,其涉及永久停止疾病的发展。这可以通过常规方法监测。当然,这种量将取决于所治疗的特定病状、病状的严重程度、单个患者的参数(包括年龄、身体状况、体型和体重)、治疗的持续时间、同时治疗的性质(如果有的话)、特定的施用途径以及健康从业者的知识和专业技能范围内的类似因素。这些因素对于本领域普通技术人员来说是众所周知的,并且可以通过不超过常规实验来解决。通常优选使用单个组分或其组合的最大剂量,即根据合理的医学判断的最高安全剂量。然而,本领域普通技术人员将理解,由于医学原因、心理原因或实际上任何其他原因,患者可能坚持较低剂量或可耐受剂量。
[0048]
前述方法中使用的表达载体组合物优选是无菌的,并且含有有效量的根据本发明的表达载体,用于以适于向患者施用的重量或体积单位产生所需反应。向受试者施用的载体的剂量可以根据不同的参数选择,特别是根据所用的施用模式和受试者的状态。其他因素包括所需治疗时间。如果受试者在施加的初始剂量下反应不足,那么可以在患者耐受性允许的范围内采用更高的剂量(或通过不同的、更局部化的递送途径有效地更高的剂量)。用于施用载体组合物的其他方案是本领域普通技术人员已知的,其中剂量、注射计划、注射部位、施用模式等与前述不同。在与上述基本相同的条件下进行组合物向除人以外的哺乳
动物(例如,用于测试目的或兽医治疗目的)的施用。如本文所用的受试者是哺乳动物,优选为人,包括非人灵长类动物、牛、马、猪、绵羊、山羊、狗、猫或啮齿动物。
[0049]
当施用时,本发明的表达载体组合物以药学上可接受的量和药学上可接受的组合物形式施用。术语“药学上可接受的”意指不干扰活性剂的生物活性的有效性的无毒物质。这种制剂通常可以含有盐、缓冲剂、防腐剂、相容的载体和任选的其他治疗剂(例如,通常用于治疗特定疾病适应症的那些)。当用于药物中时,盐应该是药学上可接受的,但是非药学上可接受的盐可以方便地用于制备其药学上可接受的盐,并且不排除在本发明的范围之外。这种药理学和药学上可接受的盐包括但不限于由下列酸制备的盐:盐酸、氢溴酸、硫酸、硝酸、磷酸、马来酸、乙酸、水杨酸、柠檬酸、甲酸、丙二酸、琥珀酸等。此外,药学上可接受的盐可以制备成碱金属或碱土金属盐,诸如钠盐、钾盐或钙盐。
[0050]
含有根据本发明的表达载体的药物组合物可以含有合适的缓冲剂,包括盐中的乙酸;盐中的柠檬酸;盐中的硼酸;以及盐中的磷酸。药物组合物还可以任选地含有合适的防腐剂,例如:苯扎氯铵(benzalkonium chloride);氯丁醇(chlorobutanol);对羟基苯甲酸酯(paraben);以及硫柳汞(thimerosal)。
[0051]
表达载体组合物可以方便地以单位剂量形式存在,并且可以通过制药领域中众所周知的任何方法制备。所有方法都包括将活性剂与构成一种或多种辅助成分的载体缔合的步骤。所述制剂可以根据已知方法使用合适的分散剂或湿润剂和悬浮剂来配制。无菌注射制剂也可以是在无毒的肠胃外可接受的稀释剂或溶剂中的无菌注射溶液或悬浮液,例如,在1,3-丁二醇中的溶液。可以采用的可接受的溶剂是水、林格氏溶液(ringer’s solution)和等渗氯化钠溶液。此外,无菌的不挥发油通常用作溶剂或悬浮介质。为此,可以采用任何温和的不挥发油,包括合成的单甘油酯或二甘油酯。此外,脂肪酸(诸如油酸)可用于制备注射剂。可以在remington’s pharmaceutical sciences,mack publishing co.,easton,pa中找到适用于口服、皮下、静脉内、肌内等施用的载体配制物。
[0052]
根据本发明的另一方面,提供一种用作药物的根据本发明的表达载体。
[0053]
根据本发明的另一方面,提供一种用于治疗神经退行性疾病的根据本发明的表达载体。
[0054]
在本发明的优选实施方案中,所述神经退行性疾病与c9orf72基因的第一内含子中的多态性glyglyglyglycyscys(g4c2;seq id no:5)重复扩增有关。
[0055]
在本发明的优选实施方案中,所述神经退行性疾病选自由以下组成的组:肌萎缩性侧索硬化(als)和额颞痴呆(ftd)运动神经元疾病、额颞叶痴呆(ftld)、亨廷顿样病症(huntington's like disorder)、原发性侧索硬化、进行性肌萎缩、皮质基底综合征、阿尔茨海默氏病和路易体痴呆。
[0056]
在本发明的优选实施方案中,所述神经退行性疾病是肌萎缩性侧索硬化(als)。
[0057]
在本发明的优选实施方案中,所述神经退行性疾病是额颞痴呆(ftd)。
[0058]
根据本发明的另一方面,提供一种用根据本发明的表达载体转染的细胞。
[0059]
在本发明的优选实施方案中,所述细胞是神经元。
[0060]
在本发明的优选实施方案中,所述神经元是运动神经元。
[0061]
根据本发明的另一方面,提供一种治疗或预防神经退行性疾病的方法,其包括施用治疗有效量的根据本发明的表达载体,以预防和/或治疗所述神经退行性疾病。
[0062]
在本发明的优选方法中,所述神经退行性疾病是肌萎缩性侧索硬化(als)。
[0063]
在本发明的优选方法中,所述神经退行性疾病是额颞痴呆(ftd)。
[0064]
在本说明书的整个说明书和权利要求书中,词语“包括(comprises)”和“含有(contain)”以及这些词语的变体,例如“包括(comprising)”和“包括(comprises)”,意指“包括但不限于(including but not limited to)”,并且不旨在(并且不排除)其他部分、添加物、组分、整数或步骤。“基本上由...组成”意指具有必要整数,但包括基本上不影响必要整数的功能的整数。
[0065]
贯穿本说明书的实施方式和权利要求,除非上下文另有规定,否则单数包涵复数。特别地,在使用不定冠词的情况下,除非上下文另有要求,否则说明书应被理解为考虑复数和单数。
[0066]
结合本发明的一方面、实施方案或实施例描述的特征、整数、特性、化合物、化学部分或组应理解为适用于本文描述的任何其他方面、实施方案或实施例,除非与其不相容。
[0067]
现在将仅通过示例并参考以下附图来描述本发明的实施方案:
[0068]
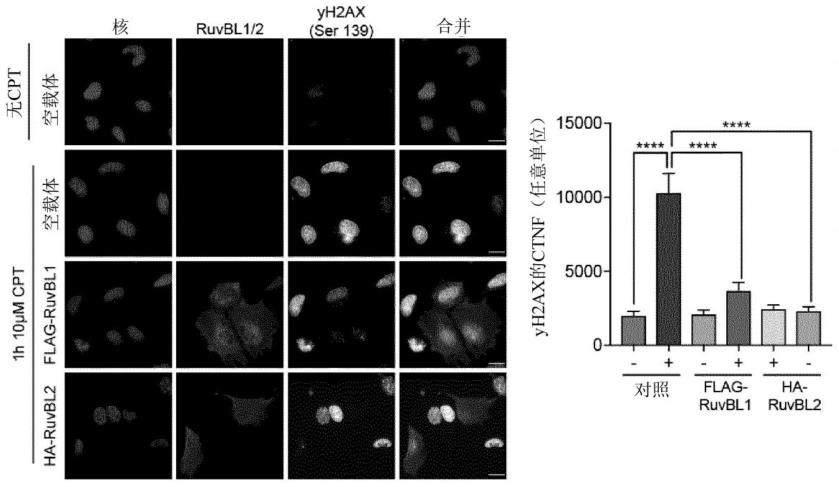
图1.cpt诱导的dna损伤后,ruvbl1和ruvbl2过表达减少核h2ax积累。在用抗flag或抗ha和抗h2ax(ser139)抗体免疫染色之前,用空载体对照、flag标记的ruvbl1或ha标记的ruvbl2转染的hela细胞用10μm喜树碱(cpt)处理1h。核h2ax的水平表示为校正的总核荧光(ctnf)。未显示未经cpt处理的flag-ruvbl1和ha-ruvbl2过表达细胞的图像。(来自2个独立实验的平均sem;单向anova与图基氏事后检验(tukey’s post-test):****p 0.0001;比例尺=20μm);
[0069]
图2.cpt诱导的dna损伤后,ruvbl1和ruvbl2过表达减少53bp1核焦点。在用抗flag或抗ha和抗53bp1抗体免疫染色之前,用空载体对照、flag标记的ruvbl1或ha标记的ruvbl2转染的hela细胞用10μm喜树碱(cpt)处理1h。未显示未经cpt处理的flag-ruvbl1和ha-ruvbl2过表达细胞的图像。定量53bp1核焦点的数量(来自2个独立实验的平均sem;单向anova与图基氏事后检验:*p 0.05,****p 0.0001;比例尺=20μm);
[0070]
图3.c9orf72 als/ftd患者inpc的ruvbl1水平降低。通过免疫印迹测定来自3个c9orf72 als/ftd患者inpc细胞系(p.183、p.78和p.201)及其年龄和性别匹配的对照(分别为c.155、c.3050和c.ag0)的ruvbl1蛋白水平。ruvbl1的水平被标准化为gapdh,并且相对于年龄和性别匹配的对照显示(平均sem;未配对t检验:*p 0.05,****p 0.0001;n=3个独立实验);
[0071]
图4.c9orf72 als/ftd患者inpc的ruvbl2水平降低。通过免疫印迹测定来自3个c9orf72 als/ftd患者inpc细胞系(p.183、p.78和p.201)及其年龄和性别匹配的对照(分别为c.155、c.3050和c.ag0)的ruvbl2蛋白水平。ruvbl2的水平被标准化为gapdh,并且相对于年龄和性别匹配的对照显示(平均sem;未配对t检验:ns=不显著;*p 0.05,***p 0.001;n=3个独立实验);
[0072]
图5.c9-bac500皮质神经元的ruvbl2水平降低。自非转基因(ntg)和转基因(tg)c9-bac500 e16小鼠胚胎分离的皮质神经元在10div(体外天数)后裂解。通过免疫印迹测定ruvbl2蛋白水平。ruvbl2的水平被标准化为gapdh,并且相对于非转基因对照显示(平均sem;未配对t检验:*p 0.05;n=3个胚胎);以及
[0073]
图6.ruvbl1和ruvbl2过表达减少c9orf72相关dpr蛋白。用空载体对照(ev)、v5标
记的ga100、gr100或pr100二肽重复表达质粒转染的hela细胞与ev、flag标记的ruvbl1或ha标记的ruvbl2共转染。转染后48h细胞裂解,通过斑点印迹分析(dot-blot analysis)确定v5标记的dpr的水平。还使用抗flag和抗ha抗体进行免疫印迹以确认flag-ruvbl1和ha-ruvbl2过表达。v5标记的dpr的水平标准化为-微管蛋白,并且相对于空载体对照表达(平均sem;未配对t检验:*p 0.05,**p 0.005,***p 0.001;n=3个独立实验)
[0074]
图7.ruvbl2的缺失导致dna损伤。用非靶向对照(sictrl)、ruvbl1(siruvbl1)或ruvbl2(siruvbl2)sirna处理hela细胞且用抗h2ax(ser139)和抗细胞周期蛋白a抗体(a)免疫染色。细胞周期蛋白a染色鉴定处于细胞周期g2期并且由于经历有丝分裂的细胞。从分析中排除细胞周期蛋白a阳性细胞。细胞周期蛋白a阴性细胞中的核h2ax的水平表示为校正的总核荧光(ctnf)。在免疫染色前用10μm cpt处理sictrl细胞1h作为dna损伤增加的阳性对照。ruvbl1和ruvbl2敲低增加了裂解的parp-1(c.parp)积累。ruvbl1和ruvbl2基因敲除通过免疫印迹来确认(c)。(来自2个独立实验的平均sem;单向anova与图基氏事后检验:****p 0.0001;比例尺=20μm)。
[0075]
图8.ruvbl1和ruvbl2的缺失干扰基础自噬。用非靶向对照(sictrl)、ruvbl1(siruvbl1)或ruvbl2(siruvbl2)sirna处理hela细胞。治疗后4天,通过免疫印迹测定p62(a)lc3-ii(b)的水平。p62和lc3-ii的水平针对-微管蛋白标准化,并且相对于sictrl样品的平均值显示。通过蛋白质印迹(c)评估ruvbl1和ruvbl2敲低(平均值sem;单向anova与图基氏事后检验:*p 0.05,***p 0.001;n=4个实验);以及
[0076]
图9.ruvbl1与c9orf72相互作用。用myc-c9orf72和空载体flag-ruvbl1或ha-ruvbl2共转染的hela细胞的细胞裂解物用抗myc抗体进行免疫沉淀。在免疫印迹上探测免疫沉淀(ip:myc-c9)的myc-c9orf72、flag-ruvbl1和ha-ruvbl2。
[0077]
材料和方法
[0078]
质粒
[0079]
pci-neo空载体质粒购自(promega),pcmv3 flag标记的ruvbl1和ha标记的ruvbl2购自sinobiologicals。
[0080]
首先使用ecori/noti将编码独立于g4c2重复的聚-gly-ala、聚-gyl-arg和聚-pro-arg x100 dpr的合成序列克隆到pcdna3.1中。使用bamhi/noti将编码聚-gly-ala、聚-gyl-arg和聚-pro-arg x100的合成序列亚克隆到使用bcli/noti的pci-neo-v5-n中。使用正向actctagaggtaccacgtgatcattctcgagggtgctatccaggc(seq id no:6)和反向gcctggatagcaccctcgagaatgatcacgtggtacctctagagt(seq id no:7)引物,通过定点突变形成将bcli限制性位点预先引入pci-neo-v5-n中。
[0081]
细胞培养和转染
[0082]
在5%co2气氛中在37℃下,在补充有10%fbs(supplier)和100iu/ml青霉素(penicillin)和100iu/ml链霉素(streptomycin)(sigma)的杜尔贝科氏改良伊格尔氏培养基(dulbecco’s modified eagle’s medium;dmem,supplier)中培养hela细胞。使用聚乙烯亚胺(pei)(储备液1mm;3μl/μg质粒)用质粒dna转染hela细胞。细胞在dna转染后24h或48h用于实验中。根据制造商的说明,使用lipofectamine rnaimax(invitrogen)对hela细胞进行sirna转染。细胞在sirna转染后4天用于实验中。
[0083]
从e15 fvb/nj-tg(c9orf72)500lpwr/j(c9 bac-500,jackson laboratory)胚胎
中分离皮质神经元并在补充有b27增补剂量(invitrogen)、100iu/ml青霉素、100mg/ml链霉素和2mm l-谷氨酰胺的神经基础培养基中在涂覆有聚-l-赖氨酸的6孔组织培养板上培养。体外10天后收获细胞以用于免疫印迹分析。
[0084]
inpc生产
[0085]
如前所述,诱导的神经祖细胞(inpc)来源于人皮肤成纤维细胞
10
。人皮肤成纤维细胞样品从谢菲尔德组织银行(sheffield tissue bank)的pamela j shaw教授处获得。样本采集前,从所有受试者获得知情同意。简言之,用oct3、sox2、klf4和c-myc的慢病毒载体转导10,000个成纤维细胞12h。转导后四十八小时,用pbs洗涤细胞并用npc培养基(dmem/f-12替换为补充有1%n2、1%b27、20ng/ml fgf-b、20ng/ml egf和5μg/ml肝素的glutamax)替换成纤维细胞培养基。当细胞开始改变形状并形成神经球时,其扩增为神经玫瑰花结。当inpc培养物汇合时(约3周),取出egf和肝素,并且fgf-b浓度增加至40ng/ml。inpc可维持约30代。inpc不通过克隆扩增,因此不显示克隆变异性。
[0086]
sds-page和免疫印迹
[0087]
在胰蛋白酶/edta(lonza)中收获细胞,并且在400xg下沉淀4min。将沉淀物在磷酸盐缓冲盐水(pbs)中洗涤一次。将细胞沉淀物在冰冷的ripa缓冲液(50mm tris-hcl ph 6.8,150mm nacl,1mm edta,1mm egta,0.1%(w/v)sds,0.5%(w/v)脱氧胆酸,1%(w/v)triton x-100+蛋白酶抑制剂混合物)中在冰中裂解30min。将裂解物在4℃下以17,000xg澄清20min。通过bradford测定(biorad)测量蛋白质浓度。蛋白质通过sds-page分离并通过电印迹(biorad)转移至硝酸纤维素膜(whatmann)。将膜在具有5%无脂牛奶(marvel)和0.1%tween-20的tris缓冲盐水(tbs)中封闭1h。将膜在封闭缓冲液中的一级抗体中在4℃下温育过夜。将膜用具有0.1%tween-20的tbs洗涤膜三次,每次10min,然后在室温下与稀释在具有0.1%tween-20的tbs中的二级抗体一起温育1h。将膜在具有0.1%tween-20的tbs中再次洗涤三次,每次10min。根据制造商的说明,用增强型化学发光(ecl)底物制备用于化学发光信号检测的膜。在syngene gbox上检测化学发光信号,并且使用imagej定量信号强度。
[0088]
斑点印迹
[0089]
对于斑点印迹分析,将细胞直接收获到2x laemmli载样缓冲液中,并且用蒸馏的h2o以1:2稀释。使裂解物通过25g针20次以剪切基因组dna,然后在95℃下沸腾3min。将等体积的裂解物装载到96孔bio-dot微量过滤装置(biorad)上,并且在真空下转移至硝酸纤维素膜。将样品孔在具有0.1%tween-20的tbs中洗涤3次,然后废除。然后如上所述对硝酸纤维素膜进行计时和免疫印迹。在syngene gbox上检测化学发光信号,并且使用imagej定量信号强度。
[0090]
抗体
[0091]
所用的一级抗体如下:兔抗ruvbl1(bethyl laboratories,wb:1:1,000)、兔抗ruvbl2(bethyl laboratories,wb:1:1,000)、兔抗53bp1(bethyl laboratories,if:1:500)、小鼠抗h2ax(merck millipore,if:1:1,000)、小鼠抗gapdh(merck millipore,wb:1:4,000)、小鼠抗微管蛋白(dm1a,sigma,wb:1:10,000)、小鼠抗v5(invitrogen,wb:1:5,000)、小鼠抗flag(m2,sigma,wb和if:1:2,000)、小鼠抗ha(ha-7,sigma,wb和if:1:2,000)。用于免疫印迹的二级抗体是辣根过氧化物酶偶联的山羊抗兔和兔抗小鼠igg(dako;1:5,000)。用于免疫荧光的二级抗体是alexa荧光团(488和568)偶联的山羊/驴抗小鼠igg、
105个病毒基因组(vg)添加至培养基中。温育4小时后,用条件培养基替换转导培养基。每3天用新鲜培养基替换一半的培养基。转导后7天(13div),将细胞用4%多聚甲醛或甲醇∶丙酮(50:50)固定或适当时收获以用于sds-page和免疫印迹。
[0101]
向小鼠体内递送aav9
[0102]
所有涉及小鼠的实验均根据1986年《动物(科学程序)法(animal(scientific procedures)act)》在项目许可证40/3739下进行,并且经谢菲尔德大学伦理审查小组委员会(university of sheffield ethical review sub-committee)和英国动物程序委员会(uk animal procedures committee)(london,uk)批准。根据1986年《动物(科学程序)法》,遵循英国内政部(uk home office)关于科学程序中使用的动物的居住和护理的行为准则。将动物以12小时黑暗/12小时光照周期、21℃的标准室温饲养在受控设备中,自由进食和饮水。
[0103]
为了通过枕大池将aav9递送至csf中,在出生后第1天,将15只野生型c57bl/6小鼠(n=3只/组)在诱导室中使用5%异氟烷和3升/分钟的氧气麻醉,然后将其置于红色透照仪(hilips healthcare“wee sight”—产品号1017920)上,使其头部稍微向前倾斜并将鼻子连接至麻醉剂供应源。用2%异氟烷和0.3升/分钟的氧气维持麻醉。使用立体定位装置以45度角将连接至hamilton注射器和蠕动泵的33号针降低到枕大池区域中大约1mm,并且以1升/分钟的速率注射1μl病毒溶液(1
×
1010vg/μl)。等体积的pbs/35mmol/l nacl用作对照溶液。
[0104]
对于aav9的尾静脉注射,将3-4周龄的动物置于更温暖的环境(31℃)中长达15分钟,然后在约束装置的帮助下牢牢固定。使用加热灯进一步扩张尾部的侧静脉,之后小鼠接受每只小鼠1x10
12
vg的单次静脉内剂量,最终体积为100μl。给未经治疗的动物注射补充有35mm nacl的100μl pbs。
[0105]
实施例1
[0106]
基因组稳定性对细胞存活至关重要并由dna损伤反应(ddr)来维持。ddr修复损伤的失败与一系列神经退行性疾病有关
11,12
。我们之前证明了c9orf72重复扩增通过形成称为r环的rna/dna杂交体导致dna损伤,这反过来导致dna双链断裂(dsb)1。因此,校正c9als/ftd的基因组不稳定性具有治疗益处。
[0107]
含有ruvbl1/2的复合物参与一系列细胞过程,包括ddr。作为tip60和ino80复合物的部分,ruvbl1/2被募集至dna损伤部位,以调控组蛋白修饰、dna可及性、ddr信号放大并最终修复
13-17
。因此,我们首先研究了提高ruvbl1/2水平是否能促进dna损伤修复。喜树碱对hela细胞的化学诱导的dna损伤导致dsb标记物yh2ax和53bp1的核积累(图1和图2)。在ruvbl1和ruvbl2过表达的情况下,核yh2ax的水平和53bp1焦点的数量显著减少,从而表明更有效的dna修复反应(图1和图2)。这些数据表明,ruvbl1/2过表达因此可以减轻c9als/ftd患者神经元中发现的dna损伤。
[0108]
实施例2
[0109]
如果调节c9als/ftd患者的ruvbl1/2水平被认为是一种治疗方法,我们接下来研究了c9als/ftd患者细胞中ruvbl1和ruvbl2的内源性表达。与年龄和性别匹配的对照相比,所有3名c9als/ftd患者inpc显示显著减少的ruvbl1蛋白(图3)。与匹配的对照相比,ruvbl2蛋白表达在3名c9als/ftd患者中的2名中显著降低(图4)。类似地,ruvbl2表达在c9als/ftd
的c9 bac-500小鼠模型中显著降低(图5)。因此,这些发现加强了我们在c9als/ftd患者中增加ruvbl1/2表达水平的基本原理。
[0110]
实施例3
[0111]
最近,ruvbl1/2与蛋白质折叠和聚集体清除有关
18,19
。c9orf72重复扩增被异常翻译成5种dpr蛋白:poly ga、gr、gp、pa和pr。由于这些c9orf72相关dpr蛋白在细胞内形成毒性聚集体,我们研究了ruvbl1/2过表达是否能促进c9als/ftd相关dpr清除。hela细胞与poly ga、gr或pr(被认为是三种毒性最大的dpr)以及空载体对照flag-ruvbl1或ha-ruvbl2共转染。过表达或ruvbl1和ruvbl2导致ga和gr dpr蛋白的量显著减少,如斑点印迹所定量(图6a和图6b)。ruvbl1/2过表达不影响pr dpr水平(图6b)。虽然与c9orf72重复扩增相关的确切致病机制是复杂的,但越来越多的人认识到,rna毒性、dna损伤、dpr毒性和c9orf72单倍体不足的组合可能均有助于疾病的发展。这些数据表明,ruvbl1/2过表达可减轻相关的dna损伤,同时有助于去除毒性dpr蛋白。
[0112]
实施例4
[0113]
先前的研究指示,ruvbl1/2水平降低可能导致缺陷性dna损伤修复和dna损伤超敏反应
17
。由于c9als/ftd患者降低了ruvbl1和/或ruvbl2的表达(图3和图4),我们研究了ruvbl1/2的缺失是否会增加dna损伤。用靶向sirna的对照ruvbl1或ruvbl2处理hela细胞。然后通过定量核yh2ax信号来测量dna损伤。ruvbl1的敲低对核yh2ax信号不具有显著影响,而ruvbl2的敲低显著增加核yh2ax信号,类似于cpt处理的阳性对照(图7a)。细胞用细胞周期蛋白a共染色,以区分dna损伤升高的细胞和即将经历细胞分裂的细胞。虽然ruvbl1敲低不会导致dna损伤标记物的可检测增加,但对裂解的parp-1蛋白(凋亡细胞死亡的标志物)的分析指示,ruvbl1和ruvbl2 sirna均特别有毒。由于parp-1参与dna损伤感知,这种裂解的parp-1细胞死亡信号可能是dna损伤增加和未解决的结果(图7b)。通过蛋白质印迹证实了ruvbl1和ruvbl2的敲低(图7c)。
[0114]
实施例5
[0115]
由于ruvbl1和ruvbl2参与聚集体蛋白清除,我们接下来研究了ruvbl1/2敲低对自噬降解途径的影响。用靶向sirna的对照ruvbl1或ruvbl2处理的hela细胞通过蛋白质印迹分析两种最常评估的自噬相关蛋白p62和lc3-ii。p62是一种自噬受体蛋白并将自噬底物(包括蛋白聚集体)递送至自噬体以进行溶酶体降解。ruvbl1和ruvbl2的敲低导致p62蛋白水平显著降低(图8a)。除此之外,ruvbl1 sirna导致了lc3-ii的量的少量但不显著增加,而ruvbl2 sirna显著增加lc3-ii水平(图8b)。通过蛋白质印迹证实ruvbl1和ruvbl2敲低(图8c)。lc3-ii蛋白在自噬过程中与自噬体膜直接相关,并且因此被认为是自噬诱导的真正标记物。这些观察到的ruvbl1/2敲低后p62和lc3-ii的差异因此指示ruvbl1和/或ruvbl2的缺失可能干扰正常的基础自噬,从而潜在地破坏正常的蛋白质清除。考虑到dpr蛋白是自噬底物
20
,缺陷性自噬途径会严重阻碍dpr清除。
[0116]
除此之外,我们之前已经证明了c9orf72蛋白本身参与自噬
21
。因此,这导致了毒性前馈机制的假设,由此c9orf72的单倍体不足导致缺陷性自噬,因此阻止了c9orf72相关的dpr自噬底物的有效清除,并且导致其毒性累积。现在已知c9orf72蛋白作为smcr8和wdr41复合物的部分发挥作用,c9orf72的存在似乎稳定了作为此复合物的部分的smcr8
22
。事实上,c9orf72的缺失似乎降低了smcr8表达和稳定性
23,24
.已经描述了广泛范围的其他
sporadic als.proceedings of the national academy of sciences 111,829-832,doi:10.1073/pnas.1314085111(2014).
[0129]
11mckinnon,p.j.atm and the molecular pathogenesis of ataxia telangiectasia.annu rev pathol 7,303-321,doi:10.1146/annurev-pathol-011811-132509(2012).
[0130]
12obulesu,m.&rao,d.m.dna damage and impairment of dna repair in alzheimer's disease.int j neurosci 120,397-403,doi:10.3109/00207450903411133(2010).
[0131]
13jha,s.,gupta,a.,dar,a.&dutta,a.rvbs are required for assembling a functional tip60 complex.mol cell biol 33,1164-1174,doi:10.1128/mcb.01567-12(2013).
[0132]
14jha,s.,shibata,e.&dutta,a.human rvb1/tip49 is required for the histone acetyltransferase activity of tip60/nua4 and for the downregulation of phosphorylation on h2ax after dna damage.mol cell biol 28,2690-2700,doi:10.1128/mcb.01983-07(2008).
[0133]
15ikura,t.et al.dna damage-dependent acetylation and ubiquitination of h2ax enhances chromatin dynamics.mol cell biol 27,7028-7040,doi:10.1128/mcb.00579-07(2007).
[0134]
16murr,r.et al.histone acetylation by trrap-tip60 modulates loading of repair proteins and repair of dna double-strand breaks.nat cell biol 8,91-99,doi:10.1038/ncb1343(2006).
[0135]
17wu,s.et al.a yy1-ino80 complex regulates genomic stability through homologous recombination-based repair.nat struct mol biol 14,1165-1172,doi:10.1038/nsmb1332(2007).
[0136]
18zaarur,n.et al.ruvbl1 and ruvbl2 enhance aggresome formation and disaggregate amyloid fibrils.embo j 34,2363-2382,doi:10.15252/embj.201591245(2015).
[0137]
19narayanan,a.et al.a first order phase transition mechanism underlies protein aggregation in mammalian cells.elife 8,doi:10.7554/elife.39695(2019).
[0138]
20boivin,m.et al.reduced autophagy upon c9orf72 loss synergizes with dipeptide repeat protein toxicity in g4c2 repeat expansion disorders.embo j 39,e100574,doi:10.15252/embj.2018100574(2020).
[0139]
21webster,c.p.et al.the c9orf72 protein interacts with rab1a and the ulk1 complex to regulate initiation of autophagy.the embo journal 35,1656-1627,doi:10.15252/embj.201694401(2016).
[0140]
22su,m.y.,fromm,s.a.,zoncu,r.&hurley,j.h.structure of the c9orf72 arf gap complex that is haploinsufficient in als and ftd.nature 585,251-255,doi:10.1038/s41586-020-2633-x(2020).
[0141]
23amick,j.,roczniak-ferguson,a.&ferguson,s.m.c9orf72 binds smcr8,localizes to lysosomes and regulates mtorc1 signaling.mol biol cell,doi:10.1091/mbc.e16-01-0003(2016).
[0142]
24zhang,y.et al.the c9orf72-interacting protein smcr8 is a negative regulator of autoimmunity and lysosomal exocytosis.genes dev 32,929-943,doi:10.1101/gad.313932.118(2018).
[0143]
25sivadasan,r.et al.c9orf72 interaction with cofilin modulates actin dynamics in motor neurons.nat neurosci 19,1610-1618,doi:10.1038/nn.4407(2016).
[0144]
26chitiprolu,m.et al.a complex of c9orf72 and p62 uses arginine methylation to eliminate stress granules by autophagy.nat commun 9,2794,doi:10.1038/s41467-018-05273-7(2018).
[0145]
27goodier,j.l.et al.c9orf72-associated smcr8 protein binds in the ubiquitin pathway and with proteins linked with neurological disease.acta neuropathol commun 8,110,doi:10.1186/s40478-020-00982-x(2020).
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1