制备活化免疫细胞的方法与流程
制备活化免疫细胞的方法
1.相关申请的交叉引用
2.本技术要求于2020年3月4日提交的第62/985,237号美国临时申请的优先权,所述申请以整体通过援引并入本文。
背景技术:
3.癌症治疗的复杂且渴望的目标为在对于健康细胞仅具有极小影响的情况下根除恶性细胞。这一目标的实现部分地归因于癌症对于免疫系统具有隐匿效果(stifling effect),所述效果与肿瘤重编程免疫系统从而建立对于许多癌症疗法的免疫屏障的能力有关。仅治疗肿瘤内的一部分敏感细胞是耐药性和随后的疾病复发的主要原因。与癌症相关的高死亡率是由肿瘤细胞自起源组织转移性扩散至继发部位而引起。癌转移为全世界大致90%的癌症相关死亡的原因。癌细胞能够通过避开常见免疫监视而进展至转移性部位。因此,免疫疗法旨在恢复尤其是肿瘤微环境内的免疫系统功能,以便将癌细胞识别为外来物。需要注意的是,大部分免疫疗法定向于我们的复杂免疫系统的特定缺陷,而在治疗之前完全诊断出特定患者免疫系统缺陷的能力极其有限。因此,大部分免疫定向疗法,诸如检查点抑制剂和小分子免疫调节剂,仅在某些明确定义的患者群体中取得成功。自广泛有效(但具毒性的)疗法至“精准医疗”的此范式转移(paradigm shift)也部分地受嵌合抗原受体(car)t-细胞(car t)疗法在急性淋巴细胞白血病(all)方面的成功所推动。此疗法为过继转移具有针对特异性all肿瘤抗原cd19的工程改造t细胞受体的自体细胞。包括car t的过继细胞疗法通常依赖于主要组织相容性复合体(mhc)呈递肿瘤相关抗原,所述抗原也可仅在某一肿瘤细胞子集上仅弱表达。car t疗法成功表明了免疫细胞驱动记忆免疫反应的能力。这一成功的益处为与car t和其他免疫分子(例如检查点抑制剂)的联合疗法的概念,重新聚焦于t、nk和t细胞过继细胞转移作为针对癌症的免疫疗法。然而,主要归因于要求对于患者而言自体细胞或组织匹配的供体和昂贵的良好操作规范(gmp)制造规模以及高成本,car t和其他免疫细胞疗法在广泛使用方面均受到限制。所有这些因素似乎均造成当前癌症疗法使患者受益受限。
4.许多研究表明,细胞因子-诱导的杀伤(cik)细胞疗法可为用于以mhc-非依赖性方式杀伤广泛而非狭窄癌症类型集合的更强效的方法。cik是保留效应记忆t细胞亚群的各种特征同时也表达nk细胞的非mhc限制性杀伤特性的异质细胞群体(heterogenous cell population)。cik细胞是在与ifn-γ、抗cd3抗体和il-2进行体外扩增期间衍生自人类外周血单核细胞(pbmc)。cik细胞表达nkg2d受体,所述受体直接与表达于肿瘤细胞表面上的一类逆境相关配体(stress-associated ligand)(nkg2d配体)结合以介导恶性细胞的裂解。归因于这些逆境相关配体的异质性,cik细胞呈现针对各种癌症类型的抗肿瘤细胞毒性。此外,多个研究已证实,cik细胞也具有强效的肿瘤内归巢能力。实际上,临床前成像研究已证实,在静脉内递送72小时后,cik信号主要发现于肿瘤部位。归因于其归巢能力和针对多种肿瘤类型的不受mhc限制的亲和力,cik细胞作为癌症治疗和用于联合治疗的载体具有巨大潜力。
5.一种此类联合疗法利用cik细胞作为用于递送选择性地杀伤癌细胞的溶瘤病毒(ov)的载体(thorne和contag,2006)。近年来,归因于ov的杀伤肿瘤细胞的双模态机制,ov作为一种癌症治疗方法已引起大量注意。首先,病毒优选地在肿瘤细胞内部复制,最终导致癌细胞溶解而不伤害健康组织。另外,由于裂解的细胞释放肿瘤相关抗原(taa)和危险相关分子模式(danger-associated molecular pattern;damp),ov将免疫抑制的肿瘤微环境转化为发炎的微环境。尽管已显示溶瘤病毒具有用于直接裂解肿瘤细胞的有前景的效果,但在动物模型中单独施用溶瘤病毒并未显示任何治疗效果,这是因为它们会被免疫系统迅速清除。归因于溶瘤病毒在感染时的较长的隐蔽期(eclipse period),cik细胞提供将溶瘤病毒有效负载直接递送至肿瘤部位而不警示患者的免疫系统的载体(参见美国专利第9,101,658号和第10,064,893号)。
6.尽管适应性细胞生物疗法具有用于治疗多种多样癌症的极大的潜力,但患者来源的细胞的体外扩增增加联合细胞疗法的产生、储存和运送的复杂性和成本。考虑到患者对治疗的迫切需求,扩增的衍生自pbmc的cik细胞必须以时间敏感的方式同时保持高活力和表型自实验室运送至向患者施用的位置。在此过程期间,cik细胞可保留在不透气的流体转移袋中。这种做法的历史观点导致人们认为cik细胞必须在6小时内输注且因此必须在极近距离制备(laport,gg等人,2012,biol blood marrow transplant.17(11):1679-1687)。然后,当我们准备输注用减毒溶瘤病毒(诸如牛痘病毒)感染的cik细胞时,这一观点随后被移至临床环境中,所述cik细胞然后必须立即回输至患者体内。鉴于自体细胞疗法用于癌症治疗的个体化性质,储存和运送方法对于确保扩增的cik细胞和溶瘤病毒以具有时间和成本效益的方式到达患者而言极其重要。各种研究已表明,在储存期间即使小的温度波动也影响储存在低温的免疫细胞的存活率和活性。此外,已显示,溶瘤病毒的储存也是高度温度相关的,因为在室温下的储存会直接降低牛痘病毒疫苗的效价。
7.适应性细胞疗法具有用于治疗广泛的癌症类型的巨大的潜力。然而,与临床储存和运送相关的高成本预示增加与向患者提供治疗相关的成本和时间。仍存在对扩增的免疫细胞的优化储存和递送条件以允许远距离制备和更多制备选择的需求。本发明解决目前这些未满足的需求中的每一项。
8.本文所引用的所有参考文献,包括专利申请和出版物以整体通过援引并入本文中。
技术实现要素:
9.在一些方面,本发明提供一种制造稳定的免疫细胞群体的方法,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和/或t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出所述细胞且将所述细胞保持在约2℃至约室温长达约120小时,从而产生稳定的免疫细胞群体。在一些实施方案中,稳定的免疫细胞群体包括细胞因子-诱导的杀伤(cik)细胞。在一些实施方案中,cik细胞为cd3+/cd56+细胞。在一些实施方案中,保持或提高群体中的cik细胞的百分比。在一些实施方案中,稳定的免疫细胞群体包括cd3+/cd56+细胞。在一些实施方案中,保持或提高群体中的cd3+/cd56+细胞的百分比。在一些实施方案中,稳定的免疫细胞群体包括nkg2d+细胞。在一些实施方案中,保持或提高群体中的nkg2d+细胞的百分比。在一些实施方案中,保持或提高cd3+/cd56+/nkg2d+细胞的百分
比。在一些实施方案中,稳定的免疫细胞群体的存活率大于约70%。在一些实施方案中,通过台盼蓝(trypan blue)拒染法或通过流式细胞术测量细胞的存活率。
10.在本发明的一些实施方案中,免疫细胞衍生自外周血单核细胞(pbmc)。在一些实施方案中,在约1升至约10升的培养基中培养步骤a)的免疫细胞。在一些实施方案中,在约1升或约5升的培养基中培养步骤a)的免疫细胞。在一些实施方案中,培养步骤a)的免疫细胞约7天、约14天、约28天、约32天、约36天或约40天。
11.在本发明的一些实施方案中,将步骤b)的细胞保持在室温。在一些实施方案中,室温为约22℃。在一些实施方案中,将步骤b)的细胞保持在约2℃至约8℃(例如约4℃)。在一些实施方案中,将步骤b)的细胞保持在袋中。在一些实施方案中,袋为塑料袋。在一些实施方案中,袋为不透气的。在一些实施方案中,将步骤b)的细胞保持在《1%co2中。在一些实施方案中,将步骤b)的细胞保持在盐溶液中。在一些实施方案中,将步骤b)的细胞保持在中。在一些实施方案中,盐溶液基本上不含血清和/或生长因子。在一些实施方案中,将步骤b)的细胞保持在暗处。
12.在本发明的一些实施方案中,稳定的免疫细胞群体的细胞包含溶瘤病毒。在一些实施方案中,溶瘤病毒为牛痘病毒。在一些实施方案中,牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。在一些实施方案中,牛痘病毒包括病毒胸苷激酶基因中的突变。在一些实施方案中,牛痘病毒包括病毒生长因子(vgf)基因中的突变。在一些实施方案中,溶瘤病毒具有复制能力。在一些实施方案中,牛痘病毒为eev病毒。
13.在一些方面,本发明提供一种制造稳定的免疫细胞群体的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞和/或自然杀伤(nk)细胞和/或t细胞的条件下在约37℃培养免疫细胞;b)使细胞与溶瘤病毒接触;和c)从培养物移出细胞且将细胞保持在约2℃至室温长达约120小时。在一些方面,本发明提供一种制造稳定的免疫细胞群体的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞和/或自然杀伤(nk)细胞和/或t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出细胞且将细胞保持在约2℃至室温约12小时至约36小时;c)使细胞与溶瘤病毒接触;和d)将细胞保持在室温约12小时至约36小时。在一些实施方案中,将步骤b)的细胞保持在约2℃至约室温约24小时。
14.在本发明的一些实施方案中,稳定的免疫细胞群体的细胞包含溶瘤病毒。在一些实施方案中,溶瘤病毒为牛痘病毒。在一些实施方案中,牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。在一些实施方案中,牛痘病毒包括病毒胸苷激酶基因中的突变。在一些实施方案中,牛痘病毒包括病毒生长因子(vgf)基因中的突变。在一些实施方案中,溶瘤病毒具有复制能力。在一些实施方案中,牛痘病毒为eev病毒。在一些实施方案中,以约0.1的感染复数(moi)至约10的moi,用溶瘤病毒感染细胞。
15.在本发明的一些实施方案中,稳定的免疫细胞群体包括细胞因子-诱导的杀伤(cik)细胞。在一些实施方案中,cik细胞为cd3+/cd56+细胞。在一些实施方案中,保持或提高群体中的cik细胞的百分比。在一些实施方案中,稳定的免疫细胞群体包括cd3+/cd56+细胞。在一些实施方案中,保持或提高群体中的cd3+/cd56+细胞的百分比。在一些实施方案中,稳定的免疫细胞群体包括nkg2d+细胞。在一些实施方案中,保持或提高群体中的nkg2d+
细胞的百分比。在一些实施方案中,保持或提高cd3+/cd56+/nkg2d+细胞的百分比。在一些实施方案中,稳定的免疫细胞群体的存活率大于约70%。在一些实施方案中,通过台盼蓝拒染法或通过流式细胞术测量细胞的存活率。
16.在本发明的一些实施方案中,免疫细胞衍生自外周血单核细胞(pbmc)。在一些实施方案中,在约1升至约10升的培养基中培养步骤a)的免疫细胞。在一些实施方案中,在约1升或约5升的培养基中培养步骤a)的免疫细胞。在一些实施方案中,培养步骤a)的免疫细胞约7天、约14天、约28天、约32天、约36天或约40天。
17.在本发明的一些实施方案中,将细胞保持在室温。在一些实施方案中,室温为约22℃。在一些实施方案中,将细胞保持在约2℃至约8℃(例如约4℃)。在一些实施方案中,将细胞保持在袋中。在一些实施方案中,袋为塑料袋。在一些实施方案中,袋为不透气的。在一些实施方案中,将细胞保持在《1%co2中。在一些实施方案中,将细胞保持在盐溶液中。在一些实施方案中,将细胞保持在中。在一些实施方案中,盐溶液基本上不含血清和/或生长因子。在一些实施方案中,将细胞保持在暗处。
18.在本发明的一些实施方案中,稳定的免疫细胞群体的细胞包含溶瘤病毒。在一些实施方案中,溶瘤病毒为牛痘病毒。在一些实施方案中,牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。在一些实施方案中,牛痘病毒包括病毒胸苷激酶基因中的突变。在一些实施方案中,牛痘病毒包括病毒生长因子(vgf)基因中的突变。在一些实施方案中,溶瘤病毒具有复制能力。在一些实施方案中,牛痘病毒为eev病毒。在一些实施方案中,以约0.01的感染复数(moi)至约10的moi,用溶瘤病毒感染细胞。
19.在一些方面,本发明提供一种提高治疗性免疫细胞的功效的方法,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和/或t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出细胞且将细胞保持在约2℃至室温达约120小时以产生提高的免疫细胞。在一些方面,本发明提供一种提高治疗性免疫细胞的功效的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养外周血单核细胞(pbmc);b)使细胞与溶瘤病毒接触;和c)从培养物移出细胞且将细胞保持在约2℃至室温达约120小时以产生提高的免疫细胞。在一些方面,本发明提供一种提高治疗性免疫细胞的功效的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养外周血单核细胞(pbmc);b)从培养物移出细胞且将细胞保持在约2℃至室温达约12-36小时;c)使细胞与溶瘤病毒接触;和d)从培养物移出细胞且将细胞保持在约2℃至室温达约12-36小时以产生提高的免疫细胞。在一些实施方案中,将步骤b)或步骤d)的细胞保持在约2℃至约8℃(例如约4℃)达约120小时。
20.在提高治疗性免疫细胞的功效的方法的一些实施方案中,溶瘤病毒为牛痘病毒。在一些实施方案中,溶瘤病毒为牛痘病毒。在一些实施方案中,牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。在一些实施方案中,牛痘病毒包括病毒胸苷激酶基因中的突变。在一些实施方案中,牛痘病毒包括病毒生长因子(vgf)基因中的突变。在一些实施方案中,溶瘤病毒具有复制能力。在一些实施方案中,牛痘病毒为eev病毒。在一些实施方案中,以约0.1的感染复数(moi)至约10的moi,用溶瘤病毒感染细胞。
21.在提高治疗性免疫细胞的功效的方法的一些实施方案中,稳定的免疫细胞群体包括细胞因子-诱导的杀伤(cik)细胞。在一些实施方案中,cik细胞为cd3+/cd56+细胞。在一些实施方案中,保持或提高群体中的cik细胞的百分比。在一些实施方案中,稳定的免疫细胞群体包括cd3+/cd56+细胞。在一些实施方案中,保持或提高群体中的cd3+/cd56+细胞的百分比。在一些实施方案中,稳定的免疫细胞群体包括nkg2d+细胞。在一些实施方案中,保持或提高群体中的nkg2d+细胞的百分比。在一些实施方案中,保持或提高cd3+/cd56+/nkg2d+细胞的百分比。在一些实施方案中,稳定的免疫细胞群体的存活率大于约70%。在一些实施方案中,通过台盼蓝拒染法或通过流式细胞术测量细胞的存活率。
22.在提高治疗性免疫细胞的功效的方法的一些实施方案中,免疫细胞衍生自外周血单核细胞(pbmc)。在一些实施方案中,在约1升至约10升的培养基中培养步骤a)的免疫细胞。在一些实施方案中,在约1升或约5升的培养基中培养步骤a)的免疫细胞。在一些实施方案中,培养步骤a)的免疫细胞约7天、约14天、约28天、约32天、约36天或约40天。
23.在提高治疗性免疫细胞的功效的方法的一些实施方案中,将细胞保持在室温。在一些实施方案中,室温为约22℃。在一些实施方案中,将细胞保持在约2℃至约8℃(例如约4℃)。在一些实施方案中,将步骤b)的细胞保持在袋中。在一些实施方案中,袋为塑料袋。在一些实施方案中,袋为不透气的。在一些实施方案中,将细胞保持在《1%co2中。在一些实施方案中,将细胞保持在盐溶液中。在一些实施方案中,将细胞保持在中。在一些实施方案中,盐溶液基本上不含血清和/或生长因子。在一些实施方案中,将细胞保持在暗处。
24.在一些方面,本发明提供一种稳定的免疫细胞的组合物,其是通过本文所述的方法制备的。在一些实施方案中,组合物包含一或多种药学上接受的赋形剂。
25.在一些方面,本发明提供一种治疗个体的癌症的方法,所述方法包括向个体施用有效量的包含溶瘤病毒的稳定的免疫细胞群体,其中稳定的免疫细胞群体通过包括以下的方法制备:a)在选择及提高自然杀伤t(nkt)细胞、和/或自然杀伤(nk)细胞和/或t细胞的条件下在约37℃培养免疫细胞;b)使细胞与溶瘤病毒接触;和c)从培养物移出细胞且将细胞保持在约2℃至室温达约120小时。在一些方面,本发明提供一种治疗个体的癌症的方法,所述方法包括向个体施用有效量的包含溶瘤病毒的稳定的免疫细胞群体,其中稳定的免疫细胞群体通过包括以下的方法制备:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出细胞且将细胞保持在约2℃至约室温约12小时至约120小时;c)使细胞与溶瘤病毒接触;和d)从培养物移出细胞且将细胞保持在约2℃至室温(例如约4℃)达约120小时。在一些实施方案中,溶瘤病毒保留在免疫细胞中直至免疫细胞与个体的肿瘤相互作用。在一些实施方案中,在溶瘤病毒的隐蔽期期间向个体施用稳定的免疫细胞群体。在一些实施方案中,免疫细胞为自体细胞。在一些实施方案中,免疫细胞为同种异体细胞。在一些实施方案中,通过血管内、皮下、腹膜内或肿瘤内注射施用稳定的免疫细胞群体。在一些实施方案中,将步骤b)的细胞保持在约2℃至约室温约24小时。
26.在治疗方法的一些实施方案中,溶瘤病毒为牛痘病毒。在一些实施方案中,牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。在一些实施方案
中,牛痘病毒包括病毒胸苷激酶基因中的突变。在一些实施方案中,牛痘病毒包括病毒生长因子(vgf)基因中的突变。在一些实施方案中,溶瘤病毒具有复制能力。在一些实施方案中,牛痘病毒为eev病毒。在一些实施方案中,以约0.1的感染复数(moi)至约10的moi,用溶瘤病毒感染细胞。
27.在治疗方法的一些实施方案中,稳定的免疫细胞群体包括细胞因子-诱导的杀伤(cik)细胞。在一些实施方案中,cik细胞为cd3+/cd56+细胞。在一些实施方案中,保持或提高群体中的cik细胞的百分比。在一些实施方案中,稳定的免疫细胞群体包括cd3+/cd56+细胞。在一些实施方案中,保持或提高群体中的cd3+/cd56+细胞的百分比。在一些实施方案中,稳定的免疫细胞群体包括nkg2d+细胞。在一些实施方案中,保持或提高群体中的nkg2d+细胞的百分比。在一些实施方案中,保持或提高cd3+/cd56+/nkg2d+细胞的百分比。在一些实施方案中,稳定的免疫细胞群体的存活率大于约70%。在一些实施方案中,通过台盼蓝拒染法或通过流式细胞术测量细胞的存活率。
28.在治疗方法的一些实施方案中,将细胞保持在室温。在一些实施方案中,室温为约22℃。在一些实施方案中,将细胞保持在约2℃至约8℃(例如约4℃)。在一些实施方案中,将细胞保持在袋中。在一些实施方案中,袋为塑料袋。在一些实施方案中,袋为不透气的。在一些实施方案中,将细胞保持在《1%co2中。在一些实施方案中,将细胞保持在盐溶液中。在一些实施方案中,将细胞保持在中。在一些实施方案中,盐溶液基本上不含血清和/或生长因子。在一些实施方案中,将细胞保持在暗处。
附图说明
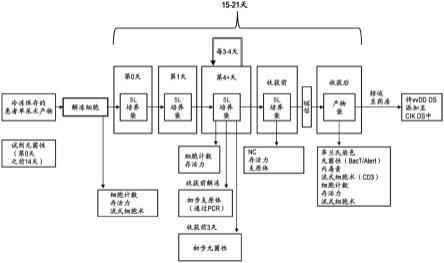
29.图1显示制备方法计划。
30.图2为显示在室温的cik细胞物质保持研究的图。储存在室温的细胞的台盼蓝存活率(圆形)、sytox蓝流式细胞术存活率(菱形)和活细胞密度(方形)。
31.图3为显示在37℃的cik细胞物质保持研究的图。储存在37℃的细胞的台盼蓝存活率(圆形)、sytox蓝流式细胞术存活率(菱形)和活细胞密度(方形)。
32.图4为显示在室温的cik细胞物质保持研究的图。通过台盼蓝染色和血球计计数测量存活率。
33.图5为显示在室温的cik细胞物质保持研究的图。通过流式细胞术测量存活率。
34.图6为显示在37℃的cik细胞物质保持研究的图。
35.图7为显示在室温的cik细胞物质保持研究的图。用低剂量的vvdd感染细胞。通过台盼蓝染色测量存活率。
36.图8为显示在室温的cik细胞物质保持研究的图。用高剂量的vvdd感染细胞。通过台盼蓝染色测量存活率。
37.图9为显示在37℃的cik细胞物质保持研究的图。用高剂量的vvdd感染细胞。通过流式细胞术测量存活率。
38.图10为显示在不透气袋中装运过夜后,在37℃孵育0和24小时时cd107a表面标记的存在呈阳性的cik细胞物质的百分比的图。脱粒标记(cd107a)评估为细胞毒性的标记。
39.图11a至图11c为显示在20天内在培养袋中的细胞生长的图。图11a显示细胞浓度。
图11b显示存活率%。图11c显示细胞总数。
40.图12a至图12c为显示在20天内培养袋中的呈cd3+细胞(图12a)、cd3+/cd56+细胞(cik细胞;图12b)和cd3-/cd56+细胞(nk细胞;图12c)的细胞的百分比的图。
41.图13a至图13d为显示在20天内培养袋中的各种细胞类型中的cd314+细胞的百分比的图。图13a为显示所有淋巴中的cd314+细胞的百分比的图。图13b为显示cd3+/cd56-t细胞中的cd314+细胞的百分比的图。图13c为显示cik cd3+/cd56+细胞中的cd314+细胞的百分比的图。图13d为显示cd3-/cd56+nk细胞中的cd314+细胞的百分比的图。
42.图14a和图14b为显示在保持在4℃、室温或37℃期间的细胞的存活率的图。图14a显示直至保持48小时的存活率。图14b显示直至保持115小时的存活率。
43.图15a和图15b为显示在保持在4℃、室温或37℃期间的细胞浓度的图。图15a显示保持直至48小时的细胞浓度。图15b显示保持直至115小时的细胞浓度。
44.图16a至图16d为显示在保持在4℃、室温或37℃115小时后的细胞百分比的图。所监测细胞为cd3+细胞(图16a)、cd3+/cd56+细胞(cik细胞;图16b)、cd3+/cd56-细胞(图16c)和cd3-/cd56+细胞(nk细胞;图16d)。
45.图17a至图17d为显示在115小时内各种细胞类型中的cd314+细胞的百分比的图。图17a为显示所有淋巴细胞中的cd314+细胞的百分比的图。图17b为显示cd3+/cd56-t细胞中的cd314+细胞的百分比的图。图17c为显示cik cd3+/cd56+细胞中的cd314+细胞的百分比的图。图17d为显示cd3-/cd56+nk细胞中的cd314+细胞的百分比的图。
46.图18a和图18b显示在4℃和22℃的cik和crx100袋的百分比存活率(图18a)和细胞浓度(细胞/ml)(图18b)评估。使用tc-20自动细胞计数器进行评估。百分比存活率测定为:(活细胞计数
÷
总细胞计数)
×
100%。
47.图19显示外推总细胞计数。将细胞浓度(图18b)乘以350ml的体积,得到外推总细胞群体。
48.图20a至图20d显示通过流式细胞术,在4℃和22℃温度的cik和crx100的细胞亚群特征。图20a为总cd3+细胞%,图20b为cd3-/cd56+nk细胞%,图20c为cd3+/cd56-t细胞%,且图20d为cd3+/cd56+cik细胞%。
49.图21a至图21d显示通过流式细胞术测量的cd314特征。图21a显示cd3+/cd56-细胞中的cd314+%,图21b显示cd3+t细胞中的cd314+%,图21c显示cd3+/cd56+cik细胞中的cd314+%,且图21d显示cd3-/cd56+nk细胞中的cd314+%。
50.图22a至图22c显示通过流式细胞术细胞亚群分离的总细胞计数。图22a显示总cd3+细胞计数。图22b显示总cd3+/cd56+cik细胞计数。图22c显示总cd314+/cd3+/cd56+细胞计数。
51.图23a和图23b显示如通过对于在4℃(图23a)和22℃(图23b)的vero e6细胞进行噬斑测定(plaque assay)评估,细胞结合病毒(细胞团块)和无细胞病毒(上清液)的病毒脱落概况。
52.图24a和图24b显示crx100和cik细胞对于ovcar-3肿瘤细胞的效力评估。ovcar-3的百分比存活率显示于图24a中。ovcar-3的活细胞计数显示于图24b中。
53.图25显示新鲜洗涤的和保持在4℃120小时以及保持在22℃120小时的crx100的效力比较。
54.图26为表明来自人类患者单采术(apheresis)产物的gmp设施内配制的crx100和cik细胞对于ovcar-3肿瘤细胞的效力的图。利用所杀伤肿瘤细胞的百分比显示效力。crx100和cik细胞的e:t比率描述效应细胞与肿瘤细胞的比率。vvdd的e:t比率描述病毒pfu与靶细胞的比率。
55.图27为表明来自人类患者单采术产物的gmp设施内配制的crx100和cik细胞对于ovcar-3细胞的效力的图。利用所杀伤肿瘤细胞的百分比显示效力。cik细胞的e:t比率(上轴)描述效应细胞与肿瘤细胞的比率。vvdd与crx100的e:t比率描述病毒pfu与靶细胞的比率。crx100中的vvdd pfu测定为moi、细胞计数和细胞结合病毒的百分比的乘积,如通过噬斑测定所测定(75%)。
56.图28为表明保持在中的不同温度(37℃、22℃和4℃)的crx100细胞的细胞结合病毒效价概况的图。
57.图29为表明保持在中的不同温度(37℃、22℃和4℃)的crx100细胞的无细胞病毒效价概况的图。
具体实施方式
58.本发明提供延长已用溶瘤病毒预感染的免疫细胞的存活期的方法。在一些实施方案中,效应细胞为t细胞但可包括其他亚群,包括但不限于nk细胞和nkt细胞。免疫细胞用溶瘤病毒感染且储存于不透气的袋中且储存在暗处在环境室温(22℃
±
5℃)或在2-8℃。所关注的溶瘤病毒可为复制选择性的病毒或倾向性修饰(tropism-modified)的病毒,其仅能够完成在转化细胞中成功感染。相较于储存在37℃的细胞,在储存在室温2-8℃之前预感染免疫细胞或在储存在室温或2-8℃24小时之后预感染免疫细胞引起扩增免疫细胞的持续存活和更高百分比的活cd3+/cd56+t细胞。
59.用溶瘤病毒预感染免疫细胞(具体地是cd3+/cd56+cik细胞)和在室温(22℃
±
5℃)或在2-8℃延长储存,引起nkg2d(cd314)上调,这增加其与肿瘤细胞结合且裂解肿瘤细胞的能力。在在室温(22℃
±
5℃)下储存在不透气的袋中后,观察到扩增的免疫细胞群具有更高的cd314+细胞百分比。
60.在一些方面,本发明提供制造稳定的免疫细胞群体的方法,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和/或t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出细胞且将细胞保持在室温或2-8℃达约72小时,从而产生稳定的免疫细胞群体。在一些方面,本发明提供一种制造稳定的免疫细胞群体的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养外周血单核细胞(pbmc);b)使细胞与溶瘤病毒接触;和c)从培养物移出细胞且将细胞保持在室温达约72小时。在一些方面,本发明提供一种制造稳定的免疫细胞群体的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养外周血单核细胞(pbmc);b)从培养物移出细胞且将细胞保持在室温或2-8℃约24小时;c)使细胞与溶瘤病毒接触;和d)将细胞保持在室温或2-8℃达约24-48小时。在一些实施方案中,溶瘤病毒为牛痘病毒。在一些实施方案中,牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的
突变。
61.在一些方面,本发明提供一种提高治疗性免疫细胞的功效的方法,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和/或t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出细胞且将细胞保持在室温或2-8℃达约72小时。在一些方面,本发明提供一种提高治疗性免疫细胞的功效的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞及t细胞的条件下在约37℃培养外周血单核细胞(pbmc);b)使细胞与溶瘤病毒接触;和c)从培养物移出细胞且将细胞保持在室温达约72小时。在一些方面,本发明提供一种提高治疗性免疫细胞的功效的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养外周血单核细胞(pbmc);b)从培养物移出细胞且将细胞保持在室温或2-8℃约24小时;c)使细胞与溶瘤病毒接触;和d)将细胞保持在室温或2-8℃达约24-48小时。在一些实施方案中,溶瘤病毒为牛痘病毒。在一些实施方案中,牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。
62.除非另外指明,否则本发明的实施将采用本领域技术范围内的分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术。此类技术在诸如以下的文献中充分阐述:“molecular cloning:a laboratory manual”,第二版(sambrook等人,1989);“oligonucleotide synthesis”(m.j.gait编,1984);“animal cell culture”(r.i.freshney编,1987);“methods in enzymology”(academic press,inc.);“handbook of experimental immunology”(d.m.weir和c.c.blackwell编);“gene transfer vectors for mammalian cells”(j.m.miller和m.p.calos编,1987);“current protocols in molecular biology”(f.m.ausubel等人编,1987);“pcr:the polymerase chain reaction”,(mullis等人编,1994);和“current protocols in immunology”(j.e.coligan等人编,1991)。
63.可以理解的是,本文所述的本发明的方面和实施方案包括“由方面和实施方案组成”和/或“基本上由方面和实施方案组成”。除非另外指明,否则如本文所用,单数形式“一个/一种”和“该/所述”包括复数个参考。
64.在本技术中,除非明确地说明或本领域技术人员理解,否则“或”的使用是指“和/或”。在多项从属权利要求的上下文中,“或”的使用是指引用超过一个在先独立权利要求或从属权利要求。
65.如本领域技术人员所理解的,本文中提到“约”值或参数包括(并描述)针对所述值或参数本身的实施方案。例如,提到“约x”的描述包括“x”的描述。
66.如本文所用,“靶细胞”为病毒在其中复制的肿瘤细胞。通常,靶细胞为哺乳动物细胞,例如人类细胞。
[0067]“宿主细胞”包括可以是或已经是本发明的任何病毒和/或病毒载体的接受体的个体细胞或细胞培养物。宿主细胞包括单个宿主细胞的后代,且后代可归因于自然、偶发或故意突变和/或变化而未必与初始亲本细胞完全一致(在形态或全部dna互补序列方面)。宿主细胞包括用本发明的多核苷酸和/或载体体内转染或感染的细胞。
[0068]
术语“基因”在本领域中是众所周知的且为编码多肽的多核苷酸。除多肽编码区以外,基因包括在编码区段上游和下游的非编码区,包括但不限于内含子、转录但非翻译区段
和调节元件。
[0069]“复制”和“繁殖”可互换地使用且指病毒再生或增殖的能力。此术语在本领域中众所周知。为了本发明的目的,复制涉及产生病毒蛋白且通常涉及病毒基因组的复制。可使用本领域中和本文所述的分析标准(诸如爆发分析(burst assay)或噬斑测定)来测量复制。“复制”和“繁殖”包括直接地或间接地参与病毒制备过程的任何活动,包括但不限于病毒基因表达;产生病毒蛋白、核酸或其他组分;将病毒组分包装为完整病毒;和细胞裂解。
[0070]
术语“核酸分子”、“核酸”和“多核苷酸”可互换使用,是指核苷酸聚合物。此类核苷酸聚合物可含有天然和/或非天然核苷酸且包括但不限于dna、rna和pna。“核酸序列”是指构成核酸分子或多核苷酸的核苷酸的线性序列。
[0071]
术语“多肽”和“蛋白质”可互换使用以指氨基酸残基的聚合物,且不限于最小长度。此类氨基酸残基的聚合物可含有天然或非天然氨基酸残基,包括但不限于氨基酸残基构成的肽、寡肽、二聚体、三聚体和多聚体。全长蛋白与其片段皆包含于所述定义中。术语也包括多肽的表达后修饰,例如糖基化、唾液酸化、乙酰化、磷酸化等类似修饰。此外,出于本发明的目的,“多肽”是指包括对天然序列的修饰(诸如缺失、添加和取代(一般为保守性质))的蛋白,只要所述蛋白保持所需活性即可。这些修饰可为有意的,如通过定点诱变进行;或可为偶然的,诸如通过产生蛋白的宿主的突变或由于pcr扩增所引起的错误引起。
[0072]
如本文所用,“细胞毒性”是本领域中众所周知的术语,是指其中扰乱一种或多种细胞的常见生物化学或生物学功能的状态。这些活动包括但不限于代谢、细胞复制、dna复制、转录、翻译和分子摄取。“细胞毒性”包括细胞死亡和/或细胞裂解。指示细胞毒性的分析为本领域已知的,诸如染料拒染法、3h-胸苷吸收法和噬斑测定法。如本文所用,术语“选择性细胞毒性”是指与病毒对非允许细胞的细胞毒性相比,病毒对靶细胞的细胞毒性。此类细胞毒性可例如通过以下测量:噬斑测定、包括靶细胞的肿瘤的大小的减小或稳定化或肿瘤细胞的标记特征或组织特异性标记(例如癌症标记,诸如前列腺特异性抗原)的血清含量的降低或稳定化。
[0073]“生物样本”涵盖获自个体的多种样本类型且可用于诊断或监测分析。所述定义涵盖血液和生物来源的其他液体样本;固体组织样本,诸如活检标本或组织培养物或源自其的细胞,及其后代。所述定义也包括在获取后以任何方式处理的样本,诸如通过试剂处理、溶解、或对某些组分(诸如蛋白质或多核苷酸)富集。术语“生物样本”涵盖临床样本且也包括培养中的细胞、细胞上清液、细胞裂解物、血清、血浆、生物体液和组织样本。
[0074]
术语“个体”或“受试者”在本文中可互换地用于指动物,例如哺乳动物。在一些实施方案中,提供治疗哺乳动物的方法,所述哺乳动物包括但不限于人类、啮齿动物、猿猴、猫科动物、犬科动物、马科动物、牛科动物、猪科动物、绵羊、山羊、哺乳类实验室动物、哺乳类农畜、哺乳类运动动物和哺乳类宠物。在一些实施例中,“个体”或“受试者”是指需要治疗疾病或障碍的个体或受试者。
[0075]
如本文所用,“疾病”或“障碍”是指其中需要治疗的病症。
[0076]
如本文所用,“癌症”和“肿瘤”是可互换的术语,意指动物体内的任何异常细胞或组织生长或增殖。如本文所用,术语“癌症”和“肿瘤”涵盖实体癌症和血液/淋巴癌且也涵盖恶性、恶性前期和良性生长,诸如发育异常。癌症的实施例包括但不限于上皮癌、淋巴瘤、母细胞瘤、肉瘤和白血病。
[0077]
如本文所用,“治疗”为用于获得有益或所需临床结果的方法。如本文所用的“治疗”涵盖对于包括人类在内的哺乳动物的疾病进行的任何给药或施用治疗方案。出于本发明的目的,有益或期望的临床结果包括但不限于以下中的任一种或多种:减轻一种或多种症状;减轻疾病程度;预防或延缓疾病扩散(例如癌转移,例如癌转移至肺或至淋巴结);预防或延缓疾病复发;延缓或减缓疾病进展;改善疾病病况;抑制疾病或疾病的进展;抑制或减缓疾病或其进展;阻止其发展;和缓解(无论为部分的或为完全的)。“治疗”也涵盖增殖性疾病的病理后果减轻。本发明的方法考虑了这些治疗方面的任一种或多种。
[0078]
在癌症方面,术语“治疗”包括以下任一种或全部:抑制癌细胞生长、抑制癌细胞复制、减轻整体肿瘤负荷和改善与疾病相关的一种或多种症状。
[0079]
药剂的“有效量”是指在所需剂量和时间段内有效达到所需治疗或预防结果的量。
[0080]
本发明的物质/分子(激动剂或拮抗剂)的“治疗有效量”可根据诸如以下的因素而变化:个体的疾病状态、年龄、性别和体重,和物质/分子(激动剂或拮抗剂)在个体中引起所期望反应的能力。治疗有效量还是治疗的有益作用超过所述物质/分子(激动剂或拮抗剂)的任何有毒或有害作用的量。治疗有效量可经一次或多次施用来递送。
[0081]“预防有效量”是指在所需剂量和时间段内有效达到所需预防结果的量。通常但不一定,由于受试者在疾病之前或疾病早期使用预防剂量,因此预防有效量将小于治疗有效量。
[0082]
术语“药物制剂”和“药物组合物”是指所呈形式允许活性成分的生物活性有效,且不含对制剂将施用的受试者具有不可接受毒性的其他组分的制剂。此类制剂可为无菌的。
[0083]“药学上可接受的载体”是指本领域常规的无毒固体、半固体或液体填补剂、稀释剂、包封材料、制剂助剂或载体,其与治疗剂一起使用,一起构成向受试者施用的“药物组合物”。药学上可接受的载体在所用剂量和浓度下对接受者无毒且与制剂的其他成分兼容。药学上可接受的载体适于所用的制剂。
[0084]
溶瘤病毒是当与肿瘤细胞接触时能够杀伤这些细胞的病毒。所关注的病毒对于肿瘤细胞而言为复制选择性或倾向性修饰的,且通常经基因修饰以减少在非转化细胞中的复制能力。所关注的病毒包括:腺病毒;单纯疱疹病毒-1型;牛痘病毒;微小病毒;呼肠孤病毒;新城疫病毒;和其类似物。牛痘病毒尤其受关注。
[0085]
如本文所用,“病毒”是指病毒自身或其衍生物。除非另外指明,否则所述术语涵盖所有血清型和亚型以及自然存在的形式与重组形式两者。本发明的病毒载体可呈以下若干形式中的任一种:包括但不限于裸病毒基因组dna;包封于病毒衣壳中的病毒基因组;包装在另一病毒中或病毒样形式中(诸如单纯疱疹病毒和aav);包封在脂质体中;与聚赖氨酸或其他生物相容性聚合物复合;与合成聚阳离子分子复合;与转铁蛋白结合;与化合物(诸如peg)复合以在免疫学上“掩蔽(mask)”分子和/或增加半衰期;或与非病毒蛋白结合。出于本发明的目的,病毒载体在目标肿瘤细胞中具有复制能力的。
[0086]
溶瘤病毒
[0087]
肿瘤选择性复制的机制性途径包括:使用具有固有肿瘤选择性的病毒(例如新城疫病毒(ndv)、呼肠孤病毒、水疱性口炎病毒(vsv)和自主性微小病毒);缺失整个基因(单纯疱疹病毒(hsv)、腺病毒和牛痘病毒)或功能基因区(腺病毒和脊髓灰质炎病毒),所述功能基因区为在正常细胞中有效复制和/或毒性所必需的但在肿瘤细胞中为消耗性的;将肿瘤/
组织特异性启动子工程改造至病毒中以限制癌细胞的复制所必需基因的表达(腺病毒和hsv);和修饰病毒外壳以选择性地靶向摄取至肿瘤细胞(腺病毒和脊髓灰质炎病毒)。
[0088]
本领域已知的特定修饰包括针对肿瘤选择性对病毒进行的修饰,包括在正常细胞而非肿瘤细胞中复制所必需的病毒基因的缺失,例如腺病毒e1b 55kd缺失;hsv-1核糖核苷酸还原酶亚基破坏;腺病毒e1a cr1或cr2缺失;脊髓灰质炎病毒pv1缺失等。肿瘤特异性启动子元件可用于驱动早期病毒基因的表达,例如:在α胎蛋白启动子/增强子控制下的腺病毒e1a;在psa启动子/增强子控制下的腺病毒e1a或e1b;在α胎蛋白启动子/增强子控制下的腺病毒e1a;在白蛋白启动子/增强子控制下的hsv-1icp4等。病毒可经工程改造以在病毒外壳中表达肿瘤选择性受体,例如替代car/整合素与肿瘤靶向配体结合的腺病毒;和其类似物。
[0089]
溶瘤病毒可进一步包括一或多种用于向患者施用的蛋白质的一或多个编码序列。在一些实施方案中,这种蛋白质是对于肿瘤细胞具有细胞毒性或细胞生长抑制的这些蛋白质,例如肿瘤坏死因子(tnf)、白细胞介素-2(il-2)、可用于有效化学治疗方案中的药物,诸如多耐药性蛋白。编码此类活性蛋白成分的dna可获自任何方便的来源,且根据所选择蛋白质而定,可化学上合成、从cdna文库恢复、从基因组dna分离或以本领域已知的方式获得。。
[0090]
所关注的蛋白质包括对待治疗的受试者中对于感染细胞具有预期效果的任何蛋白质。本发明的药物递送系统的优点尤其在蛋白质在靶细胞的细胞质内运作或从被感染或裂解的细胞中释放以诱发对于邻近细胞的细胞毒性或细胞生长抑制效果(旁观者效应)时体现。例如,肿瘤坏死因子(tnf)能够选择性地杀伤肿瘤细胞,但需要通过细胞膜才能发挥其效果。其他蛋白质,诸如核糖体毒素和各种集落刺激因子,也在细胞内发挥作用。
[0091]
应了解,经构造以表达两种基因的病毒可包括具有预防或治疗价值的两种蛋白质,或一个基因可表达一种占主导的可选标记,这将有助于鉴别用两种基因构建体转染的细胞。可选标记的示例应为通过新霉素基因序列的存在赋予细胞对g418的抗性。替代地,第二基因可用于成像目的,例如可表达钠碘转运体(sodium iodide symporter;nis)基因或生长激素抑制素受体基因以便通过递送放射性标记的示踪剂,随后通过pet或spect成像而定位和量化病毒基因表达。
[0092]
编码前述蛋白质的dna在本领域中可以获得,且在必要时可具有接头序列以便于操纵。递送系统的性质决定了可使用基因组和cdna序列两者,因为内含子可在原病毒转染的环境中进行加工。蛋白质药物可在递送病毒粒子中编码以指定所需蛋白质的任何形式,例如活性形式、成熟形式、融合蛋白质、前蛋白或前原蛋白。
[0093]
对于本发明的方法而言,牛痘病毒尤其受关注。野生型牛痘病毒在肿瘤内和膀胱内治疗后均具有良好耐受性,且表达肿瘤相关抗原或促炎症细胞因子的牛痘病毒在使用皮下、皮内或肿瘤内接种的多种i期试验中具有良好耐受性。牛痘,不同于建议用于病毒治疗的大部分病毒,具有一些已证实的系统性递送潜力的优点。然而,由于病毒能够感染许多不同细胞类型,所以仅一小部分的用于病毒治疗的任何病毒株的接种物可到达肿瘤。因此,开发将病毒递送至肿瘤靶点的有效方法为开发有效疗法所必需的。
[0094]
在本发明的一个实施方案中,溶瘤病毒为牛痘病毒。所有所测试的牛痘病毒株(包括野生型病毒株)在免疫细胞中显示异常的复制动力学,其中存在初始延长的缓慢复制隐蔽期,随后快速的复制爆发。隐蔽期为在感染后至少约1天(通常至少约2天)且不大于约4天
(通常不大于约3天)。
[0095]
多种牛痘病毒株已显示在cik细胞中呈现隐蔽期且可在本发明的方法中使用。单独或携带tk、vgf或两者基因中的缺失的牛痘病毒株western reserve(wr)呈现隐蔽期,所述隐蔽期在双重缺失的病毒中“增加”。其他牛痘病毒株,包括wyeth和international health department(ihd)也在cik细胞中呈现隐蔽期。另外,wr主链中的各种缺失突变也呈现隐蔽期,值得注意的是增加病毒的eev(胞外带衣壳病毒)形式的产生的缺失和防止胞外ifn结合蛋白的产生的缺失。
[0096]
含有胸苷激酶(tk)基因的缺失的牛痘的复制已显示局限于胸苷激酶的细胞含量升高的细胞,例如分裂细胞和肿瘤细胞。具有tk缺失的牛痘将在效应细胞培养物(其中已通过抗cd3抗体刺激细胞分裂)中和在肿瘤细胞中复制。因此,在一个实施方案中,溶瘤病毒为包括实质上消除从病毒基因组表达的活性tk的基因修饰的牛痘病毒。
[0097]
其缺失不影响或增加隐蔽期的病毒基因包括但不限于tk、vgf、b5r(eev产生);b8r(ifnγ结合蛋白);b18r(i型ifn结合蛋白)。溶瘤病毒可包括基本上消除自病毒基因组表达的以下的基因修饰:活性病毒生长因子(vgf);b5r(eev产生);b8r(ifnγ结合蛋白);或b18r(i型ifn结合蛋白)。例如,vgf基因产物在受感染细胞分泌之后通过与生长因子受体相互作用而促进细胞生长。vgf缺失已显示将病毒复制限于具有ras/mapk/erk途径突变的细胞,从而提供另外的肿瘤选择性。在一个实施方案中,溶瘤病毒为包括基本上消除从病毒基因组表达的活性tk和从病毒基因组表达的活性vgf的基因修饰的牛痘病毒。
[0098]
降低如上文所述的所关注的基因的表达的“基因改变”或“突变”是指其中基因的表达显著地降低或其中基因产物呈现非功能性或其作用能力显著地降低的所述基因的任何改变。术语“基因”涵盖编码基因产物的区以及所述基因的调节区,诸如启动子或增强子。此类改变使基因的产物为非功能性的或减少所述基因的表达,使得病毒突变体具有本发明的特性。此外,本发明涵盖具有所关注的一或多个基因中的一或多个突变的突变体。因此,“一个(种)”意指一个(种)或多个(种)。例如,“一个tk基因中的一个突变”是指,可存在一个或多个tk基因中的一个或多个突变。
[0099]
实现这种改变的方式包括破坏基因的产物的表达的任何方法或使所表达的蛋白质呈现为非功能性的任何方法。已知破坏基因的表达的多种方法为已知的,包括基因的编码区或其启动子序列通过插入、缺失和/或碱基变化而产生的改变。(参见roizman和jenkins,science 229:1208(1985))。
[0100]
优选的突变为从基因缺失核酸。用于构建工程改造的病毒和对dna序列的遗传操作的方法在本领域中是已知的。一般而言,这些包括ausubel等人,current protocols in molecular biology(john wiley and sons,inc.)中的第16章;paoletti等人,美国专利第4,603,112号(1986年7月)。病毒学考虑也综述于coen,virology,1990(第2版增刊)raven press,第123-150页中。
[0101]
免疫细胞
[0102]
出于本发明的目的,免疫细胞为具有针对肿瘤细胞的细胞溶解活性的自体或同种异体免疫细胞。效应细胞可具有不需要通过t细胞抗原受体进行识别的细胞溶解活性。备受关注的细胞包括t和/或nk谱系的细胞,例如lak细胞、cik细胞、ctl、til细胞等。效应细胞通常通过将外周血淋巴细胞(pbl)与增加激活的细胞因子和/或抗原组合一起进行体外培养
而获得。在本发明的方法中,激活的效应细胞被病毒感染且将其施用于患者。在培养之前、在施用之前或两者,任选地将细胞与不需要的细胞分开。免疫效应细胞对肿瘤细胞进行细胞介导的细胞溶解被认为是由穿过结合的靶细胞细胞膜的细胞质颗粒的局部定向的胞外分泌介导的。
[0103]
自然杀伤(nk)细胞属于负责在无事先致敏的情况下的细胞毒性的细胞类别的细胞毒性细胞。il-2激活的nk细胞,淋巴因子激活的杀伤(lak)细胞中的主要效应细胞群体,是体外自体和同种异体白血病细胞裂解的有效介质。lak细胞为能够以非mhc限制性方式识别癌细胞的非b、非t细胞。lak细胞,其可由正常或携带肿瘤的宿主产生,似乎显示了一种能够识别且破坏改变的细胞的原始免疫监视系统。nk细胞通常不与患者肿瘤细胞反应,除非其通过干扰素、il-2激活,或除非从效应细胞群体移除抑制因子单核细胞。il-2诱导t淋巴细胞和nk细胞的增殖与ifn-γ的产生;其也引起诱导针对先前nk抗性细胞制剂和细胞系的lak细胞。lak活性可在与il-2一起孵育之后从人类和鼠类t细胞产生。
[0104]
大部分nk活性以及lak活性由cd3-大颗粒淋巴细胞(lgl)细胞群体介导。观察到针对各种肿瘤细胞和病毒感染细胞的这种裂解活性。形态上,nk细胞特征为含有肾形细胞核和细胞质中的显著嗜天青颗粒的lgl细胞。人类lgl共享骨髓单核细胞(例如cd11)和t细胞(例如cd2和cd8)相关标记。然而,大多数人类nk细胞活性是由cd3-、cd56+和cd16+淋巴细胞介导,尽管cd16-nk细胞也已经特征化。cd16c细胞也具有高含量的抗体依赖型细胞毒性(adcc)。cd16-nk细胞表达类似于cd16+nk细胞的标记,包括cd2、cd7、cd11b、cd38、cd45r、cd18和p75 il-2r。lak细胞已在动物和人类中体内使用以治疗黑色素瘤、肾细胞癌、非霍奇金氏淋巴瘤和肺癌与结肠直肠癌。
[0105]
对于自体肿瘤细胞具有反应的细胞毒性t淋巴细胞(ctl)是用于过继免疫疗法的特异性效应细胞。ctl的诱导和扩增是抗原特异性且为受mhc限制的。除il-2外的各种类型的细胞因子也已报告诱导细胞毒性淋巴细胞。具有抗肿瘤活性的一类t淋巴细胞被称为”肿瘤浸润淋巴细胞”(til)。其具有比lak细胞更强效的抗肿瘤活性。其可通过在il-2中培养从肿瘤中获得的单细胞悬浮液来生长。尽管淋巴细胞仅占癌症结节中的小的细胞亚群,但这些淋巴细胞中的一些含有il-2受体且在il-2的影响下生长。尽管肿瘤细胞也在培养物中生长,但能够消除肿瘤细胞的淋巴细胞具有选择性生长优势。在2-3周培养之后,获得没有肿瘤细胞污染的纯的淋巴细胞群体。til细胞的主要效应子在表型上为cd3+cd56-cd8+的且为受mhc限制的。癌症患者已用离体抗-cd3激活的杀伤细胞和il-2处理。
[0106]
细胞因子-诱导的杀伤(cik)细胞是通过在ifn-γ、il-2(或il-12)和针对cd3的单克隆抗体(mab)存在下培养外周血淋巴细胞(pbl)所获得的高效细胞毒性效应细胞,且任选地包括il-la。可在培养物中培养细胞至少约1周、至少约2周、至少约3周或更久,且通常不大于约8周。cik效应细胞的绝对数在这种培养条件下通常增加至少约100倍,且可增加至少约500倍、至少约1000倍或更多。
[0107]
cik细胞具有比lak细胞更高含量的细胞毒性活化和更高的增殖速率。具有最大细胞毒性的细胞的表型表达t细胞标记cd3和nk细胞标记cd56。通过抗原表达cd56与抗肿瘤细胞毒性有关。cd28,tcr的主要共刺激信号,仅存在于cik细胞亚群的细胞表面上。cik细胞分泌il-2、il-6和tnf-α。il-4、il-7和il-12不分泌。这些cd3+cd33+细胞中的大部分共表达cd2、cd5、cd7、cd8和hla-dr,但对于cd4、cd13、cd14、cd15和cd16的表达呈阴性。cd3ccd33c
细胞不具有针对肿瘤细胞的细胞毒性活性。cd3+cd56+细胞在cik细胞培养物中大大扩增。cd3+cd56+细胞的百分比在培养大约1-2个月之后达到平台期。cik细胞培养物中的优势细胞表型表达α-、β-t细胞受体(tcr-α/β)。与nk细胞相比,由cd3+cd56+细胞介导的细胞毒性在不存在激活下也不受mhc限制,但其不为adcc依赖性的,这是由于这些双阳性细胞不表达cd16。形态学上,这些细胞不能与nk细胞区别。
[0108]
cd314在本文中可与nkg2d互换地使用且也称为klrk1、klr和杀伤细胞凝集素样受体k。cd314是属于c型凝集素样受体的cd94/nkg2家族的跨膜蛋白。在人类中,其由nk细胞、γδt细胞、cd8+αβt细胞和cik细胞表达。
[0109]
可使用少至1
×
107个细胞在动物模型中实现cik细胞的强效体内抗肿瘤效果。在人类中,有效剂量通常为至少约108个细胞、至少约109个细胞或至少约10
10
个细胞或更多。在一些实施方案中,有效剂量小于约1
×
107、2
×
107、3
×
107、4
×
107、5
×
107、6
×
107、7
×
107、8
×
107、9
×
107、1
×
108、2
×
108、3
×
108、4
×
108、5
×
108、6
×
108、7
×
108、8
×
108、9
×
108、1
×
109、2
×
109、3
×
109、4
×
109、5
×
109、6
×
109、7
×
109、8
×
109、9
×
109、1
×
10
10
、2
×
10
10
、3
×
10
10
、4
×
10
10
或5
×
10
10
。在一些实施方案中,有效剂量大于约5
×
10
10
。
[0110]
适用于本发明的方法中的免疫细胞在被溶瘤病毒感染后具有“隐蔽”期。已发现,具有此特性的细胞包括但不限于t细胞系和cik细胞,其中牛痘在这些培养细胞中呈现明显的隐蔽期。
[0111]
nkg2蛋白质家族
[0112]
nk、nkt和t细胞呈现裂解自身主要组织相容性复合体(mhc)i类分子的表达降低或其表达能力丧失的细胞的能力。据报告,细胞溶解功能受特异性nk细胞受体的激活和抑制信号的平衡控制。在人类中,这些基因均为具有c型凝集素域的ii型跨膜蛋白。描述了这些分子的两个不同超家族:p50/p58/p70基因,其为免疫球蛋白样(ig样)的,且第二组受体包括nkg2家族。glienke等人(1998)报告nkg2家族的四个紧密相关转录本的序列:nkg2a和nkg2b,其为替代性剪接变体;和nkg2c、nkg2e,且所述四个基因在一个p1衍生的人工染色体(p1-derived artificial chromosome;pac)克隆中的染色体12上密切连锁。nkg2d(cd314)相关但具低序列相似性(glienke j.等人,1998,immunogenetics 48:163-173)。
[0113]
zingoni等人(2018)综述了nk、t和nkt细胞上的激活受体nkg2d和肿瘤细胞和病毒感染细胞上表达而在正常细胞上仅很少地表达的其不同配体的细胞溶解活性。nkg2d配体通过对于不同刺激(但全部均导致细胞表面上的多样化的nkg2d配体(一个至多种类型)集合的表达图谱)的特异性细胞反应而在受损、转化或感染细胞中上调。流行的理论是,多于100个(对于cica)、40个(对于micb)和小于20个(对于ulbp)不同等位基因的这些配体,引起nk和t细胞独特共有的nkg2d受体激活,所述受体介导针对这些压力或感染细胞的溶解活性。配体的此冗余和多样性在宿主和病原体(病毒为主要驱动剂)的共同进化过程中产生,从而产生免疫激活和免疫逃避。因此,不同配体的表达驱动通过受体-配体结合的免疫细胞激活与各种肿瘤免疫逃避策略(具体地是肿瘤免疫逃避)之间的平衡。
[0114]
优势数据的解释为,呈相同配体的等位基因变体形式的可在其针对nkg2d的亲和力方面不同的nkg2d配体多样性的调节nkg2d传导的阈值的能力也可不同。换言之,配体调节受体并促进nk、nkt和t细胞效应功能,尤其mica(zingoni a.等人,2018年3月12日,front.immunol.)。
[0115]
然而,在此报告中,我们已表明,在肿瘤细胞或病毒感染细胞上不存在nkg2d配体的情况下,处于压力下且感染病毒的免疫群体可特异性地上调nkg2d的表达和在存在肿瘤细胞或病毒感染细胞时增加细胞溶解活性。
[0116]
制备方法
[0117]
在一些方面,本发明提供用于制备保持存活力长达或超过72小时的稳定的免疫细胞群体的方法。这些方法可用于例如用于癌症治疗中的治疗性免疫细胞的产生和运送。在一些方面,由本发明的方法制备的细胞群体具有改善的功效;例如,相较于通过其他方法产生的细胞,所述群体中的细胞具有增加的nkg2d表达。
[0118]
本发明的方法包括体外培养免疫细胞、用溶瘤病毒感染免疫细胞、通过将细胞保持在室温下稳定免疫细胞和向患癌症的患者施用受感染细胞。所述治疗旨在减小或消除患者的癌症。也提供稳定的感染溶瘤病毒的免疫细胞的组合物,所述细胞可以培养基形式、适合于向患者递送的等分试样形式和其类似形式提供。
[0119]
免疫细胞通常产生自新鲜或冷冻的造血细胞群体。相对于患者而言,细胞来源可为自体或同种异体的,但通常属于相同物种,例如对于人类患者而言为人类细胞,对于小鼠接受体而言为小鼠细胞等。细胞群体包括但不限于从外周血、脾脏、淋巴结、骨髓、动员的外周血、脐带血等获得的细胞群体。
[0120]
分离的程序可包括但不限于物理分离、磁力分离、使用抗体包被的磁珠、亲和层析、与单克隆抗体结合或与单克隆抗体结合使用的细胞毒剂(包括但不限于补体和细胞毒素)和使用与固体基质连接的抗体“淘选”,例如盘(plate)、淘析或任何其他方便技术。物理分离技术的使用包括但不限于基于以下方面的差异的这些技术:物理性(密度梯度离心和计数器-流式离心淘析)、细胞表面(凝集素和抗体亲和力)和至关重要的染色特性(粒线体结合染料rho123和dna结合染料hoechst 33342)。这些程序为本领域技术人员所熟知。
[0121]
如本文所述培养细胞,随后将其保持在约2℃至室温以提供稳定的活化细胞群体。此类培养物通常降低非所需细胞(例如同种异体反应性t细胞等)的数目。也可通过选择移除非所需细胞。用于植入的所需细胞的分离一般将使用亲和分离。提供准确分离的技术包括荧光活化细胞分选仪,其可具有变化程度的复杂度,诸如多色彩通道、低角度和钝角光散检测通道、阻抗信道等。可通过采用与死细胞相关的染料(碘化丙锭,lds),针对死细胞来选择细胞。可采用不过度地损害所选择细胞的存活力的任何技术。
[0122]
亲和试剂可为细胞表面分子(例如cd8、cd4等)的特异性受体或配体。除抗体试剂以外,可使用肽-mhc抗原和t细胞受体对;肽配体和受体;配体和受体分子;及其类似物。抗体和t细胞受体可为单克隆或多克隆的,且可由转基因动物、免疫动物、永生化人类或动物b细胞、经编码抗体或t细胞受体的dna载体转染的细胞等产生。制备抗体和其用作特异性结合药剂的适用性的细节是本领域技术人员熟知的。
[0123]
将基于所需效应细胞类型而选择特定培养条件。当效应细胞为cik细胞时,例如洗涤细胞且将细胞重悬于培养基(例如rpmi、dme等)中。以有效浓度,例如以约100至约10,000u/ml,通常大约1000u/ml,将干扰素γ添加至培养物中。以有效浓度将对cd3具有特异性的配体(例如单克隆抗cd3抗体)添加至培养物中,例如可以约1至约500ng/ml的浓度使用okt3。以规则间隔,在添加il-2时更换培养基。在一些实施方案中,当cik群体已扩增时获取效应细胞。
[0124]
用细胞溶解病毒感染效应细胞群体。在一些实施方案中,在感染与患者施用之间的时间段中病毒不引起对效应细胞的细胞溶解。如本文中所述,约1天至不大于约4天的隐蔽期提供病毒不引起显著地对效应细胞的细胞溶解的时间窗口。在一些实施方案中,隐蔽期为以下之中的任一个:约1天、约2天、约3天、约4天、约5天、约6天、约7天、约8天、约9天或约10天。在一些实施方案中,隐蔽期为约1天至约10天、约1天至约9天、约1天至约8天、约1天至约7天、约1天至约6天、约1天至约5天、约1天至约4天、约1天至约3天、约1天至约2天、约2天至约10天、约2天至约9天、约2天至约8天、约2天至约7天、约2天至约6天、约2天至约5天、约2天至约4天、约2天至约3天、约3天至约10天、约3天至约9天、约3天至约8天、约3天至约7天、约3天至约6天、约3天至约5天、约3天至约4天、约4天至约10天、约4天至约9天、约4天至约8天、约4天至约7天、约4天至约6天、约4天至约5天、约5天至约10天、约5天至约9天、约5天至约8天、约5天至约7天、约5天至约6天、约6天至约10天、约6天至约9天、约6天至约8天、约6天至约7天、约7天至约10天、约7天至约9天、约7天至约8天、约8天至约10天、约8天至约9天或约9天至约10天。
[0125]
如果作为包装病毒使用,则病毒可在适当的生理学上可接受的载体中进行施用。感染复数(moi)一般将在约0.001至100的范围内。在一些实施方案中,moi为约以下之中的任一个:0.001、0.005、0.01、0.05、0.1、0.5、1.0、5.0、10、50、或100。在一些实施方案中,moi在以下之间:约0.001至约0.01、约0.01至约0.1、约0.1至约1.0、约1.0至约10或约10至约100。可施用病毒一次或多次。在一些实施方案中,施用病毒一次、两次、三次、四次、五次或多于五次。
[0126]
替代地,采用脂质体、本领域熟知的一般转染方法(诸如磷酸钙沉淀和电穿孔)等,病毒dna可用于转染效应细胞。归因于病毒转染的高效率,我们可获得高含量的修饰细胞。
[0127]
在一些实施方案中,本发明提供制造稳定的免疫细胞群体的方法,所述方法包括:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和/或t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出细胞且将细胞保持在约2℃至约室温达约72小时,从而产生稳定的免疫细胞群体。
[0128]
在一些实施方案中,本发明提供制造稳定的免疫细胞群体的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高nkt细胞、nk细胞和t细胞的条件下在约37℃培养免疫细胞;b)使细胞与溶瘤病毒接触;和c)从培养物移出细胞且将细胞保持在约2℃至约室温达约72小时。
[0129]
在一些实施方案中,本发明提供制造稳定的免疫细胞群体的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高nkt细胞、nk细胞和t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出细胞且将细胞保持在约2℃至约室温达约12至约36小时;c)使细胞与溶瘤病毒接触;和d)将细胞保持在约2℃至约室温达约12至约36小时。
[0130]
在一些实施方案中,本发明提供一种制备具有提高的功效的免疫细胞的方法。在一些实施方案中,本发明提供一种提高治疗性免疫细胞的功效的方法,所述方法包括:a)在选择及提高nkt细胞、nk细胞和/或t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出细胞且将细胞保持在约2℃至室温达约72小时。在一些实施方案中,本发明提供一种提高治疗性免疫细胞的功效的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高nkt细胞、nk细胞和t细胞的条件下在约37℃培养外周血单核细胞(pbmc);b)使细胞与溶瘤
病毒接触;和c)从培养物移出细胞且将细胞保持在室温达约72小时。在一些实施方案中,本发明提供一种提高治疗性免疫细胞的功效的方法,其中免疫细胞包含溶瘤病毒,所述方法包括:a)在选择及提高nkt细胞、nk细胞和t细胞的条件下在约37℃培养外周血单核细胞(pbmc);b)从培养物移出细胞且将细胞保持在约2℃至约室温达约12至约36小时;c)使细胞与溶瘤病毒接触;和d)将细胞保持在约2℃至约室温达约12至约36小时。
[0131]
在一些实施方案中,本发明提供制造如上文所述的稳定的免疫细胞群体的方法,从培养物移出细胞且保持在约2℃至室温大于约以下之中的任一个:6、12、18、24、30、36、42、48、54 60、66、72、78、84、90、96、100、120小时或大于120小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:6小时至12小时、6小时至18小时、6小时至24小时、6小时至30小时、6小时至36小时、6小时至42小时、6小时至48小时、6小时至54小时、6小时至60小时、6小时至66小时、6小时至72小时、6小时至78小时、6小时至84小时或6小时至90小时。在一些实施方案中,从培养物移出细胞且保持在室温持续约以下之中的任一个之间:12小时至18小时、12小时至24小时、12小时至30小时、12小时至36小时、12小时至42小时、12小时至48小时、12小时至54小时、12小时至60小时、12小时至66小时、12小时至72小时、12小时至78小时、12小时至84小时或12小时至90小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:18小时至24小时、18小时至30小时、18小时至36小时、18小时至42小时、18小时至48小时、18小时至54小时、18小时至60小时、18小时至66小时、18小时至72小时、18小时至78小时、18小时至84小时或18小时至90小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:24小时至30小时、24小时至36小时、24小时至42小时、24小时至48小时、24小时至54小时、24小时至60小时、24小时至66小时、24小时至72小时、24小时至78小时、24小时至84小时或24小时至90小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:30小时至36小时、30小时至42小时、30小时至48小时、30小时至54小时、30小时至60小时、30小时至66小时、30小时至72小时、30小时至78小时、30小时至84小时或30小时至90小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:36小时至42小时、36小时至48小时、36小时至54小时、36小时至66小时、36小时至66小时、36小时至72小时、36小时至78小时、36小时至84小时或36小时至90小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:42小时至48小时、42小时至54小时、42小时至60小时、42小时至66小时、42小时至72小时、42小时至78小时、42小时至84小时、42小时至90小时或42小时至120小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:48小时至54小时、48小时至60小时、48小时至66小时、48小时至72小时、48小时至78小时、48小时至84小时、48小时至90小时或48小时至120小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:54小时至60小时、54小时至66小时、54小时至72小时、54小时至78小时、54小时至84小时、54小时至90小时或54小时至120小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:60小时至66小时、60小时至72小时、60小时至78小时、60小时至84小时、60小时至90小时或60小时至120小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:66小时至72小时、66小时至78小时、66小时至84小时、66
小时至90小时或66小时至120小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:72小时至78小时、72小时至84小时、72小时至90小时或72小时至120小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温持续约以下之中的任一个之间:78小时至84小时、78小时至90小时或78小时至120小时。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温约84小时至90小时之间。在一些实施方案中,从培养物移出细胞且保持在约2℃至室温约90小时至120小时之间。
[0132]
在本发明的一些实施方案中,在使细胞与病毒接触之前,从培养物移出细胞且保持在约2℃至室温约12小时至约36小时。在本发明的一些实施方案中,在使细胞与病毒接触之前,从培养物移出细胞且保持在约2℃至室温约12小时至约36小时,且然后保持在约2℃至室温约12至约36小时。在一些实施方案中,在使细胞与病毒接触之前,将细胞保持在约2℃至室温持续以下之中的任一个:约12、14、16、18、20、22、24、26、28、30、32、34或36小时。在一些实施方案中,在使细胞与病毒接触之前,将细胞保持在约2℃至室温持续以下时间之间:约12至约36小时、约12至约34小时、约12至约32小时、约12至约30小时、约12至约28小时、约12至约26小时、约12至约24小时、约12至约22小时、约12至约20小时、约12至约18小时、约12至约16小时、约12至约14小时、约14小时至约36小时、约14小时至约34小时、约14小时至约32小时、约14小时至约30小时、约14小时至约28小时、约14小时至约26小时、约14小时至约24小时、约14小时至约22小时、约14小时至约20小时、约14小时至约18小时、约14小时至约16小时、约16至约36小时、约16至约34小时、约16至约32小时、约16至约30小时、约16至约28小时、约16至约26小时、约16至约24小时、约16至约22小时、约16至约20小时、约16至约18小时、约18至约36小时、约18至约34小时、约18至约32小时、约18至约30小时、约18至约28小时、约18至约26小时、约18至约24小时、约18至约22小时、约18至约20小时、约20小时至约36小时、约20小时至约34小时、约20小时至约32小时、约20小时至约30小时、约20小时至约28小时、约20小时至约26小时、约20小时至约24小时、约20小时至约22小时、约22小时至约36小时、约22小时至约34小时、约22小时至约32小时、约22小时至约30小时、约22小时至约28小时、约22小时至约26小时、约22小时至约24小时、约24小时至约36小时、约24小时至约34小时、约24小时至约32小时、约24小时至约30小时、约24小时至约28小时、约24小时至约26小时、约26小时至约36小时、约26小时至约34小时、约26小时至约32小时、约26小时至约30小时、约26小时至约28小时、约28小时至约36小时、约28小时至约34小时、约28小时至约32小时、约28小时至约30小时、约30小时至约36小时、约30小时至约34小时、约30小时至约32小时、约32小时至约36小时、约32小时至约34小时或约34小时至约36小时。在一些实施方案中,在使细胞与病毒接触之后,将细胞保持在约2℃至室温持续以下之中的任一个:约12、14、16、18、20、22、24、26、28、30、32、34或36小时。在一些实施方案中,在使细胞与病毒接触之后,将细胞保持在约2℃至室温持续以下时间之间:约12至约36小时、约12至约34小时、约12至约32小时、约12至约30小时、约12至约28小时、约12至约26小时、约12至约24小时、约12至约22小时、约12至约20小时、约12至约18小时、约12至约16小时、约12至约14小时、约14小时至约36小时、约14小时至约34小时、约14小时至约32小时、约14小时至约30小时、约14小时至约28小时、约14小时至约26小时、约14小时至约24小时、约14小时至约22小时、约14小时至约20小时、约14小时至约18小时、约14小时至约16小时、约16至约36小时、约16至约34小时、约16至约32小时、约16至约30小时、约16至约28小时、约16至约26小时、约16至约24
小时、约16至约22小时、约16至约20小时、约16至约18小时、约18至约36小时、约18至约34小时、约18至约32小时、约18至约30小时、约18至约28小时、约18至约26小时、约18至约24小时、约18至约22小时、约18至约20小时、约20小时至约36小时、约20小时至约34小时、约20小时至约32小时、约20小时至约30小时、约20小时至约28小时、约20小时至约26小时、约20小时至约24小时、约20小时至约22小时、约22小时至约36小时、约22小时至约34小时、约22小时至约32小时、约22小时至约30小时、约22小时至约28小时、约22小时至约26小时、约22小时至约24小时、约24小时至约36小时、约24小时至约34小时、约24小时至约32小时、约24小时至约30小时、约24小时至约28小时、约24小时至约26小时、约26小时至约36小时、约26小时至约34小时、约26小时至约32小时、约26小时至约30小时、约26小时至约28小时、约28小时至约36小时、约28小时至约34小时、约28小时至约32小时、约28小时至约30小时、约30小时至约36小时、约30小时至约34小时、约30小时至约32小时、约32小时至约36小时、约32小时至约34小时或约34小时至约36小时。
[0133]
在一些实施方案中,在培养之后,将细胞保持在约2℃至室温之间。在一些实施方案中,在培养之后,将细胞保持在约2℃至约8℃之间。在一些实施方案中,在培养之后,将细胞保持在约2℃。在一些实施方案中,在培养之后,将细胞保持在约4℃。在一些实施方案中,在培养之后,将细胞保持在以下之中的任一个之间:约2℃至约26℃、约2℃至约24℃、约2℃至约22℃、约2℃至约20℃、约2℃至约18℃、约2℃至约16℃、约2℃至约14℃、约2℃至约12℃、约2℃至约10℃、约2℃至约8℃、约2℃至约6℃、约2℃至约4℃、约4℃至约26℃、约4℃至约24℃、约4℃至约22℃、约4℃至约20℃、约4℃至约18℃、约4℃至约16℃、约4℃至约14℃、约4℃至约12℃、约4℃至约10℃、约4℃至约8℃、约4℃至约6℃、约6℃至约26℃、约6℃至约24℃、约6℃至约22℃、约6℃至约20℃、约6℃至约18℃、约6℃至约16℃、约6℃至约14℃、约6℃至约12℃、约6℃至约10℃、约6℃至约8℃、约8℃至约26℃、约8℃至约24℃、约8℃至约22℃、约8℃至约20℃、约8℃至约18℃、约8℃至约16℃、约8℃至约14℃、约8℃至约12℃、约8℃至约10℃、约10℃至约26℃、约10℃至约24℃、约10℃至约22℃、约10℃至约20℃、约10℃至约18℃、约10℃至约16℃、约10℃至约14℃、约10℃至约12℃、约12℃至约26℃、约12℃至约24℃、约12℃至约22℃、约12℃至约20℃、约12℃至约18℃、约12℃至约16℃、约12℃至约14℃、约14℃至约26℃、约14℃至约24℃、约14℃至约22℃、约14℃至约20℃、约14℃至约18℃、约14℃至约16℃、约16℃至约26℃、约16℃至约24℃、约16℃至约22℃、约16℃至约20℃、约16℃至约18℃、约18℃至约26℃、约18℃至约24℃、约18℃至约22℃、约18℃至约20℃、约20℃至约26℃、约20℃至约24℃、约20℃至约22℃、约22℃至约26℃、约22℃至约24℃或约24℃至约26℃。
[0134]
在一些实施方案中,在培养之后和在病毒感染之前,将细胞保持在约2℃至室温之间。在一些实施方案中,在培养之后和在病毒感染之前,将细胞保持在约2℃至约8℃之间。在一些实施方案中,在培养之后和在病毒感染之前,将细胞保持在约2℃。在一些实施方案中,在培养之后和在病毒感染之前,将细胞保持在约4℃。在一些实施方案中,在培养之后和在病毒感染之前,将细胞保持在以下之中的任一个之间:约2℃至约26℃、约2℃至约24℃、约2℃至约22℃、约2℃至约20℃、约2℃至约18℃、约2℃至约16℃、约2℃至约14℃、约2℃至约12℃、约2℃至约10℃、约2℃至约8℃、约2℃至约6℃、约2℃至约4℃、约4℃至约26℃、约4℃至约24℃、约4℃至约22℃、约4℃至约20℃、约4℃至约18℃、约4℃至约16℃、约4℃至约
14℃、约4℃至约12℃、约4℃至约10℃、约4℃至约8℃、约4℃至约6℃、约6℃至约26℃、约6℃至约24℃、约6℃至约22℃、约6℃至约20℃、约6℃至约18℃、约6℃至约16℃、约6℃至约14℃、约6℃至约12℃、约6℃至约10℃、约6℃至约8℃、约8℃至约26℃、约8℃至约24℃、约8℃至约22℃、约8℃至约20℃、约8℃至约18℃、约8℃至约16℃、约8℃至约14℃、约8℃至约12℃、约8℃至约10℃、约10℃至约26℃、约10℃至约24℃、约10℃至约22℃、约10℃至约20℃、约10℃至约18℃、约10℃至约16℃、约10℃至约14℃、约10℃至约12℃、约12℃至约26℃、约12℃至约24℃、约12℃至约22℃、约12℃至约20℃、约12℃至约18℃、约12℃至约16℃、约12℃至约14℃、约14℃至约26℃、约14℃至约24℃、约14℃至约22℃、约14℃至约20℃、约14℃至约18℃、约14℃至约16℃、约16℃至约26℃、约16℃至约24℃、约16℃至约22℃、约16℃至约20℃、约16℃至约18℃、约18℃至约26℃、约18℃至约24℃、约18℃至约22℃、约18℃至约20℃、约20℃至约26℃、约20℃至约24℃、约20℃至约22℃、约22℃至约26℃、约22℃至约24℃或约24℃至约26℃。
[0135]
在一些实施方案中,在病毒感染之后,将细胞保持在约2℃至室温之间。在一些实施方案中,在病毒感染之后,将细胞保持在约2℃至约8℃之间。在一些实施方案中,在病毒感染之后,将细胞保持在约2℃。在一些实施方案中,在病毒感染之后,将细胞保持在约2℃。在一些实施方案中,在病毒感染之后,将细胞保持在以下之中的任一个之间:约4℃至约26℃、约2℃至约24℃、约2℃至约22℃、约2℃至约20℃、约2℃至约18℃、约2℃至约16℃、约2℃至约14℃、约2℃至约12℃、约2℃至约10℃、约2℃至约8℃、约2℃至约6℃、约2℃至约4℃、约4℃至约26℃、约4℃至约24℃、约4℃至约22℃、约4℃至约20℃、约4℃至约18℃、约4℃至约16℃、约4℃至约14℃、约4℃至约12℃、约4℃至约10℃、约4℃至约8℃、约4℃至约6℃、约6℃至约26℃、约6℃至约24℃、约6℃至约22℃、约6℃至约20℃、约6℃至约18℃、约6℃至约16℃、约6℃至约14℃、约6℃至约12℃、约6℃至约10℃、约6℃至约8℃、约8℃至约26℃、约8℃至约24℃、约8℃至约22℃、约8℃至约20℃、约8℃至约18℃、约8℃至约16℃、约8℃至约14℃、约8℃至约12℃、约8℃至约10℃、约10℃至约26℃、约10℃至约24℃、约10℃至约22℃、约10℃至约20℃、约10℃至约18℃、约10℃至约16℃、约10℃至约14℃、约10℃至约12℃、约12℃至约26℃、约12℃至约24℃、约12℃至约22℃、约12℃至约20℃、约12℃至约18℃、约12℃至约16℃、约12℃至约14℃、约14℃至约26℃、约14℃至约24℃、约14℃至约22℃、约14℃至约20℃、约14℃至约18℃、约14℃至约16℃、约16℃至约26℃、约16℃至约24℃、约16℃至约22℃、约16℃至约20℃、约16℃至约18℃、约18℃至约26℃、约18℃至约24℃、约18℃至约22℃、约18℃至约20℃、约20℃至约26℃、约20℃至约24℃、约20℃至约22℃、约22℃至约26℃、约22℃至约24℃或约24℃至约26℃。
[0136]
在一些实施方案中,在病毒感染之前,将细胞保持在相同温度。在一些实施方案中,在病毒感染之前和在病毒感染之后,将细胞保持在不同温度。在一些实施方案中,在病毒感染之前,将细胞保持在约2℃至约8℃;且在病毒感染之后,将细胞保持在室温。在一些实施方案中,在病毒感染之前,将细胞保持在约4℃;且在病毒感染之后,将细胞保持在室温。在一些实施方案中,在病毒感染之前,将细胞保持在室温;且在病毒感染之后,将细胞保持在约2℃至约8℃。在一些实施方案中,在病毒感染之前,将细胞保持在室温;且在病毒感染之后,将细胞保持在约4℃。
[0137]
在一些实施方案中,稳定的免疫细胞群体包括细胞因子-诱导的杀伤(cik)细胞。
在一些实施方案中,cik细胞为cd3+/cd56+细胞。在一些实施方案中,在约2℃至室温的保持期间,保持或提高群体中的cik细胞的百分比。在一些实施方案中,群体中的cik细胞的百分比增加了约以下之中的任一个:5%、10%、15%、20%、25%、30%、35%、40%、45%或50%,或其间的任何值。在一些实施方案中,群体中的cik细胞的百分比增加了超过约以下之中的任一个:5%、10%、15%、20%、25%、30%、35%、40%、45%或50%,或其间的任何值。
[0138]
在一些实施方案中,稳定的免疫细胞群体包括cd3+/cd56+细胞。在一些实施方案中,在约2℃至室温的保持期间,保持或提高群体中的cd3+cd56+细胞的百分比。在一些实施方案中,群体中的cd3+cd56+细胞的百分比增加了约以下之中的任一个:5%、10%、15%、20%、25%、30%、35%、40%、45%或50%,或其间的任何值。在一些实施方案中,群体中的cd3+cd56+细胞的百分比增加了超过约以下之中的任一个:5%、10%、15%、20%、25%、30%、35%、40%、45%或50%,或其间的任何值。
[0139]
在一些实施方案中,稳定的免疫细胞群体包括cd3+/cd56+细胞。在一些实施方案中,在约2℃至室温的保持期间,保持或提高群体中的cd14+细胞的百分比。在一些实施方案中,群体中的cd14+细胞的百分比增加了约以下之中的任一个:5%、10%、15%、20%、25%、30%、35%、40%、45%或50%,或其间的任何值。在一些实施方案中,群体中的cd14+细胞的百分比增加了超过约以下之中的任一个:5%、10%、15%、20%、25%、30%、35%、40%、45%或50%,或其间的任何值。
[0140]
在一些实施方案中,稳定的免疫细胞群体包括cd3+/cd56+细胞。在一些实施方案中,在约2℃至室温的保持期间,保持或提高群体中的cd3+/cd56+/cd14+细胞的百分比。在一些实施方案中,群体中的cd3+/cd56+/cd14+细胞的百分比增加了约以下之中的任一个:5%、10%、15%、20%、25%、30%、35%、40%、45%或50%,或其间的任何值。在一些实施方案中,群体中的cd3+/cd56+/cd14+细胞的百分比增加了超过约以下之中的任一个:5%、10%、15%、20%、25%、30%、35%、40%、45%或50%,或其间的任何值。
[0141]
在一些实施方案中,稳定的免疫细胞群体中的细胞的存活率大于约70%。在一些实施方案中,稳定的免疫细胞群体的细胞的存活率大于约以下之中的任一个:70%、75%、80%、85%、90%、95%或100%。在一些实施方案中,稳定的细胞群体中的细胞的存活率在以下之中的任一个之间:约70%至约75%、约70%至约80%、约70%至约85%、约70%至约90%、约70%至约95%、约70%至约100%、约75%至约80%、约75%至约85%、约75%至约90%、约75%至约95%、约75%至约100%、约80%至约85%、约80%至约90%、约80%至约95%、约80%至约100%、约85%至约90%、约85%至约95%、约85%至约100%、约90%至约95%、约95%至约100%。在一些实施方案中,对于在室温下保持超过约48、54、60、66、72、78、84或90小时中的任一个,稳定的细胞群体中的细胞的存活率在以下之中的任一个之间:约70%至约75%、约70%至约80%、约70%至约85%、约70%至约90%、约70%至约95%、约70%至约100%、约75%至约80%、约75%至约85%、约75%至约90%、约75%至约95%、约75%至约100%、约80%至约85%、约80%至约90%、约80%至约95%、约80%至约100%、约85%至约90%、约85%至约95%、约85%至约100%、约90%至约95%、约95%至约100%。在一些实施方案中,通过台盼蓝拒染法测量存活率。在一些实施方案中,通过流式细胞术测量存活率。在一些实施方案中,通过流式细胞术使用sytox
tm
蓝死亡细胞染色测量存活率。在一些实施方案中,也可通过zombie-nir
tm
染色或zombie-violet
tm
染料评估流式细胞术中的存
活率。
[0142]
在本发明的一些实施方案中,免疫细胞衍生自外周血单核细胞(pbmc)。如本文中所用,“外周血单核细胞”或”pbmc”是指具有圆形核的血细胞的异质群。在一些实施方案中,pbmc包括淋巴细胞,诸如t细胞、b细胞、nk细胞(包括nkt细胞和cik细胞),和单核细胞,诸如巨噬细胞和树突状细胞。pbmc可通过本领域已知的方法分离。例如,pbmc可基于pbmc与其他血细胞相比的密度来源于个体的外周血。在一些实施方案中,pbmc使用ficoll(例如,ficoll梯度)来源于个体的外周血。在一些实施方案中,pbmc使用细胞分离系统来源于个体的外周血。在一些实施方案中,pbmc从个体分离。在一些实施方案中,pbmc对于待用本发明的细胞治疗的个体为自体的。在一些实施方案中,pbmc对于待治疗的个体为同种异体的。
[0143]
在一些实施方案中,本发明提供增加溶瘤病毒的隐蔽期的方法,其中溶瘤病毒在治疗性免疫细胞中,所述方法包括a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养外周血单核细胞(pbmc);b)使细胞与溶瘤病毒接触;和c)从培养物移出细胞且将细胞保持在约2℃至约8℃达约120小时。在一些实施方案中,本发明提供增加溶瘤病毒的隐蔽期的方法,其中溶瘤病毒在治疗性免疫细胞中,所述方法包括a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养外周血单核细胞(pbmc);c)从培养物移出细胞且将细胞保持在约2℃至室温;c)使细胞与溶瘤病毒接触;和d)从培养物移出细胞且将细胞保持在约2℃至约8℃达约120小时。在一些实施方案中,将细胞保持在约2℃、约3℃、约4℃、约5℃、约6℃、约7℃或约8℃。在一些实施方案中,将细胞保持在以下之中的任一个之间:约12小时至约24小时、约24小时至约36小时、约36小时至约48小时、约48小时至约60小时、约60小时至约72小时、约72小时至约84小时、约84小时至约96小时、约96小时至约108小时或约108小时至约120小时。在一些实施方案中,溶瘤病毒为牛痘病毒。在一些实施方案中,牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。在一些实施方案中,牛痘病毒包括病毒胸苷激酶基因中的突变。在一些实施方案中,牛痘病毒包括病毒生长因子(vgf)基因中的突变。在一些实施方案中,溶瘤病毒具有复制能力。在一些实施方案中,牛痘病毒为eev病毒。在一些实施方案中,增加的隐蔽期为延长的隐蔽期。在一些实施方案中,增加的隐蔽期延长了超过约以下之中的任一个:12小时、24小时、36小时、48小时、60小时、72小时、84小时、96小时、108小时或120小时。
[0144]
在本发明的一些实施方案中,在超过约1升、2升、3升、4升、5升、6升、7升、8升、9升或10升培养基中的任一个中培养在选择及提高nkt细胞、nk细胞和/或t细胞的条件下培养的免疫细胞。在一些实施方案中,在介于以下体积之间的培养基中培养在选择及提高nkt细胞、nk细胞和/或t细胞的条件下培养的免疫细胞:约1升至约10升、约2升至约10升、约3升至约10升、约4升至约10升、约5升至约10升、约6升至约10升、约7升至约10升、约8升至约10升、约9升至约10升、约1升至约9升、约2升至约9升、约3升至约9升、约4升至约9升、约5升至约9升、约6升至约9升、约7升至约9升、约8升至约9升、约1升至约8升、约2升至约8升、约3升至约8升、约4升至约8升、约5升至约8升、约6升至约8升、约7升至约8升、约1升至约7升、约2升至约7升、约3升至约7升、约4升至约7升、约5升至约7升、约6升至约7升、约1升至约6升、约2升至约6升、约3升至约6升、约4升至约6升、约5升至约6升、约1升至约5升、约2升至约5升、约3
升至约5升、约4升至约5升、约1升至约4升、约2升至约4升、约3升至约4升、约1升至约3升、约2升至约3升或约1升至约2升。在一些实施方案中,在袋中培养免疫细胞。在一些实施方案中,在细胞工厂(cell factory)中培养免疫细胞。在一些实施方案中,在生物反应器(bioreactor)中培养免疫细胞。
[0145]
在本发明的一些实施方案中,将在选择及提高nkt细胞、nk细胞和/或t细胞的条件下培养的免疫细胞在使细胞保持在约2℃至室温之前培养约以下之中的任一个时间:约10天至约50天。在本发明的一些实施方案中,将在选择及提高nkt细胞、nk细胞和/或t细胞的条件下培养的免疫细胞在使细胞保持在室温下之前培养约以下之中的任一个时间:约10天、约15天、约20天、约25天、约28天、约30天、约32天、约34天、约36天、约40天、约45天或约50天。在一些实施方案中,将细胞培养介于以下时间之间:约10天至约15天、约10天至约20天、约10天至约25天、约10天至约30天、约10天至约35天、约10天至约40天、约10天至约45天、约10天至约50天、约15天至约20天、约15天至约25天、约15天至约30天、约15天至约35天、约15天至约40天、约15天至约45天、约15天至约50天、约20天至约25天、约20天至约30天、约20天至约35天、约20天至约40天、约20天至约45天、约20天至约50天、约25天至约30天、约25天至约35天、约25天至约40天、约25天至约45天、约25天至约50天、约30天至约35天、约30天至约40天、约30天至约45天、约30天至约50天、约35天至约40天、约35天至约45天、约35天至约50天、约40天至约45天、约40天至约50天或约45天至约50天。
[0146]
在本发明的一些实施方案中,室温为约22℃。在一些实施方案中,室温为22℃
±
0.5℃、22℃
±
0.6℃、22℃
±
0.7℃、22℃
±
0.8℃、22℃
±
0.9℃、22℃
±
1.0℃或22℃
±
2.0℃。
[0147]
在本发明的一些实施方案中,将细胞在袋中保持在约2℃至室温。在一些实施方案中,袋为塑料袋。在一些实施方案中,袋为不透气的。在一些实施方案中,袋不为co2可渗透的。在一些实施方案中,将细胞在小于约以下之中的任一个中保持在约2℃至室温:5%co2、4%co2、3%co2、2%co2、1%co2或0.1%co2。
[0148]
在本发明的一些实施方案中,将细胞在盐溶液中保持在2℃至室温。在一些实施方案中,将细胞保持在中。在一些实施方案中,盐溶液基本上不含血清和/或生长因子。在一些实施方案中,盐溶液包括少于约以下之中的任一个:1%血清、0.9%血清、0.8%血清、0.7%血清、0.6%血清、0.5%血清、0.4%血清、0.3%血清、0.2%血清、0.1%血清或0.01%血清。为用于静脉内灌注的晶体溶液,具有不同的电解质剂型。一般而言,溶液具有模拟人类生理学上的血浆电解质浓度、渗透压和ph的组合物。在一些实施方案中,将细胞在包括140mm钠、5mm钾、98mm氯化物、1.5mm镁、27mm乙酸盐和23mm葡糖酸盐的盐溶液中保持在2℃至室温。在一些实施方案中,为a或148。
[0149]
在本发明的一些实施方案中,将细胞在暗处保持在约2℃至室温。
[0150]
在本发明的一些实施方案中,稳定的免疫细胞群体的细胞包含溶瘤病毒。在一些实施方案中,溶瘤病毒为牛痘病毒。在一些实施方案中,牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。在一些实施方案中,牛痘病毒包括病毒胸苷激
酶基因中的突变。在一些实施方案中,牛痘病毒包括病毒生长因子(vgf)基因中的突变。在一些实施方案中,溶瘤病毒具有复制能力。在一些实施方案中,牛痘病毒为eev病毒。
[0151]
在本发明的一些实施方案中,以约1.0的感染复数(moi)至约10的moi,用溶瘤病毒感染免疫细胞。在本发明的一些实施方案中,以以下之中的任一个的感染复数(moi)用溶瘤病毒感染免疫细胞:约0.001、0.005、0.01、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0或10.0,或其间的任何值。
[0152]
在一些实施方案中,在约37℃用溶瘤病毒感染免疫细胞。在一些实施方案中,在以下任一温度用溶瘤病毒感染免疫细胞:约22℃、25℃、30℃、35℃、37℃、39℃或42℃,或其间的任何温度。在一些实施方案中,用溶瘤病毒感染免疫细胞持续约15min至约6小时。在一些实施方案中,用溶瘤病毒感染免疫细胞持续以下任一时间:约15min、30min、45min、1小时、2小时、3小时、4小时、5小时、6小时或超过6小时。在一些实施方案中,用溶瘤病毒感染免疫细胞持续约2小时。在一些实施方案中,在约37℃用溶瘤病毒感染免疫细胞持续约2小时。在一些实施方案中,溶瘤病毒为牛痘病毒。在一些实施方案中,在约37℃用牛痘病毒感染免疫细胞持续约2小时。
[0153]
治疗方法
[0154]
将感染的效应细胞群体注入接受者体中。测定施用本发明细胞的适用性将尤其取决于评估临床参数,诸如血清学适应症和组织活检的组织学检查而定。一般而言,施用药物组合物。
[0155]
在一些实施方案中,本发明提供治疗个体的癌症的方法,所述方法包括向个体施用有效量的包括如本文所述制备的溶瘤病毒的稳定的免疫细胞群体。
[0156]
在一些实施方案中,本发明提供治疗个体的癌症的方法,所述方法包括向个体施用有效量的包括溶瘤病毒的稳定的免疫细胞群体,其中稳定的免疫细胞群体是通过包括以下的方法制备:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养免疫细胞;b)使细胞与溶瘤病毒接触;和c)从培养物移出细胞且将细胞保持在约2℃至室温达约72小时。
[0157]
在一些实施方案中,本发明提供治疗个体的癌症的方法,所述方法包括向个体施用有效量的包括溶瘤病毒的稳定的免疫细胞群体,其中稳定的免疫细胞群体是通过包括以下的方法制备:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出细胞且将细胞保持在约2℃至室温达约12至约36小时;c)使细胞与溶瘤病毒接触;和c)将细胞保持在约2℃至室温达约12至约36小时。
[0158]
在一些实施方案中,本发明提供治疗个体的癌症的方法,所述方法包括:a)从个体分离免疫细胞;b)在选择及提高nkt细胞、nk细胞和t细胞的条件下在约37℃培养来自个体的免疫细胞;c)使细胞与溶瘤病毒接触;和d)从培养物移出细胞且将细胞保持在约2℃至室温达约72小时;和e)向个体施用有效量的包括溶瘤病毒的稳定的免疫细胞群体。
[0159]
在一些实施方案中,本发明提供治疗个体的癌症的方法,所述方法包括:a)从个体分离免疫细胞;b)在选择及提高nkt细胞、nk细胞和t细胞的条件下在约37℃培养来自个体的免疫细胞;c)从培养物移出细胞且将细胞保持在约2℃至室温达约12至约36小时;d)使细胞与溶瘤病毒接触;和e)将细胞保持在约2℃至室温达约12至约36小时;和f)向个体施用有
效量的包括溶瘤病毒的稳定的免疫细胞群体。
[0160]
在本发明的治疗方法的一些实施方案中,其中溶瘤病毒保留在免疫细胞中直至免疫细胞与个体的肿瘤相互作用。在一些实施方案中,在溶瘤病毒的隐蔽期期间向个体施用稳定的免疫细胞群体。
[0161]
在本发明的治疗方法的一些实施方案中,免疫细胞为自体细胞。在其他实施方案中,免疫细胞为同种异体的细胞。
[0162]
施用途径包括全身性注射,例如血管内、皮下或腹膜内注射、瘤内注射等。当受体动物为人类时,注射的细胞的数目将通常为至少约0.5
×
108,和不超过约5
×
10
10
,更通常至少约1
×
108或至少约1
×
109。在一些实施方案中,向患者施用不超过约以下之中的任一个:0.5
×
108、0.75
×
108、1.0
×
108、2.0
×
108、3.0
×
108、4.0
×
108、5.0
×
108、6.0
×
108、7.0
×
108、8.0
×
108、9.0
×
108、1.0
×
109、2.0
×
109、3.0
×
109、4.0
×
109、5.0
×
109、6.0
×
109、7.0
×
109、8.0
×
109、9.0
×
109、1.0
×
10
10
、2.0
×
10
10
、3.0
×
10
10
、4.0
×
1.0
×
10
10
或5
×
1.0
×
10
10
。在一些实施方案中,向患者施用介于约以下之中的任一个:0.5
×
108至1.0
×
108、1.0
×
108至5.0
×
108、5.0
×
108至1.0
×
109、1.0
×
109至5.0
×
109、5.0
×
10至1.0
×
10
10
或1.0
×
10
10
至5.0
×
10
10
。
[0163]
本发明提供抑制肿瘤细胞生长的方法,其包括使肿瘤细胞与本发明的感染效应细胞接触,以便溶瘤病毒进入肿瘤细胞,且存在对肿瘤细胞的选择性细胞毒性。可将组合物施用一次或一系列时间,例如每日、每周、每半月等。可通过如适于特定癌症,例如肿瘤大小、活检、血液中肿瘤细胞的存在等的标准方法来监测功效。可通过使用3h-胸腺嘧啶核苷掺入法(3h-thymidine incorporation assay)或对肿瘤细胞进行计数来确定肿瘤细胞是否正在增殖来评估肿瘤细胞生长。“抑制”肿瘤细胞生长是指以下状态中的任一个或全部:减缓、延缓和停止肿瘤生长,以及肿瘤缩小。“抑制”肿瘤生长表明当与不与本发明的细胞接触的生长相比时缩减的生长状态。
[0164]
如本文中所使用,癌症是指过度增殖性病症。术语通常表示恶性细胞群体。此类障碍具有一个或多个细胞亚群的过量细胞增殖,其在形态和基因型上通常与周围组织不同。可通过参照通用群体和/或参照特定患者,例如在患者生命的早期时刻来测定过量细胞增殖。过度增殖细胞障碍可出现在不同类型的动物和人类中,且视受影响细胞产生不同的物理表现。
[0165]
在本发明的一些实施方案中,稳定的免疫细胞群体用于治疗癌症。在一些实施方案中,癌症为以下(但不限于以下)中的任一种:白血病;淋巴瘤(霍奇金氏和非霍奇金氏);肉瘤;黑色素瘤;腺瘤;固体组织癌瘤,包括乳腺癌和胰腺癌;缺氧性肿瘤;口腔、咽喉、喉和肺的鳞状细胞癌;泌尿生殖系统癌症,诸如宫颈癌、卵巢癌和膀胱癌;造血癌症;头颈癌;和神经系统癌症,诸如神经胶质瘤、星形细胞瘤、脊膜瘤等;良性的病变,诸如乳头状瘤;和类似者。在一些实施方案中,癌症为结肠直肠癌、上皮卵巢癌、胃癌、肝细胞癌、骨肉瘤或三阴性乳腺癌。
[0166]
在一些实施方案中,用于治疗的癌症包括但不限于卵巢癌和乳腺癌和淋巴瘤。卵巢癌为美国女性中第二大最常诊断的妇科恶性肿瘤、最致命的妇科恶性肿瘤和癌症相关死亡的第四大主要原因。70名女性中约1名最终患上卵巢癌,且100名女性中约1名死于所述癌症。卵巢癌主要影响围绝经期和绝经后女性。
[0167]
卵巢瘤为组织学上最多样化的一组肿瘤。至少80%的恶性卵巢瘤由体腔上皮(coelomic epithelium)引起。最常见类型为浆液性的囊腺癌,其占上皮卵巢癌病例的75%。其他包括黏液性、子宫内膜样、移行细胞、布伦纳(brenner)、透明细胞和类别不明的癌瘤。其余20%的恶性卵巢瘤为非上皮起源的生殖细胞和性索-间质细胞肿瘤,和转移到卵巢的癌瘤(最常见的为乳腺癌和gi癌)。由卵巢的原发性生殖细胞引起的生殖细胞肿瘤出现在年轻女性中且在》30岁的女性中不常见。恶性生殖细胞肿瘤包括无性细胞瘤、不成熟畸胎瘤、内胚窦瘤、胚胎癌瘤、绒毛膜癌和多胚瘤。基质恶性病包括颗粒-卵泡膜细胞肿瘤(granulosa-theca cell tumors)和史脱力-莱迪希氏细胞肿瘤(sertoli-leydig cell tumors)。
[0168]
卵巢癌通过直接扩展、通过经由将细胞脱落至腹腔内进行腹膜内植入、通过在骨盆和主动脉旁区域中进行淋巴传播来扩散,和较不常见地血源性扩散至肝或肺。
[0169]
ca 125为在80%上皮卵巢癌病例中可检测到的细胞表面糖蛋白。然而,其对患有卵巢癌的患者不具有特异性,且在绝经前患者当中,可在若干良性的障碍中轻度升高,所述良性的障碍包括子宫内膜异位、盆腔炎、妊娠和子宫平滑肌瘤。对于患有晚期上皮卵巢癌的患者,建议进行细胞减灭(肿瘤消减)手术以提高辅助疗法的疗效。目标为减少肿瘤负荷以便剩余植入物的最大直径《1cm。细胞减灭术通常包括全子宫切除术、双侧输卵管卵巢切除术、网膜切除术和从任何其他部位切除肿瘤。可能需要直肠乙状结肠切除术(通常伴原发性再吻合)、根治性腹膜剥离术、横膈腹膜切除术或脾切除术。患有晚期疾病的患者的预后直接地与细胞减灭术的成功相关。
[0170]
组合的方法可与常规化学疗法、放射性和/或手术治疗方法组合。用于减少细胞增殖的细胞毒剂为本领域已知的且被广泛使用。此类药剂包括烷基化剂,诸如氮芥,例如二氯甲二乙胺、环磷酰胺、美法仑(melphalan)(l-溶肉瘤素)等;和亚硝基脲,例如卡莫司汀(carmustine)(bcnu)、洛莫司汀(lomustine)(ccnu)、司莫司汀(semustine)(甲基-ccnu)、链脲霉素(streptozocin)、氯脲菌素(chlorozotocin)等。抗代谢物药剂包括嘧啶,例如阿糖胞苷(cytarabine)(cytosar-u)、胞嘧啶阿拉伯糖苷(cytosine arabinoside)、氟尿嘧啶(5-fu)、氟尿苷(fudr)等;嘌呤,例如硫鸟嘌呤(6-硫鸟嘌呤)、巯基嘌呤(6-mp)、喷司他汀(pentostatin)、氟尿嘧啶(5-fu)等;和叶酸类似物,例如甲胺喋呤、10-炔丙基-5,8-二去氮叶酸酯(pddf,cb3717)、5,8-二去氮四氢叶酸(ddathf)、甲酰四氢叶酸等。其他天然产物包括硫唑嘌呤;布喹那(brequinar);生物碱和其合成或半合成衍生物,例如长春新碱(vincristine)、长春碱(vinblastine)、长春瑞滨(vinorelbine)等;鬼臼毒素(podophyllotoxins),例如依托泊苷(etoposide)、替尼泊苷(teniposide)等;抗生素,例如蒽环霉素(anthracycline)、盐酸道诺霉素(daunorubicin hydrochloride)(道诺霉素(daunomycin)、红比霉素(rubidomycin)、柔红霉素(cerubidine))、伊达比星(idarubicin)、多柔比星(doxorubicin)、表柔比星(epirubicin)和吗啉衍生物等;酚西酮双环肽(phenoxizone biscyclopeptide),例如更生霉素(dactinomycin);碱性糖肽,例如博莱霉素(bleomycin);蒽醌糖苷,例如普卡霉素(plicamycin)(米曲霉素(mithromycin));蒽二酮,例如米托蒽醌(mitoxantrone);氮丙啶吡咯吲哚二酮(azirinopyrrolo indoledione),例如丝裂霉素;和类似物。其他化学治疗剂包括金属络合物,例如顺铂(cisplatin)(cis-ddp)、卡铂(carboplatin)等;脲,例如羟基尿素;和肼,例如n-甲基肼。其
他关注的抗增殖剂包括免疫抑制剂,例如霉酚酸、沙利度胺(thalidomide)、脱氧精胍菌素(desoxyspergualin)、氮杂孢菌素(azasporine)、来氟米特(leflunomide)、咪唑立宾(mizoribine)、氮杂螺烷(azaspirane)(skf 105685)等。抗肿瘤剂紫杉醇(taxols)(或紫杉烷(taxane))高度稳定聚合微管,从而在增殖性细胞中产生有丝分裂阻滞和细胞毒性。紫杉烷(或紫杉醇),诸如太平洋紫杉醇(paclitaxel)、多烯紫杉醇(docetaxel)等是受人关注的。还关注微管稳定埃博霉素(参见bollag等人(1995)cancer research,vol 55,issue 11 2325-2333,关于这些化学治疗剂的级别和其用途的教导内容以引用的方式并入本文),例如埃博霉素a和埃博霉素b。类视黄醇,例如维生素a、13-顺式-视黄酸、反式-视黄酸、异维甲酸等;类胡萝卜素,例如β-胡萝卜素、维生素d等。类视黄醇调节上皮细胞分化和增殖且用于上皮过度增殖性病症的治疗和防治两者。本发明涉及通过组合病毒介导的肿瘤细胞溶解和免疫疗法选择性杀伤肿瘤细胞,所述组合在与单一疗法中的任一个相比时提供协同益处。本发明提供溶瘤病毒感染的免疫细胞、使用溶瘤病毒感染的免疫细胞杀伤肿瘤细胞的方法和含有溶瘤病毒感染的免疫细胞的药物组合物。在联合治疗(combined therapeutic)中,显示效应细胞保留其运输至肿瘤的能力。在肿瘤部位,溶瘤病毒在肿瘤深处而非仅仅表面处释放;因此,细胞介导的病毒递送引起肿瘤内增加的生物分布。另外,可通过肿瘤靶标中的病毒复制增加效应细胞的细胞毒性效果。此联合治疗已证实为安全的,具有最少的正常组织病毒感染,且高度有效。
[0171]
已显示本发明的效应细胞可用于将溶瘤病毒递送至能够建立针对溶瘤病毒的记忆性反应的接受体,例如可将牛痘病毒成功地递送至先前经牛痘免疫的患者。此特性克服了先前描述的病毒治疗的限制,其中单一试剂(例如溶瘤病毒)由于接受体免疫反应而在重复剂量中或在接种个体中无效。已发现,多克隆、抗牛痘抗体未能识别感染牛痘的cik细胞,尽管抗体确实识别感染牛痘的肿瘤细胞。vig(牛痘免疫球蛋白)为针对在天花疫苗接种之后的不良事件的经fda批准的治疗。完全中和牛痘(防止牛痘在暴露于vig 2h之后感染细胞层)的vig的剂量对受感染cik细胞将病毒转送至细胞层的能力没有影响。用牛痘治疗的动物(或受感染cik细胞)产生可识别受感染肿瘤细胞而非受感染cik细胞的ctl(细胞毒性t淋巴细胞)。携带肿瘤且经免疫的小鼠用牛痘或经感染cik细胞治疗(iv)。当单独递送时,在肿瘤中存在极少的牛痘迹象。当使用经感染cik细胞时,在肿瘤内存在多个阳性染色的细胞区域(用于牛痘感染)。用高剂量(10
×
疗法含量)的vig治疗且然后用受感染cik细胞治疗的携带肿瘤的动物仍自肿瘤内产生信号(自病毒编码的荧光素酶进行生物发光成像)。
[0172]
在一些实施方案中,本发明提供稳定的免疫细胞群体的组合物在制备用于治疗个体的病症(例如,癌症)的药物中的用途,其中稳定的免疫细胞群体通过包括以下的方法制备:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养免疫细胞;b)使细胞与溶瘤病毒接触;和c)从培养物移出细胞且将细胞保持在约2℃至室温达约72小时。
[0173]
在一些实施方案中,本发明提供稳定的免疫细胞群体的组合物在制备用于治疗个体的病症(例如,癌症)的药物中的用途,其中稳定的免疫细胞群体通过包括以下的方法制备:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出细胞且将细胞保持在约2℃至室温达约12至约36小时;c)使细胞与溶瘤病毒接触;和c)将细胞保持在约2℃至室温达约12至约36小时。
[0174]
在一些实施方案中,本发明提供用于治疗个体的病症(例如,癌症)的稳定的免疫细胞群体的组合物,其中稳定的免疫细胞群体通过包括以下的方法制备:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养免疫细胞;b)使细胞与溶瘤病毒接触;和c)从培养物移出细胞且将细胞保持在约2℃至室温达约72小时。
[0175]
在一些实施方案中,本发明提供用于治疗个体的病症(例如,癌症)的稳定的免疫细胞群体的组合物,其中稳定的免疫细胞群体通过包括以下的方法制备:a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和t细胞的条件下在约37℃培养免疫细胞;b)从培养物移出细胞且将细胞保持在约2℃至室温达约12至约36小时;c)使细胞与溶瘤病毒接触;和d)将细胞保持在约2℃至室温达约12至约36小时。
[0176]
药物组合物
[0177]
本发明也包括组合物,包括药物组合物,其含有本文描述的免疫细胞。例如当测量个体中细胞杀伤的效果时,此类组合物适用于施用。在一些实施方案中,这些组合物进一步包括药学上可接受的赋形剂。这些组合物(其可在药学上可接受的赋形剂中包括有效量的本发明的免疫细胞)适用于以单位剂量形式、无菌非经肠溶液或悬浮液、无菌非经肠溶液或口服溶液或悬浮液、水包油或油包水乳液和类似物全身性施用至个体。用于非经肠和经肠药物递送的制剂为本领域已知的且阐述于remington's pharmaceutical sciences,18.sup.th edition,mack publishing(1990)。组合物也包括本发明的载体的冻干和/或重构形式。
[0178]
在一些实施方案中,本发明提供通过本文所述的方法制备的免疫细胞的药物组合物。在一些实施方案中,本发明提供通过本文所述的方法制备的用溶瘤病毒感染的免疫细胞的药物组合物。在一些实施方案中,本发明提供通过本文所述的方法制备的用牛痘病毒感染的免疫细胞的药物组合物。在一些实施方案中,免疫细胞为自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和/或t细胞。在一些实施方案中,免疫细胞包括细胞因子-诱导的杀伤(cik)细胞。在一些实施方案中,本发明提供通过本文所述的方法制备的用牛痘病毒感染的nkt细胞、nk细胞和/或t细胞的药物组合物。在一些实施方案中,本发明提供通过本文所述的方法制备的用牛痘病毒感染的cik细胞的药物组合物。在一些实施方案中,牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。在一些实施方案中,药物组合物在袋中。
[0179]
试剂盒
[0180]
也提供用于产生稳定的免疫细胞群体,例如包括溶瘤病毒的稳定的免疫细胞群体的试剂盒或制品。在一些实施方案中,试剂盒包括稳定的免疫细胞和/或溶瘤病毒。在一些实施方案中,试剂盒包括适合的包装中的本文描述的组分(例如,用于分析免疫细胞群体的细胞、袋、试剂)。适合的包装材料为本领域已知的,且包括例如小瓶(诸如密封小瓶)、容器、安瓿、瓶、罐、软包装(例如经密封mylar或塑料袋)和类似物。所述制品可进一步被灭菌和/或密封。
[0181]
在一些实施方案中,本发明提供用于治疗个体的癌症的试剂盒,其中试剂盒包括通过本文所述的方法制备的稳定的免疫细胞的药物组合物。在一些实施方案中,试剂盒包括溶瘤病毒。在一些实施方案中,试剂盒包括通过本文所述的方法制备的用溶瘤病毒感染的稳定的免疫细胞的药物组合物。
[0182]
在一些实施方案中,免疫细胞为自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和/或t细胞。在一些实施方案中,免疫细胞包括细胞因子-诱导的杀伤(cik)细胞。在一些实施方案中,试剂盒包括通过本文所述的方法制备的用牛痘病毒感染的nkt细胞、nk细胞和/或t细胞的药物组合物。在一些实施方案中,试剂盒包括通过本文所述的方法制备的用牛痘病毒感染的cik细胞的药物组合物。在一些实施方案中,牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。
[0183]
本发明也提供包括本文所述的方法的组分的试剂盒且可进一步包括用于执行所述方法以制备稳定免疫细胞的说明书和/或用于生产此类细胞和将此类细胞引入个体中的说明书。本文描述的试剂盒可进一步包括其他材料,包括缓冲液、稀释剂、过滤器、针头、注射器、容器、袋和具有用于执行本文所述的任一方法的说明的药品说明书(package insert);例如用于产生稳定免疫细胞群体和用于将此类细胞引入个体中的说明。
[0184]
例示性实施方案
[0185]
以下为本发明的例示性实施方案。
[0186]
1.一种制造稳定的免疫细胞群体的方法,所述方法包括
[0187]
a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和/或t细胞的条件下在约37℃培养免疫细胞,
[0188]
b)从培养物移出所述细胞且将所述细胞保持在约2℃至约室温长达约120小时,从而产生稳定的免疫细胞群体。
[0189]
2.根据权实施方案1所述的方法,其中所述稳定的免疫细胞群体包括细胞因子-诱导的杀伤(cik)细胞。
[0190]
3.根据实施方案2所述的方法,其中所述cik细胞为cd3+/cd56+细胞。
[0191]
4.根据实施方案2或3所述的方法,其中保持或提高所述群体中的cik细胞的百分比。
[0192]
5.根据实施方案1所述的方法,其中所述稳定的免疫细胞群体包括cd3+/cd56+细胞。
[0193]
6.根据实施方案5所述的方法,其中保持或提高所述群体中的cd3+/cd56+细胞的百分比。
[0194]
7.根据实施方案1至6中任一项所述的方法,其中所述稳定的免疫细胞群体包括nkg2d+细胞。
[0195]
8.根据实施方案7所述的方法,其中保持或提高所述群体中的nkg2d+细胞的百分比。
[0196]
9.根据实施方案7或8所述的方法,其中保持或提高cd3+/cd56+/nkg2d+细胞的百分比。
[0197]
10.根据实施方案1至9中任一项所述的方法,其中所述稳定的免疫细胞群体的存活率大于约70%。
[0198]
11.根据实施方案10所述的方法,其中通过台盼蓝拒染法或通过流式细胞术测量细胞的存活率。
[0199]
12.根据实施方案1至11中任一项所述的方法,其中所述免疫细胞源于外周血单核细胞(pbmc)。
[0200]
13.根据实施方案1至12中任一项所述的方法,其中步骤a)的免疫细胞在约1升至约10升的培养基中培养。
[0201]
14.根据实施方案1至13中任一项所述的方法,其中步骤a)的免疫细胞在约1升或约5升的培养基中培养。
[0202]
15.根据实施方案1至14中任一项所述的方法,其中培养步骤a)的免疫细胞约28天、约32天、约36天或约40天。
[0203]
16.根据实施方案1至15中任一项所述的方法,其中将步骤b)的细胞保持在室温。
[0204]
17.根据实施方案1至16中任一项所述的方法,其中室温为约22℃。
[0205]
18.根据实施方案1至15中任一项所述的方法,其中将步骤b)的细胞保持在约2℃至约8℃或约4℃。
[0206]
19.根据实施方案1至18中任一项所述的方法,其中将步骤b)的细胞保持在袋中。
[0207]
20.根据实施方案19所述的方法,其中所述袋为塑料袋。
[0208]
21.根据实施方案19或20所述的方法,其中所述袋为不透气的。
[0209]
22.根据实施方案1至21中任一项所述的方法,其中将步骤b)的细胞保持在《1%co2中。
[0210]
23.根据实施方案1至22中任一项所述的方法,其中将步骤b)的细胞保持在盐溶液中。
[0211]
24.根据实施方案1至23中任一项所述的方法,其中将步骤b)的细胞保持在中。
[0212]
25.根据实施方案23或24所述的方法,其中所述盐溶液基本上不含血清和/或生长因子。
[0213]
26.根据实施方案1至25中任一项所述的方法,其中将步骤b)的细胞保持在暗处。
[0214]
27.根据实施方案1至26中任一项所述的方法,其中所述稳定的免疫细胞群体的细胞包含溶瘤病毒。
[0215]
28.根据实施方案27所述的方法,其中所述溶瘤病毒为牛痘病毒。
[0216]
29.根据实施方案28所述的方法,其中所述牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。
[0217]
30.根据实施方案28或29所述的方法,其中所述牛痘病毒包括病毒胸苷激酶基因中的突变。
[0218]
31.根据实施方案28至30中任一项所述的方法,其中所述牛痘病毒包括病毒生长因子(vgf)基因中的突变。
[0219]
32.根据实施方案28至31中任一项所述的方法,其中所述溶瘤病毒具有复制能力。
[0220]
33.根据实施方案28至32中任一项所述的方法,其中所述牛痘病毒为eev病毒。
[0221]
34.一种制造稳定的免疫细胞群体的方法,其中所述免疫细胞包含溶瘤病毒,所述方法包括
[0222]
a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞及t细胞的条件下在约37℃培养免疫细胞,
[0223]
b)使所述细胞与溶瘤病毒接触,及
[0224]
c)将所述细胞保持在约2℃至室温长达约120小时。
[0225]
35.根据实施方案34所述的方法,其中将步骤c)细胞保持在约2℃至约室温约24小时。
[0226]
36.根据实施方案34所述的方法,其中将步骤c)的细胞保持在约2℃至约8℃或约4℃约24小时。
[0227]
37.根据实施方案34所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,自培养物移出所述细胞且将所述细胞保持在约2℃至室温。
[0228]
38.根据实施方案37所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,将所述细胞保持在约2℃至约室温约24小时。
[0229]
39.根据实施方案37所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,将所述细胞保持在约2℃至约8℃或约4℃长达约120小时。
[0230]
40.根据实施方案34至39中任一项所述的方法,其中所述溶瘤病毒为牛痘病毒。
[0231]
41.根据实施方案40所述的方法,其中所述牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。
[0232]
42.根据实施方案40或41所述的方法,其中所述牛痘病毒包括病毒胸苷激酶基因中的突变。
[0233]
43.根据实施方案40至42中任一项所述的方法,其中所述牛痘病毒包括病毒生长因子(vgf)基因中的突变。
[0234]
44.根据实施方案40至43中任一项所述的方法,其中所述溶瘤病毒具有复制能力。
[0235]
45.根据实施方案40至44中任一项所述的方法,其中所述牛痘病毒为eev病毒。
[0236]
46.根据实施方案37至45中任一项所述的方法,其中所述免疫细胞以约0.1的感染复数(moi)至约10的moi与所述溶瘤病毒接触。
[0237]
47.根据实施方案37至46中任一项所述的方法,其中所述免疫细胞与所述溶瘤病毒在37℃接触约2小时。
[0238]
48.根据实施方案34至47中任一项所述的方法,其中所述稳定的免疫细胞群体包括细胞因子-诱导的杀伤(cik)细胞。
[0239]
49.根据实施方案48所述的方法,其中所述cik细胞为cd3+/cd56+细胞。
[0240]
50.根据实施方案48或49所述的方法,其中保持或提高所述群体中的cik细胞的百分比。
[0241]
51.根据实施方案34至47中任一项所述的方法,其中所述稳定的免疫细胞群体包括cd3+/cd56+细胞。
[0242]
52.根据实施方案51所述的方法,其中保持或提高所述群体中的cd3+/cd56+细胞的百分比。
[0243]
53.根据实施方案34至52中任一项所述的方法,其中所述稳定的免疫细胞群体包括nkg2d+细胞。
[0244]
54.根据实施方案53所述的方法,其中保持或提高所述群体中的nkg2d+细胞的百分比。
[0245]
55.根据实施方案53或54中任一项所述的方法,其中保持或提高cd3+/cd56+/nkg2d+细胞的百分比。
[0246]
56.根据实施方案34至55中任一项所述的方法,其中所述稳定的免疫细胞群体的
存活率大于约70%。
[0247]
57.根据实施方案56所述的方法,其中通过台盼蓝拒染法或通过流式细胞术测量细胞的存活率。
[0248]
58.根据实施方案34至57中任一项所述的方法,其中所述免疫细胞源于外周血单核细胞(pbmc)。
[0249]
59.根据实施方案34至58中任一项所述的方法,其中步骤a)的免疫细胞在约1升至约10升的培养基中培养。
[0250]
60.根据实施方案34至59中任一项所述的方法,其中步骤a)的免疫细胞在约1升或约5升的培养基中培养。
[0251]
61.根据实施方案34至60中任一项所述的方法,其中培养步骤a)的免疫细胞约28天、约32天、约36天或约40天。
[0252]
62.根据实施方案37至61中任一项所述的方法,其中将步骤c)的细胞保持在室温。
[0253]
63.根据实施方案34至62中任一项所述的方法,其中室温为约22℃。
[0254]
64.根据实施方案37至61中任一项所述的方法,其中将步骤c)的细胞保持在约2℃至约8℃或约4℃。
[0255]
65.根据实施方案34至64中任一项所述的方法,其中将步骤c)的细胞保持在袋中。
[0256]
66.根据实施方案65所述的方法,其中所述袋为塑料袋。
[0257]
67.根据实施方案65或66所述的方法,其中所述袋为不透气的。
[0258]
68.根据实施方案34至67中任一项所述的方法,其中将步骤c)的细胞保持在《1%co2中。
[0259]
69.根据实施方案34至68中任一项所述的方法,其中将步骤c)的细胞保持在盐溶液中。
[0260]
70.根据实施方案34至69中任一项所述的方法,其中将步骤c)的细胞保持在中。
[0261]
71.根据实施方案69或70所述的方法,其中所述盐溶液基本上不含血清和/或生长因子。
[0262]
72.根据实施方案34至71中任一项所述的方法,其中将步骤c)的细胞保持在暗处。
[0263]
73.根据实施方案34至72中任一项所述的方法,其中所述稳定的免疫细胞群体的细胞包含溶瘤病毒。
[0264]
74.根据实施方案73所述的方法,其中所述溶瘤病毒为牛痘病毒。
[0265]
75.根据实施方案74所述的方法,其中所述牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。
[0266]
76.根据实施方案74或75所述的方法,其中所述牛痘病毒包括病毒胸苷激酶基因中的突变。
[0267]
77.根据实施方案74至76中任一项所述的方法,其中所述牛痘病毒包括病毒生长因子(vgf)基因中的突变。
[0268]
78.根据实施方案74至77中任一项所述的方法,其中所述溶瘤病毒具有复制能力。
[0269]
79.根据实施方案74至78中任一项所述的方法,其中所述牛痘病毒为eev病毒。
[0270]
80.一种提高治疗性免疫细胞的功效的方法,所述方法包括
[0271]
a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞和/或t细胞的条件下在约37℃培养免疫细胞,
[0272]
b)从培养物移出所述细胞且将所述细胞保持在约2℃至室温长达约120小时以产生提高的免疫细胞。
[0273]
81.一种提高治疗性免疫细胞的功效的方法,其中所述免疫细胞包含溶瘤病毒,所述方法包括
[0274]
a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞及t细胞的条件下在约37℃培养外周血单核细胞(pbmc),
[0275]
b)使所述细胞与所述溶瘤病毒接触,及
[0276]
c)从培养物移出所述细胞且将所述细胞保持在约2℃至室温长达约120小时以产生提高的免疫细胞。
[0277]
82.根据实施方案81所述的方法,其中将步骤c)的细胞保持在约2℃至约8℃或约4℃长达约120小时。
[0278]
83.根据实施方案81所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,自培养物移出所述细胞且将所述细胞保持在约2℃至室温。
[0279]
84.根据实施方案83所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,将所述细胞保持在约2℃至约室温约24小时。
[0280]
85.根据实施方案83所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,将所述细胞保持在约2℃至约8℃或约4℃长达约120小时。
[0281]
86.根据实施方案81至85中任一项所述的方法,其中所述溶瘤病毒为牛痘病毒。
[0282]
87.根据实施方案86所述的方法,其中所述牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。
[0283]
88.根据实施方案86或87所述的方法,其中所述牛痘病毒包括病毒胸苷激酶基因中的突变。
[0284]
89.根据实施方案86至88中任一项所述的方法,其中所述牛痘病毒包括病毒生长因子(vgf)基因中的突变。
[0285]
90.根据实施方案81至89中任一项所述的方法,其中所述溶瘤病毒具有复制能力。
[0286]
91.根据实施方案81至90中任一项所述的方法,其中所述牛痘病毒为eev病毒。
[0287]
92.根据实施方案81至91中任一项所述的方法,其中所述免疫细胞以约0.01的感染复数(moi)至约10的moi与所述溶瘤病毒接触。
[0288]
93.根据实施方案81至92中任一项所述的方法,其中使所述免疫细胞与所述溶瘤病毒在37℃接触约2小时。
[0289]
94.根据实施方案80至93中任一项所述的方法,其中所述提高的免疫细胞包括细胞因子-诱导的杀伤(cik)细胞。
[0290]
95.根据实施方案94所述的方法,其中所述cik细胞为cd3+/cd56+细胞。
[0291]
96.根据实施方案94或95所述的方法,其中保持或提高所述群体中的cik细胞的百分比。
[0292]
97.根据实施方案80至93中任一项所述的方法,其中所述提高的免疫细胞包括cd3+/cd56+细胞。
[0293]
98.根据实施方案97所述的方法,其中保持或提高所述群体中的cd3+/cd56+细胞的百分比。
[0294]
99.根据实施方案80至98中任一项所述的方法,其中所述提高的免疫细胞包括nkg2d+细胞。
[0295]
100.根据实施方案99所述的方法,其中保持或提高所述群体中的nkg2d+细胞的百分比。
[0296]
101.根据实施方案99或100中任一项所述的方法,其中保持或提高cd3+/cd56+/nkg2d+细胞的百分比。
[0297]
102.根据实施方案80至101中任一项所述的方法,其中所述提高的免疫细胞的存活率大于约70%。
[0298]
103.根据实施方案102所述的方法,其中通过台盼蓝拒染法或通过流式细胞术测量细胞的存活率。
[0299]
104.根据实施方案80至103中任一项所述的方法,其中所述免疫细胞源于外周血单核细胞(pbmc)。
[0300]
105.根据实施方案80至104中任一项所述的方法,其中在约1升至约10升的培养基中培养步骤a)的免疫细胞。
[0301]
106.根据实施方案80至105中任一项所述的方法,其中在约1升或约5升的培养基中培养步骤a)的免疫细胞。
[0302]
107.根据实施方案80至106中任一项所述的方法,其中培养步骤a)的免疫细胞约28天、约32天、约36天或约40天。
[0303]
108.根据实施方案81至107中任一项所述的方法,其中将步骤c)的细胞保持在室温。
[0304]
109.根据实施方案81至108中任一项所述的方法,其中室温为约22℃。
[0305]
110.根据实施方案81至107中任一项所述的方法,其中将步骤c)的细胞保持在约2℃至约8℃或约4℃。
[0306]
111.根据实施方案81至110中任一项所述的方法,其中将步骤c)的细胞保持在袋中。
[0307]
112.根据实施方案111所述的方法,其中所述袋为塑料袋。
[0308]
113.根据实施方案111或112所述的方法,其中所述袋为不透气的。
[0309]
114.根据实施方案80至113中任一项所述的方法,其中将步骤c)的细胞保持在《1%co2中。
[0310]
115.根据实施方案80至114中任一项所述的方法,其中将步骤c)的细胞保持在盐溶液中。
[0311]
116.根据实施方案80至115中任一项所述的方法,其中将步骤c)的细胞保持在中。
[0312]
117.根据实施方案115或116所述的方法,其中所述盐溶液基本上不含血清和/或生长因子。
[0313]
118.根据实施方案80至117中任一项所述的方法,其中将步骤b)的细胞保持在暗处。
[0314]
119.根据实施方案80所述的方法,其中所述稳定的免疫细胞群体的细胞包含溶瘤病毒。
[0315]
120.根据实施方案119所述的方法,其中所述溶瘤病毒为牛痘病毒。
[0316]
121.根据实施方案120所述的方法,其中所述牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。
[0317]
122.根据实施方案120或121所述的方法,其中所述牛痘病毒包括病毒胸苷激酶基因中的突变。
[0318]
123.根据实施方案120至122中任一项所述的方法,其中所述牛痘病毒包括病毒生长因子(vgf)基因中的突变。
[0319]
124.根据实施方案119至123中任一项所述的方法,其中所述溶瘤病毒具有复制能力。
[0320]
125.根据实施方案120至124中任一项所述的方法,其中所述牛痘病毒为eev病毒。
[0321]
126.一种增加溶瘤病毒的隐蔽期的方法,其中所述溶瘤病毒在治疗性免疫细胞中,所述方法包括
[0322]
a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞及t细胞的条件下在约37℃培养外周血单核细胞(pbmc),
[0323]
b)使所述细胞与溶瘤病毒接触,及
[0324]
c)自培养物移出所述细胞且将所述细胞保持在约2℃至约8℃达约120小时。
[0325]
127.根据实施方案126所述的方法,其中将步骤c)的细胞保持在约2℃至约8℃或约4℃约12小时至约120小时。
[0326]
128.根据实施方案126或127所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,将从培养物移出的所述细胞保持在约2℃至室温。
[0327]
129.根据实施方案128所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,将所述细胞保持在约2℃至约室温约24小时。
[0328]
130.根据实施方案128所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,将所述细胞保持在约2℃至约8℃或约4℃达约120小时。
[0329]
131.根据实施方案126至130中任一项所述的方法,其中所述溶瘤病毒为牛痘病毒。
[0330]
132.根据实施方案131所述的方法,其中所述牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。
[0331]
133.根据实施方案131或132所述的方法,其中所述牛痘病毒包括病毒胸苷激酶基因中的突变。
[0332]
134.根据实施方案131至133中任一项所述的方法,其中所述牛痘病毒包括病毒生长因子(vgf)基因中的突变。
[0333]
135.根据实施方案126至134中任一项所述的方法,其中所述溶瘤病毒具有复制能力。
[0334]
136.根据实施方案131至135中任一项所述的方法,其中所述牛痘病毒为eev病毒。
[0335]
137.根据实施方案126至136中任一项所述的方法,其中所述免疫细胞以约0.01的感染复数(moi)至约10的moi与所述溶瘤病毒接触。
[0336]
138.根据实施方案126至137中任一项所述的方法,其中使所述免疫细胞与所述溶瘤病毒在37℃接触约2小时。
[0337]
139.根据实施方案126至138中任一项所述的方法,其中所述免疫细胞包括细胞因子-诱导的杀伤(cik)细胞。
[0338]
140.根据实施方案139所述的方法,其中所述cik细胞为cd3+/cd56+细胞。
[0339]
141.根据实施方案126至138中任一项所述的方法,其中所述提高的免疫细胞包括cd3+/cd56+细胞。
[0340]
142.根据实施方案126至141中任一项所述的方法,其中在约1升至约10升的培养基中培养步骤a)的免疫细胞。
[0341]
143.根据实施方案126至142中任一项所述的方法,其中在约1升或约5升的培养基中培养步骤a)的免疫细胞。
[0342]
144.根据实施方案126至143中任一项所述的方法,其中培养步骤a)的免疫细胞约28天、约32天、约36天或约40天。
[0343]
145.根据实施方案126至142中任一项所述的方法,其中将步骤c)的细胞保持在袋中。
[0344]
146.根据实施方案145所述的方法,其中所述袋为塑料袋。
[0345]
147.根据实施方案145或146所述的方法,其中所述袋为不透气的。
[0346]
148.根据实施方案126至147中任一项所述的方法,其中将步骤c)的细胞保持在《1%co2中。
[0347]
149.根据实施方案126至148中任一项所述的方法,其中将步骤c)的细胞保持在盐溶液中。
[0348]
150.根据实施方案126至149中任一项所述的方法,其中将步骤c)的细胞保持在中。
[0349]
151.根据实施方案149或150所述的方法,其中所述盐溶液基本上不含血清和/或生长因子。
[0350]
152.根据实施方案126至151中任一项所述的方法,其中将步骤c)的细胞保持在暗处。
[0351]
153.一种稳定的免疫细胞的组合物,其根据实施方案1至152中任一项所述的方法制备。
[0352]
154.根据实施方案153所述的组合物,其中所述组合物包括一种或多种药学上可接受的赋形剂。
[0353]
155.一种用于治疗个体的癌症的试剂盒,所述试剂盒包括根据实施方案153或154所述的组合物。
[0354]
156.根据实施方案155所述的试剂盒,其中所述试剂盒进一步包括使用说明。
[0355]
157.一种用于制造稳定的免疫细胞群体的试剂盒,所述试剂盒包括免疫细胞和/或溶瘤病毒。
[0356]
158.根据实施方案155至157中任一项所述的试剂盒,其中所述试剂盒进一步包括以下中的一种或多种:缓冲液、稀释剂、过滤器、针头、注射器、容器、袋或具有使用说明的药品说明书。
[0357]
159.一种治疗个体的癌症的方法,所述方法包括向所述个体施用有效量的包括溶瘤病毒的稳定的免疫细胞群体,其中所述稳定的免疫细胞群体是通过包括以下的方法制备:
[0358]
a)在选择及提高自然杀伤t(nkt)细胞、自然杀伤(nk)细胞及t细胞的条件下在约37℃培养免疫细胞,
[0359]
b)使所述细胞与溶瘤病毒接触,及
[0360]
c)从培养物移出所述细胞且将所述细胞保持在约2℃至室温长达约120小时。
[0361]
160.根据实施方案132所述的方法,其中将步骤c)的细胞保持在约2℃至约8℃或约4℃达约120小时。
[0362]
161.根据实施方案159或160所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,将来自培养物的所述细胞保持在约2℃至约室温。
[0363]
162.根据实施方案161所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,将所述细胞保持在约2℃至约室温约24小时。
[0364]
163.根据实施方案161所述的方法,其中在使所述细胞与所述溶瘤病毒接触之前,将所述细胞保持在约2℃至约8℃达约24小时。
[0365]
164.根据实施方案159至163中任一项所述的方法,其中所述溶瘤病毒保留在所述免疫细胞中直至所述免疫细胞与所述个体的肿瘤相互作用。
[0366]
165.根据实施方案159至164中任一项所述的方法,其中在所述溶瘤病毒的隐蔽期期间向所述个体施用所述稳定的免疫细胞群体。
[0367]
166.根据实施方案159至165中任一项所述的方法,其中所述免疫细胞为自体细胞。
[0368]
167.根据实施方案159至165中任一项所述的方法,其中所述免疫细胞为同种异体细胞。
[0369]
168.根据实施方案159至167中任一项所述的方法,其中所述稳定的免疫细胞群体通过血管内、皮下、腹膜内或肿瘤内注射施用。
[0370]
169.根据实施方案159至168中任一项所述的方法,其中所述溶瘤病毒为牛痘病毒。
[0371]
170.根据实施方案169所述的方法,其中所述牛痘病毒包括病毒胸苷激酶(tk)基因和/或病毒生长因子(vgf)基因中的突变。
[0372]
171.根据实施方案169或170所述的方法,其中所述牛痘病毒包括病毒胸苷激酶基因中的突变。
[0373]
172.根据实施方案169至171中任一项所述的方法,其中所述牛痘病毒包括病毒生长因子(vgf)基因中的突变。
[0374]
173.根据实施方案159至172中任一项所述的方法,其中所述溶瘤病毒具有复制能力。
[0375]
174.根据实施方案169至173中任一项所述的方法,其中所述牛痘病毒为eev病毒。
[0376]
175.根据实施方案159至174中任一项所述的方法,其中所述细胞以约0.01的感染复数(moi)至约10的moi被所述溶瘤病毒感染。
[0377]
176.根据实施方案159至175中任一项所述的方法,其中在37℃用所述溶瘤病毒感
染所述细胞约2小时。
[0378]
177.根据实施方案159至176中任一项所述的方法,其中所述稳定的免疫细胞群体包括细胞因子-诱导的杀伤(cik)细胞。
[0379]
178.根据实施方案177所述的方法,其中所述cik细胞为cd3+/cd56+细胞。
[0380]
179.根据实施方案177或178所述的方法,其中保持或提高所述群体中的cik细胞的百分比。
[0381]
180.根据实施方案159至176中任一项所述的方法,其中所述稳定的免疫细胞群体包括cd3+/cd56+细胞。
[0382]
181.根据实施方案180所述的方法,其中保持或提高所述群体中的cd3+/cd56+细胞的百分比。
[0383]
182.根据实施方案159至181中任一项所述的方法,其中所述稳定的免疫细胞群体包括nkg2d+细胞。
[0384]
183.根据实施方案182所述的方法,其中保持或提高所述群体中的nkg2d+细胞的百分比。
[0385]
184.根据实施方案182或183所述的方法,其中保持或提高cd3+/cd56+/nkg2d+细胞的百分比。
[0386]
185.根据实施方案159至184中任一项所述的方法,其中所述稳定的免疫细胞群体的存活率大于约70%。
[0387]
186.根据实施方案185所述的方法,其中通过台盼蓝拒染法或通过流式细胞术测量细胞的存活率。
[0388]
187.根据实施方案159至186中任一项所述的方法,其中所述免疫细胞源于外周血单核细胞(pbmc)。
[0389]
188.根据实施方案159至187中任一项所述的方法,其中在约1升至约10升的培养基中培养步骤a)的免疫细胞。
[0390]
189.根据实施方案159至188中任一项所述的方法,其中在约1升或约5升的培养基中培养步骤a)的免疫细胞。
[0391]
190.根据实施方案159至189中任一项所述的方法,其中培养步骤a)的免疫细胞约28天、约32天、约36天或约40天。
[0392]
191.根据实施方案159至190中任一项所述的方法,其中将步骤c)的细胞保持在室温。
[0393]
192.根据实施方案159至191中任一项所述的方法,其中室温为约22℃。
[0394]
193.根据实施方案159至192中任一项所述的方法,其中将步骤c)的细胞保持在约2℃至约8℃。
[0395]
194.根据实施方案159至193中任一项所述的方法,其中将步骤c)的细胞保持在袋中。
[0396]
195.根据实施方案194所述的方法,其中所述袋为塑料袋。
[0397]
196.根据实施方案194或195所述的方法,其中所述袋为不透气的。
[0398]
197.根据实施方案159至196中任一项所述的方法,其中将步骤c)的细胞保持在《1%co2中。
[0399]
198.根据实施方案159至197中任一项所述的方法,其中将步骤c)的细胞保持在盐溶液中。
[0400]
199.根据实施方案159至198中任一项所述的方法,其中将步骤c)的细胞保持在中。
[0401]
200.根据实施方案198或199所述的方法,其中所述盐溶液基本上不含血清和/或生长因子。
[0402]
201.根据实施方案159至200中任一项所述的方法,其中将步骤c)的细胞保持在暗处。
[0403]
202.根据实施方案153或154所述的组合物,其用于治疗个体的癌症。
[0404]
203.根据实施方案153或154所述的组合物用于制备用于治疗个体的癌症的药物的用途。
[0405]
实施例
[0406]
实施例1
[0407]
以一升培养规模和5升制备规模研究保持时间和病毒感染对于免疫细胞稳定性和激活的影响。
[0408]
材料和方法
[0409]
cik细胞扩增的概述
[0410]
cik细胞扩增过程的描述
[0411]
在供体筛选之后,将通过未刺激的单采术从患者身上收集足够数量的细胞(>10
10
个细胞)且以等分试样冷冻保存。在适当时间,将细胞解冻,且在透气袋或烧瓶中,cik培养物将用适当含量的在生长培养基中细胞接种。将视需要更换培养基。
[0412]
在培养的第18天,将获得的样本用于qc测试。根据在第14至21天的细胞计数和存活率,收集细胞。将移出样本以用于最终释放测试,包括表型和细胞毒性评估。
[0413]
crx100的最终悬浮液的制备
[0414]
一旦cik细胞已完成扩增且满足释放要求,则将收获cik细胞且洗涤并置于“血袋”中以用于随后递送至患者体内。移出样本且送至临床实验室以用于无菌性测试、表型分析和细胞毒性分析。
[0415]
然后,将含有所收获cik细胞的袋带至生物安全/隔离室(biosafety/isolation room)内,在所述生物安全/隔离室内解冻材料且与病毒混合(以满足指定剂量需要)。
[0416]
温和地摇动细胞和病毒且在封闭血袋中孵育。关于病毒的所有工作均在隔离室内的生物安全罩内完成。将袋在隔离室内孵育至少2小时(或直至返回无菌性测试的结果,通常2小时)以允许cik细胞感染出现。此溶液将在产物释放的24小时内使用。
[0417]
容器封闭系统
[0418]
将牛痘病毒储存于2ml一次性玻璃瓶中,所述玻璃瓶将储存在-80℃。在透气的细胞培养袋中进行cik细胞的扩增过程。这些物料袋(sourced bag)由单网聚烯烃透气膜制成。其具有整合式管以允许停留在封闭系统中同时进行填充、进料和取样。所述袋用于收获、扩增cik细胞的细胞培养物。对于crx100悬浮液的转移和输注而言,使用非渗透性的charter 500ml转移包装。
[0419]
在1升规模的cik细胞的分离和培养
[0420]
人类外周血单核细胞(pbmc)是获自新鲜leukopak(allcells,alameda,ca)且在1l透气袋(charter medical,winston-salem,nc)中的40ml 5%人类ab-血清aim-v培养基(thermofisher,waltham,ma)中悬浮培养。在第0天,用400μl的5μg/ml ifn-γ(r&d systems,minneapolis,mn)处理细胞培养物。在第1天,将1mg/ml抗-cd3 mab okt3(takara bio,mountain view,ca)和100μg/ml人类重组il-2(r&d systems,minneapolis,mn)添加至各培养物中。将细胞因子-诱导的杀伤(cik)细胞培养物在加湿的5%co2环境中在37℃孵育。每3-4天获取培养物样本。使用台盼蓝拒染法获得细胞计数。通过流式细胞术分析细胞表面标记。如果细胞密度超过3
×
106个细胞/毫升,则培养物用培养基稀释以使培养物恢复至2
×
106个细胞/毫升。在每次培养过程中,用300iu/ml il-2重新处理培养物。如果扩增袋的总体积超过500ml,则在另外稀释之前,将培养物分至两个1l扩增袋中。
[0421]
cik细胞的收获和洗涤
[0422]
在培养物扩增的第21天至第32天,收获免疫细胞且使用cobe2991cell processor(terumo,bct,lakewood,co)和(baxter int.,deerfield,il)洗涤。将所收获细胞收集于400ml液体转移袋(fluid transfer bag;ftb)中且用另外稀释直至达到8.57
×
106个细胞/毫升的密度。测定所收获细胞的总细胞计数、百分比产率和初始体积。使用管封口机,将所收获免疫细胞悬浮液均匀拆分在两个ftb之间。将具有chemolock系统(icu medical,san clemente,ca)的袋穿刺针插入各ftb中。培养物扩增袋和ftb的气体交换规格可见于表1中。
[0423]
表1.气体交换规格
[0424]
袋o2co2水蒸气ftb-400s pvc75050008charter exp-pak eva220090003.9metrix eva110060004.7
[0425]
cik细胞的保持过程
[0426]
将细胞悬浮液保持在环境室温(22℃
±
5℃)或37℃。在无搅动,同时平放于第二容器内的情况下,将两个ftb保持在暗处。将在下表2中所示的时间点自各ftb获取样本,且将进行以下分析:存活率%、流式细胞术和外观。
[0427]
表2.取样时间表
[0428]
[0429][0430]
v=细胞的存活率%
[0431]
f=流式细胞术
[0432]
a=外观
[0433]
培养物的取样以用于细胞计数和流式细胞术。
[0434]
紧接在两个ftb的制备之后,自各袋取0.5ml样本且进行初始细胞计数。在各培养物获取期间,用凸形chemolock末端(male chemolock ending),将3ml注射器与chemolock口连接。在获取之前,袋穿刺针和3ml注射器上的chemolock表面用ipa擦拭布清洁。自其第二容器移出培养物,且通过紧接在取样前的一系列360
°
旋转运动(nutating movement)变为均质悬浮液。连接袋上的chemolock口和注射器,同时袋保持为竖直地。倒置袋以便注射器现在在底部,且使袋内部的袋穿刺针浸没在产物中。然后,收集0.5ml产物样本且转移至1.5ml螺帽管中。
[0435]
分析测试
[0436]
百分比存活率。通过台盼蓝拒染法评估各ftb内的细胞的存活率。将25μl样本与25μl 0.4%台盼蓝(vwr,radnor,pa)染料混合(形成1:2稀释),且在转移至标准neubauer计数腔中之前孵育1分钟。使用相差在40
×
放大倍数下手动地计数活细胞和死细胞。如下测定百分比存活率:
[0437][0438]
流式细胞术。使用流式细胞术来鉴别细胞表面标记且表征细胞亚群。评估以下细胞表面标记:cd3、cd56和cd314(biolegend,san diego,ca)。sytox蓝(biolegend,san diego,ca)也用作存活率染料。将样本稀释为2
×
106个细胞/毫升。向待处理的96孔板中的每孔添加150μl各样本。然后,将各孔与含1μl的各抗体储备液(cd3、cd56和cd314)的50μl ab-结合缓冲液(biolegend,san diego,ca)一起在4℃孵育,洗涤2次,且最终重悬于具有2μl100
×
sytox蓝工作储备溶液的100μl pbs(corning,corning,ny)中。
[0439]
外观。在各培养物获取期间进行各ftb的外观的描述。定性评估浊度、颜色和细胞凝集。如果细胞悬浮液仍然清澈,则将所述袋描述为“ok”。如果在稳定性研究过程期间,样本的颜色或浊度显著地变化,则将对样本进行革兰氏染色以测定是否已出现细菌污染。
[0440]
研究标准
[0441]
在自各转移袋获取之后立即处理样本。立即处理(抗体染色和洗涤)流式细胞术样本,且视需要在于流式细胞仪中分析之前储存在4℃至多2小时。如果在各测试时间点获得的所有数据均满足表3中所述的相关稳定性规格,则认为此保持研究为成功的。
[0442]
表3.接受标准
[0443]
参数接受标准细胞存活率≥70%流式细胞术≥4%cd3+/cd56+外观无色至微黄色革兰氏染色没有可检测到的生物
[0444]
对于5l规模和更大规模而言的方法.
[0445]
crx100由自新鲜收集或解冻的外周血细胞培养且与牛痘病毒(vvdd)组合的细胞因子-诱导的杀伤(cik)细胞组成,为将在gmp条件中制备的实验性自体细胞疗法。为了证实建议制备方法的可行性和挑战且确认在技术转移期间书写的程序的效用,将进行至少两轮工程改造过程,从而产生两个独特批次的crx100产物。方案分为两个部分:(1)解决cik细胞的制备;和(2)解决最终药物产物crx 100的制备。第1部分可在未完成第2部分的情况下完成。此方案描述生产和测试活性以及将用于证实成功制备最终crx100产物的接受标准。自这些生产批次和特征分析收集的数据可支持监管提交。
[0446]
研究设计
[0447]
图1是描述事件的工程改造方法顺序和此研究中进行的测试的高级方法流程图。
[0448]
crx100细胞产物制备方法包括两个主要阶段:1)批量细胞产物(cik)产生;和(2)最终药物产物(crx100)产生。
[0449]
制备程序的批量细胞物质(cik)产生阶段包括:用新鲜外周血细胞接种2
×
5l exp培养袋,将培养物保持21天时段,和cik细胞的收获、配制和填充至最终输注袋中。
[0450]
crx100最终产物的产生包括解冻vvdd原料药,且将病毒与cik细胞在最终输注袋中组合,以及完成快速释放测试和产生中期coa,将在此方案中解决。
[0451]
cik细胞代表一小部分的外周血t细胞,且其离体扩增为获得用于临床应用的足够细胞所必需的。在收获用于输注之前,在透气的培养袋中孵育cik细胞至少21天。当冷冻保存时cik细胞丧失活性,因此当前试验是基于新鲜输注细胞。因此,在收获细胞的几个小时内完成释放测试至关重要。培养物可从新鲜收集或冷冻保存的外周血细胞开始,如方案所规定。通常,cik细胞培养物显示在前四天期间,所有外周血表型下降,除了cd3+细胞,其后cd3+细胞显示快速扩增,其中表达nkg2d受体(cd314)的细胞毒性细胞在所收获细胞产物中占优势。此群体中的细胞亚群共表达cd3和cd56。由于历史原因,追踪cd3+cd56+亚群,其作为培养物中存在的细胞毒性细胞的总体扩增的指标。
[0452]
试剂制备
[0453]
具有5%热灭活人类ab血清的aim-v培养基的制备。
[0454]
aim-v培养基由其制造商在10升袋中供应。对于各培养物,应使用新鲜袋的培养基。当培养基制备开始时,将完成的cik细胞培养基标记贴附至袋上。用人类ab血清制备的各袋被认为是一个独特批次的培养基。其经指定用于仅与预期接受体的cik细胞培养物一起使用。然后,以5%的浓度将无菌热灭活的人类ab血清添加至aim-v培养基中。将所制备的cik细胞培养基储存在2-8℃,避光。
[0455]
干扰素-γ的制备
[0456]
此工作稀释液将在培养当天制备且必须在制备的24小时内使用。将使用0.5ml、含有100mcg或2百万iu且储存在20℃的干扰素γ小瓶来进行其制备。将干扰素小瓶(0.5ml)的
内含物添加至19.5ml无菌水中,得到最终浓度为100,000iu/ml或5mcg/ml的工作稀释液。
[0457]
阿地白介素(proleukin)il-2的制备
[0458]
此工作溶液储备液应至少在使用前14天制备,以允许完成无菌测试。将使用浓度为1.0mg或2100万iu/小瓶且储存在-20℃的小瓶来进行其制备。使用无菌技术,将使用1ml的100mm乙酸(r&d systems)来重构il-2小瓶。将重构后小瓶的内容物添加回剩余9ml的100mm乙酸中以得到2.1
×
106iu/ml的工作稀释液。
[0459]
将制备20份1ml等分试样且冷冻在2ml冷冻小瓶中。将保留大致1ml的il-2以用于无菌测试。
[0460]
orthoclone okt-3无菌溶液的制备
[0461]
储备溶液和工作稀释液至少在使用前14天制备,以允许完成无菌性测试。将从制造商的小瓶取出1ml okt3,以制备工作稀释液的冷冻等分试样。将储备溶液的剩余部分以1ml等分试样于经恰当标记后的冷冻小瓶中冷冻在-80℃。
[0462]
通过将1ml储备溶液(来自上文的新鲜小瓶或解冻的等分试样)添加至19ml normosol中(1∶20稀释度),来制备1mg/ml的okt-3工作稀释液。然后将3ml所述溶液添加至27ml normosol中(总计1∶200稀释度),得到5μg/ml的最终工作稀释液。将工作稀释液以3.5毫升/小瓶冷冻在八个5ml冷冻小瓶中,所述冷冻小瓶将经恰当标记。剩余工作稀释液的样本将用于无菌性测试。
[0463]
cik扩增
[0464]
培养物接种
‑‑
第0天
[0465]
如果已冷藏培养基,则允许在添加细胞之前将其升温至室温以避免细胞应激。
[0466]
对于使用新鲜细胞的培养物制备而言,如果先前未完成流式细胞术,首先将获取样本以用于nc计数、hct、分化、存活率、abo/rh。然后,将对产物进行称重,且将基于1.06g/ml计算体积(如果先前未完成)。
[0467]
将cik细胞培养物以每毫升2
×
106个活tnc接种各细胞培养袋中的200ml培养物体积(也即,400
×
106个细胞/袋)。为了确保为方案制备足够的培养物体积,制备的总体积应确定为200ml
×
(规定袋数+0.5袋)。
[0468]
将所需体积的细胞悬浮液和干扰素-γ添加至培养基填充的转移包装中,且其后各自温和但充分地混合。夹出5l细胞培养袋的上部1/3,以便产生用于适合于200ml培养物的气体交换的表面积。使用无菌衔接装置和配衡天平(tared balance),将212g(200ml)培养物悬浮液转移至各培养袋中。将所有cik细胞培养袋进行恰当标记且置于37℃孵育箱中。
[0469]
起始cik细胞扩增
‑‑
第+1天
[0470]
在接种后18-24小时,将il-2和okt3添加至培养物中,以为培养中的t细胞扩增提供必需的信号。添加il-2至培养袋中300iu/ml的最终浓度,且添加okt3至50ng/ml的最终浓度。
[0471]
保持细胞扩增
‑‑
第+4天至培养物收获
[0472]
配制cik细胞培养物以促进接种物中存在的t细胞亚群的生长和分化。因此,其他细胞类型不存活,且培养物初始显示细胞数目和存活率显著降低,其中在第+3天或第+4天出现最低点,其后细胞数目和存活率增加。存活细胞将主要为cd3+(t细胞)。
[0473]
将从培养箱取出培养物,且每3-4天针对细胞计数、存活率和亚群表示进行评估,
以测定培养物生长和活性。为了避免不必要地进入所有培养袋,在培养期间,将一个袋用作参考袋。
[0474]
当细胞浓度达到3
×
106个细胞/毫升时,应在下一预定的计数之前基于预期细胞生长速率评价对另外培养基的需求。为了获得最佳生长,细胞浓度不应超过4
×
106个细胞/毫升。不管在计数时的细胞浓度如何,必须每3-4天添加il-2以保持扩增。
[0475]
收获前准备
[0476]
在培养物收获前三天(例如21天培养的第+18天)为最后一次进入培养袋,直至收获。应进行细胞计数和存活率。应视需要添加培养基和il-2,且应自各袋制备样本以用于收获前无菌性测试和支原体(mycoplasma)测试。
[0477]
cik细胞培养物收获准备
[0478]
在收获之前。获取样本以用于无菌性测试、支原体、内毒素、nc和存活率测试、洗后细胞毒性分析、流式细胞术。vvdd/cik-crx100悬浮液的制备
[0479]
一旦cik细胞已完成扩增且满足释放要求,则将其收获,洗涤两次且重悬于normosol(hospira)和1%人类血清白蛋白中且置于“血袋”中。移出样本且送至临床实验室以用于无菌性测试、表型分析和细胞毒性分析。
[0480]
然后将含有所收获cik细胞的袋带至生物安全/隔离室内,且经疫苗接种的技术人员将通过解冻和稀释病毒(根据指定剂量的要求)准备材料。将通过含有cik细胞的袋的隔膜小心地注射各剂量。
[0481]
crx100最终产物的产生包括解冻vvdd原料药,且将病毒与cik细胞在最终输注袋中组合,以及完成快速释放测试和产生中期coa。
[0482]
vvdd病毒的解冻
[0483]
将达成xx的moi的计算体积的vvdd在37℃水浴中解冻,其中在解冻过程期间连续涡旋小瓶。当最后的冰晶体已解冻时,迅速地移出小瓶。
[0484]
vvdd与批量细胞物质的组合
[0485]
crx100评估和释放
[0486]
隔离保留crx100,直至已完成所有释放测试且已满足所有释放标准。
[0487]
属性(identity))/纯度分析:
[0488]
将通过此基于流式细胞术的分析来评估在各监测点的代表样本。通过表面染色(cd3、cd56、nkg2d),此分析可检测自细胞群体表达的指定标记的表达量。此分析的方案已由bioeclipse提供且将在actl获得认证。x的频率应为nmt x%。
[0489]
外观分析:
[0490]
将视觉检查最终cik批量细胞物质以评估外观。此分析的接受标准为确认无色至微黄色外观。将验证袋完整性为完整的且将验证标记信息为准确的。
[0491]
效力分析:
[0492]
效力分析为cd3+cd56+cik细胞制剂中nkg2d+细胞的数目。cd3+cd56+cik细胞应至少占4%的总细胞群体。cik细胞药物物质的效力为以下的非依赖性组合效果:1)cik细胞通过其自身表面上的nkg2d受体和肿瘤细胞表面上的nkg2d配体与肿瘤细胞结合,从而引发孔蛋白(dap 10路径)细胞毒性反应;和2)cd3+cd56+cik细胞能够沿肿瘤细胞起始的趋化因子梯度趋化性地进入肿瘤微环境以将溶瘤病毒释放至肿瘤中。由于用vvdd复制性溶瘤病毒感
染肿瘤细胞引起在肿瘤细胞表面上表达nkg2d配体,所以核心效力集中在感染肿瘤细胞的病毒周围。因此,当含有所有达到肿瘤细胞且扩增信号以募集更多治疗剂的要素时,识别具有nkg2d受体的cd3+cd56+细胞。利用活性胸苷激酶池和ras路径,vvdd病毒能够进入所有肿瘤细胞且在其中复制。此在>70%的肿瘤中都有体现。我们已利用crx100,以1∶1moi和10:1moi的病毒与cik细胞进行动物模型,其中效力方面无差异。我们也对于杀伤uci 101和淋巴瘤细胞系进行体外细胞毒性分析,证明在极低水平的效应物:目标比率,细胞/病毒组合的协同性。
[0493]
结果
[0494]
1升培养研究
[0495]
保持研究1.在1升透气袋中,使用pbmc来扩增和选择nkt、nk和t细胞。在培养第32天收获细胞,洗涤,分开置放于两个不透气袋的一个中。在无搅动的情况下,将样本储存在暗处,22℃或37℃。在0至72小时的时间点抽取样本且进行测试。通过两种方法评估在rt和37℃的存活率:台盼蓝拒染法和流式细胞术中的sytox蓝试剂。也测量群体中的cik(定义为cd3+/cd56+)细胞的百分比。也测量表达cd314的cik细胞的百分比。此稳定性研究表明,扩增的免疫细胞保留高于86%的存活率,其中在rt达48小时的cik%无显著变化。发现cik细胞的cd314表达增加。储存在37℃的细胞的台盼蓝存活率在12小时时下降低于70%。结果显示于表4中。
[0496]
表4.保持研究1
‑‑
在环境室温(22℃)或37℃的cik细胞
[0497][0498]
保持研究2.使用来自保持研究1的用于扩增和选择nkt、nk和t细胞的相同的pbmc
培养物。在培养第39天收获细胞,洗涤,分开置放于两个不透气袋的一个中。在无搅动的情况下,将样本储存在暗处,22℃或37℃。在0至72小时的时间点抽取样本并进行测试。通过两种方法评估在rt和37℃的存活率:台盼蓝拒染法和流式细胞术中的sytox蓝试剂。也测量cik细胞%。此稳定性研究表明,扩增的免疫细胞保留高于86%的存活率,其中在rt达48小时的cik%无显著变化。储存在37℃的细胞的台盼蓝存活率在12小时时下降低于70%。对于保持在环境温度和在37℃的细胞而言,cik细胞的cd314表达增加。结果呈现于表5中。
[0499]
表5.保持研究2
‑‑
在环境室温(22℃)或37℃的cik细胞
[0500][0501]
5l培养研究
[0502]
在5升培养中,使用pbmc来扩增和选择nkt、nk和t细胞。在第21天,在进行初次取样之后,将两个培养袋与cobe 2991细胞处理器连接。浓缩来自培养物的细胞且用收获缓冲液(具有0.5%hsa的a)洗涤三次。然后将经洗涤细胞置放于两个不透气袋的一个中。在无搅动的情况下,将样本储存在暗处,室温(22℃)或37℃。在表6中显示的自0至77小时的时间点,抽取0.5ml样本且进行测试。通过两种方法评估在rt和37℃的存活率:台盼蓝拒染法和流式细胞术中的sytox蓝。cik(定义为cd3+/cd56+)百分比测量为cd3+细胞百分比和cd314+细胞百分比。此保持研究表明,扩增的免疫细胞在77小时保留高于85.8%的存活,其中在研究期间cik细胞%无显著下降。替代地,储存在37℃的细胞在53小时呈现27%的台盼蓝存活率。群体中的cd314+细胞百分比随着时间推移而增加。结果呈现于表6和图2至图6中。
[0503]
表6.来自在环境室温(22℃)或37℃的5l培养物的细胞(cik细胞)的稳定性
[0504][0505]
来自保持在环境温度或37℃的5l感染病毒的培养物的细胞的存活率研究
[0506]
如上文所述,在5升培养中,使用pbmc来扩增nk、nkt和t细胞。在培养21天之后,在37℃,以0.01(低剂量)或1.0(高剂量)的moi,用缺失tk和vgf基因的溶瘤牛痘病毒(vvdd)感染细胞两小时。然后如上文所述将细胞置于不透气的袋中且保持在环境温度或37℃。在不同时间,移出样本且分析细胞存活率和cik细胞(cd3+/cd56+)、cd3+和cd314+细胞百分比。
[0507]
低剂量感染的培养物的结果呈现于表7和图7中。当保持在室温时,细胞存活率在70小时内仍较高。在研究过程中,存在cik细胞下降和cd314+细胞增加。临床上可接受的cik细胞百分比为4%。
[0508]
表7.在环境室温(22℃)和37℃,低剂量vvdd
[0509][0510]
高剂量感染的培养物的结果呈现于表8和图8与图9中。当保持在室温时,细胞存活率在70小时内仍较高。对于临床应用,70%的存活率为可接受的。如同低剂量,在研究过程中,存在cik细胞下降和cd314+细胞增加。
[0511]
表8.在环境室温(22℃)和37℃,cik细胞+高剂量vvdd
[0512][0513][0514]
由第二个五升培养物制备nkt、nk和t细胞。在37℃将细胞与高剂量的病毒混合,且在无搅动的情况下储存在室温或37℃的暗处。如上文所述获得样本且针对存活率和细胞表面标记进行分析。结果显示于表9中。存活率仍较高且本发明cik细胞保持恒定至少48小时。
[0515]
表9.在环境室温(22℃)和37℃,cik细胞+高剂量vvdd
[0516][0517]
实施例2
[0518]
进一步研究免疫细胞的稳定性和激活。如实施例1中所述生长和处理五升培养物,其他修改如下文所述。
[0519]
如实施例1中所述,在5升培养物中,使用pbmc来扩增nk、nkt和t细胞。在培养21天之后,在37℃,以1.0(高剂量)的moi,用缺失tk和vgf基因的溶瘤牛痘病毒(vvdd)感染细胞两小时。然后如上文所述将细胞置于不透气的袋中且保持在环境温度或37℃。在不同时间,移出样本且分析细胞存活率和cik细胞(cd3+cd56+)、cd3+和cd314+细胞百分比。
[0520]
结果呈现于表10中。当保持在室温时,细胞存活率在48小时内仍较高。在研究过程中,存在cik细胞下降和cd314+细胞增加。
[0521]
表10.在环境室温(22℃)和37℃,cik细胞+高剂量vvdd
[0522][0523][0524]
在第二组研究中,在用牛痘病毒感染之前,在室温将细胞储存在中24小时。如表11中所示,细胞在室温在病毒感染前24小时保持期内保持活力且在感染后至少24小时保持活力。在感染之后,保持在37℃的细胞的存活率存在下降。值得注意的是,
群体中的cik细胞的百分比保持且nkg2d+(cd314+)细胞的百分比增加。
[0525]
表11.在感染之前环境室温(22℃)保持.
[0526][0527][0528]
在第三组研究中,在用牛痘病毒感染之前,在2-8℃将细胞储存在中24小时。如表12中所示,细胞在2-8℃在病毒感染前24小时时期保持活力且在感染后在室温至少24小时保持活力。在感染之后,保持在37℃的细胞的存活率下降。值得注意的是,群体中的cik细胞的百分比在2-8℃保持期间保持且在感染后增加。nkg2d+(cd314+)细胞的百分比在2-8℃保持期间增加。
[0529]
表12.在感染之前环境室温(22℃)保持。
[0530][0531][0532]
实施例3
[0533]
评价在不透气袋中孵育后免疫细胞和肿瘤细胞的脱粒。
[0534]
材料和方法
[0535]
cik细胞的扩增和运送
[0536]
在加州圣地亚哥的advanced cell therapy laboratory(actl)中自人类外周血单核细胞(pbmc)培养和扩增细胞因子-诱导的杀伤(cik)细胞。pbmc获自leukopak(allcells,alameda,ca)且在1l透气袋中的40ml aim-v培养基+5%人类ab-血清中悬浮培养。在第0天,用400μl的5μg/ml ifn-γ处理细胞培养物。在第1天,将1mg/ml抗-cd3 mab okt3和100μg/ml人类重组il-2添加至培养袋中。在37℃在加湿的5%co2环境中孵育cik细胞培养物。如果细胞密度超过3
×
106个细胞/毫升,则培养物用培养基稀释以使培养物恢复至2
×
106个细胞/毫升。每3-4天,用300iu/ml il-2再处理培养物。如果扩增袋的总体积超过500ml,则在另外稀释之前,将培养物分至两个1l扩增袋中。在培养的第21天,细胞使用cobe2991细胞处理器(terumo bct,lakewood,co)与(baxter int.,deerfield,il)洗涤。将所收获的细胞收集在400ml流体转移袋(ftb)中且用+5%人类ab-血清稀释直至达到约8.57
×
106个细胞/毫升的密度。将具有所收获的免疫细胞的ftb置于容器中且连夜运送至open medicine institute(mountain view,ca)。第二天上午收到ftb。
[0537]
效应细胞系的制备
[0538]
将chemolock袋穿刺针插入含有扩增的免疫细胞的ftb中。将具有luerlock系统的3ml注射器与凹形chemolock口连接和与插入ftb中的袋穿刺针连接。然后将ftb平坦放入抽屉中的第二容器中在环境温度(22℃)保持不搅动。使用注射器抽取2.0ml样本,且转移至标记有“效应细胞”的5.0ml扣盖管(snap-cap tube)中。抽取25μl用于存活率的初始评估,且使用血球计和台盼蓝染色进行细胞密度评估(参见分析测试—百分比存活率)。记录活细胞的百分比和免疫细胞的初始细胞密度。剩余“效应细胞”在400
×
g离心5分钟且用pbs洗涤两次。然后将细胞重悬于aim-v培养基(thermofisher,waltham,ma)中直至细胞密度达到8.57
×
106个细胞/毫升。
[0539]
靶细胞系的制备和染色
[0540]
在具有aim-v培养基的t75培养瓶中制备慢性粒细胞白血病细胞(k-562)的10ml悬浮培养物。在接收来自actl的免疫细胞前一天,拆分k-562细胞,使细胞密度保持在4
×
106个细胞/毫升。使用5ml玻璃移液管自t75培养瓶获取k-562细胞的1.2ml样本,且将其转移至标记有“靶细胞”的1.5ml管中。使用血球计数器和台盼蓝染色获得存活率和细胞密度(参见分析测试—百分比存活率)。
[0541]
橙色细胞追踪剂(cell tracker orange;cto)(thermo fisher,waltham,ma)用作k-562细胞系的标记。将9μl细胞培养级二甲亚砜(dmso)(vwr,radnor,pa)添加至50μg cto染料中。将2μl cto/dmso溶液添加至2ml无血清aim-v培养基中,产生10μm cto溶液。剩余“靶细胞”在400
×
g离心5分钟且重悬于1ml aim-v无血清培养基中以达到5
×
106个细胞/毫升的浓度。将2ml cto溶液添加至细胞悬浮液中且在37℃在5%co2中孵育30分钟。然后,k-562细胞用aim-v培养基洗涤两次且重悬于2ml培养基中。进行另外的细胞计数以确认得到5
×
106个细胞/毫升的浓度。
[0542]
靶细胞和效应细胞的00小时孵育
[0543]
以表13中所述的相对浓度,将所收获的免疫(效应)细胞和k-562(目标)细胞共孵育。
[0544]
根据表13,将5.0ml扣盖管标记为1至6。基于在血球计计数期间测定的活细胞密度,将必需体积的靶细胞和效应细胞添加至其对应管中。然后,视需要将aim-v培养基添加至各管中,确保各共孵育精确地在1.0ml溶液中。将靶细胞和效应细胞在暗处在环境室温下共孵育30分钟。在30分钟之后,进行以下分析测试。
[0545]
表13.靶细胞与效应细胞的孵育比率
[0546]
样本e:t比率效应细胞群体靶细胞群体11∶00.5
×
10
6-20∶1-0.5
×
10631∶10.5
×
1060.5
×
106410∶15.0
×
1060.5
×
106540∶120.0
×
1060.5
×
106640∶020.0
×
10
6-[0547]
分析测试
[0548]
百分比存活率.通过台盼蓝拒染法评估各ftb内的细胞的存活率。将25μl样本与25μl 0.4%台盼蓝(vwr,radnor,pa)染料混合染色(形成1∶2稀释液),且在转移至标准neubauer计数腔中之前孵育1分钟。使用相差在40
×
放大倍数下手动地计数活细胞和死细胞。存活率百分比测定如下:
[0549]
存活率%=(活细胞数)/(活细胞数+死细胞数)
×
100
[0550]
流式细胞术.使用流式细胞术来鉴别细胞表面标记,且特征在于效应细胞与目标(k-562)细胞结合且分泌细胞毒性分子时效应细胞的脱粒。简而言之,脱粒作为效应细胞的细胞毒性的指标。cd107a(biolegend,san diego,ca)用作脱粒的标记。此外,也评估以下细胞表面标记:cd3、cd56和cd314(biolegend,san diego,ca)。使用cto来区分效应细胞和靶细胞,而sytox蓝(biolegend,san diego,ca)表明各亚群的存活率。将样本稀释为2
×
106个细胞/毫升。在待处理的96孔板的每孔中添加150μl各样本。然后,将各孔与含1μl各抗体储备液(cd3、cd56、cd314和cd107a)的50μl ab-结合缓冲液(biolegend,san diego,ca)在4℃一起孵育,洗涤2次,且最终重悬于具有2μl 100
×
sytox蓝工作储备溶液的100μl pbs(corning,corning,ny)中。
[0551]
靶细胞和效应细胞的24小时孵育
[0552]
在30分钟后,再次进行k-562和免疫细胞的共孵育24小时。也进行存活率和流式细胞术分析。
[0553]
结果
[0554]
使用流式细胞术来鉴别细胞表面标记,且特征在于效应细胞与靶细胞结合且分泌细胞毒性分子时效应细胞的脱粒。在t=0小时(在中的四小时共孵育)的结果呈现于表14中且在t=24小时(在培养基中30分钟共孵育)的结果呈现于表15中。
[0555]
表14
[0556][0557]
表15
[0558][0559]
在1∶0和40∶0比率(在不存在k-562肿瘤细胞下)cd107a呈阳性的cik细胞的百分比显示于图10中。
[0560]
实施例4
[0561]
以一升培养规模和5升制备规模研究在4℃或室温保持情况下保持时间和病毒感染对于免疫细胞稳定性和激活的影响。
[0562]
材料和方法
[0563]
cik细胞扩增的概述
[0564]
cik细胞的分离和培养.
[0565]
人类外周血单核细胞(pbmc)是从leukopak(stemexpress,folsom,ca)获取且在aim-v培养基+5%人类ab血清(thermofisher,waltham,ma)中悬浮培养。将细胞接种于5l透气袋(1号袋和2号袋)(charter medical,winston-salem,nc)中。将200ml(2.76
×
106个细胞)接种于1号袋中,将200ml(2.25
×
106个细胞)接种于2号袋中,且将30-40ml接种于3号袋中。在第0天,用2ml的5μg/ml ifn-γ(r&d systems,minneapolis,mn)处理细胞培养物。在第1天,将1mg/ml抗-cd3 mab okt3(takara bio,mountain view,ca)和100μg/ml人类重组il-2(r&d systems,minneapolis,mn)添加至各培养物中。将细胞因子-诱导的杀伤(cik)细胞培养物在加湿的5%co2环境中在37℃孵育。每3-4天获取培养物样本。使用台盼蓝拒染法获得细胞计数。通过流式细胞术分析细胞表面标记。如果细胞密度超过3
×
106个细胞/毫升,则培养物用培养基稀释以使培养物恢复至2.3
×
106个细胞/毫升。在各培养物获取期间,用300iu/ml il-2处理培养物。如果扩增袋的总体积超过2.5l,则在另外稀释之前,将培养物分至两个5l扩增袋中。
[0566]
cik细胞的收获和洗涤
[0567]
在培养扩增的第20天,收获免疫细胞且使用cobe 2991细胞处理器(terumo,bct,lakewood,co)和+0.5%人类ab血洗涤。将所收获细胞收集于400ml流体转
移袋(ftb)中且用另外稀释直至达到6.0
×
106个细胞/毫升的密度。测定所收获细胞的总细胞计数、百分比产率和初始体积。使用管封口机,将所收获免疫细胞悬浮液均匀拆分在两个ftb之间。将具有chemolock系统(icu medical,san clemente,ca)的袋穿刺针插入各ftb中。培养扩增袋和ftb的气体交换规格如实施例1中所述。
[0568]
cik细胞的保持过程
[0569]
将细胞悬浮液保持在4℃、环境室温(22℃
±
5℃)或37℃。在无搅动同时平坦位于第二容器内的情况下,将ftb保持在暗处。在不同时间点自各ftb获取样本,且将进行以下分析:存活率%、流式细胞术和外观。
[0570]
培养物的取样以用于细胞计数和流式细胞术.
[0571]
紧接在两个ftb的制备之后,自各袋获取0.5ml样本且进行初始细胞计数。在各培养物获取期间,用凸形chemolock末端,将3ml注射器与chemolock口连接。在获取之前,袋穿刺针和3ml注射器上的chemolock表面用ipa擦拭布清洁。自其第二容器移出培养物,且通过紧接在取样前的一系列360
°
旋转运动变为均质悬浮液。连接袋上的chemolock口和注射器,同时袋保持为竖直地。倒置袋以便注射器现在位于底部,且使袋内部的袋穿刺针浸没在产物中。然后收集0.5ml产物样本且将其转移至1.5ml螺帽管中。
[0572]
分析测试
[0573]
百分比存活率.通过台盼蓝拒染法使用tc20
tm
自动细胞计数器(bio-rad)测定细胞计数。
[0574]
流式细胞术.使用流式细胞术来鉴别细胞表面标记及表征细胞亚群。评估以下细胞表面标记:cd3、cd56和cd314(biolegend,san diego,ca)。zombie violet
tm
(biolegend,san diego,ca)用作另外存活率染料。将样本稀释至2
×
106个细胞/毫升。将250μl各样本添加至待处理的各facs管(vwr,radnor,pa)中。各管首先与85μl zombie violet
tm
(染料于1
×
pbs中的1∶1000稀释液)在室温一起孵育15分钟。然后将5μl各抗体储备液(cd3、cd56和cd314)添加至各经染色样本中且使其在4℃孵育30分钟。然后将样本洗涤2次,且在250μl固定缓冲液中在4℃孵育30分钟。最后一次洗涤样本且将其重悬于100μl细胞染色缓冲液(corning,corning,ny)中。
[0575]
外观.在各培养物获取期间进行各ftb的外观的描述。定性评估浊度、颜色和细胞凝集。如果细胞悬浮液仍然清澈,则将所述袋描述为“ok”。如果在稳定性研究过程期间,样本的颜色或浊度显著地变化,则将对样本进行革兰氏染色以测定是否已出现细菌污染。
[0576]
研究标准
[0577]
在自各转移袋获取之后,立即进行样本处理。立即处理(抗体染色和洗涤)流式细胞术样本,如有必要,在于流式细胞仪中分析之前储存在4℃至多2小时。如果在各测试时间点获得的所有数据均满足如实施例1中所述的相关稳定性规格,则此保持研究视为成功的。
[0578]
结果
[0579]
定量在整个不同样本(包括1号袋和2号袋)中的细胞浓度和百分比存活率。使用tc20
tm
自动细胞计数器(bio-rad),在20天时段内定量总细胞密度(细胞/毫升)。总体而言,在各袋间,细胞的总量、细胞浓度和存活率相当(图11a至图11c和表16),表明初始接种条件
并不影响培养物的最终组成。另外,百分比存活率随时间推移增加,且细胞的总量在整个实验持续时间内为稳定的。
[0580]
表16.细胞扩增概述
[0581][0582][0583]
使用流式细胞术来定量自1号袋和2号袋合并的样本内的cd3+细胞的百分比(表17)。cd3+细胞的百分比随时间推移而增加。第20天(测量的最后一天),cd3+细胞占样本内的所有细胞的99.20%(图12a)。cd3+与cd56+细胞的比率随时间推移而增加,表明培养物内的细胞毒性细胞存在总体扩增(图12b)。第20天,cd3+/cd56+细胞的百分比达到14.6%(图12b)。有趣的是,cd3-/cd56+细胞的百分比随时间推移而降低(图12c),表明培养物样本内的nk细胞群正在减少。在第21天,cd3-/cd56+细胞的百分比发现为0.45%,而在第0天的初始百分比为3.48%(图12c)。
[0584]
表17.按亚群对细胞进行的定量
[0585][0586]
进行另外测量以进一步定量样本内的细胞亚群。测定细胞培养物样本内呈淋巴细胞的cd314+细胞的总百分比。cd314细胞的百分比随时间推移而增加,在实验的第20天达到62.70%的终值(图13a)。接下来,t细胞的cd314+细胞的百分比比例,通过记录cd314+细胞与cd3+/cd56-细胞的比率来测定。如同对于所有淋巴细胞所观察到的,cd314+t细胞的百分
比随着时间推移而增加,在实验的第20天达到60.30%的最终记录百分比(图13b)。有趣的是,尽管t细胞特异性细胞标记表明培养物样本内的细胞的百分比随着时间推移扩大,但cd314+cik细胞群体随着时间推移仍稳定。在实验的第20天,cd314+cik细胞的百分比为75.60,而在第0天的初始值为约78%(图13c)。接下来,通过定量cd314+细胞相对于cd3-/cd56+细胞的百分比来分析cd314+nk细胞的总百分比。如同对于cik细胞所观察到的,nk细胞群体很大程度上不受总培养物孵育时间影响,其中第0天的初始测量为约99%且在第21天的最终测量为99.20%(图13d)。
[0587]
保持
[0588]
以6
×
106个细胞/毫升的密度接种三个袋,且将其储存在三个不同温度条件:1号袋储存在室温,2号袋储存在37℃,且3号袋储存在4℃。在孵育后0-115小时范围内,对于所有三个袋进行细胞浓度和细胞存活率测量。测量的概述提供于表18中。
[0589]
表18.在保持后温度对于细胞浓度和百分比存活率的影响
[0590][0591]
显示针对48小时和115小时的最大孵育时间,在不同储存温度在整个培养物中的细胞浓度的时间序列测量。总体而言,相对于保持在37℃的培养物,保持在室温和4℃的细胞培养物显示增加的细胞浓度(图14a)。在较长保持时间,储存温度的差异变得明显。保持在37℃的培养物的细胞浓度的变化率似乎大于室温或4℃储存的细胞的细胞浓度的变化率(图14b),其中37℃细胞随着时间推移更迅速地降低。也测量在不同温度条件间的细胞存活率。一般而言,在37℃孵育的细胞培养物中,细胞存活率在48小时内极大地降低(图15a)。相反,在室温或4℃孵育的培养物显示高的细胞存活率百分比,其在48小时时间范围内仍未受影响。在115小时,室温和4℃储存的培养物中的细胞存活率降低,而37℃孵育的培养物呈现稳定,但百分比细胞存活率比低温培养物更低(图15b)。
[0592]
接下来,在储存在不同温度的整个细胞培养物中,将各细胞亚群进行比较。使用流式细胞术来表征细胞,其中聚焦于定量cd3+表达和cd56+表达(图16a,表19)。随着培养物储存在37℃条件内至115小时,cd3+的百分比相对于在时间0时获取的初始测量极大地降低。在115小时孵育时间,储存在室温条件中的培养物的cd3+百分比略微降低。相反,4℃储存条件在所有所测量时间点中保持cd3+百分比,表明培养物在4℃比在其他所测量温度保持更稳定(图16a)。对于cd3+/cd56+细胞的百分比,在4℃储存条件与室温和37℃之间可见惊人的差异。自孵育的0至24小时,室温和4℃储存产生类似的百分比。在室温条件中,在32小时
开始,发现cd3+/cd56+稳固降低,且在115小时实验的整个剩余部分中,百分比继续降低。尽管在42至115小时之间,在室温的cd3+/cd56+的百分比自10.4%下降至3.5%,但发现储存在4℃的细胞的cd3+/cd56+%自12.7%增加至13.8%。储存在37℃的cd3+/cd56+细胞的百分比在较早时间在孵育后24小时开始降低,且在整个实验持续时间中,百分比也继续降低。室温和37℃储存条件的最终百分比分别为3.50%和2.10%,其均惊人地低于4℃(其含有13.8%)储存条件(图16b,表20)。
[0593]
表19.cd3+细胞的百分比
[0594]
小时室温37℃4℃098.798.798.7898.698.098.62498.795.098.63283.143.986.24297.974.998.111558.618.495.7
[0595]
表20.cd3+/cd56+细胞的百分比
[0596]
小时室温37℃4℃014.114.114.1812.111.812.72413.28.212.73212.49.513.84210.46.612.71153.52.113.8
[0597]
为了进一步表征细胞培养物内存在的免疫细胞,定量整个温度孵育条件中的cd3+/cd56-t细胞的百分比。保持在4℃的培养物在自0至120115小时的整个测量持续时间中保持稳定的百分比,其中终值为82%。类似地,室温孵育的细胞保持稳定的百分比,但在115小时开始降低至55.30%的值。最后,37℃孵育的细胞显示cd3+/cd56-t细胞的百分比极大降低,在115小时达到16.3%的值(图16c,表21)。相反,在整个孵育温度条件中,cd3-/cd56+nk细胞的百分比相当。一般而言,百分比仍较低且在整个时间中具有极小影响(图16d,表22)。
[0598]
表21.cd3+/cd56-%
[0599]
小时室温37℃4℃085.185.185.1886.586.385.82485.686.885.93270.834.872.84287.868.385.311555.316.382.0
[0600]
表22.cd3-/cd56+%
[0601]
小时室温37℃4℃
00.90.90.980.91.10.9240.82.00.8322.810.42.3420.81.20.81152.03.31.0
[0602]
定量在整个温度条件中的所有淋巴细胞的群体。在整个时间中,在室温与4℃孵育温度之间的cd314+细胞的百分比相当,且在115小时cd314群体具有微弱增加(图17a,表23)。相反,在37℃孵育的细胞在115小时具有极大的降低(图17a)。当相对于cd3+/cd56-t细胞定量cd314+细胞的百分比时,在实验结束时,4℃或室温孵育呈现百分比强烈增加。在37℃孵育的培养物的细胞百分比也增加,但速率较高(图17b,表24)。
[0603]
表23.cd314+[vc]所有淋巴细胞%
[0604]
小时室温37℃4℃069.669.669.6865.363.768.62465.767.169.83267.276.968.64266.477.276.611578.653.180.0
[0605]
表24.cd314+[cd3+/cd56-]%
[0606]
小时室温37℃4℃067.467.467.4862.961.766.42463.264.767.83262.372.866.04264.575.174.711579.0 78.2
[0607]
有趣的是,当定量表达cd314+的cik细胞和nk的百分比时,观察到在整个所有测试时间点中,低温保持稳定的群体量。相反,在所测试的最终时间点,在37℃孵育的培养物的表达cd314的cik和nk细胞的百分比大大减少(图17c和图17d,表25和表26)。这些结果指出,当将细胞保持延长时间段时通过储存在4℃或室温增加培养物稳定性的潜能。
[0608]
表25.cd314+[cd3+/cd56+]cik细胞%
[0609][0610]
[0611]
表26.cd314+[cd3+/cd56+]nk细胞%
[0612]
小时室温37℃4℃099.099.099.0899.298.6100.02498.999.199.53294.290.095.04296.866.799.511591.8 100.0
[0613]
实施例5
[0614]
研究的目的为通过紧接在cobe洗涤之后在4℃和环境室温(22℃)长期储存之后进行表型评估来研究cik-ds和crx100-dp的稳定性和效力。在培养的第26天收获cik细胞且使用cobe2991细胞处理器洗涤。制备规格规定补充有0.5%人类ab血清的350ml(baxter international,deerfield,il)中的大致3
×
109个细胞,浓度为8.57
×
106个细胞/毫升。因此,将cik细胞悬浮至类似浓度(1
×
107个细胞/毫升)。
[0615]
重悬的cik细胞分至2个种子袋中,各自含有大致160ml细胞产物(3.5
×
109个细胞/袋)。然后,将双缺失牛痘病毒(vvdd-cdsr)原料药以0.1的感染复数(moi)添加至一个袋中。将两个种子袋轻缓地拍打60秒且在37℃、5.0%co2下保持2小时。将两个种子袋(仅cik细胞和crx100)各自均匀地拆分至两个新袋中,得到总共四个袋。其他cik细胞和crx100袋(各自含有80ml细胞产物)用于后续保持研究或效力分析。获得30ml的crx100和cik细胞袋且将其转移至待在暗处储存于4℃冰箱中的300ml转移包装中,同时将crx100和cik细胞的另一30ml等分试样在暗处在环境温度(22℃)储存于300ml转移袋中。
[0616]
在多个时间点处(0、4、12、22、42、48、69、94和120小时)评估利用流式细胞术的存活率和细胞表面标记表达。通过来自各袋的样本每24小时进行对vero e6细胞系的噬斑测定,以评估细胞相关和无细胞病毒效价。噬斑测定表明细胞结合和无细胞病毒在48小时之后在4.0℃储存的crx100袋中增加,而在环境温度未观察到细胞结合或无细胞病毒的增加。
[0617]
储存在4.0℃至少120小时在crx100和cik细胞袋两者中产生高于80%的长期存活率。同时,在22℃储存的袋在120小时保持高于70%活力。以moi 0.1引入vvdd-cdsr并不显著地影响表达nkg2d受体的细胞的存活率、细胞浓度或百分比。然而,至第94小时,与cik细胞对照组相比,在用vvdd-cdsr感染的cik袋中观察到更高百分比的cd3-/cd56+nk细胞。与在22℃储存的细胞相比,在4℃储存引起对nkg2d(cd314)表达呈阳性的cd3+细胞的百分比增加。至第120小时,在4℃储存也产生更高百分比的cik细胞,而表达cd314的细胞的百分比在所有袋中保持相对地类似。重要地,120小时后的效力分析表明,与保持在环境温度的crx100相比,在4.0℃储存的crx100明显更多的杀伤目标ovcar-3肿瘤细胞。实际上,与紧接在洗涤之后使用的crx100相比,保持在4.0℃持续120小时的crx100产生类似的细胞毒性效果。
[0618]
来自关于cik细胞进行的先前保持研究的数据表明在22
±
3℃长期储存保持细胞存活力持续至少96小时和表面标记表型持续72小时。此外,先前研究证实,收获后立即在37℃保持2小时不会对总细胞计数、存活率或细胞标记表型产生明显影响。最近的保持研究证
实,在30.0℃、5%co2下储存的crx100在48小时内保持高于70%。然而,先前研究尚未表明在4.0℃或环境温度储存的crx100的存活率、细胞浓度、病毒脱落概况、表面标记表达图谱或效力。因在4.0℃或环境温度长期储存所致的这些效果的特性对于理解最佳药物产物的储存条件至关重要。
[0619]
在此研究中,仅收获crx100和cik细胞,将其重悬于(补充有0.5%人类ab血清)中且储存于4℃或环境温度(22℃)。在0与120小时之间的多个时间点处收集样本以评估存活率、细胞浓度、细胞表面表型和病毒脱落。在保持研究结束之后,剩余样本用于卵巢癌细胞系ovcar-3(atcc)的效力分析。选择ovcar-3癌瘤细胞系,因为此细胞系的细胞对nkg2d配体(mica/b)的表达呈阳性且也易受牛痘病毒感染影响。
[0620]
在培养的第26天收获cik细胞,使用cobe 2991处理器洗涤且重悬至大致1
×
107个细胞/毫升。将重悬cik细胞拆分至2个种子袋中,各自含有大致160ml的细胞产物。将双缺失牛痘病毒(vvdd-cdsr)以0.1的moi添加至袋中的一个中。然后将两个种子袋置放于37℃、5.0%co2孵育箱中持续2小时。在孵育之后,再次拆分各种子袋,得到总共4个袋,所述袋含有约80ml细胞产物。其他cik细胞和crx100袋(各自含有80ml细胞产物)用于后续保持研究或效力分析。获得30ml的crx100和cik细胞袋且将其转移至暗处储存于4℃冰箱中的300ml转移包装中,同时将crx100和cik细胞的另一30ml等分试样在暗处在环境温度(22℃)储存于300ml转移袋中。立即使用来自crx100和cik袋的剩余细胞以对ovcar-3肿瘤细胞系进行效力分析。
[0621]
使用chemolock系统,1.0ml样本在如表27中所示的时间点从各袋获取。然后使用bio-rad tc-20
tm
自动细胞计数器评估样本的外观(a)、细胞浓度和存活率(v)。通过流式细胞术(f)表征细胞表面标记(cd3、cd56和cd314)。在下文适当时间点处,1.5ml等分试样用于比较不同温度的病毒脱落(viral shedding)。将来自各袋的样本以1000g快速离心10分钟且自细胞团块(细胞结合病毒)分离上清液(无细胞病毒)。将上清液连续稀释在培养基中且将1ml的各稀释液添加至六孔板中的汇合vero e6细胞中。将细胞团块重悬于1ml的培养基中且各自在干冰/乙醇和37℃水浴中冷冻-解冻五次,每次60秒,以释放膜结合和细胞内病毒。在每次冷冻-解冻结束时轻缓地漩涡震荡细胞裂解物且稀释液类似地在vero e6细胞上形成斑块。在3-4天之后计数斑块。
[0622]
表27
[0623]
时间[距开始的时间]分析0v+f+a+p4v+a12v+a22v+f+a+p42v+a48v+f+a+p69v+f+a+p94v+f+a+p120v+f+a
[0624]
v:存活率;f:流式细胞术;a:外观;p:噬斑测定
[0625]
表28、图18a和图18b和图19示出了4℃和22℃的cik和crx100原料药的存活率百分比(图18a)、细胞浓度(图18b)和总细胞计数(图19)。在4℃储存的crx100和cik细胞在120小时内保持高于80%存活率,而在22℃储存的细胞产物在大致第94小时时降至80%存活率,但在120小时研究持续时间内保持高于70%。在4℃储存的crx100和cik细胞的外推总细胞群体在120小时内保持高于2
×
109个细胞的制备规格,而在环境温度储存的细胞在48与69小时之间降至2
×
109个细胞。在相同温度储存的crx100与cik细胞之间未观察到存活率或细胞计数的显著差异。
[0626]
表28.
[0627][0628]
储存温度对亚群的影响
[0629]
crx100和cik细胞的流式细胞术表面标记特征显示,cd3+的%对于所有四个实验组在120小时研究的持续时间内保持高于90%(图20a)。然而,在第120小时,在4℃储存的cik细胞和crx100保持高于95%cd3+(尽管在第96小时观察到在4℃储存的crx100的低于95%cd3+的少量下降)。此外,cd3-/cd56+nk细胞群体的%在两种温度的crx100袋中和在环境温度储存的cik细胞中增加(图20b)。
[0630]
crx100和cik细胞的流式细胞术表面标记表达特征显示,与在环境温度储存的袋相比,在4℃储存的袋的cd3+/cd56+cik细胞%的显著可辨差异(图20)。至第94小时,与在22℃储存的crx100相比,在4℃储存的crx100展现cd3+/cd56+cik细胞%的显著增加。实际上,在第120小时,仅在4℃储存的crx100和cik细胞分别为26.2%和28.5%cik细胞,而在22℃储存的crx100和cik细胞分别为9.2%和14.4%cik细胞。最后,在图20c中,cd3+/cd56-t细胞%似乎针对在4℃储存的细胞略微地减少,但针对在环境温度储存的细胞略微地增加。
[0631]
温度和vvdd对cd314+表达%的影响
[0632]
评估cd314(nkg2d受体)以表征储存温度和vvdd-cdsr引入对细胞产物的效力的潜在作用。在第42小时,与在环境温度储存的细胞产物相比,可在4℃储存的细胞产物之间注意到cd3+和cd3+/cd56-的cd314表达的明显差异(图20a和图21b)。在第94小时,与在22℃储存的crx100中的56.6%的cd3+/cd56-细胞相比,在4℃储存的crx100中76.4%的cd3+细胞
为cd314+。用vvdd感染似乎对cd3+/cd56-细胞的cd314表达并不具有显著影响。
[0633]
在第72小时,与在环境温度的crx100中的76.2%的cd3+/cd56+cik细胞相比,4℃的crx100中的95.3%的cd3+/cd56+cik细胞为cd314+(图20c)。尽管cd314表达的此差异在第96小时时最显著,但在第120小时时不明显。vvdd感染似乎并不影响cd3+/cd56+cik细胞的cd314表达。温度和moi 0.1下的vvdd引入均不会影响nk细胞的cd314表达,因为所有四个袋在nk细胞上均展现几乎相同的cd314表达图谱(图20d)。
[0634]
流式细胞术细胞亚群的总细胞计数
[0635]
将总细胞计数(图19)乘以如由流式细胞术表征的细胞表面标记亚群(图20a至图20d,图21a至图21d),以提供总cd3+细胞计数、总cd3+/cd56+细胞计数和总cd314+/cd3+/cd56+细胞计数(图22a至图22c)。在4℃储存的总cd3+细胞群体在整个120小时保持研究中保留高于2.5
×
109个细胞,而在22℃储存的细胞降至1.5
×
109个总细胞。重要地,仅在4℃储存的crx100和cik细胞分别具有7.5
×
108和1
×
109个cd3+/cd56+细胞,其中约83%为cd314+。
[0636]
病毒脱落概况
[0637]
为表征随时间推移的crx100的隐蔽期和病毒脱落概况,在4℃和22℃温度在t=0时(在37℃、5.0%co2下两小时病毒感染结束时)和在保持研究的持续时间中每24小时自crx100和cik袋收集样本。为定量病毒效价,将1.5ml样本自各袋以1000
×
g快速离心10分钟且自细胞团块(细胞结合)分离上清液(无细胞)。然后,将上清液连续10倍稀释于伊格尔氏(eagle's)最低必需培养基中且1ml的各稀释液用于感染六孔板中的汇合vero e6单层。将vero e6细胞在37℃、5.0%co2孵育箱中与病毒接种物一起孵育2小时。在孵育结束时,移除病毒接种物且添加3ml的新鲜培养基。将板在37℃、5.0%co2下孵育3-4天以允许斑块形成。
[0638]
将细胞团块重悬于中1ml的伊格尔氏最低必需培养基中且各自在干冰/乙醇和37℃水浴中冷冻-解冻五次,每次60秒,以释放膜相关和细胞内病毒。在每次冷冻-解冻结束时轻缓地漩涡震荡细胞裂解物且稀释液类似地在vero e6细胞上形成斑块。在3-4天之后通过用0.1%结晶紫染色将斑块可视化。
[0639]
通过噬斑测定定量无细胞(上清液)和细胞结合(细胞团块)牛痘病毒效价且记录。紧接在crx100配制(t0)之后,观察到6.3
×
104pfu/ml的无细胞病毒效价,而发现细胞结合病毒则更高(9
×
104pfu/ml)。此数据表明,大致58.8%的病毒在37℃的2小时感染期间由cik细胞吸收。在24小时病毒感染后,未观察到4℃和22℃的crx100的无细胞和细胞结合病毒效价的显著差异(图23a和图23b)。
[0640]
在48小时之后观察到在4℃储存的crx100的细胞结合和无细胞牛痘病毒两者的增加(图23a)。病毒感染后72小时,4℃的crx100的细胞结合病毒效价增加至7.5
×
104pfu/ml,而无细胞病毒效价增加至4.7
×
104pfu/ml。出人意料地,在室温的crx100中未观察到细胞结合或无细胞病毒效价的此类增加,因为细胞结合和无细胞病毒效价保持约2.0
×
104pfu/ml(图23b)。在所分析的任何时间点处在来自4℃和22℃温度的cik袋的样本中未观察到斑块。这些结果证实,不仅crx100在4℃稳定延长时段,且也似乎在4℃在细胞中复制并感染其他cik细胞,如通过细胞结合效价和无细胞效价所指出的那样,从而延长vvdd在crx100细胞中的隐蔽期。
[0641]
120小时保持后的肿瘤杀伤概况
[0642]
紧接在120小时保持之后,获取来自两种储存温度的crx100和cik细胞、快速离心且重悬于补充有il-2(300iu/ml)的100μl的aim-v 5.0%人类ab血清培养基中至各种浓度。将crx100和cik细胞在各种效应比靶比率下与ovcar-3靶细胞(2.0
×
105个靶细胞)共孵育(图24a和图24b)。也将vvdd病毒以不同感染复数(moi)添加至汇合ovcar-3细胞中。使效应细胞和靶细胞在37℃、5.0%co2孵育箱中共孵育96小时。在96小时之后,移除上清液,将ovcar-3肿瘤细胞用pbs洗涤1次且使其胰蛋白酶化。将细胞用zombie-nir
tm
活力检测染料染色。通过流式细胞仪评估肿瘤细胞的存活率百分比和总活细胞计数。
[0643]
实验组中ovcar-3细胞存活率评估表明,vvdd以0.5:1的moi开始高效地溶解ovcar-3细胞。更重要地,观察到,对于1:1与50:1之间的e:t比率,在4℃储存的crx100细胞比在22℃储存的crx100引起更多的肿瘤细胞死亡。另外,在任一温度储存的crx 100比仅cik细胞引起更多的肿瘤杀伤。尽管在4℃储存的crx100似乎比vvdd引起更少肿瘤细胞死亡,在0.1的低moi下配制crx100。最后,与在环境温度储存的cik细胞相比,在4℃储存的cik细胞也似乎在100:1的e:t比率下杀灭更高数目的ovcar-3肿瘤细胞。
[0644]
肿瘤杀伤概况:与新鲜crx100进行比较
[0645]
所配制和新鲜使用的crx 100展现出与经配制且在4℃储存120小时的crx 100类似的肿瘤杀伤概况(图25)。在0.1的moi和10∶1的e:t比率下,在新鲜和4℃保持的crx100中,几乎所有的ovcar-3细胞被完全杀伤。同时,保持在环境温度的crx100在0.5∶1和50:1之间的e:t比率下的肿瘤杀伤明显更差。新鲜crx100在100:1的e:t比率下的ovcar-3肿瘤存活率的增加有可能为流式细胞术的假影,随着ovcar-3细胞死亡,其变得自板分离且自流式细胞术样本染色中移除。因此,剩余的细胞更有可能存活。当使用较大靶细胞数目时,此假影较不明显,如同120小时后研究效力分析的情况一般。
[0646]
结论
[0647]
仅cik细胞和crx100在4℃保持高于70%持续至少120小时
[0648]
如图17a、图18b和图19中所显示,在4℃储存的细胞产物保持高于80%存活率持续至少120小时。此外,在环境温度储存的细胞产物保持高于70%存活率的制造规格持续至少120小时。此直接影响最终药物产物的运送,因为一些运送容器具有15-30℃的所列温度范围。这些数据指示,尽管在低温(室温或4℃)储存产生改善的存活率,但在22℃保持120小时不会降低低于制备规格的存活率。另外,此保持研究已表明,在低温储存的细胞产物比在30℃或37℃储存的细胞产物更稳定。最后,外推总细胞计数数据表明,在4℃储存的细胞产物保持高于2
×
109个效应细胞的制备规格持续120小时保持研究的持续时间。因为细胞计数直接地与最终产物的效力有关(图24a、图24b、图25),这些数据表明在4℃储存可产生更强效的产物。
[0649]
vvdd引入对存活率、细胞计数和表面标记表达的影响
[0650]
以0.1的moi引入vvdd-cdsr并不对存活率、细胞浓度或总细胞计数具有显著影响(图18a、图18b和图19)。由于对运送的影响,此尤其重要。如果保持在4℃持续120小时,则在运送之前以此特定剂量添加vvdd-cdsr将不降低细胞产物的存活率。
[0651]
另外,以0.1的moi将vvdd引入cik似乎并不对cd314表达或细胞亚群具有较大影响,尽管在crx100袋上观察到nk细胞群体中的少量增加。这表明,随时间推移,vvdd引入似乎并不影响药物产物的稳定性或存活率。
[0652]
温度对存活率、细胞计数和表面标记表达的影响
[0653]
与在环境温度储存的细胞相比,至120小时时,在4℃储存的细胞产物最终具有更高百分比的cd3+/cd56+cik细胞%。相反地,在4℃储存的细胞中观察到cd3+/cd56-t细胞%的少量减少,从而有可能表明细胞在低温储存的袋中随时间推移自cd3+/cd56-转变为cd3+/cd56+。此现象也可对最终药物产物的效力具有直接影响,因为当前假设cd3+/cd56+细胞在所有细胞亚群中具有最强肿瘤杀伤能力。
[0654]
此外,发现在4℃储存达69小时内随时间推移产生更高的cd3+/cd56-t细胞和cd3+/cd56+cik细胞的nkg2d(cd314)表达。由于nkg2d被认为是cik细胞与肿瘤细胞之间的原发性结合位点,增加的nkg2d受体表达可能会产生更多的肿瘤杀伤作用。
[0655]
病毒脱落概况和效力
[0656]
尽管在4℃储存的细胞产物的细胞结合病毒和无细胞病毒概况不是出人意料的(在48小时之后显著增加),出人意料地发现在22℃储存的crx100中,细胞结合或无细胞病毒的类似增加。细胞结合和无细胞牛痘病毒效价在感染后48小时之后增加,从而表明病毒隐蔽期(48小时)和病毒复制动力学在维持在4℃的crx100中保持。这也表明,牛痘病毒在初次感染之后以游离病毒和4℃的crx100中的感染细胞内的细胞与细胞形式全身性地扩散。
[0657]
无细胞和细胞结合病毒效价在保持在室温的crx100中显著下降且感染后48小时未观察到病毒复制的爆发。这表明在室温,牛痘病毒未在细胞中经历完整复制过程周期或经感染细胞在室温快速死亡。在48至72小时之间观察到保持在22℃的crx100的总细胞计数的下降(图19)。因此,观察到在vero细胞上形成清晰生长(斑块)区域的较低数目的病毒粒子。也有可能的是,在室温,牛痘病毒颗粒对于在vero细胞中经历复制-溶解-感染过程且形成斑块高度不稳定,从而在室温在感染后的所有时间点产生低效价的无细胞和细胞结合病毒。
[0658]
病毒脱落或病毒复制的缺乏也可在保持在4℃或环境温度的crx100之间观察到的ovcar-3杀伤的差异中起重要作用。这些数据重要地表明,在4℃储存120小时的crx100展现与紧接在cobe洗涤之后使用的crx100相同的细胞毒性概况。这表明,crx100可洗涤后(120小时)安全地使用较长时段,且如果将其保持在4℃持续其保持的持续时间,则保留其杀伤肿瘤细胞的能力。
[0659]
实施例6
[0660]
研究的目的为研究在cobe洗涤之后立即在4℃长期储存之后cik-ds和crx100的稳定性和效力。
[0661]
如上文所述扩增cik细胞。将细胞以2
×
106个细胞/毫升种子密度的密度接种在5l扩增袋中的200ml aim-v培养基中。在扩增的第21天收获cik细胞且重悬于中+0.5%人类ab血清中。在37℃将细胞用vvdd以0.01的moi感染两小时以产生crx100。
[0662]
使crx100保持在4℃且从制造厂运送至分析实验室。在收获后约36小时在实验室接收细胞。将样本从袋中取出,在plasma-lyte中洗涤,且用于如上文所述的效力分析。将vvdd自-80℃解冻且直接用于使用如上文所述ovcar-3肿瘤细胞进行效力测定。
[0663]
结果显示于图26和图27中且显示免疫细胞cik和crx 100在4℃延长保持期间保持效力。尤其地,细胞在运送之后保持其效力。效价显示于表29中。
[0664]
表29.
[0665][0666]
实施例7
[0667]
研究的目的为研究在4℃、22℃和37℃长期储存之后cik-ds和crx100的稳定性和效力。
[0668]
使cik细胞从人类患者单采术产物扩增25天,用+0.5%人类ab血清洗涤,且在37℃用vvdd病毒(moi 0.1)感染2小时。然后,在病毒感染后,使crx100细胞在中在不同温度保持96小时。将来自各时间点和温度的3
×
106crx100细胞离心且将细胞团块冷冻-解冻5次以将细胞结合病毒滴定在vero e6细胞上。在3-4天之后使用0.1%结晶紫染色定量斑块。在保持在4℃的crx1000细胞中观察到24小时隐蔽期之后病毒效价的增加,然而,对于保持在22℃和37℃的细胞,未观察到细胞结合病毒效价增加(图28)。在96小时感染后,再次在保持在4℃的crx100细胞中观察到病毒效价的增加,从而表明病毒可再感染cik细胞并复制以增加crx100产品在4℃的细胞结合病毒效价。
[0669]
使cik细胞自患者单采术产物在bioeclipse扩增25天,用+0.5%人类ab血清洗涤,且在37℃用vvdd病毒(moi0.1)感染2小时。然后,在病毒感染后,使crx100细胞在中在不同温度保持96小时。将来自各时间点和温度的3
×
106crx100细胞以1000g离心10min。将上清液连续稀释于无血清培养基中以将无细胞病毒滴定在vero e6细胞上。在3-4天之后使用0.1%结晶紫染色定量斑块。相较于保持在22℃和4℃的细胞,保持在4℃的crx100细胞显示增加的无细胞病毒效价(图29)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1