利用一次性培养工艺系统生产流感病毒的方法及流感病毒抗原纯化条件的快速查验试验与流程
利用一次性培养工艺系统生产流感病毒的方法及流感病毒抗原纯化条件的快速查验试验
交叉引用
1.本技术要求于2020年4月29日提交的韩国专利申请no.10-020-0052700和于2020年9月29日申请的韩国专利申请no.10-2020-0052708的优先权,其全部内容通过引用并入本文。
技术领域
2.本发明涉及一种使用一次性培养工艺系统的流感病毒生产方法和流感病毒抗原纯化条件的快速确认测试。
背景技术:
3.对于流感相关疾病,治疗很重要,但通过疫苗接种预防是最现实和有效的方法。当疫苗开发速度更快时,预计在新的流感大流行期间,损害可以减少到一定程度。
4.由于用于疫苗生产的流感病毒推荐毒株每年都会发生变化,并且由于新流感爆发的性质,全世界的感染人数在不确定的时间内增加,因此开发流感病毒疫苗的关键是在短时间内为大规模生产创造条件,并生产出高产、高纯度的疫苗。
5.流感疫苗的主要抗原是流感病毒包膜中的血凝素(ha),疫苗的效力也取决于血凝素的浓度。目前,为了测定流感疫苗中的血凝素浓度,国内外普遍使用欧洲药典和世界卫生组织(who)推荐的单向辐射状免疫扩散(single radial immunodiffusion,srid)技术(非专利文件1)。当通过单向辐射状免疫扩散技术测定血凝素含量时,使用国家生物标准与控制研究所(nibsc)提供的标准抗原和标准抗体。通过将流感疫苗抗原和标准抗体聚集的环的大小与标准抗原和标准抗原聚集的环大小进行比较和转换来测定流感疫苗中血凝素的浓度。然而,这种单向辐射状免疫扩散技术处理一个样品需要24小时以上的时间,并且由于大多数过程都是手动的,因此与处理量相比,这是非常耗费人力的。
6.大流行是一种传染病在世界各地传播的情况。在流感大流行的情况下,必须迅速开发疫苗,在开发疫苗以应对流感大流行情况时,也必须迅速测定血凝素的含量。在韩国,在2009年意外的h1n1大流行期间,由于世界卫生组织(who)标准抗原和标准抗体的供应延迟,疫苗生产和后续临床试验通常被推迟。当需要快速开发疫苗时,如在大流行情况下,需要一种快速测定血凝素含量的方法,但需要2至3个月才能开发出用于单向辐射状免疫扩散技术的标准抗原和标准抗体,这已成为疫苗快速开发的障碍。
7.最近,对新的物理化学测试方法的研究已经开始。为了使新尝试的物理化学测试方法取代单向辐射状免疫扩散测试,有必要建立和验证数据,以显示替代测试方法的结果与单向辐射状免疫免疫扩散技术和测试方法结果之间的任何相关性。
8.目前,反相高效液相色谱(rp-hplc)、同位素稀释液相色谱-质谱法(id-lc/ms)、去糖基化抗原sds-page分析等被称为替代测试方法,但已知一些方法仍然需要标准抗原,需要昂贵的设备和专业人力,或者具有低分析灵敏度等缺点(非专利文献2)。
9.本领域仍然需要能够容易地替代srid技术的方法,或者需要在没有srid技术情况下制造疫苗。
10.与此同时,过去50年来,流感疫苗一直是用受精的蛋来生产的。然而,这种制造方法需要大约一个受精的蛋来生产单剂疫苗,因此制造疫苗需要很长时间,而且生产工艺复杂。此外,对于疫苗生产,将使用质量受控的spf(无特定病原体)受精的蛋,但其供应有限,如果不提前计划,当出现突然需求时,很难增加受精的蛋的供应。此外,使用受精的蛋生产的疫苗含有微量的蛋源蛋白,这增加了对这种蛋白敏感的人发生过敏反应的可能性。流感病毒在受精的蛋中培养时有时会发生抗原突变,有些病毒在受精蛋中无法培养,或者在某些情况下对鸡是致命的。在流感病毒全球大流行的情况下,这些缺点可能是供应足够疫苗的一个主要问题。为了克服这些缺点,大约15年前开始了一种利用动物细胞培养物培养流感病毒的技术。
11.同时,用于工业规模病毒生产的细胞培养通常使用不锈钢发酵罐设施进行,但当使用这种设施时,需要在使用前对发酵罐进行清洗和消毒处理,因此处理准备时间长,并且很有可能被外部物质污染。此外,在使用后的洗涤过程中,批次或病毒株之间可能发生交叉污染。特别是,流感疫苗是三价或四价疫苗,因此必须培养三种或四种不同的病毒,而且菌株之间交叉污染的可能性很高,因此需要一种新的病毒生产工艺来解决这些问题。
12.韩国专利no.10-1464783公开了一种在一次性生物反应器中培养mdck细胞的方法,但是在该文献提供的方法中,细胞培养是在微载体存在下进行的,并且添加了去除微载体的过程,因此该过程繁琐,并且污染的可能性很高。
技术实现要素:
[技术问题]
[0013]
因此,本发明人研究了在不使用单向辐射状免疫扩散技术的情况下在疫苗生产过程中设置处理条件,并确认了可以根据本发明特有的方法快速可靠地确认获得流感表面抗原的条件,含有流感抗原的疫苗生产周期显著缩短,从而完成了本发明。
[0014]
作为开发一种细胞培养系统的反复深入研究的成果,该系统缩短了工艺准备时间,并无需过度担忧用于流感病毒繁殖的细胞培养中的污染,已经发现,当使用一次性袋在一次性细胞培养箱中培养细胞,然后在使用一次性袋的低速连续离心机进行病毒感染之前进行培养基更换,可以实现所述目的,从而完成本发明。
[0015]
因此本发明的目的是提供一种使用洗涤剂从流感病毒中纯化表面抗原蛋白的方法,其中,用于处理采样流感病毒的洗涤剂处理浓度由通过确定采样流感病毒每单位剂量的总蛋白定量值(tpqv)并随后将总蛋白质定量值代入以下等式1而获得的值来确定:
[0016]
[等式1]
[0017]
洗涤剂处理浓度=[{(a*tpqv(μg/ml))/(bμg/ml)}/c]*d
[0018]
(其中,
[0019]
a为0.005%(v/v)至0.100%(v/v),
[0020]
b为100、200、300、400、500、600、700、800或900,并选择最接近tpqv的值,
[0021]
c为用于处理的洗涤剂母液浓度(%(v/v)),
[0022]
d为待用洗涤剂处理的采样流感病毒的剂量(体积)。
[0023]
本发明的另一个目的是提供一种用于快速确认流感抗原纯化条件的测试方法,该方法包括第一纯化条件确定方法和第二纯化条件确定方法:
[0024]
第一纯化条件确定方法,其用于从流感病毒培养物中纯化流感病毒的步骤,并且其中基于在不同条件下纯化获得的流感病毒样品的血凝试验、sds-page或其组合来确定流感病毒的纯化条件;以及
[0025]
第二纯化条件确定方法,其用于使用洗涤剂从流感病毒纯化表面抗原蛋白的步骤中,并且其中基于流感病毒样品的总蛋白定量测定来确定表面抗原蛋白纯化期间的洗涤剂处理浓度。
[0026]
本发明的另一个目的是一种疫苗生产方法,所述方法包括从流感病毒纯化表面抗原蛋白,其中步骤是在使用洗涤剂进行处理的条件下进行的,所述洗涤剂的值是通过确定每单位剂量采样流感病毒的总蛋白定量值(tpqv),然后将胸蛋白定量值代入以下等式1获得的:
[0027]
[等式1]
[0028]
洗涤剂处理浓度=[{(a*tpqv(μg/ml))/(bμg/ml)}/c]*d
[0029]
(其中,
[0030]
a为0.005%(v/v)至0.100%(v/v),
[0031]
b为100、200、300、400、500、600、700、800或900,并选择最接近tpqv的值,
[0032]
c为用于处理的洗涤剂母液浓度(%(v/v)),
[0033]
d为待用洗涤剂处理的样本流感病毒的剂量)。
[0034]
本发明的另一个目的是提供一种快速纯化流感表面抗原的方法,该方法包括以下步骤:
[0035]
a)用流感病毒感染细胞并培养所述细胞以获得病毒培养物;
[0036]
b)基于血凝试验、sds-page或其组合确定通过在不同条件下纯化获得的流感病毒样品的纯化条件,以从步骤a)的培养物中纯化流感病毒;
[0037]
c)根据步骤b)中确定的条件从步骤a)的培养物中纯化流感病毒;
[0038]
d)基于流感病毒的总蛋白定量测定来确定表面抗原蛋白纯化期间的洗涤剂处理浓度,以从步骤c)中纯化的流感病毒中纯化表面抗原;和
[0039]
e)通过根据步骤d)中确定的条件进行洗涤剂处理,从流感病毒中纯化表面抗原蛋白。
[0040]
本发明的另一个目的是一种制造含有流感表面抗原的疫苗的方法,该方法包括以下步骤,其中缩短了疫苗生产周期:
[0041]
a)用流感病毒感染细胞并培养该细胞以获得病毒培养物;
[0042]
b)基于血凝试验、sds-page或其组合确定通过在不同条件下纯化获得的流感病毒样品的纯化条件,以从步骤a)的培养物中纯化流感病毒;
[0043]
c)根据步骤b)中确定的条件从步骤a)的培养物中纯化流感病毒;
[0044]
d)基于流感病毒的总蛋白定量测定来确定洗涤剂处理浓度表面抗原蛋白纯化,以从步骤c)中纯化的流感病毒中纯化表面抗原;和
[0045]
e)通过根据步骤d)中确定的条件进行洗涤剂处理,从流感病毒中纯化表面抗原蛋白。
[0046]
本发明的另一个目的是提供一种生产流感病毒的方法,该方法包括:
[0047]
(a)在一次性生物反应器(sub)中培养细胞;
[0048]
(b)使用使用一次性袋的低速连续离心机将步骤(a)的细胞培养液中的一部分培养基更换为新鲜培养基;
[0049]
(c)用流感病毒感染繁殖的细胞,并在允许流感病毒复制的条件下培养细胞;和
[0050]
(d)从步骤(c)的培养物中分离流感病毒。
[0051]
本发明的另一个目的是一种制造含有流感抗原的疫苗的方法,该方法包括以下步骤,其中缩短了疫苗生产周期:
[0052]
(a)在一次性生物反应器(sub)中培养细胞;
[0053]
(b)使用低速连续离心机将步骤(a)的细胞培养液中的一部分培养基更换为新鲜培养基;
[0054]
(c)用流感病毒感染繁殖的细胞,并在允许流感病毒复制的条件下培养细胞;和
[0055]
(d)从步骤(c)的培养物中分离流感病毒。
[0056]
[技术方案]
[0057]
为了实现上述本发明的目的,本发明提供了一种用洗涤剂从流感病纯化表面抗原蛋白的方法,其中,用于处理采样流感病毒的洗涤剂处理浓度由通过确定采样流感病毒每单位剂量的总蛋白定量值(tpqv)并随后将总蛋白质定量值代入以下等式1而获得的值来确定:
[0058]
[等式1]
[0059]
洗涤剂处理浓度=[{(a*tpqv(μg/ml))/(bμg/ml)}/c]*d
[0060]
(其中,
[0061]
a为0.005%(v/v)至0.100%(v/v),
[0062]
b为100、200、300、400、500、600、700、800或900,并且选择最接近tpqv的值,
[0063]
c为用于处理的洗涤剂母液浓度(%(v/v)),
[0064]
d为待用洗涤剂处理的采样流感病毒的剂量)。
[0065]
为了实现本发明的另一目的,本发明提供了一种用于快速确认流感抗原纯化条件的测试方法,该方法包括第一纯化条件确定方法和第二纯化条件确定方法:
[0066]
第一纯化条件确定方法,其用于从流感病毒培养物中纯化流感病毒的步骤,并且其中基于在不同条件下纯化获得的流感病毒样品的血凝试验、sds-page或其组合来确定流感病毒的纯化条件;以及
[0067]
第二纯化条件确定方法,其用于使用洗涤剂从流感病毒纯化表面抗原蛋白的步骤,并且其中基于流感病毒样品的总蛋白定量测定来确定表面抗原蛋白纯化期间的洗涤剂处理浓度。
[0068]
为了实现本发明的另一目的,本发明提供了一种疫苗生产方法,所述方法包括从流感病毒纯化表面抗原蛋白其中所述步骤是在使用洗涤剂进行处理的条件下进行的,所述洗涤剂的值是通过确定每单位剂量的采样流感病毒的总蛋白定量值(tpqv),然后将总蛋白定量值代入以下等式1获得的:
[0069]
[等式1]
[0070]
洗涤剂处理浓度=[{(a*tpqv(μg/ml))/(bμg/ml)}/c]*d
[0071]
(其中,
[0072]
a为0.005%(v/v)至0.100%(v/v),
[0073]
b为100、200、300、400、500、600、700、800或900,并且选择最接近tpqv的值,
[0074]
c为用于处理的洗涤剂母液浓度(%(v/v)),
[0075]
d为待用洗涤剂处理的采样流感病毒的剂量)。
[0076]
为了实现本发明的另一目的,本发明提供了一种快速纯化流感表面抗原的方法,该方法包括以下步骤:
[0077]
a)用流感病毒感染细胞并培养该细胞以获得病毒培养物;
[0078]
b)基于血凝试验、sds-page或其组合确定通过在不同条件下纯化获得的流感病毒样品的纯化条件,以从步骤a)的培养物中纯化流感病毒;
[0079]
c)根据步骤b)中确定的条件从步骤a)的培养物中纯化流感病毒;
[0080]
d)基于流感病毒的总蛋白定量测定来确定表面抗原蛋白纯化期间的洗涤剂处理浓度,以从步骤c)中纯化的流感病毒中纯化表面抗原;和
[0081]
e)通过根据步骤d)中确定的条件进行洗涤剂处理,从流感病毒中纯化表面抗原蛋白。
[0082]
为了实现本发明的另一个目的,本发明提供了一种制造含有流感表面抗原的疫苗的方法,该方法包括以下步骤,其中缩短了疫苗生产周期:
[0083]
a)用流感病毒感染细胞并培养该细胞以获得病毒培养物;
[0084]
b)基于血凝试验、sds-page或其组合确定通过在不同条件下纯化获得的流感病毒样品的纯化条件,以从步骤a)的培养物中纯化流感病毒;
[0085]
c)根据步骤b)中确定的条件从步骤a)的培养物中纯化流感病毒;
[0086]
d)基于流感病毒的总蛋白定量测定来确定表面抗原蛋白纯化期间的洗涤剂处理浓度,以从步骤c)中纯化的流感病毒中纯化表面抗原;和
[0087]
e)通过根据步骤d)中确定的条件进行洗涤剂处理,从流感病毒中纯化表面抗原蛋白。
[0088]
为了实现本发明的另一目的,本发明提供了一种生产流感病毒的方法,该方法包括:
[0089]
(a)在一次性生物反应器(sub)中培养细胞;
[0090]
(b)使用使用一次性袋的低速连续离心机将步骤(a)的细胞培养液中的一部分培养基更换为新鲜培养基;
[0091]
(c)用流感病毒感染繁殖的细胞,并在允许流感病毒复制的条件下培养细胞;和
[0092]
(d)从步骤(c)的培养物中分离流感病毒。
[0093]
为了实现本发明的另一个目的,本发明提供了一种生产含有流感抗原的疫苗的方法,该方法包括以下步骤,其中缩短了疫苗生产周期:
[0094]
(a)在一次性生物反应器(sub)中培养细胞;
[0095]
(b)使用使用一次性袋的低速连续离心机将步骤(a)的细胞培养液中的一部分培养基更换为新鲜培养基;
[0096]
(c)用流感病毒感染繁殖的细胞,并在允许流感病毒复制的条件下培养细胞;和
[0097]
(d)从步骤(c)的培养物中分离流感病毒。
[0098]
以下,将详细描述本发明。
[0099]
本发明提供了一种使用洗涤剂从流感病毒中纯化表面抗原蛋白的方法,其中,用于处理采样流感病毒的洗涤剂处理浓度由通过确定采样流感病毒每单位剂量的总蛋白定量值(tpqv)并随后将总蛋白质定量值代入以下等式1而获得的值来确定:
[0100]
[等式1]
[0101]
洗涤剂处理浓度=[{(a*tpqv(μg/ml))/(bμg/ml)}/c]*d
[0102]
(其中,a为0.005%(v/v)至0.100%(v/v),
[0103]
b为100、200、300、400、500、600、700、800或900,并且选择最接近tpqv的值,
[0104]
c为用于处理的洗涤剂母液浓度(%(v/v)),
[0105]
d为待用洗涤剂处理的采样流感病毒的剂量)。
[0106]
流感病毒的病毒粒子结构有一个由最外侧的脂质双层组成的包膜,两种表面糖蛋白从其中突出,一种是柱状血凝素(ha),另一种是蘑菇状神经氨酸酶(na)。
[0107]
本发明提供的方法是通过洗涤剂处理分离和纯化作为流感病毒表面抗原的血凝素和神经氨酸酶的方法,其中快速计算用于从病毒核心分离流感病毒表面抗原的洗涤剂的最佳处理浓度,并在短时间内建立流感病毒表面抗体纯化条件。
[0108]
在本发明中,“洗涤剂”可与“表面活性剂”互换使用,洗涤剂的类型不受限制,只要其用于分离和纯化本领域中的病毒表面抗原即可,并且可以包括例如非离子或离子(例如阳离子)洗涤剂。洗涤剂的非限制性实例包括烷基糖苷、烷基硫代糖苷类、酰基类、糖类、磺基甜菜碱类、甜菜碱、聚氧乙烯烷基醚、n,n-二烷基葡糖胺、hecameg(甲基6-o(n-庚甲酰)-α-d-葡萄糖苷)、烷基苯氧基聚氧基乙醇、季铵化合物、十二烷基肌氨酸钠(sarcosyl)、ctab(十六烷基三甲基溴化铵)、磷酸三-n-丁基酯、西曲溴胺(cetavlon)、肉豆蔻基三甲基铵盐、lipofectin(脂质体转染剂)、lipofectamine(脂质转染胺)和dotma、辛基或壬基苯氧基聚氧乙醇(例如,triton洗涤剂,如triton x-100或triton n101)、聚氧乙烯山梨醇酯(吐温洗涤剂)、聚氧乙烯醚和聚氧乙烯酯。
[0109]
在本发明的优选实施方案中,洗涤剂可以是阳离子洗涤剂。
[0110]
在本发明的更优选实施方案中,洗涤剂可以是ctab。
[0111]
根据分子生物学特性,本发明的流感病毒包括甲、乙和丙型。优选地,流感病毒可以是甲型或乙型。其中,根据表面抗原血凝素(ha)和神经氨酸酶(na)糖蛋白的类型,可以将流感病毒分为各种亚型。更具体地说,由于18种类型的血凝素和11种类型的神经氨酸酶是已知的甲型流感病毒的表面抗原,算术上可能总共有198种亚型的甲型流感,所有这些亚型都可以理解为包含在本发明的流感病毒中。
[0112]
同时,未来将揭示的新亚型流感病毒以及迄今已知的亚型,包括作为主要抗原的ha和na被改变为与先前已知的完全不同的新亚型的抗原性转变,或其中少量氨基酸由于ha和na基因水平的点突变的积累而改变的抗原性漂移。
[0113]
在本发明的一个优选实施方案中,流感病毒可以是甲型流感病毒,其非限制性实例包括h1n1、h2n2、h3n2、h5n1、h7n7、h1n2、h9n2、h7n2、h7n3、h10n7、h7n9、h6n1等。
[0114]
在本发明中,“采样的”流感病毒可以指经过一个或多个步骤的流感病毒,所述步骤选自在宿主细胞中培养表达表面抗原蛋白的流感病毒以提供培养物的步骤、纯化和/或浓缩培养物的步骤和灭活培养物中所含流感病毒的步骤。
[0115]
在本发明的一个实施方案中,采样可以意味着流感病毒通过包括以下步骤的方法处理:
[0116]
(i)提供可在其中繁殖流感病毒的基于细胞的病毒繁殖培养液或基于受精的蛋的病毒繁殖培养液;
[0117]
(ii)澄清培养液以获得含有流感病毒的培养物;
[0118]
(iii)任选地纯化和任选地浓缩培养物;和
[0119]
(iv)任选地灭活培养物中包含的流感病毒。
[0120]
在步骤(i)中,提供含有流感病毒的培养液。这种培养液可以来源于基于细胞的病毒繁殖培养液或基于受精的蛋的病毒繁殖培养液。如本领域技术人员所知,病毒可以在细胞培养系统或受精的蛋培养系统中繁殖。用于生长流感病毒的合适细胞系通常是哺乳动物来源的,因此代表哺乳动物细胞系,优选动物细胞系。合适的动物细胞系是本领域技术人员已知的,并且可以包括仓鼠、牛、灵长类(包括人和猴)和犬源的细胞系。作为细胞系的非限制性实例,哺乳动物细胞系的细胞可包括vero、perc6、bhk、293、cos、pck、mrc-5、mdck、mdbk、wi-38及其无血清适应性细胞。优选地,细胞系可以是mdck细胞。
[0121]
流感病毒可以通过本领域技术人员已知的任何合适的方法在细胞上生长。对于基于细胞的培养系统,可以使用任何合适的培养基。在优选实施方案中,细胞可以在无血清和/或无蛋白培养基中培养。对于基于细胞的病毒繁殖,通常将病毒或活病毒制剂分别接种到它们繁殖的细胞培养物中。病毒繁殖可在分批模式、分批进料模式或灌注模式下进行。
[0122]
或者,流感病毒可以在基于受精的蛋系统中繁殖。在基于受精的蛋的生产中,通常将工作种子病毒注射到蛋鸡的胚胎卵中。病毒开始在胚胎卵的尿囊液中繁殖,病毒数量增加。例如,在孵育2至3天后,将胚胎卵冷却至2℃至8℃,然后收获每个胚胎卵的尿囊液,并使用手动或自动真空收获系统进行汇集。收集的含有病毒的尿囊液是含有病毒的受精的蛋基培养液,并在随后的纯化过程中进一步处理。
[0123]
根据用于传播流感病毒的培养系统,含有传播的病毒颗粒的培养液可能含有不同的污染物。例如,存在于基于受精的蛋的培养液中的潜在污染物是基于受精的蛋的蛋白质,例如受精的蛋的白蛋白或抗生素,但存在于基于细胞的培养液的典型污染物是残留的宿主细胞dna。优选地,在本发明提供的方法中,用于传播流感病毒的系统不受限制;并且通过处理含有在基于细胞的培养系统中繁殖的病毒的培养液和类似地在基于受精的蛋的培养系统内繁殖的病毒而获得的培养液都可以应用。
[0124]
在本发明中,步骤(i)的培养液可以通过使用一次性生物反应器来生产。例如,通过使用这种一次性生物反应器,可以提高所获得的产品本身的质量和/或纯度。当该方法在大规模(例如工业规模)进行时,这可能是特别有利的。
[0125]
可以澄清含有流感病毒的基于细胞或受精的蛋的培养液(步骤(ii))。澄清步骤是在含有病毒颗粒的培养液上进行的,而不是在沉淀或以其他方式成粒的物质上进行的。在本发明中,这种澄清步骤的目的是从培养液中除去颗粒物质,例如细胞碎片、蛋白质杂质和/或用于生长细胞的支持物质,例如微载体。蛋白质杂质可以是例如尿囊素、胶原蛋白和/或白蛋白,例如卵清蛋白。为了澄清,可以使用本领域技术人员已知的任何合适的手段或方法。特别地,可以应用切向流过滤(tff)、深度过滤或离心。因此,以实现上述目的的方式选择相应应用的澄清装置(tff、深度过滤、离心)的相应设置。一般来说,当给出这样的目的
时,本领域技术人员已知每个装置的每个设置。
[0126]
在本发明中,通过该方法获得的澄清培养液可以称为“病毒培养物”。
[0127]
在本发明的一个方面,病毒培养物可以是本发明中提供的“采样的流感病毒”。
[0128]
在本发明的另一方面,“采样的流感病毒”可以是在步骤(ii)之后额外经历以下步骤(iii)和/或步骤(iv)的病毒。
[0129]
在本发明的一个方面,步骤(iii)中培养物的纯化可以通过任何合适的方法进行,以特异性纯化病毒抗原。优选的纯化方法包括例如色谱,例如离子交换色谱、疏水相互作用色谱、伪亲和色谱、亲和色谱、尺寸排阻色谱、液-液色谱等。在一个实施方案中,优选的纯化方法是亲和色谱,更优选的纯化法是使用硫酸纤维素(cs)作为载体的亲和色谱。
[0130]
在本发明的一个方面,当cs亲和色谱用于纯化步骤(iii)中的培养物时,可由本领域技术人员确定柱尺寸的选择。在cs亲和色谱中,可使用平衡缓冲液平衡cs柱以上样流感病毒滤液。在本发明的一个实施方案中,使用平衡缓冲液平衡cs柱,平衡缓冲液可以含有10mm至20mm磷酸钠,并且可以具有7.0至7.6的ph。
[0131]
在纯化过程中,可以用洗脱缓冲液洗脱附着在cs柱上的流感病毒。在本发明的一个实施方案中,当将含有浓度为0.01m至1.0m的氯化钠的洗脱缓冲液以中性ph注入柱中时,可以洗脱附着在cs柱上的流感病毒。洗脱缓冲液可以具有6.5-7.4的ph,并且可含有0.1至0.6m的氯化钠。
[0132]
为了在纯化过程中洗掉结合到cs柱上的任何蛋白质,可以使用含有1.0m至3.0m氯化钠的洗脱缓冲液洗涤cs柱。可以任选地洗涤使用过的cs柱,将其储存在适当的试剂中,并任选地重复使用。
[0133]
在本发明的一个方面,步骤(iii)中的浓度可以通过合适的方法实现。该方法导致病毒培养物体积的减少。浓缩步骤旨在通过减少含有流感病毒的培养物的体积来获得浓缩培养物。
[0134]
在一个优选的方面,可以通过在单个步骤中应用tff超滤或tff超滤和渗滤(tff超滤/渗滤)来减少体积,并且可以使用超速离心或沉淀,优选tff超滤来减少体积。因此,选择相应应用浓缩装置(tff、tff超滤/渗滤、超速离心或沉淀)的相应设置,以实现上述目的,即减少体积和浓缩流感病毒。
[0135]
在另一个实施方案中,当通过超速离心减少体积时,超速离心的条件可以是,例如,在30000g下超过10分钟,在200000g下超过20分钟。
[0136]
在另一个实施方案中,当通过施用沉淀进行浓缩时,本领域技术人员已知合适的化学品,并且可以分别是例如盐、甲醇和乙醇以及适当浓度的聚乙二醇。适当浓度的适当化学物质沉淀产物,例如含有病毒抗原的颗粒,但对病毒抗原具有最小或无不良影响。选择该化学物质以使其不与所需抗原(例如流感病毒表面抗原蛋白)反应,并且不改变所需抗原的免疫原性。
[0137]
在一个实施方案中,浓缩步骤中的病毒培养物的体积可以减少4倍或更多、优选5倍或更多、或9倍或更多、优选12倍或更多、优选13倍或更多、或15倍或更多、优选20倍或更多、或25倍或更多。
[0138]
在本发明的一个方面,在步骤(iii)之后纯化和/或浓缩的病毒培养物可以被灭活。灭活可消除病毒的传染性,通常可通过用有效量的一种或多种以下化学手段处理病毒
来进行:洗涤剂、甲醛、β-丙内酯、亚甲基蓝、补骨脂素、羧基富勒烯(c60)、仲乙胺、乙酰基亚乙基胺或其组合。灭活方法是本领域技术人员已知的,并且包括例如用物理手段(例如伽马射线和/或uv光)处理病毒。
[0139]
在本发明的一个实施方案中,可以不使用与用于分离流感病毒表面抗原的洗涤剂相同的洗涤剂进行灭活。
[0140]
在本发明的另一方面,采样的流感病毒可以指通过包括以下步骤的方法获得的流感病毒:
[0141]
(a)在一次性生物反应器(sub)中培养细胞;
[0142]
(b)使用使用一次性袋的低速连续离心机将步骤(a)的细胞培养液中的一部分培养基更换为新鲜培养基;
[0143]
(c)用流感病毒感染繁殖的细胞,并在允许流感病毒复制的条件下培养细胞;和
[0144]
(d)从步骤(c)的培养物中分离流感病毒。
[0145]
下面将更详细地描述步骤(a)至(d):
[0146]
(a)在一次性生物反应器(sub)中培养细胞;
[0147]
在本发明中,步骤(a)是培养宿主细胞以通过感染繁殖病毒的步骤,其中细胞在一次性生物反应器中培养。在一方面,在步骤(a)中,使用生物反应器系统,其包括用于培养细胞的一次性构件,例如柔性塑料袋。这样的生物反应器系统是本领域已知的,并且是可商购的。例如,参见国际专利公开wo 05/108546、wo 05/104706和wo 05/10849以及以下第8.12节。包括一次性使用构件的生物反应器系统(本文中称为“一次性使用生物反应器”或缩写“sub”)可以预先灭菌;并且不需要就地蒸汽(sip)或就地清洁(cip)用于培养或生产系统中的批对批或产品到产品的转化。sub很少需要监管控制,因为可以确认没有批次间的污染,并且可以在使用前以最少的准备或不单独准备快速处理,从而有助于从细胞培养物中生产大量疫苗成分。因此,sub可以在成本和时间方面具有显著优势。在另一方面,一次性生物反应器系统可以是搅拌釜反应器系统,其能够提供用于混合细胞培养物的流体动力学环境,并更有效地调节营养物、o2和ph。
[0148]
在本发明的一个方面,作为细胞,任何能够通过感染病毒并进行培养来实现病毒繁殖目的的细胞都可以用于本发明而不受限制。特别地,用于生长流感病毒的合适细胞通常可以是哺乳动物来源的。合适的动物细胞是本领域技术人员已知的,并且可以包括仓鼠、牛、灵长类(包括人和猴)和犬源的细胞系。作为细胞系的非限制性实例,哺乳动物细胞可包括vero、perc6、bhk、293、cos、pck、mrc-5、mdck、mdbk、wi-38及其无血清适应性细胞。优选地,细胞系可以是mdck细胞。
[0149]
作为mdck细胞,例如,可以使用源自atcc ccl-34细胞系、atcc pta-7909或pta-7910的那些细胞。在一个示例性实施方案中,可以使用衍生自韩国专利公开no.10-2012-0024464中公开的atcc ccl-34的mdck sky1023(dsm acc3112)、mdck sky10234(dsm acc3114)或mdck sky3851(dsm acc3113)细胞系,或者使用mdck细胞系,例如韩国专利no.10-1370512中公开的mdcks-mg细胞系(kclrf-bp-00297)。特别优选地,可以使用mdck sky3851细胞,其不需要用于细胞生长的血清,可以在悬浮液中培养,而不需要用于附着的单独载体,并且具有低致瘤性。
[0150]
在优选实施方案中,用于培养细胞的培养基可以是无血清培养基。因为动物血清
可能含有其他致病物质,这些物质可能会传染给人类或正在接受细胞培养物疫苗治疗或接种疫苗的动物,并且可能是致命的,特别是在免疫力低下的人类中。作为无血清培养基,例如,可以使用公知的细胞培养基,如mem培养基,诸如eagle’s最小必需培养基(emem)和dulbecco’s改良eagle培养基(dmem),或者可以使用衍生自这些细胞培养基或从这些细胞培养培养基改良的培养基。例如,可以使用市售培养基,例如gibco brl/life technology制造的vp-sfm。衍生自这些培养基的培养基可用于诱导细胞的继代培养。
[0151]
培养基可以含有例如从玉米、豌豆、大豆、麦芽、马铃薯或小麦中的一种或多种获得的植物水解物;脂质补充剂,如胆固醇或饱和和/或不饱和脂肪酸;微量元素,如cuso4·
5h2o、znso4·
7h2o和柠檬酸铁;一种或多种激素,如生长因子;腐胺、氨基酸、维生素、诸如不饱和脂肪酸的脂肪酸、核苷、碳酸氢钠、诸如葡萄糖的碳源、铁结合物质等。可以添加到细胞培养基中的这些组分的含量在本领域是公知的。
[0152]
在本发明的一个方面,细胞可以在1%或更高、或2%或更高、3%或更高、或4%或更高、或5%或更高、或6%或更高、或7%或更高、或8%或更高、或者9%或更高、或者10%或更高、20%或更高的co2浓度下培养。
[0153]
在本发明的一个方面,在培养细胞时有利地调节一次性生物反应器中的溶解氧(do)浓度(po2值),其范围为5%至95%(基于空气饱和度),或10%至60%。在特定实施方案中,溶解氧(do)浓度(po2值)可以是10%或更高、或20%或更高、或30%或更高、或50%或更高。
[0154]
在本发明的一个方面,在培养期间调节用于培养细胞的培养基的ph,并且可以在ph 6.4至ph 8.0的范围内,或者在ph 6.8至ph 7.6的范围。在某个实施方案中,培养基的ph可以是6.4或更高、或6.6或更高、或6.8或更高、或7.0或更高、或7.2或更高。
[0155]
在本发明的一个方面,细胞可以在25℃至39℃的温度下培养。在特定的实施方案中,培养温度可以是30℃至38℃,或35℃至38c,或36℃至38℃。
[0156]
在本发明的一个方面,可以在搅拌釜sub中监测和/或控制选自温度、搅拌速度、ph、溶解氧(do)、o2和co2的流速的一个或多个参数的同时培养细胞。在特定实施方案中,温度保持在约30℃至约42℃、或约33℃至约39℃、或约35℃至约38℃。在某个实施方案中,温度保持在约36℃至约37℃。在一个实施方案中,搅拌速度保持在约50rpm至150rpm。在特定实施方案中,搅拌速度保持在约60rpm至约120rpm,或约70rpm至约100rpm。通过本领域公知的方法调节搅拌速度。在另一个实施方案中,培养物的ph保持在约6.0至约7.5。在一个特定实施方案中,培养开始时的ph为约6.0至7.5,培养过程中培养物的ph保持在约7.0至约7.5之间。起始ph可以低于或高于上述优选范围,并且本领域技术人员也可以将该ph升高或降低到期望的水平(例如7.4)并将ph保持在该水平。通过本领域已知的任何方法保持这样的ph值。例如,可以根据需要通过喷射co2和/或添加酸(例如hcl)或碱(例如naoh)来调节ph值。在又一实施方案中,可接受的do范围为约100%至约35%。在特定实施方案中,do保持在约35%至约70%、或约50%。在另一个特定实施方案中,要求do不下降到低于约35%。初始do可以是100%,并且本领域技术人员也可以将该do降至预设浓度(例如50%)并将do维持在该水平。do可以通过本领域已知的任何方法来维持,例如通过喷射o2。
[0157]
(b)使用使用一次性袋的低速连续离心机将步骤(a)的细胞培养液中的一部分培养基更换为新鲜培养基;
[0158]
步骤(b)是在步骤(a)中培养的细胞充分繁殖并感染病毒之前更换培养基的步骤。
[0159]
在本发明的一个方面中,步骤(b)的培养基更换是通过一种方法进行的,在该方法中,细胞和培养基使用使用一次性袋的低速连续离心机彼此连续分离,而不需要回收和重新引入培养液的过程,丢弃一定量的培养基,并且将新培养基再次引入一次性袋中。与回收全部培养液,然后分成较小部分放入容器中并进行离心分离的一般方法不同,当使用使用一次性袋的低速连续离心机时,可以在封闭系统中进行培养基更换,污染的可能性可以大大降低。
[0160]
在本发明的一个方面,“一部分培养基”可以是一次性使用袋中存在的整个培养液体积的50%至90%。该部分培养基可以是存在于一次性使用袋中的整个培养液体积的60%至80%,最优选70%至80%。
[0161]
在一个实施方案中,培养基被更换为具有相同体积和相同组成的培养基。具体地,当使用低速连续离心机沉淀细胞时,回收一部分上层培养基,并补充与回收培养基体积相同的培养基以进行培养基更换。在另一个实施方案中,将培养基换成减少体积的培养基,以有效地浓缩细胞。可以将培养基更换为具有相同或不同组成的培养基。在一个实施方案中,步骤(a)中用于细胞繁殖的生长培养基可以与下面步骤(c)中使用的感染培养基(即,用于感染和病毒复制的培养基)更换。任选地,生长培养基补充有和/或含有附加成分(例如葡萄糖、微量矿物质、氨基酸等),从而不需要培养基更换。在另一特定实施方案中,感染培养基含有丝氨酸蛋白酶(例如,胰蛋白酶、tryple等)。在另一个实施方案中,在培养基未改变的情况下,在感染之前、感染期间或感染之后立即添加丝氨酸蛋白酶(例如胰蛋白酶、胰蛋白酶等)。在特定实施方案中,在细胞感染病毒之前或同时添加蛋白酶。
[0162]
(c)用流感病毒感染繁殖的细胞,并在允许流感病毒复制的条件下培养细胞;
[0163]
在一个实施方案中,流感病毒可以以具有约0.00001至0.01,优选0.0001至0.002的感染复数(moi)的剂量施用到培养基中。通过这样的剂量,接种到培养基的细胞可以被充分感染,并且可以预期流感病毒以所需量繁殖。
[0164]
在一个实施方案中,感染后,在22℃至40℃的温度下培养细胞。在特定实施方案中,在感染病毒后,细胞在39℃或更低、或38℃或更低、或37℃或更低、或36℃或更低、或35℃或更低、或34℃或更低、或33℃或更低、或32℃或更低、或30℃或更低、或28℃或更低、或26℃或更低、或24℃或更低的温度下培养。在特定实施方案中,在感染病毒后,细胞在33℃的温度下培养。在另一个实施方案中,在感染病毒后,在33℃或更低的温度下培养细胞。在又一个实施方案中,感染后,在31℃的温度下培养细胞。在特定实施方案中,细胞培养进行2至10天。培养可通过分批工艺进行。
[0165]
在本发明的一个方面,步骤(c)中的培养在足以以适当产量产生病毒的时间后进行,例如,感染后2至10天,或任选地感染后3至7天。在本发明的一个方面,在感染后2天、或3天、或4天、或5天、或6天、或7天、或8天、或9天、或10天进行步骤(c)中的培养。
[0166]
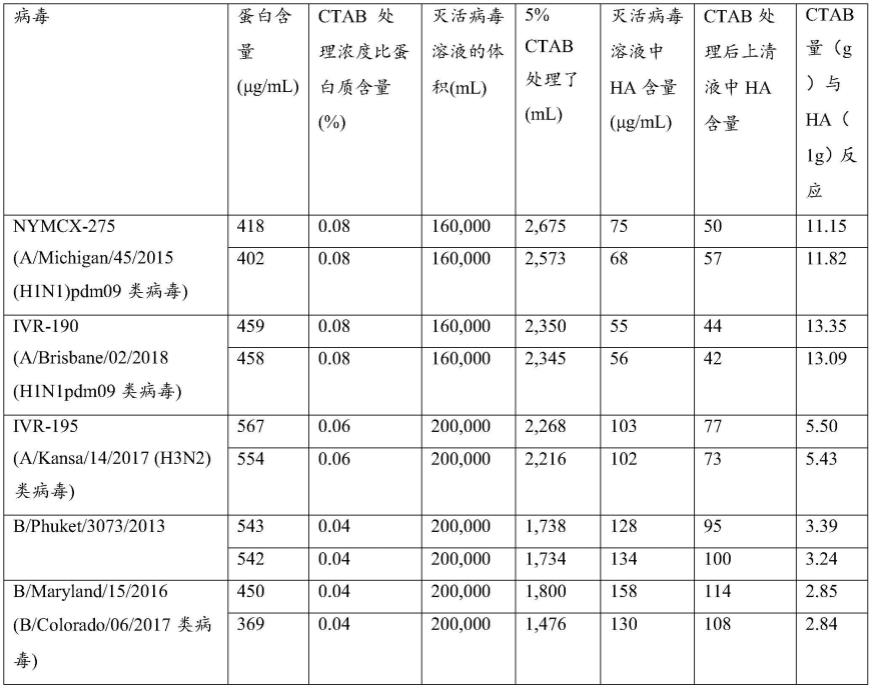
(d)从步骤(c)的培养物中分离流感病毒;
[0167]
步骤(d)是从步骤(c)中获得的病毒培养物中纯化和分离流感病毒的步骤。
[0168]
关于步骤(d)中纯化流感病毒的方法,可以同样适用上述描述。
[0169]
在本发明的一个方面中,步骤(d)可以通过包含以下的方法进行:(d-1)基于在不同条件下纯化以从步骤c)的培养物中纯化流感病毒而获得的流感病毒样品的血凝试验确
定纯化条件;和(d-2)根据步骤(d-1)中确定的条件从步骤(c)的培养物中纯化流感病毒。
[0170]
在步骤(d-1)中,将流感病毒培养物应用于色谱柱,然后在不同条件下通过色谱柱的柱流穿液分别进行血凝试验,以选择具有最低血凝素(ha)滴度的条件。作为血凝试验的结果,通过柱的病毒培养物的ha滴度高是不被优选的,因为这是病毒培养物中的病毒不能与柱结合而是原样通过柱的条件。
[0171]
在本发明的另一方面,在步骤(d-1)中,将流感病毒培养物在不同条件下施加到色谱柱上,然后使用缓冲溶液洗脱结合到色谱柱的流感病毒,并对根据每种条件的洗脱液进行血凝试验、sds-page、,以选择ha滴度最高且在sds-page上观察到ha良好的条件。
[0172]
在本发明的另一个实施方案中,步骤(d-1)可以是病毒培养物通过柱时病毒最有利地结合树脂的条件和在洗脱结合树脂的病毒的过程中病毒可以最有利地洗脱的条件的组合。病毒最有利地与树脂结合的条件可以通过使通过柱的柱流穿液经受血凝试验、sds-page或其组合来选择,并且在洗脱与树脂结合的病毒的过程中,病毒可以最有利地洗脱的条件可以通过对通过柱的洗脱液进行血凝试验、sds-page或其组合来选择。
[0173]
在本发明的另一方面,在步骤(d-1)中,可以对在不同条件下通过色谱柱的病毒培养物进行血凝试验和sds-page,以选择流感病毒损失最少的条件。
[0174]
在本发明的一个方面,浓缩纯化的病毒培养物的步骤可以在步骤(d)之后另外进行。关于浓缩纯化的病毒培养物的方法,上述描述同样适用。
[0175]
此后,用于处理所采样的流感病毒的洗涤剂处理浓度可以通过测定通过上述方法所采样的每单位剂量流感病毒培养物的总蛋白定量值(tpqv),然后将总蛋白量化值代入以下等式1而获得的值来确定:
[0176]
[等式1]
[0177]
洗涤剂处理浓度=[{(a*tpqv(μg/ml))/(bμg/ml)}/c]*d
[0178]
(其中,
[0179]
a为0.005%(v/v)至0.100%(v/v),
[0180]
b为100、200、300、400、500、600、700、800或900,并且选择最接近tpqv的值,
[0181]
c为用于处理的洗涤剂母液浓度(%(v/v)),
[0182]
d为待用洗涤剂处理的采样流感病毒的剂量)。
[0183]
病毒表面抗原疫苗是一种副作用少、纯度高的优质疫苗,设定合适的洗涤剂处理浓度非常重要。当使用过量的洗涤剂进行治疗时,整个病毒被破坏,病毒核心内的蛋白质(其为杂质)暴露在外部,导致纯度降低。当洗涤剂处理浓度不足时,大多数表面抗原不溶解,表面抗原的产率降低。
[0184]
因此,在本发明的一个方面,根据等式计算的洗涤剂处理浓度是用于在病毒核心未被破坏的状态下或病毒核心的破坏最小化的状态下选择性地仅溶解流感病毒的表面抗原的浓度。
[0185]
同时,在流感疫苗生产过程中,快速确定用于溶解病毒表面抗原的适当洗涤剂处理浓度是一个重要因素。目前,国内外普遍使用欧洲药典和世界卫生组织(who)推荐的单向辐射状免疫扩散法(srid)来测定流感疫苗的表面抗原含量,但srid有一个局限性,即获得结果所需的时间太长。
[0186]
因此,本发明提供了一种方法,其中添加的洗涤剂的处理浓度基于每单位剂量病
毒培养物的总蛋白质定量值来确定,但不需要通过srid对病毒培养物中血凝素(ha)蛋白质的量进行定量处理。
[0187]
本发明方法中每单位剂量病毒培养物的总蛋白质定量值(tpqv)可以通过本领域中用于计算蛋白质含量的任何方法来确定,其非限制性实例可以包括bca测定、lowry测定或bradford测定。
[0188]
在本发明的等式1中,a值表示基于蛋白质含量的用于处理的洗涤剂的浓度(%)。由于用于治疗的洗涤剂的最佳浓度可能根据病毒的毒株和病毒的性质而不同,因此可以通过对0.005%(v/v)至0.100%(v/v)范围内的任何值进行sds-page来确认用于治疗的合适洗涤剂浓度(%)。具体地,将病毒溶液分成小部分并用数值范围内的任何值的洗涤剂处理,然后确认用于处理的洗涤剂的最佳浓度,其中表面抗原蛋白作为上清液回收,病毒核心蛋白作为沉淀物通过进行超离心分离,由此可以确定用于处理的洗涤剂的最佳浓度。
[0189]
在本发明中,b值为100、200、300、400、500、600、700、800或900,并且选择最接近tpqv的值。例如,如果采样的流感病毒的tpqv为220μg/ml,则作为这些值中最接近的值200可以是b值,而如果tpqv是370μg/ml,则作为这些值当中最接近的值400可能是b值。
[0190]
在本发明中,tpqv可以根据采样的流感病毒的浓度程度而变化。因此,为了根据本发明的等式1确定最佳洗涤剂处理浓度,优选使用浓缩流感病毒培养物,使得采样的流感病毒具有50μg/ml至950μg/ml的tpqv。
[0191]
本发明还提供了一种用于快速确认流感抗原纯化条件的测试方法,该方法包括第一纯化条件确定方法和第二纯化条件确定方法:
[0192]
第一纯化条件确定方法,其用于从流感病毒培养物中纯化流感病毒的步骤中,并且其中基于在不同条件下纯化获得的流感病毒样品的血凝试验、sds-page或其组合来确定流感病毒的纯化条件;以及
[0193]
第二纯化条件确定方法,其用于使用洗涤剂从流感病毒纯化表面抗原蛋白的步骤中,并且其中基于流感病毒样品的总蛋白定量测定来确定表面抗原蛋白纯化期间的洗涤剂处理浓度。
[0194]
在本发明的一个实施方案中,第一纯化对应于上述步骤(c)的病毒培养纯化步骤。
[0195]
在本发明的另一方面,第一次纯化不需要通过srid(单向辐射状免疫扩散)对病毒培养物中血凝素(ha)蛋白的量进行定量处理。
[0196]
在本发明的另一方面,从流感病毒培养物中纯化流感病毒的步骤可以通过色谱进行。
[0197]
在本发明的另一方面,色谱包括例如离子交换色谱、疏水相互作用色谱、伪亲和色谱、亲和色谱、尺寸排阻色谱、液-液色谱等。在一个实施方案中,优选的纯化方法是亲和色谱,更优选的纯化法是使用硫酸纤维素(cs)作为载体的亲和色谱。
[0198]
在本发明的另一个方面,在第一次纯化中,可以确认通过柱的流感病毒培养物可以最有利地结合到树脂上的条件,然后还可以选择洗脱条件,在该洗脱条件下可以以最佳产率和纯度分离和纯化结合的病毒。
[0199]
在本发明的另一方面,在第一纯化条件确定方法中,流感病毒培养物可以通过应用各种比例用平衡缓冲液稀释,然后可以对在不同条件下通过柱的柱流穿液分别进行血凝测定,以选择具有最低血凝素(ha)滴度的条件。作为血凝试验的结果,通过柱的柱流穿液ha
滴度高是不被优选的,因为这是病毒培养物中的病毒不能与柱结合但按原样通过柱的条件。
[0200]
在本发明的另一方面,在第一纯化条件确定方法中,流感病毒培养物可通过应用各种比例用平衡缓冲液稀释,并在不同条件下应用于色谱柱,然后结合于色谱柱的流感病毒可使用洗脱缓冲液洗脱,并且可以对根据每种条件的洗脱液进行血凝试验、sds-page或其组合,以选择在sds-pace上具有最高ha滴度和最厚血凝素带的条件。
[0201]
在本发明的另一方面,第一纯化条件可以是当病毒培养物通过柱时病毒最有利地结合到树脂的条件和在洗脱结合到树脂上的病毒的过程中病毒可以最有利地洗脱的条件的组合。病毒最有利地与树脂结合的条件可以通过使通过柱的柱流穿液经受血凝试验、sds-page或其组合来选择,并且在洗脱与树脂结合的病毒的过程中,可以通过对通过柱的洗脱液进行血凝试验、sds-page或其组合来选择最有利地将病毒洗脱的条件。
[0202]
在本发明的另一方面,在第一纯化条件确定方法中,可以对在不同条件下通过色谱柱的病毒培养物(即,通过柱的柱流穿液)进行血凝试验、sds-page或其组合,以选择流感病毒损失最少的条件。
[0203]
在本发明的另一个实施方案中,条件可以是选自缓冲液类型、缓冲液浓度、缓冲液ph和电导率的一种或多种。优选地,条件可以是缓冲液的ph或电导率。
[0204]
在本发明的一个实施方案中,通过将缓冲液的ph保持在7.0至7.4来提高蛋白质稳定性,并降低电导率以寻找病毒最有利地结合树脂的条件。在流感病毒培养过程中确保的流感病毒培养物的电导率为约10.0ms/cm至15.0ms/cm,用具有低电导率的磷酸钠缓冲液稀释流感病毒培养液,以确认结合能力,同时降低待装载在柱上的样品的电导率。为了快速确认纯化条件,通过仅调节电导率来减少确认纯化条件所需的时间和变量(ph除外(ph被设置为纯化条件之一))。
[0205]
通常,已知流感病毒与树脂的结合更有利,因为电导率较低,但当电导率降低时,磷酸钠缓冲液的体积和色谱过程的时间增加,这增加了生产周期和生产成本,因此确认适当的电导率是重要的。因此,在本发明的一个实施方案中,在以使用磷酸钠缓冲液将病毒培养液稀释0.5至4倍的方式将电导率降低至10.0ms/cm或更低的同时,对通过柱的病毒培养物进行血凝测定以确认结合能力是否合适。当进行血凝试验时,可以在1小时内获得试验结果,因此在1天内获得根据每个条件的纯化结果。
[0206]
在本发明的另一个实施方案中,结合到树脂上的流感病毒的洗脱可以使用合适浓度的缓冲溶液以寻找最佳电导率的方式进行,在该浓度下,可以裂解树脂和流感病毒之间的结合。
[0207]
根据本发明的一个实施方案,在2m至5m氯化钠缓冲液/线性梯度条件下,在增加盐浓度的同时向柱中加入缓冲液的结果是,当病毒、蛋白质等被洗脱时,在uv280处出现峰值,回收并分析级分以确认含有病毒的级分的电导率和盐浓度。使用2m至5m氯化钠缓冲液和平衡缓冲液在阶梯梯度条件下洗脱病毒,以确认大多数流感病毒是否以相应的洗脱浓度洗脱,然后建立病毒洗脱条件。进行血凝试验和/或sds-page以确认病毒是否以高产率和高纯度洗脱。
[0208]
在本发明的第二纯化条件确定方法中,用于处理病毒溶液的洗涤剂处理浓度可以通过测定通过第一次纯化获得的流感病毒培养物的每单位剂量的总蛋白定量值(tpqv),然
后将总蛋白定量数值代入以下等式1而获得的值来确定:
[0209]
[等式1]
[0210]
洗涤剂处理浓度=[{(a*tpqv()μg/ml))/(bμg/ml)}/c]*d
[0211]
(其中,
[0212]
a为0.005%(v/v)至0.100%(v/v),
[0213]
b为100、200、300、400、500、600、700、800或900,并选择最接近tpqv的值,
[0214]
c为用于处理的洗涤剂母液浓度(%(vv/v)),
[0215]
d为待用洗涤剂处理的流感病毒培养物的剂量)。
[0216]
本发明还提供了一种疫苗生产方法,其中所述步骤是在使用洗涤剂进行处理的条件下进行的,所述洗涤剂的值是通过确定每单位剂量的采样流感病毒的总蛋白定量值(tpqv)
[0217]
[等式1]
[0218]
洗涤剂处理浓度=[{(a*tpqv(μg/ml))/(bμg/ml)}/c]*d
[0219]
(其中,
[0220]
a为0.005%(v/v)至0.100%(v/v),
[0221]
b为100、200、300、400、500、600、700、800或900,并选择最接近tpqv的值,
[0222]
c为用于处理的洗涤剂母液浓度(%(vv/v)),
[0223]
d为要用洗涤剂处理的病毒溶液的剂量)。
[0224]
本发明还提供了一种快速纯化流感表面抗原的方法,该方法包括以下步骤:
[0225]
a)用流感病毒感染细胞并培养该细胞以获得病毒培养物;
[0226]
b)基于血凝试验、sds-page或其组合确定通过在不同条件下纯化获得的流感病毒样品的纯化条件,以从步骤a)的培养物中纯化流感病毒;
[0227]
c)根据步骤b)中确定的条件从步骤a)的培养物中纯化流感病毒;
[0228]
d)基于流感病毒溶液的总蛋白定量测定来确定表面抗原蛋白纯化期间的洗涤剂处理浓度,以从步骤c)中纯化的流感病毒溶液中纯化表面抗原;和
[0229]
e)通过根据步骤d)中确定的条件用洗涤剂处理病毒溶液,从流感病毒中纯化表面抗原蛋白。
[0230]
在本发明的一个方面,用于快速纯化流感表面抗原的方法可以进一步包括在步骤b)之前从病毒培养物中去除细胞和细胞碎片。
[0231]
在本发明的另一方面,从病毒培养物中去除细胞和细胞碎片可以通过一种或多种方法进行,所述方法选自过滤、透析和离心。
[0232]
在本发明的另一方面,在步骤b)中,纯化条件可基于血凝试验和sds-page确定。
[0233]
在本发明的另一方面,用于快速纯化流感表面抗原的方法可以包括通过一种或多种选自步骤c)之后的超滤和渗滤的方法的额外纯化过程。
[0234]
在本发明的另一个方面,在步骤e)中,可以通过进行洗涤剂处理,然后进行离心(优选地,超速离心)并回收上清液来分离表面抗原蛋白。通过洗涤剂处理从病毒核心分离的表面抗原蛋白可以通过离心有效地分离。这种分离可以通过将病毒核心颗粒化来进行,例如通过超速离心。病毒表面蛋白,例如血凝素和/或神经氨酸酶可以存在于上清液中,病毒核心可以存在于颗粒中。为颗粒化病毒核心而选择的离心条件是本领域技术人员已知
的。例如,超速离心可以是分批模式或连续模式,并且可以在合适的温度下进行,例如2℃至25℃,更优选2℃到8℃,在30000g下持续10分钟以上,在200000g下持续10分钟以上。
[0235]
在本发明的另一方面,用于快速纯化流感表面抗原的方法可以进一步包括步骤e)之后的洗涤剂去除过程。这种洗涤剂的去除可以通过适合于此目的的任何方法进行,例如通过用amberlite(安珀莱特)或tff处理。在使用安珀莱特处理的情况下,在步骤e)完成后收集的上清液中加入安珀莱特,例如,在病毒核以安珀莱特与阳离子洗涤剂的质量比约为1:1至100:1颗粒化后,在合适的温度(例如2℃至8℃范围内的温度)下孵育合适的时间,例如,8至24小时、适当地16小时。随后,可通过本领域技术人员已知的任何合适的方法去除安珀莱特,例如,通过使用常规流动过滤/死端过滤、筛网或tff。在使用过滤器的情况下,过滤器的选择应确保过滤器能够保留大于5μm或大于7μm的颗粒。安珀莱特也可以用筛子去除。合适的筛孔可以在0.1μm至200μm的范围内,优选小于150μm,更优选小于100μm。
[0236]
根据本发明的一个实施方案,通过添加安珀莱特xad-4(大网状交联芳族聚合物)去除用作洗涤剂的ctab。由于ctab的高分子量和离子性,通过直接吸附去除ctab。用安珀莱特xad-4处理超速离心上清液以吸附ctab,在2℃至8℃的冷冻条件下搅拌反应3小时或更长时间,然后通过0.22μm过滤器过滤除去安珀莱特xad-4。
[0237]
在本发明的另一个方面,用于快速纯化流感表面抗原的方法可以包括在步骤e)之后用于去除诸如dna杂质的额外色谱执行过程。色谱可以包括例如离子交换色谱、疏水相互作用色谱、伪亲和色谱、亲和色谱、尺寸排阻色谱、液-液色谱等,并且可优选阴离子交换色谱,最优选tmae(三甲基氨基乙基)阴离子交换色谱。dna是一种阴离子,利用与阴离子交换树脂结合的特性可以很容易地分离和去除。
[0238]
在本发明的另一方面,tmae柱可使用磷酸钠缓冲液进行平衡,平衡缓冲液可含有1mm至20mm磷酸钠,ph为6.8至7.6。
[0239]
在本发明的一个实施方案中,为了将dna结合到树脂上并回收流感表面抗原作为柱流穿液,通过向经过安珀莱特xad-4吸附过滤过程的流感表面抗原处理溶液中加入ph为6.5至7.4且含有1m至6m氯化钠的磷酸钠缓冲液来调节电导率,并且在30ms/cm至120ms/cm的电导率下确认了适当水平的表面抗原回收。
[0240]
在本发明的另一方面,用于快速纯化流感表面抗原的方法可以进一步包括通过一种或多种方法的附加纯化过程,所述方法选自用于除去杂质的色谱后的超滤和渗滤。
[0241]
本发明还提供了一种制造含有流感表面抗原的疫苗的方法,该方法包括以下步骤,其中缩短了疫苗生产周期:
[0242]
a)用流感病毒感染细胞并培养该细胞以获得病毒培养物;
[0243]
b)基于血凝试验、sds-page或其组合确定通过在不同条件下纯化获得的流感病毒样品的纯化条件,以从步骤a)的培养物中纯化流感病毒;
[0244]
c)根据步骤b)中确定的条件从步骤a)的培养物中纯化流感病毒;
[0245]
d)基于流感病毒溶液的总蛋白定量测定来确定表面抗原蛋白纯化期间的洗涤剂处理浓度,以从步骤c)中纯化的流感病毒溶液中纯化表面抗原;和
[0246]
e)通过根据步骤d)中确定的条件用洗涤剂处理病毒溶液,从流感病毒中纯化表面抗原蛋白。
[0247]
在本发明的一个方面中,可以在一次性生物反应器(sub)中培养在步骤a)中被病
毒感染的细胞或在步骤b)中被感染病毒的细胞。一次性使用的生物反应器在使用前不需要清洗和消毒,因此具有缩短工艺准备时间和显著降低污染的优点。一次性使用的生物反应器可以在使用后不用洗涤过程而丢弃,并且可以使用新的一次性使用生物反应器,从而避免病毒的批次或菌株之间的交叉污染。特别是,流感疫苗是三价或四价疫苗,因此需要培养三种或四种不同的病毒,因此可以优选使用一次性生物反应器,因为该过程大大简化,并且可以防止菌株之间的交叉污染。
[0248]
在本发明的另一方面,在步骤a)中用病毒感染细胞之前,可使用低速连续离心机将用于病毒感染的细胞培养液的一部分培养基更换为新鲜培养基。由此,培养基可以通过一种方法更换,其中细胞和培养基彼此连续分离,而不需要回收和重新引入培养液的过程,培养基被丢弃,并且新的培养基再次引入生物反应器。与回收全部培养基然后将其分成较小的部分放入容器中并进行离心分离的一般方法不同,当使用低速连续离心机时,优点是可以在封闭系统中进行培养基更换,并且可以大大降低污染的可能性。
[0249]
在本发明的另一方面,在培养基更换中,可以丢弃50%至90%、优选60%至80%、最优选70%至80%的旧培养基,并且可以引入相同量的新鲜培养基。
[0250]
在本发明的另一方面,用于快速纯化流感表面抗原的方法可以进一步包括在步骤c)之后用dna切割酶处理病毒培养物的方法。由于来自用于流感病毒培养的细胞的dna可能混合在病毒培养物中,因此可以添加通过用dna切割酶处理将dna切割成100bp或更小的大小并去除片段的过程。在本发明中,dna切割酶的类型没有特别限制,但dna切割酶可以是全能核酸酶(benzonase)、核酸外切酶、核酶或其混合物。
[0251]
在本发明的另一方面,用于快速纯化流感表面抗原的方法可以进一步包括步骤c)之后的病毒灭活过程。病毒灭活可通过使用洗涤剂、甲醛、β-丙内酯、亚甲基蓝、补骨脂素、羧基富勒烯(c60)、仲乙胺、乙酰亚乙基胺或其组合进行处理。灭活可以通过本领域技术人员已知的物理手段进行,例如通过用伽马射线和/或uv光处理。
[0252]
本发明还提供了一种生产流感病毒的方法,该方法包括:
[0253]
(a)在一次性生物反应器(sub)中培养细胞;
[0254]
(b)使用使用一次性袋的低速连续离心机将步骤(a)的细胞培养液中的一部分培养基更换为新鲜培养基;
[0255]
(c)用流感病毒感染繁殖的细胞,并在允许流感病毒复制的条件下培养细胞;和
[0256]
(d)从步骤(c)的培养物中分离流感病毒。
[0257]
在本发明的一个方面,该细胞可以是madin
–
darby犬肾(mdck)细胞。
[0258]
在本发明的另一方面,在步骤(b)中,培养基可以通过一种方法进行更换,其中使用低速连续离心机将细胞和培养基彼此连续分离,而不需要回收和重新引入全部培养液的过程,丢弃一部分培养基,并将新培养基引入细胞培养箱。
[0259]
在本发明的另一方面,该一部分培养基可以是整个培养液的50%至80%。
[0260]
本发明还提供了一种制造含有流感抗原的疫苗的方法,该方法包括以下步骤,其中缩短了疫苗生产周期:
[0261]
(a)在一次性生物反应器(sub)中培养细胞;
[0262]
(b)使用低速连续离心机将步骤(a)的细胞培养液中的一部分培养基更换为新鲜培养基;
[0263]
(c)用流感病毒感染繁殖的细胞,并在允许流感病毒复制的条件下培养细胞;和
[0264]
(d)从步骤(c)的培养物中分离流感病毒。
[0265]
在本发明的一个方面,步骤(d)可以包括以下步骤来执行:
[0266]
(d-1)基于对通过在不同条件下纯化以从步骤c)的培养物中纯化流感病毒而获得的流感病毒样品的血凝测定来确定纯化条件;和
[0267]
(d-2)根据步骤(d-1)中确定的条件从步骤(c)的培养物中纯化流感病毒。
[0268]
在本发明的另一方面,该方法可进一步包括在步骤(d-1)之前从病毒培养物中去除细胞和细胞碎片。
[0269]
在本发明的另一方面,可以通过一种或多种选自过滤、透析和离心的方法来从病毒培养物中去除细胞和细胞碎片。
[0270]
在本发明的另一方面,在步骤(d-1)中,可通过对在不同条件下纯化的流感病毒培养物样品进行血凝试验、sds-page或其组合来确定纯化条件。
[0271]
在本发明的另一个方面,该方法可以包括在步骤(d-2)之后通过一种或多种选自超滤和渗滤的方法的附加纯化过程。
[0272]
在本发明的另一方面,该方法可进一步包括在步骤(d)之后用全能核酸酶、核酸外切酶、核酶或其混合物处理的方法。
[0273]
在本发明的另一方面,该方法可以进一步包括步骤(d)之后的病毒灭活过程。
[0274]
在本发明的另一个方面,病毒灭活可以通过用洗涤剂、甲醛、β-丙内酯、亚甲基蓝、补骨脂素、羧基富勒烯(c60)、仲乙胺、乙酰基亚乙基胺或其组合处理来进行。
[0275]
在本发明的另一方面,该方法还可以包括以下步骤:
[0276]
(e)从流感病毒中分离表面抗原蛋白。
[0277]
在本发明的另一方面,在步骤(e)中,可以通过执行洗涤剂处理、然后执行离心和回收上清液来分离表面抗原蛋白。
[0278]
在本发明的另一方面,步骤(e)可以包括以下步骤:
[0279]
(e-1)基于流感病毒样品的总蛋白定量测定确定表面抗原蛋白纯化期间的洗涤剂处理浓度,以从步骤(d)中纯化的流感病毒中纯化表面抗原;和
[0280]
(e-2)通过根据步骤(e-1)中确定的条件进行洗涤剂处理,从步骤(d)的流感病毒中纯化表面抗原蛋白。
[0281]
在本发明的另一方面,该方法可以进一步包括步骤(e)之后的洗涤剂去除过程。
[0282]
在本发明的另一个方面,在步骤(e-1)中,洗涤剂处理浓度可以通过测定在步骤(d)中分离的流感病毒的每单位剂量的总蛋白定量值(tpqv),然后将总蛋白量化值代入下面的等式1而获得的值来确定:
[0283]
[等式1]
[0284]
洗涤剂处理浓度=[{(a*tpqv(μg/ml))/(bμg/ml)}/c]*d
[0285]
(其中,
[0286]
a为0.005%(v/v)至0.100%(v/v),
[0287]
b为100、200、300、400、500、600、700、800或900,并且选择最接近tpqv的值,
[0288]
c为用于处理的洗涤剂母液浓度(%(v/v)),
[0289]
d为待用洗涤剂处理的采样流感病毒的剂量)。
[0290]
在本发明的另一个方面,该方法可以包括在步骤e)之后用于除去杂质的附加色谱。
[0291]
在本发明的另一方面,色谱可以是tmae(三甲基氨基乙基)阴离子交换色谱。
[0292]
在本发明的另一个方面,该方法可以包括通过一种或多种选自色谱后超滤和渗滤的方法的附加纯化过程。
[0293]
[有利效果]
[0294]
快速且可靠地确认根据本发明特有的方法获得(纯化)流感表面抗原的条件是有可能的,因此,流感表面抗原亚单位疫苗的生产周期显著缩短,反过来,通过疫苗的快速开发/生产,可以快速应对新流感快速传播的情况。
[0295]
根据本发明的流感病毒生产方法,以及使用一次性袋使用低速连续离心机更换培养基,然后在用病毒感染细胞的步骤中用病毒感染所述细胞。与回收全部培养液,然后分成较小部分放入容器中并进行离心分离的一般方法不同,当使用使用一次性袋的低速连续离心机时,可以在封闭系统中进行培养基更换,污染的可能性可以大大降低。
附图说明
[0296]
图1是通过根据本发明的方法基于蛋白质含量确定病毒(b/maryland/15/2016)的ctab处理浓度、用ctab对灭活的病毒培养液进行处理、以及使用ctab和ctab进行处理而获得的上清液或灭活病毒溶液中所含蛋白质的sds-page分析,然后进行超速离心(ha:血凝素,np:核蛋白,m:基质蛋白)的结果;
[0297]
图2是通过进行线性梯度纯化处理,然后进行sds-page和ha分析,以确定病毒与cs柱树脂结合的最佳条件(ivr-190病毒,线性梯度纯化-色谱图),确认将血凝素损失降至最低的传导性条件的结果;
[0298]
图3是通过进行线性梯度纯化处理,然后进行sds-page和ha分析,以确定病毒与cs柱树脂结合的最佳条件(ivr-190病毒,线性梯度纯化-色谱图(洗脱液部分放大)),确认将血凝素损失减至最小的传导性条件的结果;
[0299]
图4是通过执行线性梯度纯化处理,然后进行sds-page和ha分析以确定病毒与cs柱树脂结合的最佳条件(ivr-190病毒,线性梯度纯化-sds-page结果),确认将血凝素损失最小化到柱流穿液中的导电条件的结果;和
[0300]
图5是通过本发明方法中使用的ha测定和sds-page分析在每种条件下病毒洗脱液的结果。
具体实施方式
[0301]
以下,将详细描述本发明。
[0302]
然而,以下实施例仅说明本发明,并且本发明的内容不限于以下实施例。
[0303]
实施例1:使用本发明特有的一次性袋和低速连续离心机建立流感病毒培养方法的新策略
[0304]
1)mdck细胞的培养
[0305]
本发明的培养方法提供了一种使用一次性细胞培养箱和一次性袋高效培养mdck sky-3851细胞的方法。
[0306]
本发明的一个方面是一种培养方法,包括在37℃和5%co2的培养箱中使用旋转烧瓶培养mdck细胞。125ml旋转烧瓶中的搅拌速度需要设置为40rpm至150rpm,500ml和1l旋转烧瓶的搅拌速度要求设置为80rpm至150转/分。作为用于培养的培养基,使用化学定义的无血清培养基,并以3mm至6mm的浓度添加l-谷氨酰胺作为细胞生长所需的营养素。使用旋转烧瓶在1l或更小的体积中进行培养。
[0307]
本发明的另一方面是在烧瓶培养之后使用一次性袋通过细胞培养箱进行培养,可以通过使用10l、50l、200l或2000l规模的细胞培养箱来增加培养液的规模。在有利的条件下进行细胞培养,并在调节和维持培养条件如溶解氧和ph的同时进行培养。使用培养所需的气体(空气、氧气、二氧化碳或氮气)和碱(碳酸氢钠)调节溶解氧和ph。在一个特定的方面,培养步骤中的温度、溶解氧浓度和ph分别保持在37℃
±
3℃、50%
±
10%do和ph 7.2
±
0.2,并且主培养物中的培养基含有3mm至6mm的l-谷氨酰胺。
[0308]
2)病毒感染
[0309]
本发明通过用流感病毒感染在主培养步骤中固定的细胞培养液来获得病毒培养液。当通过主培养物获得足够数量的细胞时,在细胞感染病毒之前更换培养基。
[0310]
病毒感染前的培养基更换是通过一种方法进行的,在该方法中,细胞和培养基使用一次性袋的低速连续离心机连续地彼此分离,并再次将新培养基引入细胞培养箱。与回收全部培养液,然后分成较小部分放入容器中并进行离心分离的一般方法不同,当使用使用一次性袋的低速连续离心机时,可以在封闭系统中进行培养基更换,污染的可能性可以大大降低。处理步骤中产生的污染导致培养步骤中使用的培养基的浪费和处理周期的延长,导致时间和经济损失。
[0311]
在本发明中,建立了一种培养方法,该方法能够通过使用一次性袋培养细胞,并使用低速连续离心机更换培养基,然后在用病毒感染细胞的步骤中用病毒感染该细胞,从而将污染的可能性减至最小,并最大限度地减少生产周期和生产成本。这种类型的细胞培养和病毒感染过程被称为“使用一次性生物反应器和低速连续离心机(缩写:sbcc)的病毒培养过程”。
[0312]
培养基更换和病毒感染步骤是去除在主培养过程中消耗了营养物质的培养基并从外部引入新培养基和病毒的步骤,是具有最高污染风险的步骤。如果在培养基更换步骤中发生污染,则会破坏生产周期。从解冻用于疫苗生产的mdck-sky3851细胞系的细胞解冻步骤到在10l细胞培养箱中进行病毒感染的情况下的培养基更换需要约13天。在2000l商业生产的情况下,病毒感染的培养基更换大约需要24天。由于额外购买了培养基和一次性袋子,生产成本也增加了。
[0313]
在使用sbcc方法进行培养基更换后,制备用于生产的病毒株,将计算出的具有预定感染复数(moi)的病毒和浓度为2.5μg/ml至20μg/ml的胰蛋白酶无菌地引入细胞培养箱中,感染细胞并培养约2至4天,当病毒滴度、细胞数和存活率达到适当水平时,终止病毒培养,并回收培养液。在本发明的实施例中,将具有3
×
106个细胞/ml或更多的固定细胞数的mdck细胞用病毒处理,所述病毒计算量为moi 0.0001至0.01,胰蛋白酶浓度为1μg/ml至20μg/ml,并培养约3天。
[0314]
实施例2:流感病毒表面抗原纯化过程中新的纯化条件快速搜索策略的建立
[0315]
在从流感病毒纯化表面抗原的过程中,可将洗涤剂(离子或非离子)添加到流感病
毒中,并可通过分级分离手段(如离心)分离和纯化表面抗原蛋白。此时,例如,通常使用离子洗涤剂,如十六烷基三甲基溴化铵(ctab)。
[0316]
关于用于治疗流感病毒的洗涤剂处理浓度,优选根据病毒表面抗原血凝素的含量来确定处理浓度。然而,执行目前普遍使用的标准ha含量测试方法srid(单次辐射免疫扩散)需要大约2至3天,因此srid不适合作为处理中的确认测试,并且具有的缺点是,当nibsc等的srid标准产品的供应未完成或延迟时,无法进行测试。
[0317]
同时,在从流感病毒中纯化表面抗原的过程中,可以选择性地仅分离表面抗原血凝素和神经氨酸酶,而不破坏病毒核心的洗涤剂处理浓度对于每种病毒都是不同的。表面抗原疫苗是一种副作用少、纯度高的高质量疫苗,设定适当的洗涤剂处理浓度非常重要。当使用过量的洗涤剂进行处理时,整个病毒被破坏,病毒核心内的蛋白质(其为杂质)暴露在外部,导致纯化产品中表面抗原的纯度降低。当洗涤剂处理浓度不足时,大多数表面抗原存在于颗粒中,并且表面抗原的产率降低。在短时间内确定合适的洗涤剂处理浓度是生产流感疫苗的一个重要因素。
[0318]
本发明人首先在利用各种分析技术进行各种比较实验之后发明了本发明的方法,该方法与基于实际存在的标准测试方法srid的方法有显著关系,并且可靠性和再现性得到支持。以下实施例支持根据本发明特有的方法的效果是从现有的常规方法中难以预测的特殊效果。以下实施例典型地显示了使用ctab作为洗涤剂的示例,并且这被缩写为ctcct(ctab处理浓度确认测试)。
[0319]
2-1.不依赖于srid的新表面抗原纯化处理条件设置方法的建立
[0320]
本发明人已经通过使用从灭活流感病毒浓缩物中采样的每单位剂量流感病毒的总蛋白定量值(tpqv)来实施用于在表面抗原纯化期间估计优化的洗涤剂(这里,作为示例,ctab)处理浓度的算法,导出了如下等式1所示的等式关系。通过进行bca测定(或lowry测定、bradford测定等),能够在1小时内测定总蛋白质定量值(总蛋白质含量值)。参考总蛋白定量值可能因病毒株而异,但通过分析确认本研究实验中使用的灭活病毒浓缩物中的蛋白质含量为200μg/ml至600μg/ml。在测定灭活病毒溶液中的蛋白质含量后,在100μg/ml、200μg/ml、300μg/ml、400μg/ml、500μg/ml、600μg/ml、700μg/ml、800μg/ml与900μg/ml的值中,与测定的tpqv的近似值相对应的值被设定为ctab处理的蛋白质含量的参考值。根据下面的等式1确定ctab处理浓度,并且相对于灭活病毒溶液中蛋白质含量的ctab处理浓度(%)在0.005%(v/v)至0.100%(v/v)范围内确定。
[0321]
[等式1]
[0322]
洗涤剂处理浓度=[{(a*tpqv(μg/ml))/(bμg/ml)}/c]*d
[0323]
(其中,
[0324]
a为0.005%(v/v)至0.100%(v/v),
[0325]
b为100、200、300、400、500、600、700、800或900,并且选择最接近tpqv的值,
[0326]
c为用于处理的洗涤剂母液浓度(%(v/v)),
[0327]
d为待用洗涤剂处理的采样流感病毒的剂量)。
[0328]
基于蛋白质含量的ctab处理浓度(%)根据菌株和病毒特性而变化,并且在任意范围内进行sds-page以确认和确定合适的ctab处理浓度(百分比)。换言之将灭活的病毒溶液分成小部分并用任意范围的ctab处理,然后根据sky cell flu生产工艺以30000rpm或更高
的速度进行超速离心,以确认最佳ctab处理浓度。
[0329]
将确定的最佳ctab处理浓度应用于生产工艺。使用通过上述方法获得的样品(b/maryland/15/2016病毒)进行sds-page,并获得与图1中相同的结果。已经证实,当用浓度为0.01%至0.10%的ctab进行处理时,当在ctab处理后进行超速离心处理时,除灭活病毒溶液中发现的血凝素以外的杂质(如核蛋白和基质蛋白)被去除,并且只有血凝素作为超速离心上清液被回收。
[0330]
2-2.根据本发明的表面抗原纯化处理条件设置方法的可靠性和再现性的确认——与基于现有srid的方法的相关性
[0331]
表1
[0332]
表1是2000l规模商业生产数据的汇总。根据等式1,基于蛋白质含量计算洗涤剂处理浓度,并进行ctab处理过程。
[0333]
此外,获得灭活病毒溶液中的ha含量和在用ctab处理灭活病毒液后通过进行超速离心处理获得的超速离心上清液中的ha浓度,超速离心上清液中的ha含量为灭活病毒溶液中ha含量的70%至80%。当处理中过量添加ctab以提高ha回收率时,疫苗可能以裂解疫苗而非预期亚单位疫苗的形式生产,因此确定适当的ctab治疗浓度非常重要。
[0334]
因此,已经证实,根据本发明中建立的等式1的洗涤剂处理浓度计算方法是一种能够快速且准确地确定流感病毒表面抗原纯化过程中所需的ctab处理浓度的方法。
[0335]
2-3.基于现有srid(比较例1)的纯化条件设定的执行时间与根据本发明的纯化条件设置的执行时间的比较
[0336]
如在实施例2-2中进行的,将通过常规srid(单向辐射状免疫扩散)的表面抗原纯
化条件设置方法的处理执行时间与通过本发明的纯化条件设置法(参见实施例2-1和实施例2-2)的处理执行时间进行比较,通过本发明的方法的执行时间比通过常规的单向辐射状免疫扩散的执行时间短得多,如下面的表2所示,并且证实本发明方法在确认流感表面抗原纯化条件方面更有效。
[0337]
[表2]
[0338]
实施例3:病毒培养后快速流感病毒抗原纯化条件测试集(缩写rivpct)的建立
[0339]
在含有流感表面抗原的亚单位疫苗的生产过程中,纯化过程主要需要两个处理步骤,即从感染流感病毒的细胞培养物中纯化流感病毒的处理和从流感病毒中分离表面抗原蛋白的处理。在现有的疫苗生产工艺中,可以在两个处理步骤中使用标准测试方法单向辐射状免疫扩散(srid)来优化处理条件,但srid在疫苗生产中存在若干缺点,如上所述。因此本发明人已经寻找了一种新的方法,并开发了包括以下第一纯化条件确定方法和第二纯化条件确定方法(基于实施例2中建立的新策略)的快速流感病毒抗原纯化条件测试集。在本发明中,第一纯化条件确定方法和第二纯化条件确定方法的集合在本文中被称为rivpct。
[0340]
3-1.第一种纯化条件确定方法——从流感病毒培养物中分离/纯化/浓缩流感病毒的情况
[0341]
提供了一种确定方法/鉴别方法,用于快速设置每种病毒的最佳条件,无需在设置从流感病毒中纯化流感病毒的步骤中使用的纯化条件时进行srid测定病毒培养。具体地,提供了一种测试方法/判断方法,用于基于本发明特有的血凝试验、sds-page和鉴别标准,确定在不同条件下通过纯化获得的流感病毒样品中纯化流感病毒的条件,这将在后面描述。
[0342]
在以下实施例中,使用色谱的实施例被示出作为代表性的病毒纯化手段。在将病毒培养液引入色谱柱之前,可以进行预处理,其中细胞和细胞碎片主要从病毒培养液中去除,这种预处理可以通过例如离心、透析、过滤等进行。
[0343]
为了进行色谱分析,有必要为每种流感病毒设置不同的条件,并且由于流感病毒的性质,有必要迅速确认每种病毒株的纯化条件,其中疫苗生产的推荐株每年都会发生变化。为了设定色谱纯化条件,确认流感病毒能够最有利地与树脂结合的条件,然后进行洗脱条件的测试,在该洗脱条件下,结合的病毒能够以最佳产率和纯度分离和纯化。以下,作为代表性实例,描述了在使用硫酸纤维素(cs)色谱的情况下用于确定流感病毒纯化条件(目标物质与cs色谱柱树脂的结合条件和洗脱条件)的方法,其简称为cspct(cs色谱纯化条件测试)。
[0344]
病毒与色谱柱的树脂结合的原理是离子结合,这是由于流感病毒的表面蛋白对树脂的硫酸盐基团的亲和力,结合能力通常取决于电导率和ph。在本实施例中,示例性地示出
了,在将该方法中使用的缓冲液的ph保持在7.0至7.4的中性ph的同时,搜索了可以结合到树脂上的最大病毒数量。通常获得的流感病毒培养物(溶液)的电导率为约10.0ms/cm至15.0ms/cm,并且通过用具有低电导率的磷酸钠缓冲液稀释流感病毒培养液(溶液),在降低待上样到柱上的样品的电导率的同时确认了结合能力。在本实施例中,示例性地示出了,确认纯化条件所需的时间和变量(ph除外(ph通常被设置为纯化条件之一))以仅调节电导率的简单方式减少,以便快速确认处理条件。
[0345]
通常,已知流感病毒与cs树脂的结合更有利,因为电导率较低,但引入磷酸钠缓冲液以降低电导率的体积和cs色谱过程的时间增加,这增加了生产周期和生产成本,因此确认适当的电导率是重要的。因此,在以使用磷酸钠缓冲液将病毒培养液稀释0.5至4倍的方式将电导率降低至10.0ms/cm或更低的同时,对柱流穿液进行血凝试验(ha试验)以确认结合能力是否合适。
[0346]
具体而言,ha分析是根据世界卫生组织编制和分发的“流感实验室诊断和病毒学监测手册”中描述的方案进行的。根据该方法,基于柱流穿液的ha滴度降低的趋势,确认上样样品的适当电导率,同时还进行sds-page,以确认流感病毒是否在每种情况下损失到柱流穿液中。
[0347]
在如上所述确定了病毒与cs柱树脂结合的最佳条件后,搜索适合病毒洗脱的条件。结合到树脂上的流感病毒的洗脱是通过使用含有适当浓度的氯化钠的缓冲溶液来裂解与树脂的结合来寻找最佳电导率的方式进行的。当在线性梯度条件下用2m至5m氯化钠缓冲液增加盐浓度的同时将病毒培养液引入柱中时,当病毒、蛋白质等被洗脱时出现uv峰。回收这些级分,并通过进行ha测定和sds-page确认含有病毒的级分中的电导率和盐浓度。基于这里确认的病毒洗脱条件和上面正确确认的病毒结合能力的电导率条件,使用氯化钠缓冲液和磷酸钠缓冲液在阶梯梯度条件下洗脱病毒,以确认大多数流感病毒是否以相应的洗脱浓度洗脱,然后建立病毒洗脱条件。为了确认病毒是否以高产率和高纯度洗脱,用与上述相同的方法和标准进行ha测定。还进行sds-page用于确认。
[0348]
用于从回收的病毒培养液中纯化病毒的cs色谱纯化条件测试(cspct)可以在约6至12小时内完成,该测试是以上述一系列方法进行的,其中疫苗生产的菌株每年都会发生变化。
[0349]
当设置色谱条件时,最准确的方法是通过执行标准测试方法,即单向辐射状免疫扩散技术(以下简称srid)来确认柱流穿液中的血凝素含量,但确认一个纯化条件需要2至3天,大大增加了条件测试周期,并且srid技术的缺点是,当nibsc(国家生物标准与控制研究所)、tga(治疗品管理局)等的srid标准产品的供应未完成或延迟时。当根据本发明进行ha测定和sds-page时,可以在3小时内获得测试结果,因此每种病毒的纯化条件测试可以在1天内快速完成,并且由于不存在标准产品的供应等问题,对测试执行几乎没有限制。可以说,上述cspct的特征是通过适当降低电导率来确认流感病毒的结合能力的方法,并且在12小时内快速确认以高产率和高纯度洗脱病毒的条件,其原理和步骤与上述相同。
[0350]
3-2.第二纯化条件确定方法——流感病毒表面抗原的分离和纯化
[0351]
为了分离和纯化流感病毒的表面抗原,在本实施例中代表性地给出了使用ctab作为洗涤剂的例子。通过以与实施例2相同的方式在rivpct中进行ctcct,快速确认ctab处理浓度。
[0352]
3-3.根据第一纯化条件确定方法和第二纯化条件确定方法的表面抗原蛋白的纯化效果
[0353]
在基于通过执行srid确认的ha含量确定疫苗生产所需的纯化工艺的必要条件的情况下,可以设置更准确的纯化条件。然而,根据本发明的rivpct,其优点是可以更快地确定疫苗生产所需的纯化过程所需的条件。当使用srid执行方法时,即使不考虑标准产品的拥有和库存期,也需要2天或更长时间。为了缩短所需时间,已经发明了使用sds-page、ha测定等的rivpct方法。
[0354]
[表3]
[0355]
实施例4:生产周期缩短的流感亚单位疫苗生产工艺
[0356]
4-1.用流感病毒感染细胞和培养细胞
[0357]
1)培养mdck(madin
–
darby犬肾)细胞
[0358]
在37℃恒温水浴中解冻一小瓶用于生产疫苗的mdck-sky3851细胞系,并用培养基稀释。接下来,离心稀释的细胞以从培养基中分离细胞,然后用新鲜培养基再次释放细胞颗粒,采集样品,并测定细胞数量和存活率。将细胞接种在125ml旋转烧瓶中,接种浓度为1
×
105细胞/ml至5
×
105细胞/ml,并在37℃、5%co2下以80rpm搅拌培养3-4天。
[0359]
然后,测定在125ml旋转烧瓶中培养的mdck细胞的细胞数量和存活率,充分接种细胞培养液,开始在500ml旋转烧瓶中以250ml规模培养,并在37℃和5%co2下以100rpm的速度进行初级种子培养3-4天。分批处理培养细胞,使用化学定义的培养基作为细胞培养基,并以3mm/l至6mm/l的浓度添加l-谷氨酰胺。在初级种子培养后,测定细胞数量和存活率,然后充分接种细胞以在两个1l转瓶中开始500ml规模的培养,并在与初级种子培养相同的条件下培养3-4天。
[0360]
在500ml规模的培养中从1l旋转烧瓶中取出样品,测定细胞数量和存活率,然后将1l转瓶中培养液的细胞无菌接种到细胞培养箱中,足以在10l一次性细胞培养箱内开始5l规模的细胞培养,并培养3至4天。预先准备必要的仪器以及ph和do探针并进行消毒,将旋转烧瓶中的细胞培养液接种到细胞培养箱中。安装ph和do探针,引入培养基,然后将温度设置为37℃
±
1℃,并校正do值以进行细胞接种。
[0361]
以相同的方式,依次进行细胞培养至50l规模、100l规模、500l规模和2000l规模。
[0362]
2)病毒感染
[0363]
当通过在2000l规模培养的细胞培养箱中取培养液并测定细胞数量和存活率来确保1
×
106细胞/ml至3
×
106细胞/ml或更多的细胞数量时,将现有培养基更换为新鲜培养基。
通过使用低速连续离心机除去基于细胞培养液的70%至80%的培养基并再次将新鲜培养基引入用于细胞培养的一次性使用袋中来更换培养基。
[0364]
在培养基更换和病毒感染过程中,细胞培养箱内部保持在封闭环境中,用于培养基更换的材料是处于灭菌状态的一次性袋,因此污染的可能性非常低。当在10l规模上进行该处理时,相应处理所需的处理时间为3至4小时,而当在2000l规模上商业生产时,所需处理时间为7至12小时。
[0365]
在do为50%
±
10%,ph为7.2
±
0.2的条件下进行病毒感染和繁殖,将用于制造待制造流感病毒的病毒株解冻,将计算出的moi为0.0001至0.002的量的病毒和浓度为2.5μg/ml至20μg/ml的胰蛋白酶无菌导入细胞培养箱,感染细胞并培养约3-4天,当病毒滴度、细胞数量和存活率达到适当水平时,终止培养,并回收培养液。
[0366]
细胞培养和病毒感染方法中未使用微载体。特别是,通过分批细胞培养系统而不是灌注系统培养细胞和繁殖病毒。在mdck-sky3851感染流感病毒后,流感病毒在细胞中繁殖,使细胞破裂,并喷射到外部,因此灌注系统不适合于本发明的系统,因为当细胞通过灌注系统培养时,细胞数量逐渐减少。
[0367]
4-2.从病毒培养和病毒纯化中纯化流感病毒的条件的设置
[0368]
1)离心和过滤
[0369]
当细胞培养箱中的病毒培养完成时,通过使用低速连续离心机以8000rpm至20000rpm的速度离心病毒培养液并回收上清液来去除细胞和细胞碎片。回收的上清液通过1.0/0.5μm预滤器过滤,然后再次通过0.45μm过滤器过滤,以去除一定尺寸或更大的大颗粒。
[0370]
2)纯化条件设置和使用硫酸纤维素(cs)亲和树脂的流感病毒纯化。
[0371]
使用对流感病毒具有亲和性的树脂(硫酸纤维素)对过滤后的病毒培养液进行初级色谱处理。用磷酸钠缓冲液平衡柱后,引入病毒滤液。通过如上实施例3-1所述的cspct方法快速设定纯化条件。使用ivr-190(a/brisbane/02/2018(h1n1)pdm09类病毒)进行纯化条件设置测试,并将cspct方法的结果与srid方法的结果进行相互比较和分析。
[0372]
首先,为了确定病毒与cs柱树脂结合的最佳条件,进行线性梯度纯化过程,并进行sds-page和ha分析,以确认导电条件,在该导电条件下,血凝素损失到柱流穿液中的量最小(图2至图4,表4)。
[0373]
[表4]
[0374]
ivr-190病毒,线性梯度纯化
–
ha测定结果
[0375]
通过用磷酸钠缓冲液稀释ivr-190病毒培养液以1:1平衡,电导率从13.03ms/cm降低到7.54ms/cm,并进行线性梯度纯化条件测试。经证实,在sds-page上,没有ha损失到柱流穿液中,除ha外的杂质被洗脱。使用0.5%鸡红细胞进行ha测定的结果也被证实在所有柱流穿液级分中为0hau/50μl,因此证实用于试验的上样样品的电导率适用于初级色谱纯化。
[0376]
关于病毒洗脱浓度的确认,将含有氯化钠的洗脱用磷酸钠缓冲液和磷酸钠缓冲溶液以适当比例混合并引入,在确认uv280峰的同时收集洗脱的病毒级分,结果,色谱图上的最高峰(uv280值)和ha滴度在0.1m至0.2m nacl浓度下被确认,并且峰和ha滴度被确认逐渐降低,直到0.3m nacl浓度条件下,因此确认0.4m nacl适合作为病毒洗脱浓度以提高产率。考虑到测试结果,将要上样在cs柱上的样品的适当电导率被判断为7.54ms/cm,并且0μm nacl被判断为适合作为病毒洗脱浓度。
[0377]
为了将cspct法与基于srid的方法进行比较,在根据上述cspct方法设置上样样品的导电条件之后,通过将病毒洗脱浓度设置为0.3m、0.35m和0.4m nacl,然后将各个批次的病毒洗脱液中的ha含量相互比较。此外,通过进行sds-page和ha测定,确认了通过本发明的cspct方法获得的结果与通过使用srid的方法获得的结论之间的相关性。
[0378]
进行srid的结果证实,当病毒以0.4m nacl浓度洗脱时,产率和纯度是最有利的(表5)。
[0379]
[表5]
[0380]
ivr-19病毒,阶梯梯度纯化-srid结果(病毒洗脱液)
[0381]
病毒洗脱浓度0.3 m nacl0.35m nacl0.4m nacl病毒洗脱液中ha含量3μg/ml8μg/ml10μg/ml总蛋白质含量129μg/ml130μg/ml142μg/ml纯度(ha/蛋白质)2.3%6.2%7.0%
[0382]
使用用于srid的样品进行cspct方法中使用的ha测定和sds-page,以分析每种条
件下的病毒洗脱液。
[0383]
参考图5的sds-page结果,证实了ha条带随着病毒洗脱浓度的增加而变厚,并且由此发现病毒洗脱液中所含的ha增加。在0.3m和0.35m nacl浓度条件下,病毒洗脱液的ha滴度与1024hau/50μl相同,但在0.4m nacl浓度条件下增加到2048hau/5μl。因此,在同样通过cspct方法确认的病毒洗脱条件下,与使用srid的方法一样,确认病毒洗脱浓度为0.4m nacl,并且可以确认两种方法之间的相关性(表6)。
[0384]
[表6]
[0385]
每种病毒洗脱浓度下病毒洗脱液的ha滴度
[0386]
同时,将纯化过程中使用的平衡缓冲液的ph保持在7.0至7.4的中性ph,并用平衡缓冲液稀释病毒滤液,以将电导率降低到病毒可结合的最大数量的值。在病毒培养结束时,病毒培养液的电导率为约10.0ms/cm至15.0ms/cm,通过用具有低电导率的平衡缓冲液稀释病毒培养液来降低电导率,病毒在约4.0ms/cm至10.0ms/cm的条件下表现出适当水平的结合能力,尽管根据流感病毒的类型存在差异。
[0387]
将用平衡缓冲液稀释的病毒滤液引入cs柱后,对未与柱结合但流出的柱流穿液进行取样并丢弃,通过引入2至3cv的平衡缓冲液充分洗涤柱,然后将含有氯化钠的洗脱液用磷酸钠缓冲液和磷酸钠缓冲溶液以适当比例稀释并引入,在确认uv280峰的同时收集洗脱的病毒级分。流感病毒的洗脱条件是通过确认含有适当浓度的氯化钠的洗脱缓冲液来确定的,在该浓度下,通过在rivpct中进行cspct(参考实施例3-1)可以裂解病毒和树脂之间的结合,并且大多数病毒以1m或更低的氯化钠浓度洗脱。
[0388]
4-3.浓缩病毒并脱盐
[0389]
进行初级超滤以浓缩病毒洗脱液并将病毒洗脱液更换为pbs缓冲液。使用尺寸为300kda至800kda的超滤器将病毒洗脱液浓缩至基于细胞培养液体积的10%或更少,并用体积等于或大于浓缩体积8倍的pbs缓冲液进行渗滤,直到电导率与pbs缓冲溶液的电导率相同。
[0390]
4-4.病毒浓缩物中mdck细胞源dna的去除
[0391]
为了从回收的病毒浓缩物去除细胞系源的dna,用全能核酸酶(merck,inc),一种0.5u/ml至50u/ml的dna裂解酶处理回收的病毒富集物,并在室温下缓慢搅拌30分钟至24小时进行反应。为了提高全能核酸酶的活性,添加0.5mm至5mm六水合氯化镁作为全能核酸酶辅因子。
[0392]
4-5.病毒灭活
[0393]
通过灭活经过全能核酸酶反应的流感病毒浓缩物来消除传染性。作为灭活病毒的化学手段,可以使用任何已知手段,其实例包括洗涤剂、甲醛、β-丙内酯、亚甲基蓝、补骨脂
素、羧基富勒烯(c60)等。在本实施例中,通过用0.01%至0.1%水平的甲醛溶液处理使病毒灭活。
[0394]
4-6.使用洗涤剂分离表面抗原
[0395]
表面抗原蛋白可以通过用洗涤剂(离子或非离子)或溶剂处理流感病毒来分离和纯化,作为代表性实例,通常使用离子洗涤剂,如十六烷基三甲基溴化铵(ctab)。
[0396]
同样,在本实施例中,基于灭活病毒浓缩物中的蛋白质含量,用ctab处理病毒,通过在rivpct中进行ctcct确认ctab的处理浓度,如实施例3-2所示,使用连续超速离心机以30000rpm或更高转速进行离心,然后回收上清液,仅分离表面抗原蛋白。
[0397]
为了去除超速离心上清液中的ctab,向上清液添加吸附树脂(安珀莱特xad-4)以去除ctab。接下来,通过过滤器过滤除去吸附用树脂。
[0398]
4-7.使用tmae阴离子交换树脂去除残留dna
[0399]
为了进一步去除宿主细胞源dna,使用阴离子交换色谱树脂进行二次色谱。用磷酸钠缓冲液平衡柱后,引入病毒表面抗原回收滤液。此时,用含有1m至6m氯化钠且具有高电导率的磷酸钠缓冲液稀释滤液,在表面抗原不与树脂结合但dna与树脂结合的电导率下进行色谱,并回收未与树脂结合过的柱作为表面抗原级分。
[0400]
4-8.表面抗原级分的浓缩和脱盐
[0401]
使用尺寸为30kda至50kda的超滤过滤器浓缩表面抗原级分。浓缩过程完成后,使用pbs缓冲液进行缓冲液交换,直到浓缩液的电导率与pbs缓冲溶液的电导率相同,并回收浓缩液。将回收的浓缩物灭菌,并通过0.5/0.2μm过滤器过滤,以产生储备溶液,储备溶液在2℃至8℃下储存。
[0402]
工业适用性
[0403]
可以快速且可靠地确认根据本发明特有的方法获得(纯化)流感表面抗原的条件,因此,流感表面抗原亚单位疫苗的生产周期显著缩短,反过来,可以通过疫苗的快速开发/生产快速应对新流感快速传播的情况,并且该方法的工业适用性显著提高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1