经改造的CRISPR-Cas系统和用于灵敏且特异性诊断的方法
经改造的crispr-cas系统和用于灵敏且特异性诊断的方法
1.相关申请的交叉引用
2.本技术要求2020年4月27日提交的美国临时申请号63/016,081、2020年7月1日提交的美国临时申请号63/046,936、2020年7月2日提交的美国临时申请号63/047,598、2020年8月13日提交的美国临时申请号63/065,094、2020年8月14日提交的美国临时申请号63/065,626、2020年9月18日提交的美国临时申请号63/080,128和2021年3月5日提交的美国临时申请号63/157,568的优先权权益,这些申请各自通过提及而合并入本文以用于所有目的。
3.发明背景
4.频繁的测试和快速的结果对于停止sars-cov-2的散布和结束当前的covid-19大流行是关键性的。rt-qpcr(逆转录酶-定量聚合酶链反应)已经是关于病毒诊断的金标准,但是该方法是缓慢的并且需要对于购买和操作来说昂贵的复杂设备。因此,对于使得病毒的快速、可靠和可扩缩检测成为可能的便宜的新技术存在急迫的需要。
5.发明概述
6.本公开内容涉及用于检测样品中核酸的存在的方法和经改造的系统。在一些实例中,所述核酸可以与提供所述样品的受试者的疾病相关联,所述样品可以包括体液和/或其他样品类型。在一些实例中,所述核酸可以为核糖核酸(rna)或脱氧核糖核酸(dna)。在一些实例中,所述核酸来自病原体的一个或多个基因组。在一些实例中,所述病原体可以为病毒。在一些实例中,所述病原体可以为来自细菌的rna。本文中所公开的各种实例可以在检测在人中引起冠状病毒疾病2019(covid-19)的严重急性呼吸综合征冠状病毒2(sars-cov-2)的背景下进行描述,虽然可以检测其他核酸。进一步地,可以基于本文中的公开内容来检测除了人以外的其他受试者。应当进一步理解的是,可以基于本文中的公开内容来检测特异的核酸,无论这样的待检测的核酸来源于病原体还是正被测试的受试者。例如,可以基于本文中的公开内容来检测基因组成,例如突变或受试者特异性序列。
7.一个总的方面包括用于检测样品中的核酸(na)的经改造的系统。所述经改造的系统还包括用于检测所述样品中的na的经改造的iii型成簇规律间隔短回文重复序列(clustered regularly interspaced short palindromic repeat;crispr)-cas系统,所述经改造的crispr-cas系统可以包括:与所述核酸的座位互补的crispr rna-指导序列;在所述经改造的iii型crispr-cas系统与所述核酸的座位结合后经历构象变化的第一亚基,所述构象变化激活所述第一亚基的dna酶活性和/或所述第一亚基的聚合酶活性,所述聚合酶活性生成一种或多种产物。所述系统还包括用于检测所述dna酶活性和/或所述聚合酶活性的所述一种或多种产物的检测系统。
8.施行可以包括一个或多个下列特征。所述核酸可以包括病毒rna。所述病毒rna可以包括严重急性呼吸综合征冠状病毒2(sars-cov-2)的rna。所述座位可以包括sars-cov-2的核衣壳基因(n-基因)。所述座位可以包括在多个sars-cov-2基因组中保守的病毒rna的区域。所述crispr指导序列可以包括seq id no.1的核酸序列。
9.所述一种或多种产物可以包括线性或环状寡核苷酸,并且所述检测系统可以包括
仪器化荧光测定检测,其可以包括:将荧光团连接至猝灭剂的rna系链;和由所述线性或环状寡核苷酸激活的核酸酶,经激活的核酸酶切割所述rna系链以由此释放所述荧光团,其由荧光检测仪器来进行检测。所述线性或环状寡核苷酸可以包括环状寡腺苷酸,并且所述由所述线性或环状寡核苷酸激活的核酸酶可以包括csm6。所述仪器化荧光测定检测进一步可以包括:将所述荧光团或第二荧光团连接至所述猝灭剂或第二猝灭剂的dna系链,其中所述dna酶活性切割所述dna系链以由此释放所述荧光团或所述第二荧光团。所述检测系统可以包括仪器化荧光测定检测,其可以包括:将荧光团连接至猝灭剂的dna系链,其中所述第一亚基具有在所述rna指导与所述病毒rna的座位杂交后被激活的dna酶活性,所述dna酶活性切割所述dna系链以由此释放所述荧光团,其被检测。所述一种或多种产物可以包括线性或环状寡核苷酸,并且所述检测系统可以包括仪器化荧光测定检测,其可以包括:将荧光团连接至猝灭剂的dna系链;和由所述线性或环状寡核苷酸激活的核酸酶,经激活的核酸酶切割所述dna系链以由此释放所述荧光团,其由荧光检测仪器来进行检测。所述一种或多种产物可以包括焦磷酸根,并且所述检测系统可以包括可见荧光测定检测,其可以包括:被猝灭剂猝灭的荧光染料,其中所述焦磷酸根与所述猝灭剂形成不溶性沉淀物,以由此使所述荧光染料未猝灭,其基于颜色变化来进行检测。所述荧光分子可以为钙荧光素并且所述猝灭剂可以包括锰,并且未猝灭的钙荧光素被镁结合以形成荧光复合物,其被检测。
10.所述第一亚基可以包括cas10亚基,所述第二亚基可以包括csm3,并且所述cas10亚基的活性通过处于野生型形式的所述第二亚基的活性而变缓和,并且对于所述第二亚基的所引入的突变破坏所述cas10亚基的缓和。所述一种或多种产物可以包括质子,并且所述检测系统可以包括比色系统,所述比色系统可以包括:可以包括ph-敏感性染料的溶液;并且其中所述质子使所述溶液酸化,从而导致所述ph-敏感性染料的颜色变化。所述经改造的iii型crispr-cas系统进一步可以包括:经改造的第二亚基,其可以包括具有所引入的突变的所述经改造的iii型crispr-cas系统的骨架亚基,所述经改造的第二亚基在当处于野生型形式时具有rna酶活性,但是所引入的突变破坏所述rna酶活性以防止所述病毒rna的降解,由此增加了所述检测系统的信号生成。所述第二亚基的野生型形式可以包括seq idno.26的氨基酸序列,并且具有所引入的突变的所述第二亚基可以包括seq id no.27的氨基酸序列。
11.所述一种或多种产物可以包括(i)线性或环状寡核苷酸、(ii)质子和(iii)焦磷酸根,其中所述检测系统可以包括:荧光测定检测,其可以包括:将荧光团连接至猝灭剂的rna系链;由所述线性或环状寡核苷酸激活的核酸酶,经激活的核酸酶切割所述rna系链以由此释放所述荧光团,其被检测;和比色检测,其可以包括:可以包括ph-敏感性染料的溶液;并且其中所述溶液被所述质子酸化,从而导致所述ph-敏感性染料的颜色变化。所述荧光测定检测进一步可以包括:将所述荧光团或第二荧光团连接至所述猝灭剂或第二猝灭剂的dna系链,其中所述dna酶活性切割所述dna系链以由此释放所述荧光团或所述第二荧光团。所述一种或多种产物可以包括质子,其中所述检测系统可以包括:荧光测定检测,其可以包括:将荧光团连接至猝灭剂的dna系链,其中所述dna酶活性切割所述dna系链以由此释放所述荧光团,其被检测;和比色检测,其可以包括:可以包括ph-敏感性染料的溶液;并且其中所述溶液被所述质子酸化,从而导致所述ph-敏感性染料的颜色变化。所述核酸可以包括rna,所述系统可以包括:具有t7结合位点的逆转录环介导式等温扩增(rt-lamp)引物,其用
于所述rna的rt-lamp-t7扩增。所述rt-lamp-t7扩增和所述rna的检测可以包括单罐组合。
12.一个总的方面包括基于经改造的iii型成簇规律间隔短回文重复序列(crispr)-cas系统来检测样品中的核酸的方法。所述检测核酸的方法还包括使所述样品与所述经改造的iii型crispr-cas系统相接触,所述经改造的iii型crispr-cas系统可以包括:第一亚基,和可以包括经改造从而与所述核酸的座位互补的crispr指导序列的crispr指导物。当所述经改造的crispr-cas系统经由所述crispr指导物在所述座位处与所述核酸结合时,所述第一亚基经历构象变化,其激活所述第一亚基的核酸酶活性和/或聚合酶活性;并且检测所述核酸酶活性,和/或所述聚合酶活性的一种或多种产物。
13.施行可以包括一个或多个下列特征。所述方法,其中所述核酸可以包括病毒rna。所述病毒rna可以包括严重急性呼吸综合征冠状病毒2(sars-cov-2)的rna。所述方法可以包括:在使所述样品与所述经改造的iii型crispr-cas系统相接触之前,用等温扩增来扩增所述病毒rna。所述等温扩增可以包括基于针对所述座位的引物的逆转录环介导式等温扩增,所述引物包括用于t7 rna聚合的t7启动子位点。所述病毒rna在没有聚合酶链反应(pcr)的情况下进行扩增。所述经改造的iii型crispr-cas系统可以包括切割所述病毒rna的csm3亚基,所述方法可以包括:向在所述经改造的crispr-cas系统中的csm3亚基引入突变,以防止所述病毒rna的降解。使所述样品与所述经改造的iii型crispr-cas系统相接触可以包括:使所述样品与通过核酸系链而栓系在一起的荧光团和猝灭剂相接触,其中所述构象变化引起所述cas10亚基生成线性或环状寡核苷酸,其激活核酸酶,经激活的核酸酶切割所述核酸系链以由此从所述猝灭剂释放出所述荧光团;并且其中检测所述一种或多种产物可以包括检测所释放出的荧光团的荧光水平。所述系链可以包括核糖核酸和/或脱氧核糖核酸系链。
14.使所述样品与所述经改造的iii型crispr-cas系统相接触可以包括:使所述样品与ph-敏感性染料相接触,其中所述构象变化引起所述cas10亚基生成使所述溶液酸化的质子;并且其中检测构象变化的发生可以包括通过所述ph-敏感性染料的颜色变化来检测所述溶液的酸化。使所述样品与所述经改造的iii型crispr-cas系统相接触可以包括:使所述样品与可以包括被金属离子猝灭的荧光素染料的溶液相接触,其中所述第一亚基的聚合酶活性生成螯合所述金属离子以使所述荧光素染料游离的焦磷酸根,游离的荧光素染料与所述辅因子相结合以生成荧光复合物;其中检测所述一种或多种产物可以包括检测所述荧光复合物。
15.附图简述
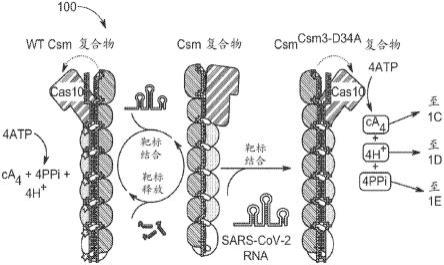
16.图1a图解说明了检测样品中的核酸(例如病毒rna)的经改造的iii型crispr-cas系统的例子。
17.图1b图解说明了鉴定用于生成crispr指导序列的sars-cov-2基因组的保守的和有过多代表的区域的例子。
18.图1c图解说明了仪器化荧光测定检测的例子。
19.图1d图解说明了比色检测的例子。
20.图1e图解说明了可见(裸眼)荧光测定检测的例子。
21.图2a图解说明了被10个指导物中的每一个所靶向的sars-cov-2基因组的区域,和用于测试指导物的基于rna报道分子的测定法(右)的示意图。
22.图2b图解说明了搀入到从缺乏sars-cov-2感染的患者中提取的rna之中的sars-cov-2ivt rna的检测,通过十种不同的ttcsm
csm3-d34a
复合物(25nm),经由在图1c中图解说明的基于报道rna的测定法和引物序列。
23.图2c图解说明了sars-cov-2基因组的直接检测的结果。
24.图2d图解说明了绘制图,其显示了通过简单线性回归计算出的渐增的荧光的斜率。
25.图3a图解说明了基于rt-lamp-t7-csm的检测的示意图。
26.图3b图解说明了绘制图,其显示rt-lamp-t7-csm是特异性的。
27.图3c图解说明了绘制图,其显示rt-lamp-t7-csm是灵敏的。
28.图3d图解说明了绘制图,其显示了在t7-csm反应中荧光信号增加的动力学。
29.图3e图解说明了绘制图,其显示了用rt-qpcr(x-轴)和rt-lamp-t7-csm(y-轴)进行测试的来自56名个体的鼻咽拭子的结果。
30.图4a图解说明了加载有不同的crrna指导物的ttcsmwt和ttcsmcsm3-d34a复合物的大小排阻色谱法(sec)特性谱的绘制图。
31.图4b图解说明了涉及图4a的级分的sds-page结果的图像。
32.图4c图解说明了从经汇集和经浓缩的sec级分中分离的rna的绘制图。
33.图4d图解说明了ttcsmcsm3-d34a n1复合物的sec特性谱。
34.图4e图解说明了对于在图4d中的六个级分中的每一个所估计的cas10的序列特异性激活。
35.图4f图解说明了在superdex 200 26/600大小排阻柱(cytiva)上纯化的ttcsm6辅助核酸酶的sec特性谱。
36.图4g图解说明了经纯化的ttcsm6的sds-page凝胶图像。
37.图5图解说明了基于csm6的ca
4-依赖性激活的荧光信号生成的绘制图。
38.图6图解说明了特异rna序列的比色检测。
39.图7a和7b图解说明了特异rna序列的可见荧光测定检测。
40.图8a和8b图解说明了通过rt-lamp-t7-csm的sars-cov-2的快速且特异性的检测。
41.图9图解说明了对于sars-cov-2滴度的绝对定量的标准曲线。
42.图10图解说明了使用rt-qpcr扩增的病毒rna检测与经由rt-lamp-t7扩增的病毒rna检测的比较。
43.图11图解说明了使用rt-qpcr扩增和rt-lamp-t7扩增及随后的iii型crispr-cas(在图10中图解说明的)的病毒rna检测的结果的例子。
44.图12a图解说明了用于放大诊断信号的在csm复合物中的rna酶失效突变的例子。
45.图12b图解说明了来自viris检测测定法的结果。
46.图13a图解说明了样品中的病毒rna的双重检查检测的例子。
47.图13b图解说明了rt-lamp-t7和viris反应的绘制图。
48.发明详述
49.图1a图解说明了检测样品中的核酸的经改造的系统的例子。如在本文中所使用的,术语“经改造的”可以是指蓄意地生成否则是非天然地出现的系统。这样的改造可以包括向基因序列引入一个或多个突变;设计基因序列;将一组组分例如蛋白质和检测组分进
行组合,当在自然界中不出现此类组合时;和/或以其他方式生成非天然地出现的系统,以检测样品中的核酸。待检测的核酸在本文中可以可互换地称为靶核酸。所述靶核酸可以为rna或dna。
50.所述经改造的iii型crispr-cas系统可以被施行为用于测试sars-cov-2病毒(或样品中的其他靶核酸)的测定法(其可以快速地实施,例如在一个小时或更短时间内)。通过iii型系统的核酸识别可以触发cas10-介导的核酸酶活性和/或聚合酶活性,其可以生成一种或多种产物例如焦磷酸根、质子和环状寡核苷酸。所述核酸酶活性和/或cas10-聚合酶的一种或多种产物通过使用比色检测、可见荧光测定检测和/或仪器化荧光测定检测来进行检测。
51.所述经改造的系统100可以包括经修饰的crispr复合物、检测组分和/或其他组分。所述经修饰的crispr复合物可以包括经修饰的iii型crispr复合物。所述经修饰的crispr复合物可以包括crispr指导物和多个亚基。
52.所述多个亚基可以包括crispr指导物,cas10亚基,与csm(例如csm3)或cmr系统相关联的骨架亚基,和/或对于iii型监视复合物以及辅助核酸酶(例如csm6、can1、csx)的装配来说必需的其他亚基。本文中所描述的各种例子可以描述从嗜热栖热菌(thermus thermophilus)这一生物中纯化出的crispr复合物。这些例子可以进一步描述嗜热栖热菌crispr复合物的蛋白质亚基的用途。因此,这些例子可以是指诸如ttcas10、ttcsm3、ttcsm6等的亚基。然而,应当注意的是,可以也和/或代替亚基的这些例子,使用执行相似功能的其他蛋白质亚基。
53.所述crispr指导物可以包括经改造以与所述核酸的座位互补的crispr指导序列。所述crispr指导序列可以基于所述靶核酸的一个或多个保守区域来进行选择。例如,图1b图解说明了鉴定用于生成crispr指导序列的靶基因组的保守区域的例子。也可以基于图1b靶向来自其他靶生物(包括受试者自身)的其他靶核酸。如所显示的,可以将sars-cov-2病毒的不同基因组相互进行比对以鉴定保守区域。一般而言,具有较大比对的区域(较少的碱基对差异和较长的比对长度)相比于具有较小比对的区域而言是更好的用于生成互补序列以用作crispr指导序列的候选物。
54.所述crispr指导序列可以基于在sars-cov-2的不同样品、sars-cov-2的不同毒株和/或对于sars-cov-2可得的其他样品之间的保守序列来进行设计。这样的保守序列可以基于序列比对来确定。当成对匹配的比对质量足以确定两个序列的所比对的部分代表了横跨sars-cov-2(或其他靶标)基因组的序列中的核苷酸的保守性时,可以考虑成对匹配。所述比对质量可以明确说明为具有至少大约1个碱基、2个碱基、4个碱基、4个碱基、5个碱基、10个碱基、15个碱基、40个碱基、25个碱基、40个碱基、45个碱基、40个碱基、45个碱基、50个碱基、55个碱基、60个碱基、65个碱基、70个碱基、75个碱基、80个碱基、85个碱基、90个碱基、95个碱基或100个碱基的最小重叠。备选地,或另外地,所述比对质量可以基于至少大约5%、10%、15%、40%、25%、40%、45%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多的最小比对同一性。在一些情况下,判断标准可以要求具有至少大约70%同一性的至少25-nt重叠。
55.在该例子中,选择编码sars-cov-2核衣壳(n)基因的序列来充当用于生成crispr指导序列的基础。所述crispr指导序列的例子包括seq id no.1和seq id no.2。
56.最近,已开发出了环介导式等温扩增(lamp)(notomi等人,2000)作为灵敏的(1-100个拷贝/μl)床旁诊断(dao thi等人,2020;zhang等人,2020)。然而,lamp倾向于生成假阳性,除非使用第二种序列特异性技术以检查扩增出的dna(dao thi等人,2020;rolando等人,2020)。已将v型(基于cas12的)和vi型(基于cas13的)crispr系统与lamp或rpa(重组酶聚合酶扩增)相偶联以用于病毒核酸的灵敏且可靠的检测(broughton等人,2020;chen等人,2018;gootenberg等人,2018,2017;joung等人,2020)。在等温扩增之后,rna-指导的cas12或cas13蛋白与经扩增的靶标相结合并且触发非序列特异性核酸酶活性,其切割经荧光团和猝灭剂标记的dna或rna(chen等人,2018;gootenberg等人,2018)。所述系链的切割导致荧光的增加,其可以在45分钟内被检测到。虽然cas12和cas13检测方法已进行了数次迭代优化以与病毒rna的等温扩增相容,但是最终目标是开发出对于直接地(没有事先扩增)检测病毒rna来说足够灵敏的基于crispr的技术。最近,fozouni等人报道,iv型(基于cas13a的)crispr系统可以用于在~30分钟内的和具有~100个拷贝/μl的灵敏度的sars-cov-2rna的无扩增检测(fozouni等人,2020)。
57.像iv型(基于cas13的)系统一样,iii型系统也靶向rna(hale等人,2009;kazlauskiene等人,2016;samai等人,2015;staals等人,2014;tamulaitis等人,2014)。然而,iii型系统依赖于独特的内在信号放大机制(图1)。这里我们着手确定通过iii型系统的内在扩增是否可以用于检测病毒rna而无需事先扩增。在此所呈现的概念验证证明,可以对来自嗜热栖热菌的csm复合物(ttcsm)进行编程以特异性地识别sars-cov-2基因组。sars-cov-2,而非sars-cov-1或一小组其他呼吸道病原体,激活cas10聚合酶,其在结合rna靶标后生成~1000个环状核苷酸(例如,ca4)(jia等人,2019;kazlauskiene等人,2017;niewoehner等人,2017;rouillon等人,2018)。像所有聚合酶一样,通过cas10的核苷酸聚合也生成质子(h
+
)和焦磷酸根(ppi)。如在本文中所公开的,这三种产物中的每一种可以分开地或与另一种相组合地用于通过使用比色方法、荧光测定方法或这两种方法(同时地)来检测sars-cov-2rna。所述测定法可以在1至30分钟内实施,取决于检测方法和rna的浓度。当与逆转录lamp(rt-lamp)相偶联时,所述测定法可以在少于30分钟内实施并且具有~200个拷贝/μl的检测极限。
58.结果和讨论
59.cas10聚合酶的序列特异性激活产生三种可检测的产物
60.通过iii型crispr系统的rna的序列特异性识别起始信号传导级联,如在图1a中所图解说明的(kazlauskiene等人,2017;niewoehner等人,2017;rouillon等人,2018)。通过ttcsm复合物的rna结合触发构象变化,其激活cas10亚基的palm结构域,其通过将atp转化为大约1,000个环状寡腺苷酸(例如,ca4)来放大rna结合信号(jia等人,2019;kazlauskiene等人,2017;niewoehner等人,2017;rouillon等人,2018)。我们假设,iii型crispr系统所独特的内在信号放大将会提高直接rna检测的灵敏度,而同时保持特异性。为了测试该假说,我们表达并且纯化了具有与sars-cov-2的n-基因互补的指导物(crrna
n1
)()的来自嗜热栖热菌的iii-a型crispr rna(crrna)-指导的监视复合物(ttcsm),它们中的一个例子图解说明在图1b中。
61.仍然参考图1a,形成csm复合物的“骨架”的csm3亚基是以6-nt增量切割所结合的靶rna的核酸酶(liu等人,2017;samai等人,2015;tamulaitis等人,2014)。经切割的rna片
1rna)可能都是对于触发荧光rna报道分子的切割来说所需要的。ca4的添加绕开信号传导途径并且直接激活ttcsm6,从而在sars-cov-2rna不存在下切割报道rna(最后一条泳道)。这些反应通过使用搀入到鼻咽拭子临床基质中的108个拷贝的体外转录出的sars-cov-1或-2rna来进行。显示了来自三次技术重复的结果。在最后一列(ca4)中呈现的结果证明,所述荧光信号由csm6的ca
4-依赖性激活来生成。在表1中举例说明了荧光报道rna的例子。
69.表1.荧光报道rna的例子
70.名称序列(5
’‑3’
)rna报道分子a/56-fam/rcrurcrurcru/3iabkfq/(图1)rna报道分子b/56-fam/rarurcrururcrururaru/3iabkfq/(图2和3)
71.通过其他csm复合物,在靶rna中的单错配已显示出导致10倍更低的环状寡腺苷酸产生量(nasef等人,2019)。通过使用荧光测定检测,突变型和野生型csm复合物两者都可以检测到处于超过108个拷贝/反应的浓度下的sars-cov-2rna,并且没有一种复合物在所测试的最高浓度下与sars-cov-1rna交叉反应。rna酶-失效ttcsm复合物比野生型灵敏大致3倍,具有~107个拷贝/反应的lod。
72.图1d和6各自图解说明了比色rna检测,其利用在核苷酸聚合期间发生的ph变化。参考6,将ttcsm
csm3-d34a
与任一rna靶标一起在atp存在下在60℃下温育30分钟。特异rna识别以及相关的cas10-介导的atp聚合引起溶液的酸化,并且将酚红ph指示剂的颜色从紫红色经由橙色变为黄色。显示了三次技术重复(a、b和c)。sars-cov-2被rna酶-失效ttcsm复合物的特异性识别激活了cas10。cas10使atp聚合(jia等人,2019;kazlauskiene等人,2017;niewoehner等人,2017;rouillon等人,2018),从而释放出一个质子/所掺入的核苷酸。由cas10生成的质子使溶液酸化,并且将ph指示剂(即,酚红)的颜色从紫红色经由橙色(10
10
个rna拷贝)变为黄色(10
11
个rna拷贝)。类似地,我们开发了可见荧光测定检测方法,其依赖于金属离子被焦磷酸根的螯合。金属指示剂钙荧光素最初被所结合的mn
2+
离子猝灭(tomita等人,2008)。除了环状寡腺苷酸和质子外,cas10聚合酶还生成一个焦磷酸根/经聚合的atp。焦磷酸根与mn
2+
形成不溶性沉淀物,这使钙荧光素未猝灭。然后,游离的钙荧光素被过量的mg
2+
结合,从而形成可以在少于10分钟内通过眼睛或用uv灯被看见的荧光复合物,如在图1e、7a和7b中所图解说明的。参考图7a,将ttcsm
csm3-d34a
与无rna、特异rna靶标(即sars-cov-2)或非特异rna靶标(sars-cov-1)一起在atp存在下在60℃下温育50分钟。反应包含相对于mn
2+
离子而言过量的mg
2+
,和金属指示剂钙荧光素。钙荧光素优先地结合mn
2+
,从而形成被猝灭的复合物。特异rna识别以及相关的cas10-介导的atp聚合生成焦磷酸根,其与mg
2+
和mn
2+
离子一起沉淀。过量的mg
2+
离子结合钙荧光素,以形成高度荧光复合物,其可以通过眼睛在可见光下或用uv光被看见。参考图7b,关于在图7a中所显示的相应的反应的钙荧光素荧光的动力学。可以在10分钟内检测到10
10
个sars-cov-2rna,和在40分钟内检测到109个拷贝。对于无rna对照,或对于包含sars-cov-1rna的样品,在头五分钟之后未看到荧光的增加。
73.患者样品中的sars-cov-2rna的基于csm的直接检测
74.使用crrna
n1
的lod为107至108个拷贝的ivt rna/μl,其不足以是在临床上适宜的。为了鉴定可能胜过或补足crrna
n1
的活性的其他指导物,我们比对了从gisaid可得的45,641个sars-cov-2基因组(elbe和buckland-merrett,2017)。将这些比对用于基于四个关键标准来选择指导物。首先,每个靶序列在所述可得的sars-cov-2基因组之中必须是大于99%
同一的。第二,不允许在靶标和crrna之间的互补性延伸超出间隔子序列(指导物),和延伸入已显示出阻抑cas10活性的crrna的重复序列衍生部分中(kazlauskiene等人,2017)。第三,我们靶向在sars-cov-1和mers-cov中相差至少两个核苷酸的sars-cov-2的区域。第四,删节靶序列的列表以去除与人mrna序列或者常见的口腔和呼吸道病原体序列具有相似性的指导物(e-值《1000)。最后,我们关注于位于orf3a基因的3’处的靶序列,其在病毒基因组上和在感染期间生成的亚基因组rna上都存在。总之,我们设计了靶向在sars-cov-2基因组上的10个不同位置的crrna,如在图2a中所图解说明的。指导rna的例子列为seq id no.3-12。图2a图解说明了被10个指导物中的每一个所靶向的sars-cov-2基因组的区域,和用于测试指导物的基于rna报道分子的测定法(右)的示意图。
75.为了测定这些指导物的每一个如何运行,我们通过使用荧光测定报道分子测定法(即,fam-rna-iowa black fq)测量了rna的序列特异性检测,其结果图解说明在图2b中。图2b图解说明了搀入到从缺乏sars-cov-2感染的患者中提取的rna之中的sars-cov-2ivt rna的检测,通过十种不同的ttcsm
csm3-d34a
复合物(25nm),经由在图1c中图解说明的基于报道rna的测定法和引物序列(seq id no.13-18)。显示了两次技术重复的平均值和标准偏差。大多数crrna提供了相似的灵敏度,但是crrna
n1
和crrna
n9
生成比所测试的次优复合物显著地更多的信号(p-值《0.0001)。然后,我们在从被感染的患者的鼻拭子中分离的rna上测试了crrna
n1
和crrna
n9
,其结果图解说明在图2c中。图2c图解说明了通过25nm ttcsm
csm3-d34a n1或n9或者十种不同的ttcsm
csm3-d34a
复合物(每种以2.5nm)的混合物,在从患者样品中提取的rna之中的sars-cov-2基因组的直接检测,经由基于报道rna的测定法。将从具有高病毒载量(5
×
108个拷贝/μl,通过rt-qpcr所测定的)的患者中提取的rna稀释到从缺乏sars-cov-2感染的患者中提取的rna之中。显示了三次技术重复的平均值和标准偏差。对于ivt rna或从sars-cov-2阳性患者中分离的rna,由crrna
n1
和crrna
n9
指导的复合物都生成相似的信号(即,相对于第一个时间点,到5分钟之前的信号的2至3倍增加)。关于crrna
n1
和crrna
n9
的lod为107个拷贝/μl,如在图2d中所图解说明的(p-值《0.0001)。参考图2d,通过简单线性回归来计算在图2c中所图解说明的渐增的荧光的斜率。显示了计算出的斜率和
±
95%置信区间。通过f-检验,将阳性rna斜率与阴性拭子rna斜率进行比较:****p《0.0001,ns=不显著地高于阴性拭子rna对照。
76.fozouni等人最近显示,对cas13多重复用(即将多种指导物合并到单个反应中)改善了sars cov-2检测的灵敏度(fozouni等人,2020)。我们推断,相似的益处对于基于csm的检测也许是可能的。为了检验该想法,我们将10种指导物(每种2.5nm)合并到单个多重复用反应中。对10种指导物多重复用将从阳性患者的鼻拭子中分离的sars-cov-2rna的ttcsm-介导的检测的灵敏度改善了大约10倍,如在图2c和2d中所显示的。然而,直接检测的灵敏度看起来随着ttcsm复合物的数目而累加地增加,这排除了在临床上适宜的浓度下的rna的直接检测。
77.通过使用rt-lamp和t7-csm来关于sars-cov-2测试临床样品
78.基于csm的检测目前对于在所有能够散布感染的患者中直接检测sars-cov-2来说不是足够灵敏的,这需要103个rna拷贝/μl的lod(la scola等人,2020;larremore等人,2021;paltiel等人,2020;等人,2020)。为了将基于iii型crispr的诊断的lod降低至103个rna拷贝/μl或更低,我们纳入了上游核酸扩增技术,如在图3a中所图解说明的。图
3a图解说明了基于rt-lamp-t7-csm的检测的示意图。将病毒rna进行逆转录,并且将所得的dna在rt-lamp反应中进行扩增以产生关于t7 rna聚合酶的转录模板(以一罐方式)。然后,将rt-lamp反应体系(29分钟)的等分试样与t7-csm反应体系(1分钟)相混合。首先,将sars-cov-2基因组rna逆转录(rt)为dna,然后将其通过lamp进行扩增,其中使用在由crrna
n1
和crrna
n9
所靶向的sars-cov-2基因组的区域侧翼的引物。lamp引物之一将t7启动子掺入到扩增出的dna中,然后将其用于体外转录(t7)并且通过ttcsm来进行检测,如在图3a和8中所图解说明的。用于rt-lamp的引物的例子提供在序列表中(seq id no.19-25)。
79.为了确认基于ttcsm的检测的特异性,我们测试了sars-cov-2,连同一小组八种其他口腔和呼吸道病原体(包括冠状病毒sars-cov-1、中东呼吸综合征冠状病毒(mers-cov)、人冠状病毒hku1和人冠状病毒nl63)一起,如在图3b中所图解说明的。图3b图解说明了绘制图,其显示rt-lamp-t7-csm是特异性的。无论是crrna
n1
还是crrna
n9
均不与其他冠状病毒或其他常见的人口腔病原体或区系交叉反应。通过所述两种crrna的sars-cov-2的检测都是快速的(1分钟),并且是稳健的(相对于无模板对照(ntc)的4-5倍的信号增加)。一式三份地显示了技术重复。
80.这些样品导致与无模板对照(ntc)相似的背景信号。相反地,sars-cov-2rna导致4-5倍的信号增加。
81.为了测定rt-lamp-t7-csm的lod,我们测试了从~100至400个拷贝/μl sars-cov-2rna变动的2-倍系列稀释的20次重复,如在图3c中所图解说明的。图3c图解说明了绘制图,其显示rt-lamp-t7-csm是灵敏的。加载有crrna
n1
或crrna
n9
的ttcsm
csm3-d34a
复合物具有198个拷贝/μl的lod(20/20次重复)。
82.在依赖于29分钟的rt-lamp步骤和随后的1分钟的t7-csm荧光测定检测反应的测定法中,rt-lamp-t7-csm的lod为198个拷贝/μl sars-cov-2rna(20/20次重复)。
83.图3d图解说明了绘制图,其显示了在t7-csm反应中荧光信号增加的动力学。观察到sars-cov-2阳性患者样品到10秒之前具有相对于ntc而言的~2倍的信号增加(crrna
n1
中值=1.8,crrna
n9
中值=2.3),其到1分钟之前快速地增加至相对于ntc反应而言的4-5倍的信号增加(crrna
n1
中值=4.2,crrna
n9
中值=5.5)。为了清楚起见,显示了一个亚组的迹线。
84.为了进一步验证该方法,我们接着测试了从56份先前已通过使用rt-qpcr进行了测试的取自患者的鼻咽拭子样品中提取的rna。在所测试的56份样品中,通过rt-qpcr,46份是关于sars-cov-2阳性的和10份是阴性的,如在图3e中所图解说明的。图3e图解说明了绘制图,其显示了用rt-qpcr(x-轴)和rt-lamp-t7-csm(y-轴)进行测试的来自56名个体的鼻咽拭子的结果。对于n1和n2 cdc诊断引物两者都具有低于40的ct值的拭子被认为是关于sars-cov-2rna阳性的。rt-lamp-t7-csm可靠地将具有ct《30.7(200-100个rna拷贝/μl)的患者样品鉴定为关于sars-cov-2阳性的。通过crrna
n1
和crrna
n9
都以阳性方式鉴定出b.1.1.7变种。将数据显示为相比于ntc反应而言的荧光的倍数变化。
85.通过使用两种不同的crrna指导物,我们证明了iii型crispr系统具有100%的特异性(阴性预测一致),以及100%的阳性预测一致,对于具有100-200个拷贝/μl sars-cov-2rna的鼻咽拭子样品,如通过rt-qpcr所测定的。全基因组测序揭示了在此所使用的患者样品中的三个属于b.1.1.7.谱系。这些基因组序列已保存在gisaid(登录id:epi_isl_l081321、epi-isl_1081322、epi_isl_1081323)(elbe和buckland-merrett,2017)。重要的
是,用n1和n9 crrna指导物均通过rt-lamp-t7-csm以阳性方式鉴定出b.1.1.7.变种(如在图3e中所图解说明的,对于n1为实心正方形,对于n9为实心菱形)。图8a和8b图解说明了通过rt-lamp-t7-csm的sars-cov-2的快速且特异性的检测。关于来自患者样品的sars-cov-2rna的rt-lamp-t7-csm检测的t7-csm阶段的原始荧光动力学,具有14.9-30.4(左)、30.7-36.2(中间)和40+(右)的ct值,如通过加载有(a)crrna
n1
或(b)crrna
n9
的rna酶失效ttcsm复合物(dttcsm)所检测的。首先将反应体系在rt-qpcr机器中在4℃下进行温育,并且每15秒测量荧光,持续150秒。在阳性和阴性反应中的荧光读数都是低的,直至将t7-csm反应体系加热至55℃,此后荧光在10秒内快速增加并且继续增加60秒(在大多数样品中)。
86.图9图解说明了对于sars-cov-2滴度的绝对定量的标准曲线。使用包含核衣壳基因的sars-cov-2合成rna片段(rtgm 10169,国家标准和技术研究院(national institute of standards and technology))的10-倍稀释系列。将数据绘制为在y-轴上的循环阈值(ct)对在x-轴上的log10(拷贝/ml)。显示了三次技术重复的平均ct,误差条代表了
±
1标准偏差。使用ggplot2 r软件包的geom_smooth函数将趋势线对所述数据进行拟合;显示了线性方程和r2值。相应于非传染性和传染性ct值的分界是指具有低于106个拷贝/ml的病毒滴度的患者罕见地是有传染性的这一观察结果。
87.图11图解说明了使用rt-qpcr扩增和rt-lamp-t7扩增(在图10中图解说明的)的病毒rna检测的结果的例子。
88.在一些实例中,可以对所述多个亚基中的至少一个进行遗传修饰。例如,可以根据seq id no.27的序列对ttcsm3亚基进行遗传修饰。
89.图12a图解说明了用于放大诊断信号的rna酶失效突变的例子。野生型ttcsm复合物随时间切割所结合的rna靶标,从而降低靶rna的量并且限制所产生的环状寡核苷酸的量/所结合的rna靶标。在csm3亚基上的编号为34的天冬氨酸残基突变为丙氨酸(csm3-d34a;黑色星形物)消除了ttcsm复合物的rna酶活性,从而导致不再转换靶rna的复合物。因此,由rna酶失效csm复合物进行的rna结合将该复合物锁定为聚合ntp的构象状态(即,“on”状态)。相比于野生型而言,对于每个由突变型ttcsm复合物所结合的rna靶标产生更多的环状寡核苷酸。进一步地,可以将由不同的环状寡核苷酸激活的辅助核酸酶(即,由ca4激活的ttcsm6;由ca6激活的stcsm6)的混合物用于通过系链的切割将环状核苷酸库中的更多转化为荧光信号。图12b图解说明了来自viris检测测定法的结果。rna酶-失效ttcsm复合物与sars-cov-2rna片段相结合并且产生ca4,其激活辅助核酸酶ttcsm6,其然后切割荧光报道rna,从而引起荧光的增加。rna酶-失效ttcsm复合物允许5
×
107个拷贝的sars-cov-2rna片段的更灵敏的检测,相比于野生型ttcsm复合物而言。虽然在csm3中的d34a突变消除了rna酶活性,但是它也可以改变环状核苷酸的特性。该改变可能不会激活如所预期的那么多的辅助核酸酶(ttcsm6)分子,并且这可以解释荧光信号的适度增加。各自由不同环状核苷酸激活的辅助核酸酶的组合可以用于将由ttcsm生成的信号完全转化为报道rna的切割。虽然寡聚核苷酸的种类可以不同,但是核苷酸聚合的副产物(ppi和质子)将会保持不受影响并且被预期增加使用ph敏感性指示剂的检测灵敏度。
90.图13a图解说明了样品中的病毒rna的双重检查检测的例子。使用序列特异性引物通过rt-lamp-t7来扩增rna(样品a)。首先通过逆转录酶将rna转变为cdna。通过使用环介导式等温扩增(lamp)来进一步扩增cdna。将关于t7 rna聚合酶的启动子掺入到经扩增的cdna
中。hi-t7聚合酶使用cdna作为模板以用于更多靶(例如,sars-cov-2)rna的转录。rt-lamp-t7的聚合酶活性产生质子(即,h+)并因此降低反应体系的ph。通过使用ph-敏感性染料来检测ph变化(检查#1)。然后,将iii型crrna-指导的监视复合物(例如,csm复合物)用于降低由于非特异性聚合而引起的潜在假阳性结果的风险(样品b)。iii型监视复合物与扩增出的靶rna(其与crrna-指导物互补)的由crispr rna(crrna)指导的结合(样品a)触发cas10亚基合成线性和环状寡核苷酸的混合物。cas10聚合酶活性的序列特异性激活生成更多的质子,其加速ph的下降并因此加速比色读出,从而减少产生结果的时间,并且对该信号的生成增添序列特异性。除了生成质子外,由cas10合成的寡核苷酸还激活先前休眠的辅助核酸酶(例如,csm6),其切割将猝灭剂连接至荧光团的rna系链。系链的切割释放出荧光团,从而导致荧光信号。通过使用荧光计对rt-lamp-t7的阳性结果进行“双重检查”,以验证靶标特异性(例如,sars-cov-2)信号(检查#2)。归因于在lamp期间的错误引发的非特异性地扩增出的rna可以导致颜色变化(样品b),从而导致假阳性。通过与特异rna的由crrna指导的结合使得“双重检查”成为可能,这同时生成质子和环状核苷酸。后者激活辅助核酸酶,其被用于生成序列特异性荧光信号。在rt-lamp-t7中阳性和在viris中阴性的样品作为假阳性而被排除。
91.图13b图解说明了rt-lamp-t7和viris反应的绘制图。单一温度(55℃,箱图)可以用于rt-lamp-t7和viris反应两者,并且可靠地检测出10个拷贝的sars-cov-2rna,具有检测出低至1个拷贝的该病毒的潜力。在两个不同的温度(行)下进行用sars-cov-2基因组的系列稀释的一罐rt-lamp-t7反应。在三个不同的温度(列)下进行随后的viris检测反应,其中使用5μl的经预扩增的样品。用荧光平板阅读器来测量信号,并且将其以相对荧光单位(rfu)绘制在y-轴上。
92.方法实例
93.核酸制备
94.以前公布的lamp引物(eurofins)被设计用于扩增sars-cov-2n-基因(broughton等人,2020)。从生成自合成的重叠dna寡聚物对的pcr产物或者使用sars-cov-2基因组作为模板(seq id no.13-17)用megascript t7(thermo fisher scientific)体外转录出靶sars-cov-2和sars-cov-1rna。将以前设计的引物库(idt)用于sars-cov-2基因组的rt-pcr和测序(https://artic.network/ncov-2019)(链接应当省略空格)。通过变性page来纯化转录出的rna。通过无rna酶的hplc来纯化荧光报道rna a和荧光报道rna b(参见表1)(idt)。就这样使用经纯化的病毒、细菌和真菌病原体的基因组,或者将其重悬浮在1
×
te(10mm tris-hcl ph 7.5,1mm乙二胺四乙酸(edta))中至~1
×
106个基因组/μl。经纯化的基因组核酸(例如,经纯化的病毒、细菌和真菌病原体的基因组)的例子举例说明在表2中。
[0095][0096]
质粒
[0097]
将关于嗜热栖热菌iii-a型csm1-csm5基因的表达载体pcdf-5xt7-ttcsm(liu等人,2019)用作模板,以用于位点定向诱变以便将csm3残基d33突变为丙氨酸(d33a),从而使靶rna的csm3-介导的切割失活(pcdf-5xt7-ttcsm
csm3-d34a
)(liu等人,2017)。将在pacyc-ttcas6-4xcrrna4.5中的crispr阵列(liu等人,2019)替代为被设计成靶向sars-cov2的n-基因的包含五个重复序列和四个相同间隔子的合成的crispr阵列(geneart)(即,pacyc-ttcas6-4xgcov2n1)。从pacyc-ttcas6-4xcrrna4.5质粒中pcr扩增出ttcas6,并且将其克隆在prsf-1b的ncoi和xhoi位点之间(prsf-ttcas6)。从pc0075 ttcsm6 his6-twinstrep-sumo-bsai表达出carf-hepn核酸酶ttcsm6(gootenberg等人,2018)。
[0098]
蛋白质纯化
[0099]
如以前所描述的并且稍加修改来进行ttcsm复合物的表达和纯化(liu等人,2019)。简而言之,将crrna质粒(例如pacyc-ttcas6-4xgcov2n1)与prsf-ttcas6和pcdf-5xt7-ttcsm或pcdf-5xt7-ttcsm
csm3-d34a
一起共转化入大肠杆菌(escherichia coli)bl21(de3)细胞中,并且使其在lb培养液体基(lennox)(thermo fisher scientific)中在37℃下生长至0.5的od
600
。然后,将培养物用0.5mm iptg(异丙基-β-d-硫代半乳糖苷)进行诱导以在25℃下表达过夜。使细胞形成粒状沉淀(在4℃下3,000
×
g 25分钟),并且在裂解缓冲液(25mm hepes ph 7.5,150mm kcl,10mm咪唑,1mm tcep,0.01% triton x-100,5%甘油,1mm pmsf)中通过超声处理来进行裂解。将裂解物通过在4℃下以10,000
×
g离心25分钟来进行澄清。然后,将裂解物在55℃下热处理45分钟,并且通过在4℃下以10,000
×
g离心25分钟来进一步进行澄清。使带有his标签的csm1和ttcsm复合物结合至histrap hp树脂(cytiva)并且用洗涤缓冲液(50mm hepes ph 7.5,150mm kcl,1mm tcep,5%甘油,20mm咪唑)进行洗涤。将蛋白质洗脱在补充有300mm咪唑的裂解缓冲液中。将洗脱出的蛋白质在4℃下进行浓缩(100k mwco corning spin-x浓缩器),之后在25mm hepes ph 7.5,150mm nacl,5%甘油,1mm tcep中通过hiload superdex 200 26/600或superose 6increase 10/300gl大小排阻柱(cytiva)进一步进行纯化。汇集包含ttcsm复合物的级分,进行浓缩,分成等分试样,在液氮中快速冷冻,并且储存于-80℃。
[0100]
如以前所描述的并且稍加修改来进行ttcsm6的表达和纯化(gootenberg等人,2018)。将pttcsm6转化入大肠杆菌bl21(de3)细胞中,并且使其在lb液体培养基(lennox)
hcl ph 7.8,250mm谷氨酸单钾,10mm硫酸铵,5mm硫酸镁,和1mm tcep)中包含25nm ttcsm
csm3-d34a n1,或25nm ttcsm
csm3-d34a n9,或2.5nm十种复合物(ttcsm
csm3-d34a
n1、n3、n6、n7、n8、n9、n10、n11、n12和i1)中的每一种,其与250μm atp、150nm荧光报道rna b、300nm ttcsm6相混合。向27μl的上述rna检测混合物添加3μl的从具有高的sars-cov-2病毒载量(~5
×
108个拷贝/μl)的患者鼻咽拭子中提取的rna。备选地,首先将来自该阳性患者样品的rna以10或100倍稀释到从对于sars-cov-2来说阴性的患者(ct》40)中提取的rna之中,并且向27μl的上述rna检测混合物添加3μl的这些稀释物。将反应体系在60℃下进行温育,并且在quantstudio 3实时pcr系统(thermofisher)中每10秒测量荧光(持续直至20分钟),其中使用制造商的对于fam染料的默认滤光器设置。
[0106]
基于比色crispr-csm的检测
[0107]
按照制造商的说明书使用microspin g25柱(cytiva)将ttcsm
csm3-d34a
储备物缓冲液交换到低缓冲容量缓冲液(0.5mm tris-hcl ph 8.8,50mm氯化钾,10mm硫酸铵,8mm硫酸镁)中。将te缓冲液(10mm tris-hcl ph 7.5,1mm edta)或者体外转录出的sars-cov-2或sars-cov-1rna与200nm ttcsm
csm3-d34a
一起在补充有另外的1mm atp的1x warmstart colorimetric lamp master mix(neb)中进行温育,以25μl反应体系。所使用的经缓冲液交换的ttcsm的体积向最终的反应体系贡献了大约40μmtris-hcl ph 8.8缓冲液。将反应体系集合在冰上,并且在led描迹垫板上用galaxy s9手机(samsung)进行成像。然后,将反应体系在60℃下温育30分钟,快速冷却,并且再次成像。
[0108]
基于可见荧光测定crispr-csm的检测
[0109]
将te缓冲液或者体外转录出的sars-cov-2或sars-cov-1rna在反应缓冲液(20mm tris-hcl ph 8.8,100mm氯化钾,10mm硫酸铵,6mm硫酸镁,0.5mm氯化锰,1mm tcep,1mm atp,和25μm钙荧光素)中与500nm ttcsm
csm3-d34a
一起进行温育,以30μl反应体系。将反应体系在60℃下进行温育,并且在abi 7500快速实时pcr系统(applied biosystems)中随时间测量荧光,其中使用制造商的对于fam染料的默认滤光器设置。在60℃下温育50分钟后,然后在可见光下和在uv光(365nm)下用galaxy s9手机(samsung)对同一反应体系进行成像。为了以高通量形式筛选指导rna(图2b),将200nm的粗制的经纯化的ttcsm复合物与10
12
个拷贝的ivt sars-cov-2rna一起在上述缓冲液中进行温育,并且如上所述在abi 7500快速实时pcr系统(applied biosystems)机器中记录荧光。
[0110]
rt-lamp-t7-csm
[0111]
拭子样品中的核酸的等温扩增通过rt-lamp来进行。简而言之,25μl反应体系在反应缓冲液(20mm tris-hcl ph 7.8,8mm硫酸镁,10mm硫酸铵,50mm氯化钾,0.1% tween-20)中包含8个单位(u)的warmstart bst 2.0(neb)和7.5u的warmstart rtx逆转录酶(neb)、1.4mm dntp、lamp引物、25u的鼠类rna酶抑制剂(neb)。添加被设计用于扩增sars-cov-2n-基因的lamp引物(broughton等人,2020),以0.2μm f3和b3、0.4μm loopf和loopb、1.6μm bip、0.53μm fip以及1.07μm t7-fip的经优化的最终浓度(例如用于rt-lamp的引物:seq id no.19-25)。t7-fip引物由与fip引物的5’末端相融合的t7启动子组成,并且允许在t7-csm反应的第二步骤期间生成t7转录模板。rt-lamp反应通过使用5μl的输入rna在65℃下进行29分钟。将3μl的rt-lamp反应体系与27μl的经修改的t7-csm荧光检测反应体系相混合,后者在反应缓冲液(40mm tris-hcl ph 7.5,4mm氯化镁,50mm氯化钠,2mm亚精胺,1mm dtt)
中包含0.5mm rntp、300nm ttcsm6、150nm荧光报道rna b和20nm的ttcsm
csm3-d34a n1或n9。将反应体系在55℃下温育直至20分钟,并且如上面所描述的那样在quantstudio 3实时pcr系统(thermofisher)中监测荧光动力学。
[0112]
通过将sars-cov-2rna稀释到从covid-19阴性患者鼻咽拭子中提取的rna之中来制备lod标准品。使用从ivt片段的10-倍稀释系列(1
×
10
6-1
×
100)生成的标准曲线,用rt-qpcr来测定浓度。
[0113]
人临床样品收集和制备
[0114]
在病毒运输介质中收集来自经测试对于sars-cov-2来说阴性或阳性的患者的鼻咽拭子。通过使用qiaamp viral rna mini kit(qiagen)从所有患者样品中提取rna。
[0115]
rt-qpcr
[0116]
使用两个引物对(n1和n2)和探针(其来自2019-ncov cdc eua试剂盒(idt#10006606))来进行rt-qpcr。按照cdc指南和实验方案(https://www.fda.gov/media/134922/download)(链接应当省略空格),在abi 7500快速实时pcr系统中通过使用一步rt-qpcr来对在经rna提取的患者鼻咽样品中的sars-cov-2进行检测和定量。简而言之,20μl反应体系包括8.5μl的无核酸酶的水、1.5μl的引物和探针混合物(idt,10006713)、5μl的taqpath 1-step rt-qpcr master mix(thermofisher,a15299)和5μl的模板。使用无核酸酶的水作为阴性模板对照(ntc)。如下来进行扩增:25℃2分钟,50℃15分钟,95℃2分钟,随后为45个循环(95℃3秒和55℃30秒)。为了定量样品中的病毒基因组拷贝数,通过使用具有从10至106个拷贝/μl变动的浓度的跨越n基因的sars-cov-2合成rna片段(rtgm 10169,国家标准和技术研究院)的稀释系列来生成关于n1和n2的标准曲线。在每个稀释度下进行三次技术重复。ntc显示出在qpcr的整个45个循环中没有扩增。
[0117]
靶向sars-cov-2的ttcsm crrna指导物的生物信息学设计
[0118]
从2020年6月23日的gisaid数据库(global initiative for sharing all influenza data;gisaid.org)(链接应当省略空格)下载45,641个sars-cov-2基因组的比对(elbe和buckland-merrett,2017;katoh和standley,2013)。用40-核苷酸滑动窗口就保守性扫描所述比对,并且保存具有强保守性的40-核苷酸区段用于下游分析。接着,就与预期的5
’‑
crrna柄(加有下划线的;5
’‑
auugcgac-3’)的前四个核苷酸的碱基配对来检查在上述40-核苷酸候选病毒靶序列侧翼的四个核苷酸,仅进一步考虑缺乏柄互补性的候选物。弃去在靶序列的前18个核苷酸中具有少于两个与sars-cov(nc_004718.3)和mers-cov(nc_019843.3)的错配的候选位点。接着,使用blast(e-值1000),就与人mrna以及从fda紧急使用授权要求下载的人病原体和常见呼吸道区系的列表(于2020年7月29日下载)的潜在交叉反应性来筛选靶向上述位点的候选crrna。然后,通过基因组定位来拣选剩余的6,229个crrna序列,并且仅进一步考虑位于sars-cov-2orf3a基因(位置25,393至29,903)的3’处的指导物。最后,从剩余的库中选择出了76种指导物,其具有最大的在sars-cov-2序列之中的保守性和最大数目的与sars-cov和mers-cov序列的错配。
[0119]
从患者样品中分离的sars-cov-2rna的测序
[0120]
如以前所描述的(nemudryi等人,2021),对从患者样品中分离的sars-cov-2基因组rna进行测序。简而言之,首先按照制造商的说明书用superscript iv(thermofisher)将10μl的从患者鼻咽拭子中提取的sars-cov-2基因组rna进行逆转录。遵循artic network实
验方案以通过使用连接测序试剂盒(oxford nanopore,sqk-lsk109)在oxford nanopore上生成覆盖全sars-cov-2基因组的序列扩增子文库(https://artic.network/ncov-2019)(grubaugh等人,2019;tyson等人,2020)(链接应当省略空格)。用在artic ncov-2019 v3 panel(例如用于生成用于sars-cov-2全基因组测序的扩增子文库的引物:seq id no.29-246)中所描述的引物库来进行两个多重pcr反应,用q5 dna聚合酶(neb)进行扩增。然后,合并两个所得的关于每个患者样品的扩增子库,并且将其用于文库制备。将样品进行末端修复(neb,e7546),和然后使用native barcoding expansion试剂盒(oxford nanopore,exp-nbd104和exp-nbd114)进行条码化。将经条码化的样品汇集在一起,和然后连接nanopore衔接头。
[0121]
将所述多重复用文库加载到minion流动池上,并且收集到总共0.3gb的原始测序数据/患者样品。以高准确度模式对原始nanopore读取进行碱基判定(oxford nanopore,minknow),并且使用关于covid-19的artic生物信息学管线(https.//artic.network/ncov-2019)(链接应当省略空格)来进一步进行分析。将共有序列上传至gisaid(https://www.gisaid.org/)(链接应当省略空格),id:epi_isl_1081321、epi-isl_1081322、epi_isl_1081323(elbe和buckland-merrett,2017)。通过自动化谱系分配器将这三个sars-cov-2基因组序列鉴定为b.1.1.7谱系的成员(rambaut等人,2020)(https://github.com/hhcov-2019/pangolin)(链接应当省略空格)。
[0122]
统计学分析
[0123]
所有实验都一式三份地或一式两份地来进行,并且将误差报告为
±
1标准偏差。在prism 9(graphpad)中,将合并的在患者样品中的sars-cov-2rna的直接的基于csm的检测的荧光动力学的重复实验数据集拟合至简单线性回归。通过f-检验,将包含sars-cov-2rna的患者样品的拟合斜率成对地与阴性拭子rna对照进行比较,****p《0.0001。
[0124]
序列
[0125]
表3.序列的例子。seq id no.29-138属于引物库ncov-2019_1,和seq id no.139-246属于引物库ncov-2019_2。
[0126]
[0127]
[0128]
[0129]
[0130]
[0131]
[0132]
[0133]
[0134]
[0135]
[0136][0137]
受试者可以是指动物,例如哺乳动物物种(优选地,人)或禽类(例如,鸟)物种,或者其他生物,例如植物。更特别地,受试者可以是脊椎动物,例如哺乳动物例如小鼠、灵长类动物、猿或人。动物包括农场动物、运动用动物和宠物。受试者可以是健康的个体,具有症状或征候或者疑似具有疾病或向着该疾病的倾向的个体,或者需要治疗或疑似需要治疗的个体。
[0138]
在经改造的系统的背景下的遗传修饰或突变可以是指在核酸中的改变、变体或多态性,其可以导致相应蛋白质的经改变或失能的功能性。这样的改变、变体或多态性可以是相关于参考基因组,所述受试者或其他个体。变异包括一个或多个单核苷酸变化(snv)、插入、缺失、重复、小插入、小缺失、小重复、结构变体连接、可变长度串联重复序列和/或侧翼序列,cnv、颠换、基因融合和其他重排也可以被认为是遗传变异的形式。变异可以是碱基变化、插入、缺失、重复、拷贝数变化、颠换或其组合。
[0139]“多核苷酸”、“核酸”、“核酸分子”或“寡核苷酸”可以各自是指通过核苷间的键而接合在一起的核苷(包括脱氧核糖核苷、核糖核苷或其类似物)的聚合物。典型地,多核苷酸包含至少三个核苷。寡核苷酸的大小通常从几个单体单元(例如3-4个)至数百个单体单元变动。无论何时多核苷酸通过一串字母(例如“atgcctg”)来表示,都将会理解所述核苷酸是以5
’→3’
次序从左至右,并且“a”表示脱氧腺苷,“c”表示脱氧胞苷,“g”表示脱氧鸟苷,和“t”表示脱氧胸苷,除非另有注解。字母a、c、g和t(或“u”,其表示rna中的尿嘧啶)可以用于指碱基自身、核苷或核苷酸(其包含所述碱基),正如这是本领域中的标准那样。
[0140]“多核苷酸”、“核酸”、“核酸分子”或“寡核苷酸”可以各自是指通过核苷间的键而接合在一起的核苷(包括脱氧核糖核苷、核糖核苷或其类似物)的聚合物。典型地,多核苷酸包含至少三个核苷。寡核苷酸的大小通常从几个单体单元(例如3-4个)至数百个单体单元变动。无论何时多核苷酸通过一串字母(例如“atgcctg”)来表示,都将会理解所述核苷酸是
tests across the u.s.doi:10.31219/osf.io/gj9x8
[0161]
liu ty,iavarone at,doudna ja.2017.rna and dna targeting by a reconstituted thermus thermophiles type iii-a crispr-cas system.plos one 12:1-20.doi:10.1371/journal.pone.0170552
[0162]
liu ty,liu jj,aditham aj,nogales e,doudna ja.2019.target preference of type iii-a crispr-cas complexes at the transcription bubble.nat commun 10.doi:10.1038/s41467-019-10780-2
[0163]
makarova ks,timinskas a,wolf yi,gussow ab,siksnys v,venclovas c,koonin ev.2020.evolutionary and functional classification of the carf domain superfamily,key sensors in prokaryotic antivirus defense.nucleic acids res 1-20.doi:10.1093/nar/gkaa635
[0164]
nasef m,muffly mc,beckman ab,rowe sj,walker fc,hatoum-aslan a,dunkle ja.2019.regulation of cyclic oligoadenylate synthesis by the staphylococcus epidermidis cas10-csm complex.rna 25:948-962.doi:10.1261/rna.070417.119
[0165]
nemudryi a,nemudraia a,wiegand t,nichols j,deann t,hedges jf,cicha c,lee h,vanderwood kk,bimczok d,jutila m,wiedenheft b.2021.sars-cov-2 genomic surveillance identifies naturally occurring truncations of orf7a that limit immune suppression.medrxiv.doi:doi.org/10.1101/2021.02.22.21252253
[0166]
niewoehner 0,garcia-doval c,rost0l jt,berk c,schwede f,bigler l,hall j,marraffini la,jinek m.2017.type iii crispr-cas systems produce cyclic oligoadenylate second messengers.nature 548:543-548.doi:10.1038/nature23467
[0167]
notomi t,okayama h,masubuchi h,yonekawa t,watanabe k,amino n,hase t.2000.loop-mediated isothermal amplification of dna nucleic acids res 28:e63.doi:10.1093/nar/28.12.e63
[0168]
paltiel ad,zheng a,walensky rp.2020.assessment of sars-cov-2 screening strategies to permit the safe reopening of college campuses in the united states.jama netw open 3:e2016818.doi:10.1001/jamanetworkopen.2020.16818
[0169]
rambaut a,holmes ec,o
‘
toole a,hill v,mccrone jt,ruis c,du plessis l,pybus og.2020.a dynamic nomenclature proposal for sars-cov-2 lineages to assist genomic epidemiology.nat microbial 5:1403-1407.doi:10.1038/s41564-020-0770-5
[0170]
rolando jc,jue e,barlow jt,ismagilov rf.2020.real-time kinetics and high-resolution melt curves in single-molecule digital lamp to differentiate and study specific and non-specific amplification.nucleic acids res 48:e42.doi:10.1093/nar/gkaa099
[0171]
rouillon c,athukoralage js,graham s,gri.ischow s,white mf.2018.control of cyclic oligoadenylate synthesis in a type iii crispr system.elife 7:1-22.doi:10.7554/elife.36734
[0172]
samai p,pyenson n,jiang w,goldberg gw,hatoum-aslan a,marraffini la 2015.co-transcriptional dna and rna cleavage during type iii crispr-cas immunity.cell 161:1164-1174.doi:10.1016/j.cell.2015.04.027
[0173]
sofos n,feng m,stella s,pape t,fuglsang a,lin j,huang q,li y,she q,montoya g.2020.structures of the cmr-complex reveal the regulation of the immunity mechanism of type iii-b crispr-cas.mol cell 79:741-757.e7.doi:10.1016/j.molcel.2020.07.008
[0174]
staals rhj,zhu y,taylor dw,kornfeld je,sharma k,barendregt a,koehorst jj,vlot m,neupane n,varossieau k,sakamoto k,suzuki t,dohmae n,yokoyama s,schaap pj,urlaub h,heck ajr,nogales e,doudna ja,shinkai a,vanderoost j.2014.rna targeting by the type iii-a crispr-cas csm complex of thermus thermophilus.mol cell 56:518-530.doi:10.1016/j.molcel.2014.10.005
[0175]
tamulaitis g,kazlauskiene m,manakova e,venclovas c,nwokeoji ao,dickman mj,horvath p,siksnys v.2014.programmable rna shredding by the type iii-a crispr-cas system of streptococcus thermophilus.mol cell 56:506-517.doi:10.1016/j.molcel.2014.09.027
[0176]
tomita n,mori y,kanda h,notomi t.2008.loop-mediated isothermal amplification(lamp)of gene sequences and simple visual detection of products.nat protoc 3:877-882.doi:10.1038/nprot.2008.57
[0177]
tyson jr,james p,stoddart d,sparks n,wickenhagen a,hall g,choi jh,lapointe h,kamelian k,smith ad,prystajecky n,goodfellow i,wilson sj,harrigan r,snutch tp,loman nj,quick j.2020.improvements to the artic multiplex pcr method for sars-cov-2 genome sequencing using nanopore.biorxiv.doi:10.1101/2020.09.04.283077
[0178]
wolfel r,corman vm,guggemos w,seilmaier m,zange s,muller ma,niemeyer d,jones tc,vollmar p,rothe c,hoelscher m,bleicker t,bri.inink s,schneider j,ehmann r,zwirglmaier k,drosten c,wendtner c.2020.virological assessment of hospitalized patients with covid-2019.nature 581:465-469.doi:10.1038/s41586-020-2196-x
[0179]
yan wx,hunnewell p,alfonse le,carte jm,keston-smith e,sothiselvam s,garrity aj,chong s,makarova ks,koonin ev.,cheng dr,scott da 2019.functionally diverse type v crispr-cas systems.science(80-)363:88-91.doi:10.1126/science.aav7271
[0180]
zhang j,graham s,tello a,iu h,white mf.2016.multiple nucleic acid cleavage modes in divergent type iii crispr systems.nucleic acids res 44:1789-1799.doi:10.1093/nar/gkw020
[0181]
zhang y,ren g,buss j,barry aj,patton gc,tanner na 2020.enhancing colorimetric loop-mediated isothermal amplification speed and sensitivity with guanidine chloride.biotechniques 69:1-8.doi:10.2144/btn-2020-0078
[0182]
上面和下面所引用的所有专利案卷、网站、其他出版物、登录号等都通过提及而以其整体合并以用于所有目的,就如同特别地和独个地指示每个独个项目通过提及而如此合并一样。如果序列的不同版本与在不同时间处的登录号相关联,那么意指在本技术的有效申请日之下与所述登录号相关联的版本。所述有效申请日意指提到所述登录号的优先权申请(如果适用)的实际申请日或申请日中的较早者。同样地,如果出版物、网站等的版本在不同的时间处公布,那么意指在所述申请的有效申请日之下最近期公布的版本,除非另有说明。本公开内容的任何特征、步骤、要素、实施方案或方面可以与任何其他相组合地进行使用,除非另有特别说明。虽然为了清楚和理解的目的,本公开内容已通过举例说明和实施例在一些细节上进行了描述,但是将会是明显的是,可以在所附权利要求书的范围内实行某些变化和修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1