糖蛋白VI的纳米抗体
本公开涉及针对糖蛋白vi(gpvi)提供的纳米抗体及其用途。
背景技术:
1、血小板糖蛋白vi(gpvi)已被确定为有吸引力的抗血栓靶标{andrews,2014}。gpvi是胶原的主要血小板信号传导受体{nieswandt,2003},也是其他配体(包括纤维蛋白)的受体{mammadova-bach,2015}。gpvi由两个免疫球蛋白(ig)样结构域(d1和d2)、高度o-糖基化的和唾液酸化的茎区、单跨膜螺旋和短细胞内尾组成{moroi,2004}。在n-末端d1结构域中存在单个n-糖基化位点。gpvi信号传导需要fcrγ链同源二聚体,其通过gpvi跨膜区的盐桥缔合{zheng,2001}。配体结合通过d1结构域发生{lecut,2004},并导致src家族激酶对fcrγ链上存在的基于免疫受体酪氨酸的激活基序(itam)中发现的两种保守酪氨酸的磷酸化{ezumi,1998}。itam的磷酸化使得酪氨酸激酶syk通过其串联sh2结构域和进一步的下游信号传导进行募集{watson,2005}。
2、已提出gpvi以单体和二聚体的形式存在于膜中{jung,2012}。moroi和jung的小组报道了重组二聚体gpvi,其中细胞外结构域与来自igg的二聚体fc结构域而不是单体gpvi融合,以微摩尔亲和力与胶原结合{miura,2002}。他们提出差异结合是由于亲合力增加或二聚体特异性表位的形成。后者得到二聚体特异性抗体的发现的支持,在血小板激活时检测到该抗体表达增加{jung,2012}。由于gpvi不存在于血小板的细胞内储存中,这表明结合的增加是由于二聚作用导致的构象变化。已解析重组gpvi细胞外结构域的晶体结构为未结合的形式(pdb:2gi7和5ou7)和胶原相关肽(crp)结合的形式(pdb:5ou8和5ou9),这两种结构均揭示了d2结构域内存在的背靠背二聚界面。此外,胶原能够使gpvi受体在血小板膜表面上聚集{poulter,2017},因此产生更高阶的低聚物。gpvi信号传导通过二聚作用发生,并通过进一步聚集而增加。
3、然而,gpvi中二聚体特异性表位的概念不受与gpvi结合的crp的晶体结构的支持,gpvi在d1结构域中显示结合,并表明结合表位的化学计量为1:1,而不是从头形成。此外,需要二聚体特异性抗体的结合位点和血小板激活导致二聚体增加的机制,以充分了解gpvi在血小板激活中的二聚体作用。
4、迄今为止,两种具有不同作用机制的gpvi阻断剂已进行早期临床试验。revacept是gpvi的fc二聚体,它与血小板gpvi竞争结合在损伤部位的胶原及其其他配体。已在患有症状性颈动脉狭窄(nct 01645306)或接受经皮冠状动脉介入治疗(nct03312855)的患者中进行revacept的i期安全性和两项ii期试验。这两项ii期试验的结果尚未报告。act017是阻断人源化fab,已进行i期安全性试验,并且目前正在急性缺血性卒中患者中进行ii期试验(nct03803007)。这两种治疗均在现行护理标准之外进行。
技术实现思路
1、本公开部分基于针对gpvi提出的新型纳米抗体的开发。
2、因此,在第一方面,提供了一种纳米抗体或其抗原结合片段,其能够特异性地结合gpvi。
3、本公开的纳米抗体可以以小于500nm,例如小于250nm、小于100nm,或者甚至小于50nm、25nm,例如小于10nm、5nm或1nm的kd值(如通过表面等离子体共振然后进行动力学分析所确定的)与gpvi结合。
4、本公开的纳米抗体可以与gpvi分子的区域结合,该区域不同于胶原或crp结合的区域。crp结合的残基是由晶体结构pdb:5ou8和5ou9确定的残基r38、e40、r67、q71、w76。因此,在一个教导中,本公开的纳米抗体不与以下gpvi残基中的一个或多个(例如2、3、4或5个)结合:r38、e40、r67、q71、w76。
5、本公开的纳米抗体可以与人gpvi中的以下残基中一个或多个结合或紧密接近(例如,鉴定的残基的任一侧的一个残基):e21、s45、r46、y47、q48、p56、a57和s61(根据uniprot条目q9hcn6的编号减去包含信号肽的前20个氨基酸)(由与纳米抗体2共结晶gpvi鉴定的结合残基),或可以与残基s45、r46、y47、q48和/或s61(根据uniprot q9hcn6的编号减去信号肽(残基1-20))中的至少一个或多个结合或紧密接近(例如,鉴定的残基的任一侧的一个残基),或在来自其他物种的同源gpvi序列中鉴定的相应残基,这些残基可以由技术人员通过序列比对研究(例如使用clustal omega)容易地辨别。本公开的纳米抗体可以与2、3、4、5、6、7或8个鉴定的残基结合或紧密接近。
6、本公开的纳米抗体或抗原结合片段可以包含以下残基中的至少1、2、3、4、5、6个或更多个,或纳米抗体或其抗原结合片段的cdr3区中的保守置换:s99、p100、y102、t104、n105、e111、d112、d114、y115(根据本文鉴定的nb2编号)。通过使用序列比对软件,例如clustal omega,本领域技术人员可以容易地辨别纳米抗体在与以上鉴定的nb2残基相应的位置上是否具有相同的残基或保守取代。
7、在一个教导中,纳米抗体或其抗原结合片段包含与seq id no:1-54具有至少85%、90%、95%、98%、99%或100%同一性的序列。
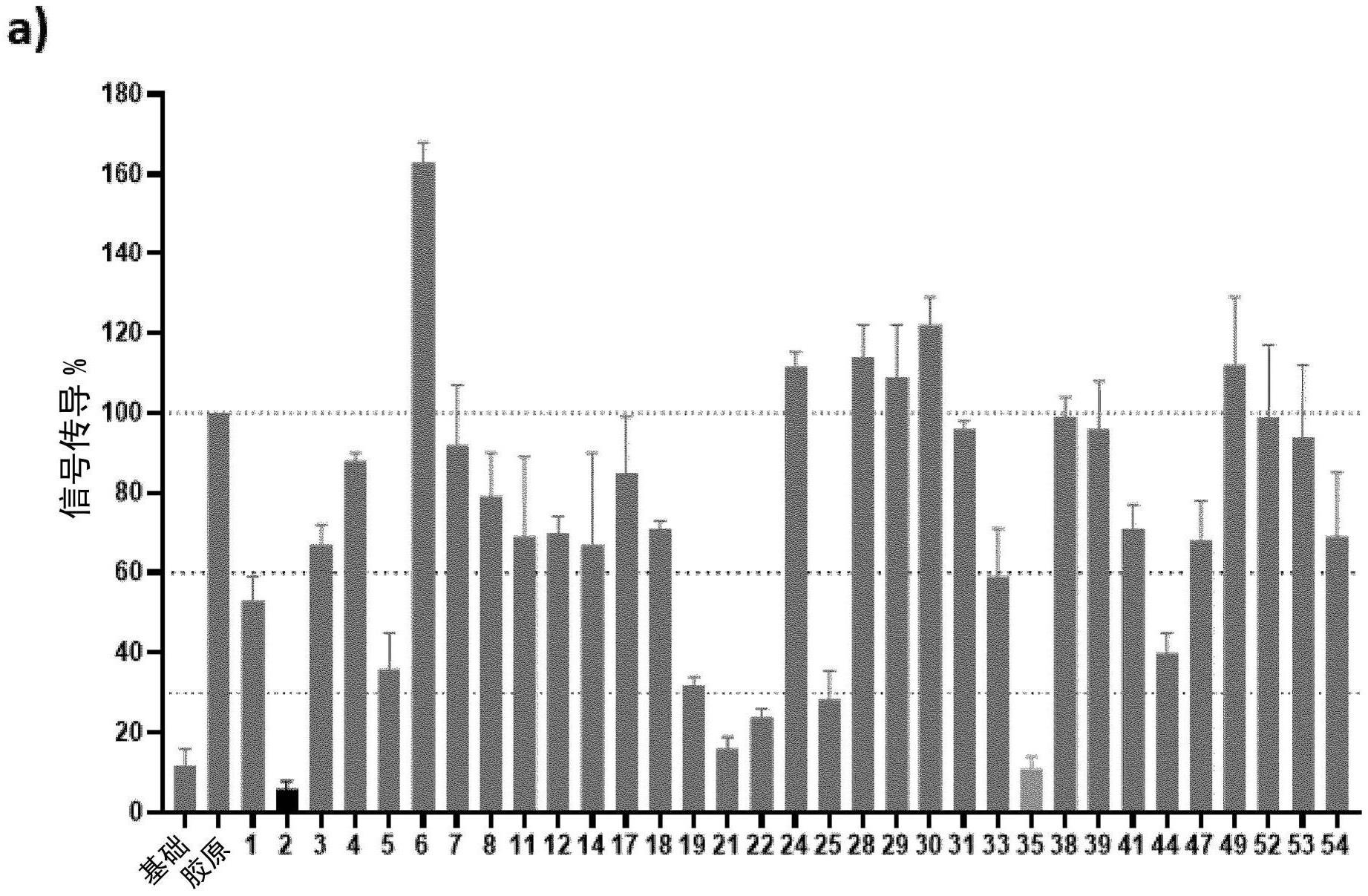
8、在一个教导中,纳米抗体或其抗原结合片段包含与seq id no:1、2、5、19、21、22、25、33、35、44具有至少85%、90%、95%、98%、99%或100%同一性的序列。这种选择的标准是在gpvi转染的细胞系测定中产生至少40% nfat信号抑制的纳米抗体(图1a)。
9、在一个教导中,纳米抗体或其抗原结合片段包含与seq id no:2、21、22、25、35具有至少85%、90%、95%、98%、99%或100%同一性的序列。这种选择的标准是在gpvi转染的细胞系测定中具有至少60% nfat信号抑制的纳米抗体(图1a)。
10、在一个教导中,纳米抗体或其抗原结合片段包含与seq id no:2、21和35具有至少85%、90%、95%、98%、99%或100%同一性的序列。这种选择的标准是在gpvi转染的细胞系测定中具有至少80% nfat信号抑制的纳米抗体(图1a),并且在elisa测定中在与gpvi-fc结合的前5个纳米抗体中进行评分(图1b)。
11、在一个教导中,纳米抗体或其抗原结合片段至少包含cdr3序列,任选地进一步包含下表中突出显示的cdr1和/或cdr3序列。
12、
13、表1前10个抑制性纳米抗体与按顺序突出显示的cdr 1、2和3序列的序列比对。
14、两个氨基酸序列之间的同一性百分比可以使用myers和miller的算法{meyersand miller 1998}来确定,该算法已被纳入align程序(2.0版),使用pam120权重残基表、空位长度罚分为12和空位罚分为4。此外,两个氨基酸序列之间的同一性百分比可以使用needleman和wunsch{needleman and wunsch 1970}算法来确定,该算法已被纳入gcg软件包中的gap程序中(可在http://www.gcg.com获得),使用blossum 62矩阵或pam250矩阵,空位权重为16、14、12、10、8、6或4以及长度权重为1、2、3、4、5或6。
15、应当理解,对序列同一性的提及是指可识别的纳米抗体序列,因此不包括可以添加到纳米抗体的n或c末端的任何另外的序列,例如可以与纳米抗体序列融合的蛋白质或肽。
16、在另一个教导中,本公开提供了与本文所述的任何纳米抗体结合至gpvi上相同表位的纳米抗体(即,具有与本公开的任何纳米抗体交叉竞争结合至人gpvi的能力的抗体)。在某些教导中,用于交叉竞争研究的参考纳米抗体可以是本文所述的nb2、nb21和/或nb35纳米抗体。这种交叉竞争的纳米抗体可以基于它们在标准gpvi结合测定中与本文鉴定的纳米抗体交叉竞争的能力来鉴定。例如,可以使用标准elisa测定,其中将重组人gpvi蛋白固定在底物上,对其中一个纳米抗体进行荧光标记,并评价未标记的纳米抗体竞争标记的纳米抗体结合的能力。此外,或可选地,biacore分析可以用于评估纳米抗体交叉竞争的能力。
17、纳米抗体是目前最小的抗体相关分子,其分子量为正常抗体的约1/10。除了单克隆抗体的抗原反应性之外,纳米抗体还具有一些独特的功能特性,包括以下属性中的一个或多个:小分子量;稳定性强;溶解性佳;易于表达;免疫原性弱;渗透性强;靶向强;人源化简单;并且与较大抗体和片段相比生产成本低廉。
18、如本文所用,术语“纳米抗体”和“单结构域抗体(vhh)”具有相同的含义,是指由单个单体可变抗体结构域组成的抗体片段。通常,纳米抗体仅由一个重链可变区组成。本文所用的术语纳米抗体是指其单体形式,以及同源或异源多聚体(例如其同源或异源二聚体和四聚体)形式。多聚体形式可以通过包括例如在单个纳米抗体结构域之间的接头而产生。合适的接头的实例是ggggs,其本身可以是单体或多聚体形式,例如三聚体。这种纳米抗体可以分别用作阻断gpvi的拮抗剂,其kd值小于500nm、250nm、100nm、50nm、25nm、10nm、5nm或1nm。
19、如本文所用,术语“可变”意指一个纳米抗体与另一个纳米抗体的纳米抗体中可变区的某些部分在序列上不同,这形成各种特定纳米抗体与其特定抗原的结合和特异性。然而,变异性通常不是均匀分布在整个纳米抗体可变区。它通常集中在轻链和重链可变区中被称为互补决定区(cdr)或高变区的三个区段中。可变区中更保守的部分被称为框架区(fr)。天然重链和轻链的可变区各自含有四个fr区,它们基本上呈β折叠构型,由三个cdr连接,形成连接环,并且在一些情况下可以形成部分β折叠结构。每条链中的cdr通过fr区与其他cdr紧密相邻,并与另一条链的cdr形成纳米抗体的抗原结合位点{参见kabat等人,1991}。
20、如本文所用,术语“重链可变区”和“vh”可以互换使用。如本文所用,术语“可变区”和“互补决定区(cdr)”可以互换使用。
21、在另一个优选的教导中,所述纳米抗体的重链可变区包含3个互补决定区:cdr1、cdr2和cdr3。
22、本公开的纳米抗体的重链的可变区特别令人感兴趣,因为可变区的至少一部分参与结合抗原。因此,本公开包括具有具有cdr的纳米抗体重链可变区的那些分子,条件是它们的cdr,特别是cdr3,与本文鉴定的cdr相同(或相对于鉴定的cdr序列包含至多一个或两个置换)。
23、本发明的纳米抗体可以使用本领域技术人员已知的技术进行人源化(参见,例如,{vincke等人2009})。
24、本教导不仅包括完整的纳米抗体,还包括免疫活性纳米抗体的抗原结合片段或由具有其他序列的纳米抗体形成的融合蛋白。因此,本公开还包括所公开的纳米抗体的片段、衍生物和类似物。
25、如本文所用,术语“片段”、“衍生物”和“类似物”是指实质上保留与本发明的纳米抗体相同的生物功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)具有一个或多个被置换的保守或非保守氨基酸残基的多肽。这种置换的氨基酸残基可以由遗传密码或也可以不由遗传密码编码;或(ii)在一个或多个氨基酸残基中具有取代基的多肽;或(iii)通过融合成熟多肽和另一种化合物(例如增加多肽半衰期的化合物,例如,聚乙二醇)形成的多肽;或(iv)通过将另外的氨基酸序列与多肽序列融合形成的多肽(例如,前导或分泌序列或用于纯化该多肽的序列或前蛋白序列,或用6his标签形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物在本领域普通技术人员的范围内。
26、本发明的纳米抗体是指包括具有gpvi蛋白结合活性的上述cdr区的多肽。该术语还涵盖包含上述cdr区的多肽的变体形式,其具有与本公开的纳米抗体相同的功能。这些变体包括但不限于一个或数个(通常1-50个、1-30个、1-20个或1-10个)氨基酸的缺失插入和/或置换,以及在c-末端和/或n-末端添加一个或数个(通常小于20个、小于10个或小于5个)氨基酸。例如,在本领域中,具有类似或相似性质的氨基酸的置换通常不改变蛋白质的功能。另一个例子,在c-末端和/或n-末端添加一个或数个氨基酸可能不改变蛋白质的功能。该术语还包括本公开的纳米抗体的活性片段和活性衍生物。
27、多肽的变体形式包括:同源序列、保守变体、等位基因变体、天然突变体、诱导突变体、由能够在高或低严格条件下与编码本发明的纳米抗体的dna杂交的dna编码的蛋白质,以及使用针对本发明的纳米抗体的抗血清获得的多肽或蛋白质。
28、本公开还涉及包含本公开的纳米抗体的其他蛋白质或融合表达产物。具体地,本公开包括本公开的纳米抗体的具有含有可变区的重链的任何蛋白质或蛋白质缀合物和融合表达产物(即免疫缀合物和融合表达产物)。如本文所用,“缀合(conjugate)”、“缀合(conjugation)”或其语法变体是指通过本领域已知的任何相连或连接方法,将两个或更多个化合物相连或连接在一起,从而形成另一个化合物。如有必要,肽接头/间隔序列也可以用于将多个多肽组分分离足以确保每个多肽折叠成其二级和/或三级结构的距离。可以使用本领域公知的标准技术将这种肽接头序列掺入融合多肽中。
29、在一个教导中,与未与该部分如此缀合的纳米抗体的半衰期相比,本发明的纳米抗体可以与能够延长纳米抗体的半衰期的部分缀合或融合。在一些实施方案中,半衰期延长大于或大于约1.2倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍或6.0倍。在一些实施方案中,与没有半衰期延长部分的纳米抗体相比,体内施用后半衰期延长了大于6小时、大于12小时、大于24小时、大于48小时、大于72小时、大于96小时或大于1周。半衰期是指蛋白质失去一半浓度、数量或活性所需的时间量。半衰期可以例如通过使用elisa测定或活性测定来确定。示例性半衰期延长部分包括fc结构域、多聚结合结构域(例如白蛋白结合结构域)、人血清白蛋白(hsa)或牛血清白蛋白(bsa)。
30、免疫球蛋白分子的fc(片段可结晶)区或结构域(也称为fc多肽)在很大程度上对应于免疫球蛋白重链的恒定区,并且负责各种功能,包括抗体的效应子功能。fc结构域含有免疫球蛋白分子的铰链结构域的部分或全部加上ch2和ch3结构域。fc结构域可以形成由一个或多个二硫键相连的两个多肽链的二聚体。
31、半衰期延长部分可以与纳米抗体直接融合或缀合,或者可以采用接头。例如,任何半衰期延长部分,例如fc区,可以与一个或多个纳米抗体或其抗原结合片段间接或直接连接。各种接头是本领域已知的,并且可以任选地用于将fc(或其他半衰期延长部分)与纳米抗体连接以产生fc融合。相同物种的fc融合可以二聚形成fc融合同源二聚体,或者使用不相同物种形成fc融合异源二聚体。
32、如本领域技术人员所知,除了以上鉴定的那些,免疫缀合物和融合表达产物包括:通过将药物、毒素、细胞因子、放射性核素、酶和其他诊断或治疗分子与本发明的纳米抗体或其片段结合而形成的缀合物。
33、本公开还提供了其他多肽,例如包含纳米抗体或其抗原结合片段的融合蛋白。除了几乎全长的多肽之外,本发明还包括本公开的纳米抗体的片段。通常,该片段具有本文所述的纳米抗体的至少约50个连续氨基酸,例如至少约50个连续氨基酸、至少约80个连续氨基酸或至少约100个连续氨基酸。该片段可以至少包含本文所述的纳米抗体的cdr3区。
34、在本教导中,“保守置换”是指与衍生多肽的纳米抗体的氨基酸序列相比,其中有至多10个、至多8个、至多5个或至多3个氨基酸被具有类似或相似性质的氨基酸置换的多肽。这些保守变体多肽可以根据以下氨基酸置换产生:
35、 残基 保守置换 残基 保守置换 ala ser leu ile;val arg lys lys arg;gln asn gln;his met leu;ile asp glu phe met;leu;tyr gln asn ser thr;gly cys ser thr ser;val glu asp trp tyr gly pro tyr trp;phe his asn;gln val ile;leu ile leu,val
36、本教导还提供了编码纳米抗体或其抗原结合片段或融合蛋白的多核苷酸分子。本发明的多核苷酸可以是dna或rna的形式。dna形式包括cdna、基因组dna或合成dna。dna可以是单链的或双链的。dna可以是编码链或非编码链。编码根据seq id no:1-54的纳米抗体的dna序列在相应的seq id no:55-108中提供。因此,seq id no:1所限定的纳米抗体由seqid no:55编码,seq id no:2所限定的纳米抗体由seq idno:56编码,依此类推。
37、编码本公开的纳米抗体的多核苷酸包括:仅编码纳米抗体的编码序列;以及纳米抗体的编码序列和各种另外的编码序列;编码序列(和任选的另外的编码序列)。
38、术语“编码多肽的多核苷酸”可以包括编码多肽的多核苷酸,并且还包括包括另外的编码和/或非编码序列的多核苷酸。
39、本公开的纳米抗体的全长核苷酸序列或其抗原结合片段通常可以通过pcr扩增方法、重组方法或人工合成方法获得。一种可能的方法是使用合成方法合成相关序列,特别是当片段长度较短时。通常,可以通过首先合成多个小片段,然后将它们连接来获得长序列的片段。此外,重链的编码序列和表达标签(例如6his)可以融合在一起以形成融合蛋白。
40、一旦已获得期望的序列,就可以使用重组方法大规模获得期望的序列。通常,可以通过以下获得序列:将期望的多核苷酸克隆到载体中,将载体转化或转染到细胞中,然后通过常规方法从增殖的宿主细胞中分离序列。本公开涉及的生物分子(核酸、蛋白质等)包括以分离形式存在的生物分子。
41、编码本公开的纳米抗体(或其抗原结合片段,或其衍生物)的核酸序列可以完全通过化学合成获得。然后,可以将dna序列引入本领域已知的各种现有dna分子(或例如载体)和细胞中。此外,还可以通过化学合成将突变引入本公开的蛋白序列中。
42、本公开还涉及包含上述合适的dna序列和合适的启动子或控制序列的载体。这些载体可用于转化合适的宿主细胞,使得其能够表达蛋白。
43、宿主细胞可以是原核细胞,例如细菌细胞;或低级真核细胞,例如酵母细胞;或更高级的真核细胞,例如哺乳动物细胞。代表性实例为:大肠杆菌(escherichia coli)、链霉菌(streptomyces)、细菌细胞(例如鼠伤寒沙门氏菌(salmonella typhimurium))、真菌细胞(例如酵母)、昆虫细胞(果蝇s2或sf9)、动物细胞(cho、cost、293细胞)等。
44、用重组dna转化宿主细胞可以使用本领域技术人员熟知的常规技术进行。当宿主是原核生物(例如大肠杆菌)时,可以在指数生长期后收获能够吸收dna的感受态细胞,并用cacl2方法处理。使用的程序是本领域熟知的。另一种方法是使用mgcl2。如有必要,还可以通过电穿孔进行转化。当宿主是真核生物时,可以使用以下dna转染方法:磷酸钙共沉淀、常规机械方法(例如显微注射、电穿孔、脂质体包装)等。
45、获得的转化体可以以常规方式培养以表达目标多肽。根据所使用的宿主细胞,培养中使用的培养基可以选自各种常规培养基。培养在适合宿主细胞生长的条件下进行。在宿主细胞生长到合适的细胞密度后,通过合适的方法(例如温度变化或化学诱导)诱导选择的启动子,并将细胞再孵育一段时间。
46、上述方法中的重组多肽可以在细胞内表达,或在细胞膜上表达,或细胞外分泌。如有必要,可以利用其物理、化学和其他特性,通过各种分离方法分离和纯化重组蛋白。这些方法是本领域技术人员熟知的。这些方法的实例包括但不限于:常规复性处理、用蛋白沉淀剂处理(盐析法)、离心、渗透破坏、超处理、超速离心、分子筛色谱(凝胶过滤)、吸附层分析、离子交换色谱、高效液相色谱(hplc)和各种其他液相色谱技术及其组合。
47、本公开的纳米抗体可以单独或与例如可检测标志物(用于诊断目的)、治疗剂、修饰部分或其组合联合或缀合使用。
48、用于诊断目的的可检测标志物包括但不限于:荧光或发光标志物、放射性标志物、mri(磁共振成像)或ct(计算机断层扫描)造影剂、或能够产生可检测产物的酶。
49、本公开还涉及如本文所述的纳米抗体、抗原结合片段和衍生物/融合体(fusion)在治疗或预防由血小板聚集过程引起的疾病以及其他相关病况的方法中的用途。
50、本文所述的纳米抗体、抗原结合片段和衍生物/融合体可用于预防和治疗血栓形成的方法中。本公开还涉及用于鉴定gpvi介导的血小板粘附于活动性血管内病变的抑制剂的体外筛选方法。
51、本文所述的纳米抗体、抗原结合片段和衍生物/融合体可用于治疗和/或预防以下的方法:与动脉内和/或静脉内血栓形成相关的急性和慢性血管疾病,例如急性冠状动脉综合征/急性心肌梗死,慢性冠状动脉综合征/稳定型冠状动脉疾病,短暂性脑缺血发作,卒中,外周血管疾病,深静脉血栓形成,房颤患者的血栓预防,近期内科或外科手术入院的患者的血栓预防,肺栓塞,脓毒症相关的凝血病,covid-19相关的血栓形成,与心脏器械(例如左心室辅助器械、体外膜肺氧合和机械心脏瓣膜)相关的血栓形成,左心室血栓形成,心力衰竭中的血栓预防,血栓性病况(例如抗磷脂综合征、因子v莱顿突变)中的血栓预防以及其他形式的炎症、感染和癌症引起的血栓形成。
52、血小板激活的抑制导致血小板在聚集、粘附于表面、释放其颗粒内容物以及产生血栓素和其他脂质物质的能力方面普遍受损。
53、此外,本公开旨在提供gpvi(特别是人gpvi)的抑制剂,其不通过固有抗体活性激活gpvi受体并且不诱导免疫性血小板减少症。此外,本公开旨在提供用于血小板释放机制和促炎反应表达的抑制剂。
54、本公开的纳米抗体或其抗原结合片段或变体可以与另一种治疗剂联合施用,该另一种治疗剂例如抗血小板药物,包括阿司匹林(和其他环氧合酶抑制剂)、p2y12受体拮抗剂和gpiib/iiia抑制剂,以及抗凝剂,包括肝素、华法林以及因子xa和凝血酶的直接抑制剂,以及溶栓疗法,例如瑞替普酶、阿替普酶和链激酶。
55、在本公开的纳米抗体或其抗原结合片段或变体与一种、两种、三种、四种或更多种,优选一种或两种,优选一种其他治疗剂联合施用的情况下,纳米抗体和试剂可以同时或顺序地施用。当顺序地施用时,它们可以以紧密间隔(例如在5-10分钟的时间段内)或以更长的间隔(例如间隔1、2、3、4小时或更多小时,或者在需要时甚至更长的时间段)施用,精确的给药方案与治疗剂的性质相称。
56、本发明的纳米抗体还可以与非活性剂治疗(例如光动力疗法、基因疗法;或手术)结合施用。
57、受试者通常是人。
58、纳米抗体通常将以治疗或预防有效量施用。治疗或预防有效量意指能够实现期望的反应的量,并且通常将由医生判断。所需的量将取决于至少一种或多种相关的活性化合物、患者、期望治疗或预防的病况以及接受治疗的患者每kg体重1μg至1g数量级化合物的制剂。
59、同样可以施用不同的给药方案,同样通常由医生自行决定。本公开的纳米抗体可以通过每日施用来提供,尽管本公开还涵盖更不频繁地施用(一种或多种)化合物的方案,例如每隔一天、每周或每两周施用一次。
60、本文中的治疗意指至少改善患者患有的病况;治疗不需要是治疗性的(即导致病况消除)。类似地,本文中对预防或预防性治疗的引用并不指示或要求完全预防病况;而是可以通过根据本公开的预防性治疗或预防来减少或延迟其表现。
61、本公开的化合物可以购自商业供应商,或者使用本领域中容易获得的试剂和技术制备。
62、药物制剂包括适用于以下的那些:口服、外用(包括真皮、口腔和舌下)、直肠或肠胃外(包括皮下、皮内、肌内和静脉内)、鼻腔和肺部施用,例如通过吸入。在适当的情况下,制剂可以方便地以离散的剂量单位存在,并且可以通过药学领域中熟知的任何方法进行制备。方法通常包括使活性化合物与液体载体或细小固体载体或两者缔合的步骤,然后,如有必要,使产物成形为期望的制剂。
63、优选地,药物组合物适合于静脉内、肌内、皮下、肠胃外、脊柱或表皮施用(例如,通过注射或输注)。根据施用途径,活性纳米抗体可以被包覆在材料中,以保护其免受酸和其他可能使其失活的自然条件的作用。本文中使用的短语“肠胃外施用”是指肠内和外用施用以外的施用模式,通常通过注射,并且包括但不限于,静脉内、肌内、动脉内、鞘内、囊内,眶内、心内、皮内、腹腔、经气管、皮下、表皮下、关节内、包膜下、蛛网膜下腔、椎管内、硬膜外和胸骨内注射和输注。可选地,本发明的纳米抗体可以通过非肠胃外途径施用,例如外用、表皮或粘膜施用途径,例如鼻内、口服、阴道、直肠、舌下或外用施用。
64、本发明的纳米抗体可以是药学上可接受的盐的形式。“药学上可接受的盐”是指保留母体纳米抗体的期望的生物活性并且不产生任何非期望的毒理学效应的盐。这种盐的实例包括酸加成盐和碱加成盐。酸加成盐包括衍生自以下的那些:无毒无机酸,例如盐酸、硝酸、磷酸、硫酸、氢溴酸、氢碘酸、磷酸等,以及无毒有机酸,例如脂肪族单羧酸和二羧酸、苯基取代的链烷酸、羟基链烷酸、芳香酸、脂肪族和芳香磺酸等。碱加成盐包括衍生自以下的那些:碱土金属,例如钠、钾、镁、钙等,以及无毒有机胺,例如n,n’-二苄基乙二胺、n-甲基葡糖胺、氯普鲁卡因、胆碱、二乙醇胺、乙二胺、普鲁卡因等。
65、药物组合物可以是无菌水溶液或分散体的形式。还可以将它们配制成微乳液、脂质体或适用于高药物浓度的其他有序结构。可以与载体材料组合以产生单一剂型的活性成分的量将根据接受治疗的受试者和特定施用方式而变化,并且通常将是产生治疗效果的组合物的量。通常,在百分之百中,该量将在约0.01%至约99%的活性成分范围内,优选地约0.1%至约70%,最优选地约1%至约30%的与药学上可接受的载体组合的活性成分。
66、调整剂量方案以提供最佳期望的反应(例如,治疗反应)。例如,可以单次推注施用,可以随着时间分多次剂量施用,或者可以根据治疗情况的紧急情况按比例减少或增加剂量。特别有利的是以剂量单位形式配制肠胃外组合物,以便于施用和剂量的均匀性。本文所用的剂量单位形式是指适合作为待治疗受试者的单一剂量的物理上离散的单位;每个单位含有预定量的与所需的药物载体缔合的活性化合物,该预定量被计算为产生期望的治疗效果。可选地,抗体可以作为缓释制剂施用,在这种情况下需要较低施用频率。
67、对于纳米抗体的施用,剂量范围为宿主体重的约0.0001至100mg/kg,更通常为0.01至5mg/kg。例如,剂量可以为0.3mg/kg体重、1mg/kg体重、3mg/kg体重、5mg/kg体重或10mg/kg体重,或在1-10mg/kg的范围内。示例性治疗方案需要每周施用一次、每两周施用一次、每三周施用一次、每四周施用一次、每个月施用一次、每3个月施用一次或每三至6个月施用一次。本公开的纳米抗体的优选剂量方案包括通过静脉内施用的1mg/kg体重或3mg/kg体重,其中使用以下给药方案中的一个方案给予纳米抗体:(i)每四周给药六次,然后每三个月给药;(ii)每三周给药;(iii)3mg/kg体重给药一次,随后每三周给药1mg/kg体重。在一些方法中,调整剂量以达到约1-1000mg/ml的血浆抗体浓度,并且在一些方法中约25-300mg/ml。
68、在一些实施方案中,根据本发明的纳米抗体,例如由sed id no:82编码的根据seqid no:28的纳米抗体,不与其他所述的纳米抗体(例如nb2和nb35)竞争与gpvi结合。这种抗体可用于gpvi的成像研究,特别是当与标签分子(例如本文所述的荧光分子)缀合时。
- 还没有人留言评论。精彩留言会获得点赞!