一种高效制备红茶菌的菌种组合及其应用
1.本发明属于食品发酵与酿造技术领域,具体涉及一种高效制备红茶菌的菌种组合及其应用。
背景技术:
2.红茶菌,又称康普茶,是一种通过微生物发酵后生成的功能性饮品。红茶菌中包含了共生的混合菌群,主要包括醋酸菌和酵母菌,有的还含有少量乳酸菌,它们在红茶菌培养中会形成类似海蜇皮的菌膜。传统红茶菌培养是将菌膜和部分菌液接种于糖茶水中静置发酵1-2周,形成有机酸、酯类等代谢产物,产生红茶菌特有的酸甜风味。
3.红茶菌的菌膜被认为具有加速发酵、抵御杂菌侵袭等作用,但它只是副产物,在红茶菌饮料终产品中不需要菌膜。不利的是,在工业化制备中,菌膜的生成一方面会消耗大量糖类、降低糖酸转化率,另一方面加重后处理过程中过滤、澄清等工序的负担。因此,减少发酵中菌膜生成将有利于降低红茶菌的生产成本。
4.现有的技术公开了一些减少菌膜形成的技术方案。公开号为cn201610681554.1的发明专利公开了一种连续型静态发酵红茶菌液的设备及制作方法,通过多罐协同进行二次发酵,消除了一次发酵中产生的菌膜,为后续的过滤、澄清等工序减轻了负担。公开号为cn201811055464.7的发明专利公开了一种利用花朵状容器旋转抑制菌膜的红茶菌液发酵设备,通过设计复杂的发酵装置提高液体的流速来减少液体的停留时间,从而降低菌膜的繁衍速度。综上所述,现有的技术主要通过设计复杂的发酵设备减少菌膜形成,一方面增加了发酵设备的成本和生产操作的难度,另一方面也没有从根本上解决菌膜产生的问题,只能相对减少菌膜的生成量。
5.基于上述问题,本发明一方面从传统红茶菌中筛选出不产菌膜的gluconacetobacter intermedius ka25作为主生产菌株,从源头上避免菌膜产生,提高糖酸转化率;另一方面从传统红茶菌中筛选出starmerella davenportii kb17,协同促进gluconacetobacter intermedius ka25发酵产酸,提高发酵效率。本发明筛选出优良的菌种,避免菌膜形成,并通过特定的菌种组合,快速稳定获得高品质红茶菌产品。本发明提供的技术方案,使得红茶菌的生产过程简单高效,产品品质优良,适宜于规模化制备红茶菌。
技术实现要素:
6.针对目前传统红茶菌存在形成大量菌膜、糖酸转化率不高、产酸效率低等问题,本发明一方面筛选出不产菌膜且糖酸转化率高的gluconacetobacter intermedius ka25,另一方面将该菌株与starmerella davenportii kb17协同发酵,大幅度提升产酸效率。将这两种菌通过特定的菌种组合发酵技术,快速稳定获得高品质红茶菌。
7.为了实现上述目的,本发明采用以下技术方案:本发明提供一种gluconacetobacter intermedius ka25,保藏单位:中国普通微生物菌种保藏管理中心,地址:中国北京市朝阳区北辰西路1号院3号,保藏日期:2021年12
月02日,保藏号为:cgmcc no.24020。
8.本发明提供一种starmerella davenportii kb17,保藏单位:中国普通微生物菌种保藏管理中心,地址:中国北京市朝阳区北辰西路1号院3号,保藏日期:2021年12月02日,保藏号为:cgmcc no.24019。
9.进一步的,本发明提供一种菌种组合, gluconacetobacter intermedius ka25和starmerella davenportii kb17活菌量比值为1~4 : 4~1;最优的,gluconacetobacter intermedius ka25和starmerella davenportii kb17活菌量比值为3:1。
10.进一步的,本发明提供gluconacetobacter intermedius ka25和starmerella davenportii kb17的菌种组合在生产红茶菌产品中的应用。
11.进一步的,通过上述菌种组合获得的红茶菌产品,包括直饮液、浓缩液和冻干粉。
12.与现有技术相比,本发明具有以下优点及有益效果:传统红茶菌容易形成大量菌膜,导致糖酸转化率不高,菌膜的存在还加重后处理中过滤和澄清等工序的负担;本发明提供了不产菌膜的gluconacetobacter intermedius ka25,避免了在发酵过程中将大量的糖转化成菌膜副产物,提高了糖酸转化率,减轻后处理的负担。传统红茶菌菌种混杂、发酵效率低下,本发明提供了starmerella davenportii kb17及其与gluconacetobacter intermedius ka25的特定组合,两种菌协同发酵,大幅度提升产酸效率。
附图说明
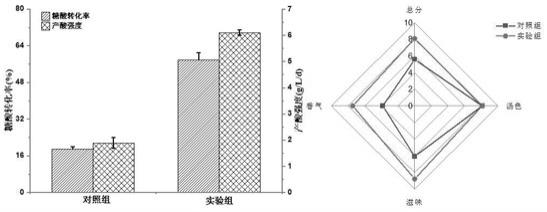
13.图1为醋酸菌的分离纯化图;图2为酵母菌的分离纯化图;图3为实施例5中发酵培养图;图4为实施例5中糖酸转化率及产酸强度分析图。
具体实施方式
14.为了使本发明更容易理解,下面结合具体实施例,进一步阐述本发明。而这些实施例仅为了说明本发明而不用于限制本发明的范围。
15.实施例1醋酸菌的分离纯化:取活化的传统红茶菌发酵液充分振荡均匀,在无菌条件下吸取0.5 ml菌液于装有4.5 ml生理盐水的离心管中混匀,得到原菌液的稀释度为10-1
,然后依次梯度稀释至10-7
。取各梯度的稀释液0.2 ml涂布于醋酸菌分离培养基上,置于28 ℃培养箱中培养2~3天。挑取平板上具有圆形,突起,不透明,淡黄色典型特征的菌落,划线分离3次以上,在显微镜下进行观察,筛选出细胞呈短杆状的菌株,获得94株菌。
16.醋酸菌初筛:用接种针挑取单个菌落,以划线的方式接种于含0.20g/l溴甲酚蓝(ph指示剂,3.80(黄)~5.40(蓝))的醋酸菌初筛培养基中,每种醋酸菌设置2个重复,于28℃培养箱倒置培养。结果如图1所示,产酸越多的菌颜色越黄,筛选出黄色明显的菌株(图1左侧),共计64株。
17.醋酸菌复筛:将初筛获得的醋酸菌进行活化,往醋酸菌液体培养基接入 5%活化的菌液,置于 30℃培养箱培养 9 天。挑选不产菌膜的菌种,取样测定总酸含量,获得不产菌
膜且产酸能力最强的菌种1株。
18.醋酸菌培养基:酵母粉10 g/l,葡萄糖10 g/l,无水乙醇30 ml/l,固体培养基添加15 g/l琼脂。
19.实施例2委托上海生工生物有限公司对实施案例1中筛选出的不产菌膜且产酸能力最强的菌株进行16s rdna测序,pcr扩增序列如seq id no.1所示。将测序结果去除引物序列后在美国国立生物技术信息中心(national center for biotechnologyinformation,ncbi)的 genbank 数据库中进行 blast 比对。鉴定为gluconacetobacter intermedius,命名为gluconacetobacter intermedius ka25。将其保藏在中国普通微生物菌种保藏管理中心,地址:中国北京市朝阳区北辰西路1号院3号,保藏日期:2021年12月02日,保藏号为:cgmcc no. 24020。
20.实施例3酵母菌的分离纯化:取活化的红茶菌发酵液充分振荡均匀,在无菌条件下吸取0.5 ml菌液于装有4.5 ml生理盐水的离心管中混匀,得到原菌液的稀释度为10-1
,然后依次梯度稀释至10-7
。取各梯度的稀释液0.2 ml涂布于酵母菌分离培养基上,置于28 ℃培养箱中培养1~2天。挑取平板上筛选出菌落颜色为奶油色(乳白色),表面光滑,球形凸起,不透明,奶油状的菌株,划线分离3次以上,在显微镜下进行观察,筛选出一端或多端出芽的酵母菌株,获得29株菌。
21.酵母菌初筛:用接种针挑取单个菌落,按三点接种法接至酵母菌分离纯化培养基中,每种酵母菌设置 2 个重复,于 25℃培养箱倒置培养。待长出菌落后,往其倒入ttc上层培养基(每个培养基大概倒入 7 mlttc 上层培养基),于25℃培养箱培养 3 h。结果如图2所示,产乙醇越多的菌颜色越红,筛选出经ttc染色后颜色深红的菌株(图2左侧),共计27株。
22.酵母菌复筛:将初筛获得的酵母菌进行活化,往酵母菌液体培养基接入 3%活化的菌液,置于30℃培养箱培养5天。每天取样测定乙醇含量,每个样品重复测量3次,从中筛选出产乙醇量最高的1株酵母菌。
23.酵母菌培养基:蔗糖40 g/l,蛋白胨10 g/l,酵母粉10 g/l,固体培养基添加15 g/l琼脂。
24.实施例4委托上海生工生物有限公司对实施案例3中筛选出乙醇含量最高的菌株进行26s rdna测序, pcr扩增序列如seq id no.2所示。测序结果去除引物序列后在ncbi的 genbank 数据库中进行 blast 比对。鉴定为starmerella davenportii,命名为starmerella davenportii kb17。将其保藏在中国普通微生物菌种保藏管理中心,地址:中国北京市朝阳区北辰西路1号院3号,保藏日期:2021年12月21日,保藏号为:cgmcc no. 24019。
25.实施例5以筛选前的传统红茶菌为对照组,上述筛选出的菌株gluconacetobacter intermedius ka25和starmerella davenportii kb17为实验组,应用于红茶菌饮料的制备,进行比较。
26.首先进行种子液培养:取gluconacetobacter intermedius ka25,按0.1%接种量
接于醋酸菌培养基中,在30℃、160 rpm下振荡下培养48~72 h;取starmerella davenportii kb17,按0.1%接种量接于ypd培养基中,在30℃、160 rpm下振荡培养24~30 h。
27.再进行发酵培养基的制备:将茶叶、白砂糖与水按0.6﹕10﹕100的质量比例在90℃保温30 min,得到发酵培养基。茶叶为祁门红茶。
28.然后将获得的种子液gluconacetobacter intermedius ka25和starmerella davenportii kb17按活菌量比值为3 :1,总接种量为4%接入发酵培养基中,在 30℃下静置培养9天。
29.对照组以分离前的传统红茶菌母液为种子液,按总接种量为4%接入发酵培养基中,在 30℃下静置培养 9 天。
30.如图3所示,发酵后,实验组(左侧)没有长菌膜,而对照组(右侧)的液面漂浮着一层厚厚的菌膜。如图4所示,实验组的糖酸转化率及产酸强度分别为 57.9%、6.1 g/l/d,分别为对照组的3.06和3.23倍。感官品质方面,实验组的香气和滋味得分显著高于对照组,其感官总分相比对照组提升了45%。因此,相比传统红茶菌,通过本发明提供的菌种组合生产红茶菌不仅生产效率明显提升,而且其品质也明显改善。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1