一种五元脂质纳米颗粒及其制备方法和应用
1.本发明涉及化学制药以及生物技术领域,涉及核酸递送系统,具体涉及一种高稳定性肺靶向的聚合物-脂质纳米颗粒的制备方法及其在核酸递送中的应用。
背景技术:
2.新冠肺炎疫情的爆发,让人们意识到肺部传染病的严重性。而除传染病之外,肺部其他相关疾病,如肺癌和遗传性罕见疾病,也缺乏有效的治疗手段。在新冠肺炎期间,一种新型的包裹在脂质纳米颗粒(lnp)中的mrna疫苗表现出高达95%的保护功效,这是第一个获得fda紧急使用许可的mrna疫苗。除此之外,基于脂质纳米颗粒(lnp)的mrna可以通过编码基因编辑的工具来根治遗传性疾病,也可以通过编码肿瘤抗原、免疫检查点抑制剂、双特异性抗体等实现肿瘤的免疫治疗。因此,将mrna-lnp制剂应用于肺相关疾病的治疗无疑具有巨大的潜力和意义。
3.目前有少数研究提出了mrna核酸肺靶向的策略,如sort提出带正电荷的纳米粒可以实现肺的递送。然而,目前lnp的应用仍面临许多问题,其中储存的稳定性是限制其广泛临床应用的主要缺点,稳定性低的lnp制剂在储存和运输上会有巨大的经济障碍。因此lnp的不稳定性是一个亟待解决的问题。目前影响mrna-lnps不稳定性的主要因素如下,即mrna的不稳定性和lnp的不稳定性:
4.1)在水存在的情况下mrna中的化学成分容易氧化和水解。例如,mrna中磷酸酯键上的2'oh基团攻击p-o5'酯键,导致mrna链断裂。这个过程需要水,可以由酸或者碱催化。2)由于化学材料的降解,mrna与化学脂质的作用力变弱,mrna泄漏。泄露的裸mrna难以被细胞吸收,而且会迅速降解;3)由于水中纳米颗粒之间的斥力不足,脂质纳米颗粒有发生聚集、融合和渗漏的倾向。
技术实现要素:
5.为了在体内有效发挥作用,脂质纳米颗粒-mrna需要克服多种细胞外和细胞内屏障。首先,mrna需要被脂质纳米颗粒成功包裹。其次,脂质纳米颗粒需要到达靶组织,然后被靶细胞内化。最重要的是,mrna必须逃脱核内体,翻译成功能性蛋白质。另外,该制剂在临床应用时,最好可以在4℃条件下长期储存,以减少在运输的贮存过程中的经济负担。
6.总的来说,纳米粒子的物理化学特性是后续有效性评估的基础。例如,较高的核酸包封率是决定有效转染和适宜粒径的关键因素;zeta电位也在一定程度上影响其毒性和体内分散能力。zeta电位越高,生理条件下红细胞的溶血能力越强,毒性也越大。而pdi则在一定程度上反映了处方的均一性和完善性。合适的纳米粒粒径及电位会降低体内栓塞的概率,促进体内深部组织的穿透,提高细胞的摄取及转染效率。
7.本发明人创新性地发现pbae和阳离子脂质的加入可以增加fnp的稳定性。
8.例如,本发明采用了经典的阳离子脂质dotap,它具有很强的正电荷来阻止分子间的聚集;其次,首次将一种辅助聚合物聚β-氨基酯(pbae)引入到传统的四组分阳离子lnp配
方中组成一种新型的五元纳米颗粒fnp。pbae作为一种可质子化的含多重氮的阳离子材料,进一步增强了对mrna的包封,防止mrna泄漏以及减少冻干过程中因结晶和真空脱水产生的不利影响,进一步保障了纳米粒的稳定性。这两种组分的加入,使纳米粒具有高稳定性,可以很好地耐受冷冻干燥过程,进而可以通过冻干去除水分对mrna和脂质材料水解的影响。
9.本发明构建了不同侧链长度、不同聚合度的新型pbae聚合物库,并进一步探讨了其体内、体外构效关系。pbae的碳链长度越接近c16,递送效率越高;pbae的聚合度越高,递送效率越高。基于上述成分的新型辅助聚合物的fnp经体内筛选出具有特异、高效的肺靶向pbae材料,经冷冻干燥后在4℃下的稳定时间超过3个月。
10.此外,本发明通过质谱分析研究了fnp的蛋白冠组成,并进一步研究了其肺靶向性机制。发现在fnp中,玻连蛋白高度富集。首次采用小鼠肺原代微血管内皮细胞,验证玻连蛋白通过与肺内皮细胞整合素受体αvβ3结合,介导fnp的肺特异性靶向。
11.本发明主要通过以下技术方案解决上述技术问题。
12.本发明的目的在于提供一种能够有效包封核酸并能被细胞高效摄取后快速逃逸出溶酶体,最终实现体内目的基因高效表达的肺靶向核酸递送系统,同时该系统具有高稳定性,经冷冻干燥后能够在4℃的条件下长期储存。
13.为实现对于核酸的有效包封并提高细胞摄取和溶酶体逃逸效率的目的,本发明公开了以下技术方案:一种在脂质纳米颗粒中添加辅助聚合物pbae和阳离子脂质的聚合物-脂质纳米颗粒,该纳米粒由聚合物pbae、阳离子脂质、甾醇、磷脂、peg脂质和一种或多种核酸分子组成,所述的核酸分子包裹在脂质和聚合物中形成层层包裹的结构中。
14.本发明首次将一种辅助聚合物聚β-氨基酯(pbae)引入到传统的四组分阳离子lnp配方中组成一种新型的五元纳米颗粒fnp。pbae作为一种可质子化的含多重氮的阳离子材料,进一步增强了对mrna的包封。
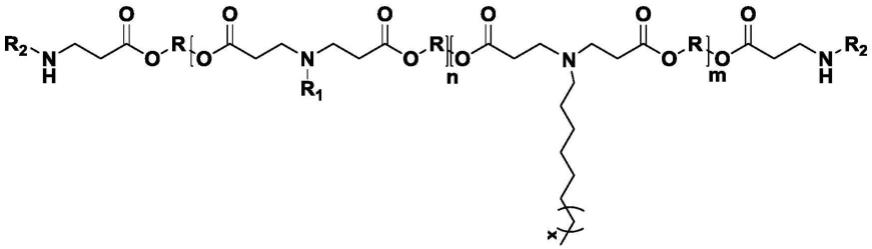
15.本发明提供一种聚合(β-氨基酯)(pbae),其包含式(i);
[0016][0017]
其中:
[0018]
r1独立地是含有或者不含有羟基的脂肪链,r2独立地是包含伯胺、仲胺或叔胺的端基单体,r包含直链或支链的c
1-c
50
亚烃基链,其可进一步包含一个或更多个杂原子或一个或更多个碳环基团、杂环基团或芳族基团;
[0019]
m为1-15,n为3-45,x为1-13。
[0020]
本发明中,所述r1优选独立地为
[0021]
所述r2优选独立地为
[0022][0023]
所述r优选独立地为
[0024]
或者
[0025]
所述pbae的制备方法可为本领域常规,例如其制备方法包含:将r1、r2、r以及烷基胺混合在一起进行迈克尔加成反应。
[0026]
本发明还提供一种五元脂质纳米颗粒,其原料包含阳离子脂质、如上所述的聚合(β-氨基酯)、甾醇、磷脂以及peg脂质。
[0027]
当五元脂质纳米颗粒作为核酸递送系统时,其还可包含核酸分子。
[0028]
本发明中,所述阳离子脂质与所述pbae摩尔比较佳地为(2.5~40):1。
[0029]
本发明中,所述阳离子脂质与所述pbae质量与所述核酸分子的相对用量较佳地为(10~80):1。
[0030]
本发明中,所述磷脂与所述甾醇的摩尔比较佳地为(0.2~1):1。
[0031]
本发明中,所述磷脂与所述peg脂质的摩尔比较佳地为(5~20):1。
[0032]
在本发明一较佳实施方案中,n:m的比为7:3;即:脂肪链的占比为30%。
[0033]
在本发明中,所述x较佳地为3~11。
[0034]
在本发明中,所述甾醇选自胆固醇、菜油甾醇、海藻甾醇以及胡萝卜甾醇中的一种或多种;优选胆固醇。
[0035]
在本发明的上下文中,阳离子脂质是指永久带正电荷的脂质,可以选自包含以下的列表:氯化三甲基-2,3-二油烯氧基丙基铵(dotma),溴化三甲基-2,3-二油酰氧基丙基铵(dotap),三氟乙酸二甲基-2,3-二油烯氧基丙基-2-(2-精胺甲酰氨基)乙基铵(dospa),溴化三甲基十二烷基铵(dtab),溴化三甲基十四烷基铵(ttab),溴化三甲基十六烷基铵(ctab),溴化二甲基双十八烷基铵(ddab),溴化二甲基-2-羟乙基-2,3-二油酰氧基丙基铵(dori),溴化二甲基-2-羟乙基-2,3-二油烯氧基丙基铵(dorie),溴化二甲基-3-羟丙基-2,3-二油烯氧基丙基铵(dorie-hp),溴化二甲基-4-羟丁基-2,3-二油烯氧基丙基铵(dorie-hb),溴化二甲基-5-羟戊基-2,3-二油烯氧基丙基铵(dorie-hpc),溴化二甲基-2-羟乙基-2,3-双十六烷氧基丙基铵(dprie),溴化二甲基-2-羟乙基-2,3-双十八烷氧基丙基铵(dsrie),溴化二甲基-2-羟乙基-2,3-双十四烷氧基丙基铵(dmrie),n-(2-精胺甲酰基)-n’,n
’‑
双十八烷基甘氨酰胺(dogs),1,2-二油酰-3-琥珀酰-sn-甘油胆碱酯(dosc),3β-[n-(n’,n
’‑
二甲基胺乙基)胺基甲酰基]胆固醇(dc-chol)。
[0036]
术语“磷脂”是指由两个疏水性脂肪酸“尾部”和由磷酸基团构成的亲水性“头部”组成的脂质分子,在本发明的上下文中,合适的磷脂可以选自包含以下的列表:1,2-二油酰
基-sn-甘油-3-磷酸乙醇胺(dope),1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc),1,2-二亚油酰基-sn-甘油-3-磷酸胆碱(dlpc),1,2-二肉豆蔻酰基-sn-甘油-磷酸胆碱(dmpc),1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc),1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc),1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱(dspc),1,2-二十一烷酰基-sn-甘油-磷酸胆碱(dupc),1-棕榈酰基-2-油酰基-sn-甘油-3-磷酸胆碱(popc),1,2-二-o-十八碳烯基-sn-甘油-3-磷酸胆碱(18:0二醚pc),1-油酰基-2-胆甾醇基半琥珀酰-sn-甘油-3-磷酸胆碱(ochemspc),1-十六烷基-sn-甘油-3-磷酸胆碱(c 16lyso pc),1,2-二亚麻酰基-sn-甘油-3-磷酸胆碱,1,2-二花生四烯酰基-sn-甘油-3-磷酸胆碱,1,2-二十二碳己酰基-sn-甘油-3-磷酸胆碱,1,2-二植烷酰基-sn-甘油-3-磷酸乙醇胺(me 16.0pe),1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺,1,2-二亚油酰基-sn-甘油-3-磷酸乙醇胺,1,2-二亚麻酰基-sn-甘油-3-磷酸乙醇胺,1,2-二花生四烯酰基-sn-甘油-3-磷酸乙醇胺,1,2-二十二碳己酰基-sn-甘油-3-磷酸乙醇胺,1,2-二油酰基-sn-甘油-3-磷酸-rac-(1-甘油)钠盐(dopg),鞘磷脂及其混合物。
[0037]
术语“peg脂质”或可替代地“peg化脂质”是指用peg(聚乙二醇)基团修饰的任何合适的脂质。可以选自包含以下的列表:peg修饰的磷脂酰乙醇胺,peg修饰的磷脂酸,peg修饰的神经酰胺,peg修饰的二烷基胺,peg修饰的二酰基甘油,peg修饰的二烷基甘油及其混合物。此类peg脂质的更具体实例包括c14-peg2000(1,2-二肉豆蔻酰基-rac-甘油、甲氧基聚乙二醇-2000(dmg-peg2000))和c18-peg5000(1,2-二硬脂酰基-rac-甘油、甲氧基聚乙二醇-5000(dsg-peg5000))。
[0038]
在一个具体的实施方案中,所述peg脂质为甲氧基聚乙二醇-2000(dmg-peg2000)。
[0039]
本发明中,所述核酸分子可为rna和/或dna;例如mrna、pdna。
[0040]
在本发明一较佳实施方案中所述的五元脂质纳米颗粒的制备方法包括:
[0041]
将阳离子脂质、如上所述的聚合(β-氨基酯)、甾醇、磷脂以及peg脂质溶解为乙醇相,将核酸分子溶解为水相;
[0042]
将两相混合即得所述五元脂质纳米颗粒;
[0043]
两相优选以乙醇与水体积比1:1混合。
[0044]
在本发明一具体实施方案中,所述的五元脂质纳米颗粒的原料包含dotap、pbae、胆固醇、dope以及peg脂质,摩尔比为(dotap+pbae):dope:胆固醇:dmg-peg=50:10:38.5:1.5。
[0045]
本发明还提供一种药物组合物或疫苗,其包含如上所述的五元脂质纳米颗粒以及药学上可接受的载体。
[0046]
本发明还提供如上所述的聚合(β-氨基酯)在制备五元脂质纳米颗粒中的应用。
[0047]
本发明还提供一种包含如上所述的五元脂质纳米颗粒的冻干制剂。
[0048]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0049]
本发明所用试剂和原料均市售可得。
[0050]
本发明的积极进步效果在于:
[0051]
本发明制备得到的pbae具有良好的生物相容性。利用其制备得到的五元脂质纳米颗粒可以实现高效高特异性的体内转染并具有高稳定性,经冷冻干燥后能够在4℃的条件
下长期储存,可作为核酸药物递送系统(如肺靶向等);具有良好的耐受性且具有接近+5mv的适宜的表面zeta电位。
附图说明
[0052]
图1a~图1c为pbae结构、合成方法以及部分代表性氢谱。
[0053]
图2为pbae递送egfp-mrna在293t细胞转染效率筛选。
[0054]
图3为含荧光素酶mrna的fnp与293t细胞孵育后的细胞活力评价。
[0055]
图4为fnp在细胞中转染荧光素酶mrna的筛选结果。
[0056]
图5为fnp递送不同剂量的荧光素酶mrna的体内结果,表达效率呈现剂量依赖性(0.15~0.45mg/kg数据以均数
±
s.e.m表示n=3)。
[0057]
图6为fnp体内转染筛选。荧光素酶mrna剂量为(0.3mg/kg)。
[0058]
图7为fnp递送高剂量mrna(0.6mg/kg)在体内耐受良好;肾功能(a、bun、b、crea)和肝功能(c、ast、d、alt)测定结果均显示无明显毒性。
[0059]
图8为各主要器官h&e染色结果。fnp递送高剂量mrna(0.6mg/kg)在体内耐受良好;比例尺=50μm。
[0060]
图9为fnp的冷冻电镜图像。
[0061]
图10为fnp的mrna包封效率(ee)。
[0062]
图11为fnp的粒径,pdi以及电位。
[0063]
图12为ph5.0(模拟溶酶体酸性环境)和ph7.4(模拟血浆生理环境)条件下对fnp进行体内溶血评价。
[0064]
图13为细胞摄取和溶酶体逃逸;4,6-二氨基2-苯基吲哚(dapi)染色细胞核(蓝色),lysotracker染色溶酶体(绿色)。
[0065]
图14为fnp在293t细胞的摄取情况。
[0066]
图15为fnp在293t细胞中的溶酶体逃逸效率。
[0067]
图16为传统lnp以及引入正电荷、负电荷后和单独的pbae处方冻干前后细胞转染效果的对比。
[0068]
图17为传统lnp以及引入正电荷、负电荷后和单独的pbae处方冻干前后粒径,pdi以及电位的对比。
[0069]
图18为冻干后(左图)的fnp可在4℃长时间保持稳定的细胞转染效果,而未经冻干处理的fnp转染效果下降迅速(右图)。
[0070]
图19为冻干后的fnp可在4℃长时间保持稳定的粒径,pdi以及电位。
[0071]
图20为fnp在ai9小鼠的肺中诱导特异性tdtom荧光表达。
[0072]
图21为荧光显微镜图像显示包载cre mrna的fnp给药后肺tdtomato阳性细胞;比例尺:50μm。
[0073]
图22为用流式细胞仪(facs)量化肺中特定细胞类型中tdtom+细胞的百分比。
[0074]
图23为fnp的器官分布;a)包载cy5-mrna的fnp的器官分布图像,b)通过qpcr检测各器官mrna的分布情况。
[0075]
图24为富含玻连蛋白的蛋白冠介导αvβ3受体相关的肺特异性表达;a)从11c18e1中分离的冠状蛋白的蛋白质组学分析(n=23.64fnp,control,,dlin-mc3 lnp)(n=4/组),b)
包载egfp-mrna的fnp与不同量的玻连蛋白孵育对αvβ3受体阳性的u87细胞系和小鼠原代肺微血管内皮细胞以及αvβ3受体阴性的hepg2细胞系进行转染,标尺为50μm,c)对图b各组egfp阳性细胞比例的定量分析结果。
[0076]
图25为pbae递送pdna在293t细胞转染效率筛选。
[0077]
图26为fnp可有效包封pdna;使用动态光散射(dls)测量颗粒粒径、pdi和zeta电位(a),琼脂糖凝胶电泳结果表明,fnp能有效包封pdna(b)。
[0078]
图27为fnp(11c18e1 n=23.64)可以有效地递送pdna(0.3mg/kg)到小鼠肺部。
具体实施方式
[0079]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0080]
本发明对具有不同表面电位的处方冻干前后的细胞转染效果进行了研究。首先对于c12-200以及dlin-mc3的传统处方在冻干复溶之后,其转染效果有明显下降,这表明传统的肝靶向纳米粒难以;耐受冻干这一过程。而根据我们的之前的假设,在纳米粒中加入阳离子脂质可以使其表面带正电荷而增加粒子间的排斥作用,减少其在冻干的过程中粒子的团聚而保持稳定,于是在c12-200和dlin-mc3的处方中加入50%的dotap而使其成为表面带正电的纳米粒,结果表明这两种处方可以在冻干后维持转染效果基本保持不变。进一步实现的结果表明,掺入50%18:pa的两种表面带负电的纳米粒经过冻干之后,其转染效果明显下降。
[0081]
除此之外,本发明设计了一系列具有不同疏水链长度的pbae材料,根据之前筛选的结果,选取了其中体内外效果最好的一组(11c16e2 n=24.11)研究了单独的pbae处方是否可以通过促进核酸的包封而在冻干之后维持转染效果。结果显示,pbae可以有效地增加纳米粒的稳定性。
[0082]
综合以上两方面的结果,预测通过在lnp中添加聚合物pbae以及阳离子脂质可以有效地增加处方稳定性并可以在冻干之后长时间维持转染效果。本发明进一步对体内效果最好的五种fnp处方进行了稳定性研究,测定了其在冻干后不同时间点的细胞转染效果,结果表明,前四组fnp的稳定性都较好,而尽管第五组具有最高的表面电位,但其转染细胞的能力随着时间的推移而下降,表现出较差的稳定性,这可能与其pbae的疏水链长度较其余四组短有关,这也暗示并不是表面电位越高纳米粒的稳定性就越好,pbae也从中发挥着极为重要的作用。
[0083]
实施例1
[0084]
本发明设计并合成了一系列pbae材料,其骨架结构为11,结合图1a~图1c:第一个1指的是back bone(b)的结构,即b1;第二个1指的是side chain(s)的结构,即s1)。为了进一步探讨各种pbae的端封基团对其效率的影响,我们选择了两组端封基团,即e1和e2。基于pbae的烷基侧链可以促进mrna封装、溶酶体逃逸的假设,我们设计了不同碳链烷基侧链的长度,分别为8、10、12、14、16和18,不同长度疏水链的加入帮助pbae对核酸的包封形成更加稳定的结构,使其可以经受冷冻干燥这一过程。由于已有报道pbae的聚合程度对其转染效率也有很大的影响,所以这里将其作为变量之一,设置了3种主要的聚合度类型(以下以n表
示;以下若无特殊说明,脂肪链的占比为30%),分别为4-7、9-12、17-26。通过如图1a~图1c所示的迈克尔(michael)加成反应合成一系列pbae:将双丙烯酸酯主链(b)单体与总侧链(s)单体按1.1:1的摩尔比混合(总侧链单体的30%为烷基链单体),其中b过量,以确保bs基聚合物为双丙烯酸酯端接。在90℃下搅拌不同时间,得到不同分子量的pbae。将得到的聚合物基溶解在四氢呋喃或二甲基亚砜(dmso)中,然后加入10倍当量的末端基团(e)分子,在室温下搅拌2小时。之后加入乙醚将所得到的聚合物从溶液中沉淀出来,用乙醚洗涤两次后真空干燥。将所得聚合物溶于cdcl3或d6-dmso中,用1h-nmr(bruker 400mhz)测量其分子量。
[0085]
实施例2不同pbae材料以不同处方比例制备的fnp在293t细胞上的转染效果
[0086]
1、制备包载egfp mrna的fnp纳米粒
[0087]
制备fnp,其包含pbae、dotap、chol、dope、dmg-peg以及核酸分子,具有60-160nm的平均直径以及3-20mv的表面电位。
[0088]
制备方法如下:将dotap、pbae、dope、chol和用无水乙醇按特定的摩尔比溶解成乙醇相,(dotap+pbae)/dope/chol/dmg-peg摩尔比固定为50/10/38.5/1.5。dotap与pbae的摩尔比根据pbae的类型不同,在2.5/1到40/1之间变化。水相为含有核酸的100mm柠檬酸缓冲液(ph=3)。dotap+pbae与mrna的质量比为20。两相以乙醇与水体积比1/1快速混合。24小时后于荧光显微镜下观察表达水平。
[0089]
2、mtt法研究fnp对293t细胞体外存活率的影响
[0090]
为了评估pbae体外转染效率,本发明选择293t细胞作为模型。pbae作为一种可质子化的阳离子材料,由于其结构不同,其最优配比与dotap不同。因此,为了确定最佳配比,将egfp-mrna包被不同dotap-pbae配比的fnp(dotap:pbae=2.5:1、5:1、10:1)中,转染完全培养基中的293t细胞。此后,确定了每种pbae最合适的dotap/pbae的比例,并将继续用于后续的体内和体外实验(图2)。
[0091]
对于体外细胞转染,将新鲜fnp直接稀释在dmem完全培养基中;在体内递送时,将制备的fnp在pbs溶液中用3500mwco透析膜进行透析,在4℃下2h。
[0092]
用mtt法研究fnp对293t细胞体外存活率的影响,在加入fnp纳米粒转染24h后(fnp纳米粒和细胞的相对用量为150ng mrna/孔;96孔板中细胞的接种密度为104个/ml),加入mtt(5mg/ml in pbs,20ul,beyotime)与细胞37℃孵育4h。孵育期结束后,移除细胞培养基,加入150μl dmso(solarbio),采用酶标仪(spectramax i3,md)在490nm波长下测量吸光度。细胞存活率(%)是用处理后的细胞与未处理的对照组细胞相比计算得出的。
[0093]
采如图3所示。这些pbae大多数都没有明显的细胞毒性。77.77%的pbae细胞活性大于80%。
[0094]
实施例3评估几种不同的pbae材料组成的fnp处方在小鼠体内转染荧光素酶mrna的转染效果的剂量依赖性
[0095]
为了进一步探究pbae的构效关系,本发明用荧光素酶(fluc)mrna转染293t细胞,量化荧光素酶活性,如图4所示,基本上egfp-mrna和fluc-mrna的转染趋势相同。根据结果分析,e1封端相较于e2封端具有更好的转染效果。聚合度越高,转染效果越好,碳链长度越接近16,转染效果越好。
[0096]
根据细胞的mrna转染结果,选取转染效果最好的前三种材料11c14e1 n=17.41,11c14e2 n=17.41,11c18e1 n=23.64,探究由pbae组成的fnp在体内是否存在剂量依赖性
(同实施例1,第一个1指的是back bone(b)的结构,即b1;第二个1指的是side chain(s)的结构,即s1;n为氢谱计算出的pbae聚合度。c14或者c18代表碳链烷基侧链的长度)。
[0097]
纳米粒制备方法与以上实施例相同,纳米粒制备完成后,将制备的fnp在pbs溶液中用3500mwco透析膜进行透析,在4℃下透析2h。之后经尾静脉注射进入小鼠体内,给药六小时后按150mg/kg的剂量腹腔注射30mg/ml的荧光素钾盐,并在注射后十分钟左右检测荧光素酶表达情况。
[0098]
如图5所示,这三种材料在0.15mg/kg到0.45mg/kg的fluc mrna范围内均具有肺特异性和剂量敏感性。随后对体内所有pbae的评估将以0.3mg/kg的剂量进行。
[0099]
选择荧光素酶活性(rlu/well)大于100,000和各种聚集程度11c10e1的pbae在体内进行筛选,如图6中a所示。从6中b中可以看出,4种最高效的pbae生物发光信号(11c16e2 n=24.11,11c18e1 n=23.64,11c16e1 n=11.85,11c14e2 n=17.41)均主要分布在肺中,其中最佳材料11c16e2 n=24.11的荧光效率最高可达108。除此之外,pbae的体内构效关系与体外基本一致。从聚合度的角度来看,11c10e1 n=5.13,11c10e1 n=9.66,11c10e1 n=20.58,随着聚合度的增加转染效率增大。对于不同的封端基团,在体内转染效率最高的前5个pbae中,有3/5的属于e1组。碳链长度方面,在n=9-12或17-26组中,比较11c10e1、11c12e1/11c14e1、11c16e1和11c18e1,得出碳链长度越接近16,转染效果越好的结论仍然适用。
[0100]
实施例4评估fnp处方在小鼠体内的毒性
[0101]
优良的配方不仅要求转染效率高,而且要具有良好的生物相容性。为此,接下来使用更高的mrna剂量(0.6mg/kg)评估了前5种pbae的体内毒性。
[0102]
将体重为15-20g的雄性c57bl/6小鼠随机分组,每组4只。将制备好的fnp制剂按荧光素酶mrna剂量0.6mg/kg经尾静脉给药。阳性对照组腹腔注射脂多糖(5mg/kg),阴性对照组静脉注射pbs。48h后采集全血,离心分离血清。对小鼠脏器(心、肝、脾、肺、肾)切片,进行h&e染色。然后用试剂盒检测肝脏(ast、alt)和肾脏(bun、crea)功能。
[0103]
有前5位pbae的fnp对肾功能和肝功能没有改变,如图7所示,图8显示组织组织学上无不良损伤迹象。上述结果表明,fnp具有良好的耐受性。
[0104]
实施例5
[0105]
制备了fnp纳米粒用于冷冻电镜成像,在用2%乙酸铀酰进行阴性染色后,用tecnai spirit透射电子显微镜(fei,hillsboro,or)对fnp进行成像。冷冻电镜结果显示(图9),由11c18e1 n=23.64组成的fnp,呈玫瑰状结构,粒径约为70nm。
[0106]
评估不同fnp对mrna的包封效率,使用了一种改进的quant-it ribogreen rna分析(invitrogen)试剂盒进行分析。
[0107]
采用上述实施例的方法制备不同pbae材料的fnp处方,制备完成后对fnp进行表征,将fnp在dpbs溶液中稀释40倍,使用nanozs zetasizer(malvern)测量其大小、多分散性(pdi)和zeta电位。
[0108]
如图10和11所示,最有效的几组pbae粒径最小,pdi最小,封装效率接近80%,四种效果最好的fnp均具有接近+5mv的表面zeta电位,既不过高也不过低。
[0109]
实施例6评估不同fnp的溶血情况
[0110]
选取体重为15-20g的雄性c57bl/6小鼠,取全血,通过离心(10000g,5min)分离血
细胞。之后使用ph7.4和ph5.0的pbs溶液分别重悬血细胞,向其中分别加入不同fnp材料,37℃孵育30min,10000g离心5min,取上清,测定其在540nm下的吸光值,以不加fnp纳米粒的组作为阴性对照,以triton x-100溶液(1wt.%)作为阳性对照。
[0111]
通过溶血试验评价fnp的破膜活性,如图12所示,转染效果好的pbae在ph5.0时表现出较高的溶血能力,表示在溶酶体酸性的环境下具有较高的逃逸能力。
[0112]
实施例7评估fnp在293t细胞中的摄取和逃逸情况
[0113]
293t细胞接种于8孔玻璃底板(cellvis,mountain view,ca,cat.c8-1.5h-n)。当细胞密度达到60-70%时,每孔加入375ng cy5标记mrna包被的fnp,4小时后用60倍油浸物镜在尼康共聚焦显微镜(ti-e+a1 r si)上成像。细胞核和溶酶体分别用dapi和lysotracker red dnd-99标记。
[0114]
利用lysotracker和cy5分别对溶酶体和mrna进行标记,通过imagej对单个细胞中的cy5信号的半定量分析确定mrna摄取情况,通过cy5和lysotracker的离散度半定量分析内体逃逸能力。
[0115]
使用imagej(fiji)进行细胞摄取分析。在图像中选取单个细胞所在的区域,通过计算该区域内cy5的荧光强度来表示单个细胞对fnp的摄取。使用imagej(fiji)的coloc 2插件进行共定位分析,通过计算远红(cy5-mrna)通道和红色(内体标记)的皮尔森相关系数来表示溶酶体逃逸情况。其中,皮尔斯相关系数越接近0,表示两通道相关性越低,也就表明溶酶体逃逸效率越高。
[0116]
如图13-15所示,细胞上以及体内转染效果好的fnp均具有很高的摄取效果,同时具有良好的溶酶体逃逸能力。
[0117]
实施例8从细胞转染能力随时间的变化来评价fnp纳米颗粒的稳定性
[0118]
fnp的制备与上述实施例相同,制备完成后加入蔗糖至终浓度为10%(w/v),在-80℃预冻之后使用冷冻干燥机(labconco,美国)冷冻干燥12小时至水分完全蒸发。冷冻干燥后的fnp置于4℃保存,在选定的时间点用原体积的ddh2o重新溶解。将含有150ng核酸的fnp与100ul dmem(high glucose)complete medium(10%fbs)混合,加入到80%-90%的密度的293t细胞中并替换为原培养基。24小时后测定荧光素酶表达情况。
[0119]
图16-17展示了对于c12-200以及dlin-mc3的传统处方在冻干复溶之后,其转染效果有明显下降,通过在c12-200和dlin-mc3的处方中加入50%的dotap而使其成为表面带正电的纳米粒可以在冻干后维持转染效果基本保持不变,而掺入50%18:pa的两种表面带负电的纳米粒经过冻干之后,其转染效果明显下降;单独的pbae处方是否可以通过促进核酸的包封而在冻干之后维持转染效果。这表明dotap以及pbae的加入都可以有效地增加纳米粒的冻干稳定性。
[0120]
图18展示了fnp纳米粒经冷冻干燥之后与4℃中长期保存,并在选定的时间点测定其细胞转染效果,在5个最佳的pbae中,前4个pbae的稳定性都较好,而第5个pbae的稳定性稍差,其转染细胞的能力随着时间的推移而下降。与冻干处理组相比,未经冻干直接在4℃保存的fnp转染效果下降迅速。
[0121]
此外,在选定的时间点使用zetasizer nano-zs(malvern,uk)动态光散射(dls)测量冻干后长期保存的fnp颗粒尺寸和多分散性指数(pdi)变化情况。每个样品的测量重复3次。
mix(vazyme cat。q711-02)进行qpcr检测。rt-qpcr引物为gapdh:5'-cgacttcaacagcaactcccactcttcc-3'(正向),引物为5'-tgggtggtccagggtttcttactcctt-3'(反向);egfp:5'-cgaccactaccagcagaaca-3'(正向),egfp引物为5'-tctcgttggggtctttgctc-3'(反向)。pbs组为阴性对照组,gapdh为内源性对照。
[0132]
图23a显示cy5荧光信号主要分布在肺内,仅有少量荧光信号散在肝、肾、脾(肺内荧光信号约为肝、肾、脾的2倍)。如图23b所示,rt-qpcr结果显示cy5-egfp mrna主要分布在肺内,远远高于其他器官(肺的荧光信号至少是肝、肾、脾的10倍以上)。上述两个实验结果显示mrna在肺和其他器官的分布比例不同,荧光成像结果显示egfp mrna上的cy5信号的一小部分是分布在肝脏,肾脏和脾脏,然而通过rt-qpcr测定各脏器mrna的含量却发现非肺脏器含量很低,这可能是因为降解代谢掉了。
[0133]
这在一定程度上解释了为什么纳米颗粒只在肺中特异性表达,但要真正了解其机制,还需要了解为什么这些纳米颗粒会在肺中特异性表达,以及是什么促进了这些纳米颗粒被肺吸收。
[0134]
实施例12对fnp所结合的蛋白冠组成进行分析并验证目标蛋白对肺原代细胞转染效果的促进作用
[0135]
传统的四组分lnp可以通过吸附血清中的apoe,并与肝细胞上的低密度脂蛋白受体(ldl-r)结合从而将功能性rna传递到肝细胞。因此我们猜测fnp也是通过结合血清中的蛋白实现的特异性肺内皮细胞靶向。
[0136]
将fnp与小鼠血清在37℃条件下孵育,模拟体内蛋白冠的形成,经离心分离结合蛋白冠后的fnp,将从fnp中分离出来的蛋白冠加入6倍体积的冷丙酮以去除脂质含量并沉淀出蛋白质。16000g 4℃离心15min,将所得蛋白混合物重悬于1m尿素/50mm nh4hco3中,加入1m dtt使最终dtt浓度为5mm,37℃孵育1h。然后加入500mm iam,使最终iam浓度为10mm,室温孵育45min。加入胰蛋白酶消化蛋白质。所得的多肽混合物被重新悬浮在0.1%的甲酸中,并用q exactive hf(thermofisher)分析。
[0137]
通过蛋白质组学分析形成蛋白冠的组成,如图24a所示。与对照dlin-mc3组成的纳米粒处方相比,玻连蛋白是fnp中最富含的血浆蛋白。与apoe相比,玻连蛋白的不同功能可能在形成fnp的肺靶识别中发挥作用。玻连蛋白促进多种细胞类型的细胞附着、扩散和迁移。至少有四种已知的整合素受体能够识别玻连蛋白:包括αvβ3,αvβ5,αvβ1和αⅱb
β3。整合素αvβ3是一种主要的玻连蛋白受体,可以与血浆中的玻连蛋白结合。事实上,整合素αvβ3在很多细胞中都存在,比如内皮细胞,软骨细胞,成纤维细胞,母细胞。αvβ1分布在有限的细胞类型中,如成纤维细胞和某些肿瘤细胞系。αvβ5在成纤维细胞和肿瘤中也有分布。而αⅱb
β3主要分布在血小板和巨核细胞中,需要活化才能与玻连蛋白结合。纳米粒子通过小鼠尾静脉注射后,将经过体循环返回心脏,之后迅速进入肺循环,交换气体肺泡周围的肺泡毛细血管网络,然后注入到左心房、左心室通过各级肺静脉,最后流经主动脉和由其产生的动脉的几个分支,将血液输送到相应的器官进行物质交换。
[0138]
因此结合上述两个主要方面,我们设想fnp一旦进入血液,就会吸附玻连蛋白,迅速通过心脏进行肺循环,并与肺内皮细胞高表达的αvβ3受体相互作用。因此,大部分的纳米颗粒会在肺中被截取,从而大大减少了纳米颗粒在肝、肾部分的分布。
[0139]
为验证假设,将包载了egfp mrna的fnp和不同剂量的玻连蛋白进行孵育分别转染
αvβ3受体阳性的u87细胞系,小鼠肺原代微血管内皮细胞,以及αvβ3受体阴性的hepg2细胞系,如图24b,24c所示。在αvβ3受体阳性的u87细胞系和小鼠肺原代微血管内皮细胞中,随着玻连蛋白的增加,转染效率均有显著提高。而在αvβ3受体阴性的hepg2细胞系中,随着玻连蛋白的增加,转染效率无明显增加。此说明αvβ3受体在介导玻连蛋白富集的fnp的细胞转染上是起着关键性影响的因素。除此之外,我们将fnp和不同剂量的牛血清白蛋白进行孵育转染αvβ3受体阳性的u87细胞系,随着牛血清白蛋白的增加,转染效率无明显增加。此说明玻连蛋白在fnp介导的αvβ3受体阳性细胞的转染中同样起着关键性的作用。
[0140]
综上所述,fnp进入体内后,迅速富集血液中的玻连蛋白,通过和肺部αvβ3受体相互作用,介导了肺部特异性转染。
[0141]
实施例13评估fnp包载pdna后的性质
[0142]
测试了fnp包载pdna的效果,fnp处方的制备方法与包封mrna时相同。
[0143]
使用zetasizer nano-zs(malvern,uk)动态光散射(dls)测量冻干后长期保存的fnp颗粒尺寸和多分散性指数(pdi)变化情况。每个样品的测量重复3次;通过琼脂糖凝胶电泳,分析fnp包载pdna的包封情况。
[0144]
使用动态光散射(dls)测量fnp-pdna的粒径、pdi和zeta电位,图26a表明fnp对于包封pdna和mrna在纳米粒粒径以及电位上没有明显差异。图26b琼脂糖凝胶电泳结果表明,fnp能有效包封pdna。
[0145]
评估了fnp处方在小鼠体内转染荧光素酶pdna的转染效果。纳米粒制备方法与第三个实施例中相同。之后经尾静脉注射进入小鼠体内,给药六小时后按150mg/kg的剂量腹腔注射30mg/ml的荧光素钾盐,并在注射后十分钟左右检测荧光素酶表达情况。
[0146]
最后验证了fnp处方在小鼠体内转染荧光素酶pdna的转染效果。图27表明在0.3mg/kg的质粒剂量下,可以有效地实肺部特异性荧光素酶的表达。
[0147]
实施例14评估不同pbae材料以不同处方比例制备的fnp在293t细胞上的转染效果
[0148]
制备了包载egfp pdna的fnp纳米粒,fnp是以(dotap+pbae)/dope/chol/dmg-peg摩尔比固定为50/10/38.5/1.5在乙醇中,与含有核酸的水相(100mm柠檬酸钠缓冲溶液)以体积比1:1快速混合制备的。制备好的纳米粒直接加入到完全dmem培养基中转染细胞,24小时后与荧光显微镜下观察表达水平。dotap与pbae的摩尔比根据pbae的类型不同,在5/1到20/1之间变化,根据转染效率选取每个pbae材料的最佳配比。
[0149]
对于体外细胞转染,将新鲜fnp直接稀释在dmem完全培养基中;在体内递送时,将制备的fnp在pbs溶液中用3500mwco透析膜进行透析,在4℃下2h。图25展示了不同pbae材料在不同的配比条件下在293t细胞上的转染效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1