一种提高CAR-T细胞抗肿瘤效果的方法
一种提高car-t细胞抗肿瘤效果的方法
技术领域
1.本发明涉及免疫学技术领域,尤其涉及一种提高car-t细胞抗肿瘤效果的方法。
背景技术:
2.重氮氧代正亮氨酸(don)是一种从链霉菌中分离出来的非蛋白质氨基酸。在分子结构上,don是由一个碱化基团取代谷氨酰胺侧链氨基形成的重氮酮化合物,是一种谷氨酰胺类似物。don能够不可逆地抑制一系列谷氨酰胺相关酶活性,阻断谷氨酰胺代谢,具有止痛、抗菌、抗病毒以及抗肿瘤的作用。谷氨酰胺是细胞代谢中重要的氮源和碳源,参与糖酵解、三羧酸循环、氧化磷酸化等代谢途径。研究表明,阻断谷氨酰胺代谢能够抑制肿瘤细胞的增殖,控制肿瘤生长。2019年,发表在science上题为“阻断谷氨酰胺诱导不同代谢程序从而抵抗肿瘤免疫逃逸”的文章揭示了t细胞与肿瘤细胞于阻断谷氨酰胺后在能量供应及代谢途径中的差异。
3.嵌合抗原受体t细胞(car-t)疗法在血液肿瘤,如复发或难治性b细胞急性淋巴细胞白血病以及非霍奇金淋巴瘤治疗领域展现出较好的临床治疗效果。
技术实现要素:
4.为了解决现有技术存在的问题,本发明提供一种提高car-t细胞抗肿瘤效果的方法,通过重氮氧代正亮氨酸处理car-t细胞可以有效提高car
+
t细胞中tn(cd45ra
+
ccr7
+
)和t
cm
(cd45ra-ccr7
+
)亚群的比例,进而提高其杀伤肿瘤细胞的能力。
5.本发明所称重氮氧代正亮氨酸为6-重氮-5-氧代-l-正亮氨酸(don)。
6.本发明研究发现t细胞的分化状态很大程度上决定了其持久性,相较于分化程度更高的效应t细胞(teff)和效应记忆t细胞(tem),处于低分化状态的初始t细胞(tn)和中枢记忆t细胞(tcm)具有更强的生存能力和抗肿瘤功能。t细胞在免疫应答中的分化过程伴随着代谢途径的改变,因此,本发明通过改变细胞体外培养环境,采用don对其处理,干预t细胞的代谢过程,能够改变其分化状态,获得更多低分化的t细胞,进而延长car-t细胞回输体内后的存活时间,有利于增强car-t细胞的抗肿瘤效果,为肿瘤患者带来福音。
7.第一方面,本发明提供一种提高car-t细胞抗肿瘤效果的方法,包括:
8.采用重氮氧代正亮氨酸处理car-t细胞。
9.进一步地,所述重氮氧代正亮氨酸的浓度为1~10μmol/l。
10.进一步地,所述采用重氮氧代正亮氨酸处理car-t细胞为:
11.在制备car-t细胞的过程中的培养基中加入1~10μmol/l的重氮氧代正亮氨酸。
12.进一步地,所述方法包括:
13.采用包含有car核苷酸序列的慢病毒在t细胞培养基中感染t细胞;
14.所述t细胞培养基中含有2.5~5μmol/l的重氮氧代正亮氨酸。
15.进一步地,所述慢病毒的moi为(5~15):1。
16.进一步地,所述t细胞培养基还包括:okt3和cd28抗体。
17.进一步地,所述t细胞培养基可以采用本领域常规的用于制备car-t细胞的t细胞培养基,其中为了激活t细胞,均含有okt3和cd28抗体,例如包括:x-vivo 15无血清培养基、il2、il-7、il-15、okt3抗体和cd28抗体。
18.更进一步地,所述t细胞培养基以x-vivo 15无血清培养基为基础,还包括il2 10~100u/ml、il-7 1~20ng/ml、il-151~20ng/ml、okt3抗体10~100ng/ml和cd28抗体0.1~10μg/ml。
19.作为一种优选的具体实施方式,本发明提供一种提高car-t细胞抗肿瘤效果的方法,包括:
20.(1)构建携带靶向肿瘤细胞的car核苷酸序列的慢病毒载体;
21.(2)将所述慢病毒载体转染293ft细胞制备得到携带靶向肿瘤细胞的car核苷酸序列的慢病毒;
22.(3)采用所述慢病毒于t细胞培养基中感染t细胞48~96小时,moi=(5~15):1。
23.所述t细胞培养基以x-vivo 15无血清培养基为基础,还包括il210~100u/ml、il-7 1~20ng/ml、il-151~20ng/ml、okt3抗体10~100ng/ml和cd28抗体0.1~10μg/ml。
24.本发明进一步提供重氮氧代正亮氨酸在促进t细胞分化为低分化t细胞中的应用。
25.进一步地,所述低分化t细胞包括:初始t细胞和/或中枢记忆t细胞。
26.本发明进一步提供重氮氧代正亮氨酸在提高car-t细胞制备效率中的应用。
27.本发明进一步提供重氮氧代正亮氨酸在这制备用于提高car-t细胞的肿瘤杀伤效率的药物中的应用。
28.本发明具备如下有益效果:
29.现有技术中,常规制备car-t细胞的过程中一般都需要cd3和cd28抗体的刺激,使得获得的car-t细胞中t
em
和t
eff
比例较高,本发明发现在体外培养的培养基中加入don可以提高获得的car-t细胞中tn和t
cm
的比例,进而增强其体内持久性,从而提高其杀伤肿瘤细胞的能力,因此don体外处理的car-t具有更好的治疗效果。
附图说明
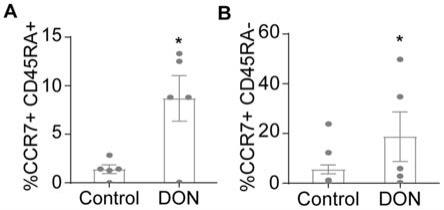
30.图1为本发明实施例1提供的don处理组和对照组中tn(cd45ra
+
ccr7
+
)和t
cm
(cd45ra-ccr7
+
)亚群的统计结果示意图;其中a为tn亚群的统计结果,b为t
cm
亚群的统计结果。
31.图2为本发明实施例2提供的don对于car-t细胞的影响的统计结果示意图;其中a为感染72小时后,car-t细胞所占比例示意图,b为感染72小时后tn(cd45ra
+
ccr7
+
)亚群所占比例,c为感染72小时后,t
cm
(cd45ra-ccr7
+
)亚群所占比例示意图。
32.图3为本发明实施例2提供的针对raji细胞,在不同效靶比的情况下,don处理组和未经don处理组的car-t细胞分泌的ifn-γ蛋白表达量对比示意图。
33.图4位本发明实施例2提供的针对raji细胞,在不同效靶比的情况下,don处理组和未经don处理组的car-t细胞特异性识别并杀伤靶细胞能力对比示意图。
34.图5为本发明实施例2提供的针对淋巴瘤小鼠模型,don处理组和未经don处理组的识别和杀伤靶细胞功能对比示意图。
35.图6为本发明实施例2提供的针对肿瘤复发的情况下,don处理组和未经don处理组
抵抗肿瘤复发的功能对比示意图。
具体实施方式
36.以下实施例用于说明本发明,但不用来限制本发明的范围。
37.若未特别指明,以下实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrook j&russell dw,molecular cloning:alaboratory manual,2001),或按照制造厂商说明书建议的条件。
38.慢病毒包装质粒(pmdl,vsv-g,rev)、载体pcdh-ef1-luc2-t2a-tdtomato质粒购自武汉淼灵生物科技有限公司。xbai和sali内切酶购自new england biolabs(beijing)ltd.。pei购自sigma公司。cd19-fc融合蛋白购自acro biosystems有限公司。x-vivo15培养基购自lonza公司。il-2,il-7,il-15细胞因子购自peprotech公司。okt3购自acro biosystems有限公司。cd28抗体购自同立海源公司。293ft细胞、raji细胞购自atcc。raji-luciferase细胞购自苏州东岭生物技术有限公司。cd45ra,ccr7,cfse,pi等流式抗体购自bd公司。nog免疫缺陷小鼠购自北京维通利华实验动物技术有限公司。
39.实施例1
40.本实施例验证don对于t细胞分化的影响,具体流程如下:
41.1、pbmc培养
42.无菌收集肿瘤患者外周静脉血,用ficoll-paque plus(ge,usa)淋巴细胞分离液进行密度梯度离心,分离得到外周血单个核细胞(pbmc),加入t细胞培养基进行培养。
43.t细胞培养基包含:x-vivo 15无血清培养基(lonza,usa)以及il2(50u/ml;peprotech,usa),il-7(10ng/ml;peprotech,usa),il-15(10ng/ml,peprotech,usa),okt3 antibody(50ng/ml;acro,usa)and anti-cd28 antibody(1μg/ml;t&l biotechnology,china).。
44.2、don处理的pbmc分化情况
45.将分离得到的pbmc分成两组:
46.对照组(control)经t细胞培养基培养7天;
47.don处理组经含don(2.5μm)(sigma-aldrich,usa)的t细胞培养基培养7天。
48.本发明通过流式抗体对两组pbmc进行染色并进行数据分析,数据分写结果显示don处理组组pbmc的tn(cd45ra
+
ccr7
+
)和t
cm
(cd45ra-ccr7
+
)亚群的比例显著增高(图1中的a和b),即低分化的t细胞占比显著增多。
49.实施例2
50.本实施例验证don对于car-t细胞的影响,具体流程如下:
51.1、靶向cd19的car-t细胞的慢病毒载体的构建
52.(1)参照专利(us 10,633,442b2)合成靶向cd19的car核苷酸序列,并在这段核苷酸序列的两端分别添加xbai和noti酶切位点,并克隆到puc57载体上;
53.(2)用xbai和noti双酶切包含目的基因的puc57载体,切胶回收目的基因片段;
54.(3)用xbai和noti双酶切原始载体pcdh-ef1-mcs-t2a-puro,切胶回收约6.5kb的载体片段;
55.(4)用dna连接酶连接回收的目的基因片段和载体片段,即得携带cd19 car的重组
慢病毒载体。
56.2、cd19 car慢病毒的制备
57.将步骤1得到的重组慢病毒载体通过转染试剂(pei)转染293ft细胞产生慢病毒。具体方法包括:
58.包装质粒混合物(pmdl:vsv-g:rev=5:3:2,质量比)和cd19 car慢病毒载体按1:1的质量比加入500μl无血清培养基opti-mem中,涡旋至充分混匀。将32g pei加入500μl无血清培养基opti-mem中,涡旋至充分混匀。然后将500μl质粒混合物与500μl pei混合,并将其加入汇合度约90%的293ft细胞中,48小时后收集病毒上清,超速离心后,对病毒进行100倍浓缩,进而获得浓缩后病毒。
59.3、cd19 car-t细胞的制备
60.分离外周血t细胞,在t细胞培养基中培养,用浓缩后病毒感染激活的t细胞,moi=10:1(t细胞培养基成分中的okt3和cd28抗体能激活t细胞)。感染的同时,分为两组:
61.don处理组(dcar-t)在t细胞培养基中加入don(2.5μm);
62.未经don处理组(car-t)不加don。
63.本发明以fitc偶联的cd19-fc融合蛋白检测cd19 car表达,结果显示:感染72小时之后,dcar-t组cd19 car感染效率显著高于car-t组(图2中的a)。同时,dcar-t组的tn(cd45ra
+
ccr7
+
)和t
cm
(cd45ra-ccr7
+
)亚群的比例明显增高(图2中的b和c)。
64.4、cd19 car-t细胞体内外功能鉴定
65.将步骤3中的dcar-t组和car-t组细胞分别与5x104个burkitt's淋巴瘤细胞(raji细胞)以2:1的效靶比共孵育24小时之后检测上清ifn-γ浓度。结果表明,don处理的car-t细胞分泌的ifn-γ高于未处理组(图3)。
66.将步骤3中的dcar-t组和car-t组细胞分别与cfse预标记的raji细胞以1:20,1:10,1:5,1:2,1:1,2:1的效靶比共孵育,流式鉴定cfse标记的靶细胞中细胞死亡比例(pi+靶细胞百分比)。结果显示,降低效靶比时,don处理的car-t细胞特异性识别并杀伤靶细胞功能显著高于未经don处理的car-t细胞(图4)。
67.将步骤3中的dcar-t组和car-t组细胞(1x106)回输raji-luciferase细胞株构建的淋巴瘤小鼠模型,结果显示,don处理的car-t细胞体内杀伤对应肿瘤细胞能力显著强于未经don处理的car-t细胞(图5)。对肿瘤完全消退的小鼠二次注射raji-luciferase细胞模拟肿瘤复发,结果显示,don处理的car-t细胞抵抗肿瘤复发的能力显著强于未经don处理的car-t细胞(图6),即don处理的car-t细胞在体内扩增能力更强,持久性更好。
68.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1