4-氨基喹啉类化合物及其制备方法和在抗肿瘤药物中的应用
1.本发明涉及有机化学合成领域,具体涉及一种4-氨基喹啉类化合物及其制备方法和在抗肿瘤药物中的应用。
背景技术:
2.4-氨基喹啉是一类重要的结构单元,存在于许多活性药物中,4-氨基喹啉类化合物在抗疟疾、抗病毒和抗真菌感染等方面的活性被广泛地报道,如羟氯喹iv作为一种毒性较小的氯喹衍生物,在体外能有效地抑制严重急性呼吸系统综合症冠状病毒2(sars-cov-2)的感染,目前被用于治疗covid-19患者(cell discov.2020,6,16);他克林-8-羟基喹啉复合物具有神经保护、胆碱激导、抗氧化和与铜络合的作用,是治疗阿尔茨海默病的一类多功能药物(j.med.chem.2010,53,4927)。另外,4-氨基喹啉通过化学转化衍生得到的产物同样具有重要的生物活性,如4-氨基喹啉衍生物磺胺能够增强植物的非生物胁迫耐性(us 20170027172 a1)。总之,4-氨基喹啉及其衍生物一系列重要活性的发现使其成为医药研发的创新之源。因此,对4-氨基喹啉类化合物进行合成方法的研究具有重要的意义。关于4-氨基喹啉类化合物的合成,早期文献报道大多是在喹啉核上进行一定程度的官能团化,如通过喹啉-4-苯肼的还原(j.am.chem.soc.1946,68,1250)、2,3-二甲基喹啉-4-羧酰胺在次溴酸盐作用下氧化(j.chem.soc.1945,18)、或者4-卤喹啉与胺发生亲核取代反应(tetrahedron 2007,63,12791)制备得到。在这些方法中,buchwald-hartwig胺化法被证明是合成4-氨基喹啉非常简便的方法(eur.j.org.chem.2011,302),然而该方法所使用的原料4-卤喹啉有些是商业上买不到的。为了克服这个缺点,近些年来金属催化环化法为该类化合物的构建提供了新途径,但由于大多数方法使用过渡金属,导致有毒金属废物的产生,不符合环境友好与可持续发展的要求,而且有的催化剂比较昂贵,反应条件也比较苛刻,因此,发展新颖、高效、绿色的方法构建4-氨基喹啉类化合物仍然是目前的迫切需求。
技术实现要素:
3.为了克服上述技术缺陷,本发明目的在于提供一种新的4-氨基喹啉类化合物及其制备方法和在抗肿瘤药物中的应用。
4.为实现本发明目的,本发明采用氮端连有芳基的炔酰胺在非金属催化下发生自身环合,然后环合产物脱除保护基得到新型4-氨基喹啉类化合物4。
5.具体技术方案如下:
6.本发明所述4-氨基喹啉类化合物,其结构通式为:
[0007][0008]
其中,r选自氢,烷基,烷氧基,卤素,硝基;r1选自氢,烷基,芳基。
[0009]
优选:r选自c1-3烷基,c1-3烷氧基或卤素,在苯环上单取代或双取代;r1选自氢,c1-6烷基。
[0010]
所述4-氨基喹啉类化合物的合成路线如下:
[0011][0012]
具体合成步骤如下:
[0013]
1)氮气保护下,向干燥的反应管中依次加入炔酰胺1或1'、二氯甲烷和离心管中混合好的三氟甲磺酸三甲基硅酯和三氟甲磺酸,封闭反应管,搅拌反应;薄层色谱法监测反应进程,待反应完成后,抽滤,减压蒸馏除去溶剂,所得粗产物经柱层析分离得到4-氨基喹啉类化合物2或3。
[0014]
2)氮气保护下,向干燥的反应管中依次加入金属钠、萘和无水四氢呋喃,室温搅拌;将4-氨基喹啉类化合物2或3溶于无水四氢呋喃,缓慢加入反应体系,封闭反应管,升温搅拌反应;薄层色谱法监测反应进程,待反应完成后,加水淬灭,抽滤,减压蒸馏除去溶剂,所得粗产物经柱层析分离得到4-氨基喹啉类化合物4。
[0015]
所述步骤中当r1为氢时,得到4-氨基喹啉类化合物2;当r1为烷基时,得到4-氨基喹啉类化合物3;炔酰胺1或1'、三氟甲磺酸三甲基硅酯和三氟甲磺酸的摩尔比为5:3:1;4-氨基喹啉类化合物2或3、金属钠和萘的摩尔比为1:10:12.5。
[0016]
进一步地,在上述技术方案中,所述原料炔酰胺1或1'的合成路线如下:
[0017][0018]
具体合成步骤如下:
[0019]
1)将磺酰胺5和碳酸铯置于反应瓶中,进行氮气保护,加入无水n,n-二甲基甲酰胺,室温下搅拌;将tms-ebx碘代物6溶于无水二氯甲烷,在避光且冰浴的条件下将其加入反应体系,升至室温,搅拌至反应完全,砂芯漏斗铺硅胶抽滤,减压蒸馏除去溶剂后直接硅胶柱层析分离得炔酰胺1。
[0020]
2)将炔酰胺1置于反应瓶中,进行氮气保护,加入无水四氢呋喃进行溶解,在
–
73℃~
–
78℃条件下缓慢滴入双(三甲硅基)氨基锂,搅拌并缓慢升至
–
60℃~
–
65℃,在
–
60℃~
–
65℃下缓慢滴入碘代烷化合物,升至室温搅拌;薄层色谱法监测反应进程,待反应完成后,加水淬灭,乙酸乙酯萃取,合并有机相,经干燥,过滤,减压蒸馏除去溶剂,所得粗产物经硅胶柱层析分离得到原料炔酰胺1'。
[0021]
所述步骤中磺酰胺5、碳酸铯和tms-ebx碘代物6的摩尔比为1:1.3:1.5;二氯甲烷和n,n-二甲基甲酰胺溶剂体积比为2.5:1;炔酰胺1、双(三甲硅基)氨基锂和碘代烷烃或碘代苯的摩尔比为1:1.5:2。
[0022]
进一步地,在上述技术方案中,所述tms-ebx碘代物6的合成路线如下:
[0023][0024]
具体合成步骤如下:
[0025]
1)将邻碘苯甲酸7和高碘酸钠置于反应瓶中,加入冰醋酸(含质量百分比30%)的水溶液,回流至反应完全,避光下加入冰水冷却至室温,滤出固体,经冰水和冰丙酮洗涤,得到1-羟基-1,2-苯并三唑-3-酮化合物8。
[0026]
2)将1-羟基-1,2-苯并三唑-3-酮化合物8溶于二氯甲烷,进行氮气保护,0℃下缓慢加入三氟甲磺酸三甲基硅酯,升至室温搅拌;再加入双(三甲基甲硅烷基)乙炔,室温搅拌至反应完全;经萃取,合并有机相,经干燥,减压蒸馏除去溶剂,得到tms-ebx碘代物6。
[0027]
所述步骤中邻碘苯甲酸7和高碘酸钠的摩尔比为1:1.05;1-羟基-1,2-苯并三唑-3-酮化合物8、三氟甲磺酸三甲基硅酯和双(三甲基甲硅烷基)乙炔的摩尔比为1:1.5:1.1。
[0028]
进一步地,在上述技术方案中,所述4-氨基喹啉类化合物在抗肿瘤药物中的应用,4-氨基喹啉类化合物显示出抑制5637、hela、sw480、hep g2、a549和mcf-7的细胞活性,可将其应用于治疗膀胱癌、胶质母细胞瘤、恶性黑色素瘤、子宫颈癌、结肠癌、宫颈癌、胰腺癌、肝癌、肺癌和乳腺癌的研究。
[0029]
与现有技术相比,本发明提供的4-氨基喹啉类化合物,具有如下优势:1、这些化合物具有抑制人膀胱癌细胞5637、人胶质母细胞瘤细胞a172、人恶性黑色素瘤细胞a375、人子宫颈癌细胞c33a、人结肠癌细胞hct 116和sw480、人宫颈癌细胞hela、人胰腺癌细胞cfpac-1、人肝癌细胞hep g2、人肺癌细胞a549和人乳腺癌细胞mcf-7的活性,将其应用于抗肿瘤药物的研究,具有良好的应用前景。2、本发明合成方法在非金属条件下进行,后处理简单,对环境友好,原料易得,底物普适性广。3、反应路径短,产物收率高,达80%
–
97%,能够快速实现一系列多取代的4-氨基喹啉类化合物的高效合成。
具体实施方式
[0030]
下面通过具体实施方式,对本发明的技术方案做进一步的详细描述,但本发明的保护范围并不局限于此。若未特别指明,以下实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
[0031]
主要仪器与化学试剂
[0032]
核磁共振波谱仪:bruker ascend
tm 400;高分辨质谱仪:bruker microtof-q ii质谱仪;红外光谱仪:知微smart傅立叶变换红外光谱仪(天津港东科技股份有限公司);三用
紫外线分析仪:zf-6型(上海高鹏科技有限公司);测定用熔点仪:xt4a显微熔点测定仪(北京科仪电光仪器厂)。
[0033]
本发明实施过程中所用的原料、溶剂均为商业途径购进。
[0034]
实施例1:tms-ebx碘代物6的合成
[0035][0036]
tms-ebx碘代物6具体合成步骤如下:
[0037]
1)将邻碘苯甲酸7(7.44g,30mmol)和高碘酸钠(6.74g,31.5mmol)溶于体积比为30%的冰醋酸水溶液(50ml)中,回流4.0h至反应完全,向反应体系中加入冰水(30ml),避光的条件下,冷却至室温,过滤出白色固体,并用冰水(60ml)和冰丙酮(60ml)洗涤,在避光下室温干燥,得到1-羟基-1,2-苯并三唑-3-酮化合物8(7.13g,27mmol),产率为90%。
[0038]
2)在氮气保护下,将1-羟基-1,2-苯并三唑-3-酮8(5.28g,20mmol)置于圆底烧瓶中,加入二氯甲烷(30ml),0℃下缓慢加入三氟甲磺酸三甲基硅酯(5.44ml,30mmol),升至室温搅拌0.5h;再加入双(三甲基甲硅烷基)乙炔(4.99ml,22mmol),室温搅拌6.0h至反应完全;向反应体系加入饱和碳酸氢钠至溶液呈澄清状态,加入二氯甲烷萃取,合并有机相,无水硫酸钠干燥,减压蒸馏除去溶剂,得到tms-ebx碘代物6(6.81g,19.8mmol),产率为99%。
[0039]
实施例2:原料炔酰胺1和1'的合成
[0040][0041]
以炔酰胺1'a具体合成步骤为例,具体合成步骤如下:
[0042]
1)在氮气保护下,向25ml圆底烧瓶中依次加入磺酰胺5a(130.7mg,0.50mmol),碳酸铯(211.8mg,0.65mmol),再加入干燥过的n,n-二甲基甲酰胺(1.0ml),室温搅拌0.5h;将tms-ebx碘代物6(258.2mg,0.75mmol)溶于二氯甲烷(2.5ml),在避光且冰水浴的条件下缓慢加入反应体系,升至室温搅拌0.5h;薄层色谱法监测反应进程,待反应完成后,砂芯漏斗铺硅胶抽滤,减压蒸馏除去溶剂,所得粗产物以石油醚/乙酸乙酯(10:1~5:1)为洗脱剂,经硅胶柱层析分离得到白色固体产物1a(128.8mg,0.451mmol),产率为90%。
[0043]
将对应的磺酰胺5b、5c、5d和5e按本实施例中上述方法步骤1分别制备炔酰胺1b、1c、1d和1e。
[0044]
2)在氮气保护下,向50ml圆底烧瓶中加入炔酰胺1a(956.0mg,3.35mmol),加入无水四氢呋喃(20.0ml)进行溶解,在
–
78℃下缓慢滴入双(三甲硅基)氨基锂(5.02ml,1.0m四氢呋喃溶液),缓慢升至
–
60℃再搅拌1.0h,在
–
60℃下缓慢滴入碘甲烷(417.3μl,6.70mmol),升至室温搅拌12h;薄层色谱法监测反应进程,待反应完成后,加水淬灭,乙酸乙酯萃取(3
×
10.0ml),合并有机相,无水硫酸钠干燥,抽滤,减压蒸馏除去溶剂,所得粗产物以石油醚/二氯甲烷(5:1~2:1)为洗脱剂,经硅胶柱层析分离得到白色固体产物1'a(802.4mg,2.68mmol),产率为80%。
[0045]
按上述方法制备炔酰胺1b和1c按本实施例中上述方法步骤2分别制备炔酰胺1'b和1'c。(ts代表对甲基苯磺酰基)。
[0046][0047]
化合物1a:白色固体,90%产率,1h nmr(400mhz,cdcl3)δ7.59(dt,j=8.6hz,2.2hz,2h),7.30-7.28(m,2h),7.11(s,4h),2.81(s,1h),2.45(s,3h),2.34(s,3h);
13
c nmr(100mhz,cdcl3)δ145.2,138.8,135.8,133.1,129.9,129.7,128.4,126.4,76.9,58.7,21.9,21.3.
[0048][0049]
化合物1b:白色固体,99%产率,1h nmr(400mhz,cdcl3)δ7.59(dt,j=8.6hz,2.2hz,2h),7.29(d,j=12.0hz,2h),7.12(dt,j=10.3hz,3.5hz,2h),6.82(dt,j=10.3hz,3.5hz,2h),3.80(s,3h),2.80(s,1h),2.45(s,3h);
13
c nmr(100mhz,cdcl3)δ159.7,145.2,133.0,131.0,129.7,128.5,128.1,114.4,77.1,58.4,55.7,21.9.
[0050][0051]
化合物1c:白色固体,93%产率,1h nmr(400mhz,cdcl3)δ7.60(dt,j=8.6hz,2.2hz,2h),7.30-7.28(m,2h),7.22-7.18(m,1h),7.14-7.08(m,2h),7.02-6.99(m,1h),2.82(s,1h),2.45(s,3h),2.32(s,3h);
13
c nmr(100mhz,cdcl3)δ145.2,139.4,138.3,133.2,129.7,129.4,129.0,128.5,127.2,123.4,76.8,58.9,21.9,21.4.
[0052][0053]
化合物1d:白色固体,91%产率,1h nmr(400mhz,cdcl3)δ7.61(d,j=8.4hz,2h),7.29(d,j=8.0hz,2h),7.23-7.19(m,1h),6.87-6.81(m,3h),3.76(s,3h),2.84(s,1h),2.44(s,3h);
13
c nmr(100mhz,cdcl3)δ160.1,145.3,139.4,133.1,129.9,129.7,128.4,118.4,114.5,112.0,76.9,59.3,55.6,21.9.
[0054]
[0055]
化合物1e:白色固体,86%产率,1h nmr(400mhz,cdcl3)δ7.62(dt,j=8.7hz,2.1hz,2h),7.30(d,j=8.1hz,2h),6.95(s,1h),6.85(s,2h),2.81(s,1h),2.45(s,3h),2.27(s,6h);
13
cnmr(100mhz,cdcl3)δ145.1,139.1,138.2,133.3,130.4,129.6,128.5,124.2,77.0,58.8,21.9,21.3.
[0056][0057]
化合物1'a:白色固体,80%产率,1h nmr(400mhz,cdcl3)δ7.56(d,j=8.3hz,2h),7.27(d,j=7.2hz,2h),7.10(s,4h),2.43(s,3h),2.33(s,3h),1.91(s,3h);
13
c nmr(100mhz,cdcl3)δ144.7,138.3,136.8,133.3,129.7,129.5,128.3,126.3,73.1,65.4,21.8,21.2,3.5.
[0058][0059]
化合物1'b:白色固体,87%产率,1h nmr(400mhz,cdcl3)δ7.56(d,j=8.2hz,2h),7.28(d,j=9.3hz,2h),7.11(dt,j=10.0hz,3.2hz,2h),6.81(dt,j=10.3hz,3.3hz,2h),3.79(s,3h),2.44(s,3h),1.91(s,3h);
13
c nmr(100mhz,cdcl3)δ159.4,144.7,133.2,132.1,129.5,128.4,128.1,114.3,73.3,65.2,55.6,21.9,3.5.
[0060][0061]
化合物1'c:白色固体,85%产率,1h nmr(400mhz,cdcl3)δ7.57(dt,j=8.8hz,2.4hz,2h),7.27(d,j=7.6hz,2h),7.18(t,j=7.7hz,1h),7.10-7.08(m,2h),7.02-6.99(m,1h),2.44(s,3h),2.31(s,3h),1.92(s,3h);
13
c nmr(100mhz,cdcl3)δ144.7,139.3,139.2,133.4,129.5,129.0,128.9,128.4,127.1,123.3,73.0,65.7,21.9,21.5,3.6.
[0062]
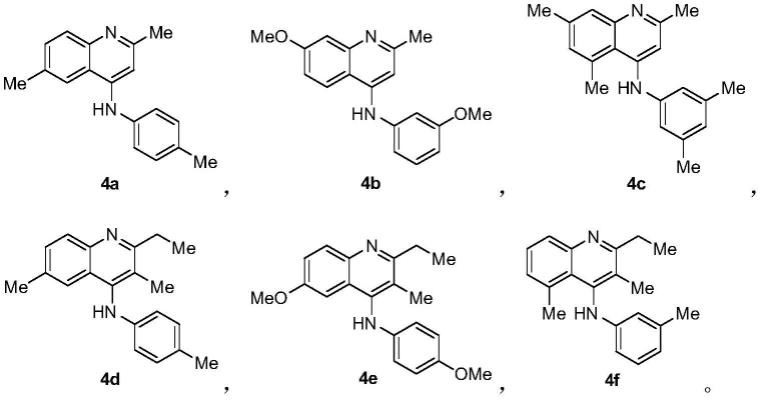
实施例3:4-氨基喹啉类化合物4a-4f的合成
[0063]
3.1 4-氨基喹啉类化合物4a-4e的合成
[0064][0065]
以化合物4a具体合成步骤为例,具体合成步骤如下:
[0066]
1)氮气保护下,向干燥的反应管中依次加入炔酰胺1a(114.1mg,0.40mmol)和二氯甲烷(1.0ml),将三氟甲磺酸三甲基硅酯(43.5μl,0.24mmol)和三氟甲磺酸(7.1μl,0.08mmol)于离心管中混合均匀,再缓慢加入反应体系,封闭反应管,30℃下搅拌0.5h;薄层色谱法监测反应进程,待反应完成后,过硅胶抽滤,减压蒸馏除去溶剂,所得粗产物以石油醚/乙酸乙酯(5:1~2:1)为洗脱剂,经中性氧化铝柱层析分离得到4-氨基喹啉类化合物2a(107.3mg,0.125mmol),产率为94%。
[0067]
将对应的炔酰胺1d、1e、1'a和1'b按本实施例中上述方法步骤1分别制备得到4-氨基喹啉类化合物2b、2c、3a和3b。其中化合物2c、3a和3b具有阻转异构体,比例分别为2:1、1:1和1:1。
[0068]
2)氮气保护下,向干燥的反应管中依次加入金属钠(23.0mg,1.00mmol)、萘(160.1mg,1.25mmol)和无水四氢呋喃(1.5ml),室温搅拌1h直至出现墨绿色;将化合物2a(85.6mg,0.10mmol)溶于无水四氢呋喃(1.0ml),缓慢加入反应体系,封闭反应管,升至70℃反应7.0h;薄层色谱法监测反应进程,待反应完成后,加一滴水淬灭,砂芯漏斗铺硅胶抽滤,减压蒸馏除去溶剂,所得粗产物以石油醚/乙酸乙酯(5:1~3:1)加3%et3n为洗脱剂,经硅胶柱层析分离得到4-氨基喹啉类化合物4a(23.9mg,0.09mmol),产率为91%。
[0069]
将步骤1制备得到的4-氨基喹啉类化合物2b、2c、3a和3b按本实施例中上述方法步骤2分别制备得到4-氨基喹啉类化合物4b、4c、4d和4e。
[0070][0071]
化合物2a:黄色固体,94%产率,rf=0.23[石油醚/乙酸乙酯(2:1)];mp=99
–
100℃;1h nmr(400mhz,cdcl3)δ7.60(d,j=8.2hz,2h),7.52-7.49(m,3h),7.43-7.40(m,2h),
7.31-7.25(m,6h),7.21-7.16(m,3h),7.07(dd,j=10.6,2.0hz,1h),7.02-6.95(m,4h),6.57(s,3h),5.79(d,j=2.4hz,1h),5.59(s,1h),5.02(d,j=2.5hz,1h),2.44(s,3h),2.42(s,3h),2.41(s,3h),2.31(s,3h),2.30(s,3h),2.10(s,3h);
13
c nmr(100mhz,cdcl3)δ147.7,144.9,144.1,142.4,142.2,142.0,138.1,137.8,136.7,136.3,135.6,132.9,132.4,132.2,130.0,129.8,129.45,129.42,128.4,128.0,127.4,126.3,124.9,120.6,118.0,116.0,107.1,95.8,21.79,21.76,21.7,21.3,21.2,21.0,其中在130.0,129.8,129.45和126.3ppm处有四个碳信号重叠;ir(neat)(cm-1
)1629m,1525m,1429w,1355m,1163s,1082s,654s;hrms(esi):m/z calcd for c
48h46
n3o6s3[m+h]
+
856.2543,found 856.2548.
[0072][0073]
化合物2b:黄色固体,87%产率,rf=0.17[石油醚/乙酸乙酯(2:1)];mp=95
–
96℃;1h nmr(400mhz,cdcl3)δ7.68-7.62(m,4h),7.54(d,j=7.9hz,2h),7.40(d,j=8.1hz,2h),7.30-7.24(m,5h),7.14-7.05(m,5h),6.81(t,j=2.4hz,1h),6.77(dd,j=8.3,2.6hz,1h),6.67(dd,j=8.8,2.4hz,1h),6.54(s,1h),6.35-6.20(m,2h),5.80(d,j=2.6hz,1h),5.62(s,1h),5.13(d,j=2.4hz,1h),3.87(s,3h),3.72(s,3h),3.30(s,3h),2.43(s,3h),2.39(s,3h),2.37(s,3h);
13
c nmr(100mhz,cdcl3)δ162.3,160.1,159.6,148.3,145.0,144.2,142.5,142.0,141.9,141.7,140.6,136.2,135.9,135.6,135.4,130.0,129.9,129.8,129.5,129.2,128.3,128.0,127.7,126.6,126.0,122.4,118.9,117.1,115.5,114.6,113.1,113.0,111.0,108.4,100.8,95.9,56.0,55.5,55.1,21.7,21.6,其中在21.7ppm处有一个碳信号重叠;ir(neat)(cm-1
)1734w,1599m,1528m,1252m,1163s,1081s,657s;hrms(esi):m/z calcd for c
48h46
n3o9s3[m+h]
+
904.2391,found 904.2393.
[0074][0075]
化合物2c:黄色固体,80%产率,rf=0.30[石油醚/乙酸乙酯(2:1)];mp=93
–
94℃;1h nmr(400mhz,cdcl3)δ7.66(d,j=8.2hz,2.0h),7.56-7.37(m,6.0h),7.31-7.26(m,5.0h),7.24-7.23(m,3.0h),7.20-7.08(m,3.5h),7.02-6.95(m,4.0h),6.88-6.71(m,7.0h),6.41(s,1.0h),5.81(d,j=1.9hz,1.0h),5.66(s,1.0h),5.63(s,0.5h),5.57(d,j=
1.8hz,0.5h),5.053(s,1.0h),5.048(s,0.5h),2.81(s,1.5h),2.69(s,3.0h),2.46(s,3.5h),2.40(s,3.0h),2.38(s,1.5h),2.34(s,6.0h),2.28(s,3.0h),2.25(s,1.5h),2.18-2.15(m,14.5h),1.92(s,3.0h);
13
c nmr(100mhz,cdcl3)δ147.7,147.4,144.8,144.6,144.2,144.1,142.5,142.4,142.3,142.2,142.1,142.0,141.7,141.4,140.9,140.69,140.65,139.6,139.0,138.7,138.4,136.9,136.4,136.2,136.1,135.9,135.74,135.66,135.3,134.7,131.5,131.1,129.98,129.92,129.7,129.5,129.32,129.26,128.5,128.3,128.2,128.1,128.0,127.8,126.6,126.0,125.9,125.8,121.5,120.4,120.2,119.1,118.4,117.8,115.6,115.3,108.1,107.0,95.4,94.1,23.7,23.1,21.8,21.70,21.65,21.61,21.54,21.47,21.2,20.8,其中在21.65,21.61和21.2ppm处有八个碳信号重叠;ir(neat)(cm-1
)2922w,1606s,1453m,1355m,116s,1085m;hrms(esi):m/z calcd for c
51h51
n3o6s3[m+h]
+
898.3013,found 898.3006.
[0076][0077]
化合物3a:白色固体,97%产率,rf=0.16,0.23[石油醚/乙酸乙酯(5:1)];mp=99
–
100℃;1hnmr(400mhz,cdcl3)δ7.77-7.73(m,4h),7.67-7.64(m,3h),7.45-7.33(m,8h),7.28-7.24(m,3h),7.22-7.17(m,4h),7.13-6.99(m,8h),4.99(q,j=6.8hz,1h),4.89(q,j=6.9hz,1h),2.52(s,3h),2.44(s,6h),2.42(s,3h),2.39(s,3h),2.34(s,3h),2.28(s,6h),2.23(d,j=2.8hz,6h),1.87(d,j=6.8hz,3h),1.79(d,j=6.9hz,3h);
13
c nmr(100mhz,cdcl3)δ153.9,153.7,146.3,146.0,144.7,144.6,144.38,144.35,143.5,143.2,138.6,138.1,138.0,137.73,137.67,135.5,135.4,133.8,133.5,133.1,132.1,131.4,131.2,130.1,130.0,129.89,129.88,129.76,129.64,129.59,129.27,129.25,127.17 128.3,128.22,128.19,128.0,126.8,123.7,123.2,122.8,122.7,63.9,63.7,22.1,21.9,21.73,21.70,21.68,21.66,20.9,20.8,16.1,15.8,15.0,14.9;ir(neat)(cm-1
)2924w,1597w,1508m,1357m,1164s,1147m,1088m;hrms(esi):m/z calcd for c
34h35
n2o4s2[m+h]
+
599.2033,found 599.2040.
[0078][0079]
化合物3b:白色固体,97%产率,rf=0.10[石油醚/乙酸乙酯(5:1)];mp=97
–
98℃;1h nmr(400mhz,cdcl3)δ7.74-7.64(m,6h),7.41-7.32(m,7h),7.29-7.17(m,10h),7.10(d,j=8.2hz,2h),6.99(d,j=2.7hz,1h),6.82-6.78(m,2h),6.76-6.71(m,2h),5.00(q,j=6.8hz,1h),4.90(q,j=6.9hz,1h),3.78(s,3h),3.72(s,3h),3.69(s,3h),3.55(s,3h),2.63(s,3h),2.43(s,3h),2.41(s,3h),2.38(s,3h),2.35(s,3h),2.33(s,3h),1.85(d,j=6.8hz,3h),1.80(d,j=6.9hz,3h);
13
c nmr(100mhz,cdcl3)δ159.0,158.8,157.71,157.68,
151.9,151.7,144.64,144.59,144.4,144.3,143.8,143.7,143.4,143.1,138.0,137.9,133.8,133.6,133.5,133.3,132.3,131.4,131.1,129.91,129.85,129.76,129.2,129.1,129.0,128.12,128.10,127.9,125.5,125.3,121.99,121.89,114.6,114.5,102.5,101.9,63.8,63.7,55.45,55.42,55.1,21.67,21.65,21.59,16.6,16.1,14.95,14.89,其中在129.76,129.1,128.12和114.6ppm处有四个碳信号重叠;ir(neat)(cm-1
)1621m,1507s,1493s,1232m,1146s,1088m;hrms(esi):m/z calcd for c
34h35
n2o6s2[m+h]
+
631.1931,found 631.1929.
[0080][0081]
化合物4a:白色固体,91%产率,rf=0.25[石油醚/乙酸乙酯(2:1)];mp=127
–
128℃;1h nmr(400mhz,cdcl3)δ7.86(d,j=8.5hz,1h),7.64(s,1h),7.47(dd,j=8.6,1.8hz,1h),7.24-7.18(m,4h),6.77(s,1h),6.57(s,1h),2.53(s,3h),2.52(s,3h),2.39(s,3h);
13
c nmr(100mhz,cdcl3)δ158.7,147.6,147.3,137.5,134.5,134.3,131.6,130.4,129.1,123.4,118.7,118.1,102.1,25.6,21.9,21.1;ir(neat)(cm-1
)2919w,1586s,1534m,1512s,1401m,1271m;hrms(esi):m/z calcd for c
18h19
n2[m+h]
+
263.1543,found 263.1547.
[0082][0083]
化合物4b:白色固体,93%产率,rf=0.13[石油醚/乙酸乙酯(2:1)];mp=88
–
89℃;1h nmr(400mhz,cdcl3)δ7.78(d,j=9.1hz,1h),7.33-7.29(m,2h),7.07(dd,j=9.2,2.5hz,1h),6.89-6.83(m,3h),6.72(dd,j=8.3,1.7hz,1h),6.65(s,1h),3.91(s,3h),3.82(s,3h),2.55(s,3h);
13
c nmr(100mhz,cdcl3)δ160.9,160.8,159.9,150.7,147.6,141.5,130.5,121.1,117.2,114.7,113.0,109.7,108.3,107.6,102.0,55.6,55.5,25.6;ir(neat)(cm-1
)2923w,1582s,1463s,1328m,1218m,1035m;hrms(esi):m/z calcd for c
18h19
n2o2[m+h]
+
295.1441,found 295.1449.
[0084][0085]
化合物4c:白色固体,81%产率,rf=0.41[石油醚/乙酸乙酯(1:1)];mp=88
–
90℃;1h nmr(400mhz,cdcl3)δ7.59(s,1h),6.98(s,1h),6.86(s,2h),6.81(s,1h),6.79(s,1h),6.72(s,1h),2.94(s,3h),2.50(s,3h),2.43(s,3h),2.34(s,6h);
13
c nmr(100mhz,cdcl3)δ158.7,151.2,150.4,140.4,139.7,138.7,132.2,130.4,127.3,126.1,120.3,117.0,104.3,25.2,24.9,21.5,21.4;ir(neat)(cm-1
)1602m,1561w,1492s,1403m,1300w,
1248w;hrms(esi):m/z calcd for c
20h23
n2[m+h]
+
291.1856,found 291.1857.
[0086][0087]
化合物4d:油状物,92%产率,rf=0.38[石油醚/乙酸乙酯(5:1)];1h nmr(400mhz,cdcl3)δ7.94(d,j=8.5hz,1h),7.57(s,1h),7.42(dd,j=8.6,1.9hz,1h),7.00(d,j=8.1hz,2h),6.57(d,j=8.4hz,2h),5.90(s,1h),3.01(q,j=7.6hz,2h),2.41(s,3h),2.26(d,j=6.8hz,6h),1.36(t,j=7.6hz,3h);
13
c nmr(100mhz,cdcl3)δ163.3,145.8,143.1,142.7,135.3,130.9,129.9,129.5,128.8,123.9,122.8,121.5,115.9,30.3,21.9,20.7,14.4,13.3;ir(neat)(cm-1
)1614m,1502s,1494m,1385m,1296w,1254w;hrms(esi):m/z calcd for c
20h23
n2[m+h]
+
291.1856,found 291.1859.
[0088][0089]
化合物4e:油状物,91%产率,rf=0.18[石油醚/乙酸乙酯(5:1)];1h nmr(400mhz,cdcl3)δ7.93(d,j=9.1hz,1h),7.23(dd,j=9.1,2.8hz,1h),7.02(d,j=2.8hz,1h),6.78(dt,j=10.1hz,3.5hz,2h),6.63(j=10.1hz,3.4hz,2h),5.85(s,1h),3.75(s,3h),3.68(s,3h),2.99(q,j=7.5hz,2h),2.27(s,3h),1.35(t,j=7.6hz,3h);
13
c nmr(100mhz,cdcl3)δ161.4,156.9,154.2,143.6,143.1,138.5,130.4,123.9,121.5,120.8,118.4,114.7,101.7,55.8,55.5,30.2,14.1,13.4;ir(neat)(cm-1
)1622m,1509s,1463w,1229s,1179w,1034m;hrms(esi):m/z calcd for c
20h23
n2o2[m+h]
+
323.1754,found 323.1762.
[0090]
3.2 4-氨基喹啉类化合物4f的合成
[0091]
4-氨基喹啉类化合物4f的合成步骤跟4a-4e是类似的,只是第一步反应完中间不经过柱层析分离,直接投下一步,一锅法获得,具体合成步骤如下:
[0092][0093]
氮气保护下,向干燥的反应管中依次加入炔酰胺1'c(119.8mg,0.40mmol)和二氯甲烷(1.0ml),将三氟甲磺酸三甲基硅酯(43.5μl,0.24mmol)和三氟甲磺酸(7.1μl,0.08mmol)于离心管中混合均匀,再缓慢加入反应体系,封闭反应管,30℃下搅拌0.5h;薄层色谱法监测反应进程,待反应完成后,减压蒸馏除去溶剂,所得粗产物直接投到下一步。氮气保护下,向干燥的反应管中依次加入金属钠(46.0mg,2.00mmol)、萘(320.4mg,2.50mmol)和无水四氢呋喃(3.0ml),室温搅拌1h直至出现墨绿色;将粗产物溶于无水四氢呋喃(2.0ml),缓慢加入反应体系,封闭反应管,升至70℃反应7.0h;薄层色谱法监测反应进程,
待反应完成后,加一滴水淬灭,过硅胶抽滤,减压蒸馏除去溶剂,所得粗产物以石油醚/乙酸乙酯(8:1)加3%et3n为洗脱剂,经硅胶柱层析分离得到4-氨基喹啉类化合物4f(21.5mg,0.074mmol)和其异构体4f'(32.8mg,0.113mmol),总产率为93%。
[0094][0095]
化合物4f:白色固体,rf=0.52[石油醚/乙酸乙酯(5:1)];mp=45
–
46℃;1h nmr(400mhz,cdcl3)δ7.92(d,j=8.2hz,1h),7.49-7.45(m,1h),7.19-7.17(m,1h),7.07(t,j=7.8hz,1h),6.42(d,j=7.5hz,1h),6.35(s,1h),6.31-6.28(m,1h),5.79(s,1h),3.03(q,j=7.5hz,2h),2.75(s,3h),2.29(s,3h),2.25(s,3h),1.38(t,j=7.5hz,3h);
13
c nmr(100mhz,cdcl3)δ163.7,149.1,145.4,143.9,139.6,133.5,129.5,129.4,128.28,128.18,126.6,125.2,120.4,115.3,111.7,30.44,24.4,21.8,14.3,13.1;ir(neat)(cm-1
)2922s,1659m,1633m,1470m,1425w,1191w;hrms(esi):m/z calcd for c
20h23
n2[m+h]
+
:291.1856;found 291.1854.
[0096][0097]
化合物4f':白色固体,rf=0.50[石油醚/乙酸乙酯(5:1)];mp=41
–
42℃;1h nmr(400mhz,cdcl3)δ7.83(s,1h),7.70(d,j=8.5hz,1h),7.20-7.18(m,1h),7.07(t,j=7.8hz,1h),6.68(d,j=7.5hz,1h),6.49(s,1h),6.44-6.42(m,1h),5.84(s,1h),3.03(q,j=7.6hz,2h),2.50(s,3h),2.29(s,3h),2.25(s,3h),1.37(t,j=7.4hz,3h);
13
c nmr(100mhz,cdcl3)δ164.3,147.6,145.1,143.2,139.4,138.8,129.3,128.3,127.7,122.7,122.2,121.9,121.1,116.6,112.9,30.5,21.8,21.7,14.2,13.3;ir(neat)(cm-1
)3362w,2922s,2851m,1633m,1470m,1301w,1188w;hrms(esi):m/z calcd for c
20h23
n2[m+h]
+
291.1856,found 291.1856.
[0098]
实施例4:本发明实施例3所合成的代表性化合物抗肿瘤活性研究
[0099]
4-氨基喹啉类化合物4抗肿瘤活性研究所用的细胞株、细胞培养试剂、实验仪器及来源见表1、表2和表3。
[0100]
表1细胞株种类及来源
[0101][0102]
表2细胞培养试剂及生产厂家
[0103][0104]
表3实验仪器及生产厂家
[0105][0106]
化合物4抗癌细胞活性及安全性检测
[0107]
取对数生长期的癌细胞计数,配制成浓度为5
×
104个/ml细胞悬液,震荡混匀后接
种于96孔板,每孔加入细胞悬液100μl,37℃、体积百分比5%co2培养条件下培养4-8h;用新鲜的培养基配置含不同浓度化合物的培养液培养48h;48h后,甩掉96孔板孔内培养液,每孔加入10%cck8溶液100μl,继续培养1-4h,然后在450nm波长下检测吸光度。抑制率=[(ac-as)/(ac-ab)]
×
100%;as:实验孔吸光度(含细胞、培养基、cck-8溶液,化合物培养液处理组);ac:对照孔吸光度(含细胞、培养基、cck-8溶液,不含化合物培养液处理组);ab:空白孔吸光度(含培养基和cck-8溶液,不含细胞和化合物)。以vcr(长春新碱)为阳性对照药,使用graphpad prism9.0计算化合物的ic
50
见表4.1和表4.2。
[0108]
表4.1化合物4对5637、a172、a375、c33a、hct 116及hela的抑制活性
[0109][0110]
表4.2化合物4对cfpac-1、sw480、hep g2、a549、mcf-7及293t的抑制活性
[0111][0112]
本试验采用本领域技术人员熟知的方法进行,利用12种细胞株(含11种癌细胞和1种正常细胞)来评价本发明4-氨基喹啉类化合物4a-4f的抗肿瘤活性及细胞毒性。实验结果表明:1.所检测的所有环合反应产物4a-4f对人膀胱癌细胞5637和人乳腺癌细胞mcf-7均具有很强的抑制活性;2.具体到各个化合物与阳性对照药vcr相比,4a和4e对人膀胱癌细胞5637、人肝癌细胞hep g2和人乳腺癌细胞mcf-7具有很好的抑制活性,及对正常细胞293t(肾上皮细胞)低的细胞毒性;4b对所测的几乎所有的细胞株(人膀胱癌细胞5637、人胶质母细胞瘤细胞a172、人恶性黑色素瘤细胞a375、人子宫颈癌细胞c33a、人结肠癌细胞hct 116和sw480、人宫颈癌细胞hela、人胰腺癌细胞cfpac-1、人肝癌细胞hep g2、人肺癌细胞a549和人乳腺癌细胞mcf-7)均具有很好的抑制活性,但对正常细胞293t(肾上皮细胞)细胞毒性
稍强;4c和4d对人膀胱癌细胞5637和人乳腺癌细胞mcf-7均具有很好的抑制活性,及对正常细胞293t(肾上皮细胞)低的细胞毒性;4f对人膀胱癌细胞5637、人宫颈癌细胞hela、人肝癌细胞hep g2和人乳腺癌细胞mcf-7均具有很好的抑制活性,及对正常细胞293t(肾上皮细胞)低的细胞毒性。本发明在抗肿瘤药物的制备与研究中具有很好的应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1