基于miRNA特征标记的肝癌早期检测的制作方法
id no:31所示的逆转录引物、seq id no:32和seq id no:33所示的扩增引物,和/或seq id no:34所示的探针。
24.18.根据项1-17任一项所述的试剂盒,其特征在于,还包含检测外参mirna的检测试剂,所述外参mirna是cel-mir-39-5p;优选地,所述检测外参mirna的检测试剂是seq id no:35所示的逆转录引物、seq id no:36和seq id no:37所示的扩增引物,seq id no:38所示的探针。
25.19.根据项1-18任一项所述的试剂盒,其特征在于,所述试剂盒还包括针对血浆或血清样本的mirna提取试剂。
26.20.根据项1-19任一项所述的试剂盒,其特征在于,所述肝癌为早期肝癌。
27.21.一种检测肝癌的方法,其特征在于,所述方法包含检测样本中的选自hsa-mir-33b-3p,hsa-mir-92b-3p,hsa-mir-205-5p,hsa-mir-374c-5p,hsa-mir-4516-3p,和hsa-mir-6803-3p的一个或多个mirna的浓度。
28.22.根据项21所述的方法,其特征在于,所述方法包含检测样本中的选自hsa-mir-33b-3p,hsa-mir-92b-3p,hsa-mir-205-5p,hsa-mir-374c-5p,hsa-mir-4516-3p,和hsa-mir-6803-3p的至少两个mirna的浓度。
29.23.根据项21所述的方法,其特征在于,所述方法包含检测样本中的选自hsa-mir-33b-3p,hsa-mir-92b-3p,hsa-mir-205-5p,hsa-mir-374c-5p,hsa-mir-4516-3p,和hsa-mir-6803-3p的至少三个mirna的浓度。
30.24.根据项21所述的方法,其特征在于,所述方法包含检测样本中的选自hsa-mir-33b-3p,hsa-mir-92b-3p,hsa-mir-205-5p,hsa-mir-374c-5p,hsa-mir-4516-3p,和hsa-mir-6803-3p的至少四个mirna的浓度。
31.25.根据项21所述的方法,其特征在于,所述方法包含检测样本中的选自hsa-mir-33b-3p,hsa-mir-92b-3p,hsa-mir-205-5p,hsa-mir-374c-5p,hsa-mir-4516-3p,和hsa-mir-6803-3p的至少五个mirna的浓度。
32.26.根据项21所述的方法,其特征在于,所述方法包含检测样本中的hsa-mir-33b-3p,hsa-mir-92b-3p,hsa-mir-205-5p,hsa-mir-374c-5p,hsa-mir-4516-3p,和hsa-mir-6803-3p的浓度。
33.27.根据项21-26任一项所述的方法,其特征在于,使用至少一个逆转录引物,至少一个扩增引物,和/或至少一个探针。
34.28.根据项27所述的方法,其特征在于,使用包含选自含seq id no:7,11,15,19,23和27至少一个的逆转录引物。
35.29.根据项27或28所述的方法,其特征在于,使用包含选自含seq id no:8-9,12-13,16-17,20-21,24-25和28-29至少一个的扩增引物。
36.30.根据项27-29任一项所述的方法,其特征在于,使用包含选自含seq id no:10,14,18,22,26和30至少一个的探针。
37.31.根据项21-30任一项所述的方法,其特征在于,检测hsa-mir-33b-3p的检测试剂包含seq id no:7所示的逆转录引物、seq id no:8和seq id no:9所示的扩增引物,和/或seq id no:10所示的探针。
38.32.根据项21-31任一项所述的方法,其特征在于,检测hsa-mir-92b-3p的检测试
剂包含seq id no:11所示的逆转录引物、seq id no:12和seq id no:13所示的扩增引物,和/或seq id no:14所示的探针。
39.33.根据项21-32任一项所述的方法,其特征在于,检测hsa-mir-205-5p的检测试剂包含seq id no:15所示的逆转录引物、seq id no:16和seq id no:17所示的扩增引物,和/或seq id no:18所示的探针。
40.34.根据项21-33任一项所述的方法,其特征在于,检测hsa-mir-374c-5p的检测试剂包含seq id no:19所示的逆转录引物、seq id no:20和seq id no:21所示的扩增引物,和/或seq id no:22所示的探针。
41.35.根据项21-34任一项所述的方法,其特征在于,检测hsa-mir-4516-3p的检测试剂包含seq id no:23所示的逆转录引物、seq id no:24和seq id no:25所示的扩增引物,和/或seq id no:26所示的探针。
42.36.根据项21-35任一项所述的方法,其特征在于,检测hsa-mir-6803-3p的检测试剂包含seq id no:27所示的逆转录引物、seq id no:28和seq id no:29所示的扩增引物,和/或seq id no:30所示的探针。
43.37.根据项21-36任一项所述的方法,其特征在于,所述样本为血浆或血清样本。
44.38.根据项21-37任一项所述的方法,其特征在于,所述肝癌为早期肝癌。
45.39.根据项21-38任一项所述的方法,其特征在于,将hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516和hsa-mir-6803-3p与内参hsa-mir-16、和外参cel-mir-39根据荧光定量pcr检测得到的ct值相减,得到的差值作为协变量,用于roc曲线分析,利用下述logistic regression方程判断肝癌发生的可行性进行判定:p=ek/(1+ek),其中e为自然常数,k=(0.15501)+(0.01785)hsa-mir-33b-3p+(-0.02857)hsa-mir-92b-3p+(-0.01955)mir-205-5p+(0.03704)mir-374c-5p+(0.04277)mir-4516-3p+(0.04277)mir-6803-3p。若p值高于0.478,则认为是极早期肝癌高危患者。
附图说明
46.图1为6个靶标的roc曲线分析
47.发明详述
48.本发明的目的在于提供诊断早期肝癌的mirna组合及试剂盒。为解决现有早期肝癌诊断技术中存在的灵敏度低的不足之处,本发明提供了一种基于mirna的检测产品,以及mirna特征标记在制备肝癌筛查及诊断试剂或试剂盒中的应用。在一些实施例中,其产品包含用于检测mirna含量的引物、探针、检测试剂及试剂盒。在一些实施例中,通过从血浆样本中提取并检测一个或多个mirna的表达水平,能够判断待检个体是否患有肝癌。本方法安全、无创,且具有较高的灵敏度和特异性,能够有效地用于肝癌早期诊断。
49.本发明的第一方面,提供一种用于检测肝癌的试剂盒,所述的试剂盒中包括选自:
50.特异性检测人hsa-mir-33b-3p的检测试剂;
51.特异性检测人hsa-mir-92b-3p的检测试剂;
52.特异性检测人hsa-mir-205-5p的检测试剂;
53.特异性检测人hsa-mir-374c-5p的检测试剂;
54.特异性检测人hsa-mir-4516-3p的检测试剂;和
55.特异性检测人hsa-mir-6803-3p的检测试剂;
56.的一个或多个检测试剂。在一些实施例中,所选试剂盒包括选自上述mirna检测试剂的2,3,4,5,或6个检测试剂。在一些实施例中,所选试剂盒包括选自上述的全部6个mirna检测试剂。
57.在一些实施例中,所述的试剂盒中,所述的检测试剂是rna逆转录引物、dna扩增引物和dna探针。
58.在一些实施例中,在一些实施例中,所述的试剂盒中,特异性检测人hsa-mir-33b-3p的检测试剂是seq id no:7所示的逆转录引物、seq id no:8和seq id no:9所示的扩增引物,seq id no:10所示的探针;
59.在一些实施例中,在一些实施例中,所述的试剂盒中,特异性检测人hsa-mir-92b-3p的检测试剂是seq id no:11所示的逆转录引物、seq id no:12和seq id no:13所示的扩增引物,seq id no:14所示的探针;
60.在一些实施例中,在一些实施例中,所述的试剂盒中,特异性检测人hsa-mir-205-5p的检测试剂是seq id no:15所示的逆转录引物、seq id no:16和seq id no:17所示的扩增引物,seq id no:18所示的探针;
61.在一些实施例中,在一些实施例中,所述的试剂盒中,特异性检测人hsa-mir-374c-5p的检测试剂是seq id no:19所示的逆转录引物、seq id no:20和seq id no:21所示的扩增引物,seq id no:22所示的探针;
62.在一些实施例中,所述的试剂盒中,特异性检测人hsa-mir-4516-3p的检测试剂是seq id no:23所示的逆转录引物、seq id no:24和seq id no:25所示的扩增引物,seq id no:26所示的探针;
63.在一些实施例中,所述的试剂盒中,特异性检测人hsa-mir-6803-3p的检测试剂是seq id no:27所示的逆转录引物、seq id no:28和seq id no:29所示的扩增引物,seq id no:30所示的探针;
64.在一些实施例中,所述的试剂盒中还包括:
65.特异性检测内参基因和外参基因的检测试剂;较佳地,所述的特异性检测内参基因的检测试剂是针对人hsa-mir-16-5p的逆转录引物、扩增引物和探针;更佳地,所述的特异性检测内参基因的检测试剂是seq id no:31所示的逆转录引物、seq id no:32和seq id no:33所示的扩增引物,seq id no:34所示的探针。所述的特异性检测外参基因的检测试剂是针对人cel-mir-39-5p的逆转录引物、扩增引物和探针;更佳地,所述的特异性检测外参基因的检测试剂是seq id no:35所示的逆转录引物、seq id no:36和seq id no:37所示的扩增引物,seq id no:38所示的探针。
66.在一些实施例中,针对每一mirna或内参的探针连接有特定的荧光基团。
67.在一些实施例中,该试剂盒中还包括:阴性质控品和/或阳性质控品。
68.在一些实施例中,该试剂盒中还包括:rna提取试剂,逆转录反应试剂,pcr扩增试剂和/或使用说明书。
69.在本发明的另一方面,提供针对选自hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p的一个或多个mirna进行检测的用途,可用于检测肝癌或制备检测肝癌的试剂或试剂盒。在一些实施例中,所述用途
包括对选自上述mirna的2,3,4,5,或6个mirna进行检测。在一些实施例中,所述用途包括对上述全部6个mirna进行检测。
70.在一些实施例中,所述的检测试剂是rna逆转录引物、dna扩增引物和dna探针。
71.在一些实施例中,所述的肝癌是早期肝癌,所述的早期肝癌包括极早期肝癌(最早期肝癌)。
72.在一些实施例中,肝癌分期采用巴塞罗那肝癌临床分期系统(barcelona clinic liver cancer(bclc),见下方表a)。在一些实施例中,所述早期肝癌包括巴塞罗那分期的a期。在一些实施例中,所述早期肝癌包括巴塞罗那分期的0期和a期。
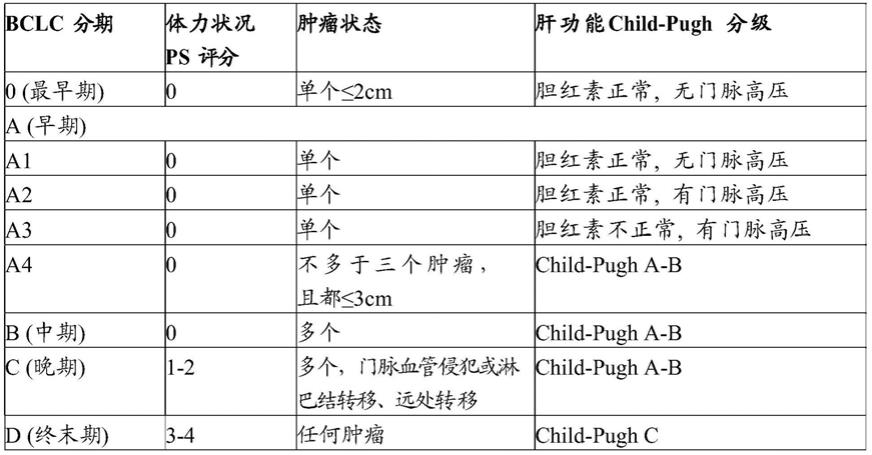
73.表a:巴塞罗那肝癌临床分期
[0074][0075]
在一些实施例中,肝癌分期采用中国肝癌的分期方案(china liver cancer staging,cnlc),包括:cnlcia期、ib期、ⅱa期、ⅱb期、iiia期、iiib期、iv期,具体如下:
[0076]
cnlc ia期:体力活动状态(performance status,ps)评分0~2分,肝功能child-pugh a/b级,单个肿瘤、直径≤5cm,无血管侵犯和肝外转移。
[0077]
cnlc ib期:ps 0~2分,肝功能child-pugh a/b级,单个肿瘤、直径>5cm,或2~3个肿瘤、最大直径≤3cm,无血管侵犯和肝外转移。
[0078]
cnlc
ꢀⅱ
a期:ps 0~2分,肝功能child-pugh a/b级,2~3个肿瘤、最大直径>3cm,无血管侵犯和肝外转移。
[0079]
cnlc
ꢀⅱ
b期:ps 0~2分,肝功能child-pugh a/b级,肿瘤数目≥4个、肿瘤直径不论,无血管侵犯和肝外转移。
[0080]
cnlc iiia期:ps 0~2分,肝功能child-pugh a/b级,肿瘤情况不论、有血管侵犯而无肝外转移。
[0081]
cnlc iiib期:ps 0~2分,肝功能child-pugh a/b级,肿瘤情况不论、血管侵犯不论、有肝外转移。
[0082]
cnlc iv期:ps 3~4,或肝功能child-pugh c级,肿瘤情况不论、血管侵犯不论、肝外转移不论。
[0083]
在一些实施例中,所述早期肝癌包括中国肝癌分期(cnlc)的ia期。在一些实施例
中,所述早期肝癌包括中国肝癌分期(cnlc)的ib期。在一些实施例中,所述早期肝癌包括中国肝癌分期(cnlc)的ia期和ib期。
[0084]
在一些实施例中,所述试剂盒包含游离核酸提取试剂。在一些实施例中,所述游离核酸提取试剂通过磁珠法提取并纯化血浆游离核酸。
[0085]
在一些实施例中,所述血浆游离核酸为血浆游离dna。在一些实施例中,所述血浆游离核酸为血浆游离rna。
[0086]
本发明的优点包括并不限于:首次提出通过检测患者血浆中(特别是循环系统中)特异性mirnas分子标记的拷贝数,并利用诊断模型对病毒性肝炎患者发生肝癌的风险进行判定,在诊断肝细胞癌,尤其是在无症状高风险个体的群体中鉴定早期肝癌具有85%以上的准确性。
[0087]
本发明人经过深入的研究,首次揭示一种通过协同检测六种mirnas的表达情况来诊断肝癌,特别是早期肝癌的方法,本发明还提供了用于实施所述诊断的试剂或试剂盒。
[0088]
如本文所用,“待测样本”、“待测样品”、“分析物”或“待测核酸(如dna,rna)样品”是指待检测的样本,其中含有一种核酸或多种核酸,需要了解其中是否存在目标核酸。本发明中,所述的待测样本可以是:血浆,血清等。
[0089]
如本文所用,“目标核酸”是指感兴趣的核酸片段。在一些实施例中,目标核酸是指人源的hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p中的一种或多种。
[0090]
如本文所用,“探针”是指一种具有已知核苷酸序列的单链核酸,其具有与目标核酸基本上互补的核苷酸序列结构,可以与“目标核酸”形成双链。所述的“探针”可以携带标记物。例如,标记物可以连接在探针的5’末端或3’末端。
[0091]
如本文所用,所述的“mirna组合”是指由hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p中的一种或多种(例如全部六种)组成的一组mirnas,该组合可应用于检测肝癌,特别是早期肝癌。
[0092]
本发明人收集了其中发生肝癌的患者确诊半年至一年半以前的血浆,通过筛选出与未发生肝癌者相比差异表达的mirnas谱,得到了能够预测病毒性肝炎患者高风险人群发生肝癌的可能性的特异性mirnas分子标记。
[0093]
基于本发明人的上述新发现,提供了特异性检测所述的hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p的检测试剂的用途,用于制备检测肝癌,特别是早期肝癌的试剂盒。
[0094]
可采用各种本领域已知的技术来检测所述的hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p的存在或表达情况,这些技术均包含在本发明中。例如可用已有的技术如聚合酶链式反应技术(pcr),southern印迹法,原位杂交法,dna序列分析等,这些方法也可结合使用。
[0095]
本发明还提供了用于在分析物中检测所述的hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p的存在表达情况的试剂。作为一种优选方式,可以采用其特异性扩增引物或特异性探针,通过rcr法来确定所述mirna的量。针对mirna的特异性引物和探针的设计是本领域人员熟知的技术。
[0096]
作为本发明的优选方式,检测血浆或血清中的hsa-mir-33b-3p、hsa-mir-92b-3p、
hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p。
[0097]
在一些实施例中,肝癌样本中的hsa-mir-205-5p的单位浓度/含量比正常样本低。在一些实施例中,肝癌样本中的hsa-mir-205-5p的单位浓度/含量比正常样本低至少5%,至少10%,至少20%,至少30%,至少50%,至少70%,至少100%,至少150%,至少200%,至少300%,至少400%,至少500%,至少600%,至少700%,至少800%,至少900%,或至少1000%。
[0098]
在一些实施例中,肝癌样本中的hsa-mir-374c-5p的单位浓度/含量比正常样本高。在一些实施例中,肝癌样本中的hsa-mir-374c-5p的单位浓度/含量比正常样本高至少5%,至少10%,至少20%,至少30%,至少50%,至少70%,至少100%,至少150%,至少200%,至少300%,至少400%,至少500%,至少600%,至少700%,至少800%,至少900%,或至少1000%。
[0099]
在一些实施例中,肝癌样本中的hsa-mir-33b-3p的单位浓度/含量比正常样本低。在一些实施例中,肝癌样本中的hsa-mir-33b-3p的单位浓度/含量比正常样本低至少5%,至少10%,至少20%,至少30%,至少50%,至少70%,至少100%,至少150%,至少200%,至少300%,至少400%,至少500%,至少600%,至少700%,至少800%,至少900%,或至少1000%。
[0100]
在一些实施例中,肝癌样本中的hsa-mir-92b-3p的单位浓度/含量比正常样本高。在一些实施例中,肝癌样本中的hsa-mir-92b-3p的单位浓度/含量比正常样本中高至少5%,至少10%,至少20%,至少30%,至少50%,至少70%,至少100%,至少150%,至少200%,至少300%,至少400%,至少500%,至少600%,至少700%,至少800%,至少900%,或至少1000%。
[0101]
在一些实施例中,肝癌样本中的hsa-mir-4516-3p的单位浓度/含量比正常样本低。在一些实施例中,肝癌样本中的hsa-mir-4516-3p的单位浓度/含量比正常样本低至少5%,至少10%,至少20%,至少30%,至少50%,至少70%,至少100%,至少150%,至少200%,至少300%,至少400%,至少500%,至少600%,至少700%,至少800%,至少900%,或至少1000%。
[0102]
在一些实施例中,肝癌样本中的hsa-mir-6803-3p的单位浓度/含量比正常样本低。在一些实施例中,肝癌样本中的hsa-mir-6803-3p的单位浓度/含量比正常样本低至少5%,至少10%,至少20%,至少30%,至少50%,至少70%,至少100%,至少150%,至少200%,至少300%,至少400%,至少500%,至少600%,至少700%,至少800%,至少900%,或至少1000%。
[0103]
本发明还提供了用于检测肝癌,特别是早期肝癌的试剂盒,包含:特异性检测人hsa-mir-33b-3p的检测试剂;特异性检测人hsa-mir-92b-3p的检测试剂;特异性检测人hsa-mir-205-5p的检测试剂;特异性检测人hsa-mir-374c-5p的检测试剂;特异性检测人hsa-mir-4516-3p的检测试剂和特异性检测人hsa-mir-6803-3p的检测试剂。作为一种优选方式,所述的检测试剂是rna逆转录引物、dna扩增引物和dna探针。
[0104]
所述的试剂盒中还可包含rna提取试剂、逆转录试剂、核酸扩增试剂、无rna酶的纯水、阴性质控品、阳性质控品等。
[0105]
可选的,所述用于提取rna的试剂为trizol试剂、磁珠法抽提rna所用的试剂、柱法
抽提rna所用的试剂。
[0106]
本发明所述的试剂盒中逆转录试剂包括:检测所述mirna组合中的各mirna的逆转录引物、逆转录酶、逆转录反应体系。
[0107]
所述逆转录酶可以为m-mlv逆转录酶或amv逆转录酶。
[0108]
所述逆转录反应体系可以包括:逆转录缓冲液、dntps、无rna酶的纯水,rna酶抑制剂,及对照或提取出的rna。
[0109]
本发明所述的核酸扩增试剂可以包括:正向引物、反向引物、寡核苷酸探针、核酸扩增酶、定量核酸扩增反应体系。
[0110]
所述核酸扩增酶可以为dna扩增酶;
[0111]
所述定量核酸扩增反应体系可以包括定量缓冲液、dntps、纯水,及逆转录得到的cdna。
[0112]
本发明所述的阴性质控品可以为正常人血浆、无肝癌的慢性乙肝患者血浆、牛血清白蛋白溶液或生理盐水溶液;阳性质控品可以为经过测定为阳性的早期肝癌患者血浆,或为特定拷贝数的hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p寡核苷酸。
[0113]
为了避免扩增产生的误差,还可设置内参。在本发明的实施例中,以hsa-mir-16-5p作为内参。应理解,选择其它类似的基因作为内参也是可行的。
[0114]
为了避免扩增产生的误差,还可设置外参。在本发明的实施例中,以cel-mir-39-5p作为外参。应理解,选择其它类似的基因作为外参也是可行的。
[0115]
本发明还进一步提供了肝脏肿瘤极早期诊断相关血浆小分子核酸的检测方法,包括以下步骤:
[0116]
(1)血浆标本中rna的提取:
[0117]
取待测病人血浆、阴性对照血浆、阳性对照血浆、合成的外参基因cel-39-5p的mimic,按照所选用的rna抽提试剂盒的标准操作方法,或使用的核酸抽提试剂盒的说明书,抽提血浆标本中的rna;
[0118]
(2)用上述试剂盒进行检测:
[0119]
对内参、外参和所述mirna组合同时进行定量测定。将提取的rna加入至预混合的含有逆转录引物、逆转录酶、逆转录反应体系的反应管中,进行逆转录;然后使用cdna加入至含有正向引物、反向引物、寡核苷酸探针、核酸扩增酶、定量核算扩增反应体系的定量核酸扩增反应管中,进行扩增,使用荧光定量pcr检测仪进行检测。
[0120]
(3)通过逻辑回归(logistic regression)模型联合分析循环系统中多个特定的小分子核酸,用以判断肝癌发生的可行性:p=ek/(1+ek)。
[0121]
上式中,p为综合指数,其范围为0《p《1;e为自然常数;k=(0.15501)+(0.01785)hsa-mir-33b-3p+(-0.02857)hsa-mir-92b-3p+(-0.01955)mir-205-5p+(0.03704)mir-374c-5p+(0.04277)mir-4516-3+(0.04277)mir-6803-3p。其中,hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p的表达水平是以mir-16-5p为内参和cel-mir-39-5p为外参检测得到。根据临床样本检测数据(p值)的分布确定判定阈值,p≥所述阈值时检测结果判定为阳性,p《所述阈值时检测结果判定为阴性。
[0122]
本发明首次提出通过检测患者血浆中(特别是循环系统中)特异性mirnas分子标记的拷贝数,并利用诊断模型对病毒性肝炎患者发生肝癌的风险进行判定,在诊断肝细胞癌,尤其是在无症状高风险个体的群体中鉴定早期肝癌具有85%以上的准确性。
具体实施例
[0123]
以下结合附图和具体实施例对本发明作具体介绍。具体实施例不代表对本发明保护范围的限制,其他人根据本发明理念所作出的一些非本质的修改和调整仍属于本发明的保护范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。
[0124]
实施例1:筛选能够预测病毒性肝炎患者高风险人群发生肝癌可能性的特异性mirnas分子标记
[0125]
收集了其中发生肝癌的患者的确诊患病的半年至一年半以前的血浆,筛选出与未发生肝癌者相比差异表达的mirnas谱,筛选能够预测病毒性肝炎患者高风险人群发生肝癌的可能性的特异性mirnas分子标记。
[0126]
研究用的血浆样本中,慢性乙肝表面抗原(hbsag)阳性(hbsag-阳性)的患者70例,丙型肝炎患者40例,肝癌患者80例;
[0127]
针对上述样本进行二代测序筛选二者之间的差异表达mirnas谱,得到10个差异表达的mirnas(见表1)。
[0128]
表1
[0129][0130][0131]
通过进一步扩大样本量,获取30个慢性乙肝病毒感染患者及40个极早期肝癌患者作为训练集,用定量rt-pcr方法对10个候选mirnas进行进一步的验证。结果发现,下列6个mirnas可以显著地区分干扰组及肝癌组:hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516和hsa-mir-6803-3p,在早期肝癌患者中它们的表达的上调或下调与表1相符,该结果表明这6个循环mirnas是肝癌筛查的新的标志物。
[0132]
各个mirna的序列分别如下:
no:23)
[0164]
上游引物:5
’‑
aactatcgtaccgggagaagg-3’(seq id no:24)
[0165]
下游引物:5
’‑
ctcaactggtgtcgtggagt-3’(seq id no:25)
[0166]
探针:5
’‑
ttcagttgaggccccgac-3’(seq id no:26)。该探针的5’端带有fam;3’端带有mgb。
[0167]
针对hsa-mir-6803-3p:
[0168]
逆转录引物:5
’‑
ctcaactggtgtcgtggagtcggcaattcagttgagctgagggt-3’(seq id no:27)
[0169]
上游引物:5
’‑
atagagtccctcgccttctc-3’(seq id no:28)
[0170]
下游引物:5
’‑
ctcaactggtgtcgtggagt-3’(seq id no:29)
[0171]
探针:5
’‑
ttcagttgagctgagggt-3’(seq id no:30)。该探针的5’端带有fam;3’端带有mgb。
[0172]
以has-mir-16-5p为内参,相关引物如下:
[0173]
逆转录引物:5
’‑
ctcaactggtgtcgtggagtcggcaattcagttgagcgccaata-3’(seq id no:31)
[0174]
上游引物:5
’‑
gccgagtagcagcacgtaaa-3’(seq id no:32)
[0175]
下游引物:5
’‑
ctcaactggtgtcgtggagt-3’(seq id no:33)
[0176]
探针:5
’‑
ttcagttgagcgccaata-3’(seq id no:34)。该探针的5’端带有fam;3’端带有mgb。
[0177]
以cel-mir-39-5p为外参,相关引物如下:
[0178]
逆转录引物:5
’‑
ctcaactggtgtc gtggagtcggcaattcagttgagcaagctga-3’(seq id no:35)
[0179]
上游引物:5
’‑
gccgagtcaccgggtgtaaa-3’(seq id no:36)
[0180]
下游引物:5
’‑
ctcaactggtgtcgtggagt-3’(seq id no:37)
[0181]
探针:5
’‑
ttcagttgagcaagctga-3’(seq id no:38)。该探针的5’端带有fam;3’端带有mgb。
[0182]
2.总rna抽提
[0183]
运用柱提取法,对病人血浆进行总rna提取,具体步骤如下:
[0184]
a)使用2.0ml离心管,取0.2ml血浆样本加入0.3ml的结合液和0.3ml的裂解液(请注意查看是否加入β-巯基乙醇),涡旋混匀15s;
[0185]
b)放在60℃的电热恒温鼓风干燥箱中孵育10min;
[0186]
c)孵育结束后取出,并加入0.75ml的无水乙醇,涡旋混匀15s;
[0187]
d)1250rpm离心1min,小心去上清,但要保证碳化硅不被丢弃;
[0188]
e)加入0.3ml裂解液(请注意查看是否加入β-巯基乙醇),涡旋混匀15s;
[0189]
f)重复步骤3.2;
[0190]
g)孵育结束后取出,并加入0.3ml的无水乙醇,涡旋混匀15s;
[0191]
h)取650μl上述混合液加入至rna纯化柱中,14000rpm离心1min,弃废液;
[0192]
i)重复3.8直至混合液完全转移至rna纯化柱中;
[0193]
j)加入400μl清洗液,14000rpm离心1min,弃废液;
[0194]
k)重复3.10两次;
[0195]
l)14000rpm离心3min,弃收集管;
[0196]
m)将rna纯化柱放入1.5ml ep管中,加入30μl洗脱液,2000rpm离心2min,随后14000rpm离心3min,将rna纯化柱取出,得到rna洗脱液。
[0197]
3.样本rna逆转录反应
[0198]
各取5μl抽提好的样本rna,阳性对照rna,阴性对照加入逆转录的缓冲液5μl,震荡混匀后,备用。随后加入10μl逆转录酶混合液。逆转录反应体系如表2所示。
[0199]
表2
[0200]
物料推荐体系不含rnase的dd h2o4.11μl100mm dntps(具有dttp)0.2μl逆转录酶,50u/μl1.0μl10
×
逆转录缓冲液1.5μlrnase抑制剂,20u/μl0.19μl茎环引物3.0μl
[0201]
其中,逆转录过程中的条件如下:16℃-30min,42℃-30min,85℃-5min。
[0202]
4.样本cdna荧光定量pcr检测
[0203]
逆转录得到的cdna片段,在独立的反应孔中分别对hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p、has-mir-16、cel-mir-39进行荧光定量pcr检测,并用applied biosystems 7500real-time pcr系统软件分析结果。
[0204]
其中,每个反应孔中荧光定量pcr检测体系如表3所示。
[0205]
表3
[0206]
组分1t2x taq pro hs通用探针主混合物10μl引物f(10μm)0.4μl引物-r(10μm)0.4μltaqman探针(10μm)0.2μlcdna3μlddh2o7μl
[0207]
荧光定量pcr的循环次数为45,具体的,在95℃预变性4分钟,95℃变性15秒,60℃复性30秒。
[0208]
荧光定量pcr结果,阳性对照的扩增曲线呈典型的s型曲线,且ct值均小于40,认为是阳性扩增曲线;而阴性对照的扩增曲线不呈s型,ct值大于40,认为是阴性扩增曲线。
[0209]
将早期肝癌特异性分子标记的ct值和内参和外参的ct值相减,得到的差值(
△
ct)作为后续roc曲线分析的协变量。
[0210]
5.样本通过逻辑模型联合分析用于判断肝癌发生的可行性
[0211]
将独立反应孔中的hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p与has-mir-16、cel-mir-39的ct值相减,得
到的差值作为协变量,用于roc曲线分析,较优但不仅限于利用下述逻辑回归方程及临界值判断肝癌发生的可行性进行判定。
[0212]
所述逻辑回归计算公式为:p=ek/(1+ek)。
[0213]
上式中,p为综合指数,其范围为0《p《1;e为自然常数;k=(0.15501)+(0.01785)hsa-mir-33b-3p+(-0.02857)hsa-mir-92b-3p+(-0.01955)mir-205-5p+(0.03704)mir-374c-5p+(0.04277)mir-4516-3p+(0.04277)mir-6803-3p。模型中的p值的cutoff值介于0~1之间,较优为0.3~0.5之间。待测样本经模型分析后若p值高于cutoff值,则认为是极早期肝癌高危患者。
[0214]
实施例3制备一种本发明的试剂盒
[0215]
本实施例中,以实施例2中设计的检测试剂,制备包含如下组分或组件的试剂盒:rna提取试剂、针对每一待测mirnas及内参的逆转录试剂、针对每一待测mirnas及内外参的pcr扩增上游引物及下游引物、无rna酶的纯水、阴性质控品、阳性质控品。
[0216]
1)rna提取试剂:本实施例中使用的是柱提取法试剂(norgen公司,加拿大);
[0217]
2)逆转录引物、正向引物、反向引物、寡核苷酸探针,及阳性对照,委托英潍捷基贸易有限公司合成;
[0218]
3)逆转录酶m-mlv、逆转录反应体系、核酸扩增酶及定量pcr反应体系购自赛默飞公司。
[0219]
4)阴性质控品为灭菌生理盐水,阳性质控品为各1
×
106拷贝数的hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p、has-mir-16、cel-mir-39寡核苷酸。
[0220]
上述每一种试剂置于独立的试剂瓶或管中,将这些试剂瓶或管有效分隔,集中包装于包装盒中。
[0221]
实施例4进一步样本验证试剂盒应用于早期肝癌检测的特异性和灵敏度
[0222]
为了进一步验证实施例3制备的试剂盒应用于无症状高风险个体的群体的极早期肝癌鉴定的特异性、敏感性,获取100个受试者的血浆样本(验证集,其中60例慢性乙肝患者,40例极早期肝癌患者),验证上述mirna组合(hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p)应用于早期肝癌检测的特异性和敏感性。以并行检测afp的结果作为对比。预测概率被用来建立受试者工作特征曲线(见图1)。mirna多靶标联合诊断模型性能与afp单标记检测性能对比结果如表4所示。
[0223]
表4
[0224] 灵敏度特异性约登指数mirna联检82.5%88.3%0.705afp单标记62.5%85.0%0.475
[0225]
实施例5检测试剂盒的临床应用
[0226]
对于医院随访的慢性hbsag-阳性患者,收集患者的血清,如实施例2的方法抽提rna逆转录,以上述mirna组合(hsa-mir-33b-3p、hsa-mir-92b-3p、hsa-mir-205-5p、hsa-mir-374c-5p、hsa-mir-4516-3p和hsa-mir-6803-3p)作为标志物,以has-mir-16和cel-mir-39作为内外参,以实施例2设计的引物和探针进行定量pcr检测。
[0227]
cutoff值设为0.438。如实施例2对样本进行模型分析,如果测得的cutoff值高于0.438,则认为是极早期肝癌高危患者,建议后续进行积极随访检查和治疗。
[0228]
在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
[0229]
尽管在本技术中已经将权利要求阐述为特征的特定组合,但应该理解的是,本公开的范围还包括本文明确或隐含地公开的任何新颖特征或任何新颖特征组合或其任何概括,无论它是否涉及与任何权利要求中目前要求保护的相同的发明,并且无论它是否减轻了与本发明相同的技术问题中的任何一个或全部问题。申请人在此提供通知,在本技术或由此衍生的任何进一步申请的审查期间,新的权利要求可以被制定为这样的特征和/或特征的组合。
[0230]
尽管已经示出和描述了一些实施例,但是本领域技术人员应该理解,在不脱离本发明的原理的情况下可以对这些实施例进行改变,本发明的范围在权利要求中限定。
[0231]
本领域技术人员会理解,在不脱离本发明的全部范围和精神的情况下,可对本技术描述的部件、方法、步骤、结构、运动、配合进行修改(添加和/或去除),本发明的范围和精神涵盖这样的修改以及其任何和全部等同物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1