一种尿源性干细胞的培养基、培养方法及其应用与流程
1.本发明属于干细胞技术领域,具体涉及一种尿源性干细胞的培养基、培养方法及其应用。
背景技术:
2.干细胞疗法在肾脏疾病治疗中带来了新希望。已经发现许多类型的干细胞,包括间充质干细胞(msc)、精原干细胞、诱导多能干细胞(ipsc)和衍生自ipsc的细胞可减轻iri后的肾脏功能障碍或稳定形态变化。msc的治疗方法已经进入临床试验。人尿源性干细胞(huscs)作为新事物进入了许多应用中,例如血管和神经组织工程、软骨再生和膀胱/输尿管重塑。从尿液中分离出的尿源性干细胞(usc)具有msc的许多特征,并且具有多个细胞谱系分化产生内皮细胞、神经细胞、软骨细胞和肌细胞。而且,usc的某些细胞特征会在疾病状态下发生变化。患者来源的usc可用作预测肾脏疾病预后的工具。另外,与来自其他供体来源的干细胞相比,usc易于获取、可连续生产且相对没有伦理问题。因此,usc逐渐成为各种疗法的新的细胞来源。
3.虽然与骨髓间充质干细胞相比,usc具有更高的端粒酶活性和更长的端粒序列,因而具有更强的增殖能力,但是尿源细胞传代次数仍然有限,常规培养尿源细胞仅能扩增5-7代。因此如何提高其传代次数并保持尿源细胞稳定性是目前亟需解决的问题。
4.毛喉素(forskolin)是一种疏水性激活剂,可以刺激升高哺乳动物细胞内腺苷酸环化酶(除去ix型所有亚型)的活性,以此使细胞内camp浓度升高。有研究指出毛喉素在促进细胞分化上具有一定作用,例如增强神经元分化能力和猪卵泡颗粒细胞分化能力等。
5.iwp-2是一种wnt信号和分泌抑制剂,无细胞试验中ic50为27nm,选择性阻断porcn介导的wnt棕榈酰化,一般不影响wnt/β-catenin,且对wnt刺激的细胞反应没有影响。iwp-2可特定低抑制ck1δ。wnt信号通路是调控细胞增殖,分化的关键途径,在胚胎发育中起重要作用。
6.目前没有毛喉素和iwp-2用于尿源性干细胞培养的相关研究。
技术实现要素:
7.本发明要解决的技术问题是尿源性干细胞在常规培养过程中不定向分化,可传代次数少的技术问题。
8.本发明的尿源性干细胞的培养方法和培养基,可以让尿源性干细胞的长期维持干性,并且可增加传代次数。这样的培养方法有利于保存尿源性干细胞,有利于后续细胞实验的灵活性。
9.本发明的第一个目的,在于提供一种干细胞培养基。
10.本发明的第二个目的,在于提供上述干细胞培养基的应用。
11.本发明的第三个目的,在于提供一种干细胞培养方法。
12.本发明所采取的技术方案是:
13.本发明的第一方面,提供一种干细胞培养基,包含基础培养基、wnt信号通路抑制剂和腺苷酸环化酶激活剂;所述wnt信号通路抑制剂的浓度为0.5~1.5μm,所述腺苷酸环化酶激活剂的浓度为16~20μm。
14.在本发明的一些实施方式中,所述wnt信号通路抑制剂包括小分子化合物iwp2。
15.在本发明的一些实施方式中,所述腺苷酸环化酶激活剂为毛喉素。
16.在本发明的一些实施方式中,所述基础培养基为dmem。
17.在本发明的一些实施方式中,所述基础培养基还包含:胎牛血清、乙醇胺、谷胱甘肽、抗坏血酸、胰岛素、转铁蛋白。
18.在本发明的一些实施方式中,所述的胎牛血清占干细胞培养基体积的5~15%、所述的乙醇胺浓度为1.7~2.1mg/l、所述的谷胱甘肽浓度为0.8~1.2mg/l、所述的抗坏血酸浓度为2.3~2.7mg/l、所述的胰岛素浓度为8~12mg/l、所述的转铁蛋白浓度为7.3~7.7mg/l、所述的毛喉素浓度为16~20μm、所述的iwp-2浓度为0.8~1.2μm。
19.在本发明的一些实施方式中,余量为dmem基础培养基。
20.在本发明的一些优选实施方式中,所述培养基包含以下成分:基础培养基、10%胎牛血清、1.9mg/l乙醇胺、1mg/l谷胱甘肽、2.5mg/l抗坏血酸、10mg/l胰岛素、7.5mg/l转铁蛋白、18μm毛喉素、1μm iwp2。
21.在本发明的一些实施方式中,余量为dmem基础培养基。
22.在本发明的一些实施方式中,所述干细胞为尿源性干细胞。
23.本发明的第二方面,提供本发明第一方面所述培养基在如下任一中的应用:
24.1)增加尿源性干细胞传代次数;
25.2)提高尿源性干细胞增殖能力;
26.3)维持尿源性干细胞干性;
27.4)尿源性干细胞培养;
28.5)尿源性干细胞建系;
29.6)制备尿源性干细胞增殖培养基。
30.本发明的第三方面,提供一种尿源性干细胞的培养方法,利用本发明第一方面所述的干细胞培养基进行尿源性干细胞的培养。
31.所述培养方法可以同时扩增细胞、维持细胞干性和增加细胞传代次数。
32.在本发明的一些实施方式中,所述方法包括以下步骤:将干细胞接种于本发明第一方面所述的尿源性干细胞培养基中进行培养,培养至尿源性干细密度为80%~90%汇合时进行传代。
33.在本发明的一些实施方式中,所述传代的比例为1:(1~3)。
34.在本发明的一些优选实施方式中,所述传代的比例为1:2。
35.在本发明的一些实施方式中,所述接种密度为(1~1.25)
×
105个/cm2。
36.本发明的有益效果是:
37.本发明通过在基础培养基的基础上复配毛喉素、iwp2等物质,提供了一种配比优良、利于尿源性干细胞的生长,大大提高了尿源性干细胞增殖率以及维持干性的培养基,解决了尿源性干细胞可传代次数少、容易分化的技术问题。本发明的尿源性干细胞扩增和维持干性的培养基和培养方法,能让尿源性干细胞扩增,提高可传代次数达到至少15次,而且
尿源性干细胞的干性维持,基本没有出现分化,细胞形态好。
附图说明
38.图1为尿源性干细胞在实施例1a和对比例4的培养基中培养3天的情况。
39.图2为在尿源性干细胞在实施例1的培养基中传代至第15代的细胞的干性基因表达检测。
40.图3为尿源性干细胞在实施例1的培养基中传代至第15代的细胞培养情况。
41.图4为尿源性干细胞在对比例4的培养基中传代至第3、第5代的细胞培养情况。
42.图5为尿源性干细胞在对比例4的培养基中传代至第3、第5代的细胞的干性基因表达检测。
43.图6为尿源性干细胞在对比例1培养基培养传代至第3代和第5代的细胞的干性基因表达检测。
44.图7为尿源性干细胞在对比例1培养基培养传代至第7代和第10代的细胞培养情况。
45.图8为尿源性干细胞在对比例1培养基培养传代至第7代和第10代的细胞的干性基因表达检测。
46.图9为尿源性干细胞在对比例2培养基培养传代至第10代和第15代的细胞培养情况。
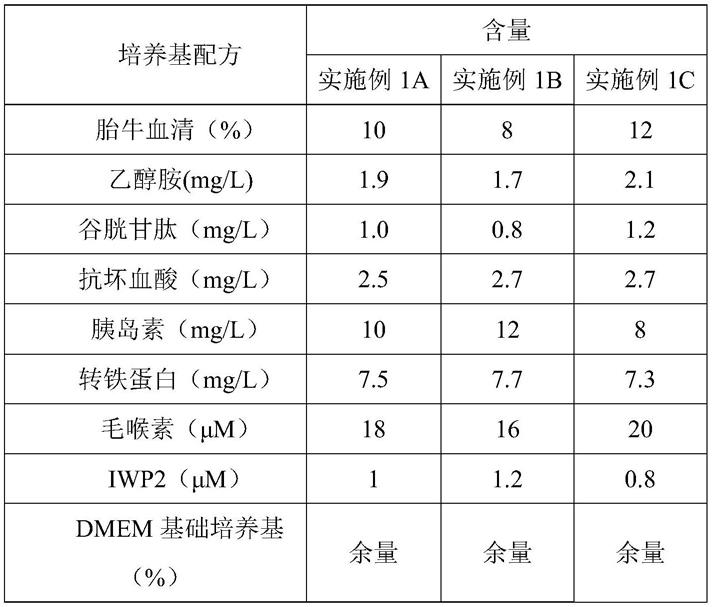
47.图10为尿源性干细胞在对比例2培养基培养传代至第10代和第15代的细胞的干性基因表达检测。
48.图11为尿源性干细胞在对比例3培养基培养传代至第7代和第10代的细胞培养情况。
49.图12为尿源性干细胞在对比例3培养基培养传代至第7代和第10代的细胞的干性基因表达检测。
50.图13为尿源性干细胞在对比例3培养基培养传代至第11代的细胞培养情况。
具体实施方式
51.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
52.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
53.实施例1培养基配制
54.本实施例根据表1的配方,将乙醇胺、谷胱甘肽、抗坏血酸、胰岛素、转铁蛋白、毛喉素和iwp2溶解或分散于dmem基础培养基中(无菌操作),再加入10%(体积分数)胎牛血清于培养基中,获得培养基1a、1b和1c,置于4℃环境保存待用。
55.表1实施例1中培养基配方
[0056][0057]
对比例1
[0058]
本对比例根据表2的配方,将乙醇胺、谷胱甘肽、抗坏血酸、胰岛素、转铁蛋白溶解或分散于基础培养基中(无菌操作),再加入10%(体积分数)胎牛血清于培养基中,获得对比例1培养基,置于4℃环境保存待用。对比例1配方不含有实施例1配方中的毛喉素和iwp2。所述的基础培养基为dmem。
[0059]
表2对比例1中培养基配方
[0060]
培养基配方成分含量胎牛血清(%)10乙醇胺(mg/l)1.9谷胱甘肽(mg/l)1.0抗坏血酸(mg/l)2.5胰岛素(mg/l)10转铁蛋白(mg/l)7.5dmem基础培养基(%)余量
[0061]
对比例2
[0062]
本对比例根据表3的配方,将乙醇胺、谷胱甘肽、抗坏血酸、胰岛素、转铁蛋白和毛喉素溶解或分散于基础培养基中(无菌操作),再加入10%(体积分数)胎牛血清于培养基中,获得对比例2培养基,置于4℃环境保存待用。对比例2培养基配方不含有实施例1配方中的iwp2。所述的基础培养基为dmem。
[0063]
表3对比例2培养基配方
[0064]
培养基配方成分含量胎牛血清(%)10
乙醇胺(mg/l)1.9谷胱甘肽(mg/l)1.0抗坏血酸(mg/l)2.5胰岛素(mg/l)10转铁蛋白(mg/l)7.5毛喉素(μm)18dmem基础培养基(%)余量
[0065]
对比例3
[0066]
本对比例根据表4的配方,将乙醇胺、谷胱甘肽、抗坏血酸、胰岛素、转铁蛋白和iwp2溶解或分散于基础培养基中(无菌操作),再加入10%(体积分数)胎牛血清于培养基中,获得对比例2培养基,置于4℃环境保存待用。对比例3培养基配方不含有实施例1配方中的毛喉素。所述的基础培养基为dmem。
[0067]
表4对比例3培养基配方
[0068]
培养基配方含量胎牛血清(%)10乙醇胺(mg/l)1.9谷胱甘肽(mg/l)1.0抗坏血酸(mg/l)2.5胰岛素(mg/l)10转铁蛋白(mg/l)7.5iwp2(μm)1dmem基础培养基(%)余量
[0069]
对比例4
[0070]
本对比例配制本领域较为常用的usc培养基(doi:10.7150/thno.42153),usc培养基包含以下组分:50%regm肾脏上皮细胞生长培养基(每500ml regm含0.5ml表皮生长因子,0.5ml转铁蛋白,0.5ml胰岛素,0.5ml氢化可的松,0.5ml ga-1000,0.5ml三碘甲状腺素,0.5ml肾上腺素,2.5ml fbs)+45%dmem+5%fbs+0.5
×
非必须氨基酸(3.75mg/l甘氨酸,4.45mg/l l-丙氨酸,6.60mg/l l-天冬酰胺,6.65mg/l l-天冬氨酸,7.35mg/l l-谷氨酸,5.75mg/l l-脯氨酸,5.25mg/l l-丝氨酸)。培养基4℃保存待用。
[0071]
效果例1尿源性干细胞的细胞提取和培养
[0072]
1、提取尿源性干细胞,包含以下步骤:
[0073]
1)收集人晨起第二次尿液的100-200ml中段尿。
[0074]
2)加入双抗(青链霉素混合液(100x)),摇匀,400g离心力离心10min。
[0075]
3)去掉离心后的大部分上清液体,留下约1ml。
[0076]
4)加入10ml重悬液(pbs+双抗)清洗,400g离心力离心10min;重复一次。
[0077]
5)去掉大部分上清,留下0.4ml液体,加入2ml对比例4的usc培养基重悬。
[0078]
6)在24孔板中加入细胞悬液,每孔0.6ml。
[0079]
7)放二氧化碳培养箱培养(37℃、5%co2)。种板3天后添加等体积培养基;出现克隆后,2天换一次对比例4的usc培养基。
[0080]
2、分别采用实施例1a和对比例4的培养基培养尿源性干细胞:
[0081]
当经过步骤1所述的提取操作获得的第0代尿源性干细胞培养至细胞汇合度达到80-90%后,分别以细胞密度为1
×
105个/cm2的量将细胞接种于实施例1a和对比例4的培养基中,每隔2天换液、当细胞汇合度达到80-90%进行传代,传代比例为1:2。细胞传至第3代以前(包括第3代),每次传代所种的细胞培养板均为24孔板;当细胞可传至第4代时,将第4代细胞以细胞密度为1.25
×
105个/cm2的量接种于6孔板;从第4代开始的后续传代均将细胞接种于6孔板。上述所有的传代操作中,传代比例始终为1:2。每次细胞传代时,取部分细胞利用takara试剂盒提取mrna,利用天根试剂盒反转录获得cdna,采用天根试剂盒qpcr检测尿源性干细胞的干性基因cd29、cd44和cd73。
[0082]
结果:检测发现尿源性干细胞在实施例1a和对比例4的培养基中均保持较快且一致的生长速度,如:传至第2~3代的尿源性干细胞种24孔板3天后即可长满(图1)。尿源性干细胞在实施例1a的培养基中保持较快生长速度,可传代至第15代,其干性基因cd29、cd44和cd73在多次传代后仍然比较好(图2),第15代的尿源性干细胞的形态均一(图3)。但在对比例4培养基中,尿源性干细胞可传代次数较少,第3代开始细胞凋亡,传代到第5代,细胞不增殖,体积变大,细胞内出现大量空泡,甚至死亡(图4),其干性基因cd29、cd44和cd73表达下降(图5)。
[0083]
3、对比例1、对比例2和对比例3配制的培养基培养尿源性干细胞:
[0084]
当经过步骤1所述的提取操作获得的第0代尿源性干细胞培养至细胞汇合度达到80-90%后,分别以细胞密度为1
×
105个/cm2的量将细胞接种于对比例1、对比例2和对比例3的培养基中,每隔2天换液、当细胞汇合度达到80-90%进行传代,传代比例为1:2。细胞传至第3代以前(包括第3代),每次传代所种的细胞培养板均为24孔板;当细胞可传至第4代时,将第4代细胞以细胞密度为1.25
×
105个/cm2的量接种于6孔板;从第4代开始的后续传代均将细胞接种于6孔板。上述所有的传代操作中,传代比例始终为1:2。每次细胞传代时,取部分细胞利用takara试剂盒提取mrna,利用天根试剂盒反转录获得cdna,采用天根试剂盒qpcr检测尿源性干细胞的干性基因cd29、cd44和cd73。
[0085]
结果:检测发现对比例1培养基培养尿源性干细胞至第5代时,尿源性干细胞干性基因的cd29、cd44和cd73表达水平均可被维持(图6)。但细胞只能长到10代,细胞开始出现死亡和空泡化(图7),并且干性基因难以维持,如图8所示。
[0086]
对比例2培养基培养尿源性干细胞,虽然可以传代到15代,但第15代的细胞形态发生明显改变(图9)。细胞干性减弱,其干性基因cd29、cd44和cd73表达明显减少(图10)。
[0087]
对比例3培养基培养尿源性干细胞,其细胞只能生长到第10代,细胞形态也没有明显改变(图11)。虽然第10代的尿源性干细胞干性基因cd29、cd44和cd73表达水平没有明显改变(图12),但细胞只能生长到第11代,细胞开始出现死亡和空泡化(图13)。
[0088]
上述具体实施方式对本发明作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下做出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1