用于检测人粪便样本中结直肠癌基因甲基化水平的引物和探针
1.本发明涉及分子生物学技术领域,尤其是一种用于检测人粪便样本中结直肠癌基因甲基化水平的引物和探针及试剂盒。
背景技术:
2.结直肠癌(肠癌)是世界上第三大恶性肿瘤。肠癌早期治疗效果好,中晚期预后极差,给家庭和社会带来极大的负担,严重影响大健康产业的发展,早诊是改善预后的最重要手段,而积极开展肠癌筛查及早期防治工作,对于减少政府相关医疗成本同样重要。
3.目前筛查主要有以下几类:(1)常规血检类,特异性敏感性不强,对身体有创伤性;(2)影像学类,如肠镜检查、软式乙状结肠镜、ct 结肠成像(虚拟肠镜检查)、双对比钡灌肠(dcbe)等,此类方法需要检查前药物清肠、麻醉等处理,对身体创伤性比较严重;(3)粪便潜血检测类,如粪便隐血试验(fobt)、粪便免疫化学试验(fit)等,方便无创,但特异性敏感性不强。且以上方法均需要到医院实施,处理周期长,或者费用较高。
4.肠癌作为肠道上皮的异质性疾病,其特征在于宿主基因突变累积,因此,对瘤细胞异常 dna 片段的检测,可以用于结直肠癌的筛查和早期诊断,该方法不会对身体造成创伤,且可以用于全成人年龄段人群的筛查,但筛选出特异性、敏感性强的试剂盒对该检测方法的事实至关重要。
技术实现要素:
5.本发明公开了一种用于检测人粪便样本中结直肠癌基因甲基化水平的引物和探针,提供的引物和探针可用于结直肠肿瘤的早期诊断,为结直肠肿瘤早发现提供了一个简便易行的解决方案。
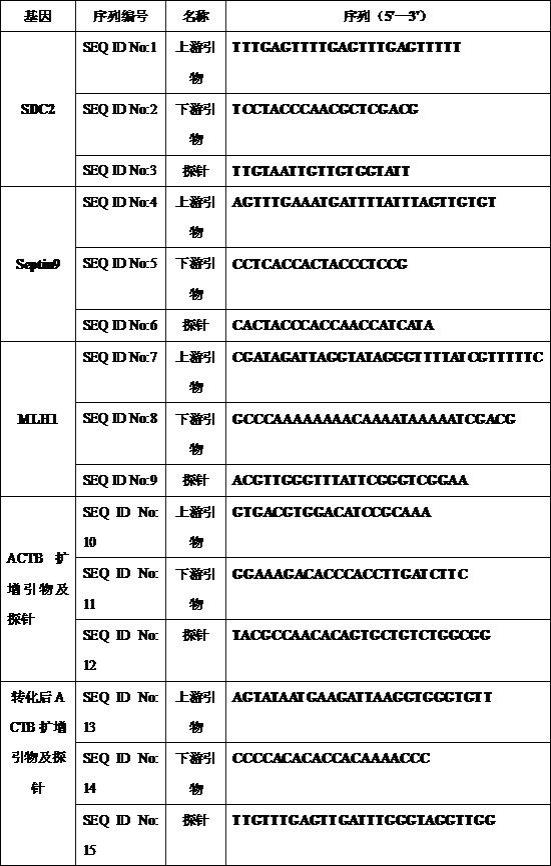
6.为实现上述目的,本发明的技术方案为:一种用于检测人粪便样本中结直肠癌基因甲基化水平的引物和探针,包括用于检测sdc2甲基化水平的引物和探针和/或用于检测septin9甲基化水平的引物和探针和/或用于检测mlh1甲基化水平的引物和探针;所述用于检测sdc2甲基化水平的引物为:上游引物选自seq id no:1所示的序列,下游引物选自seq id no:2所示的序列,探针为选自seq id no:3所示的序列;所述用于检测septin9甲基化水平的引物为:上游引物选自seq id no:4所示的序列,下游引物选自seq id no:5所示的序列,探针为选自seq id no:6所示的序列;所述用于检测mlh1甲基化水平的引物为:上游引物选自seq id no:7所示的序列,下游引物选自seq id no:8所示的序列,探针为选自seq id no:9所示的序列;进一步的,seq id no:3、seq id no:6、seq id no:9所示的序列5'端标记有hex荧光基团,各所述探针3'端标记有mgb淬灭基团。
7.人粪便样本中结直肠癌基因甲基化水平的检测方法,包括以下步骤:
(1)样品的制备:从收集到的人粪便样本中进行 dna 的提取及亚硫酸盐的处理;(2)pcr 扩增:加入以上所述的引物和探针,将步骤(1)中提取及亚硫酸盐处理后的 dna 进行荧光定量 pcr 检测;(3)甲基化水平分析和微生物水平分析:计算目标基因 sdc2、septin9、mlh1 与内参基因 actb 的扩增 ct 比差值,得到样本相对甲基化水平。
8.其中,采用roche lightcycler 480 ii 仪器结果分析时,使用 absquant/2nd derivative max 分析方法分析扩增的循环数;abi 7500 仪器结果分析时使用仪器默认基线。采用sds v2.3.1 软件分析时,fam 通道(检测 sdc2 基因)值设置为 65000,texasred 通道(检测 actb 基因)阈值设置为 95000,fam 通道和texas red 通道扩增曲线呈现“s”型扩增才可计算 ct 值。
9.进一步的,所述步骤(2)中,actb 扩增所用引物为:上游引物为seq id no:10所示的序列,下游引物为seq id no:11所示的序列;actb 扩增所用探针为seq id no:12所示的序列,探针5'端标记有hex荧光基团,3'端标记有bhq2淬灭基团;亚硫酸盐处理后的actb 扩增所用引物为:上游引物为seq id no:13所示的序列,下游引物为seq id no:14所示的序列;actb 扩增所用探针为seq id no:15所示的序列,探针5'端标记有hex荧光基团,3'端标记有bhq2淬灭基团。
10.进一步的,所述pcr的反应体系如下:2
×
aceq qpcr probe master mix
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10 μlprimer mix
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4.6μl50
×ꢀ
rox reference dye 2
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.4μltemplate dna
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5μl。
11.进一步的,pcr反应条件:95℃预变性2min,95℃10s,60℃30s,扩增 50个循环,最后 12℃终延伸。
12.sdc2、septin9、mlh1 在结直肠癌细胞中都有高度的甲基化表现,本发明利用大量临床样本验证,设计和筛选引物探针,使用本发明引物和探针进行检测具有高灵敏度和高特异性。
13.本发明的检测方法基于定量 pcr 的甲基化 dna 检测技术,利用探针和 pcr 引物来区分甲基化和未甲基化的 dna。首先用亚硫酸氢盐处理 dna 片段,并设计能与待测位点互补的探针引物,通过实时定量 pcr 测定,测定该基因中和结直肠肿瘤最具有关联性的 cpg 位点,并同时测定样本中的内参基因 actb,判定目标基因的甲基化水平。这种方法优势在于其高通量和高敏感性,且无需在 pcr 后电泳、杂交等操作,减少了污染和操作误差。可以为医生提供用于结直肠肿瘤早期诊断的信息,为结直肠肿瘤早发现提供了一个简便易行的解决方案。
14.普通人每天数以百万计的细胞从结肠壁脱落进入到排泄系统,包括肠道肿瘤形成过程中的细胞,进入排泄系统后的细胞中含有相应的 dna,其中含有和肿瘤密切相关的遗传信息,反映结直肠癌或肿瘤的形成过程。早期肠癌细胞中有些基因发生甲基化转变,是肠癌的预兆,这些细胞会自然脱落到肠道中,与粪便一起排出。通过检测这些 dna 标记物,就
可以发现结直肠癌或肿瘤等在肠壁上的存在。
15.因此本发明优选的检测方法采用粪便人源 dna,从普通粪便中取得,非侵入性、无创无痛、方便居家采样,无需前往医院,无时间限制,且本发明的粪便 dna的检测方法,比粪便潜血查出更多的癌症和癌前病变,假阳性更低。
16.综上,本发明提供的引物和探针可检测人粪便样本中 sdc2、septin9、mlh1的甲基化水平,具有高灵敏度和特异性,其用于结直肠肿瘤的早期诊断,大大提供了结直肠肿瘤诊断的灵敏度,且不会对身体造成创伤,适用于全成人年龄段人群的筛查,具有广阔的应用前景。
附图说明
17.图1是内参基因 actb荧光定量pcr扩增曲线图(阳性)。
18.图2是转化后的actb(q-actb)荧光定量pcr扩增曲线图(阳性)。
19.图3是sdc2荧光定量pcr扩增曲线图(阳性)。
20.图4是septin9荧光定量pcr扩增曲线图(阳性)。
21.图5是mlh1荧光定量pcr扩增曲线图(阳性)。
具体实施方式
22.实施例1一种用于检测人粪便样本中结直肠癌基因甲基化水平的引物和探针,包括用于检测sdc2甲基化水平的引物和探针和/或用于检测septin9甲基化水平的引物和探针和/或用于检测mlh1甲基化水平的引物和探针;用于检测sdc2甲基化水平的引物为:上游引物选自seq id no:1所示的序列,下游引物选自seq id no:2所示的序列,探针为选自seq id no:3所示的序列;用于检测septin9甲基化水平的引物为:上游引物选自seq id no:4所示的序列,下游引物选自seq id no:5所示的序列,探针为选自seq id no:6所示的序列;用于检测mlh1甲基化水平的引物为:上游引物选自seq id no:7所示的序列,下游引物选自seq id no:8所示的序列,探针为选自seq id no:9所示的序列;seq id no:3、seq id no:6、seq id no:9所示的序列5'端标记有hex荧光基团,各所述探针3'端标记有mgb淬灭基团。
23.表1 引物和探针序列表
实施例2人粪便样本中结直肠癌基因甲基化水平的检测方法,包括以下步骤:
(1)核酸提取:从 100~200mg 粪便样品中提取宿主细胞 dna 及亚硫酸盐的处理该方案适合于从 100~200mg 粪便样品中提取宿主细胞 dna1.1 高温裂解法(常规检测)a1.转移 100~200mg 粪便样品至 2ml 离心管,加入 1.0 ml buffer atl/pvp-10 至样品中,最高涡旋 1 分钟打散样。吸取液体粪便时,把 1ml 移液枪头的头部剪去小部分,以方便转移样品。使用前,把 pvp-10 粉末倒至 buffer atl 瓶子中,颠倒混匀,完全溶解后使用。处理富含纤维的动物粪便样品(牛羊等),样品量控制在 70~140mg,处理水份极少的动物粪便(如老鼠粪便),样品量为 50~70mg。
24.a2.70℃水浴 10 分钟。
25.a3.室温下,13000 rpm 离心3分钟。
26.a4.转移 0.6ml上清液至新的离心管中,加入 0.6ml buffer pci 至裂解液中,涡旋混匀 15 秒,静置 3 分钟。
27.a5.室温下,13000 rpm离心3分钟。
28.1.2转移 500
µ
l上清液至2ml离心管中,加入4
µ
l rnase solution 至上清液中,室温静置10分钟。
29.1.3 加入20
µ
l proteinase k 和 500
µ
l buffer al 至上清液中。颠倒混匀,70oc 消化 10分钟。
30.1.4 加入 500
µ
l 无水乙醇至混合液,涡旋混匀 15 秒。
31.1.5 把 hipure dna mini column ii 装在 2ml 收集管中,转移一半体积的混合液至柱子中。10000rpm离心 30~60 秒。
32.1.6 倒弃滤液把柱子装回收集管中。把剩余的混合液转移至柱子中。10000rpm离心 30~60秒。
33.1.7 倒弃流出液,把柱子装回收集管中。加入 500
µ
l buffer gw1(已用无水乙醇稀释)至柱子上。10000rpm离心 30~60 秒。buffer gw1 须用无水乙醇稀释,按瓶子标签或说明书指示进行稀释。
34.1.8 倒弃滤液,把柱子装回收集管中。加入 650
µ
l buffer gw2(已用乙醇稀释)至柱子中。10000rpm离心 30~60 秒。buffer gw2 须用无水乙醇稀释。按瓶子标签或说明书指示进行稀释。
35.1.9 倒弃滤液,把柱子装回收集管中。13000 rpm离心 2 分钟甩干柱子。
36.1.10 将柱子装在1.5ml 离心管中。加入 30~100
µ
l 预热至 65
º
c 的 buffer ae 或灭菌水至柱子的膜中央,室温放置 2 分钟。13000 rpm 离心 1 分钟。
37.1.11. 丢弃 dna 结合柱。把 dna 保存 2-8℃,长期保存需保存于-20℃。
38.(2)dna硫化(使用试剂盒ⅱ)准备工作:
①
bw buffer 加 30 ml 无水乙醇,室温保存。
②
bd buffer 加27 ml 无水乙醇,且 2-8℃保存。
③
carrier rna 加 310 ul 水,分装后
ꢀ‑
20℃保存。
④
样本及 buffer 需平衡至室温。
⑤
bl buffer 60℃水浴。
39.2.1 解冻dna:确保硫化试剂完全溶解,必要时,可 60℃,涡旋至成分溶解。注:不能将硫化试剂至于冰上。
40.2.2 建立硫化反应,如下表2:
注:若总体积不足140ul,用水补至140。
41.2.3盖上pcr管盖,充分混匀,使样本常温。注:dna保护buffer变蓝,说明硫化反应的ph值是正确的。
42.2.4根据表格3 运行 pcr 仪器。pcr仪器热盖调至 105℃。注:若pcr仪器最大体积调整不到 140 ul,则调整最大体积。
43.注:60℃延伸时间长达20min是有必要的,可以使dna完全硫化转化。转化后的dna可以在pcr仪器上过夜,实验结果也没有影响。
44.2.5将pcr管放置pcr仪器,开始孵育。
45.2.6硫化完的样本,简略的离心,转移液体至新的1.5ml离心管。
46.2.7 加入 310 ul现配置的bl buffer后,简略的涡旋,离心mix。若dna总量小于 100 ng,加入溶解carrier rna的bl buffer,只需要准备需要的用量(表4),注:是含有dna的mix.表4 carrier rna 和bl buffer体积2.8再加入250ul无水乙醇(96-100%),脉冲式涡旋15秒,然后简略离心,去除盖子上的液滴。
47.2.9将混合物65℃孵育3min,看结晶状态,若没有结晶,立刻将混合物加入预热的minelute dna 离心柱,马上离心。全速离心 1 min,丢弃液体,将离心柱放置回离心管。
48.2.10加入 500ul bw buffer,全速离心 1 min,丢弃液体,将离心柱放置回离心管。
49.2.11加入 500ul bd buffer,应避免吸到沉淀。盖上盖子,室温孵育 15 min。注:bd buffer使用时,最短的时间接触空气,防止酸化。全速离心 1 min,丢弃液体,将离心柱放置回离心管。
50.2.12 加入 500ul bw buffer,全速离心 1 min,丢弃液体,将离心柱放置回离心管。重复一次。
51.2.13 加入 250 ul无水乙醇(96-100%),全速离心 1 min。
52.2.14 将离心柱放置新的 2 ml 收集管,全速离心 1 min。去除残留液体。
53.2.15 将离心柱放置新的 1.5 ml 离心管,60ul eb buffer直接加至离心柱膜的中间位置,关闭盖子。室温孵育 1 min,离心 1 min。注:加入的洗脱液最少体积为10ul。
54.(3)pcr 扩增:按照表5的 pcr 反应体系和表6的pcr 反应程序,使用下述引物和探针,将修饰后的样本 dna 进行荧光定量 pcr 检测。
55.按照以下反应体系加入各种成分:表5 pcr 反应体系加样完成后,充分混匀后离心,将 pcr 管放入 pcr 仪中。
56.按照下面步骤设置 pcr 的反应条件:表6 pcr 反应程序(4)甲基化水平分析:计算目标基因 sdc2、septin9、mlh1 与内参基因 actb 的扩增 ct 比差值,得到样本相对甲基化水平。分析条件设置:roche lightcycler 480 ii 仪器结果分析时使用 absquant/2nd derivative max 分析方法分析扩增的循环数;abi7500 仪器结果分析时使用仪器默认基线,sds v2.3.1 软件分析时,fam 通道(检测 sdc2 基因)值设置为 65000,texasred 通道(检测 actb 基因)阈值设置为 95000。fam 通道和 texas red 通道扩增曲线呈现“s”型扩增才可计算 ct 值。
57.表7 阳性判断值
检验结果的解释:1. 试验结束以后运行 ct 值的计算,运行无模板对照(ntc)的 ct 值≥40 或者没有出现扩增曲线时,说明试验无污染存在,可以继续分析试验情况。
58.2. 运行阳性质控品、阴性质控品 fam 通道,阳性质控 ct 值≤35 时,阴性质控 ct 值≥40 或者无 ct 值;texas red 通道阴性质控品、阳性质控品 ct 值均≤35 时,说明实验体系正常,可以继续分析实验。
59.3. 在检测样本反应孔中 texas red 通道,一般 ct 值≤36,可以继续分析,如果 ct 值》36 则说明样本 dna 量不足或者降解严重,不适合实验分析。
60.4. 在检测样本反应孔 fam 通道中,在没有出现扩增曲线或者 ct 值>38 的样本为阴性。出现 s 型扩增曲线且 ct 值≤38 的样本为阳性。
61.5. 判定为阳性的样本的患者,建议进行肠镜检查以确诊;判定为阴性的患者不排除患病的可能;判定为样本不合格的,建议患者重新取样检测。
62.6. 干扰实验结果显示:粪便样品中分别含有以下物质:动物 dna(500ng/ml)、植物组织(500ng/ml)、植物油(10μl/ml)、通便类药物甘露醇(75mg/ml)、通便灵胶囊(7.25mg/ml)、痔疮膏(24.75mg/ml)、吗丁啉(0.14mg/ml)、四环素(10.65mg/ml)、青霉素(2.56mg/ml)、布洛芬胶囊 75μg/ml、胃药斯达舒(6.84mg/ml)、噢美拉唑(2.82mg/ml)、头孢克肟(20.5mg/ml)、盐酸左氧氟沙星(0.15mg/ml)、西咪替丁(2mg/ml)、感冒灵胶囊(0.27mg/ml)对检测结果无影响。特异性试验:选取肠癌样本138例,健康人群17例;灵敏度试验:选取肠癌样本138例,健康人群17例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1