一种微生物菌剂及其制备方法与流程
1.本发明涉及微生物领域,具体而言,涉及一种微生物菌剂及其制备方法。
背景技术:
2.在植物病害防治方面,化学药剂被认为是最有效的方式之一。但化学药剂的大量使用,常常会造成环境污染、农药残留、抗药性增加等一系列突出问题。为促进农业可持续发展,国家提出了“药肥双减”的政策,以此增产创收。为响应此政策,生物防治以其环境友好,产品无农药残留等特点,越来越广泛的被用于植物病害防治,有益微生物便是其中一个方面。植物病害生物防治是指利用有益微生物或微生物代谢产物对植物病害进行有效防治的技术与方法。目前,用于生物防治的微生物主要有木霉属、芽胞杆菌属、假单胞菌属等。
3.芽孢杆菌具有耐高温、快速复活和较强分泌酶等特点,因其具有较强的抗逆能力;在营养缺乏、干旱等条件下可以形成芽孢,适宜时又可以重新萌发成营养体;代谢产物具有丰富的生物学活性和广泛的抗致病菌功能,在农业生产中具有广阔的应用前景。从健康植株根系分离筛选出的有益微生物具有促进植物生长,对多种病原菌具有拮抗作用。然而,若微生物菌剂中的微生物量较低,将无法充分发挥作用,导致病害防治效果甚微,因此存在对高浓度生物菌剂的客观需要,对未来菌剂实现大规模化生产也同样具有重要意义。
技术实现要素:
4.鉴于此,本发明意在提供一种有益微生物菌剂贝莱斯芽孢杆菌rjw-5-5的高浓度生物菌剂,为生产需要提供技术支撑。
5.为了实现上述目的,本发明提供以下技术方案:
6.在本发明一方面涉及一种高浓度微生物菌剂,其中所述微生物菌剂中含有贝莱斯芽孢杆菌(bacillus velezensis)rjw-5-5,保藏登记号为cgmcc no.22939,保藏时间为2021年07月22日,保藏机构为中国微生物菌种保藏管理委员会普通微生物中心(cgmcc);,保藏地址是北京市朝阳区北辰西路1号院3号;所述微生物菌剂中有效活菌数总量不低于1
×
10
11
cfu/g。
7.优选的,所述微生物菌剂中有效活菌数总量不低于3
×
10
11
cfu/g、更优选不低于5
×
10
11
cfu/g。
8.本发明提供的菌株是从棉花枯萎病发病严重地区中健康棉花植株的根际土壤中筛选出来的。采用梯度稀释分离法获得对根际营养竞争能力强的根际微生物菌株,划线纯化后,再采用平板对峙法再次筛选拮抗菌,获得具有高效拮抗作用的菌株,观察抑菌圈的大小,通过比较抑菌圈的大小,选择抑菌圈较大的菌株。采用显微镜进行观察并经形态学、生理生化特性、分子生物学和16s rrna基因鉴定,确定所述拮抗菌的分类地位,为贝莱斯芽孢杆菌。
9.本发明提供的贝莱斯芽孢杆菌rjw-5-5是需氧型、能运动的革兰氏阳性菌,在lb培养基上菌落形态为椭圆形或圆形,颜色为乳白色,质地粘稠,边缘粗糙,在电镜下观察为杆
状。该菌的主要生物功能有:改变其周围菌群环境和种类,与病原菌竞争植物周围的位点,并且分泌多种抗菌物质以抑制病原菌生长,同时诱导植物防御系统抵御病原菌入侵,从而达到改良土壤和生防的目的,具有防病和促生作用。
10.本发明另一方面涉及所述高浓度微生物菌剂的制备方法,其制备步骤包括:
11.(1)先制作lb固体培养基,于灭菌后倒板并将贝莱斯芽孢杆菌rjw-5-5菌株接种到lb固体培养基上进行活化;
12.(2)然后制作lb液体培养基,灭菌后挑取活化好的菌株于超净台中接种于lb液体培养基中,置于摇床震荡培养,制作种子液;
13.(3)制作固体发酵培养基,接种种子液,于培养箱中进行发酵培养,最后将发酵物进行烘干粉碎并计数,获得本发明的高浓度微生物菌剂。
14.在上述步骤(1)中,优选的,所述lb固体培养基配方包括以下组分:胰蛋白胨12g,酵母浸粉8g,nacl 11g,琼脂17g,0.05g kno3,0.1g k2hpo4,0.05g cacl2。
15.在上述步骤(1)中,优选的,所述菌株需在划线后于30℃培养箱中培养36h。
16.在上述步骤(2)中,优选的,所述lb液体培养基配方包括以下组分:胰蛋白胨12g,酵母浸粉8g,nacl 11g,0.05g kno3,0.1g k2hpo4,0.05gcacl2。
17.在上述步骤(2)中,优选的,所述种子液需在温度35℃、转速200r/min摇床上培养48h,即为所需种子液。
18.在上述步骤(3)中,优选的,所述固体发酵培养基的配方组分为:400g麸皮,300g豆粕,100g玉米淀粉,100g酵母浸粉,50g蛋白胨,50g nacl,80g葡萄糖,0.1g kno3,0.6g mgso4,0.4g mnso4,0.1g kh2po4,0.2g cacl2,0.2g cuso4,0.2g fecl3。
19.在上述步骤(3)中,优选的,所述固体发酵培养基于灭菌冷却后接种种子液,接种量为种子液:固体发酵培养基=1:10(体积/质量)。
20.在上述步骤(3)中,优选的,所述接种后的培养基需在35℃培养箱中培养3天进行发酵。
21.在上述步骤(3)中,优选的,所述培养基完成发酵后需在烘箱中进行烘干,之后用粉碎机将发酵物粉碎后,于200目筛网过筛。
22.在上述步骤(3)中,优选的,所述粉碎物用稀释涂布平板法测得活孢子数。
23.本发明提供了一种高浓度有益微生物贝莱斯芽孢杆菌rjw-5-5的菌剂,以及制备方法。所述菌剂抗逆能力强,且制备方法简便,易保藏运输,能够满足实际生产中对高浓度微生物的需要,对未来菌剂的大规模化生产也具有重要的指导意义。
附图说明
24.图1:贝莱斯芽孢杆菌rjw-5-5在lb培养基上的菌落形态图;
25.图2:贝莱斯芽孢杆菌rjw-5-5 16s rrna系统发育树;
具体实施方式
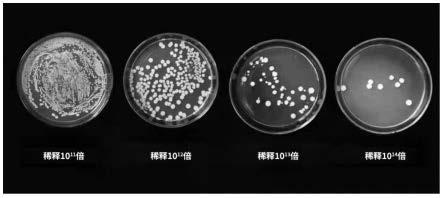
26.下面通过具体的实施例对本发明做进一步的详细描述。
27.实施例1:贝莱斯芽孢杆菌菌株rjw-5-5的分离与筛选:
28.(1)拮抗菌分离:称取棉花根际土壤1g,倒入装有100ml灭菌水的锥形瓶中,220r/
min振荡30min,65℃水浴40min,进行梯度稀释,涂布分离培养。
29.(2)拮抗菌纯化:根据细菌的特征及时挑取单个细菌落至lb固体斜面试管上,采用斜面划线法分离纯化,置于培养箱中培养3d待目标菌长为菌株,纯化的菌株经革兰氏染色和芽孢染色,显示为革兰氏阳性菌,菌体呈杆状、产芽孢。lb固体培养基配方为:酵母浸膏5g,蛋白胨12g,nacl 5g,琼脂18g,水1000ml,ph 7.5。
30.(3)拮抗菌筛选:将4℃保存的棉花枯萎病病原接种于pda培养基上活化,用打孔器打菌饼,置于pda平板正中间,十字交叉法接已分离纯化的菌株于等距的四端,31℃培养2d,测定抑菌圈直径和抑菌带(从活性菌菌落的边缘到抑菌圈的外缘)的大小。pda培养基的配方为:土豆150g,葡萄糖20g,琼脂15g,水1000ml,ph值7.5。
31.分离筛选获得本发明所提供的菌株,实验室编号为rjw-5-5。
32.实施例2:贝莱斯芽孢杆菌rjw-5-5的鉴定:
33.对实施例1所得的菌株的鉴定过程为:
34.(1)形态特征:rjw-5-5在lb培养基上的菌落形态为椭圆形或圆形,颜色为乳白色,质地粘稠,边缘粗糙,革兰氏染色呈阳性。在电镜下观察菌体为杆状。
35.(2)生理生化实验:通过对贝莱斯芽孢杆菌进行生理生化特性试验并结合该菌株的形态特征,对照《伯杰氏细菌手册》(buchanan&gibbons,1984)和《常见细菌系统鉴定手册》(东秀珠和蔡妙英,2001)进行检索,鉴定为芽孢杆菌属。
36.(3)分子生物学:对菌株rjw-5-5的16s rrna基因进行pcr扩增,由上海生工对纯化后的产物进行测序,贝莱斯芽孢杆菌rjw-5-5 16s rrna基因序列见序列表。将测得的序列在ncbi网站上blast比对,进行同源性分析,下载同源模式序列,并建立系统发育树,将菌株rjw-5-5鉴定为贝莱斯芽孢杆菌(图2)。
37.实施例3高浓度贝莱斯芽孢杆菌rjw-5-5微生物菌剂制备
38.本实施例采用以下步骤制备微生物菌剂:
39.制备lb固体培养基,灭菌后倒板,于其上对菌株rjw-5-5划线,并于30℃培养箱中培养36h。lb固体培养基组分为胰蛋白胨12g,酵母浸粉8g,nacl 11g,琼脂17g,0.05gkno3,0.1gk2hpo4,0.05gcacl2。
40.将活化好的菌株于超净台中挑取一菌环,接种到灭菌后的lb液体培养基中,于35℃、200r/min摇床上培养48h,即为种子液。lb液体培养基组分为胰蛋白胨12g,酵母浸粉8g,nacl 11g,0.05gkno3,0.1gk2hpo4,0.05gcacl2。
41.制作固体发酵培养基,灭菌冷却后接种种子液,接种量为培养基的10%(体积/质量)。堆砌后,于35℃培养箱中培养3天。固体发酵培养基的组分为:400g麸皮,300g豆粕,100g玉米淀粉,100g酵母浸粉,50g蛋白胨,50g nacl,80g葡萄糖,0.1gkno3,0.6gmgso4,0.4gmnso4,0.1gkh2po4,0.2gcacl2,0.2gcuso4,0.2gfecl3。
42.取出发酵好的培养基,于烘箱中烘干,之后用粉碎机将发酵物进行粉碎,并于200目筛网上过筛。
43.取10g粉碎物依次稀释成10-8
,10-9
,10-10
,10-11
,10-12
,10-13
,10-14
的稀释度,选取10-11
,10-12
,10-13
,10-14
四个稀释度于lb平板上涂布,在培养箱中培养一段时间,选取菌落数在30cfu~300cfu之间并计数。
44.平板计数方法为:
[0045][0046]n‑‑
样品中菌落数;c
‑‑
平板(含适宜范围菌落数的平板)菌落数;n1
‑‑
第一稀释度(低稀释倍数)平板个数;n2
‑‑‑
第二稀释度(高稀释倍数)平板个数;s
‑‑
第二稀释度:第一稀释度;d
‑‑
稀释因子(第一稀释度)。
[0047]
选取菌落数在30cfu~300cfu之间的10-12
,10-13
的稀释度经测定,本发明方法得到的微生物菌剂中的有效活菌数为7.27
×
10
11
cfu/g,通过此种制备方法得到了含量较高的微生物菌剂,该种方法对于未来该种菌株的大规模生产也具有重要的指导意义。
[0048]
实施例4贝莱斯芽孢杆菌rjw-5-5对黄瓜白粉病的盆栽防治效果
[0049]
称取实施例3所述的贝莱斯芽孢杆菌rjw-5-5微生物菌剂,用无菌水稀释,制得菌体浓度为1
×
107cfu/ml的贝莱斯芽孢杆菌菌悬液。
[0050]
用加有0.1%吐温80的纯净水,洗取长满白粉病菌植物叶片上的新鲜孢子,用双层纱布过滤,制成孢子浓度为1
×
105个孢子/ml的悬浮液。
[0051]
选取长势一致的黄瓜苗在两叶一心期接种黄瓜白粉病菌(10ml/株),待黄瓜叶片出现零星病斑时开始喷药(6ml/株),将药液均匀喷施于黄瓜叶面至全部湿润,待药液自然风干。每处理3盆,4个重复,分别以无菌水和25%乙嘧酚磺酸酯(按照说明书进行等量喷施)作空白对照。然后移至恒温室,在温度20℃~24℃的条件下培养10d。
[0052]
待空白对照病叶率达到80%以上时,分级调查各处发病情况,每处理至少调查30叶片,分级标准为:
[0053]
0级:无病;
[0054]
1级:病斑面积占整片叶面积的5%以下;
[0055]
3级:病斑面积占整片叶面积的5%~15%以下;
[0056]
5级:病斑面积占整片叶面积的15%~25%以下;
[0057]
7级:病斑面积占整片叶面积的25%~50%以下;
[0058]
9级:病斑面积占整片叶面积的50%~75%以下;
[0059]
11级:病斑面积占整片叶面积的75%以上;
[0060]
病情指数及相对防效按下述公式计算:
[0061]
病情指数=∑(各病级叶数
×
相对级数值)/(调查总叶数
×
11)
×
100
[0062]
防效=(对照组病情指数-处理组病情指数)/对照组病情指数
×
100表1温室中贝莱斯芽孢杆菌rjw-5-5可湿性粉剂对棉花枯萎病的防治效果
[0063]
处理组病情指数防治效果贝莱斯芽孢杆菌rjw-5-5菌剂2.2176.78%25%乙嘧酚磺酸酯水乳剂2.5463.17%ck9.78—
[0064]
从表1可以看出使用本发明制备的贝莱斯芽孢杆菌rjw-5-5菌剂对黄瓜白粉病的温室防效可达76.78%尺,相比较市售的化学药剂25%乙嘧酚磺酸酯水乳剂的防效63.17%更加有效。
[0065]
以上所述仅是本发明的优选实施方式,并不用于限制本发明,虽然参照前述实施例对本发明进行了详细的说明,但对于本技术领域的普通技术人员来说,在不脱离本发明
原理的前提下,做出的若干改进也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1